какие химические элементы содержатся в водопроводной воде – Москва 24, 13.04.2015
13 апреля 2015, 15:00
Наука
Иллюстрация: Ольга Денисова
Путешественники знают, что одним из первых факторов, на которые нужно обращать внимание при подготовке к поездке – это качество воды в пункте назначения. Мы твердо выучили, что в странах Азии и Африки лучше покупать бутилированную воду и использовать ее как для питья, так и для бытовых нужд. Но знаем ли мы, что льется нам в стакан, когда мы открываем кран в обычной московской квартире? Наши коллеги из научно-популярного журнала “Кот Шредингера” помогли разобраться.
Состав водопроводной воды сильно разнится в зависимости от того, где вы ее пьете, но в той или иной мере включает в себя добрую половину химических элементов таблицы Менделеева. Основной состав воды прост: в ней обязательно содержатся кислород и водород (которые, собственно, и образуют молекулу воды Н₂O) и микроскопические пузырьки воздуха, состоящие из кислорода, углекислого газа и азота.
В воде может содержаться хлор – он необходим для дезинфекции. Для осаждения примесей, замутняющих воду, используются соли алюминия. Если у вас в районе старые трубы, тогда медь и железо с их стенок вполне могут оказаться в вашем стакане.
Состав воды, поступающей из водозаборных сооружений, зависит от того, откуда ее черпают: из реки, водохранилища, артезианской скважины или из других мест. В ее состав могут входить такие элементы как кальций, натрий, калий, магний, сера, бром, фтор и органические соединения. Все они обычно связаны друг с другом и с остальными, ранее упоминавшимися веществами, например хлором или кислородом.
В водопроводную воду часто добавляют дополнительный фтор. Аналогично фторосодержащей зубной пасте такая жидкость служит для укрепления зубной эмали и предотвращения кариеса. Стоит отметить, что во многих районах земного шара количество фтора в воде превышает допустимые нормы и на водоочистных сооружениях в этих местностях применяется обратный процесс – дефторирование.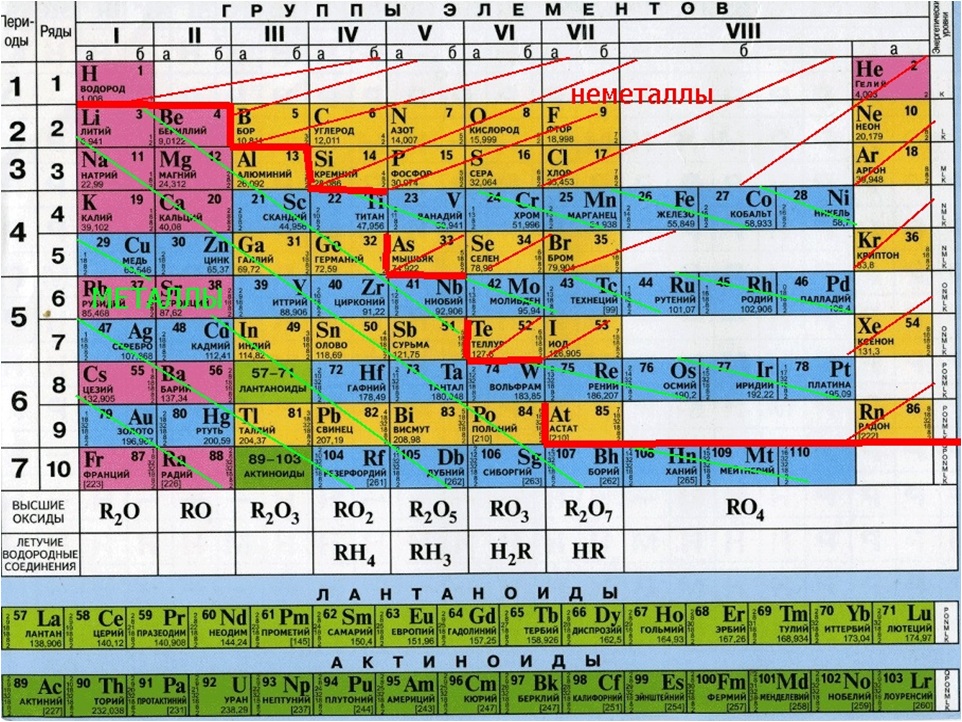
Разумеется, химический состав воды из-под крана строго регламентируется и контролируется. Вода подвергается тщательной очистке и обеззараживанию, поэтому в большинстве случаев ее можно без опасений пить даже без очистки или кипячения.
Вадим Мочалов
О “Физике города”
Каждый день, просыпаясь утром, мы погружаемся в город, полный фактур, звуков и красок. Пока мы идем на работу и гуляем в парке, нам в голову приходит миллион вопросов о том, как же все вокруг нас устроено в этом огромном мегаполисе. Почему небоскребы не падают? Чем отличается кровь горожанина от крови жителя деревни? Выше какого этажа не стоит жить и почему?
Мы предложили коллегам из журнала “Кот Шредингера” дать ответы на наши вопросы и разъяснить, чем опасно обилие городского освещения, как наше дыхание может навредить окружающим и из-за чего люди болеют зимой. Так появился проект “Физика города”. Новые вопросы и новые ответы ищите на нашем сайте по понедельникам и четвергам.
наука безопасность ученые здоровье вода журналы химия таблица Менделеева зубы очистка мегаполис столица хлор спецпроекты
Новости СМИ2
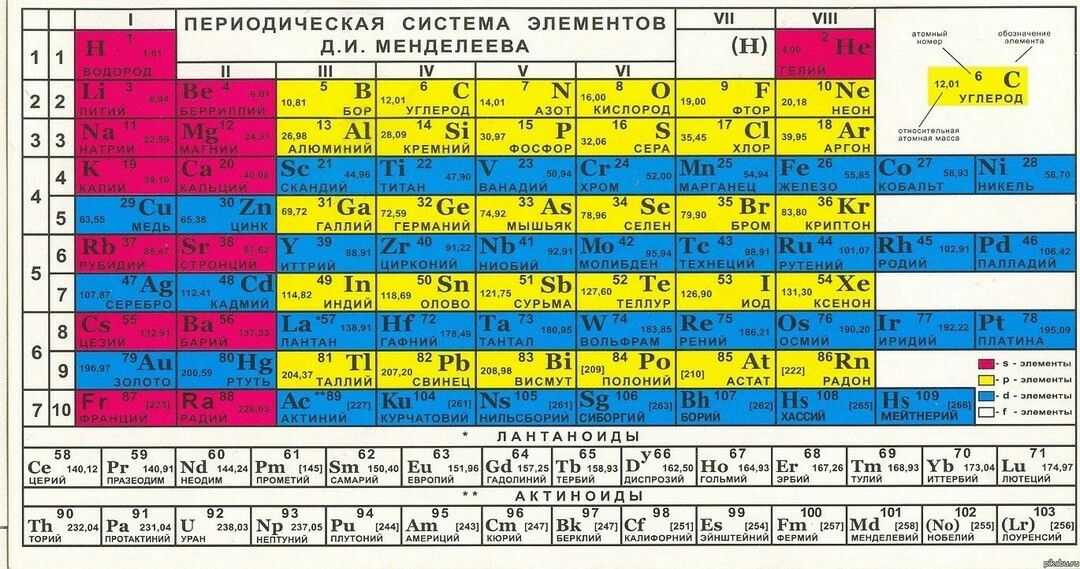
Водка и таблица. Мифы о Менделееве
110 лет назад скончался один из самых известных в мире русских учёных Дмитрий Иванович Менделеев. В каждой школе в кабинете химии висит открытая им периодическая таблица. В каждом магазине, торгующем крепкими напитками, имеется в наличии другое приписываемое ему изобретение – 40-градусная водка.
Гений из Сибири водку не изобретал
Дмитрий Иванович Менделеев (1834–1907) происходил из семьи тобольского директора гимназии. В той гимназии он и учился, поступив затем и окончив с золотой медалью физико-математический факультет Главного педагогического института в Санкт-Петербурге. В 1856 году он защитил магистерскую диссертацию и стал читать лекции по органической химии в Санкт-Петербургском университете. В 1861 году, по возвращении из Германии, Менделеев опубликовал свой учебник по органической химии. За него учёный получил Демидовскую премию.
За него учёный получил Демидовскую премию.
В 1865 году Дмитрий Иванович защитил уже докторскую диссертацию «Рассуждение о соединении спирта с водою». С ней связана известная легенда о «менделеевской водке». На самом деле в этой научной работе были заложены основы скучной даже по названию гидратной теории растворов. Об оптимальных свойствах сорокаградусной там не было и речи – вопреки тому, что писал о Менделееве как об изобретателе водки писатель Вильям Похлёбкин в книге «История водки» (1991). В диссертации лишь указывалось на специфические свойства смеси из одной части спирта и трёх частей воды.
Вернулся к своей гидратной теории Менделеев лишь в 1884 году. В 1887 он выступил с докладом о существовании гидратов определённого состава в растворе спирта с водой, но опять же не упоминал водку.
Но опосредованное отношение к огненной воде великий учёный всё же имел: в том же 1887 году в своём «Исследовании водных растворов по удельному весу» Дмитрий Иванович привёл сводную таблицу значений удельных весов водных растворов спирта при различных температурах. Она до сих пор служит основой алкоголеметрических таблиц производителей водки. Также Менделеев был председателем комиссии по виноградному вину в 1895–1896 годах. Тем дело и ограничивается. Нет никаких подтверждений тому, что великий химик стал реформатором водки или хотел им стать.
Она до сих пор служит основой алкоголеметрических таблиц производителей водки. Также Менделеев был председателем комиссии по виноградному вину в 1895–1896 годах. Тем дело и ограничивается. Нет никаких подтверждений тому, что великий химик стал реформатором водки или хотел им стать.
Всё важное в таблице
Чем действительно прославился русский учёный, так это своей знаменитой периодической таблицей химических элементов, ставшей одним из величайших открытий в мировой науке.
Ещё в XVII веке ирландский химик, физик и богослов Роберт Бойль опубликовал книгу, в которой рассуждал о необходимости поиска разложимых химических элементов. Сам он вывел 15 элементов, но признавал, что их может быть больше. Уже в XVIII столетии французский учёный Антуан Лавуазье создал свой список из 35 элементов. Поиск же новых элементов продолжался. Решающий вклад в него внёс Менделеев, который впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может существовать взаимосвязь.
Дмитрий Иванович также пришёл к выводу, что свойства элементов не есть что-то случайное, наоборот, они представляют собой периодически повторяющуюся закономерность. В феврале 1869 года Менделеев сформулировал первый периодический закон, в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества. В том же году была опубликована статья об открытии химика в немецком журнале Zeitschrift für Chemie. Ещё одна, более обширная публикация увидела свет в 1871 году.
Помимо водки, о Менделееве распространён ещё один устойчивый миф, согласно которому таблица просто приснилась учёному. Этот миф получил распространение благодаря соратнику Менделеева геологу Александру Иностранцеву, рассказывавшему студентам, что во сне химик чётко увидел таблицу, в которой все химические элементы были расставлены по порядку. Сам Менделеев всю эту историю опровергал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг. .. готово».
.. готово».
С 1869 по 1871 год Дмитрий Иванович пришёл к пониманию того, что любой элемент в системе нужно располагать исходя из совокупности его свойств в сравнении со свойствами других элементов. Основываясь на этом, учёному удалось внести поправки в значения атомных масс некоторых элементов, таких как уран, индий и бериллий.
Первооткрыватель
В периодической таблице оставались незанятые клетки. В 1870 году Менделеев предсказал открытие неизвестных ранее науке химических элементов, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (1879) и германий (1885). Последователи великого химика вскоре открыли ещё восемь элементов, среди которых полоний (1898), рений (1925), технеций (1937), франций (1939) и астат (1942–1943). В 1900 году сам Менделеев вместе с шотландским химиком Уильямом Рамзаем включил в таблицу и так называемые элементы нулевой группы, больше известные как инертные газы. Открытие новых элементов периодической системы продолжается и в наши дни.
Помимо своих научных открытий, Менделеев был и прекраснейшим педагогом. Много сил Дмитрий Иванович отдавал преподаванию – в Санкт-Петербургском университете, профессором которого он являлся, а также в других учебных заведениях. В конце жизни химик отмечал: «Из тысяч моих учеников много теперь повсюду видных деятелей, профессоров, администраторов, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность».
С начальством, в отличие от студентов, он сходился не всегда. В 1890 году учёный в знак протеста против притеснения студенчества покинул столичный университет. После этого Менделеев несколько лет проработал в Морском министерстве, а с 1892 года и до конца жизни возглавлял Главную палату мер и весов.
До сих пор великого русского химика знают во всём мире. Это та часть русской науки и русского мира, которая была и остаётся неоспоримым поводом для гордости.
Реакции элементов основной группы с водой
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 608
Вода состоит из двух атомов водорода и атома кислорода. {-}(водн.) + h3(г)} \]
{-}(водн.) + h3(г)} \]
Из этой реакции видно, что образуются ОН – , создавая щелочную или щелочную среду. Элементы группы 1 называются щелочными металлами из-за их способности вытеснять H 2 (g) из воды и создавать щелочной раствор.
Известно также, что щелочные металлы бурно и взрывоопасно реагируют с водой. Это связано с тем, что во время экзотермической реакции выделяется достаточно тепла, чтобы воспламенить H
Эту реакцию можно обобщить на все гидриды щелочных металлов.
Группа 2: Щелочноземельные металлы
Большинство щелочноземельных металлов также образуют гидроксиды при взаимодействии с водой. Гидроксиды кальция, стронция и бария мало растворимы в воде; однако образуется достаточно ионов гидроксида, чтобы создать щелочную среду.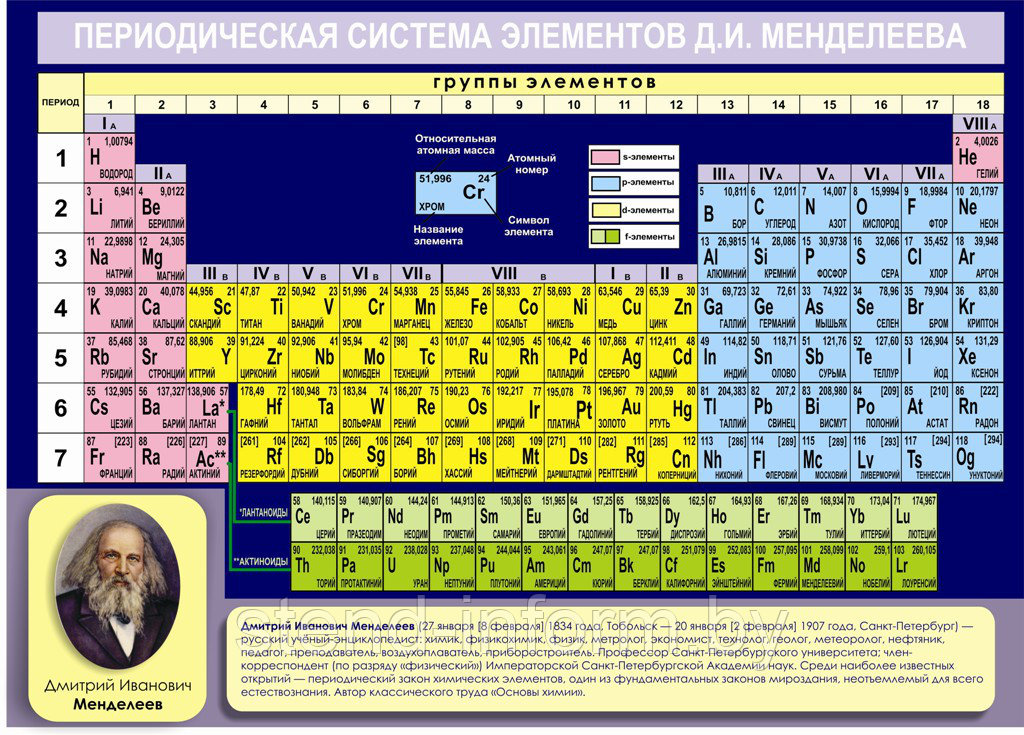 Общая реакция кальция, стронция и бария с водой представлена ниже, где М представляет собой кальций, стронций или барий:
Общая реакция кальция, стронция и бария с водой представлена ниже, где М представляет собой кальций, стронций или барий:
\[M_{(s)} + 2H_2O_{(l)} \longrightarrow M(OH)_{2(aq)}+H_{2\;(g)} \label{5}\]
Магний (Mg) реагирует с водяным паром с образованием гидроксида магния и газообразного водорода. Бериллий (Be) — единственный щелочноземельный металл, не вступающий в реакцию с водой. Это связано с его небольшими размерами и высокой энергией ионизации по сравнению с другими элементами группы.
Оксиды щелочноземельных металлов и вода
Подобно оксидам щелочных металлов, монооксиды щелочноземельных металлов соединяются с водой с образованием гидроксидных солей металлов (как показано в приведенном ниже уравнении). Исключением из этого общего предположения является бериллий, оксид которого (BeO) не реагирует с водой.
\[MO_{(s)}+H_2O_{(l)} \longrightarrow M(OH)_{2(s)} \label{6}\]
Одним из наиболее известных оксидов щелочноземельных металлов является CaO или негашеная известь. Это вещество часто используется для очистки воды и удаления вредных \(SO_{2(g)}\) из промышленных дымовых труб.
Это вещество часто используется для очистки воды и удаления вредных \(SO_{2(g)}\) из промышленных дымовых труб.
Гидриды щелочноземельных металлов и вода
За исключением бериллия (Be), гидриды щелочных металлов реагируют с водой с образованием гидроксида металла и газообразного водорода. Реакцию этих гидридов металлов можно описать ниже:
\[MH_{2(s)}+2H_2O_{(l)} \longrightarrow M(OH)_{2(aq)}+2H_{2(g)} \label{7} \]
Жесткая вода
Два типа жесткой воды включают временную жесткую воду и постоянную жесткую воду. Временно жесткая вода содержит бикарбонат (HCO 3 – ), который при нагревании образует CO 3 -2 (водн.), CO 2 (г) и H 2 O. Ионы бикарбоната реагируют с катионами щелочноземельных металлов и выпадают в осадок из раствора, вызывая образование накипи и проблемы в водонагревателях и сантехнике. Общие катионы в воде включают Mg +2 и Ca +2 . Чтобы смягчить воду, в водоочистные сооружения добавляют гидроксид щелочноземельного металла, такой как гашеная известь [Ca(OH) 2 ]. Это твердое вещество растворяется в воде с образованием иона металла (M +2 ) и ионов гидроксида (OH –). Ионы гидроксида объединяются с ионами бикарбоната в воде, образуя воду и ион карбоната. Затем ион карбоната осаждается вместе с ионом металла с образованием MCO 3 (s). Установки водоподготовки способны удалять осажденный карбонат металла и, таким образом, смягчать воду.
Это твердое вещество растворяется в воде с образованием иона металла (M +2 ) и ионов гидроксида (OH –). Ионы гидроксида объединяются с ионами бикарбоната в воде, образуя воду и ион карбоната. Затем ион карбоната осаждается вместе с ионом металла с образованием MCO 3 (s). Установки водоподготовки способны удалять осажденный карбонат металла и, таким образом, смягчать воду.
Другой тип жесткой воды – постоянная жесткая вода. Постоянная жесткая вода содержит ионы бикарбоната (HCO 3 – ), а также другие анионы, такие как сульфат-ионы (SO 4 -2 ). Затвердевающие частицы часто не удается выпарить. Для смягчения постоянной воды добавляется карбонат натрия (Na 2 CO 3 ). Карбонат натрия осаждает ионы Mg +2 и Ca +2 в виде соответствующих карбонатов металлов и вводит Na + ионов в растворы.
Группа 13: Семейство бора
Элементы группы 13 слабо реагируют с водой.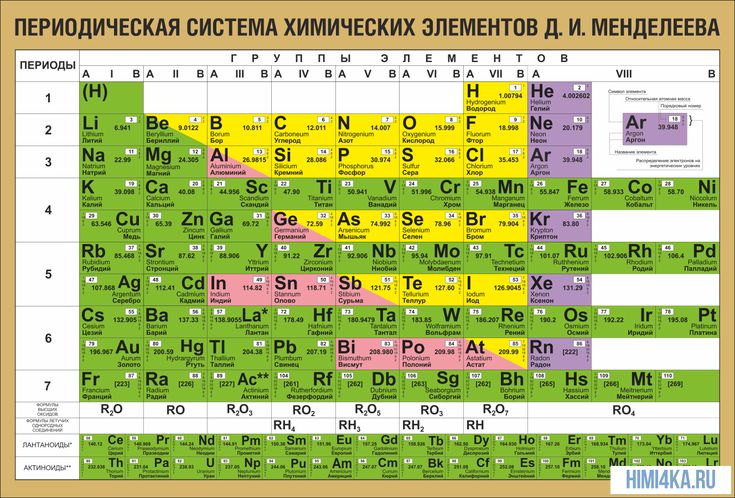 На самом деле бор (B) не реагирует с водой. Одной из примечательных реакций в этой группе является реакция алюминия (Al) с водой. Алюминий, по-видимому, не реагирует с водой, потому что внешний слой оксида алюминия (Al 2 O 3 ) образует твердое вещество и защищает остальную часть металла.
На самом деле бор (B) не реагирует с водой. Одной из примечательных реакций в этой группе является реакция алюминия (Al) с водой. Алюминий, по-видимому, не реагирует с водой, потому что внешний слой оксида алюминия (Al 2 O 3 ) образует твердое вещество и защищает остальную часть металла.
Группа 14: Семейство углерода
По большей части элементы группы 14 не реагируют с водой. Одним интересным следствием этого является то, что олово (Sn) часто напыляют в качестве защитного слоя на железные банки, чтобы предотвратить коррозию банки.
Рис.: Пустая консервная банка. Стальные банки изготавливаются из белой жести (сталь с луженым покрытием) или из стали, не содержащей олова. из Википедии.Группа 15: Семейство азота
Чистые элементы этого семейства не вступают в реакцию с водой. Соединения азота (нитраты и нитриты), а также газообразный азот (N 2 ) растворяются в воде, но не вступают в реакцию.
Группа 16: Семейство кислорода
Как упоминалось ранее, многие оксиды групп 1 и 2 реагируют с водой с образованием гидроксидов металлов. Оксиды неметаллов реагируют с водой с образованием оксокислот. Примеры включают фосфорную кислоту и серную кислоту.
Оксиды неметаллов реагируют с водой с образованием оксокислот. Примеры включают фосфорную кислоту и серную кислоту.
Группа 17: Галогены
Обычно галогены реагируют с водой с образованием галогенидов и гипогалогенидов. Газообразные галогены по-разному реагируют с водой из-за их различной электроотрицательности. Поскольку фтор (\(\ce{F2}\)) настолько электроотрицателен, он может вытеснять газообразный кислород из воды. Продукты этой реакции включают газообразный кислород и фтористый водород. Галогениды водорода реагируют с водой с образованием галоидоводородных кислот (\(\ce{HX}\)). За исключением \(\ce{HF}\), галогеноводородные кислоты являются сильными кислотами в воде. Примером является соляная кислота (\(\ce{HCl}\)), сильная кислота.
\[\ce{Cl2(г) + 2h3O(ж) → HCl(водн.) + HOCl(водн.)}\]
Хлорноватистая (\(\ce{HOCl}\)) кислота является сильным отбеливающим агентом и не очень стабилен в растворе и легко разлагается, особенно под воздействием солнечного света, с выделением кислорода.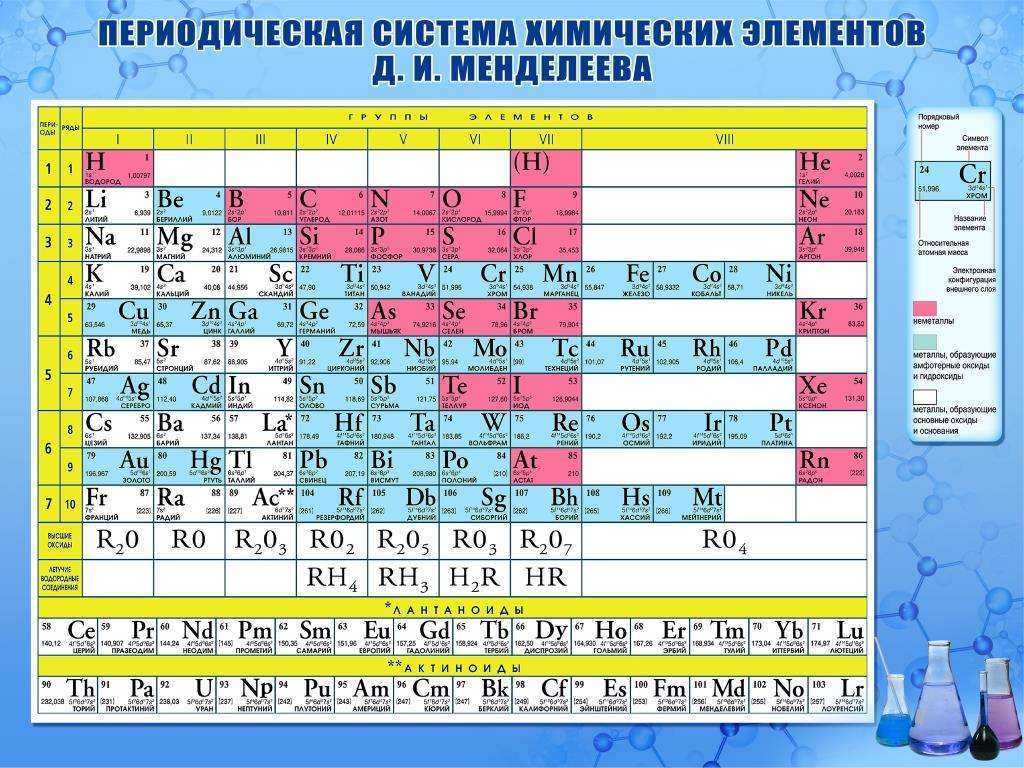
\[\ce{ 2 HClO -> 2 HCl + O2}\]
Жидкий бром медленно растворяется в воде с образованием желтовато-коричневого раствора.
\[\ce{Br2(g) + 2h3O(l) → HBr(aq) + HOBr(aq)}\]
Бромноватая (\(\ce{HOBr}\)) кислота является слабым отбеливающим агентом.
\[\ce{I2(g) + 2h3O(l) → HI(aq) + HOI(aq)}\]
Лишь небольшое количество йода растворяется в воде с образованием желтоватого раствора и гипойодистого (\(\ce {HOI}\)) кислота обладает очень слабой отбеливающей способностью.
Группа 18: Инертные газы
Инертные газы не вступают в реакцию с водой.
Общие сведения
| Реагент #1 | Реагент #2 | Продукция |
|---|---|---|
| Металл группы 1 периода 3 или выше | Холодная вода | Гидроксид металла и молекулярный водород |
| Металл группы 2 периода 3 или выше | Холодная вода | Гидроксид металла и молекулярный водород |
| Неметаллический элемент (кроме галогенов) | Холодная вода | Нет реакции |
| Фтор (F 2 ) | Вода | Фторид водорода (HF) и молекулярный кислород (O 2 ) |
| Галоген | Вода | Галоидоводородная кислота или галоидоводородная кислота |
| Металл с E 0 < -4,14 В для низшей степени окисления | Пар | Оксид металла и молекулярный водород |
| Неметаллический галогенид | Вода | Оксид неметалла и галогеноводород |
| Оксид металла | Вода | Гидроксид металла |
| Оксид неметалла | Вода | оксокислота |
Ссылки
- Бирк, Джеймс П.

- Хьюи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы строения и относительности . 4-е изд. Нью-Йорк: Колледж ХарперКоллинз, 1993. Печать.
- Massey, A.G. Химия основной группы . Лондон: Эллис Хорводд, 1990. Печать.
- Петруччи и др. Общая химия: принципы и современные приложения. 9изд. Река Аппер-Сэдл, Нью-Джерси, 2007 г.
Задачи
- Предскажите продукты следующих реакций:
- \(Be_{(s)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Ne_{(g)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Cl_{2\;(g)}+2H_{2}O_{(l)} \longrightarrow\)
- \(Li_2O_{(s)}+2H_{2}O_{(l)} \longrightarrow\)
- Верно/Ложно
- Оксиды металлов образуют основные растворы в воде
- Дифтор не реагирует с водой.
 -_{(водн.)}+H_2 \; {(g) }\)
-_{(водн.)}+H_2 \; {(g) }\)Авторы и ссылки
- Тревор Ландас (Калифорнийский университет, Дэвис)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- Гидриды щелочных металлов
- щелочные металлы
- Карбоновая серия
- Группа 1
- Галогены
- Жесткая вода
- Гидриды
- Элементы основной группы
- Семейство азота
- Благородные газы
- Оксиды
- Кислородная серия
- Вода
Периодическая таблица элементов Алюминий Спортивная вода
Etsy больше не поддерживает старые версии вашего веб-браузера, чтобы обеспечить безопасность пользовательских данных.

Воспользуйтесь всеми возможностями нашего сайта, включив JavaScript.
Товар на фото в Цвет: Белый
Вариант выбран!
Этот вариант продан.
Вариант выбран!
Этот вариант продан.

Нажмите, чтобы увеличить
39 477 продаж |
4,5 из 5 звездВ 18 тележках
99,56 датских крон+
Загрузка
С учетом НДС (где применимо) плюс стоимость доставки
Цвет
Выберите вариант Белый (110,63 датских крон – 121,70 датских крон) Алюминий (99,56 датских крон – 110,63 датских крон)
Пожалуйста, выберите вариант
Емкость
Выберите вариант 400 миллилитров (99,56 датских крон – 110,63 датских крон) 600 миллилитров (110,63 датских крон – 121,70 датских крон)
Выберите опцию
Количество
12345678910111213141516171819202122232425262728293031323334353637383940414243444546474849505152535455565758596061626364656667686970717273747576777879808182838485868788899091929394959697989910010110210310410510610710810911011111211311411511611711811912012112212312412512612712812913013113213313413513613713813914014114214314414514614714814915015115215315415515615715815916016116216316416516616716816917017117217317417517617717817918018118218318418518618718818911921931941951961971981992002012022032042052062072082092102112122132142152162172182192202212222232242252262272282292302312322332342352362372382392402412422432442452462472482492502512522532542552562572582592602612622632642652662672682692702712722732742752762772782792802812822832842852862872882892
29229329429529629729829930030130230330430530630730830931031131231331431531631731831932032132232332432532632732832933033133233333433533633733833934034134234334434534634734834935035135235335435535635735835936036136236336436536636736836937037137237337437537637737837938038138238338438538638738838933923933943953963973983994004014024034044054064074084094104114124134144154164174184194204214224234244254264274284294304314324334344354364374384394404414424434444454464474484494504514524534544554564574584594604614624634644654664674684694704714724734744754764774784794804814824834844854864874884894492493494495496497498499500501502503504505506507508509510511512513514515516517518519520521522523524525526527528529530531532533534535536537538539540541542543544545546547548549550551552553554555556557558559560561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597598599600601602603604605606607608609610611612613614615616617618619620621622623624625626627628629630631632633634635636637638639640641642643644645646647648649650651652653654655656657658659660661662663664665666667668669670671672673674675676677678679680681682683684685686687688689690691692693694695696697698699700701702703704705706707708709710711712713714715716717718719720721722723724725726727728729730731732733734735736737738739740741742743744745746747748749750751752753754755756757758759760761762763764765766767768769770771772773774775776777778779780781782783784785786787788789790791792793794795796797798799800801802803804805806807808809810811812813814815816817818819820821822823824825826827828829830831832833834835836837838839840841842843844845846847848849850851852853854855856857858859860861862863864865866867868869870871872873874875876877878879880881882883 Listed on Dec 29, 2022
103 избранных
Информация о продавце
Сообщить об этом элементе в Etsy
Выберите причину… С моим заказом возникла проблемаОн использует мою интеллектуальную собственность без разрешенияЯ не думаю, что это соответствует политике EtsyВыберите причину…
Первое, что вы должны сделать, это связаться с продавцом напрямую.



 -_{(водн.)}+H_2 \; {(g) }\)
-_{(водн.)}+H_2 \; {(g) }\)

