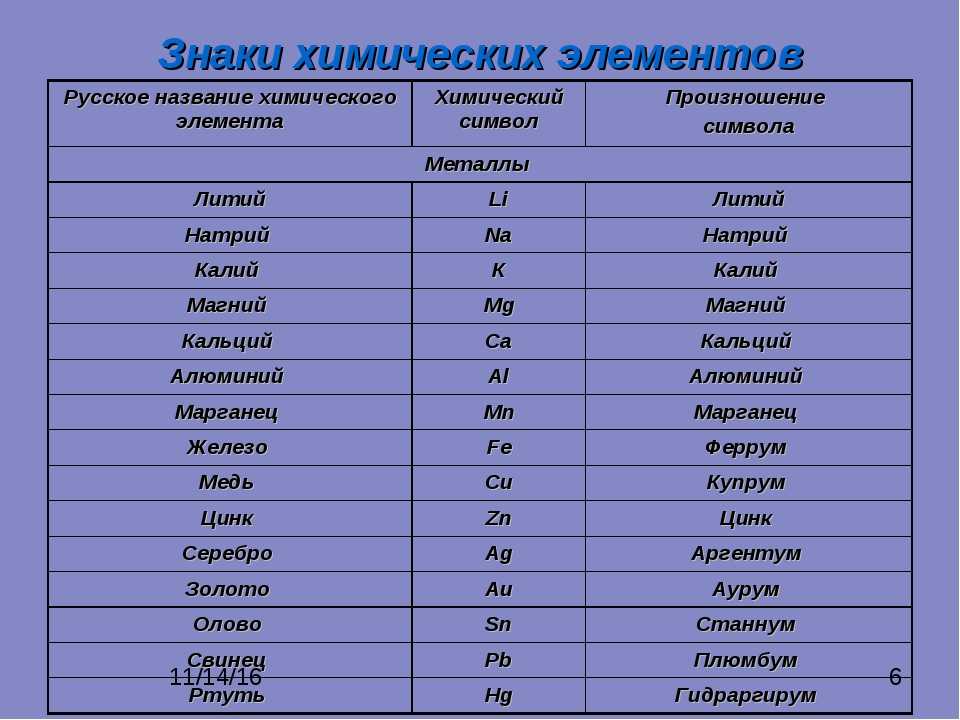
О чем даже не догадывался Менделеев? Любопытные факты об открытии химических элементов
Периодическая таблица химических элементов по праву считается величайшим достижением химической науки и одним из самых важных научных достижений человечества. Однако в ее первоначальном варианте всего 63 заполненных клетки. Гениальный ученый, предвосхищая новые и новые открытия в будущем, оставил несколько незаполненных граф и даже предсказал свойства некоторых элементов, которые на тот момент еще не были обнаружены.
Что сказал бы ученый, узнав, что сегодня элементов уже 118? Причем с открытием некоторых из них связаны любопытные факты…
Мы расскажем некоторые захватывающие истории открытия «недостающих» элементов вместе с ученым Ратмиром Дашкиным, директором Менделеевского инжинирингового центра РХТУ им. Д.И. Менделеева, героем первой серии проекта «Россия научная. Великие имена», посвященной Дмитрию Менделееву. Цикл документальных фильмов «Россия научная. Великие имена» эксклюзивно представлен в мультимедийном сервисе Okko. Это совместный проект Okko, АНО «Национальные приоритеты» и телеканала «365 дней ТВ», запущенный в рамках Года науки и технологий в России.
Это совместный проект Okko, АНО «Национальные приоритеты» и телеканала «365 дней ТВ», запущенный в рамках Года науки и технологий в России.
Ратмир Дашкин
Ученый, директор Менделеевского инжинирингового центра РХТУ им. Д.И. Менделеева, герой первой серии проекта «Россия научная. Великие имена», посвященной Дмитрию Менделееву.
Полоний. Как мир оказался на грани политического скандала
Элемент № 84 был открыт супругами Пьером Кюри и Марией Склодовской-Кюри. Полоний — так он был назван в честь исторической родины Марии (на латыни — Polonia). Но вот незадача, Польши в тот момент не существовало на карте Европы: ее земли принадлежали Российской империи, и даже топоним «Польша», по сути, был под запретом. Этот шаг легко можно было бы считать мощной политической декларацией, а полоний стал воистину «политическим» химическим элементом. К счастью, нобелевским лауреатам простили их волюнтаризм, и чуть позже мир узнал о… радиации.
Радий. Мода на радиацию
Получить чистый радий в начале XX века стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы добыть лишь крупинку. А тем, кто захотел бы стать обладателями всего 1 г чистого радия, потребовалось бы несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Неудивительно, что на начало прошлого века в мире не было более дорогого металла.
Мария Кюри трудилась 12 лет, чтобы добыть лишь крупинку. А тем, кто захотел бы стать обладателями всего 1 г чистого радия, потребовалось бы несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Неудивительно, что на начало прошлого века в мире не было более дорогого металла.
Любопытно, что изначально радий считался очень полезным для здоровья и быстро появился в косметических кремах, зубных пастах, ушных каплях и медицинских процедурах. В частности, его использовали для приготовления радоновых ванн, а люди на SPA-курортах пили обогащенную радием воду. Журнал American Journal of Clinical Medicine опубликовал статью, в которой утверждалось: «Радиоактивность предотвращает умопомешательство, пробуждает благородные чувства, отодвигает старость и дает прекрасную, энергичную, радостную жизнь». Страшно представить, но потенциальной начинкой атомных бомб питали кожу, отбеливали зубы и повышали потенцию.
На тот момент, когда стало ясно, что что-то идет не так, сотни рабочих, имевших контакт с радием, умерли или стали инвалидами. Но, определенно, наиболее известной жертвой радия можно назвать его первооткрывательницу — Марию Кюри. Причина ее смерти, апластическая анемия, более чем наверняка является следствием работы с радиоактивными материалами. Мадам Кюри похоронена в свинцовом гробу, а ее рабочие записи и дневники хранятся в коробках, экранированных свинцом.
Но, определенно, наиболее известной жертвой радия можно назвать его первооткрывательницу — Марию Кюри. Причина ее смерти, апластическая анемия, более чем наверняка является следствием работы с радиоактивными материалами. Мадам Кюри похоронена в свинцовом гробу, а ее рабочие записи и дневники хранятся в коробках, экранированных свинцом.
Торий и фонари Санкт-Петербурга
Еще один радиоактивный элемент был открыт незадолго до появления самого понятия радиоактивности и назван шведским химиком Йенсом Якобом Берцелиусом в честь скандинавского бога грома и молний Тора. Словно оправдывая свое название, этот элемент послужил освещению улиц. Тугоплавкие соединения тория, раскаляющиеся добела, стали использовать в газовых фонарях уличного освещения. В первую очередь такие фонари появились в нашей Северной столице, затем в Париже, Лондоне и т. д.
Значение газового освещения улиц сейчас забыто, но в те времена это было величайшее достижение, позволившее людям без опасений выходить за порог дома с окончанием светового дня. Времена непрактичных «персональных источников света» — смоляных факелов — канули в Лету.
Времена непрактичных «персональных источников света» — смоляных факелов — канули в Лету.
Плутоний. Восставший из царства мертвых
Впервые элемент был получен в декабре 1940 года в Беркли. В секретном письме тогдашнего президента США Рузвельта информировали о возможности применения нового элемента для создания мощного источника энергии.
С этого письма можно отсчитывать начало опаснейшей гонки вооружений, едва не стершей человечество с лица Земли. К слову, металлической плутониевой сферой была оснащена атомная бомба «Толстяк», которая 9 августа 1945 года была сброшена на Нагасаки.
Ученые предполагали, что плутоний — последний элемент в периодической системе, и назвали его в честь последней (по, опять же, представлениям, бытовавшим в те времена) планеты Солнечной системы. Любопытно, что тот самый Плутон был назван уже в честь другого Плутона — римско-греческого бога, заведовавшего царством мертвых. Что тут скажешь, элемент полностью оправдал свое мрачное название.
Менделевий. Американский русский
Любопытно, что элемент, названный в честь автора периодической таблицы, появился лишь в 1955 году и имел № 101. Особый интерес представляет тот факт, что открыли его американские ученые и для подобного шага требовалось определенное мужество. В середине прошлого века в США превалировали антикоммунистические и антирусские настроения. Однако авторитет как Менделеева, так и американских ядерщиков был столь велик, что никаких дискуссий об альтернативном названии элемента № 101 не было.
Мейтнерий как победа феминизма
Считается, что элемент № 109 (открыт в 1982 году) — единственный в периодической системе назван исключительно в честь женщины-ученого (название «кюрий» увековечивает не только Марию Кюри, но и ее мужа Пьера). Лиза Мейтнер была физиком и радиохимиком австрийского происхождения.
Кстати, химические и физические свойства мейтнерия до сих пор практически не исследованы. Что ж, «должна быть в женщине загадка!».
Новые имена: нихоний, московий, теннессин и оганесон
Тем временем периодическая таблица продолжает пополняться. В 2015-м в ней появились нихоний, московий, теннессин и оганесон. Три из них получены российскими физиками-ядерщиками из Объединенного института ядерных исследований в Дубне. Причем последний получил имя в честь ныне здравствующего российского физика-ядерщика Юрия Оганесяна.
В 2015-м в ней появились нихоний, московий, теннессин и оганесон. Три из них получены российскими физиками-ядерщиками из Объединенного института ядерных исследований в Дубне. Причем последний получил имя в честь ныне здравствующего российского физика-ядерщика Юрия Оганесяна.
Все эти элементы синтезированы искусственно, исследования и опыты в этой области продолжаются. Сколько ячеек будет финально в периодической таблице Менделеева, пока неизвестно. Эта история все еще пишется при нас.
Факт: Время от времени химики перестраивают периодическую таблицу, отображая ее в форме спирали, трехмерных конструкций, кругов или цилиндров. Утверждают, что существует по крайней мере 700 ее версий.
Биографии великих людей из мира науки можно представить как длинную дорогу — к истине, просвещению, прогрессу. Каждая точка на этом пути для нас, потомков, — гиперссылка в будущее. Сегодня благодаря новому документальному фильму, посвященному гению Менделеева, мы соединим их в единый маршрут. Узнаем, как ученому, опередившему свое время, удалось упорядочить хаос, и убедимся, что до сих пор пользуемся его изобретениями и открытиями. Смотрите фильмы о Менделееве и других великих российских ученых в цикле «Россия научная. Великие имена».
Узнаем, как ученому, опередившему свое время, удалось упорядочить хаос, и убедимся, что до сих пор пользуемся его изобретениями и открытиями. Смотрите фильмы о Менделееве и других великих российских ученых в цикле «Россия научная. Великие имена».
Женщины периодической таблицы – Science in School
Author(s): Аннет Ликкнес [Annette Lykknes], Бригит Ван Тиггелен [Brigitte Van Tiggelen]
Перевод выполнен Надей Фёдоровой (Nadia Fedorova). Познакомьтесь со вкладом женщин-учёных в изучение химических элементов – и как это влияет на наше понимание природы…
В марте 1869 года русский химик Дмитрий Менделеев впервые докладывал об изобретённый им периодической системе химических элементов в Российской Академии Наук (Gordin, 2004). Менделеев разработал свою систему на основании сформулированного им же периодического закона, утверждающего что свойства элементов стоят в периодической зависимости от их атомного веса. Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Система Менделеева, достигшая полуторавековой годовщины, доказала свою устойчивость в свете новых научных открытий, начиная с открытия благородных газов и радиоактивных элементов и кончая квантовой физикой.
Впрочем история периодической таблицы элементов началась задолго до 1869 года, так же как и научный вклад внесённый в разработку периодической теории женщинами-учёными. История научных открытий часто представляется с точки зрения основных понятий и теорий, и упускает огромное количество экспериментальных работ и случайных наблюдений благодаря которым были разработаны эти понятия и теории. Именно эту забытую и неоценённую работу часто выполняли женщины. Желая изменить эту тенденцию, в год объявленный Международным Годом Периодической Таблицыw1, мы хотим рассказать истории нескольких женщин-учёных, чьи работы внесли важный вклад в изучение элементов периодической таблицы.
XVIII век
Мария-Анна Лавуазье и новая идея химического элемента
Портрет Марии-Анны иАнтуана Лавуазье [Marie-
Anne and Antoine Lavoisier]
(1788) (нажмите на
фотографию для
увеличения)
Жак-Луи Давид [Jacques-Louis
David], свободный доступ
Революция в химии, происшедшая во Франции в восьмидесятых годах восемнадцатого века, часто отмечается как начало современной химической науки. Центральной фигурой в этом процессе выступал французский аристократ Антуан Лавуазье [Antoine Lavoisier]. В своей работе Méthode de nomenclature chimique (1787), Лавуазье и его коллеги присвоили новые систематические имена всем известным в то время химическим элементам и разработали правила наименование химических соединений которые используются по сей день. Лавуазье также определил химический элемент как элементарную субстанцию которая не поддается разложению во время химического анализа, и составил таблицу содержащую 33 элемента. Хотя не все они признаются элементами в современной химии, работы Лавуазье положили конец эпохе в которой выделялись только четыре элемента, земля, воздух, огонь, и вода.
Центральной фигурой в этом процессе выступал французский аристократ Антуан Лавуазье [Antoine Lavoisier]. В своей работе Méthode de nomenclature chimique (1787), Лавуазье и его коллеги присвоили новые систематические имена всем известным в то время химическим элементам и разработали правила наименование химических соединений которые используются по сей день. Лавуазье также определил химический элемент как элементарную субстанцию которая не поддается разложению во время химического анализа, и составил таблицу содержащую 33 элемента. Хотя не все они признаются элементами в современной химии, работы Лавуазье положили конец эпохе в которой выделялись только четыре элемента, земля, воздух, огонь, и вода.
На известной картине Лавуазье изображён со своей женой Марией-Анной: он занят работой а она представлена в виде его музы-вдохновительницы. На самом деле, их отношения этим не ограничивались. Мария-Анна принимала активное участие в научной работе мужа. Она помогала ему в лаборатории, вела его корреспонденцию, принимала иностранных учёных в своём салоне, переводила зарубежные научные статьи на французский, и иллюстрировала научные книги. Кроме того, она сыграла большую роль в распространении новых химических идей, особенно идеи кислорода, когда она перевела и снабдила критическими комментариями работу ирландского химика Ричарда Кирвана [Richard Kirwan], скептически относившегося к идее синтеза воздуха из кислорода и водорода и придерживавшегося теории ‘флогистона’.
Кроме того, она сыграла большую роль в распространении новых химических идей, особенно идеи кислорода, когда она перевела и снабдила критическими комментариями работу ирландского химика Ричарда Кирвана [Richard Kirwan], скептически относившегося к идее синтеза воздуха из кислорода и водорода и придерживавшегося теории ‘флогистона’.
XIX век
Джейн Марсе знакомит широкую публику с химическими элементами
В 1806 году, спустя несколько десятилетий после революции в химической науке, швейцарка из Лондона по имени Джейн Марсе [Jane Marcet] написала учебник по химии который выдержал 16 английских и по меньшей мере 23 американских издания и был переведён на французский, немецкий и итальянский языки (Dreifuss & Sigrist, 2012).
Учебник был написан в форме диалога и предназначен для женской аудитории, и его широкий успех сделал химию изысканным и благородным предметом интереса для широкой публики, включая женщин и девочек. Марсе включила в учебник новейшие на то время открытия в химии: взяв за основу таблицу химических элементов Лавуазье, она добавила в неё только-что открытые Хэмфри Дэви [Humphry Davy] щелочные и щелочноземельные металлы (Na, K, Mg, Ca, Sr, Ba). Кроме того в учебнике были упомянуты элементы теоретически предсказанные или практически полученные Йёнсом Якобом Берце́лиусом [Jöns Jacob Berzelius] и его учениками (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), а также элементы открытые Уильямом Хайдом Волластоном [William Hyde Wollaston] (Rh, Pd), Смитсоном Теннантом [Smithson Tennant] (Os, Ir), и Чарльзом Хэтчеттом [Charles Hatchett] (колумбий, сейчас известный как Nb). Марсе вращалась в Лондонском научном обществе, и через своих знакомых она знала о многих открытиях которые ещё не стали достоянием общественности. Не смотря на это, первые издания её учебника были опубликованы анонимно.
Кроме того в учебнике были упомянуты элементы теоретически предсказанные или практически полученные Йёнсом Якобом Берце́лиусом [Jöns Jacob Berzelius] и его учениками (Ce, Th, Se, Si, Zr, Li, La, Er, Tb, V), а также элементы открытые Уильямом Хайдом Волластоном [William Hyde Wollaston] (Rh, Pd), Смитсоном Теннантом [Smithson Tennant] (Os, Ir), и Чарльзом Хэтчеттом [Charles Hatchett] (колумбий, сейчас известный как Nb). Марсе вращалась в Лондонском научном обществе, и через своих знакомых она знала о многих открытиях которые ещё не стали достоянием общественности. Не смотря на это, первые издания её учебника были опубликованы анонимно.
Национальная медицинская библиотека США [US National Library of Medicine/archive.
 org], свободный доступ
org], свободный доступЮлия Лермонтова и редкие платиновые металлы
Портрет Юлии Лермонтовой[Julia Lermontova]
А Карвэйн [A Karvain]/Institut
Mittag-Leffler
Положение Юлии Лермонтовой [Julia Lermontova] намного отличалось от её предшественниц. Русская женщина-химик стала первой женщиной в Германии (и одной из первых в мире) получившей докторскую степень в химии в 1874 году. Современница Менделеева, она училась в Гейдельберге [Heidelberg] у Роберта Бунзена [Robert Bunsen], работала с Августом Вильгельмом фон Гофманом [Wilhelm von Hoffman] и получила свою докторскую степень в Гёттингене [Göttingen]. Лермонтова взяла на себя тяжёлую и кропотливую работу по определению места в периодической таблице для элементов платиновой группы (Ru, Rh, Pd, Os, Ir, Pt). Эти элементы очень близки друг к другу по своим свойствам и атомному весу. Необходимость точно определить их атомный вес требовала приготовления абсолютно чистых химических субстанций, для чего было необходимо точно повторять сложные аналитические измерения много раз подряд. Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
Понятно что такая работа не пользовалась интересом у большинства учёных и обычно доставалась “пехотинцам от науки”, таким как Лермонтова. Научный вклад таких лабораторных химиков, многие из которых были женщинами и от которых требовалось получение чистых элементов или измерение точного атомного веса, огромен, но в большинстве своём забыт. Однако именно эта кропотливая работа ярко иллюстрирует проблемы с которыми сталкивались Менделеев и его современники в своих усилиях сгруппировать все известные элементы в осмысленную систему. Неопубликованные работы Лермонтовой, долгое время остававшиеся неизвестными, были обнаружены в архиве Менделеева почти сто лет спустя.
XX век
Мария Склодовская-Кюри и радиоактивные элементы
Мария и Пьер Кюри [Marieand Pierre Curie] в своей
лаборатории, около 1900
года
Wellcome Collection,CC BY 4.0
Не смотря на то что научные работы Марии Склодовской-Кюри [Marie Curie] хорошо известны, их научный вклад всё равно поражает воображение. С тех пор как Мария, вместе с мужем Пьером и сотрудником Густавом Бемонтом [Gustave Bémont], открыла полоний и радий в 1898 году, они должны были проделать огромную работу, подвергая тонны минеральной смолы тщательному химическому анализу, чтобы получить 0.1 г хлорида радия в 1902 году (Quinn, 1995). Хотя Мария была женой Пьера, они работали независимо друг от друга до тех пор пока Пьер не осознал огромную важность работы жены и не присоединился к её лаборатории. Любопытно что в данном случае забытым учёным оказалась не женщина а мужчина, Бемонт.
С тех пор как Мария, вместе с мужем Пьером и сотрудником Густавом Бемонтом [Gustave Bémont], открыла полоний и радий в 1898 году, они должны были проделать огромную работу, подвергая тонны минеральной смолы тщательному химическому анализу, чтобы получить 0.1 г хлорида радия в 1902 году (Quinn, 1995). Хотя Мария была женой Пьера, они работали независимо друг от друга до тех пор пока Пьер не осознал огромную важность работы жены и не присоединился к её лаборатории. Любопытно что в данном случае забытым учёным оказалась не женщина а мужчина, Бемонт.
Ида Ноддак-Такке и рений
Ида Ноддак-Такке [IdaNoddack—Tacke] регулирует
рентгеновский
спектрометер в своей
лаборатории, 1944 год
Архив Католического
Университета в Левене
[Universiteitsarchief Katholieke
Universiteit te Leuven]
Немецкому химику Иде Ноддак-Такке [Ida Noddack-Tacke] пришлось проделать ту же изнуряющую работу что и Марии Склодовской-Кюри когда она трудилась над получением одного из самых редких металлов на земле, рения (Van Tiggelen, 2001). Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Открытие рения было объявлено Идой (вместе с её женихом Вальтером Ноддаком [Walter Noddack] и сотрудником Отто Бергом [Otto Berg], ещё одним забытым учёным) в 1925 году, но прошло ещё три года прежде чем были получены первые 120мг чистого рения, а его атомный вес был измерен только в 1929 году. Столько времени Иде и Вальтеру потребовалось чтобы найти места с богатыми залежами рениевой руды и проанализировать тысячи образцов для получения чистого элемента. Осталось большое количество лабораторных записей свидетельствующих о кропотливой и однообразной работе которая часто не приносила успеха. Несмотря на то что Ноддаки, также как Кюри, помогали друг другу в научной работе, Ида оставалась в финансовой зависимости от мужа и её академическая карьера полностью зависела от Вальтера.
Стефани Хоровиц и доказательство радиоактивных изотопов
Стефани Хоровиц [StefanieHorovitz] в Институте Радия
[The Radium Institute] в
Вене, 1915 год
Австрийская Центральная
Физическая Библиотека
[Austrian Central Library for
Physics], Вена
Работа польского химика еврейского происхождения Стефани Хоровиц [Stefanie Horovitz] обеспечила первое авторитетное доказательство существования изотопов.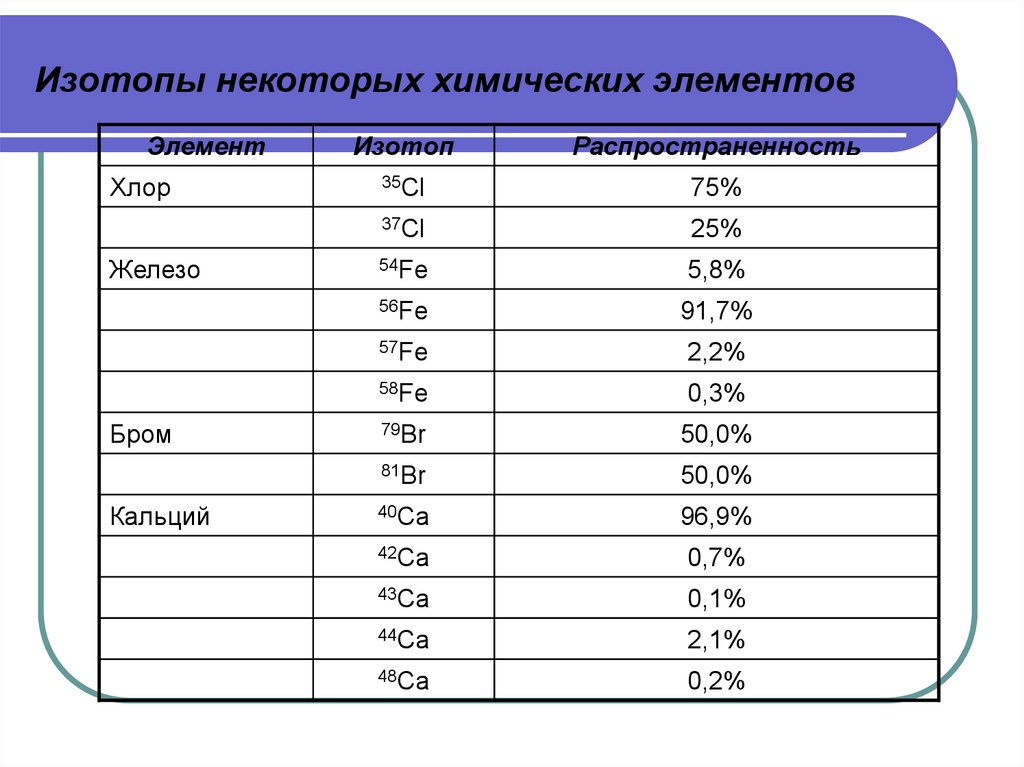 Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Идея изотопов, элементов которые могут существовать в состоянии разного атомного веса, была изначально предложена английским химиком Фредериком Содди [Frederick Soddy] в 1913 году. Содди, в свою очередь, использовал термин предложенный английским доктором Маргарэт Тодд [Margaret Todd]. К этому времени было открыто около 35 радиоактивных элементов – намного больше чем количество пустых мест в периодической таблице. Существование изотопов разрешало эту проблему, так как многие вновь открытые радиоактивные элементы позже оказались изотопами ранее известных. Однако эта идея была вначале встречена скептически.
Чтобы доказать существование изотопов, Содди выдвинул идею для экспериментального анализа: если свинец может существовать в виде разных изотопов, тогда атомный вес свинца полученного из урана будет отличаться от обычного свинца. В 1914 году эта работа была поручена Хоровиц её научным руководителем, Отто Хёнигшмидом [Otto Hönigschmid] из Венского Института Радия. Много дней Стефани провела в лаборатории изолируя образцы чистейшего свинца из радиоактивной урановой руды и измеряя их атомный вес с помощью точнейших гравиметрических методов. Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Её измерения показали разницу в атомном весе превышающую экспериментальную ошибку, тем самым раз и навсегда доказав существование изотопов.
Кроме того, вместе с Хёнигшмидом, она помогла опровергнуть существование предположительно нового элемента названного ионием. Они доказали что ионий имел те-же спектроскопические и химические свойства что и торий, отличаясь от тория только атомным весом. В результате ионий был классифицирован как изотоп тория (Th-230).
Эллен Гледич и не радиоактивные изотопы
Портрет Эллен Гледич [EllenGleditsch], 1927 год
Крис Кох [Chris Koch]
Хотя Эллен Гледич [Ellen Gleditsch] родилась и выросла в Норвегии, она получила первый опыт работы с радиоактивными элементами в лаборатории Марии Кюри в Париже (Lykknes, 2005). После этого она уехала в Америку, где её работа в Йельском Университете [Yale University] помогла установить точную величину периода полураспада радия (позднее классифицированного как изотоп RA-226). Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Эта работа, опубликованная в 1915 году, дала науке важную константу так как радий считался эталоном в этой исследовательской области.
Позднее, работая в Гарвардском Университете [Harvard University], Гледич (как и Хоровиц) увлеклась работой с изотопами. Тогда уже было известно что атомный вес радиоактивных элементов (или продуктов радиоактивного распада) может меняться в зависимости от их геологической природы. Например, в рудах богатых природным торием, изобилие свинца-208 повышает атомный вес свинца, тогда как в урановых рудах (откуда получают свинец-206) атомный вес свинца будет ниже. Эта изменчивость изначально приписывалась только радиоактивным элементам.
Но изобретение масс-спектрографа, совершённое Фрэнсисом Астоном [Francis Aston] в 1919 году, опровергло это убеждение. Масс-спектрограф позволил произвести исключительно аккуратную классификацию элементов на основании их атомного веса и электрического заряда. Когда Астон объявил что он обнаружил два отдельных атомных веса хлора (35 и 37) со средним атомным весом в 35. 46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
46, это было встречено скептически – получалось что и в этом случае изотопный состав зависит от геологической природы. Вся концепция постоянства атомного веса, на базе которой была построена периодическая система, оказалась под сомнением.
Когда Гледич и её сотрудники исследовали хлор полученный из разных источников, они обнаружили что изотопный состав хлора на самом деле не меняется от источника к источнику. Несмотря на то что Ирэн Кюри [Irène Curie] (дочь Пьера и Марии) получила противоположные результаты, Гледич заключила что образцы Кюри были загрязнены. В конце концов атомный вес хлора оказался постоянным и угроза стабильности атомного веса была предотвращена.
Комплексность и сотрудничество
На протяжение всего существования периодической системы женщины внесли значительный научный вклад в её развитие: в салонах VIII века; как переводчики научных трактатов; как авторы учебников и распространительницы знаний; как жёны, сёстры и дочери учёных, помогавшие им в научных исследованиях; как лаборанты, учителя, и профессора; в лабораториях, школах, в семьях, и на заводах (Watts, 2007). Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Истории отдельных женщин, которые обогатили науку периодической системы элементов, доказывают что научная работа сложна и многогранна и что она основана на взаимном сотрудничестве. Кроме того, эти истории не только знакомят нас с мало известным научным вкладом многих женщин (и мужчин): они также открывают перед нами истинную природу науки и научных исследований.
Благодарности
Авторы хотят поблагодарить всех кто предоставил статьи о женщинах-учёных и химических элементах в предстоящий том “Женщины в своей стихии: Вклад отдельных женщин в развитие периодической системы” [Women in their Element: Selected Women’s Contributions to the Periodic System] (публикуется World Scientific, Август 2019). Особенная благодарность следующим авторам: Патрис Брет [Patrice Bret] и Кейко Кавашима [Keiko Kawashima], Жизела Боек [Gisela Boeck], Питер Чайлдс [Peter Childs], Джон Хадсон [John Hudson], Мерилин и Джофри Рэйнер-Кэнем [Marelene and Geoffrey Rayner-Canham], и Кзэвиер Рок [Xavier Roqué].
References
- Dreifuss JJ, Sigrist NT (2012) The making of a bestseller: Alexander and Jane Marcet’s Conversations on Chemistry. In Lykknes A, Opitz DL, Van Tiggelen B (eds) For Better or For Worse? Collaborative Couples in the Sciences pp 19–32. Basel, Switzerland: Birkhäuser/Springer. ISBN: 3034802854
- Gordin MD (2004) A Well-Ordered Thing: Dmitrii Mendeleev and the Shadow of the Periodic Table. New York, USA: Basic Books. ISBN: 046502775X
- Lykknes A (2005) Ellen Gleditsch: Professor, Radiochemist, and Mentor. PhD thesis, Department of Chemistry, Norwegian University of Science and Technology, Trondheim, Norway.
- Quinn S (1995) Marie Curie: A Life. Cambridge, USA: Perseus Books. ISBN: 0201887940
- Van Tiggelen B (2001) The discovery of new elements and the boundary between physics and chemistry in the 1920s and 1930s. The case of elements 43 and 75. In Reinhardt C (ed) Chemical Sciences in the 20th Century: Bridging Boundaries pp 131–145.
 Weinheim, Germany: Wiley-VCH. ISBN: 3527302719
Weinheim, Germany: Wiley-VCH. ISBN: 3527302719 - Watts R (2007) Women in Science: A Social and Cultural History. London, UK: Routledge. ISBN: 0415253071
Web References
Resources
- Узнайте больше о Международном Годе Периодической Таблицы на сайте IYPT2019.
- Прочитайте больше о Джейн Марсе и написанном ей учебнике в этой статье Chemistry World.
- Прочитайте краткие биографии Марии Склодовской-Кюри, Антуана Лавуазье и Джейн Марсе на сайте Института Научной Истории [Science History Institute].
- Исследуйте историю периодической таблицы прочитав об альтернативных путях расположения элементов. Смотрите:
- Lorch M (2019) Arranging the elements: the evolving design of the periodic table. Science in School 47: 26-29.
Author(s)
Аннет Ликкнес [Annette Lykknes] — профессор химического образования в Норвежском Университете Науки и Техники [Norwegian University of Science and Technology] в Норвегии. Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Она имеет степень магистра в области химического образования и докторскую степень по истории химии. С 2005 года она готовит преподавателей естественных наук. Ее научные интересы включают историю химии, научный вклад женщин и семейных пар, историю учебников по химии (как старых так и современных), природу науки, и преподавание естественных наук в школах через культуру и практику.
Бригит Ван Тиггелен [Brigitte Van Tiggelen] является директором по европейским операциям и старшим научным сотрудником Центра Исторических Исследований Института Истории Науки [Center for Historical Research at the Science History Institute] в Филадельфии, Пенсильвания, США. Она также является членом Центра Исторических Наук Католического Университета [Centre de Recherche en Histoire des Sciences, Université Catholique de Louvain] в Лувене, Бельгия. Она изучала физику и историю, и написала докторскую диссертацию по истории химии. Ее исследовательские интересы включают научный вклад семейных пар и женщин, историю отечественной науки и бельгийской химии. Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Она основала Mémosciences с целью популяризации истории науки, в особенности среди учителей средних школ.
Review
Большинство людей, если их попросят назвать женщин внёсших научный вклад в развитие периодической таблицы, не смогут назвать ни одной. Эта статья даёт короткое но исключительно интересное представление о развитие этого фундаментального химического принципа, а также знакомит со многими забытыми учёными (как женщинами так и мужчинами) выполнившими большую научную работу но не получившими должного признания.
Эта статья может помочь стимулировать дискуссию, или послужить как материал для дополнительного чтения при изучении химии. Рекомендуется также делать меж-предметные ссылки в другие области науки где роль женщин недооценивается, например вычислительная техника, математика, и исследование космоса. Статья будет хорошим ресурсом для организованного классного чтения или как упражнение на понимание. Возможны следующие вопросы:
- Опишите роль Марии-Анны Лавуазье в установлении современной концепции химического элемента.
- Объясните почему учебник Джейн Марсе был успешным в популяризации химических элементов.
- Почему определение правильного расположения некоторых элементов в периодической таблице оказалось трудной задачей?
Кэрин Ховард [Caryn Howard], руководитель отдела химии, Школа Святой Марии [St Mary’s School], Калн, Великобритания
License
CC-BY
Download
Download this article as a PDF
Четыре химических элемента добавлены в периодическую таблицу
Элементы 113, 115, 117 и 118 будут названы учеными из России, США и Японии.
НАБЛЮДЕНИЕ ЗА ТЕНДЕНЦИЕЙ: Четыре новых элемента были официально добавлены в периодическую таблицу, заполнив ее седьмую строку.
Элементы 113, 115, 117 и 118 были занесены в таблицу в течение многих лет, и лаборатории в России, США и Японии неоднократно заявляли об их открытии. Но официального признания пришлось ждать до конца 2015 года, когда группа независимых экспертов согласилась, что доказательства достоверны (см. график). Международный союз теоретической и прикладной химии (IUPAC), штаб-квартира которого находится в Research Triangle Park, Северная Каролина, объявил выводы группы 30 декабря.
график). Международный союз теоретической и прикладной химии (IUPAC), штаб-квартира которого находится в Research Triangle Park, Северная Каролина, объявил выводы группы 30 декабря.
Все элементы были созданы в лаборатории путем столкновений более легких атомных ядер. Нестабильные скопления протонов и нейтронов существуют всего доли секунды, прежде чем они распадаются на более мелкие и более стабильные фрагменты.
Команды, получившие признание за открытия, теперь могут выдвигать предложения по названиям элементов и двухбуквенным символам. Элементы могут быть названы в честь одного из их химических или физических свойств, мифологической концепции, минерала, места или страны или ученого.
Приоритет в открытии элемента 113 достался исследователям из Японии, которые особенно рады тому, что он станет первым искусственным элементом, получившим название в Восточной Азии. Когда этот элемент был впервые обнаружен 12 лет назад, в качестве названия было предложено название «японий».
Японский химик Косуке Морита является частью команды, которая получила признание за открытие элемента 113. Авторы и права: Kazuhiro Nogi/AFP/Getty
Команда Центра ускорительных исследований RIKEN Nishina в Вако, недалеко от Токио, сделала первое заявление об обнаружении 113-го элемента в 2004 году, а затем более убедительно обнаружила его в 2012. К тому времени было создано три атома элемента. «Для ученых это имеет большую ценность, чем олимпийская золотая медаль», — сказал Рёдзи Ноёри, лауреат Нобелевской премии по химии 2001 года, на пресс-конференции, посвященной решению IUPAC. (Ноёри не был членом японской команды, но является бывшим президентом RIKEN).
Российские и американские исследователи сделали соперничающие заявления об открытии 113, но группа экспертов, составленная из IUPAC и Международного союза теоретической и прикладной физики (IUPAP), не отдала им приоритет.
Тем не менее, Россия и США получили кредит и права на наименование других новых элементов. Элементы 115 и 117 были впервые созданы в сотрудничестве между Объединенным институтом ядерных исследований в Дубне, Россия, Ливерморской национальной лабораторией Лоуренса в Ливерморе, Калифорния, и Национальной лабораторией Ок-Ридж в Теннесси, заявил комитет IUPAC/IUPAP. Работа других команд, таких как шведская группа, использующая немецкий ускоритель, помогла подтвердить существование элемента 115.
Элементы 115 и 117 были впервые созданы в сотрудничестве между Объединенным институтом ядерных исследований в Дубне, Россия, Ливерморской национальной лабораторией Лоуренса в Ливерморе, Калифорния, и Национальной лабораторией Ок-Ридж в Теннесси, заявил комитет IUPAC/IUPAP. Работа других команд, таких как шведская группа, использующая немецкий ускоритель, помогла подтвердить существование элемента 115.
Заслуга открытия 118-го элемента — самого тяжелого из когда-либо созданных — принадлежит командам из Дубны и Лоуренса Ливермора. У этого элемента пестрая история: заявление 1999 года о его создании было отозвано два года спустя на фоне обвинений в фальсификации данных.
Теперь физики попытаются создать элементы 119 и 120, что вполне возможно при современных технологиях, говорит Рольф-Дитмар Герцберг, физик-ядерщик из Ливерпульского университета, Великобритания. Однако никто еще не заявил о наблюдении: исследователи из Центра исследований тяжелых ионов им. Гельмгольца GSI в Дармштадте, Германия, безуспешно пытались в течение пяти месяцев в 2012 году.
Периодическая таблица химических элементов
Периодическая таблица химических элементов похожа на химический алфавит. Подобно буквам в алфавите, элементы могут комбинироваться и реагировать разными способами.
На самом деле перестановок всех возможных химических комбинаций элементов больше, чем расчетное количество атомов в видимой Вселенной!
Если мы включим инертные газы в перестановки, то будет 6,62×10184 возможностей. Из этих возможностей возникла сложная химия жизни. Для сравнения, расчетное общее верхнее число атомов во Вселенной составляет всего около 1×1082, или сто тысяч квадриллионов вигинтиллион атомов.
Вы можете предсказать некоторые реакции и сочетания элементов, если знаете их свойства на основе таблицы Менделеева. И если вы знакомы с тем, как организована таблица, вы можете описать по крайней мере некоторые свойства элемента, просто взглянув на его положение в таблице.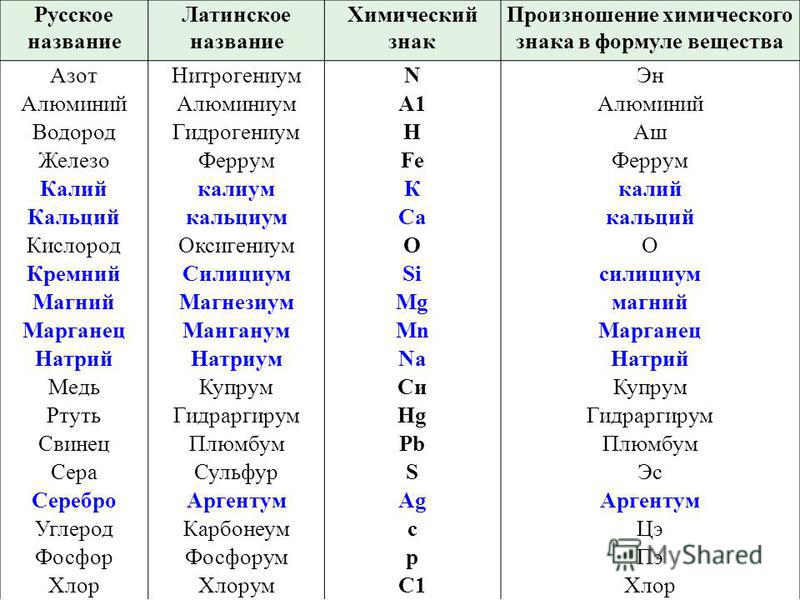
В этом сообщении:
Что такое Периодическая таблица?
В Периодической таблице все известные элементы распределены по периодам и группам, которые соответствуют определенным химическим свойствам.
Тенденции сразу бросаются в глаза, если вы понимаете, как устроена таблица Менделеева.
Вот некоторые свойства и тенденции химических элементов, перечисленных в периодической таблице:
- Атомный радиус — Вы можете определить радиус атома, измерив расстояние между двумя ядрами ионной связи. Радиус атома имеет тенденцию к уменьшению при перемещении слева направо по таблице. Она увеличивается по мере продвижения сверху вниз.
- Энергия ионизации — это энергия, необходимая для удаления электрона с самой внешней орбитали газообразного атома или иона. Энергия ионизации увеличивается при движении слева направо и уменьшается сверху вниз по таблице Менделеева.
- Сродство к электрону . В отличие от энергии ионизации, сродство к электрону представляет собой количество энергии, высвобождаемой при присоединении электрона к атому.
 Сродство к электрону увеличивается слева направо по периодической таблице.
Сродство к электрону увеличивается слева направо по периодической таблице. - Электроотрицательность — Электроотрицательность — это то, насколько хорошо атом может притягивать пару связывающих электронов в молекулах. Сила электроотрицательности атома увеличивается среди элементов по мере движения слева направо по периоду.
- Характеристики металлов – Металлы являются хорошими проводниками тепла и электричества. Они пластичны, податливы и, за исключением ртути, тверды. Металлические характеристики элементов увеличиваются по диагонали справа налево.
Для чего используется периодическая таблица?
Периодическая таблица используется химиками и другими учеными в качестве всеобъемлющего справочного источника.
Очень полезно знать относительные свойства элементов и уметь предсказывать их реакционную способность на основе их положения в периодической таблице.
Например, периодическую таблицу можно использовать для предсказания и сравнения энергии ионизации различных элементов.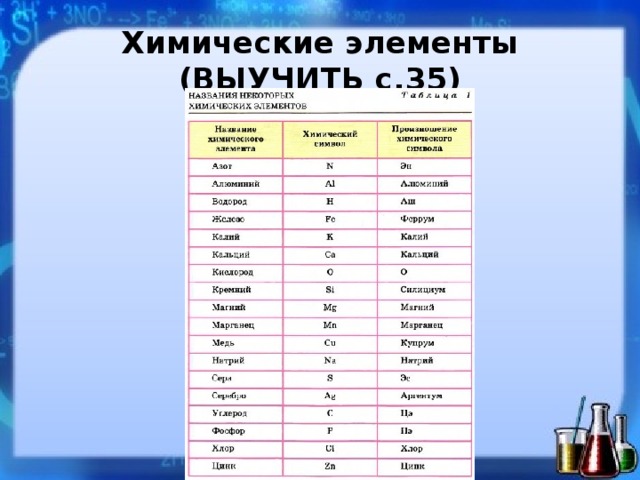 Конкретные детали, такие как атомный вес и значения электроотрицательности, также можно найти довольно легко.
Конкретные детали, такие как атомный вес и значения электроотрицательности, также можно найти довольно легко.
Печатные периодические таблицы могут содержать лишь очень ограниченный объем информации, не становясь при этом чрезвычайно большими и непрактичными. Однако цифровые периодические таблицы не ограничены физическим пространством. Это означает, что они могут предоставить больше информации, включая видеоконтент. Некоторые цифровые периодические таблицы также являются интерактивными и позволяют вам щелкнуть символ элемента, чтобы просмотреть дополнительные сведения.
Как расположены элементы в периодической таблице?
Как следует из названия, элементы в периодической таблице расположены в виде периодов или строк с возрастающим атомным номером. Есть семь периодов.
Также имеется 18 «групп», представленных разными столбцами. Для каждого периода характерны определенные тенденции, например увеличение сродства к электрону. Группы классифицируют элементы на основе их общих свойств. Например, группа 15 (5А) — это колонка для инертных газов, которые являются наименее реакционноспособными элементами.
Например, группа 15 (5А) — это колонка для инертных газов, которые являются наименее реакционноспособными элементами.
Периоды в основном представляют количество орбиталей. Элементы, принадлежащие к одному периоду, имеют одинаковое количество орбиталей. Это означает, что вы также можете записать электронную конфигурацию этих элементов. Электронная конфигурация описывает, как электроны распределяются по орбиталям.
- Период 1: одна орбиталь, два элемента
- Период 2: две орбитали, восемь элементов
- Период 3: три орбитали, восемь элементов
- Период 4: четыре орбитали, 18 элементов
- Период 5: пять орбиталей, 18 элементы
- Период 6: шесть орбиталей, 32 элемента
- Период 7: семь орбиталей, 32 элемента
Сколько групп в периодической таблице?
Периодическая таблица элементов состоит из 18 групп, каждая из которых представляет определенный набор свойств. Все элементы в определенной группе или столбце имеют одинаковое количество валентных электронов.
- Группа 1 : Эта группа известна как щелочные металлы, за исключением водорода. Эти металлы очень реакционноспособны и очень чувствительны к воде, поэтому они встречаются во многих соединениях. Каждый элемент имеет только один валентный электрон.
- Группа 2 : Щелочноземельные металлы являются вторыми наиболее реакционноспособными металлами. Они также являются очень хорошими восстановителями. Щелочноземельные металлы отдают электроны в ходе химических реакций. Каждый элемент этой группы имеет два валентных электрона.
- Группы 3-12 : Также известные как переходные металлы, элементы этих групп образуют две или более степеней окисления. Эти металлы относительно стабильны и не так активны, как щелочные и щелочноземельные металлы. Большинство переходных металлов прочны и тверды, но податливы. Они также блестящие и имеют высокую температуру плавления. Переходные металлы являются хорошими проводниками электричества и тепла. У каждого из них по два валентных электрона.

- Группа 13 : Это группа бора. Элементы этой категории имеют три валентных электрона. Они также обладают металлоидными или металлическими свойствами. Элементами этой группы являются бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нихоний (Nh).
- Группа 14 : Эта группа называется углеродной и включает углерод (C), кремний (Si), германий (Ge), олово (Sn), свинец (Pb) и флеровий (Fl). Каждый из этих элементов имеет пять валентных электронов. Большинство этих элементов довольно распространены в земной коре. Углерод является наиболее важным элементом, потому что он служит основой органических соединений и самой жизни.
- Группа 15 : Это группа элементов азота. К элементам этой группы относятся азот (N), фосфор (P), мышьяк (As), сурьма (Sb), висмут (Bi) и московий (Mc). Каждый из этих элементов имеет шесть валентных электронов. Они имеют общее химическое поведение, но их физические свойства различаются.
- Группа 16 : Эта группа известна как кислородное семейство или халькогены.
 К этой группе относятся кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и ливерморий (Lv). Каждый из этих элементов имеет шесть валентных электронов.
К этой группе относятся кислород (O), сера (S), селен (Se), теллур (Te), полоний (Po) и ливерморий (Lv). Каждый из этих элементов имеет шесть валентных электронов. - Группа 17 : Это группа галогенов, названная в честь их способности образовывать соли. Этимология имени греческая: hal или соль и -gen, что означает формировать. К элементам этой группы относятся фтор (F), хлор (Cl), бром (Br), йод (I), астат (At) и теннессин (Ts). Они очень реактивны с щелочными металлами и щелочноземельными металлами. Каждый элемент имеет семь валентных электронов.
- Группа 18 : Известные также как благородные газы, элементы этой группы очень стабильны, поскольку все они имеют восемь валентных электронов. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe), радон (Rn) и оганесон (Og). Они наименее реакционноспособны из всех элементов и в основном находятся в элементарном состоянии. Из этих элементов в природе образуется очень мало соединений.

История периодической таблицы
С древних времен философы задавались вопросом об окончательном или фундаментальном составе материи. Например, греческий философ Аристотель считал, что в природе всего четыре элемента: земля, воздух, вода и огонь.
Древние греки считали, что четыре элемента: земля, воздух, вода и огонь составляют всю материю.Эта вера стала основой алхимии и даже медицины на тысячи лет. Однако эта идея была опровергнута открытием многих других элементов. Эти прорывы также показали, что так называемые четыре элемента были не элементами, а скорее смесями и соединениями.
Первая научная попытка классифицировать элементы восходит к Антуану Лавуазье в 1789 году.. Он попытался классифицировать элементы, сгруппировав их в газы, неметаллы и земли. Эти группы все еще существуют в современной периодической таблице элементов.
Прошло более четырех десятилетий, прежде чем триада элементов была признана другим ученым, Иоганном Доберейнером. В 1829 году он понял, что элементы можно разделить на три группы в зависимости от их свойств. Это означало, что свойства среднего элемента можно было предсказать на основе двух известных элементов триады. Похоже, Доберейнер имел представление о периодичности.
В 1829 году он понял, что элементы можно разделить на три группы в зависимости от их свойств. Это означало, что свойства среднего элемента можно было предсказать на основе двух известных элементов триады. Похоже, Доберейнер имел представление о периодичности.
Прошло три десятилетия, прежде чем был достигнут настоящий прогресс в открытии периодичности элементов. Именно во время конференции в Германии в 1860 году научному сообществу стал доступен точный список атомных масс элементов.
Кто изобрел периодическую таблицу?
Периодическую таблицу химических элементов никто не изобретал. Скорее, нынешнее расположение элементов в периодической таблице было обнаружено и разработано несколькими учеными в течение нескольких десятилетий.
Разработка современной периодической таблицы элементов в основном принадлежит следующим ученым: винт), опубликованный в 1862 году. Он был основан на известных атомных весах элементов. В результате на диаграмме выстроились элементы со схожими свойствами.
Джон Ньюлендс. Примерно за четыре года до того, как Менделеев опубликовал свою периодическую таблицу химических элементов (см. ниже), Ньюлендс предложил Закон Октав, основанный на сходстве элементов, вес которых различается на семь единиц. Однако его система была неуклюжей и не предусматривала пробелов для неоткрытых элементов. Его также критиковали за излишнюю произвольность.
Юлий Лотар Мейер. Технически Мейеру можно было приписать идею современной периодической таблицы химических элементов. Однако его работа была опубликована намного позже открытий Менделеева. Мейер сгруппировал элементы по их валентности и в порядке атомного веса. Его таблица была очень похожа на таблицу Менделеева.
Дмитрий Менделеев – Менделеев считается отцом современной периодической таблицы элементов. Подобно ученым до него, он расположил элементы по их атомному весу, но заметил некоторые несоответствия. Вместо этого он сгруппировал их в соответствии с их химическими свойствами. Однако истинная гениальность его открытия заключалась в том, что он включал пробелы, представляющие неоткрытые элементы.
Генри Мозли. Главный вклад Мозли заключался в упорядочении элементов по их атомному номеру, а не по атомному весу. Хотя веса хорошо соответствуют атомному номеру с точки зрения периодичности свойств, были некоторые исключения. Мозли разрешил это противоречие.
Периодическая таблица в 2022 году
Современная периодическая таблица содержит 92 элемента естественного происхождения и 26 синтетических элементов. По мере увеличения атомного номера атом становится менее стабильным. Синтетические элементы существуют мгновенно во время атомных столкновений. Они слишком нестабильны, чтобы существовать в большом количестве, а некоторые из них могут быть получены только из нескольких атомов.
Текущая таблица Менделеева не меняется уже несколько лет. Новейшими элементами в периодической таблице являются:
- Нигоний (Nh) – атомный номер 113
- Московий (Mc) – атомный номер 115
- Теннессин (Ts) – атомный номер 117
- Оганесон (Og) – атомный номер 118
Отказ от ответственности
Весь контент, опубликованный в блоге ReAgent.
