Таблица Периодическая система химических элементов Д.И.Менделеева 1200х1700 винил
Стенды для школьных кабинетов
Цифровые лаборатории и датчики для учебных кабинетов
Робототехника
Общее и вспомогательное оборудование для учебных кабинетов
Кабинет начальной школы
Кабинет физики
Кабинет химии
Кабинет биологии
Кабинет русского языка и литературы
Кабинет математики
Кабинет истории
Кабинет географии
Кабинет английского языка
Кабинет немецкого языка
Кабинет французского языка
Кабинет черчения и ИЗО
Кабинет музыки
Кабинет астрономии
Кабинет технологии для девочек
Кабинет технологии для мальчиков
Кабинет ОБЖ
Кабинет НВП
Кабинет ПДД
Кабинет психолога
Кабинет логопеда
Медицинский кабинет
Школьная мебель эконом класса
Школьная мебель класса стандарт
Бытовая техника
Актовый зал для школы
Шторы и жалюзи для школы
Посуда
Хозяйственный инвентарь
Металлические стеллажи, шкафы, сейфы
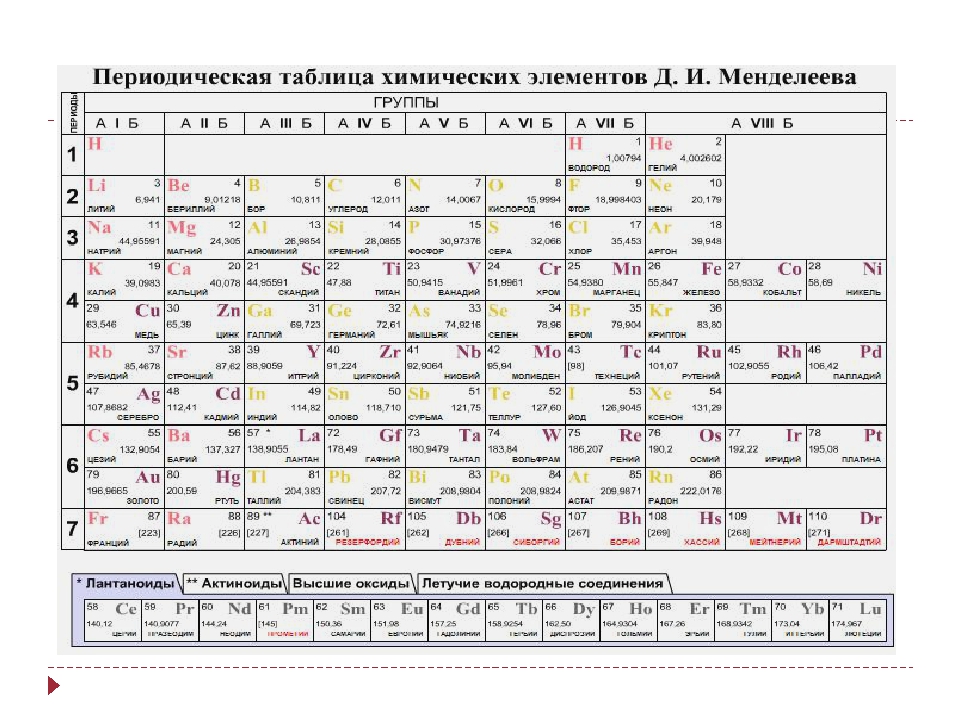
Таблица Менделеева – периодическая система элементов + мобильная версия
|
ПЕРЕЙТИ В РАЗДЕЛ:Таблица МенделееваТаблица РастворимостиИграНовостиО Проектеin English |
|
элемент по номеру01 – H [Водород]2 – He [Гелий]3 – Li [Литий]4 – Be [Бериллий]5 – B [Бор]6 – C [Углерод]7 – N [Азот]8 – O [Кислород]9 – F [Фтор]10 – Ne [Неон]11 – Na [Натрий]12 – Mg [Магний]13 – Al [Алюминий]14 – Si [Кремний]15 – P [Фосфор]16 – S [Сера]17 – Cl [Хлор]18 – Ar [Аргон]19 – K [Калий]20 – Ca [Кальций]21 – Sc [Скандий]22 – Ti [Титан]23 – V [Ванадий]24 – Cr [Хром]25 – Mn [Марганец]26 – Fe [Железо]27 – Co [Кобальт]28 – Ni [Никель]29 – Cu [Медь]30 – Zn [Цинк]31 – Ga [Галлий]32 – Ge [Германий]33 – As [Мышьяк]34 – Se [Селен]35 – Br [Бром]36 – Kr [Криптон]37 – Rb [Рубидий]38 – Sr [Стронций]39 – Y [Иттрий]40 – Zr [Цирконий]41 – Nb [Ниобий]42 – Mo [Молибден]43 – Tc [Технеций]44 – Ru [Рутений]45 – Rh [Родий]46 – Pd [Палладий]47 – Ag [Серебро]48 – Cd [Кадмий]49 – In [Индий]50 – Sn [Олово]51 – Sb [Сурьма]52 – Te [Теллур]53 – I [Иод]54 – Xe [Ксенон]55 – Cs [Цезий]56 – Ba [Барий]57 – La [Лантан]58 – Ce [Церий]59 – Pr [Празеодим]60 – Nd [Неодим]61 – Pm [Прометий]62 – Sm [Самарий]63 – Eu [Европий]64 – Gd [Гадолиний]65 – Tb [Тербий]66 – Dy [Диспрозий]67 – Ho [Гольмий]68 – Er [Эрбий]69 – Tm [Тулий]70 – Yb [Иттербий]71 – Lu [Лютеций]72 – Hf [Гафний]73 – Ta [Тантал]74 – W [Вольфрам]75 – Re [Рений]76 – Os [Осмий]77 – Ir [Иридий]78 – Pt [Платина]79 – Au [Золото]80 – Hg [Ртуть]81 – Tl [Таллий]82 – Pb [Свинец]83 – Bi [Висмут]84 – Po [Полоний]85 – At [Астат]86 – Rn [Радон]87 – Fr [Франций]88 – Ra [Радий]89 – Ac [Актиний]90 – Th [Торий]91 – Pa [Протактиний]92 – U [Уран]93 – Np [Нептуний]94 – Pu [Плутоний]95 – Am [Америций]96 – Cm [Кюрий]97 – Bk [Берклий]98 – Cf [Калифорний]99 – Es [Эйнштейний]100 – Fm [Фермий]101 – Md [Менделевий]102 – No [Нобелий]103 – Lr [Лоуренсий]104 – Rf [Резерфордий]105 – Db [Дубний]106 – Sg [Сиборгий]107 – Bh [Борий]108 – Hs [Хассий]109 – Mt [Мейтнерий]110 – Ds [Дармштадтий]111 – Rg [Рентгений]112 – Cn [Коперниций]113 – Uut [Унунтрий]114 – Fl [Флёровий]115 – Uup [Унунпентий]116 – Lv [Ливерморий]117 – Uus [Унунсептий]118 – Uuo [Унуноктий] |
|
элемент по названию0Азот [7 – N ]Актиний [89 – Ac ]Алюминий [13 – Al ]Америций [95 – Am ]Аргон [18 – Ar ]Астат [85 – At ]Барий [56 – Ba ]Бериллий [4 – Be ]Берклий [97 – Bk ]Бор [5 – B ]Борий [107 – Bh ]Бром [35 – Br ]Ванадий [23 – V ]Висмут [83 – Bi ]Водород [1 – H ]Вольфрам [74 – W ]Гадолиний [64 – Gd ]Галлий [31 – Ga ]Гафний [72 – Hf ]Гелий [2 – He ]Германий [32 – Ge ]Гольмий [67 – Ho ]Дармштадтий [110 – Ds ]Диспрозий [66 – Dy ]Дубний [105 – Db ]Европий [63 – Eu ]Железо [26 – Fe ]Золото [79 – Au ]Индий [49 – In ]Иод [53 – I ]Иридий [77 – Ir ]Иттербий [70 – Yb ]Иттрий [39 – Y ]Кадмий [48 – Cd ]Калий [19 – K ]Калифорний [98 – Cf ]Кальций [20 – Ca ]Кислород [8 – O ]Кобальт [27 – Co ]Коперниций [112 – Cn ]Кремний [14 – Si ]Криптон [36 – Kr ]Ксенон [54 – Xe ]Кюрий [96 – Cm ]Лантан [57 – La ]Ливерморий [116 – Lv ]Литий [3 – Li ]Лоуренсий [103 – Lr ]Лютеций [71 – Lu ]Магний [12 – Mg ]Марганец [25 – Mn ]Медь [29 – Cu ]Мейтнерий [109 – Mt ]Менделевий [101 – Md ]Молибден [42 – Mo ]Мышьяк [33 – As ]Натрий [11 – Na ]Неодим [60 – Nd ]Неон [10 – Ne ]Нептуний [93 – Np ]Никель [28 – Ni ]Ниобий [41 – Nb ]Нобелий [102 – No ]Олово [50 – Sn ]Осмий [76 – Os ]Палладий [46 – Pd ]Платина [78 – Pt ]Плутоний [94 – Pu ]Полоний [84 – Po ]Празеодим [59 – Pr ]Прометий [61 – Pm ]Протактиний [91 – Pa ]Радий [88 – Ra ]Радон [86 – Rn ]Резерфордий [104 – Rf ]Рений [75 – Re ]Рентгений [111 – Rg ]Родий [45 – Rh ]Ртуть [80 – Hg ]Рубидий [37 – Rb ]Рутений [44 – Ru ]Самарий [62 – Sm ]Свинец [82 – Pb ]Селен [34 – Se ]Сера [16 – S ]Серебро [47 – Ag ]Сиборгий [106 – Sg ]Скандий [21 – Sc ]Стронций [38 – Sr ]Сурьма [51 – Sb ]Таллий [81 – Tl ]Тантал [73 – Ta ]Теллур [52 – Te ]Тербий [65 – Tb ]Технеций [43 – Tc ]Титан [22 – Ti ]Торий [90 – Th ]Тулий [69 – Tm ]Углерод [6 – C ]Унуноктий [118 – Uuo ]Унунпентий [115 – Uup ]Унунсептий [117 – Uus ]Унунтрий [113 – Uut ]Уран [92 – U ]Фермий [100 – Fm ]Флёровий [114 – Fl ]Фосфор [15 – P ]Франций [87 – Fr ]Фтор [9 – F ]Хассий [108 – Hs ]Хлор [17 – Cl ]Хром [24 – Cr ]Цезий [55 – Cs ]Церий [58 – Ce ]Цинк [30 – Zn ]Цирконий [40 – Zr ]Эйнштейний [99 – Es ]Эрбий [68 – Er ] |
Продвинутое приложение Таблица Менделеева. Новейшая и самая проверенная информация по элементам. Интерактивный и удобный интерфейс. Возможность игрового изучения таблицы. Используются Flash технологии. Мобильная версия Таблицы Менделеева прямо на сайте!!!
Новейшая и самая проверенная информация по элементам. Интерактивный и удобный интерфейс. Возможность игрового изучения таблицы. Используются Flash технологии. Мобильная версия Таблицы Менделеева прямо на сайте!!!
Меню:
Периодическая система элементов
Периодическая система элементовПЕРИОДИЧЕСКАЯ ТАБЛИЦА
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
Be
4
9. 0122
0122
Бериллий
Можно найти в изумрудах и орбитальных телескопах, но не стоит трогать руками.B 5 10.811
Бор
Возможно, помог зародиться жизни, причём не на Земле.F 9 18.9984
Фтор
Спасёт жизнь и разрушит всё на своём пути.Na 11 22.9898
Натрий
Помогает клеткам жить и охлаждает атомные реакторы.Si 14 28.0855
Кремний
Сопровождает нас от каменного века до века информационного.Co 27 58.9332
Кобальт
Сверлит чугун, красит стекло и вызывает прыщи.As 33 74.9216
Мышьяк
В прошлом нёс мучительную смерть, а теперь помогает искать жизнь за пределами Земли.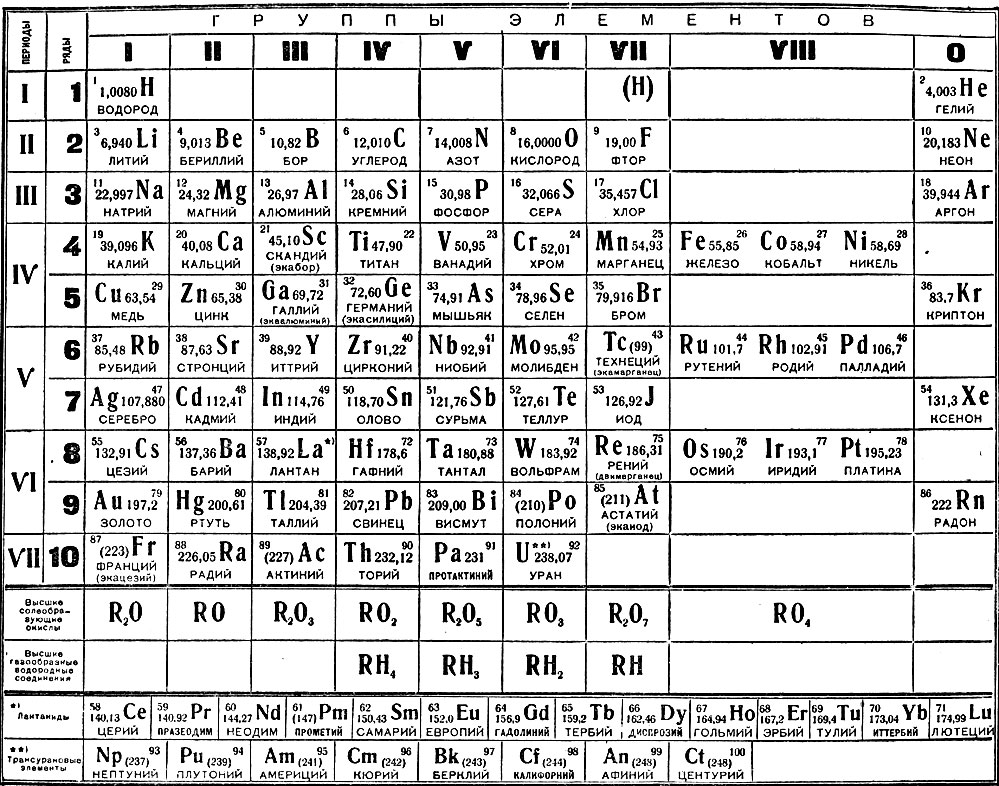
Br 35 79.904
Бром
Успокаивает и спасает от пожара.Nb 41 92.9064
Ниобий
Летал на Луну, ускорял частицы на коллайдере и пробрался в самое сердце термоядерного реактора.Cd 48 112.411
Кадмий
Добавляет ярких красок картинам, защищает от коррозии технику и помогает увидеть невидимый свет далёких галактик.I 53 126.9045
Йод
Жжёт, разгоняет облака и выявляет некачественный мёд.Yb 70 173.04
Иттербий
Скрывался на острове в Балтийском море, а потом проник в твердотельные лазеры.Lu 71 174.967
Лютеций
Последний из лантаноидов. Os
76
190. 23
23
Осмий
Тяжёлый, дорогой и совсем не пчела.Pb 82 207.2
Свинец
Крайне токсичен и защищает от радиации.Th 90 232.0381
Торий
Освещал путь морякам, а в будущем поможет сделать самые точные часы во Вселенной.«В периодической системе постоянно что-то обсуждается и дорабатывается»
— Во-первых, мы регулярно синтезируем новые сверхтяжелые элементы — по одному примерно каждые 2,5 года. Это нелегко, но ученые продолжают это делать. Кроме того, стоит помнить о возможности существования новых физических механизмов. В своей модели я постарался учесть релятивистские эффекты и эффекты квантовой электродинамики. Периодическая таблица — это очень сложная структура, и пускай ее фундаментальная значимость неоспорима, в ней постоянно что-то обсуждается и дорабатывается. Я однажды пошутил во время лекции, что каждый человек в мире имеет право на создание собственной версии периодической таблицы.
Я однажды пошутил во время лекции, что каждый человек в мире имеет право на создание собственной версии периодической таблицы.
— Ваша система заканчивается на элементе № 172. А что дальше? Это принципиальный барьер или только временный?
— На самом деле, никто этого не знает. Ответ находится где-то в нижних электронных состояниях, но каким он будет, сложно предугадать. Над этой темой еще предстоит поработать. Возможно, моя модель закончится 172-м элементом, а возможно, и нет. Профессор (Университета Сорбонны Поль — Indicator.Ru) Инделикато из Парижа полагает, что 173-й элемент существует. Если вы хотите получить более точный комментарий, я бы посоветовал обратиться к профессору Владимиру Шабаеву из СПбГУ. Он точно будет знать.
— Почему?
— Потому что он блестящий физик, а я больше сфокусирован на химии.
— Чтобы опровергнуть существование границ Периодической таблицы, человечеству, вероятно, нужно будет синтезировать все более и более тяжелые элементы. Есть вероятность, что по крайней мере в этом веке таких возможностей у ученых просто не будет. Как тогда доказать, что предложенная вами модель — это не просто теория?
Есть вероятность, что по крайней мере в этом веке таких возможностей у ученых просто не будет. Как тогда доказать, что предложенная вами модель — это не просто теория?
— Это станет понятно со временем. Чтобы получить экспериментальные доказательства, для начала нужно синтезировать изотопы. Если добавить в ядро дополнительные нейтроны, можно получить более стабильные изотопы. Правда, мы пока не знаем, в каких условиях или с использованием каких мишеней это можно сделать. Тем не менее у нас есть лучик надежды, пускай и очень слабый.
— Ваше предложение расширить список лантаноидов и актиноидов до 15 было «узаконено» решением IUPAC, но у него и сейчас есть противники среди ученых. Приходится ли вам до сих пор вести споры с коллегами по этому вопросу?
Периодическая систем таблица – Справочник химика 21
При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам.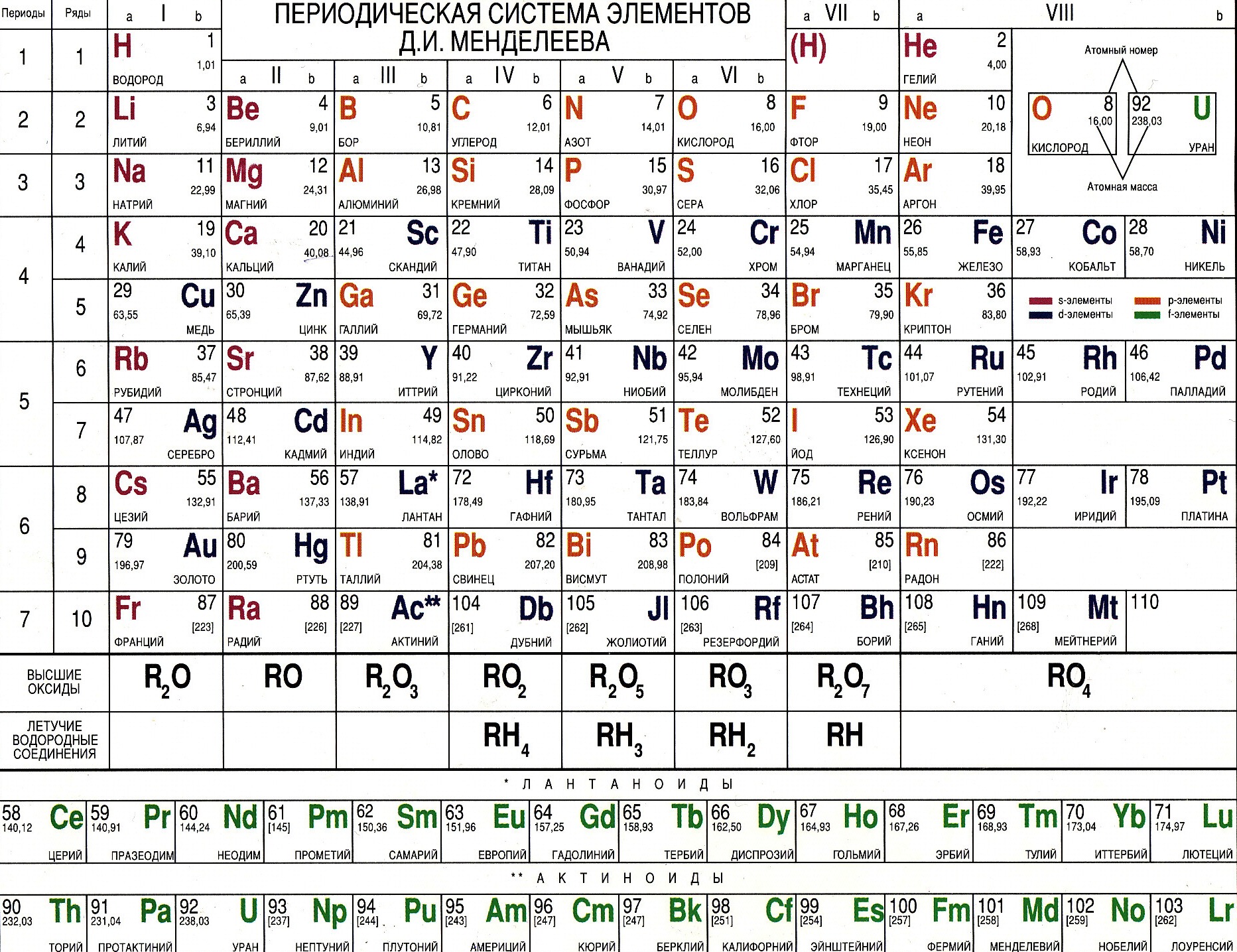 Однако, как видно нз таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52]
Однако, как видно нз таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52]
Как известно, открытие периодической системы элементов является главным образом заслугой русского химика Дмитрия Ивановича Менделеева (1834-1907), хотя немецкий химик Лотар Мейер независимо и почти одновременно с ним предложил во многом сходную систему.
 Насколько известно, никто из них не знал о работе Ньюлендса. Опубликованная Менделеевым в 1869 г. таблица периодической системы (рис. 7-1) соответствовала плану Ньюлендса расположить элементы в порядке возрастания атомных масс, но обладала существенными преимуществами. [c.307]
Насколько известно, никто из них не знал о работе Ньюлендса. Опубликованная Менделеевым в 1869 г. таблица периодической системы (рис. 7-1) соответствовала плану Ньюлендса расположить элементы в порядке возрастания атомных масс, но обладала существенными преимуществами. [c.307] Вот как выглядела эта история. Иногда говорят, что Ньюлендсу задавали вопросы об аккордах и арпеджио , но на самом деле его спрашивали только об алфавитном порядке. Однако недоверие было совершенно очевидным, а незадачливая музыкальная аналогия сделала идеи Ньюлендса больше похожими на магию, чем на науку. Отсутствие места для новых элементов и помещение по два элемента в некоторые места таблицы были серьезными недостатками. По-видимому, главным достоинством схемы, предложенной Менделеевым, было введение больших периодов после двух первых, содержащих по восемь элементов. Менделеев подкреплял свою таблицу очень большим числом химических доказательств, а также прославившими его предсказаниями новых элементов и их химических свойств. Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]
Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]
Разделив все элементы иа периоды и располагая одн,н период под другим так, чтобы сходные ио свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Эта таблица в современном виде, дополненная открытыми уже после Менделеева элементами, приведена в начале книги. Она состоит из десяти горизонтальных рядов и восьми вертикальных столбцов, или групп, [c.49]
Однако ее прогнозы со временем были реализованы, а прогностические возможности исчерпались. Более того, новые открытия, сделанные уже без предсказания Периодической системы, таблица не могла вмещать в себя. Наступила длительная полоса усовершенствований Периодической системы, в результате которых таблица изменилась до неузнаваемости, но все спорные вопросы так и не были решены.
 Начались попытки изобразить Систему какими-то другими, не табличными способами. [c.165]
Начались попытки изобразить Систему какими-то другими, не табличными способами. [c.165]Группа (в периодической системе) Вертикальный столбец элементов в периодической таблице, обладающих общими свойствами [c.544]
Свою таблицу Менделеев опубликовал в 1869 г., т. е. раньше, чем была издана основная работа Мейера (рис. 16). Однако честь открытия Периодической системы элементов принадлежит Менделееву не из-за приоритета публикации, действительная причина состоит в том, как Менделеев построил свою таблицу. [c.99]
В предыдущей главе мы познакомились с волновыми функциями и энергетическими уровнями атома водорода. При помощи этих сведений и так называемого принципа заполнения мы сможем перейти к выяснению электронного строения атомов всех элементов. Это позволит нам понять структуру периодической системы, таблица которой изображена на рис. 7-3 [c.385]
При изучении неметаллов мы уделяли особое внимание.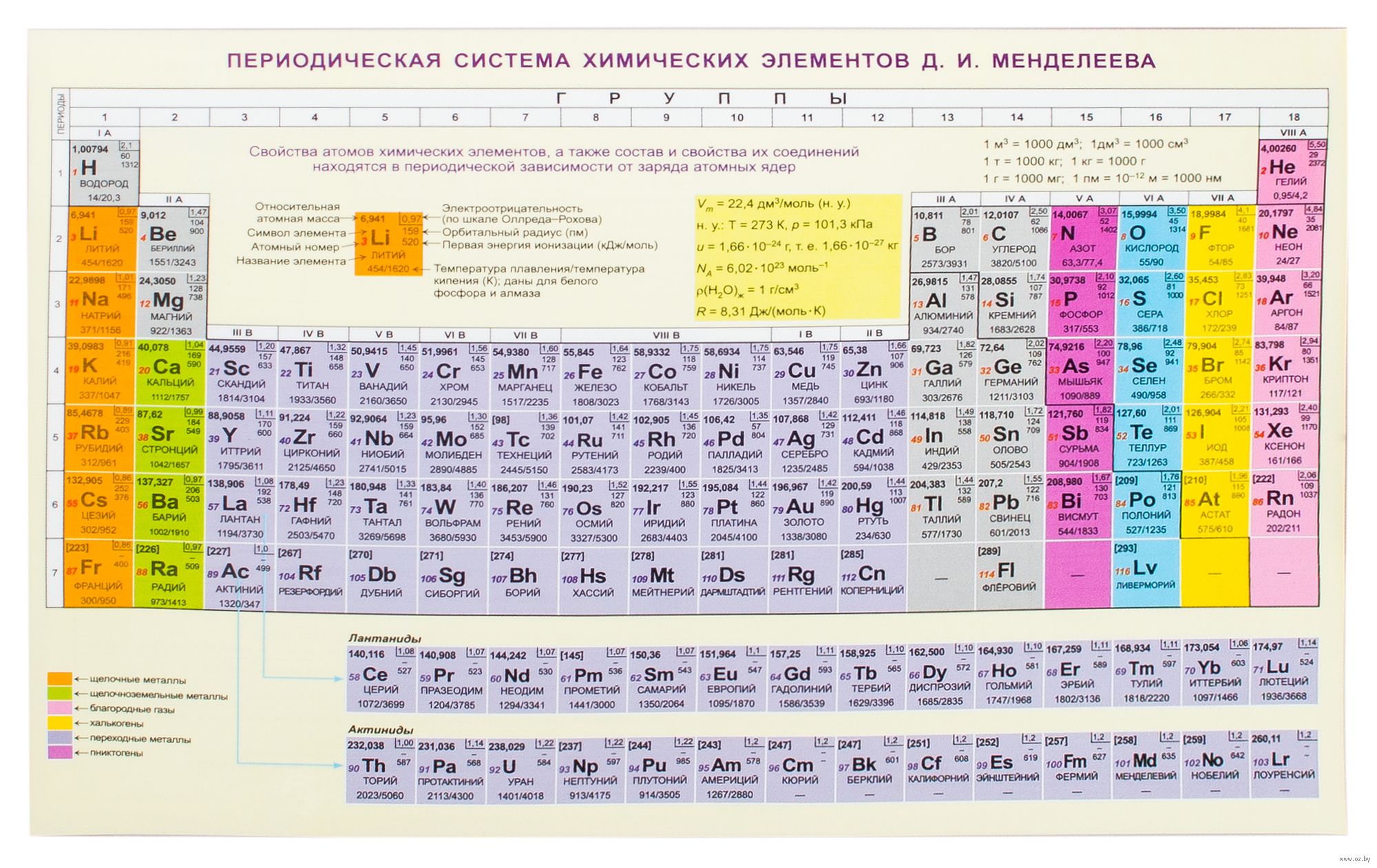 их водородным соединениям, особенно для них характерным. Теперь рассмотрим зависимость свойств этих соединений от положения элемента в периодической системе (таблица 11). Атом водорода может н принимать (Н-1-е = Н ) и отдавать электрон (Н—е=Н+). [c.117]
их водородным соединениям, особенно для них характерным. Теперь рассмотрим зависимость свойств этих соединений от положения элемента в периодической системе (таблица 11). Атом водорода может н принимать (Н-1-е = Н ) и отдавать электрон (Н—е=Н+). [c.117]
Две таблицы — две формы изображения Периодической системы. Таблица с восемью группами — короткопериодная форма, таблица прошлого века, времен Менделеева. Число восемь означает полное заселение 8- И р-орбиталей. Длиннопериодная форма Периодической системы — современное табличное изображение Периодического закона. В ней каждая группа содержит элементы с однотипным строением электронной оболочки атомов. Число 32 отвечает полному заселению электронами 8-, р-, 4- и / орбиталей (2 + 6 + 10 + 14 = 32). [c.202]
У47. — Периодическая система (таблица, составитель Н. С. Ахметов). Изд. КХТИ, Казань, 1965. [c.190]
Если же исходить из того, что для завершения внешнего электронного слоя атому водорода не хватает одного электрона, то водород следует поместить в VII группе. Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в VII группу периодической системы. Вместе с тем водород—элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно. [c.272]
Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в VII группу периодической системы. Вместе с тем водород—элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно. [c.272]
Расположение элементов в периодической таблице кратко выражает ключевые характеристики элементов. Если мы знаем основные свойства некоторой группы периодической системы, то можем предсказать и химическое поведение отдельных элементов этой группы. Постарайтесь потренироваться в таких предсказаниях. [c.127]
Элементы, находящиеся в первом основном ряду таблицы периодической системы элементов, как бор, углерод и азот, имеют по четыре электронных орбиты, которые могут быть использованы для образования связей. Они известны как 2s, 2рх, 2ру, 2pz — электронные орбиты. Каждая из орбит способна удерживать два электрона с противоположными спинами. Химическая связь (образуется путем частичного перекрывания двух таких орбит, по одной от каждого атома, содержащих пару электронов противоположного спина. Так, нанример, атомы таких элементов, как бор, углерод и азот, имеющих суммарно по четыре орбиты, способны к образованию максимум четырех простых связей. [c.393]
Так, нанример, атомы таких элементов, как бор, углерод и азот, имеющих суммарно по четыре орбиты, способны к образованию максимум четырех простых связей. [c.393]
В то время целый ряд ученых, работая независимо, пытались создать классификацию элементов, в которой бы рядом располагались элементы с близкими свойствами. Такой тип расположения называется периодической системой. В 1869 году русский химик Дмитрий Иванович Менделеев опубликовал периодическую систему, очень похожую на ту, что используется в настоящее время. Это таблица, напоминающая табличный календарь, в котором все воскресения расположены в одной колонке, нее понедельники — в другой и т.д., а все дни одной недели располагаются в одном горизонтальном ряду. [c.124]
Выражением периодического закона является периодическая система элементов. Были предлолвариантов периодической системы элементов, однако широкое применение получили только те из них, которые весьма близки к таблице, составленной Д. И. Менделеевым. [c.33]
И. Менделеевым. [c.33]
В этой главе мы исследуем закономерности, обнаруживаемые во взаимосвязи между физическими и химическими свойствами элементов и их соединений. Эти закономерности приводят непосредственно к важнейшей схеме классификации материи-периодической системе элементов. Эрнсту Резерфорду, который однажды сказал, что существуют два типа науки — физика и коллекционирование марок,-периодическая система элементов могла казаться доведенным до совершенства альбомом марок. Если бы данная глава была последней в нашей книге, его точка зрения представлялась бы оправданной. Однако сведение всех элементов природы в таблицу периодической системы является лишь началом развития химии, а отнюдь не его концом. Установив схему классификации элементов, мы должны найти способ ее объяснения на основе рассмотрения свойств электронов и других субатомных частиц, из которых построены атомы. Такое объяснение-задача следующих глав. Но прежде чем обратиться к теоретическому описанию природы, надо сначала узнать, что она представляет собой в действительности. [c.303]
[c.303]
На примере гидридов и оксидов типических элементов хорошо иллюстрируется корреляция между валентностью и номером группы элемента. Элементы, расположенные в левом нижнем углу периодической системы, представляют собой металлы. Они образуют ионные гидриды и оксиды, водные растворы которых обладают основными свойствами. Элементы, расположенные в верхнем правом углу периодической системы, являются неметаллами. Их соединения с водородом и оксиды представляют собой небольщие молекулы с ковалентными связями при нормальных условиях они существуют в форме жидкостей или газов и проявляют кйслотные свойства. В промежуточной части периодической таблицы между ее верхним правым и нижним левым углами находятся элементы, которые обнаруживают постепенно изменяющиеся свойства. По мере перехода от неметаллических элементов к семиметаллическим и далее к металлам их соединения с водородом становятся вместо кислотных инертными или нейтральными и далее основными (хотя эта общая закономерность осложняется многими отклонениями), а оксиды переходят более закономерным образом от кислотных к амфотерным и далее к основным.
 [c.323]
[c.323] Например, в настоящее время установлено, что атомные массы возрастают в такой последовательности Ре, N1, Со, Си в четвертом периоде (ср. с 4-й строкой рис. 7-1), Яи, КЬ, Рс1, Ag в пятом периоде (ср. с 6-й строкой рис. 7-1) и 08, 1г, Р1, Аи в шестом периоде (ср. с 10-й строкой рис. 7-1). Однако N1 по своим свойствам больше напоминает Рё и Р1, чем Со. Кроме того, оказалось, что Те имеет большую атомную массу, чем I, но I несомненно сходен по химическим свойствам с С1 и Вг, а Те сходен с 8 и 8е. Наконец, после открытия благородных газов обнаружилось, что Аг имеет большую атомную массу, чем К, тогда как все остальные благородные газы имеют меньшие атомные массы, чем ближайшие к ним щелочные металлы. Совершенно очевидно, что во всех трех отмеченных случаях нельзя руководствоваться атомными массами при размещении элементов в периодической системе. Поэтому всем элементам периодической системы были приписаны порядковые номера от 1 до 92 (в наше время до 105). (Порядковые номера элементов приблизительно соответствуют возрастанию их атомных масс. ) Если расположить элементы в периодической таблице в последовательности возрастания их порядковых номеров, химически сходные элементы образуют в ней вертикальные колонки (семейства или группы). [c.311]
) Если расположить элементы в периодической таблице в последовательности возрастания их порядковых номеров, химически сходные элементы образуют в ней вертикальные колонки (семейства или группы). [c.311]
В связи с возможностью достижения новой области устойчивости представляет интерес дальнейшее расширение таблицы периодической системы элементов. На рис. 23-7 показан расширенный вариант периодической таблицы, включающий весь частично заполненный в настоящее время седьмой период и новый восьмой период. В последнем впервые встречаются д-орбитали, 5д. Последовательность заполнения орбиталей 5д, б/ и Id точно предсказать заранее невозможно. Однако проведенные в исследовательском центре Лос-Аламоса расчеты указывают, что после первых одного-двух новых электронов следующие электроны должны последовательно заполнять 5д-орбитали. Соответствующие элементы могут быть названы сверхпереходными металлами. [c.423]
В качестве приложения в конце книги приведена периодическая система элементов Д. И.Менделеева в виде таблиц двух форм – с короткими периодами и с длинными периодами. [c.10]
И.Менделеева в виде таблиц двух форм – с короткими периодами и с длинными периодами. [c.10]
Сведения, которые можно получить о каждом элементе из таблицы периодической системы элементов, приведенной в настоящей книге. [c.41]
Мак-Брайд и др. выпустили таблицы термодинамических свойств 210 веществ, образуемых первыми 18 элементами периодической системы. Данные относятся к газообразному состоянию веществ при температурах от О да бООО К. Кроме обычных величин Ср, Н°г — Н1, S°r, (Gr — Яо), АН1 т и g Kf.r — приводятся значения функции /г при базисной температуре 298,15 К (в справочнике эта функция обозначена через Яг) и ДЯ/, г реакций образования вещества из свободных атомов элементов. Слабым местом расчета многих значений параметров реакции образования (из простых веществ или из свободных атомов) является щирокое использование величин средней энергии связи. [c.77] Ионы в таблице расположены в порядке групп элементов периодической системы. [c.36]
[c.36]
Во второй таблице реактивы расположены в алфавитном порядке. Ионы размещены так же как и в первой таблице, в порядке групп периодической системы. [c.36]
Распростракенность всех элементов сравнивается в таблице с распространенностью кислорода дается логарифм количества атомов соответствующего элемента, которое приходится на каждые 10 атомов кислорода. Сведения о содержании кислорода в хондритах и железных метеоритах отсутствуют, и данные о распространенности элементов в этих объектах градуированы по железу (логарифм относительной распространенности Ре принят равным 8,0, как н в солнечной атмосфере), —порядковый номер соответствующего элемента в Периодической системе Д. И. Менделеева. [c.28]
Таблица построена в порядке, отвечающем положению элементов в периодической системе. [c.279]
У44. — Периодическая система (таблица, составитель П. С. Афанасьев под ред. А. Ф. Богоявленского). Татгос издат, Казань, 1957. [c.190]
Татгос издат, Казань, 1957. [c.190]
Существует много вариантов изображения периодической системы элементов Д. И. Менделеева (более 400). Наиболее распространены клеточные варианты, а из них — восьми-, восемнадцати-и тридцатидвухклеточные, соответствующие емкости квантовых слоев из 8, 18 и 32 электронов. Один из вариантов восьмиклеточной таблицы, так называемый короткий вариант, помещен на первом форзаце книги, а тридцатидвухклеточная таблица (длинный вариант) — на втором форзаце книги. Восемнадцатиклеточный вариант приведен в табл. 4. [c.28]
В восьмиклеточных и восемнадцатиклеточных вариантах периодической системы семейства лантаноидов и актиноидов часто выносят за пределы таблицы. Подобный вариант приведен, в частности, в табл. 4. [c.30]
Итак, в периодической системе свойства элементов, их атом-пая масса, валентность, химический характер изменяются в известной последовательности как в горизонтальном, так и в вертикальном иаиравлениях. Место элемента в таблице определяется, следовательно, его свойствами, и, наоборот, каждому месту соответствует элемент, обладающий определенной совокупиостью свойств. Поэтому, зная положение элемента в таблице, можно довольно точно указать его свойства. [c.53]
Место элемента в таблице определяется, следовательно, его свойствами, и, наоборот, каждому месту соответствует элемент, обладающий определенной совокупиостью свойств. Поэтому, зная положение элемента в таблице, можно довольно точно указать его свойства. [c.53]
Большое значение имела периодическая система также при устаповлении валентности и атомных масс некоторых элементов. Так, элемент бериллий долгое время считался аналогом алюминия и его оксиду приписывали формулу ВегОз. Исходя из процентного состава и предполагаемой формулы оксида бериллия, его атомную массу считали равной 13,5. Периодическая система показала, что для бериллия в таблице есть только одно место, а именно — над магнием, так что его оксид должен иметь формулу ВеО, откуда атомная масса бериллия получается равной девяти. Этот вывод вскоре был подтвержден определениями атомной массы бериллия по плотности пара его хлорида. [c.55]
Определение порядковых номеров элементов по зарядам ядер их атом ш позволило установигь общее число мест в периодической системе между водородом, имеющим порядковый номер 1, и ураном (порядковый номер 92), считавшимся в то время последним членом периодической системы элементов. Когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что указывало па возможность сун1ествования еще неоткрытых элементов. И действительно, в 1922 г. был открыт элемент гафний, который занял место 72 затем в 1925 г. — рений, занявший место 75. Элементы, которые должны занять остальные четыре свободных места таблицы, оказались радиоактивными и в природе [c.61]
Когда создавалась теория строения атома, оставались незанятыми места 43, 61, 72, 75, 85 и 87, что указывало па возможность сун1ествования еще неоткрытых элементов. И действительно, в 1922 г. был открыт элемент гафний, который занял место 72 затем в 1925 г. — рений, занявший место 75. Элементы, которые должны занять остальные четыре свободных места таблицы, оказались радиоактивными и в природе [c.61]
Первые периодические таблицы были очень полезны с практической точки зрения, но они мало помогали в понимании того, что определяет сходство или различия элементов между собой. Это понимание пришло примерно на 50 лет позже, и именно оно находится в основе современной периодической системы. Вспомним, что атомы состоят из микроскопических частиц из равного количества положительно заряженных протонов и отрицательно заряженных элеь тронов (гл. I, разд. Б.6). Одной из главных характеристик, по которой различаются атомы элементов, является число протонов — атомный номер. Каждый атом натрия содержит 11 протонов, а каждый атом углерода содержит 6 протонов. Если число протонов в атоме равно 9, то это атом фтора, если 12 – это атом магния. Атом водорода содержит один протон, в результате атомный номер водорода — единица. Атом гелия содержит два протона, и, следовательно, его атомный номер — 2. [c.125]
Каждый атом натрия содержит 11 протонов, а каждый атом углерода содержит 6 протонов. Если число протонов в атоме равно 9, то это атом фтора, если 12 – это атом магния. Атом водорода содержит один протон, в результате атомный номер водорода — единица. Атом гелия содержит два протона, и, следовательно, его атомный номер — 2. [c.125]
После того как порядковый номер элементов достигает 57, энергия 4/-орбиталей становится достаточно низкой, чтобы они могли использоваться для заселения электронами в атомах. Таким образом, после бария в шестом периоде начинается последовательное заселение электронами 4/-орбиталей, которое происходит у атомов 14 лантаноидных металлов. Подобно этому, в седьмом периоде после 2 = 89, когда 5/- и 6 -орбитали приобретают практически одинаковую энергию, возникает 14 актиноидных металлов, в атомах которых происходит последовательное заселение электронами 5/-орбиталей. Электронные конфигурации атомов, принадлежащих этим двум рядам внутренних переходных металлов, показаны на рис. 9-3. Как и при заселении -орбиталей у переходных металлов, заселение /-орбиталей также сопровождается отклонениями от строгой закономерности, причем такие отклонения чаще встречаются у актиноидов, чем у лантаноидов. Но и в этом случае достаточно запомнить лищь общую закономерность, отложив обсуждение отклонений от нее на более позднее время. (Укажем только, что поскольку первый элемент в каждом из рядов /-элементов- Ьа и Ас-имеет валентную конфигурацию вместо /, то иногда считается, что эти ряды начинаются с Се и ТЬ, как это указано, например, в таблице периодической системы, помещенной на внутренней стороне обложки этой книги.) [c.451]
9-3. Как и при заселении -орбиталей у переходных металлов, заселение /-орбиталей также сопровождается отклонениями от строгой закономерности, причем такие отклонения чаще встречаются у актиноидов, чем у лантаноидов. Но и в этом случае достаточно запомнить лищь общую закономерность, отложив обсуждение отклонений от нее на более позднее время. (Укажем только, что поскольку первый элемент в каждом из рядов /-элементов- Ьа и Ас-имеет валентную конфигурацию вместо /, то иногда считается, что эти ряды начинаются с Се и ТЬ, как это указано, например, в таблице периодической системы, помещенной на внутренней стороне обложки этой книги.) [c.451]
Учашиеся должны получить ясное представление о том, что форма современной периодической таблицы не зависит ни от какого произвола, а определяется экспериментально наблюдаемыми химическими свойствами элементов ее структура не предопределяется какой-либо теорией (объяснение периодической системы на основе представлений о строении атома излагается в двух следующих главах). Учащиеся должны усвоить названия различных частей периодической таблицы и понять, что, запомнив свойства нескольких химических веществ, они смогут делать довольно точные предсказания свойств многих других веществ. [c.573]
Учащиеся должны усвоить названия различных частей периодической таблицы и понять, что, запомнив свойства нескольких химических веществ, они смогут делать довольно точные предсказания свойств многих других веществ. [c.573]
Первая оболочка (Ь-электроны) последовательно заполняется в атомах водорода и гелия, причем фатомах всех остальных элемент в ней сохраняется по два электруна (см. таблицу периодической системы элементов в конце кнИ1Ч ). [c.40]
За небольшим исключением здесь представлены только вещества, для которых имеются данные для высоких температур, причем преимущественно те, которые более интересны в практическом или теоретическом отношении. Так, из неорганических галогенидов представлены почти исключительно фториды и хлориды, из халь-когенидов — окислы и сульфиды и т. д. Не были включены группы веществ, представляющих более узкий интерес, например соединения индивидуальных изотопов водорода (кроме воды), моногидриды и моногалогениды элементов 2, 4 и последующих групп периодической системы, некоторые сложные соединения, (смешанные галогениды и оксигалогениды металлов, алюмосиликаты, кристаллогидраты солен, комплексные соединения). Однако в таблицах приведены данные для некоторых молекулярных ионов, радикалов и частиц, неустойчивых в рассматриваемых условиях. Из органических веществ здесь представлены только углеводороды, спирты, тиолы, тиоэфиры и отдельные представители других классов. При этом из всех классов органических веществ исключены высшие нормальные гомологи, для которых данные получены на основе допу- [c.312]
Однако в таблицах приведены данные для некоторых молекулярных ионов, радикалов и частиц, неустойчивых в рассматриваемых условиях. Из органических веществ здесь представлены только углеводороды, спирты, тиолы, тиоэфиры и отдельные представители других классов. При этом из всех классов органических веществ исключены высшие нормальные гомологи, для которых данные получены на основе допу- [c.312]
Таблицы периодической системы. На основании открытого им периодического закона Менделеев составил периодическую систему элементов. Он разбил весь ряд элементов на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств, и расположил эти отрезки один под другим. Как известно, таблица Менделеева в ее так называемой коротко-пернодной форме (табл. 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групи. [c.36]
Выделяемые ионы расположены в первой графе таблицы в соответствии с периодической системой sjjeMeHTOB. [c.59]
[c.59]
Истории, скрытые в периодической таблице
Конечно, не нужно быть ученым, чтобы верить в мир, состоящий из более чем четырех элементов. Горняки семнадцатого века, пишет Уотерс, различали разные виды воздуха: они называли более легкий воздух, кружащийся наверху пещер, «огненно-влажным», потому что он легко загорался, и тяжелые облака, висевшие у земли « душно-сырость », потому что они затрудняли дыхание. В восемнадцатом веке местные жители окрестили пещеру недалеко от Неаполя Grotta del Cane : собаки, которые забрели в пещеру, неспособные поднять голову над газом, просачивающимся из Земли, вскоре начали задыхаться; после возвращения на открытый воздух животные оживают.
По мере роста количества этих наблюдений росло и убеждение в том, что должно быть много разных элементов. К концу восемнадцатого века ученые, комбинируя вещества, начали понимать, что определенные материалы всегда реагируют в одних и тех же пропорциях, что предполагает, что у них разные основные массы. (Для нейтрализации такого же количества серной кислоты всегда требовалось немного больше аммиака, чем магнезии.) В 1803 году английский ученый Джон Дальтон предположил, что в таких реакциях участвуют атомы; он призвал своих коллег помочь ему определить, сколько весят эти невидимые сущности.Началось то, что Скерри называет «увлечением поисками числовых закономерностей». Химики вскоре заметили закономерности, когда они сгруппировали элементы в наборы из трех элементов по атомному весу. (Литий, натрий и калий, например, все шипят или взрываются в воде; оказалось, что атомный вес натрия является средним атомным весом лития и калия.) Такие эксперименты давали представление о порядке в элементарной вселенной. Но работа разочаровывала. В 1836 году химик Жан Батист Андре Дюма, ученик Далтона, в отчаянии вскинул руки.«Что осталось от амбициозной экскурсии, которую мы позволили себе в область атомов?» он написал. «Если бы я был мастером, я бы стер слово« атом »из науки».
(Для нейтрализации такого же количества серной кислоты всегда требовалось немного больше аммиака, чем магнезии.) В 1803 году английский ученый Джон Дальтон предположил, что в таких реакциях участвуют атомы; он призвал своих коллег помочь ему определить, сколько весят эти невидимые сущности.Началось то, что Скерри называет «увлечением поисками числовых закономерностей». Химики вскоре заметили закономерности, когда они сгруппировали элементы в наборы из трех элементов по атомному весу. (Литий, натрий и калий, например, все шипят или взрываются в воде; оказалось, что атомный вес натрия является средним атомным весом лития и калия.) Такие эксперименты давали представление о порядке в элементарной вселенной. Но работа разочаровывала. В 1836 году химик Жан Батист Андре Дюма, ученик Далтона, в отчаянии вскинул руки.«Что осталось от амбициозной экскурсии, которую мы позволили себе в область атомов?» он написал. «Если бы я был мастером, я бы стер слово« атом »из науки».
Другие химики настаивали. По мере того, как атомные веса становились более точными, появлялось больше закономерностей. В 1864 году немецкий химик Юлиус Лотар Мейер опубликовал таблицу из двадцати восьми элементов. Элементы Мейера, расположенные в основном по возрастанию веса, также были выстроены в соответствии с их общими химическими свойствами, которые повторялись через регулярные промежутки времени.Пять лет спустя Менделеев опубликовал свою собственную таблицу Менделеева, которая постепенно превратилась в версию, которую мы используем сегодня. Как и Мейер, Менделеев организовал свои частицы в грубую сетку, ряды которой содержали элементы со схожими свойствами. Но он также украсил свой стол множеством заманчивых вопросительных знаков и пустых мест и сделал явные элементарные пророчества. Менделеев точно предсказал существование еще неоткрытых элементов, таких как галлий и германий, и предсказал их взаимодействие с другими элементами.
Предсказания Менделеева были ошибочными так же часто, как и верными. Но, как объясняет Скерри, русский химик был прекрасным рассказчиком и, по сравнению с Мейером и другими конкурентами, более эффективным проповедником периодической системы. Менделеев использовал любую возможность, чтобы утверждать, иногда небрежно, что характеристики элементов повторяются упорядоченным и предсказуемым образом. Он был одновременно неутомимым и непреклонным, по крайней мере, до тех пор, пока волна научного мнения не обратилась против него. В конце 1950-х годов ученые обнаружили, что элементарный состав данного вещества можно определить по свету, который он испускал при поджоге; В 1868 году французский астроном Жюль Янссен применил этот метод для открытия гелия (элемент No.2) на поверхности Солнца во время полного солнечного затмения. Сначала Менделеев утверждал, что гелий не может существовать; ему не было места в периодической таблице. Но на рубеже двадцатого века, после того, как были обнаружены другие благородные газы, и было показано, что они обладают общими свойствами с гелием, другие ученые построили колонну только для них, и Менделеев попал в их ряды.
Но, как объясняет Скерри, русский химик был прекрасным рассказчиком и, по сравнению с Мейером и другими конкурентами, более эффективным проповедником периодической системы. Менделеев использовал любую возможность, чтобы утверждать, иногда небрежно, что характеристики элементов повторяются упорядоченным и предсказуемым образом. Он был одновременно неутомимым и непреклонным, по крайней мере, до тех пор, пока волна научного мнения не обратилась против него. В конце 1950-х годов ученые обнаружили, что элементарный состав данного вещества можно определить по свету, который он испускал при поджоге; В 1868 году французский астроном Жюль Янссен применил этот метод для открытия гелия (элемент No.2) на поверхности Солнца во время полного солнечного затмения. Сначала Менделеев утверждал, что гелий не может существовать; ему не было места в периодической таблице. Но на рубеже двадцатого века, после того, как были обнаружены другие благородные газы, и было показано, что они обладают общими свойствами с гелием, другие ученые построили колонну только для них, и Менделеев попал в их ряды. (Столбец идет справа, гелий торчит сверху.)
(Столбец идет справа, гелий торчит сверху.)
Способность таблицы к адаптации помогла ей выжить. В двадцатом веке ученые осознали, что периодичность не определяется атомным весом; вместо этого имело значение количество протонов, которые каждый атом содержал в своем ядре.Но и это открытие не сломило таблицу; после нескольких перетасовок стало точнее. За последние полтора века наши представления о Вселенной коренным образом изменились. Но основной формат таблицы Менделеева сохранился.
Это не означает, что никто не пытался его пересмотреть: Скерри отмечает, что с 1860-х годов было предложено более тысячи альтернативных периодических таблиц, часто с целью зафиксировать периодические закономерности, оставшиеся за пределами оригинала.В их числе трехмерная рождественская елка Фернандо Дюфура 1990 года; Спиральный узор Теодора Бенфея, напоминающий голову утки, 1964 г .; и скульптура Уильяма Крукса в форме кренделя девятнадцатого века, которая сейчас находится в Музее науки в Лондоне. В этой последней модели в основу был положен уран, исходя из предположения, что химия никогда не встретит атом большего размера. Но потолок стихий продолжал расти. Истории о тридцати или около того элементах, обнаруженных в прошлом веке – некоторые из которых Менделеев и Мейер не могли себе представить – составляют основную часть книги «Сверхтяжелые: создание и разрушение периодической таблицы» (Блумсбери) научного журналиста Кита Чепмена. .
В этой последней модели в основу был положен уран, исходя из предположения, что химия никогда не встретит атом большего размера. Но потолок стихий продолжал расти. Истории о тридцати или около того элементах, обнаруженных в прошлом веке – некоторые из которых Менделеев и Мейер не могли себе представить – составляют основную часть книги «Сверхтяжелые: создание и разрушение периодической таблицы» (Блумсбери) научного журналиста Кита Чепмена. .
Ранние охотники за элементами использовали огонь для дистилляции своих элементов или смешивали минералы с кипящей кислотой. Эти методы были заменены в двадцатом веке технологиями, которые использовали электричество для расчленения атомов на куски. Более того, ученые поняли, что атомы имеют структуры, состоящие из протонов, нейтронов и электронов; эти структуры могут развалиться или стать больше. Эти события коренным образом изменили наше отношение к материи. Раньше обнаружение элемента было похоже на поиск доктораЛивингстон в Восточной Африке: вы знали, что он где-то был. Теперь грань между открытием и творчеством размыта. Элементы, изготовленные в лаборатории, могут не существовать больше нигде.
Теперь грань между открытием и творчеством размыта. Элементы, изготовленные в лаборатории, могут не существовать больше нигде.
Современная эра охоты за элементами началась в 1930-х годах, когда физик Эрнест Лоуренс поручил ученым из Калифорнийского университета в Беркли разработать серию устройств, называемых циклотронами, которые используют электричество для взрыва протонов по установленным мишеням из фольги. внутри металлических камер. Вскоре исследователи обнаружили, что некоторые из ядерных частиц с наддувом будут стекать на атомы в мишенях и создавать более крупные и тяжелые элементы.Частицы были бесконечно малы, и их шансы на столкновение ничтожно малы. «Это похоже на стрельбу по птицам в темноте в стране, где всего несколько птиц», – сказал Альберт Эйнштейн в 1934 году. Тем не менее, циклотроны Лоуренса позволяли охотникам за элементами делать триллионы выстрелов, и к 1937 году одно из его устройств создало технеций (элемент № 43), атом, предсказанный Менделеевым. Как и все элементы, впервые рожденные в циклотронах, технеций был радиоактивным. Лоуренс получил Нобелевскую премию за свое изобретение в 1939 году; В том же году Эйнштейн сказал президенту Рузвельту приступить к работе над ядерным оружием.
Лоуренс получил Нобелевскую премию за свое изобретение в 1939 году; В том же году Эйнштейн сказал президенту Рузвельту приступить к работе над ядерным оружием.
Такие бомбы, когда они взорвались, пополнили таблицу Менделеева. Начиная с 1952 года Соединенные Штаты взорвали водородные бомбы вокруг Маршалловых островов. Затем исследователи отправили летчиков истребителей F-84 лететь во взрывы. (Огненные шары, отмечает Чепмен, были достаточно горячими, чтобы «имитировать интенсивную печь Солнца».) Ученые оснастили законцовки крыльев F-84 фильтрами, способными улавливать атомы, выкованные во время взрыва. Пробиваясь сквозь стволы грибовидных облаков, пытаясь удержать свои самолеты от грохота, пилоты, пишет Чампан, собирали «элементы, обычно присутствующие только в сливающихся нейтронных звездах.(Один пилот, Джимми Робинсон, спасшись от ядерной пыльной бури, обнаружив, что его двигатели заглохли; он погиб при попытке приземления на воду.) Позже в лаборатории Беркли физик Гленн Сиборг и его коллеги обнаружили двести атомов то, что станет элементом №99 в фильтре, вытащенном из одной из плоскостей. Потребовались годы споров, чтобы рассекретить их открытие, но ученые из Беркли публично описали этот элемент в 1954 году. Они выпили «много коктейлей» и в конце концов назвали свою новую частицу эйнштейниумом в честь человека, который предложил бомбу.
Потребовались годы споров, чтобы рассекретить их открытие, но ученые из Беркли публично описали этот элемент в 1954 году. Они выпили «много коктейлей» и в конце концов назвали свою новую частицу эйнштейниумом в честь человека, который предложил бомбу.
Даже в лабораторных условиях охота за новыми элементами может быть опасной. В 1959 году Аль Гиорсо, физик из Беркли со стальными нервами – он, как известно, наполнял теннисные мячи радиоактивным материалом и бил ими – искал элемент № 102. Однажды, около обеда, он перегрузил ускоритель элементарных частиц гелием. при бомбардировке фильтра из кюрия; Гелий набухал в кюриевом фильтре, пишет Чепмен, пока не лопнул, как «воздушный шар, наполненный радиоактивным блеском».Гиорсо нырнул под облако, и здание было эвакуировано. И все же, несмотря на свои затруднения, Гиорсо, возможно, не был первым, кто открыл этот элемент. Шведская группа, использовавшая элементарное оборудование, утверждала, что нашла его первой; они хотели назвать его nobelium в честь шведского изобретателя динамита. Между тем советские ученые подвергли сомнению результаты, полученные как в Стокгольме, так и в Беркли. Названия элементов № 100 и № 101, фермия и менделевия, не вызвали особого шума, но это относительное спокойствие вскоре разрушилось.В период, который сейчас называется «трансфертными войнами», цикл открытий и сомнений стал лейтмотивом исследований элементов холодной войны. (В конце концов, Международный союз чистой и прикладной химии приписал открытие Советам, сохранив при этом название «нобелий».) К 1970 году в периодической таблице Менделеева было по крайней мере два основных варианта. Американцы назвали элемент № 104 в честь Эрнеста Резерфорда, отца ядерной науки; Советы назвали его в честь Игоря Курчатова, отца русского ядерного оружия.
Между тем советские ученые подвергли сомнению результаты, полученные как в Стокгольме, так и в Беркли. Названия элементов № 100 и № 101, фермия и менделевия, не вызвали особого шума, но это относительное спокойствие вскоре разрушилось.В период, который сейчас называется «трансфертными войнами», цикл открытий и сомнений стал лейтмотивом исследований элементов холодной войны. (В конце концов, Международный союз чистой и прикладной химии приписал открытие Советам, сохранив при этом название «нобелий».) К 1970 году в периодической таблице Менделеева было по крайней мере два основных варианта. Американцы назвали элемент № 104 в честь Эрнеста Резерфорда, отца ядерной науки; Советы назвали его в честь Игоря Курчатова, отца русского ядерного оружия.
Периодическая таблица элементов – база данных элементов
Периодическая таблица В нашей периодической таблице химических элементов представлена полная информация о химических элементах, включая символ химического элемента, атомный номер, атомный вес и описание.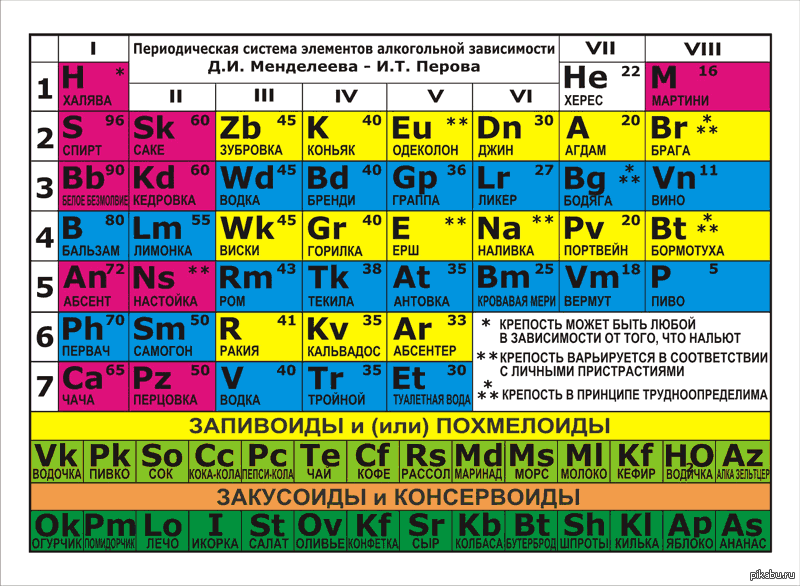 Ссылки ниже ведут к подробному описанию наиболее известных химических элементов. Информация из нашей периодической таблицы может быть полезна студентам-химикам и физикам, а также исследователям естественных наук.Вы можете проверить свои знания о Периодической таблице с помощью нашей викторины.
Ссылки ниже ведут к подробному описанию наиболее известных химических элементов. Информация из нашей периодической таблицы может быть полезна студентам-химикам и физикам, а также исследователям естественных наук.Вы можете проверить свои знания о Периодической таблице с помощью нашей викторины.
Динамическая периодическая таблица
Происхождение Периодической таблицы элементов
Периодическая таблица отображает все известные химические элементы, сгруппированные по химическим свойствам и атомной структуре.
Медь, серебро, золото, ртуть, олово, свинец и другие элементы известны с древних времен и использовались для изготовления ювелирных изделий, монет и инструментов. Фосфор стал первым элементом, открытым Хеннигом Брандом в 1649 году. Он известен как первое научное открытие химического элемента.
Фосфор стал первым элементом, открытым Хеннигом Брандом в 1649 году. Он известен как первое научное открытие химического элемента.
Ранние попытки систематизации
К 1869 году было открыто 63 элемента. Однако первые попытки систематизации были предприняты в 1829 и 1862 годах. Йохан Доберейнер сгруппировал химические элементы в триады, а Де Шанкуртуа составил таблицу с тесно связанными элементами.
Периодическая таблица Менделеева
Только в 1869 году Дмитрий Менделеев, изобретатель и химик русского происхождения, открыл Периодический закон и организовал все химические элементы в столбцы и строки.Элементы были организованы на основе их физических и химических свойств.
Расширенная периодическая таблица
Еще предстоит выяснить, насколько далеко простирается Периодическая таблица элементов. По мнению американского ученого Гленна Сиборга, 130-й элемент является максимально возможным.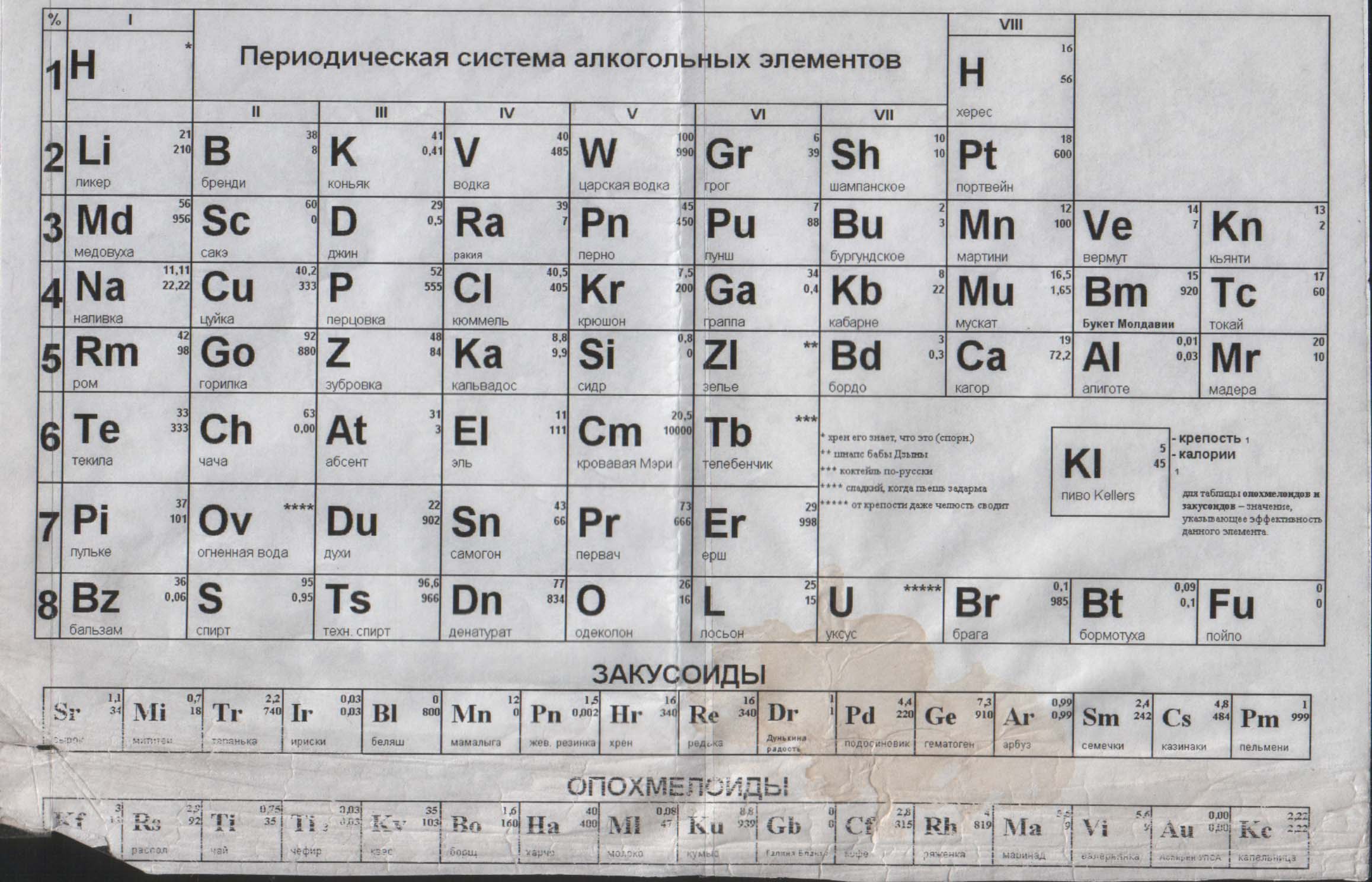 Были предприняты попытки синтезировать несколько новых элементов, в том числе унбисептиум, унбигексий, унбиквадий и унбибий.
Были предприняты попытки синтезировать несколько новых элементов, в том числе унбисептиум, унбигексий, унбиквадий и унбибий.
Группировка периодической таблицы
Периодическая таблица включает 18 групп, и каждая группа содержит элементы с аналогичными химическими и физическими свойствами внешних электронных оболочек.Так называемые типовые элементы находятся в первых двух рядах.
Группы
Группа 1 Периодической таблицы объединяет щелочные металлы, а группа 2 содержит все щелочноземельные металлы. Благородные газы и галогены находятся в группах 18 и 17 соответственно. В Периодической таблице элементы разбиты на кобальт, хром, ванадий, скандий, медь, кобальт и другие группы.
Периоды
Есть 7 периодов элементов, которые группируют элементы с похожими свойствами.Период 1 содержит два элемента, гелий и водород, а период 7 содержит радиоактивные элементы. Редкоземельные элементы находятся в периоде 6. Многие элементы периода 6 токсичны, тяжелы и радиоактивны.
Многие элементы периода 6 токсичны, тяжелы и радиоактивны.
Блоки
Блоки объединяют смежные группы и также называются семействами элементов. В Периодической таблице есть 4 блока – f, d, p и s. Блок f включает внутренние переходные элементы, а блок d состоит из переходных элементов. Блок p включает постпереходные металлы, полуметаллы и неметаллы, за исключением гелия и водорода.Блок s содержит щелочноземельные и щелочные металлы.
Основные категории
Основными категориями являются металлоиды, неметаллы и металлы, а большинство элементов в Периодической таблице – металлы. Металлы податливы, блестят и пластичны, в то время как неметаллы не обладают металлическими свойствами и являются летучими. Металлоиды имеют общие свойства как с неметаллами, так и с металлами.
Периодическая таблица Любопытные факты
Самый дорогой элемент
Лютеций – металл и самый дорогой из имеющихся химических элементов. Цена 1 грамма – 100 долларов. Однако франций – самый дорогой элемент, который может быть произведен. Небольшая сумма обойдется в несколько миллиардов.
Цена 1 грамма – 100 долларов. Однако франций – самый дорогой элемент, который может быть произведен. Небольшая сумма обойдется в несколько миллиардов.
Самый легкий и тяжелый элемент
Водород – самый легкий элемент, но также и самый распространенный элемент. Водород имеет важные коммерческие применения, например, в водородных топливных элементах и производстве химических продуктов. Уран – самый тяжелый элемент, который свободно встречается в природе. Унунокций более тяжелый и самый тяжелый из известных химических элементов, но он создан руками человека.
Самый редкий элемент
Самым редким элементом является астат, общее количество которого, по оценкам ученых, составляет менее 1 грамма. Исследователи ЦЕРН предполагают, что его изотопы можно использовать в терапии рака.
Драгоценные металлы
Группа драгоценных металлов включает такие элементы, как палладий, рутений, платина, иридий и золото. Другие драгоценные металлы включают осмий, рутений, серебро и родий.Они используются для чеканки монет, ювелирных изделий и сплавов и имеют различное коммерческое применение.
Другие драгоценные металлы включают осмий, рутений, серебро и родий.Они используются для чеканки монет, ювелирных изделий и сплавов и имеют различное коммерческое применение.
Искусственно созданные элементы
Некоторые элементы не встречаются в природе, но синтезируются в лабораторных условиях. Их еще называют синтетическими элементами, они обладают радиоактивными свойствами. Фермий и эйнштейний – первые искусственно созданные элементы, открытые в 1952 году. Сегодня известно 20 синтетических или искусственно созданных элементов, среди которых коперниций, рентгений, дубний, унунсептиум, лоуренсий и другие.
Самый многочисленный элемент во Вселенной
Около 75 процентов массы Вселенной состоит из водорода, что делает его наиболее распространенным элементом. Это бесцветный газ без запаха, из которого состоит ядерное вещество. Вторым по распространенности является гелий, на долю которого приходится около 25 процентов массы. Другие элементы включают кислород, железо, неон, магний, углерод и азот.
Другие элементы включают кислород, железо, неон, магний, углерод и азот.
Сколько радиоактивных элементов?
В Периодической таблице 37 радиоактивных элементов.Также были изолированы многие радиоактивные изотопы. В список радиоактивных элементов входят берклий, радон, полоний, калифорний, торий и другие.
Какой элемент самый радиоактивный?
Полоний, который классифицируется как металл и металлоид, является наиболее радиоактивным элементом, не имеющим стабильных изотопов. Он встречается в природе в очень низких концентрациях. Лоуренсий и нобелий также являются высокорадиоактивными элементами.
Самый плотный? Наименее плотный?
Осмий – самый плотный из известных химических элементов с плотностью 22.61 г / см3. Другие элементы с высокой плотностью включают платину, рений, золото, таллий, берклий и америций. Наименее плотным элементом является водород, а литий – наименее плотный твердый металл.
Химия не должна быть скучной. Узнайте больше о химии отбеливания зубов. Если вам интересно, какое отношение химия имеет к деньгам, прочтите «Химию бумажных денег», «Химию полимерных банкнот» и «Химию кредитных карт». Узнайте, почему драгоценные металлы такие особенные.Узнайте больше о банковском деле, деньгах и финансовых вопросах в канадских банках. Если вам интересно, что означает гликемический индекс, что такое углеводы (простые и сложные), как работает низкоуглеводная диета и можно ли пить сахарные спирты, вы пришли в нужное место :).
ТвитнутьCopyright © ElementsDatabase.com 2015 Все права защищены. | Конфиденциальность | О нас | Контакты
Периодическая таблица факторов SEO
Поисковая оптимизация – SEO – может показаться непосвященным алхимией.Но в этом есть наука.
Поисковые системы награждают страницы правильной комбинацией факторов ранжирования или «сигналов». SEO – это обеспечение того, чтобы ваш контент генерировал сигналы правильного типа.
The Search Engine Land Guide To SEO более подробно объясняет факторы, включенные в нашу Периодическую таблицу факторов SEO, включая советы экспертов по SEO.
Получить периодическую таблицу. Прочтите руководство по SEO
- Получите свою копию обновленной периодической таблицы SEO и сопроводительного отчета, подходящего для печати, и отправьте его прямо вам через поле электронной почты вверху или внизу этой страницы.
- Получите еще более подробную информацию с помощью Search Engine Land’s Guide to SEO.
С момента своего первого дебюта в 2011 году Периодическая таблица факторов SEO в Search Engine Land стала всемирно признанным инструментом, на который специалисты по поиску положились, чтобы помочь им понять элементы, необходимые для успешной стратегии SEO.
И в этом году мы еще больше расширили нашу Периодическую таблицу, чтобы охватить еще больше вопросов SEO. Наряду с регулярным ежегодным обновлением отдельных элементов, мы внесли ряд серьезных изменений и добавили новый раздел «Ниши». В то время как общая периодическая таблица SEO дает вам представление об общих передовых методах, раздел «Ниши» посвящен нюансам SEO для трех новых областей: локальных, издательских и электронных.
В то время как общая периодическая таблица SEO дает вам представление об общих передовых методах, раздел «Ниши» посвящен нюансам SEO для трех новых областей: локальных, издательских и электронных.
В этой обновленной инфографике мы предлагаем как опытным специалистам по поисковой оптимизации, так и новичкам в отрасли обзор того, что важно для достижения успеха в области поисковой оптимизации. Речь идет не только о рейтинге, но и о достижении положительных результатов за счет большей видимости в поисковых системах.
Предположим, вы видели предыдущие версии этой диаграммы.В этом случае вы будете знакомы с общей концепцией – каждый элемент в таблице представляет собой фактор, который необходимо учитывать для достижения успеха в SEO. В зависимости от вашей вертикали относительная важность факторов может варьироваться. Тем не менее, эта обновленная Периодическая таблица дает базовое представление о пространстве в том виде, в каком оно существует в 2021 году, с его содержанием, основанным на вкладах наших редакторов, а также на информации и мнениях, почерпнутых из опроса нашей аудитории.
Хотя SEO – это действительно искусство, это также наука.Мы надеемся, что этот обновленный инструмент послужит важным справочником для ваших экспериментов.
На этой неделе периодической таблице исполняется 150 лет
«L A république n’a pas besoin de savants ni de chimistes ». Этим кратким увольнением суд революционной Франции оборвал жизнь Антуана-Лорана де Лавуазье, которого некоторые считали величайшим химиком из всех. Грех Лавуазье – сбор налогов.Он был членом фирмы, которая собирала различные пошлины монархии, а затем, взяв ее, передавала оставшуюся часть в королевскую казну. То, что он и многие его товарищи-фермеры встретили свои концы под лезвием гильотины, неудивительно. Но что отличало Лавуазье от своих собратьев, так это то, на что он решил потратить свой доход. Во многом это пошло на создание самой оснащенной химической лаборатории в Европе.
Послушайте эту историюВаш браузер не поддерживает элемент
Больше аудио и подкастов на iOS или Android.
Ничего не происходит из ничего. Спорный вопрос, где на самом деле начинается история периодической таблицы элементов. Но лаборатория Лавуазье – лучшее место для начала, потому что именно Лавуазье опубликовал первый предположительно исчерпывающий список химических элементов – веществ, неспособных расщепляться с помощью химических реакций на другие вещества, – и это были Лавуазье и его жена Мари. Энн, которая впервые применила технику количественного измерения того, что входит и выходит в результате химической реакции, как способ понять суть того, что такое такая реакция на самом деле.
Список элементов Лавуазье, опубликованный в 1789 году, за пять лет до его казни, состоял из 33 записей. Из них 23 – пятая от общего числа признанных в настоящее время – выдержали испытание временем. Некоторые из них, такие как золото, железо и сера, были известны с древних времен. Другие, такие как марганец, молибден и вольфрам, были недавними открытиями. Чего в списке не было, так это структуры. Это было, avant la lettre , коллекция марок. Но альбома не было.
Создание этого альбома, наполнение его и понимание того, почему он такой, заняли полтора века.Однако теперь это привычная черта каждой научной лаборатории средней школы. Его ряды и столбцы прямоугольников, каждый из которых содержит одно- или двухбуквенное сокращение имени элемента, вместе с его порядковым атомным номером, представляют порядок и основную структуру Вселенной, которая удивила бы Лавуазье. Будет небольшим преувеличением сказать, что почти все в современной науке связано с периодической таблицей, обычно всего одним или двумя перерывами.
Могущественный атом
Тщательные измерения Лавуазье открыли нечто, теперь считающееся банальным, – закон сохранения материи.Химия меняет природу веществ, но не их общую массу. Установив этот факт, другой француз, Луи-Жозеф Пруст, расширил эту идею с помощью закона определенных пропорций. Этот закон, опубликованный в 1794 году, в год казни Антуана Лавуазье, гласит, что весовое соотношение элементов в химическом составе всегда одинаково. Это не зависит от способа приготовления этого соединения. Отсюда, возможно, Пруст сделал небольшой шаг к идее, что соединения состоят из частиц разного веса, причем каждый вес представляет собой определенный элемент.Но он этого не взял. Это прозрение пришлось ждать Джона Далтона, человека, который был полной противоположностью аристократического бонвивана Лавуазье. Родители Далтона были настолько бедны, что его заставили работать в возрасте десяти лет. Сам этот человек был аскетом, дальтоником квакером. И он был англичанином.
Далтон жил в Манчестере, когда это был крупнейший промышленный город мира. Он зарабатывал скромно на жизнь репетиторством, но большую часть своей энергии тратил на научные исследования, в том числе на дальтонизм, состояние, которое еще иногда называют дальтонизмом.Этот запрос ни к чему не привел. Но в течение первого десятилетия XIX века он взял концепцию Пруста и показал, что не только элементы реагируют в фиксированных пропорциях по весу, но и что эти пропорции представляют собой отношения малых целых чисел. Самый простой способ объяснить это – и, по сути, способ, которым осветил Дальтон – состоял в том, чтобы предположить, что каждый элемент состоит из крошечных неделимых частиц, имеющих одинаковый вес. Греческое слово «неделимое» – «атомос». Так родился атом.
Дальтон основал свою систему относительных атомных весов на водороде, атомы которого он обнаружил самыми легкими.И его быстро подхватил кто-то, кто, хотя и менее знаменит, чем Лавуазье, возможно, из-за его ужасной кончины, возможно, был более великим человеком. Якоб Берцелиус, швед, снабдил химию своим языком. Именно он придумал аббревиатуры, которые теперь занимают прямоугольники периодической таблицы. Именно он объединил эти сокращения с числами, обозначающими соответствующие пропорции, чтобы составить формулы для химических соединений: H 2 O (вода), H 2 SO 4 (серная кислота), NaCl (поваренная соль).И именно он использовал эти формулы для описания реакций: H 2 SO 4 + Zn → ZnSO 4 + H 2 (серная кислота плюс цинк превращается в сульфат цинка плюс водород). Хотя Дальтон изобрел атомную теорию, именно Берцелиус вложил ее в суть предмета.
И Берцелиус сделал больше. Он использовал недавно изобретенную батарею Алессандро Вольта, которая вырабатывала электричество в результате химической реакции, чтобы сделать обратное. Он использовал электричество для управления химическими реакциями в растворах (например, для выделения металлической меди из раствора сульфата меди). Этот процесс называется электролизом.
Вернувшись в Англию, Хэмфри Дэви, изобретатель шахтерской предохранительной лампы, подхватил идею электролиза и развил ее. Он использовал более мощную версию батареи Вольта для разложения расплавленных материалов, а не растворов. Таким образом, он открыл натрий и калий в 1807 году и магний, кальций, стронций, барий и бор в 1808 году. Он также показал, что хлор, который ранее считался соединением кислорода, на самом деле был элементом.
После того, как Дэви начал работать, новые элементы начали течь густо и быстро.Йод (1811 г.). Кадмий и селен (1817 г.). Литий (1821 г.). Кремний (1823 г.). Алюминий и бром (1825 г.). К тому времени их было достаточно, чтобы сделать следующий шаг в путешествии.
Со времени их открытия было очевидно, что натрий и калий похожи, как и кальций, стронций и барий. Литий, когда его обнаружили, оказался похож на натрий и калий. Точно так же бром и йод оказались похожими на хлор. В 1829 году немец Иоганн Доберейнер заметил любопытство по поводу этих троек (членов групп, теперь известных, соответственно, как щелочные металлы, щелочноземельные металлы и галогены), а также еще одного триплета, обладающего схожими свойствами: сера, селен и теллур.В каждом случае, если элементы были расположены в порядке атомного веса, средний элемент (натрий, стронций, бром, селен) имел вес, который был средним из самого легкого и самого тяжелого из трех. Доберейнер назвал это законом триад. Это был первый намек на некий базовый образец.
Коллекция марок продолжала расти. Торий был открыт в 1829 году (так случилось, что Берцелиус). За ним последовал лантан в 1838 году, эрбий в 1843 году и рутений в 1844 году. Затем, в 1860 году, Роберт Бунзен, изобретатель горелки, носящей его имя, показал, как новые элементы можно распознать по ярким линиям в спектрах, полученных, когда материалы, содержащие их, были нагревается в пламени.Такой подход имел мгновенный успех. Бунзен и его коллега Густав Кирхгоф добавили в список цезий (1860 г.) и рубидий (1861 г.). Другие, копируя их, добавляли таллий (1861 г.) и индий (1863 г.). Однако величайшим триумфом спектроскопического анализа стал гелий (1868 г.). Это было обнаружено не по образцу пламени бунзеновской горелки, а по солнечному спектру.
По мере того, как появлялось все больше и больше элементов, поиск порядка усиливался. В 1864 году британец Джон Ньюлендс чуть не получил его.Он опубликовал то, что он назвал законом октав. Расположив известные элементы в порядке их атомного веса, он полагал, что обнаружил, что, как и в музыкальной гамме, каждый восьмой элемент «рифмуется» так, как натрий рифмуется с калием, а хлор – с бромом.
Проблема схемы Ньюлендса заключалась в том, что очень много рифм были навязаны. Взгляд на современную таблицу Менделеева показывает, почему. Для высоких внешних колонн (и без учета водорода, что само по себе является законом) октавы Ньюлендса идеально подходят для самых легких из известных на тот момент элементов.Однако, начиная с ряда, начинающегося с калия (K, от латинского kalium , что означает поташ), высокие внешние столбцы разделены на части из-за вторжения десяти других, более коротких, известных как переходные металлы. Чтобы справиться с этим вторжением с использованием имеющихся на тот момент данных, требовалось сочетание удачи и гения. А через несколько лет после публикации Newlands удачливый гений боролся с этим вопросом в своем исследовании в Санкт-Петербурге.
Менделеев
Альберт Эйнштейн, щеголеватый в молодости, в старости воспитывал своенравную внешность, что и внесло свой вклад в образ безумного профессора.Дмитрий Менделеев (на фото) выглядел так с самого начала – ему стриг волосы пастухом только раз в год с помощью ножниц для шерсти. К тому же он вел себя как сумасшедший профессор. Он был склонен к танцевальной ярости, которая напомнила одному биографу главного героя детской сказки «Румпельштильцхен». Также, как и Румпельштильцхен, он доказал, по крайней мере в переносном смысле, способен превращать солому в золото.
Какое-то время Менделеев работал в Германии с Бунзеном и Кирхгофом, но поссорился с ними и вернулся домой.В 1869 году он был профессором общей химии Петербургского университета и писал русскоязычный учебник по этому предмету. 14 февраля по юлианскому календарю, который тогда использовался в России (26 февраля по григорианскому календарю, используемому в большей части остальной Европы), обратившись к галогенам и щелочным металлам, он ломал себе голову над тем, чтобы принцип организации действовал в качестве шаблона. для остальных. 14-е было пятницей, и на выходных эта проблема все больше и больше беспокоила его.Но в понедельник 17-го, когда он ждал, когда сани отвезут его на вокзал для поездки в имение, которое он купил в сельской местности, у него была волна мозгов.
Менделеев был заядлым игроком в терпение. Его мозговая волна заключалась в том, чтобы осознать, что точно так же, как игры на терпение требуют, чтобы игрок организовал колоду в виде сетки мастей в порядке достоинства карт, так и элементы могут быть расположены по их атомному весу в «мастях», которые имеют общий химический состав. и физические свойства. Создав свою собственную колоду, в которой каждая карта представляет один из 63 известных на тот момент элементов, он смог начать, пожалуй, самую важную игру на терпение, в которую когда-либо играли.
Впоследствии он утверждал, что ответ пришел к нему во сне. Возможно. Но после четырех дней работы над проблемой без особого отдыха граница между сном и бодрствованием должна была быть довольно размытой. Какими бы ни были детали, в результате получилась сетка из карточек, в которой элементы располагались в виде узора (см. Рисунок). Он опубликовал ее через две недели.
Мечта МенделееваЕго сетка была несовершенной. Действительно, он был дырявый. Но эти дыры (во всяком случае, некоторые из них) оказались краеугольными камнями.Хотя в 1860-х годах не было оснований полагать, что все элементы были обнаружены, Ньюлендс вёл себя так, как если бы они были открыты. Менделеев имел достаточно уверенности, чтобы оставлять пробелы, чтобы образец работал. В то время некоторые восприняли это как признак слабости. Фактически, это был знак силы – тем более, что для нескольких пробелов он подробно описал свойства элементов, которые, по его предсказанию, заполнят их, и эти прогнозы, в общем, сбылись.
Точно так же есть места в исходной таблице Менделеева, где она работает только путем обмана, то есть путем перестановки двух соседних элементов между местами, которым их присваивает их атомный вес.Здесь Менделеев утверждал, что принятые веса были неправильными и нуждались в повторном измерении. Иногда он оказывался прав и в этом. Но не всегда. Несколько таких пар, например, кобальт и никель (которые на самом деле занимают одно место в опубликованной таблице), упорно оставались нестабильными, что свидетельствовало о том, что атомный вес на самом деле является косвенным показателем более глубокого структурного принципа
Что принципиально важно, Менделеев не ограничивался. , как и Ньюлендс, из-за предвзятого мнения о том, как все должно быть.В тех случаях, когда правило октав не работало, он позволял сетке вырываться из корсета. Это можно увидеть как вверху, так и внизу опубликованной таблицы.
В правом верхнем углу указаны переходные металлы. Здесь последующие открытия доказали, что Менделеев более или менее прав в своих догадках. Нижний левый вариант более проблематичен. Его содержимое представляет собой мешок для переноски, хотя в нем есть все известные на тот момент элементы набора элементов, называемых лантаноидами. Возможно, Менделееву повезло, что к 1869 году было открыто только три лантаноида.В современной таблице их 15, и вместе с актинидами под ними они образуют неуклюжую интерполяцию, которая часто отправляется в конец как сноска, отмеченная звездочкой. Помогло бы или помешало бы Менделеевской игре в химическое терпение наличие большего количества лантаноидов в пакете – это интригующий вопрос.
Была еще и невидимая брешь, заполнение которой было одним из величайших успехов стола. Гелий, который Менделеев игнорировал, потому что его атомный вес не мог быть установлен, оказался самым легким членом целой новой строки (или столбца в современной таблице).Это благородные газы, ранее не обнаруженные, поскольку они химически инертны. Остальные – неон, аргон, криптон, ксенон и радон.
Как и открытия Дэви, благородные газы пришли в упадок. Все, кроме радона, были созданы британцем Уильямом Рамзи. Вместе с разными сотрудниками Рамзи выделил аргон в 1894 году, гелий в 1895 году и неон, криптон и ксенон в 1898 году. Вместо химии он использовал физические процессы. Все, кроме гелия, были продуктами недавно разработанной криогенной технологии, которую он использовал для сжижения воздуха и последующего разделения его на компоненты в соответствии с их температурами кипения.Гелий он обнаружил при нагревании минерала под названием клевеит.
Трансмутация элементов
1890-е годы также увидели первые признаки того, что сами атомы, несмотря на значение их имени, не могут быть по-настоящему неделимыми. Первоначальное свидетельство того, что атомы могут отделять части самих себя и, следовательно, должны иметь более мелкие компоненты, появилось в 1896 году. Именно тогда Анри Беккерель, исследовавший природу фосфоресценции, обернул некоторые соли урана в фотобумагу и обнаружил, что бумага запотели.Так Беккерель открыл радиоактивность.
В следующем году J.J. Томсон выяснил, что «катодные лучи», испускаемые отрицательным электродом в вакуум, были электрически заряженными частицами, которые весили намного меньше, чем любой атом. Затем, в 1899 году, Эрнест Резерфорд, бывший ученик Томсона, показал, что излучение Беккереля состоит из двух компонентов, которые он назвал «альфа» (тяжелые, положительно заряженные частицы) и «бета» (легкие, отрицательно заряженные).
Есть сурьма, мышьяк, алюминий, селен.И водород, и кислород, и …Сам Беккерель в 1900 году показал, что бета-частицы были такими же, как катодные лучи Томсона. Семь лет спустя Резерфорд продемонстрировал, что альфа-частицы являются ионами гелия (таким образом, попутно объясняя, почему клевеит, являющийся рудой урана, также является источником гелия). Теперь все было готово для некоторых из самых важных экспериментов в истории: попыток Резерфорда выяснить, как выглядят атомы.
Ранее предполагалось, что это вихри в светоносном эфире, через которые, как считалось, распространяются свет и радиоволны.Эта гипотеза, однако, умерла вместе с эфиром, когда существование последнего было опровергнуто экспериментально в 1890-х годах. Эксперименты Резерфорда, проведенные между 1908 и 1910 годами, исследовали материю, стреляя альфа-частицами по золотой фольге. Большинство из них проплыли, чтобы их зафиксировал сцинтилляционный экран за фольгой. Но некоторые были отклонены от курса, чтобы их могли зафиксировать другие экраны, в том числе один за источником. Запись на этом экране альфа-частиц, возвращающихся туда, откуда они пришли, была описана Резерфордом как «почти такая невероятная, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и поразил вас».Его объяснение, теперь полностью подтвержденное верным, заключалось в том, что атомы в фольге имеют крошечные положительно заряженные ядра, которые отражают положительно заряженные альфа-частицы, и что эти ядра окружены электронами.
Независимо от точной природы атома потеря альфа- и бета-частиц обязательно меняет его. Такой радиоактивный распад оказался источником еще большего количества членов периодической таблицы. Полоний и радий – продукты распада урана – были открыты в 1898 году Пьером и Мари Кюри.Актиний, самый легкий актинид, последовал за ним в 1899 году. Радон был признан в 1900 году. Протактиний в 1913 году.
Модели атома также стали более сложными. В 1913 году Резерфорд и его датский коллега Нильс Бор предположили, что электроны вращаются вокруг ядра, как планеты вращаются вокруг Солнца, при этом электрическое притяжение играет роль гравитации. В том же году Генри Мозли, другой соратник Резерфорда, обнаружил математическую связь между спектром лучей X элемента при бомбардировке электронами и его атомным номером в таблице.В парах, таких как кобальт и никель, где стол был фадж, Мозли подтвердил, что фадж верны. Он привел в порядок лантаноиды, предсказывая недостающие элементы, как это сделал Менделеев. Он также предсказал два новых переходных металла с атомными номерами 72 и 75, которые должным образом появились в 1923 г. (гафний) и 1925 г. (рений).
Спектры Мозли X -лучей продемонстрировали, что атомный номер элемента не зависит напрямую от его атомного веса. Резерфорд вскоре показал, что атомный номер – это фактически номер в ядре положительно заряженной частицы, которая стала известна как протон.Несмотря на то, что протоны весят почти в 2000 раз больше электронов, оба заряда имеют равные (хотя и противоположные) заряды. Следовательно, атом, в котором их количество равно одинаковому, электрически нейтрален. Однако протоны недостаточно тяжелы, чтобы учесть измеренный атомный вес. Для этого требуется вторая, электрически нейтральная частица – нейтрон. Это было открыто в 1932 году. Нейтроны также являются причиной того, что элемент может иметь атомы разного атомного веса, известные как изотопы. Эти изотопы имеют разное количество нейтронов.
Модель атома Бора-Резерфорда, однако, имела проблему. Электростатические силы должны притягивать электроны к ядру, а не удерживать их на орбите. Здесь на помощь пришла новая наука – квантовая механика. Квантовая теория требует, чтобы объекты были как частицами, так и волнами. Волнообразный аспект электронов означает, что, когда они окружают атомное ядро, они образуют самоусиливающиеся трехмерные стоячие волны, называемые орбиталями. Стабильность этих стоячих волн останавливает втягивание электронов в ядро.И вот, наконец, объяснение того, почему таблица Менделеева такая, какая она есть.
Spdfg
По причинам, лежащим в основе квантовой механики, каждая орбиталь может содержать один или два электрона, но не более. Сами орбитали бывают разных типов (см. Диаграмму), и они расположены в оболочках вокруг ядра. Первая оболочка имеет одну орбиталь типа «s», максимум для двух электронов. Второй, тип s и три типа p, максимум восемь. У третьего есть один s, три p и пять d, максимум 18.Четвертый, один s, три p, пять d и семь f, максимум 32. И так далее. Имена происходят от спектральных линий, которые видели Бунзен и его последователи. Цвета этих линий представляют энергию, выделяемую в виде света электронами, движущимися между орбиталями.
Это оболочки, которые определяют строки таблицы. В первом ряду, состоящем из водорода (один электрон) и гелия (два), заполнена первая оболочка. Во втором ряду от лития до неона залита вторая оболочка. Третий ряд, от натрия до аргона, заполняет s- и p-орбитали третьей оболочки.Четвертый, от калия до криптона, заполняет s- и p-орбитали четвертой оболочки и d третьей оболочки (которая имеет всего десять электронов для десяти столбцов переходных металлов).
Соединения создаются либо неспаренными электронами от разных атомов, образующими совместные орбитали, называемые ковалентными связями, либо полным переносом неспаренных электронов между атомами, чтобы создать парные орбитали в реципиентах. Когда это происходит, образующиеся положительные и отрицательные ионы удерживаются вместе за счет электростатических сил – процесс, называемый ионной связью.Повторяющийся порядок, в котором оболочки заполняются в каждой строке, означает, что элементы в каждом столбце таблицы имеют одинаковую комбинацию неспаренных электронов и, следовательно, аналогичные свойства. Например, благородные газы инертны, потому что в них нет неспаренных электронов. Более того, дальнейший анализ показал, что разница между металлами и неметаллами зависит от того, насколько легко внешние электроны атома отделяются (если их легко отсоединить, они могут течь как электрический ток, отражать свет так, чтобы металлы блестели, и придают пластичность твердой форме элемента).И это, по сути, химия.
Однако это еще не конец. В 1930-х годах физики обнаружили, что радиоактивность, по сути, можно обратить вспять, бомбардируя атомы субатомными частицами для увеличения их атомных номеров. Таким образом можно производить новые элементы. Технеций, созданный в 1937 году, был первым из них. Два года спустя франций, последний из обнаруженных в природе, был выделен как продукт распада актиния. С этого момента расширение периодической таблицы стало делом физиков, а не химиков.
Технеций странный. Несмотря на свой низкий атомный номер (43), он не имеет стабильных изотопов и поэтому встречается в природе лишь временно. Это особенность физики протонов и нейтронов, которую он разделяет с прометием (61). Но в самом конце таблицы, помимо свинца (82), радиоактивность является обязательной для всех. А помимо урана (92) он настолько обязателен, что когда-то считалось, что «трансурановые соединения» не встречаются в природе.
Эта часть таблицы Менделеева была игровой площадкой американского физика Гленна Сиборга.В 1940 году Сиборг был частью группы в Калифорнийском университете в Беркли, которая производила нептуний (93). Когда позже в том же году глава группы ушел, его взял на себя Сиборг. На его часах были созданы америций (95), кюрий (96), берклий (97), калифорний (98), эйнштейний (99), фермий (100), менделевий (101) и нобелий (102). Но его первое открытие, плутоний (94, в 1941 г.), было самым важным. 16 июля 1945 года первая атомная бомба, взрывное устройство из плутония, была испытана в Аламогордо, штат Нью-Мексико.9 августа того же года другой корабль с такой же конструкцией разрушил Нагасаки в Японии.
Америций тоже находит применение. Поскольку это был синтетический продукт, он был запатентован, и Сиборг действительно запатентовал его. Он использовался (и используется) в детекторах дыма, и на протяжении многих лет он получал от этого неплохой доход. Однако после 95 года практический смысл расширения стола становился все менее очевидным, поскольку элементы становились все менее и менее стабильными.
Усилия по созданию новых элементов замедлились после 1955 года, хотя в середине 1990-х годов снова возобновились.Однако ни химия, ни мир в целом не вызвали воодушевления при создании дармштадция (110), рентгения (111), коперника (112) и нихония (113), как это было с открытием калия или гелия. или радий, или плутоний. То, что начиналось как коллекционирование марок, вернулось к своим корням – за исключением одного аспекта. Дело в том, что благодаря таланту Менделеева у охотников за стихиями теперь есть альбом, в который они могут вставить свои открытия.
Самый тяжелый элемент – оганессон (118) – был создан в 2002 году, но назван только в 2016 году.Оганессон замыкает седьмой ряд таблицы. По химическому составу это должен быть благородный газ. Но, учитывая, что одновременно можно играть всего с несколькими атомами, и с этими атомами, время жизни которых измеряется в миллисекундах, кажется невероятным, что кто-то когда-либо узнает наверняка.
Таким образом, несмотря на все усилия физиков, восьмой ряд так и не был достигнут. Но, как сказал сам Менделеев, «постичь, понять и уловить всю симметрию научного здания, включая его незавершенные части, равносильно вкушению того удовольствия, которое передают только высшие формы красоты и истины.Тем, кто разделяет эту точку зрения и видит в периодической таблице величайший образец поэзии природы, дополнение оганессона для завершения строк и альбомов может показаться таким же хорошим местом, чтобы остановиться.
Эта статья появилась в разделе «Наука и технологии» печатного издания под заголовком «Суть вопроса»
Плакат с периодической таблицей – вкратце – kurzgesagt
Подтвердите свое местоположение, чтобы получить лучшие цены на доставку
AfghanistanÅland IslandsAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntarcticaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBolivia, многонациональное государство ofBonaire, Синт-Эстатиус и SabaBosnia и HerzegovinaBotswanaBouvet IslandBrazilBritish Индийский океан TerritoryBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCape VerdeCayman IslandsCentral африканских RepublicChadChileChinaChristmas IslandCocos (Килинг) IslandsColombiaComorosCongoCongo, Демократическая Республика theCook IslandsCosta RicaCôte d’IvoireCroatiaCubaCuraçaoCyprusCzech RepublicDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland острова (Мальвинские) Фарерские острова, Фиджи, Финляндия, Франция, Французская Гвиана, Французская Полинезия, Французские Южные территории, Габон, Гамбия, Грузия, Германия, Гана, Гибралтар, Греция, Гренландия, Гренада, Гваделупа, Гуам, Гватемала, Гернси, Гвинея, Гвинея-Бисау, Гайана, Гаити, Hear d Island и McDonald IslandsHoly Престол (Ватикан) HondurasHong KongHungaryIcelandIndiaIndonesiaIran, Исламская Республика ofIraqIrelandIsle из ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Корейская Народно-Демократическая Республика ofKorea, Республика ofKuwaitKyrgyzstanLao Народная Демократическая RepublicLatviaLebanonLesothoLiberiaLibyaLiechtensteinLithuaniaLuxembourgMacaoMacedonia, бывшая югославская Республика ofMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMicronesia, Федеративные Штаты ofMoldova, Республика ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNauruNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorthern Mariana IslandsNorwayOmanPakistanPalauPalestinian край , ОккупированнаяПанамаПапуа-Новая ГвинеяПарагвайПеруФилиппиныПиткэрнПольшаПортугалияПуэрто-РикоКатарРеюньонРумынияРоссийская ФедерацияРуандаСент-БартелемиСвятую Елену, Вознесение и Тристан-да-КуньяСент-Китс и Нев isSaint LuciaSaint Мартин (французская часть) Сен-Пьер и MiquelonSaint Винсент и GrenadinesSamoaSan MarinoSao Томе и PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Маартен (Голландская часть) SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Джорджия и Южные Сандвичевы IslandsSouth SudanSpainSri LankaSudanSurinameSvalbard и Ян MayenSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwan, провинция ChinaTajikistanTanzania, Объединенная Республика ofThailandTimor -ЛестеТогоТокелауТонгаТринидад и ТобагоТунисТурцияТуркменистанТуркс и острова КайкосТувалуУгандаУкраинаОбъединенные Арабские ЭмиратыВеликобританияСоединенные ШтатыМалые Соединенные Штаты Внешние острова УругвайУзбекистан Вануату, Виргинские острова, Вирджиния, Болгарская Республика, Вирджиния, Вирджиния, Вирджиния, ВирджинияС. Уоллис и Футуна, Западная Сахара, Йемен, Замбия, Зимбабве,
. GoПериодическая таблица элементов, выпуск
Элемент 82 обвиняли в падении Римской империи и сводили с ума художников эпохи Возрождения. Это штука из пуль и этилированного бензина. И в последние годы это вызвало кризисы в области общественного здравоохранения во Флинте, штат Мичиган, и Ньюарке, штат Нью-Джерси, в результате чего были загрязнены источники воды и повышен уровень свинца в крови у детей, которые непропорционально были из бедных общин и меньшинств.
Когда свинец связывается с белками или вытесняет важные металлы в организме, последствия могут быть катастрофическими. «Красота свинца для химика в том, что он может связываться разными способами», – говорит Марк Уилсон, доцент кафедры химии Университета Торонто. «Опасность свинца для биолога заключается в том, что он может связываться разными способами».
Но, как мог бы заметить химик, свинец – это не все плохо. Подкладки на основе свинца защищают ваши органы во время рентгеновских лучей и защищают окружающую среду от некоторых опасных материалов.Свинец делает ваши хрустальные бокалы прочными и блестящими, а автомобильный аккумулятор заряжается.
Его полезность отчасти объясняет его повсеместное распространение. Когда в 2002 году Ассоциация производителей свинца обанкротилась, сославшись на отсутствие страховки на случай судебных разбирательств, никто не стал говорить о положительных моментах. Имея это в виду, Bloomberg Businessweek поговорил с Мэттом Сорреллом, креативным директором рекламного агентства Wieden + Kennedy, чтобы обсудить, может ли выгодное использование лида каким-то образом его погасить.Интервью отредактировано для большей ясности.
Что вам нужно знать, прежде чем взять на себя ведущую роль в качестве клиента?
Вы пытаетесь обучать людей? Или какой-то ведущий магнат просто пытается очистить склад от этих вещей?
Давайте начнем с обновления бренда и продолжим продажи.
В этом случае нам нужен дальновидный подход. «Свинец – это жизнь». «Веди со свинцом». «Ведущий: постарайтесь не думать об этом слишком много.”
Второй вариант может быть трудным для понимания в печатном виде.
Может быть, просто поставить знак ударения над буквой «е» или «а», чтобы мы получили другое произношение, чтобы сделать его перспективным.
Расскажите, как вы реализовали проект «Lead Is Life».
Свинец защищает человеческое тело – он защищает человеческие гениталии! Если посмотреть на это с другой стороны, может быть, свинец создает жизнь.
В свинце много положительного.Он дешев, податлив и устойчив к коррозии. Знаете ли вы, что Вселенная всегда создает больше свинца?
Я этого не знал. Это никуда не денется, так что, может быть, нам не стоит игнорировать это.
Он также имеет наивысший атомный номер среди всех стабильных элементов. Вот что делает его таким отличным щитом от радиации.
Ага! У него высокий балл, высокий показатель, но он на грани сверхопасности. Максимально сильная атмосфера Тайленола.
История рекламы знает множество примеров проблемных товаров, таких как сигареты. В чем обратная сторона более открытого признания темной стороны свинца?
Плохой PR в рекламной индустрии.
Но разве не главная задача агентства – убедить людей купить то, что им не подходит?
Продать непродаваемое? Мне это кажется скользким, старомодным способом сделать это. Человек Мальборо и [Джо] Верблюд – странные образцы поп-культуры, которых бы не существовало, если бы люди не отказались от своей морали.
Вы говорите, что рекламная индустрия изменилась?
Произошли изменения на обоих концах; общественные знания также изменились. ( Пауза. ) Когда информация так легко доступна, люди поймут, что она вредна для вас. Так зачем это скрывать? Может быть, мы примем это. Сейчас у людей действительно есть что-то вроде судного дня. Может быть, лучше принять то, что смеется над этим? Людям нравятся вещи, которые им вредны. «Ведущий: разоблачите себя.Или «Свинец: плохо до костей». Или «Свинец: так больно».
Мы говорим здесь о отмеченной наградами рекламе?
Прямо сейчас индустрия наград активно занимается работой, которая доводит дело до крайности и заставляет людей чувствовать себя некомфортно.
Перспективно. Так вы бы взяли на себя ведущую роль в качестве клиента?
Ознакомившись с плюсами и минусами? Точно нет.
Home – Ресторан и бар Periodic Table
Добро пожаловать в ресторан и бар Periodic Table!
“ Формулирование ароматизаторов ежедневно ”
Что мы подразумеваем под ежедневным составлением ароматизаторов?
Наша цель – найти идеальные, «симбиотические» отношения между едой и спиртными напитками с каждым созданным блюдом и напитком!
Мы предлагаем эклектичное меню блюд, каждое блюдо сочетается с вкусным напитком. Еда отличного качества с некоторыми изюминками некоторых из ваших любимых блюд, таких как начо, крылышки, мясной рулет, пастуший пирог и крабовые пирожные. Множество разнообразия , включая креативные закуски и уникальные закуски, бутерброды, салаты и первые блюда, которые включают свежие морепродукты, мясо отличного качества и диетические варианты (GF, V, Ve).
Мы не типичный для вас ресторан и бар. Неважно, к какому настроению вы настроены, The Table может удовлетворить вас. Наша команда готовит блюда отличного качества со всего мира и добавляет изюминку к разным вкусам.
Специальные предложения на неделю – В дополнение к нашему обычному меню наша команда создает уникальные блюда, каждую неделю используя свой разнообразный опыт и различные кулинарные навыки. Все, от специальных гамбургеров до восхитительной паэльи, приготовленной на медленном огне, до потрясающего стейка – все в сочетании с оригинальными коктейлями, винами и пивом. Таблица Менделеева предлагает выгодных предложений, и еженедельные специальные предложения, чтобы все остались довольны.
Наша талантливая команда бара создает удивительные фирменные коктейли и великолепные напитки , используя бурбон, виски, джин, текилу, водку, ром, а также вино и широкий выбор пива на разлив или в бутылках.
