Молярный объем – таблица, формулы (химия, 8 класс)
4.2
Средняя оценка: 4.2
Всего получено оценок: 254.
4.2
Средняя оценка: 4.2
Всего получено оценок: 254.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Рис. 1. Молярный объем формула.Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Рис. 2. Таблица молярных объемов.Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
10/10
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 254.
А какая ваша оценка?
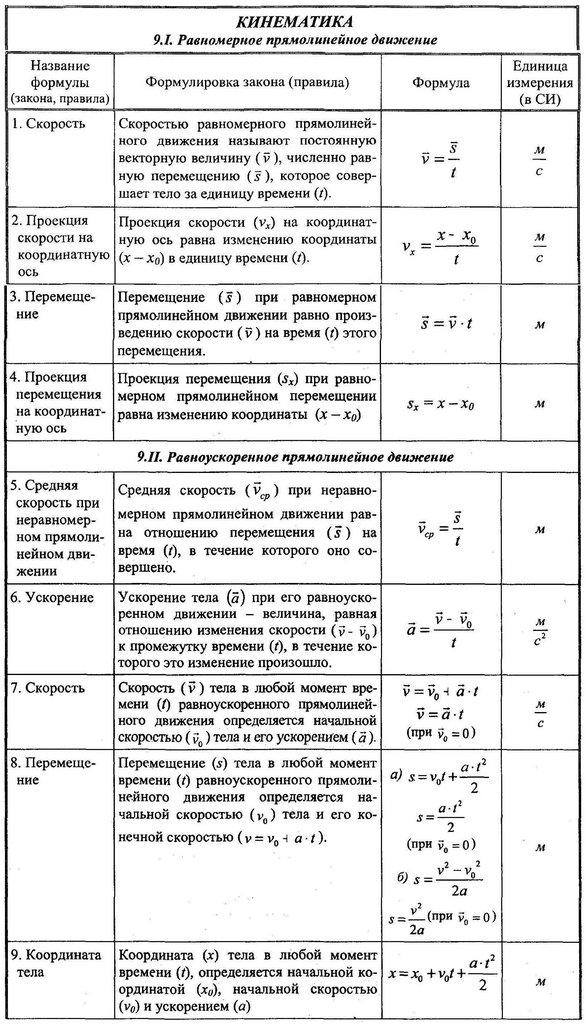
Готовимся к ОГЭ. Физика. 9 класс. Опора №1
1. Физическая величина – это свойство класса явлений или типового физического объекта, имеющего единую качественную характеристику. Различают основные и производные физические величины.
Производными считаются величины, определяемые двумя или более основными.
Примеры производных физических величин: скорость, сила, ускорение, объем, давление.
2. Под физическим явлением понимается процесс изменения существующего на данный момент (или в данной точке) положения либо состояния физической системы.
Примеры физических явлений: диффузия, отражение света, испарение влаги, горение газа, электризация.
3. Физическим законом называется устойчивая взаимосвязь между физическими величинами, явлениями, состояниями тел, установленная эмпирически (опытным путем) и выраженная в виде математической формулы либо словесной формулировки.
Примеры физических законов: закон Архимеда, Ома, законы Ньютона, закон Бойля-Мариотта.
4. Единицы измерения физических величин
Любая величина характеризуется собственной единицей измерения.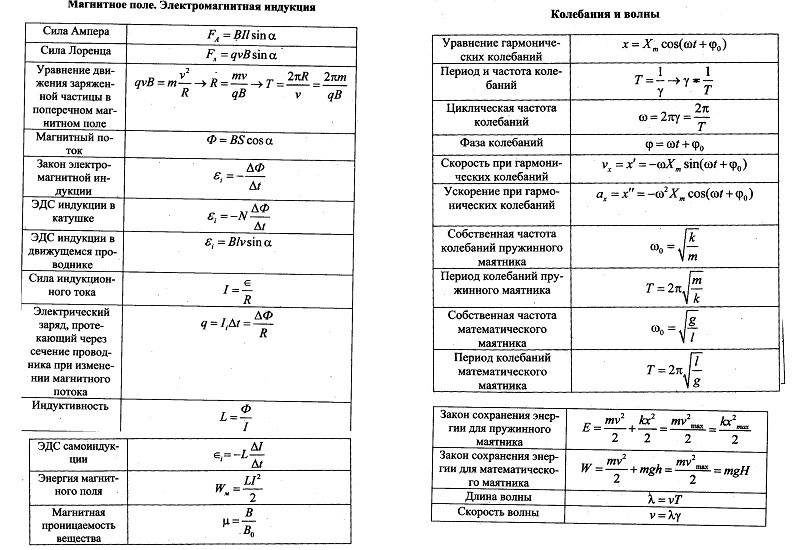 Единица .измерения позволяет определить ее количественное значение и соотнести его с проявлениями физической величины в других объектах и процессах. Как правило, единицы измерения производных физических величин представлены через единицы основных и других производных.
Единица .измерения позволяет определить ее количественное значение и соотнести его с проявлениями физической величины в других объектах и процессах. Как правило, единицы измерения производных физических величин представлены через единицы основных и других производных.
Основные физические величины и единицы их измерения (в СИ):
- длина, перемещение, координата,высота,путь – метр (м),
- скорость – метр в сек. (м/с),
- ускорение – (м/с2),
- время, период колебаний – секунда (с),
- частота колебаний – Герц (Гц),
- масса – килограмм (кг),
- сила – Ньютон (Н),
- импульс – килограмм-метр в сек. (кг·м/с),
- работа (механическая, силы тока и т.д.), энергия, количество теплоты – Джоуль (Дж),
- мощность – Ватт (Вт),
- плотность вещества – килограмм на метр кубический (кг/м3),
- давление – Паскаль (Па),
- температура – Кельвин (К), «градус Цельсия» (0С),
- электрический заряд – Кулон (Кл),
- напряженность – вольт на метр (В/м),
- сила тока – Ампер (А),
- потенциал, напряжение – Вольт (В).

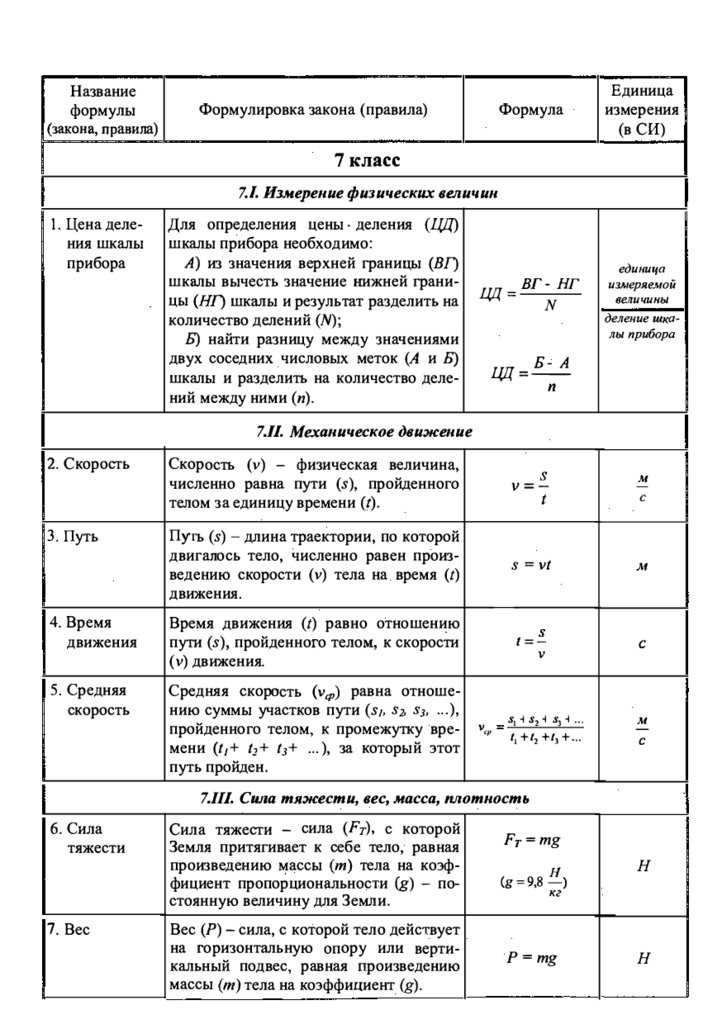
5. Приборы для измерения физических величин
Они представляют собой устройства для определения количественных значения тех или иных физических величин. Приборы могут быть различными по сложности своего устройства – от простейших (линейка, рычажные весы) до более или менее сложных (барометр, вольтметр). Основные измерительные приборы и величины, измеряемые ими:
- спидометр – скорость,
- динамометр – сила в механике,
- термометр – температура,
- манометр – давление газа или жидкости внутри сосуда,
- барометр – атмосферное давление,
- гигрометр – влажность воздуха,
- ареометр – плотность веществ,
- мензурка – объем жидкостей,
- амперметр – сила тока,
- электрометр – электрический потенциал,
- вольтметр – электрическое напряжение (разность потенциалов),
- омметр – электрическое сопротивление.
6. Физическое тело
Телом в физике считается материальный объект, отделенный конкретными собственными границами от других тел и характеризующийся а) конкретным объемом, б) постоянной массой, в) формой (обычно – простой).
Примеры физических тел: автомобиль, человек, Луна, здание.
скачать опору №1 в формате pdf
9 класс – Блок 3 – Периодическая таблица, формулы и уравнения
Доктор Судзуки IGCSE Химия
В этом разделе учащиеся будут изучать закономерности, встречающиеся в Периодической таблице, и использовать их для прогнозирования поведения элементов и свойств соединений, которые они образуют. Они будут использовать свои знания об атомной структуре, чтобы вывести формулы химических веществ. Студенты также получат опыт написания сбалансированных химических уравнений для простых химических реакций. Теория будет проиллюстрирована серией практических занятий.
SMEO
Тщательное наблюдение и распознавание моделей поведения позволяет нам делать прогнозы о поведении в мире природы
C4.
 Стехиометрия
Стехиометрия- Используйте символы элементов для написания формул простых соединений
- Выведите формулу простого соединения из относительного числа присутствующих атомов
- Вывести формулу простого соединения из модели или диаграммы
- Составление и использование словесных уравнений
- Дополнение: определите формулу ионного соединения по зарядам присутствующих ионов Дополнение
- : Построение и использование символьных уравнений с символами состояния
- : Выведите сбалансированное уравнение для химической реакции, учитывая соответствующую информацию.
С9. Периодическая таблица
- Опишите, как Периодическая таблица классифицирует элементы в порядке протонного числа Дополнение
- : используйте периодическую таблицу для предсказания свойств элементов с помощью групп и периодов .
C9.1 Периодические тренды
- Описать переход от металлического к неметаллическому характеру в течение периода Приложение
- : Опишите взаимосвязь между номером группы, количеством электронов внешней оболочки (валентности) и металлическим/неметаллическим характером .

C9.2 Групповые свойства
- Опишите литий, натрий и калий в Группе I как совокупность относительно мягких металлов, демонстрирующих тенденцию изменения температуры плавления и реакции с водой
- Опишите тенденции изменения свойств хлора, брома и йода в группе VII, включая цвет, физическое состояние и реакции с другими ионами галогенидов
- Дополнение: прогнозировать свойства других элементов в группе I, учитывая данные, где это уместно
- Дополнение: предскажите свойства других элементов в группе VII, учитывая данные, где это необходимо
C9.3 Переходные элементы
- Опишите переходные элементы как совокупность металлов, имеющих высокую плотность, высокую температуру плавления и образующих окрашенные соединения, которые, как элементы и соединения, часто действуют как катализаторы.
C9.4 Благородные газы
- Описать инертные газы как нереакционноспособные Приложение
- : Опишите использование инертных газов для создания инертной атмосферы, например, аргона в лампах, гелия для наполнения воздушных шаров.

Атомы и молекулы, класс 9
Главная » Класс 9 » Атомы и молекулы » Ионы
Последнее обновление Г-жа Шилпи Нагпал
Вопрос 1 Что такое ионы?
Вопрос 2 Как образуется ион?
Вопрос 3 Как образуется катион. Приведите пример?
Вопрос 4 Как образуется анион. Приведите пример?
Вопрос 5 Что такое простые ионы. Приведите пример?
Вопрос 6 Что такое комплексные ионы. Приведите пример?
Вопрос 7 Что такое ионные соединения?
Вопрос 8 Определите формульную единицу ионного соединения?
Вопрос 9 Рассчитайте формулу массы хлорида кальция и карбоната натрия?
Contents
- 1 Ions
- 2 There are two types of Ions
- 2.1 (1) Cation
- 2.2 (2) Anion
- 3 Simple Ions
- 4 Polyatomic Ions
- 5 Ionic compounds
- 6 Формула Единица
- 7 Формула Масса
Атом содержит электроны, протоны и нейтроны.
Электрон имеет 1 единицу отрицательного заряда.
Протон имеет 1 единицу положительного заряда.
Нейтрон не имеет заряда.
Атом содержит равное количество отрицательного и положительного заряда, что делает его стабильным.
(1) Если в атоме меньше электронов, чем обычно, то он получает положительный заряд.
(2) Если в атоме больше электронов, чем обычно, то он получает отрицательный заряд.
Ион представляет собой положительно или отрицательно заряженный атом, группу или атом.
Например: ион натрия, ион магния, хлорид-ион, оксид-ион и т. д.
Существует два типа ионов (1) Катион
Положительно заряженный ион известен как катион. Катион образуется в результате потери атомом одного или нескольких электронов.
Катион образуется путем удаления электронов из атома, поэтому катион содержит меньше электронов, чем обычный атом.
Из-за того, что протонов больше, чем электронов, катион имеет положительный заряд.
Все атомы металлов могут легко терять электроны, поэтому все металлические элементы образуют катионы.
(а) Если атом теряет 1 электрон, то образовавшийся катион имеет 1 единицу положительного заряда.
(б) Если атом теряет 2 электрона, то образовавшийся катион имеет 2 единицы положительного заряда.
(c) Если атом теряет 3 электрона, то образовавшийся катион имеет 3 единицы положительного заряда.
Например: ион натрия, ион магния, ион алюминия и т. д.
(2) АнионОтрицательно заряженный ион известен как анион. Анион образуется в результате приобретения атомом одного или нескольких электронов.
Анион образуется в результате присоединения одного или нескольких электронов к атому.
, поскольку анион образуется путем присоединения электрона к атому, поэтому анион содержит больше электронов, чем обычно.
Из-за того, что электронов больше, чем протонов, анион имеет отрицательный заряд.
(a) Если атом получает 1 электрон, то образовавшийся анион имеет 1 единицу отрицательного заряда.
(b) Если атом получает 2 электрона, то образовавшийся анион имеет 2 единицы отрицательного заряда.
(c) Если атом получает 3 электрона, то образовавшийся анион имеет 3 единицы отрицательного заряда.
Например: хлорид-ион, оксид-ион, нитрид-ион и т. д.
Простые ионыТе ионы, которые образуются из отдельных атомов, называются простыми ионами. Их также называют одноатомными ионами .
Например: ион натрия, хлорид-ион, ион магния, ион алюминия, оксид-ион и т. д.
Многоатомные ионыТе ионы, которые образуются из групп соединенных атомов, называются многоатомными ионами.
Например: ион аммония, карбонат-ион, сульфат-ион и т. д.
Ионные соединенияСоединения, состоящие из ионов, называются ионными соединениями.
В ионном соединении положительно заряженный ион (катион) и отрицательно заряженный ион (анион) удерживаются вместе сильными электростатическими силами притяжения.
Силы, удерживающие их вместе, называются ионными связями или электровалентными связями.
Например: хлорид натрия (NaCl) представляет собой ионное соединение, состоящее из равного количества положительно заряженных ионов натрия и отрицательно заряженных ионов хлорида.
Хлорид алюминия, хлорид кальция, нитрат калия, карбонат кальция и т. д.
Формульная единицаИонное соединение состоит из чрезвычайно большого числа положительно заряженных ионов и отрицательно заряженных ионов, соединенных вместе.
Простая комбинация ионов, образующая электрически нейтральную единицу, называется формульной единицей ионного соединения.
Масса формулыМасса формулы ионного соединения представляет собой относительную массу его формульной единицы по сравнению с массой атома углерода-12, принятой за 12 единиц.
Масса формулы представляет собой сумму атомных масс атомов или ионов, представленных формулой.