Таблица Менделеева шпора по химии
РАСТВОРИМОСТЬ НЕКОТОРЫХ ВЕЩЕСТВ В ВОДЕ (ПРИ t F 0 B 0=25 F 0 B 0C)И ИХ МОЛЕКУЛЯРНЫЕ МАССЫ Катионы H+ NH 4 + Li + Rb + K + Ba 2 + Sr 2 + Ca 2 + Na + Mg 2 + Be 2 + Al 3 + Mn 2 + Zn 2 + Cr 2 + Cr 3 + Fe 2 + Fe 3 + Cd 2 + Co 2 + Co 3 + Ni 2 + Sn 2 + Pb 2 + Cu 2 + Ag + Hg 2 + Анионы OH – ГИДРОКСИД 18 35 24 102 56 171 122 74 40 58 43 78 89 99 86 103 90 107 146 93 110 93 153 241 98 125 235 F – ФТОРИД 20 37 26 104 58 175 126 78 42 62 47 83 93 103 90 109 94 113 150 97 116 97 157 245 102 127 238 Cl – ХЛОРИД 36 53 42 121 74 208 159 111 58 95 80 133 126 136 123 158 127 162 183 130 165 130 190 278 134 143 272 Br – БРОМИД 81 98 87 165 119 297 247 200 103 184 169 267 215 225 212 292 216 296 272 219 299 219 279 367 223 188 360 I – ЙОДИД 128 145 134 212 166 391 341 294 150 278 263 408 309 319 306 433 310 ? 366 313 440 313 373 461 317 235 454 S 2- СУЛЬФИД 34 68 46 203 110 169 120 72 78 56 41 150 87 97 84 200 88 208 144 91 214 91 151 239 96 248 233 SO42- СУЛЬФАТ 98 132 110 267 174 233 184 136 142 120 105 342 151 161 148 392 152 400 208 155 406 155 215 303 160 312 297 HSO42- ГИДРОСУЛЬФАТ 98 115 104 182 136 ? 282 ? 120 ? ? ? 249 259 ? ? ? ? ? ? ? ? ? 401 ? 205 ? SO32- СУЛЬФИТ 82 116 94 251 158 217 168 120 126 104 89 294 135 145 ? 344 136 ? 192 139 ? 139 199 287 144 296 281 ClO4- ПЕРХЛОРАТ 100 117 106 185 138 336 287 239 122 223 208 325 254 264 251 350 255 354 311 258 357 258 ? 406 262 207 400 ClO3- ХЛОРАТ 84 101 90 169 122 304 255 207 106 191 176 277 222 232 ? 302 ? ? 279 226 ? 226 ? 374 230 191 368 NO3- НИТРАТ 63 80 69 147 101 261 212 164 85 148 133 213 179 189 ? 238 180 242 236 183 245 183 243 331 188 170 325 NO2- НИТРИТ 47 64 53 131 85 229 180 132 69 116 101 ? 147 157 ? ? ? ? ? 151 ? 151 ? 299 156 154 293 PO43- ФОСФАТ 98 149 116 351 212 602 453 310 164 263 217 122 355 386 346 147 357 151 527 367 ? 366 546 812 381 419 792 HPO42- ГИДРОФОСФАТ 98 132 ? 267 174 233 184 136 142 120 105 342 151 161 ? 392 152 ? ? ? ? ? 215 303 160 312 297 h3PO4- ДИГИДРОФОСФАТ 98 115 104 182 136 331 282 234 120 218 203 318 249 259 ? ? 250 ? 306 ? ? ? 313 401 ? 205 395 Сh4COO- АЦЕТАТ 60 77 66 144 98 255 206 158 82 142 127 204 173 183 170 229 174 233 230 177 236 177 237 325 182 167 319 Cr2O72- ДИХРОМАТ 218 252 230 387 294 353 304 256 262 240 225 ? ? ? ? ? 272 760 ? ? ? ? 335 423 280 432 417 CrO42- ХРОМАТ 118 152 130 287 194 253 204 156 162 140 125 ? 171 181 ? ? ? 460 228 175 ? 175 235 323 180 332 317 MnO4- ПЕРМАНГАНАТ 120 137 126 204 158 375 326 278 142 262 247 384 ? 303 ? ? ? ? 350 ? ? 297 ? ? ? 227 ? CO32- КАРБОНАТ 62 96 74 231 138 197 148 100 106 84 69 ? 115 125 112 284 116 ? 172 119 298 119 ? 267 124 276 261 HCO3- ГИДРОКАРБОНАТ 62 79 68 146 100 259 210 162 84 146 ? ? ? 187 174 235 178 ? 234 ? ? 181 ? 329 ? 169 ? SiO32- МЕТАСИЛИКАТ 78 ? 90 247 154 213 164 116 122 100 85 ? 131 141 ? ? 132 ? 189 ? ? ? 195 283 ? 292 277 МОЛЕКУЛЯРНЫЕ МАССЫ ОРГАНИЧЕСКИХ ВЕЩЕСТВ РАСТВОРЯЕТСЯ (>1 г. на 100г воды) НЕ РАСТВОРЯЕТСЯ (<0.1г на 100 г воды) МАЛО РАСТВОРЯЕТСЯ (от 0.1г до 1г на 100г воды) РАДИКАЛ Ы ФУНКЦИОНАЛЬНЫЕ ГРУППЫ РАЗЛАГАЕТСЯ В ВОДЕ / НЕТ ДАННЫХ О РАСТВОРИМОСТИ ? НЕТ ДАННЫХ О ВЕЩЕСТВЕ -H -Cl -Br -OH -N02 – Nh3 CH O CO OH C6H 5 Ch4 Мети л 16 50 95 32 61 31 44 60 92 РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ЭЛЕМЕНТОВ C 2H5 Этил 30 65 109 46 75 45 58 74 106 ЭЛ- ТЫ C s K B a S r N a C a Li MgC d A g Z n C u B e H g A l P b S n A u Si B A s P H C r S Mn C I B r N C l O F C 3H7 Проп ил 44 79 123 60 89 59 72 88 120 F 0 6 3 0. 63 0. 69 0. 72 0. 8 0. 82 0. 86 0. 86 1. 08 1. 22 1. 28 1. 29 1. 29 1. 31 1. 35 1. 43 1. 57 1. 63 1. 66 1. 82 1. 86 1. 92 1. 98 2. 07 2. 27 2. 41 2. 45 2. 5 2. 58 2. 6 2. 82 2. 86 4. 08 4.97 C 4H9 Бути л 58 93 137 74 103 73 86 102 134 Взаимодействие металлов с кислотами F 0 6 3-относительные величины электроотрицательности по А.С. Поваренных Кислоты Металлы Результат Ch3C H Вини л 28 63 107 73 43 56 72 104 HCl, h3SO4 (разб.), h4PO4 (разб.) До Н2 соль + h3 ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ ОРБИТАЛЕЙ АТОМОВ ЭЛЕМЕНТА C 6H5 Фени л 78 113 157 94 123 93 106 122 154 h3SO4 (конц.
на 100г воды) НЕ РАСТВОРЯЕТСЯ (<0.1г на 100 г воды) МАЛО РАСТВОРЯЕТСЯ (от 0.1г до 1г на 100г воды) РАДИКАЛ Ы ФУНКЦИОНАЛЬНЫЕ ГРУППЫ РАЗЛАГАЕТСЯ В ВОДЕ / НЕТ ДАННЫХ О РАСТВОРИМОСТИ ? НЕТ ДАННЫХ О ВЕЩЕСТВЕ -H -Cl -Br -OH -N02 – Nh3 CH O CO OH C6H 5 Ch4 Мети л 16 50 95 32 61 31 44 60 92 РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ЭЛЕМЕНТОВ C 2H5 Этил 30 65 109 46 75 45 58 74 106 ЭЛ- ТЫ C s K B a S r N a C a Li MgC d A g Z n C u B e H g A l P b S n A u Si B A s P H C r S Mn C I B r N C l O F C 3H7 Проп ил 44 79 123 60 89 59 72 88 120 F 0 6 3 0. 63 0. 69 0. 72 0. 8 0. 82 0. 86 0. 86 1. 08 1. 22 1. 28 1. 29 1. 29 1. 31 1. 35 1. 43 1. 57 1. 63 1. 66 1. 82 1. 86 1. 92 1. 98 2. 07 2. 27 2. 41 2. 45 2. 5 2. 58 2. 6 2. 82 2. 86 4. 08 4.97 C 4H9 Бути л 58 93 137 74 103 73 86 102 134 Взаимодействие металлов с кислотами F 0 6 3-относительные величины электроотрицательности по А.С. Поваренных Кислоты Металлы Результат Ch3C H Вини л 28 63 107 73 43 56 72 104 HCl, h3SO4 (разб.), h4PO4 (разб.) До Н2 соль + h3 ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ ОРБИТАЛЕЙ АТОМОВ ЭЛЕМЕНТА C 6H5 Фени л 78 113 157 94 123 93 106 122 154 h3SO4 (конц. ) Кроме Al, Cr, Fe (холод), Pt, Au соль + h3O + SO2 F 0 A DПЕРИ- ОД 1 2 3 4 5 6 7 Ch4C O Ацет ил 44 78 123 60 89 59 72 88 120 HNO 3 Кроме Al, Cr, Fe (холод), Pt, Au соль + h3O + ? (см. табл. HNO3) ОРБИ- ТАЛЬ 1s 2s,2p 3s,3p 4s,3d,3p 5s,4d ,5p 6s,4f,5d ,6s 7s,5f,6d,7 p ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb h3 Cu Ag Hg Pt Au Me + h3O = MeOH + h3 F 0 A D Me + h3O = MeO + h3 F 0 A D Me + h3O F 0 B 9 F 0 A EОслабление восстановительных свойств, активности F 0 A E HNO 3 Me до H Me после H Порядкового номера: Номера группы: Физический смысл. указывает на заряд ядра и число электронов в атоме. указывает на высшую положительную степень окисления для всех элементов группы и на число электронов на внешнем энергетическом уровне для элементов главных подгрупп Разб. Nh5NO3 NO Конц . N2; N2O NO2 РЯД АКТИВНОСТИ КИСЛОТ (ПРИ 25 F 0 B 0 С) Формулы к-т HI HBr HClO4 HC l h3SO4 HMnO 4 HNO3 h3Cr2O 7 h3CrO4 h3SO3 h4PO4 HF HNO2 Ch4COOH h3CO3 h3S h4BO3 HCN h3SiO3 pKa= F 0 2 D lgKa -11 -9 -8 -7 -3 -2.
) Кроме Al, Cr, Fe (холод), Pt, Au соль + h3O + SO2 F 0 A DПЕРИ- ОД 1 2 3 4 5 6 7 Ch4C O Ацет ил 44 78 123 60 89 59 72 88 120 HNO 3 Кроме Al, Cr, Fe (холод), Pt, Au соль + h3O + ? (см. табл. HNO3) ОРБИ- ТАЛЬ 1s 2s,2p 3s,3p 4s,3d,3p 5s,4d ,5p 6s,4f,5d ,6s 7s,5f,6d,7 p ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb h3 Cu Ag Hg Pt Au Me + h3O = MeOH + h3 F 0 A D Me + h3O = MeO + h3 F 0 A D Me + h3O F 0 B 9 F 0 A EОслабление восстановительных свойств, активности F 0 A E HNO 3 Me до H Me после H Порядкового номера: Номера группы: Физический смысл. указывает на заряд ядра и число электронов в атоме. указывает на высшую положительную степень окисления для всех элементов группы и на число электронов на внешнем энергетическом уровне для элементов главных подгрупп Разб. Nh5NO3 NO Конц . N2; N2O NO2 РЯД АКТИВНОСТИ КИСЛОТ (ПРИ 25 F 0 B 0 С) Формулы к-т HI HBr HClO4 HC l h3SO4 HMnO 4 HNO3 h3Cr2O 7 h3CrO4 h3SO3 h4PO4 HF HNO2 Ch4COOH h3CO3 h3S h4BO3 HCN h3SiO3 pKa= F 0 2 D lgKa -11 -9 -8 -7 -3 -2.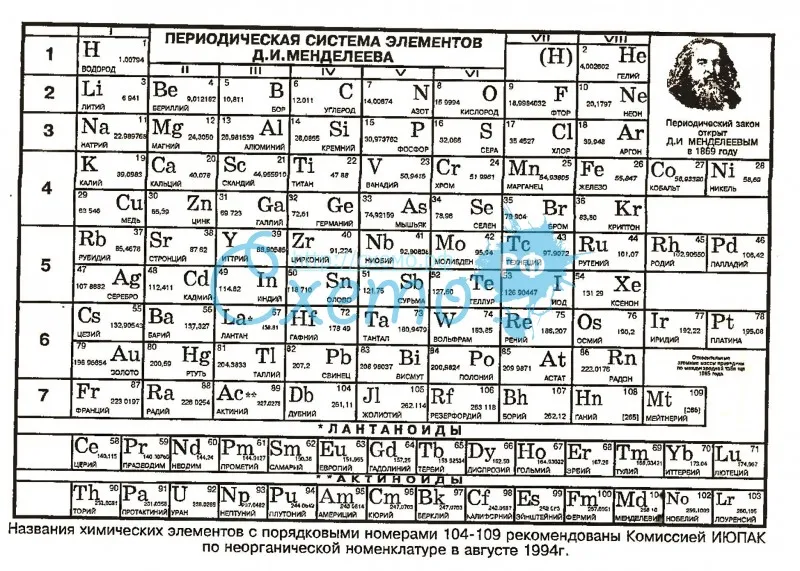 3 -1.6 0.5 0.74 1.8 2.1 3.2 3.4 4.75 6.4 7.0 9.2 9.3 9.9 Сила кислот Сильные Средние Слабые Очень слабые
3 -1.6 0.5 0.74 1.8 2.1 3.2 3.4 4.75 6.4 7.0 9.2 9.3 9.9 Сила кислот Сильные Средние Слабые Очень слабые
Шпаргалка – Таблица Менделеева в Картинках
{“items”:[“5f5cead1377898001753d80d”,”6000b69d187ce10017730671″],”styles”:{“galleryType”:”Strips”,”groupSize”:1,”showArrows”:true,”cubeImages”:true,”cubeType”:”fill”,”cubeRatio”:”100%/100%”,”isVertical”:false,”gallerySize”:30,”collageDensity”:0.8,”groupTypes”:”1″,”oneRow”:true,”imageMargin”:0,”galleryMargin”:0,”scatter”:0,”rotatingScatter”:””,”chooseBestGroup”:true,”smartCrop”:false,”hasThumbnails”:false,”enableScroll”:true,”isGrid”:false,”isSlider”:false,”isColumns”:false,”isSlideshow”:true,”cropOnlyFill”:false,”fixedColumns”:1,”enableInfiniteScroll”:true,”isRTL”:false,”minItemSize”:120,”rotatingGroupTypes”:””,”rotatingCropRatios”:””,”columnWidths”:””,”gallerySliderImageRatio”:1.7777777777777777,”numberOfImagesPerRow”:3,”numberOfImagesPerCol”:1,”groupsPerStrip”:0,”borderRadius”:0,”boxShadow”:0,”gridStyle”:0,”mobilePanorama”:false,”placeGroupsLtr”:false,”viewMode”:”preview”,”thumbnailSpacings”:4,”galleryThumbnailsAlignment”:”bottom”,”isMasonry”:false,”isAutoSlideshow”:true,”slideshowLoop”:false,”autoSlideshowInterval”:3,”bottomInfoHeight”:0,”titlePlacement”:”SHOW_ON_HOVER”,”galleryTextAlign”:”center”,”scrollSnap”:true,”itemClick”:”nothing”,”fullscreen”:true,”videoPlay”:”hover”,”scrollAnimation”:”NO_EFFECT”,”slideAnimation”:”SCROLL”,”scrollDirection”:1,”scrollDuration”:400,”overlayAnimation”:”FADE_IN”,”arrowsPosition”:0,”arrowsSize”:18,”watermarkOpacity”:40,”watermarkSize”:40,”useWatermark”:true,”watermarkDock”:{“top”:”auto”,”left”:”auto”,”right”:0,”bottom”:0,”transform”:”translate3d(0,0,0)”},”loadMoreAmount”:”all”,”defaultShowInfoExpand”:1,”allowLinkExpand”:true,”expandInfoPosition”:0,”allowFullscreenExpand”:true,”fullscreenLoop”:false,”galleryAlignExpand”:”left”,”addToCartBorderWidth”:1,”addToCartButtonText”:””,”slideshowInfoSize”:160,”playButtonForAutoSlideShow”:false,”allowSlideshowCounter”:false,”hoveringBehaviour”:”NEVER_SHOW”,”thumbnailSize”:120,”magicLayoutSeed”:1,”imageHoverAnimation”:”NO_EFFECT”,”imagePlacementAnimation”:”NO_EFFECT”,”calculateTextBoxWidthMode”:”PERCENT”,”textBoxHeight”:0,”textBoxWidth”:200,”textBoxWidthPercent”:50,”textImageSpace”:10,”textBoxBorderRadius”:0,”textBoxBorderWidth”:0,”loadMoreButtonText”:””,”loadMoreButtonBorderWidth”:1,”loadMoreButtonBorderRadius”:0,”imageInfoType”:”ATTACHED_BACKGROUND”,”itemBorderWidth”:0,”itemBorderRadius”:0,”itemEnableShadow”:false,”itemShadowBlur”:20,”itemShadowDirection”:135,”itemShadowSize”:10,”imageLoadingMode”:”BLUR”,”expandAnimation”:”NO_EFFECT”,”imageQuality”:90,”usmToggle”:false,”usm_a”:0,”usm_r”:0,”usm_t”:0,”videoSound”:false,”videoSpeed”:”1″,”videoLoop”:true,”jsonStyleParams”:””,”gallerySizeType”:”px”,”gallerySizePx”:326,”allowTitle”:true,”allowContextMenu”:true,”textsHorizontalPadding”:-30,”showVideoPlayButton”:true,”galleryLayout”:5,”arrowsColor”:”rgba(0,0,0,1)”,”targetItemSize”:326,”selectedLayout”:”5|bottom|1|fill|false|1|true”,”layoutsVersion”:2,”selectedLayoutV2″:5,”isSlideshowFont”:true,”externalInfoHeight”:0,”externalInfoWidth”:0},”container”:{“width”:324,”height”:344,”galleryWidth”:324,”galleryHeight”:183,”scrollBase”:0}}
| Оксиды. Соли. Кислоты. Классификация, свойства, получение. Ряд напряжений металлов. Гидролиз. | Основания. Классификация, свойства, получение. Электролитическая диссоциация. Таблица растворимости кислот, оснований и солей. | Строение атома, периодическая система Менделлева, таблица Менделеева. | Химическая связь. Ионная, ковалентная, металлическая, водородная химические связи. Классификация химических реакций. Реакции – ионного обмена, окислительно-восстановительные, термохимические, обратимые и необратимые. |
Органическая химия. Гибридизация. Химические связи в органических веществах, их характеристики. Типы химических реакций – замещение, присоединение, отщепление (элиминирование), перегруппировка (изомеризация), окисления и восстановления. |
|||
| Растворимость оснований, кислот и солей в воде. Относительные молекулярные массы неорганических солей, оснований, кислот, оксидов. Относительные молекулярные массы органических веществ. Ряд электроотрицательностей. Ряд анионов | Классификация химических реакций по типам и видам | Периодический закон в современной формулировке. Периодическая система. Физический смысл периодического закона. Структура. | |
| Строение вещества. Ядерная модель строения атома. Состояние электрона в атоме. Заполнение электронами орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда | Важнейшие классы неорганических веществ.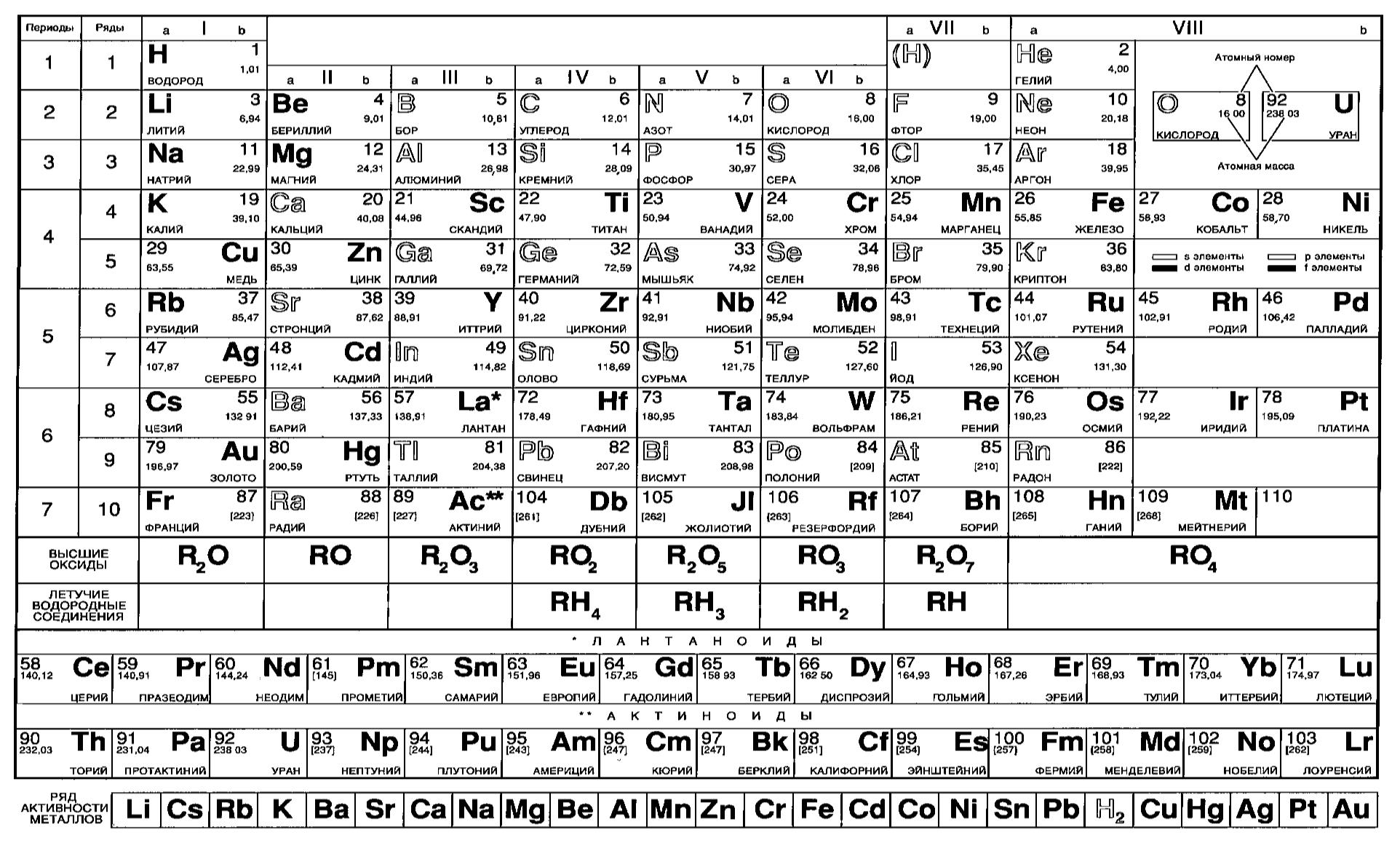 Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. Оксиды. Гидроксиды. Соли. Кислоты, основания, амфотерные вещества. Важнейшие кислоты и их соли. Генетическая связь важнейших классов неорганических веществ. |
||
| Химия металлов. Щелочные металлы. Элементы IIА группы. Алюминий. Железо | Химия неметаллов. Галогены. Сера. Азот. Углерод. Инертные газы | Закономерности течения химических реакций | – – – – – – – – – |
| – – – – – – – – – | |||
| Химическая связь. Понятия.Правило октета. Металлы и неметаллы. Гибридизация электронных орбиталей. Валентные электроны, понятие валентности, понятие электроотрицательности. | Виды химической связи. Ковалентная связь (механизмы образования, характеристики, полярная, неполярная. Ионная связь. Степень окисления. Металлическая связь. Водородная связь | ||
|
Растворы. |
Реакции в растворах электролитов + Окислительно-восстановительные реакции. (Реакции ионного обмена. Образование малорастворимого вещества. Образование газообразного вещества. Образование малодиссоциирующего вещества. Гидролиз водных растворов солей. Окислитель. Восстановитель.) | ||
|
Важнейшие производные углеводородов: спирты, фенолы, карбонильные соединения, карбоновые кислоты, амины, аминокислоты |
– – – – – – – – – | ||
| – – – – – – – – – | |||
Библиотеки города Канаш провели мероприятия, посвященные 185-летию со дня рождения Д.
 И. Менделеева
И. МенделееваНациональная библиотека Чувашской Республики 8 февраля 2019 года проводит единый день химических знаний, посвященный 185-летию со дня рождения Д.И. Менделеева и 150-летию Периодической таблицы химических элементов. В этот день библиотеки ЦБС г. Канаша также провели мероприятия, направленные на повышение научной грамотности, расширение научного кругозора населения, особенно учащейся молодежи.
Так, в Центральной библиотеке для учащихся 8 класса школы №8 состоялась выставка-обзор «Д.И. Менделеев – великий ученый и патриот». Библиотекарь К.Г. Павлова рассказала увлекательные факты из жизни ученого, провела обзор книжно-иллюстративной выставки «Великий сын России», продемонстрировала познавательную презентацию «Гений и гражданин» о передовых идеях и научных трудах Д. Менделеева, в течение многих десятилетий способствующих прогрессу науки.
В краеведческой библиотеке с восьмиклассниками школы №11 состоялась Заведующая библиотекой Федорова В.В. рассказала об открытиях великих русских ученых Э.К. Циолковском, И.В. Курчатове, С.П. Королеве, о жизни и деятельности учёного-энциклопедиста, профессора, члена-корреспондента Д.И. Менделеева. Ребята узнали о Дмитрии Ивановиче, как о разностороннем ученом, о его достижениях не только в области химии, но и других наук. Юных знатоков также увлекла игра-викторина «Великое имя Менделеев» с заданиями о биографии и открытиях ученого, о химических элементах по описанию и расшифровкой названий элементов. Например: «Не всё то аурум, что блестит», «Много оксида водорода утекло с тех пор». Лучшими знатоками химии оказались С. Романов, Н. Александров и О. Терентьев. К мероприятию организована выставка «Наука – дорога в будущее».
Заведующая библиотекой Федорова В.В. рассказала об открытиях великих русских ученых Э.К. Циолковском, И.В. Курчатове, С.П. Королеве, о жизни и деятельности учёного-энциклопедиста, профессора, члена-корреспондента Д.И. Менделеева. Ребята узнали о Дмитрии Ивановиче, как о разностороннем ученом, о его достижениях не только в области химии, но и других наук. Юных знатоков также увлекла игра-викторина «Великое имя Менделеев» с заданиями о биографии и открытиях ученого, о химических элементах по описанию и расшифровкой названий элементов. Например: «Не всё то аурум, что блестит», «Много оксида водорода утекло с тех пор». Лучшими знатоками химии оказались С. Романов, Н. Александров и О. Терентьев. К мероприятию организована выставка «Наука – дорога в будущее».
В филиале № 2 – библиотеке семейного чтения для студентов Канашского строительного техникума прошел тематический час «Ученый, химик, путешественник». Из рассказа заведующей библиотекой Тимофеевой Е.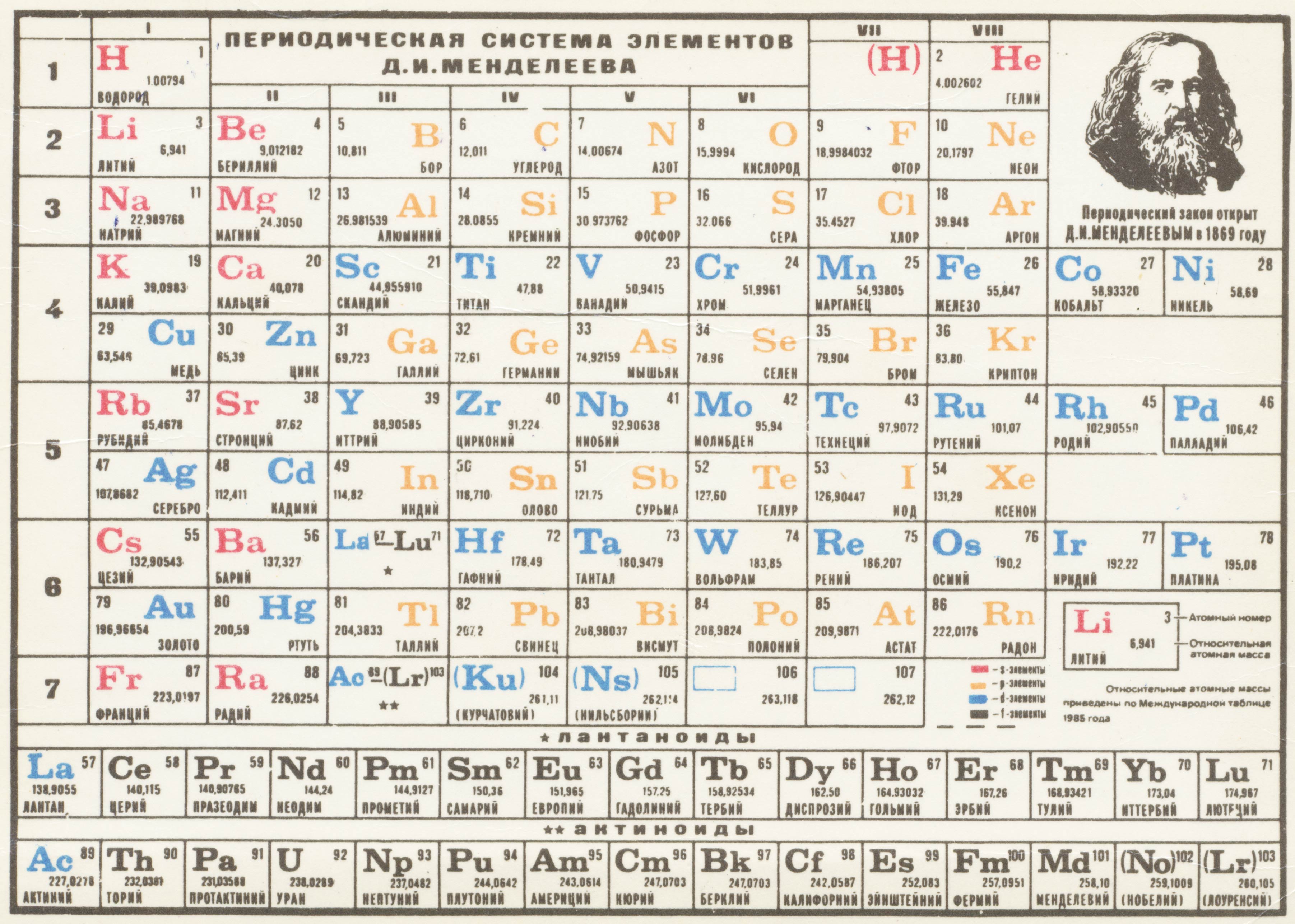 Н. студенты узнали о жизни Д.И. Менделеева и о его разносторонних научных интересах. Мероприятие завершилось просмотром видеоролика «История создания периодической таблицы» и обзором книг с выставки «Главная «шпаргалка» химиков».
Н. студенты узнали о жизни Д.И. Менделеева и о его разносторонних научных интересах. Мероприятие завершилось просмотром видеоролика «История создания периодической таблицы» и обзором книг с выставки «Главная «шпаргалка» химиков».
Сотрудники филиала №3 – библиотеки семейного чтения в школе №6 с учащимися 8-х классов провели химический вечер «Менделеевская пятница». Заведующая филиалом Г.Н. Игнатьева рассказала об основных этапах жизни и научной деятельности Д.И. Менделеева, также продемонстрировала видеофильм «Таблица Менделеева». Учитель химии Ф.И. Голованова дополнила рассказ интересными фактами об открытиях ученого в области гидродинамики, метеорологии, геологии, химической промышленности, также о периодическом законе Д.И. Менделеева. Были продемонстрированы занимательные опыты «Кровь», «Вулкан» и «Химическое молоко», направленные на изучение различных свойств окружающих предметов. Мероприятие завершилось обзором книг о творчестве Д.И. Менделееве.
В филиале № 4 – библиотеке семейного чтения для учащихся 9 класса школы №3 прошла квест-игра «Таблица Менделеева в литературе».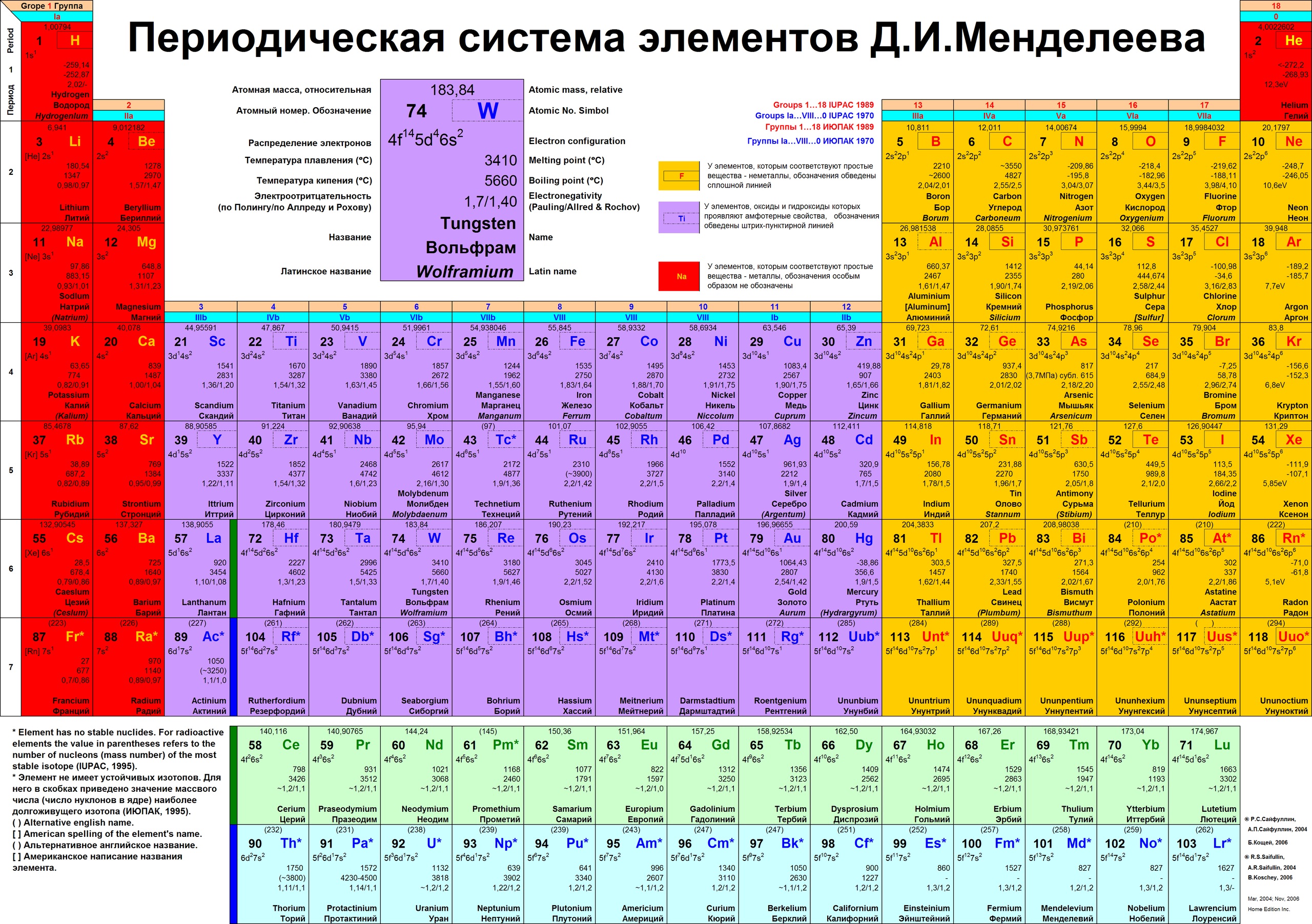 Заведующая библиотекой Каргина С.А., используя презентацию и материалы выставки – портрета «Гений мировой науки», рассказала старшеклассникам о жизни и научных достижениях выдающегося русского учёного Д.И. Менделеева. Далее школьники приняли участие в квест – игре, маршрут которой проходил по лабораториям: «Металлы в ребусах», «Металлы в истории», «Убери лишнее», «Химия в пословицах», «Химические ошибки в литературных произведениях». Завершилась игра чтением стихотворения поэта С. Щипачева «Читая Менделеева».
Заведующая библиотекой Каргина С.А., используя презентацию и материалы выставки – портрета «Гений мировой науки», рассказала старшеклассникам о жизни и научных достижениях выдающегося русского учёного Д.И. Менделеева. Далее школьники приняли участие в квест – игре, маршрут которой проходил по лабораториям: «Металлы в ребусах», «Металлы в истории», «Убери лишнее», «Химия в пословицах», «Химические ошибки в литературных произведениях». Завершилась игра чтением стихотворения поэта С. Щипачева «Читая Менделеева».
Как подготовиться к ЕГЭ по химии?
К ЕГЭ по химии нужно начинать готовиться заблаговременно, хотя бы за год, а лучше за два. Так вы успеете разобраться во всех темах, понять формулы и таблицу растворимости. Для того, чтобы не упустить ничего важного, рекомендуем подобрать подходящие учебники с актуальными материалами и придерживаться последовательного плана..jpg) В настоящей статье дадим еще несколько полезных рекомендаций по подготовке.
В настоящей статье дадим еще несколько полезных рекомендаций по подготовке.
1. Вам необходим человек, который сможет ответить на любой ваш вопрос
Возможно, это будет не репетитор, а ваш школьный педагог или студент химического факультета. Ваша задача – задавать любые вопросы, не стесняясь того, что они могут показаться простыми, и устранять провалы в знаниях, которые могут вскрыться в процессе подготовки. Не бойтесь спрашивать наставника обо всем, что непонятно, принимайте участие в обсуждениях различных сообществ по вашей теме и не комплексуйте, что в глазах других участников будете выглядеть не достаточно образованным.
2. Без математики химию не сдать
Да, на ЕГЭ по химии в вашем распоряжении будет непрограммируемый калькулятор, но освежить в памяти темы процентов и пропорций просто необходимо. А для решения задач выучите несколько основных формул:
-для расчёта массовой доли;
-массы вещества;
-объёма;
-количества вещества;
-плотности и выхода продукта.
Из них вы без труда можете вывести остальные формулы, так как они связаны друг с другом. Это вы поймете в процессе подготовки.
3. На ЕГЭ по химии в вашем распоряжении будет 3 легальных шпаргалки, и вам предстоит научиться в них разбираться
Шпаргалки будут такие:
-периодическая таблица Д.И. Менделеева;
-таблица растворимости;
-таблица напряжения металлов.
В данных шпаргалках примерно 65 % полезной информации для того, чтобы удачно сдать ЕГЭ. Оставшиеся 35 % – это ваше умение правильно и со знанием дела их использовать.
Изучение периодической таблицы Д.И. Менделеева следует начать с разбора свойств ее элементов:
-структура атомов;
-электроотрицательность;
-металлические, неметаллические, окислительно-восстановительные свойства;
-валентности;
-степени окисления.
Вам не нужно будет удерживать в памяти свойства каждого из элементов, стоит только посмотреть на таблицу и освежить знания периодического закона.
4. Таблица химических реакций – надежный помощник
В химии на самом деле очень много элементов, но все их легко упорядочить и привести к единой закономерности. Для этого вашим помощником станет таблица химических реакций. Она должна быть у вас в распечатанном виде и всегда на виду, когда вы дойдете до решения реакций и цепочек.
Как правильно пользоваться данной таблицей?
Вырабатывайте навык определения класса веществ, их различия и изучите типы реакций (оксиды, кислоты, соли, основания, металлы и неметаллы). Реакция происходит минимум с двумя элементами. Выясните, класс 1-го вещества и отыщите нужный пункт справа (или вверху) в таблице. То же сделайте и со 2-м элементом, а нужный вам пункт найдите в таблице сверху или справа.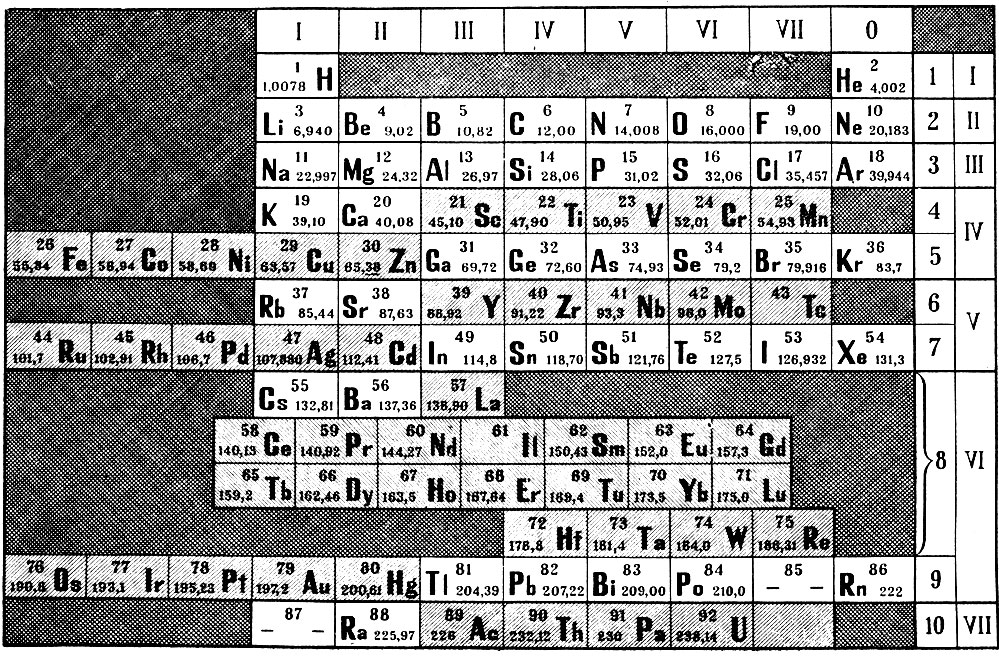
Ответ, который вы увидите на пересечении этих пунктов, будет результатом данной реакции.
К сожалению, данной таблицей на ЕГЭ по химии пользоваться запрещено. Но в ваших силах за время подготовки запомнить, как реагируют вещества друг с другом (это 70 % заданий экзамена).
5. Готовьтесь по книгам ФИПИ и начинайте с простого
Конечно, не так важно, какой учебник вы выберете себе в помощь для подготовки к экзамену. Главное, чтобы в нем были все экзаменационные темы и материал был изложен доступным языком. Тесты решайте по книгам ФИПИ, в них задания наиболее соответствуют тем, что будут на ЕГЭ, а также рекомендуем готовиться и проверять себя на их официальном сайте.
6. Не читайте ненужные статьи и литературу
Не увлекайтесь при подготовке к ЕГЭ по химии чтением источников узконаправленного характера. Так вы рискуете запутаться и не справиться с решением простейших заданий.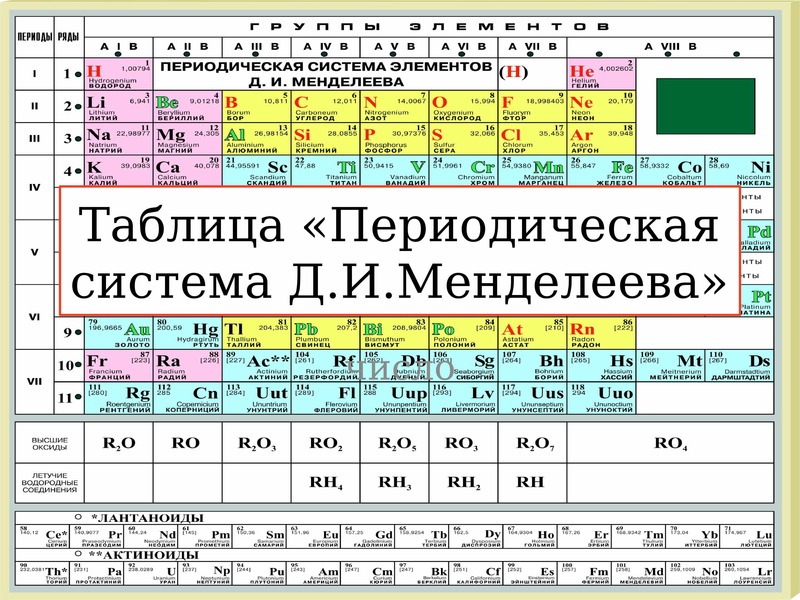 В вопросах экзамена заложены ответы только по школьной программе, поэтому не перемудрите, ведь чем ответ покажется вам проще, тем вероятнее он окажется правильным.
В вопросах экзамена заложены ответы только по школьной программе, поэтому не перемудрите, ведь чем ответ покажется вам проще, тем вероятнее он окажется правильным.
Не пугайтесь предстоящего ЕГЭ по химии, он только на первый взгляд вызывает тревогу. Но стоит начать разбираться, готовиться, выстроить четкую систему понятий и план подготовки, как станет все просто и понятно.
Желаем всем удачи на ЕГЭ!
Шпаргалка по периодической таблице
| Интернет-уроки химии
Шпаргалка по периодической таблице
Периодическая таблица
Периодическая таблица предназначена для классификации элементов в соответствии с их сходством по химическим и физическим свойствам. В этой таблице элементы упорядочены по возрастанию атомного номера. В периодической таблице вы можете увидеть атомный номер, имя, символ и массовое число элементов. Как видно из приведенного выше рисунка, горизонтальные строки называются периодом , а вертикальные столбцы называются группой .
Как видно из приведенного выше рисунка, горизонтальные строки называются периодом , а вертикальные столбцы называются группой .
Орбитали в периодической таблице
s блок: Этот блок содержит элементы, имеющие валентные электроны на s-орбитали. IA и IIA – это группы блоков.
p блок: Этот блок содержит элементы, имеющие валентные электроны на p-орбиталях. IIIA, IVA, VA, VIA, VIIA и VIII A представляют собой группы p-блоков.
d блок: Этот блок содержит элементы, имеющие валентные электроны на d-орбиталях. IIIB, IVB, VB, VIB, VIIB, VIIIB, IB и IIB представляют собой группы d-блока.
f блок: Этот блок содержит элементы, имеющие валентные электроны на f-орбиталях. Два элемента, упомянутые в блоке d (IIIB), и две строки, нарисованные внизу периодической таблицы, принадлежат блоку f.
Определение местоположения элементов в периодической таблице
а) Период обнаружения элементов:
Период элемента равен наивысшему уровню энергии электронов или главному квантовому числу.
16 S: 1s 2 2s 2 2p 6 3 s 2 3 p 4 3 – наивысший уровень энергии электронов или главное квантовое число.Таким образом, период S равен 3.
б) Поиск группы элементов:
Группа элементов равна количеству валентных электронов элемента или количеству электронов на самом высоком энергетическом уровне элементов. Другой способ найти группу элементов – это посмотреть на субоболочки. Если последней подоболочкой электронной конфигурации является «s» или «p», тогда группа становится A. Элементы в группе B имеют электронную конфигурацию нс и (n-1) d , общее количество электронов на этих орбиталях дает нам группа элемента.Взгляните на следующие примеры.
Периодические свойства элементов
1) Атомный радиус:
Атомный радиус элементов уменьшается, когда мы идем слева направо в периодической таблице. Напротив, в той же группе, когда мы идем сверху вниз, атомный радиус элементов увеличивается.
Напротив, в той же группе, когда мы идем сверху вниз, атомный радиус элементов увеличивается.
2) Энергия ионизации:
Энергия, необходимая для удаления электрона из атомов или ионов, называется энергией ионизации . Увеличение силы притяжения, прилагаемой ядром к электронам, затрудняет удаление электронов из оболочек.Вторая энергия ионизации больше, чем первая энергия ионизации, вторая энергия ионизации больше, чем третья энергия ионизации.
Изменения энергии ионизации в периодической таблице;
I A
3) Сродство к электрону:
Если к нейтральному атому в газообразном состоянии добавить электрон, выделяется энергия. Мы называем эту энергию « сродства к электрону ». Сродство к электрону увеличивается по мере того, как мы идем слева направо по периоду.Напротив, сродство к электрону уменьшается в группе сверху вниз.
4) Электроотрицательность:
В химической связи способность атомов притягивать электроны называется электроотрицательностью. Слева направо в периоде электроотрицательность увеличивается, а сверху вниз в группе электроотрицательность уменьшается.
5) Металл-неметалл:
Способность отдавать электрон называется свойством металла, а способность отдавать электрон называется неметаллическим свойством элементов.Двигаясь по периоду слева направо, свойства металла увеличиваются, а свойства неметалла уменьшаются. В группе металлов сверху вниз свойства металла повышаются. В группах неметаллов сверху вниз неметаллические свойства атомов снижаются.
Свойства групп
a) Щелочные металлы I A:
За исключением 1 H, все элементы в этой группе металлические. Это 1 H, 3 Li, 11 Na, 19 K, 37 Rb, 55 Cs, 87 Fr. Они;
Они;
- имеют тенденцию терять один электрон во внешних оболочках и превращаться в +1 ион
- очень реакционноспособны и существуют в соединениях
- хорошие проводники электричества и тепла
- все соединения из них растворимы в воде
b) II A Щелочноземельные металлы:
Все элементы данной группы металлические. Это 4 Be, 12 Mg, 20 Ca, 38 Sr, 56 Ba, 88 Ra.Они;
- имеют тенденцию терять два электрона во внешних оболочках и становиться +2 ионом
- являются хорошими проводниками электричества и тепла в твердой и жидкой фазах
- реакционноспособны и существуют в соединениях
c) VII A Галогены:
Все элементы этой группы неметаллы: 9 F, 17 Cl, 35 Br, 53 I и 85 At. Они;
- имеют более высокую тенденцию к связыванию электронов и превращаются в -1 ион
- имеет семь электронов на внешних оболочках, поэтому они могут иметь значения, изменяющиеся от +7 до -1 в соединениях
- если они находятся в соединениях металл-неметалл, они имеют значение -1
- они существуют в двухатомных молекулах, таких как F 2 , Br 2
d) Благородные газы VIII A:
Они есть; 2 He, 10 Ne, 18 Ar, 36 Kr, 54 Xe, 86 Rn.
- иметь восемь электронов на внешних оболочках
- электронные конфигурации заканчиваются нс 2 нп 6
- Благородные газы являются наиболее стабильными элементами и не образуют соединений с другими элементами и друг с другом.
- В нормальных условиях они находятся в газовой фазе
- У них энергии ионизации выше, чем у других элементов группы за тот же период
Экзамены по таблице Менделеева и решения проблем
| Свойства групп с примерами <Пред. |
|---|
БЕСПЛАТНАЯ периодическая таблица элементов Шпаргалки
Бонни Роуз Хадсон,
В этом посте могли быть использованы партнерские ссылки.БЕСПЛАТНЫЕ предложения часто зависят от времени и могут быть ограничены только по времени.
Химия может быть сложным предметом. Помогите сделать это немного менее пугающим с помощью этой удобной печатной формы. Эти БЕСПЛАТНЫХ Шпаргалок по Элементам дают вашему старшекласснику ключевую информацию об элементах с первого взгляда.
Эти БЕСПЛАТНЫХ Шпаргалок по Элементам дают вашему старшекласснику ключевую информацию об элементах с первого взгляда.
Каждая страница FREE Periodic Table of the Elements Cheat Sheets проиллюстрирована полной периодической таблицей. Затем элементы разбиваются на классы, причем каждый класс находится в отдельной таблице.Включены все 10 классов:
- щелочные металлы
- щелочноземельные металлы
- переходные металлы
- прочие металлы
- металлоиды
- неметаллы
- галогены
- благородные газы
- лантаноиды
- актинидов
Таблица для каждого класса включает имя, атомный номер и химический символ каждого элемента. Если учащиеся запутаются, пытаясь вспомнить, относится ли фтор к F или FL, они смогут быстро и легко найти ответ. Прокрутите вниз для мгновенной загрузки.
Периодическая таблица элементов: набор для печати
– Не могли бы вы использовать простой, не требующий подготовки способ детализировать и просматривать периодическую таблицу? Наш пакет для печати Периодической таблицы элементов предлагает компактный способ , чтобы помочь учащимся запомнить ключевую информацию без необходимости перелистывать учебники, чтобы найти все.
Эти БЕСПЛАТНЫХ Шпаргалок по Периодической таблице элементов отлично подходят для школьных планировщиков или ученических папок. Прокрутите, чтобы скачать копию БЕСПЛАТНО сегодня!
Найдите больше шпаргалок и печатных форм, идеально подходящих для ученических переплетов, в нашем обзоре Как построить свой домашний переплетчик!
Мы ценим вашу конфиденциальность и обещаем никогда не рассылать вам спам; Вы можете отписаться в любое время. Ознакомьтесь с нашей Политикой конфиденциальности для получения дополнительной информации о том, как мы обрабатываем ваши данные.
Бонни Роуз Хадсон искренне желает, чтобы каждый ребенок чувствовал любовь Бога и знал, насколько он особенный для Него.Она хотела бы, чтобы вы зашли на ее веб-сайт WriteBonnieRose.com, чтобы получить домашнее обучение и учебную программу по истории, ресурсы, которые помогут рассказать вашим детям о миссиях и преследуемой церкви, бесплатную историю и написание печатных материалов, а также ознакомьтесь с ее новейшим выпуском JourneyForth, The Скрытая деревня , ранний читатель, установленный в Индии.
Самая большая шпаргалка в мире
В честь Недели «Снова в школу» Common Science публикует дань уважения величайшей в мире памятке – Периодической таблице элементов.Где-то в течение первой недели занятий по химии в старшей школе (да, я знаю, что некоторые из вас никогда не занимались химией в старшей школе, но я стараюсь не думать об этом) ваш учитель представил Периодическую таблицу, которая, вероятно, выглядела как та, что в верхней части страницы. . Иногда, когда я разговариваю с людьми об их опыте изучения химии в средней школе, я спрашиваю их: «Почему Периодическая таблица называется Периодической таблицей?» Обычно я не получаю ответа. Периодический означает «повторяющийся». Она называется Периодической таблицей, потому что столбцы построены вокруг повторяющихся шаблонов.Человеком, которому приписывают создание современной версии в 1869 году, был русский ученый по имени Дмитрий Менделеев. Периодическая таблица элементов представляет собой шпаргалку во всех соответствующих аспектах. И он хороший.
Большинство из нас знает, что атомы состоят из протонов, нейтронов и электронов. Элемент – это особый тип атома. Элементы имеют одинаковое количество протонов и электронов. Протоны и нейтроны образуют ядра атомов, а электроны плавают поблизости.Самый простой из всех элементов, водород, имеет один протон и один электрон. Следующий простейший элемент – это гелий, который имеет 2 протона и два электрона. Атомный номер каждого элемента соответствует количеству протонов / электронов в атоме, например Водород и гелий имеют атомные номера 1 и 2 соответственно. У элементов также есть простые сокращения. Водород – это H, а гелий – это He.
Затем наступила трудная часть для вашего учителя. Некоторые элементы, в зависимости от количества электронов, стабильны и поэтому не реагируют с другими элементами.Число электронов в элементе повторяется, что соответствует стабильности. История немного усложняется, если ввести понятие орбиталей. Обычно в старшей школе орбитали представляют в упрощенной форме в виде кругов вокруг ядра. (См. Рисунок под этим абзацем.) Задача учителя на этом этапе состоит в том, чтобы объяснить, почему некоторые орбитали стабильны, а некоторые нет. Это требует обсуждения квантовой механики, к которой студенты еще не готовы.Таким образом, учитель должен просто сказать ученикам, что они должны принять, что некоторые конфигурации стабильны, а некоторые нет. Первые три стабильные конфигурации имеют 2, 10 и 18 электронов (2 на первой орбитали, 8 на второй и 8 на третьей). Таблица Менделеева построена вокруг этих образцов стабильности.
Итак, давайте начнем прогулку по таблице Менделеева. Водород (H) имеет один протон и один электрон. Один электрон, вращающийся вокруг протона, не является стабильной конфигурацией, поскольку первая орбиталь, чтобы быть стабильной, должна иметь два электрона.Итак, атом водорода должен найти партнера, с которым он поделится электронами, чтобы быть счастливым. Наиболее распространенный способ, которым водород делает это, – это объединение с другим атомом водорода с образованием молекулы H 2 (для визуализации см. Рисунок под этим абзацем). Теперь два электрона от двух атомов водорода вращаются вокруг двух протонов, образуя стабильную первую орбиталь.
Если мы перейдем к гелию, у него два протона и два электрона.Два электрона без посторонней помощи образуют стабильную первую орбиталь. Гелий – первый из «благородных газов», названный так потому, что они слишком горды, чтобы наклоняться, чтобы делиться своими электронами с другими элементами. Глядя вниз на столбец Гелия, мы получаем отличный пример шпаргалки по возможности Периодической таблицы. Ниже гелия находятся другие благородные газы: неон, аргон, криптон, ксенон, радон и унунокций (подробнее об этом ниже). Все эти атомы имеют точное количество электронов, необходимое для того, чтобы на самой внешней орбитали было необходимое количество электронов для стабильности.Следовательно, как и гелий, другие благородные газы, как правило, не участвуют в каких-либо химических реакциях.
Позвольте мне кратко коснуться Ununoctium, крупнейшего известного элемента с атомным номером 118. Готовясь написать этот блог, я достал свой учебник химии, полученный на первом курсе колледжа (1984), и посмотрел на раздел периодической таблицы. (Если вам интересно, да, у меня все еще есть все учебники для колледжа). В моем учебнике 1984 года сказано, что известно 108 элементов.И увлекательно, и тревожно осознавать, что я достаточно стар, чтобы с тех пор, как я поступил в колледж, было «открыто» 10 новых элементов. Я использую кавычки, поскольку эти дополнительные элементы, по сути, были синтезированы, а не обнаружены путем столкновения других атомов вместе с невероятно высокой скоростью. Унунокций был впервые синтезирован в российской лаборатории (г-н Менделеев будет гордиться этим) в 2002 году. С 2002 года ученые считают, что они синтезировали 3 или 4 атома унунокция, каждый из которых существует в течение нескольких миллисекунд, прежде чем распасться в результате спонтанного ядерного деления.
Хорошо, так что вернемся к столу. Литий (Li) имеет 3 электрона и 3 протона. (Не волнуйтесь, я не буду рассматривать всю таблицу Менделеева.) Два электрона образуют первую орбиталь. Следующей орбитали нужно 8 электронов, чтобы быть стабильной. Атом лития имеет только одну на второй орбитали (см. Рисунок выше), следовательно, он находится в отчаянном поиске 7 электронов, которые другие электроны могли бы разделить на своей внешней орбитали. Самый простой способ для лития достичь этой цели – использовать фтор (F).У фтора 9 электронов, 2 на первой орбитали и 7 на второй. Таким образом, литий и фтор подобны браку, заключенному на небесах, образующему молекулу LiF с одним атомом лития и одним атомом фтора. Теперь у нас есть еще один отличный пример шпаргалки. Поскольку мы знаем, что один литий будет успешно соединяться с одним фтором, мы знаем, что то же самое будет верно и для всех других пар в столбцах. Если вы посмотрите на столбцы, вы найдете знакомую пару натрий (Na) и хлор (Cl), которые образуют пары один к одному, чтобы получить NaCl, поваренную соль.
В качестве последнего примера давайте начнем обсуждать, как начать использовать Периодическую таблицу, чтобы выяснить, как образуются более крупные молекулы. Кислород (O) имеет атомный номер 8, поэтому в нем 8 электронов. Сверху мы знаем, что 2 из этих электронов сформируют первую орбиталь вокруг ядра атома кислорода. Это оставляет 6 электронов для второй орбитали, которой необходимо 8 для стабильности. Многие атомы кислорода получают два дополнительных электрона, которые им необходимы, реагируя с двумя атомами водорода, каждый из которых вносит по одному электрону, чтобы создать стабильную и знакомую молекулу воды H 2 O.Итак, здесь мы снова можем просто взять нашу шпаргалку и начать выяснять, какие молекулы могут образовываться, а какие нет.
С годами, когда студенты обнаружили, что они могут использовать свои шпаргалки по Периодической таблице во время тестов, все больше и больше информации накапливалось на бумаге. Вы можете легко найти периодические таблицы, в которых каждый квадрат выглядит так, как показано ниже.
Вы можете ответить практически на любой вопрос по химии с помощью такой шпаргалки.Поздравляем с возвращением в школу!
Есть комментарий или вопрос? Войдите в систему ниже и дайте мне знать, что вы думаете, или отправьте мне электронное письмо по адресу [email protected].
СвязанныеПериодические таблицы для печати бесплатно (PDF и PNG)
Периодические таблицы для печати – важные инструменты для химии и других наук.Печатная таблица Менделеева – важный инструмент для студентов и химиков.Вы можете разместить его там, где вам нужно, при решении проблем, пометить его и распечатать новый, когда захотите. Это коллекция бесплатных распечатываемых периодических таблиц в формате PDF или PNG для сохранения, печати и использования. В этих периодических таблицах используются точные данные для названия, атомного номера, символа элемента, атомного веса и электронной конфигурации, полученные от Международного союза чистой и прикладной химии или ИЮПАК.
Мы сделали список таблиц вместе со ссылками, чтобы вы могли получить подробную информацию о каждой из них.Периодические таблицы HD являются отличными хранителями экрана или справочными таблицами на мобильных устройствах. Их размер соответствует размеру листа бумаги, и вам не нужно беспокоиться о том, чтобы пометить их, потому что вы всегда можете распечатать больше для выполнения домашних заданий или выполнения лабораторных расчетов. Таблицы точно меняют размер, поэтому вы можете просматривать или распечатывать их с любым размером и соотношением сторон, от крошечного до размера плаката.
Чтобы загрузить таблицу, щелкните изображение правой кнопкой мыши и сохраните или используйте предоставленные ссылки для загрузки изображений или PDF-файлов (если они доступны).
118 Периодическая таблица Менделеева с приглушенными элементами для печати
Это наша самая популярная таблица Менделеева для цветной печати. У него есть номер каждого элемента, символ, имя и атомная масса. Эту таблицу Менделеева мы рекомендуем использовать для расчетов и выполнения домашних заданий.
Ссылки для скачивания: Изображение | PDF
Живая периодическая таблица с 118 элементами
Эта периодическая таблица с 118 элементами представляет собой HD-обои с разрешением 1920 × 1080. В нем используется наша любимая цветовая схема из всех созданных нами столов.Он включает имена элементов, символы, группы, атомные номера и атомные массы. Это наша любимая цветовая схема.
Ссылки для скачивания: Изображение (белый фон) | Изображение (черный фон)
Цветная рамка Периодическая таблица для печати
Периодическая таблица элементов – 118 элементов Стандартная атомная масса ИЮПАК В этой печатной таблице Менделеева приведены стандартные значения атомной массы ИЮПАК. Это точная актуальная таблица для расчетов и домашних заданий. Поскольку окрашены только границы плиток элементов, таблицу легко читать и относить к картриджам с тонером.
Ссылки для скачивания: Изображение | PDF
Таблица Менделеева с начислениями
Эта черно-белая таблица Менделеева для печати специально разработана для средних и старших классов. Он включает электронные конфигурации, степени окисления, группы, периоды и многое другое.
Ссылки для скачивания: Изображение | PDF
Таблица Менделеева для детей
Эта таблица Менделеева из 118 элементов для печати идеально подходит для детей или тех, кто хочет получить четкую диаграмму с атомными весами, округленными до двух десятичных знаков после запятой.С домашним заданием это намного проще!
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Цветная периодическая таблица
В этой периодической таблице есть названия и символы всех 118 элементов. О, и он также гигантский, так что вы можете покрыть им стену, если хотите.
Ссылки для скачивания: Изображение | PDF
Цветная таблица Менделеева
Эта цветная таблица Менделеева ярко окрашена и оптимизирована для размещения на одном листе бумаги.Наряду с обычной информацией в нем есть квадрат легенды и пронумерованные столбцы, а также фамилии, рекомендованные IUPAC.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица туманности Киля
Эта таблица Менделеева доступна в качестве плаката с туманностью Киля (фотография, сделанная космическим телескопом Хаббла).
Ссылка для скачивания: Изображение
Черно-белая периодическая таблица
Это бесплатная черно-белая печатная таблица Менделеева, содержащая факты и цифры.Это периодическая таблица с именами, символами элементов, атомными номерами, атомными весами и группами. Значимые цифры Международного союза теоретической и прикладной химии (IUPAC) указаны для атомных масс (принятое единственное значение, а не диапазон атомных масс). Эта диаграмма идеальна, если у вас есть черно-белый принтер или вы просто хотите попрактиковаться в раскрашивании групп элементов самостоятельно.
Ссылки для скачивания: Изображение | PDF
Пустая периодическая таблица
Заполните пропуски в этой печатной таблице Менделеева, указав символы элементов, группы или все, что вы пытаетесь изучить.Вы можете получить пустую таблицу в виде файла изображения или PDF-файла, чтобы вы могли сохранить ее и распечатать столько копий, сколько вам нужно. Он точно меняет размеры в соответствии с вашими потребностями. Зигзагообразная линия отделяет металлы от неметаллов. Для вашего удобства указаны номера групп и периодов.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица электроотрицательности
Эта бесплатная периодическая таблица имеет цветовую кодировку для обозначения электроотрицательности атома элемента.Электроотрицательность – это тенденция, которая естественным образом проявляется в периодической таблице Менделеева, но, как вы можете видеть, это не постоянная тенденция. Используйте таблицу для написания названий соединений и прогнозирования химических реакций. Также интересно посмотреть, где элементы отклоняются от периодичности. Эта печатная таблица Менделеева также содержит основные факты, необходимые для общих вычислений.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица зарядов элементов
В этой таблице для печати перечислены наиболее распространенные заряды или состояния окисления, переносимые атомами каждого элемента.Он содержит основные факты об элементах, поэтому вы можете использовать его как стандартную таблицу Менделеева.
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Периодическая таблица атомных радиусов
Эта цветная периодическая таблица показывает относительные размеры каждого атома. Диаметр каждого атома масштабируется относительно самого большого атома элемента: цезия.Это забавная таблица, которую можно использовать, когда вы рассматриваете тенденции в периодической таблице, потому что она показывает, как на самом деле уменьшается атомный радиус по мере того, как вы перемещаетесь через период, даже если атомы набирают большую массу. Тенденция размеров соответствует цветам радуги
Ссылка для скачивания: Изображение | PDF
Периодическая таблица открытия элементов
Когда элементы были обнаружены (периодическая таблица). Каждая ячейка элемента этой таблицы указывает год, в котором этот элемент был обнаружен.Раскраска плиток группирует элементы в соответствии с периодом времени их обнаружения. Посмотрите, сможете ли вы заметить первый искусственный элемент. Подсказка: символ элемента начинается с буквы «Т».
Ссылка для скачивания: Изображение
Периодическая таблица с электронными оболочками
Устали выяснять электронные конфигурации или просто хотите проверить свою работу? Эта таблица для печати показывает название элемента, символ, номер, группу, а также заполнение электронных оболочек.Это одна из самых полных периодических таблиц на сайте.
Цвет Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Белое на черном Ссылки для скачивания: Изображение | PDF
Периодическая таблица плотности
Каждая ячейка элемента содержит полосу, которая показывает плотность элемента относительно осмия, самого плотного элемента.Состояние вещества, группа, период, название элемента, атомный номер элемента и атомная масса также указаны на этой красочной таблице.
Ссылки для скачивания: Изображение | PDF
Черно-белое Ссылки для скачивания: Изображение | PDF
Содержание элементов в морской воде
Эта таблица Менделеева из 118 элементов указывает среднее содержание каждого химического элемента в морской воде Земли.
Ссылки для скачивания: Изображение | PDF
Изобилие элементов в земной коре
Посмотрите относительное количество элементов с помощью этой печатной таблицы Менделеева из 118 элементов.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица точек плавления
Эта ярко окрашенная периодическая таблица содержит точки плавления элементов. Обычно эти значения приводятся в STP, поэтому, если вы используете другую температуру или давление, ожидайте некоторого отклонения от значения. В основном это руководство, помогающее проиллюстрировать тенденции в периодической таблице Менделеева.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица точек кипения
Эта красочная таблица Менделеева содержит точки кипения каждого элемента.Конечно, температура кипения зависит от атмосферного давления. Обозначения указывают, находится ли значение на уровне моря или нет.
Ссылки для скачивания: Изображение | PDF
Электронная орбитальная периодическая таблица
Периодическая таблица для печати организована в соответствии с внешней электронной оболочкой или электронными орбиталями. Эта таблица делает тенденцию очевидной и подчеркивает, почему таблица имеет знакомую нам форму.
Ссылка для скачивания: Изображение
Металлы, металлоиды и неметаллы Периодические таблицы
Это коллекция периодических таблиц для печати, в которых показаны металлы, металлоиды (полуметаллы) и неметаллы, а также свойства этих важных группы элементов.Также перечислены свойства этих групп элементов.
Металлы, металлоиды, неметаллы Таблица [ Image ]
Таблица металлов (и список металлов) [ Image ]
Таблица металлоидов (и список) [ Image]
Таблица неметаллов (и список) [ Image ]
Периодическая таблица круговых плиток
Кто сказал, что плитки элементов должны быть квадратами или прямоугольниками? Вот модная таблица Менделеева, сделанная из круглых плиток.Не волнуйтесь – все обычные факты и цифры остались на месте. Тайлы элементов содержат символ элемента, имя, атомный номер и атомную массу. Немного перемешайте. Мыслите нестандартно.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица со всем остальным
Это наша самая полная таблица Менделеева. Эта диаграмма содержит всю информацию, которую вы можете захотеть из печатной таблицы Менделеева, включая символы элементов, имена, атомные номера, атомные массы, электронные оболочки, периоды, группы, состояние вещества и многое другое.Эта таблица особенно удобна на мониторе, потому что вы можете увеличивать масштаб, чтобы увидеть важные факты.
Ссылки для скачивания: Изображение | PDF
Периодическая таблица без имен
На этой диаграмме показаны символы элементов, атомные номера и атомные веса, но не перечислены имена элементов. Вы можете использовать его, чтобы научиться связывать имена и символы, например, для викторин и тому подобного. Цветная версия таблицы включает группы элементов и ключ, тогда как черно-белая версия опускает группы, поэтому вы можете изучить их или раскрасить их.
Color Ссылки для скачивания: Изображение | PDF
Black and White Ссылки для скачивания: Изображение | PDF
Периодические таблицы на иностранных языках
Японские периодические таблицыЭто собрание периодических таблиц на языках, отличных от английского.
Как пользоваться периодической таблицей
Научитесь читать периодическую таблицу. Теперь у вас есть таблица Менделеева. Вы уверены, что знаете, как ею пользоваться? Вот информация, которую вы найдете в типичной таблице Менделеева, и способы ее использования для ответа на вопросы об элементах.
Ячейки элементов периодической таблицы
Это набор ячеек отдельных элементов, которые можно сохранить и распечатать. Отдельные ячейки элементов поставляются в виде файлов PNG. Вы также можете загрузить всю коллекцию элементов в виде файла PDF. Доступно несколько цветовых вариаций, в том числе черно-белый набор плиток.
Инструкции по печати периодических таблиц для печати
Вы можете либо распечатать файл изображения высокой четкости (PNG), либо открыть и распечатать файлы PDF.Разложить изображение на нескольких страницах и сделать большой настенный плакат очень просто. Мы рекомендуем вам распечатать файлы PDF, потому что они созданы для этой цели!
Особые запросы
Хотите увидеть другую цветовую схему, периодическую таблицу на другом языке, периодическую таблицу для определенного праздника или группы элементов, назначенные по-другому? Дайте нам знать, и мы составим для вас столик!
Печатные периодические таблицы Условия использования
Пожалуйста, распечатайте эти таблицы для личного использования и для раздачи студентам.Вы можете разместить их в своем классе, лаборатории, кухне и т. Д. И отображать их на своем телефоне и компьютере. Вы не можете копировать и размещать периодические таблицы на своем веб-сайте. Вы не можете продавать их или адаптировать для продажи.
Если вы хотите использовать периодическую таблицу (или любое изображение) с сайта для печатной публикации или видео, свяжитесь с нами, чтобы мы могли дать письменное разрешение издателю.
Основы таблицы Менделеева «Ваша шпаргалка».
Презентация на тему: «Основы таблицы Менделеева« Ваша шпаргалка ».»- стенограмма презентации:
ins [data-ad-slot = “4502451947”] {display: none! important;}} @media (max-width: 800px) {# place_14> ins: not ([data-ad-slot = “4502451947”]) {display: none! important;}} @media (max-width: 800px) {# place_14 {width: 250px;}} @media (max-width: 500 пикселей) {# place_14 {width: 120px;}} ]]>1 Основы периодической таблицы «Ваша шпаргалка»
2 На карточке элемента / коробке
Атомный номер (атомный номер = p = e) Химический символ Название атома Атомная масса (округлить до целого числа) 6 C Углерод 12.0
3 Для каждого элемента Название Что это такое Где они Как определить
Протоны Положительные частицы Ядро атома То же, что и атомный номер
4 Для каждого элемента Название Какие они Где они Как определить
Протоны Положительные частицы Ядро атома То же, что и атомный номер Электроны Отрицательные частицы Вне ядра То же, что и количество протонов
5 Для каждого элемента Название Какие они Где они Как определить
Протоны Положительные частицы Ядро атома То же, что и атомный номер Электроны Отрицательные частицы Вне ядра То же, что и количество протонов Нейтроны Нейтральные частицы Массовое число – атомный номер
6 Валентные электроны
7 Для каждого элемента Название Какие они Где они Как определить
Протоны Положительные частицы Ядро атома То же, что и атомный номер Электроны Отрицательные частицы Вне ядра То же, что и количество протонов Нейтроны Нейтральные частицы Массовое число – атомный номер Валентность электроны Наибольшие электроны Наибольшее кольцо / самое дальнее от ядра Группы 1, 2: то же, что и номер группы Группы 13-18: Группа № – 10
Список формул периодической таблицы | Шпаргалка и таблицы для таблицы Менделеева
Периодическая таблица представляет собой диаграмму всех известных элементов.Познакомьтесь с символами и полными названиями всех элементов в нем легко, обратившись к нашей Коллекции формул Периодической таблицы. Изучите основы концепции периодической таблицы, воспользовавшись нашей шпаргалкой по периодической таблице. Когда вы начнете практиковать формулы, вы легко вспомните их вместе с названиями химических соединений.
1. Периодическая таблица Менделеева основана на атомном весе, а Современная периодическая таблица основана на атомном номере.
2. Общая электронная конфигурация (внешних орбит):
- S-блок ⇒ нс 1-2
- p-блок ⇒ ns 2 np 1-6
- d-блок ⇒ (n – 1) d 1-10 нс 1-2 ,
- f-блок ⇒ (n – 2) f 1-14 s 2 p 6 d 10 (n – 1) s 2 p 6 d 0 или 1 ns 2
3.Расчет ковалентного радиуса:
- In A 2 , r A = d A-A /2
- In AB, d A-B = r A + r B (если X A ≈ X B )
- Формула Шкомакера и Стивенсона, d A-B = r A + r B – 0,09 Δx (если X A ≠ X B )
4.VWR> MR> CR и размер изоэлектронных частиц Z ↑ r ↓
5.
6. (a) Шкала EN:
(b) X м = 2,8 x p , x p = 0,349 x AR + .744, √x p = 0,2 x с + 0,77 SR
⇒ Коэффициенты устойчивости
7.% ионный характер = 16 Δ + 3,5 Δ 2 = 16 (x A – x B ) + 3.5 (x A – x B ) 2
(формула Хенни и Смита)
8.
9. (i) Радиус:
- In Pr (r) max = Элемент инертного газа (VWR)
- r ↓ r почти то же → r ↑
- Радиус элементов серий 4d и 5d почти такой же r (Lanthanide Contract)
(ii) Потенциал ионизации (IP):
Единица I.P. = кДж моль -1 , эВ и 1 эВ = 96,5 кДж моль -1 и IP 1
Если ΔIP ≥ 16 эВ, более низкая степень окисления является стабильной. & Если ΔIP ≤ 11,2 эВ, то более высокая степень окисления устойчива.
IP ∝ \ (\ frac {1} {\ text {size}} \ propto \ frac {1} {\ text {Эффект экранирования}} \ propto \ frac {1} {\ text {количество внутренних электронов}} \ ) ∝ ядерный заряд
∝ Стабильность
(Стабильность) ⇒ p 6 > d 10 > p 3 > d 5 & (IP) p 6 > d 10 > p 3 > d 5
& (IP) 2 nd переходная серия> 3 rd переходная серия.
(IP) He> Li & Tl> In & Pb> Sn и Zn> Ga & w
IP ∝ \ (\ frac {1} {\ text {Металлический символ}} \ propto \ frac {1} {\ text {Сокращающий символ}} \ propto \ frac {1} {\ text {Реакционная способность}} \)
\ (\ propto \ frac {1} {\ text {Основное содержание оксида}} \ propto \ frac {1} {\ text {Основное содержание гидроксида}} \)
(iii) Сродство к электрону (EA): (iv) (X или EN): 10. Некоторые важные моменты: Максимально используйте формулы, представленные в Onlinecalculator.гуру и упростите свою работу.
EA ∝ \ (\ frac {1} {\ text {size}} \) ∝ ядерный заряд
(EA) N
(EN ∝ ядерное притяжение ∝ + степень окисления ∝ \ (\ frac {1} {\ text {atomicradius}} \) ∝ символ% S). (энергия) sp> sp 2 > sp 3 & (EN) sp> sp 2 > sp 3
& (Size) sp
(EN гибридного ) CH ≡ CH> CH 2 = CH 2 > CH 3 – CH 3
& (кислотная природа) CH ≡ CH> CH 2 = CH 2 > CH 3 – CH 3
(EN) ⇒ Катион> атом, анион <атом
cr +6 > cr +3 > cr +2 , F –
(EN) ⇒ Si H ≤ P
Δ EN ∝ B.E. ∝ \ (\ frac {1} {\ text {Bond Length}} \) ∝% ионного характера ∝ неметаллический символ
∝ BS
EN инертного газа = 0
В сериях 4d и 5d при перемещении в одной группе EN ↑ 11 интересных фактов о периодической таблице Менделеева
Знаете ли вы, что периодическая таблица на самом деле была шпаргалкой? Прокрутите, чтобы узнать больше.
Периодическая таблица
Имена четырех недавно обнаруженных элементов не доступны для всеобщего ознакомления. Элементам 113, 115, 117 и 118 даны названия – Nihonium, Moscovium, Tennessine и Oganesson соответственно. Публичное рассмотрение завершится 8 ноября.
По этому поводу мы представляем вам 11 интересных фактов о периодической таблице Менделеева:
- Вы знаете, почему они называют ее периодической таблицей? Это потому, что строки называются периодами
- Ужасная Периодическая таблица на стене вашего класса на самом деле является гигантской шпаргалкой. Создатель таблицы Дмитрий Менделеев опоздал с представлением работы по всем 63 элементам. Чтобы ускорить процесс, он составил базу данных всех элементов в соответствии с их атомными массами
- В периодической таблице 118 подтвержденных элементов.Из них 90 элементов можно найти в природе, а остальные созданы руками человека. Технеций был первым искусственным элементом
- Водород – самый легкий элемент с атомным весом 1, поэтому его можно найти в верхнем левом углу периодической таблицы
- Уран – самый тяжелый элемент с атомный вес 238
- Гелий, неон, аргон, криптон, ксенон и радон известны как благородные газы, поскольку считались инертными.Но недавние исследования показали реактивные соединения ксенона, криптона и радона
- Международный союз чистой прикладной химии (IUPAC) отвечает за поддержание периодической таблицы Менделеева
- Большинство элементов в периодической таблице – металлы – почти 75 процентов
- Различные формы чистых элементов называются аллотропами. Например, алмаз, графит, бакминстерфуллерен и аморфный углерод являются аллотропами одного чистого элемента – углерода
- Периодическая таблица Менделеева была разработана в порядке увеличения атомного веса, в то время как современная таблица Менделеева разработана в соответствии с возрастающим атомным номером .

 – Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)
– Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info)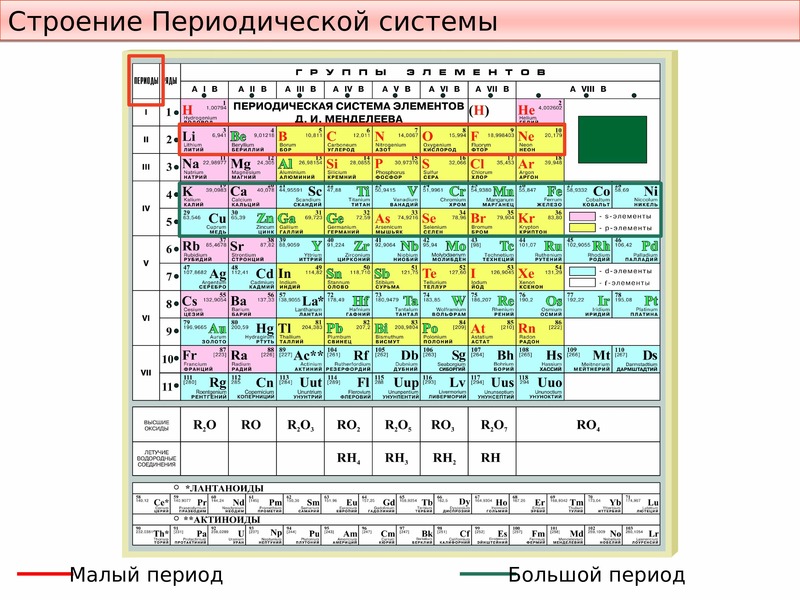 Электролитическая диссоциация. Понятия, растворимость, электролитическая диссоциация, теория электролитическoй диссоциации, степень диссоциации, диссоциация кислот, оснований и солей, нейтральная, щелочная и кислая среда
Электролитическая диссоциация. Понятия, растворимость, электролитическая диссоциация, теория электролитическoй диссоциации, степень диссоциации, диссоциация кислот, оснований и солей, нейтральная, щелочная и кислая среда