Атомные массы некоторых элементов таблицы Менделеева будут переписаны
Автор: Александр Березин, Компьютерра–Онлайн
Источник: www.compulenta.ru
…Причём случится это, судя по всему, уже в августе 2013-го.
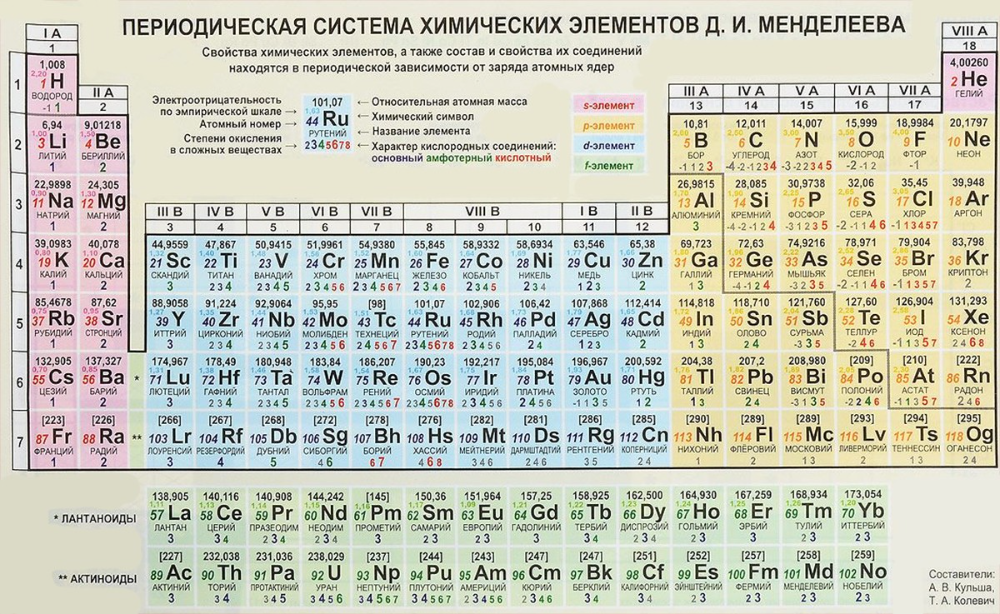
Наследие русской химической науки XIX века только что получило небольшой апдейт: пять элементов в сердце периодической таблицы Менделеева оказались не совсем такими, какими мы их представляли.
«Ваш учитель химии, возможно, говорил вам, что “атомные массы — природные константы”, но ничто не может быть дальше от истины, чем это утверждение», — развенчивает наши школьные иллюзии Тайлер Коплен (Tyler Coplen), директор Рестоновской лаборатории стабильных изотопов (США). И правда, атомный вес некоторых элементов варьируется в зависимости от того, в какой именно точке Земли вы находитесь.
Подавляющая часть атомной массы покоится в ядре атома в виде протонов и нейтронов (исключение — водород, в ядре которого один протон). Количество протонов в ядре действительно константно для данного изотопа; скажем, у ядра углерода их всегда шесть, у кислорода — восемь, и так далее. А вот число нейтронов может меняться от атома к атому, причём у одного и того же химического элемента. Собственно, отсюда и изотопы, так что, как видим, в целом учебник за седьмой класс прошёл проверку фактами.
А вот число нейтронов может меняться от атома к атому, причём у одного и того же химического элемента. Собственно, отсюда и изотопы, так что, как видим, в целом учебник за седьмой класс прошёл проверку фактами.
Так-так, а как же обещанные колебания веса в «зависимости от географии»? Их, увы, не избежать. Несмотря на то что многие изотопы нестабильны, ряд элементов имеет больше одного стабильного изотопа. Скажем, у брома таких два, причём их распространённость на планете Земля примерно одинакова: 79Br — 50,56 %, 81Br — 49,44 %. И тут появляется проблема: какую именно атомную массу указывать в таблице Менделеева? Конечно, можно обойтись «средним арифметическим», но тогда отличникам будет казаться, что в природе доминирует искусственно получаемый нестабильный бром-80…
Чтобы жизнь химика не казалась вам чёрной икрой, добавим, что в морской воде и в солях 81Br несколько более распространён, чем в живых организмах. То есть в вас или в омулёвой бочке по имени Байкал доминирует бром 79Br, а в Красном и тем паче Мёртвом море — 81Br. У магния стабильных изотопов три, и их распространённость также варьируется в разных окружающих средах. Но какой бы из изотопов вы ни выбрали за «основной», действие это будет очень условным — уже сейчас известно, что на других планетах Солнечной системы, а также на самом Солнце распределение стабильных изотопов может отличаться от земного. Тем более оно может быть другим в иных звёздных системах. Словом, пока просто нельзя понять, какой изотоп того же брома чаще встречается на миллиардах планет нашей Галактики, не говоря уже обо всей Вселенной.
У магния стабильных изотопов три, и их распространённость также варьируется в разных окружающих средах. Но какой бы из изотопов вы ни выбрали за «основной», действие это будет очень условным — уже сейчас известно, что на других планетах Солнечной системы, а также на самом Солнце распределение стабильных изотопов может отличаться от земного. Тем более оно может быть другим в иных звёздных системах. Словом, пока просто нельзя понять, какой изотоп того же брома чаще встречается на миллиардах планет нашей Галактики, не говоря уже обо всей Вселенной.
Всё это заставило Международный союз теоретической и прикладной химии (ИЮПАК) заявить, что в случае атомных масс брома и магния лучше использовать интервалы, нежели просто цифры. Оттого атомная масса брома теперь не 79,904, а 79,901–79,907 ([79,901, 79,907]), а магния — не 24,3050, а 24,304–24,307 ([24,304, 24,307]).
И тут, как вы уже догадались, только начни, а остановиться будет архитрудно. Тут же — то есть пару лет назад — ИЮПАК заменил «чёткие» атомные массы десяти других элементов интервалами, причём сделал это для сверхраспространённых водорода и углерода. А не так давно та же операция была проделана с ещё тремя элементами — германием, индием и ртутью.
А не так давно та же операция была проделана с ещё тремя элементами — германием, индием и ртутью.
Тайлер Коплен, автор последнего доклада ИЮПАК, уверен, что в будущем, по мере роста чувствительности приборов, которые позволяют оценить доли различных изотопов в тех или иных районах Земли, та же история повторится с другими элементами, имеющими более одного стабильного изотопа. «Комитет ИЮПАК вновь соберётся в августе, — сообщает учёный. — Думаю, ещё нескольким элементам придётся измениться».
Подробнее о поднятой теме можно почитать в журнале Pure and Applied Chemistry.
Подготовлено по материалам NewScientist.
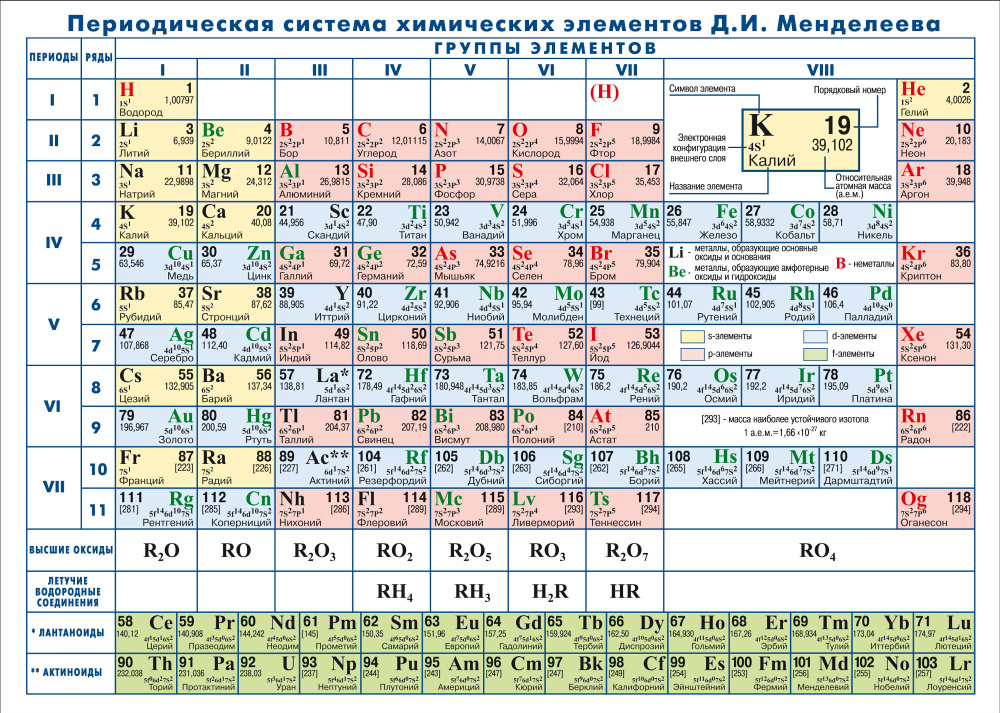
Новые значения атомных масс получили 19 элементов таблицы Менделеева
https://ria.ru/20130926/965950814.html
Новые значения атомных масс получили 19 элементов таблицы Менделеева
Новые значения атомных масс получили 19 элементов таблицы Менделеева – РИА Новости, 26.09.2013
Новые значения атомных масс получили 19 элементов таблицы Менделеева
У многих элементов атомная масса в естественных условиях слегка варьируется из-за того, что соотношение легких и тяжелых изотопов этих элементов в разных местах разное. Для науки это важно: знание атомных масс нужно для понимания законов физики.
Для науки это важно: знание атомных масс нужно для понимания законов физики.
2013-09-26T11:45
2013-09-26T11:45
2013-09-26T11:47
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/sharing/article/965950814.jpg?1380181640
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2013
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия – риа наука
Открытия – РИА Наука, Наука
МОСКВА, 26 сен — РИА Новости. Ученые уточнили атомные массы 19 элементов таблицы Менделеева, сообщается на официальном сайте Международного союза теоретической и прикладной химии.
“Изменения атомных масс очень малы. У многих элементов атомная масса в естественных условиях слегка варьируется из-за того, что соотношение легких и тяжелых изотопов этих элементов в разных местах разное. Для науки это важно: знание атомных масс нужно для понимания законов физики. Хороший свежий пример: в 2005 году высокоточные измерения атомных масс позволили исследователям проверить верность знаменитой формулы E=mc^2”, — пояснил Юрис Мейя (Juris Meija), секретарь комиссии Международного союза теоретической и прикладной химии по соотношению изотопов и атомным массам, слова которого приводит газета Guardian.
Элементы таблицы Менделеева с номерами 114 и 116 получили имена
24 октября 2012, 16:13
В природе элементы обычно существуют в виде смесей из нескольких изотопов, поэтому в реальности масса элемента отличается от массы любого из его изотопов. Атомные массы химических элементов, которые приводятся в таблице Менделеева, рассчитываются на основе соотношения, в котором изотопы каждого элемента встречаются в природе. В результате в таблице появляется условная масса элемента.
Этими расчетами занимается Международный союз теоретической и прикладной химии. Его комиссия по соотношению изотопов и атомным массам собирается раз в два года для того, чтобы на основе последних исследований уточнить массы элементов.
В этом году комиссия переопределила массы 19 химических элементов, среди них — молибден, торий, алюминий, мышьяк. Некоторые из элементов “прибавили в весе”, а другие, наоборот, “похудели”. Эти изменения очень малы, и в целом таблица Менделеева потяжелела на 0,003640021 атомных единиц масс. Новые массы будут опубликованы в журнале Pure and Applied Chemistry в 2014 году.
Новые массы будут опубликованы в журнале Pure and Applied Chemistry в 2014 году.
Периодическая таблица
Периодическая таблица| Н | Он | ||||||||||||||||
| Ли | Бе | Б | С | Н | О | Ф | Не | ||||||||||
| Нет данных | мг | Ал | Си | П | С | Кл | Ар | ||||||||||
| К | Ка | Sc | В | Кр | Мн | Fe | Ко | Никель | Медь | цинк | Га | Ге | Как | Се | руб. | Кр | |
| руб. | Старший | Д | Зр | Нб | Мо | Ру | Правая | палладий | Аг | CD | В | Сн | Сб | Те | я | Хе | |
| Цс | Ба | Ла* | Гф | Та | Вт | Ре | Ос | Ир | Пт | Ау |  ст. ст. | Тл | Свинец | Би | ПО | В | Р-н |
| Пт | Ра | Ас# | – | – | – | – | – | – | – | – | – | ||||||
| *СЕ | Пр | Нд | вечера | см | ЕС | Гд | Тб | Дай | Хо | Эр | Тм | Ыб | Лу | ||||
| #Т | Па | У | Нп | Пу | Ам | см | Бк | См. | Эс | FM | Мд | Нет | Лр |
| щелочные металлы | щелочноземельные | переходные металлы | кальцигены |
| галогены | благородные газы | лантаноиды | актиноиды |
щелкните элемент, чтобы просмотреть его свойства
| # = атомный номер | масса = атомная масса (в г/моль) |
| плотность = плотность (в г/мл) | номера оксидов = наиболее распространенные степени окисления |
| tпл = температура плавления (в градусах Цельсия) | п. н. = температура кипения (в градусах Цельсия) н. = температура кипения (в градусах Цельсия) |
| EN = электроотрицательность | Энергия ионизации = (в кДж/моль) |
| рад. = атомный радиус (в ангстремах) |
| Элемент (sym) | # | Масса | Плотность | № оксида | т.ч. | б.п. | EN | Энергия ионизации | рад. |
|---|---|---|---|---|---|---|---|---|---|
| Водород (H) | 1 | 1,01 | 0,00009 | +1, -1 | -259 90 006 | -286 | 2,1 | 1314 | 0,37 |
| Гелий (He) | 2 | 4,00 | 0,00018 | – | – | -269 | – | 2372 | 1,22 |
| Литий (Li) | 3 | 6,94 | 0,53 | +1 | 181 | 1 347 | 1,0 | 520, 7298 | 1,52 |
| Бериллий (Be) | 4 | 9. 012 012 | 1,85 | +2 | 1278 | 9002 2 29701,5 | 899, 1757, 14848 | 1,11 | |
| Бор (В) | 5 | 2.34 | +3 | 2300 | 2550 | 2.0 | 801, 2427, 3660, 25025 | 0,88 | |
| Углерод (C) | 6 | 12.011 | 3,51 | +4 | 3550 | 4827 | 2,5 | 1086 | 0,77 |
| Азот (N) | 7 | 14,01 | 0,00125 | +5, -3 | -210 | -196 | 3,0 | 1402 | 0,70 |
| Кислород (O) | 8 | 16,00 | 0,00143 | -2, -1 | -218 | -183 | 3,5 | 1314 | 0,66 |
| Фтор (F) | 9 | 19,00 | 0,00169 | -1 | -220 | 900 22 -1884,0 | 1681 | 0,64 | |
| Неон (Ne) | 10 | 20,18 | 0,0009 | – | -249 | -246 | – | 2079 | 9002 2 1,6
| Элемент (sym) | # | Масса | плотность | оксид #’s | mp | bp | EN | Энергия ионизации | рад. |
|---|---|---|---|---|---|---|---|---|---|
| Скандий (Sc) | 21 | 44,96 | 3,0 | +3 | 1541 | 2831 | 1,3 | 632 | 1,44 |
| Титан (Ti) | 22 | 47,88 | 4,5 | +4 | 1660 | 3287 | 1,5 | 657 | 1,32 |
| Ванадий (V) | 23 | 50,94 | 6,0 | +5 | 1890 | 3380 | 1,5 | 649 | 1,22 |
| Хром (Cr) | 24 | 52,00 | 7,2 | +3, +6 | 1857 | 90 022 26721,6 | 653 | 1,18 | |
| Марганец (Mn) | 25 | 54,94 | 7,2 | +7, +4, +2 | 1244 | 1962 | 1,5 | 715 | 1,17 |
| Железо (Fe) | 26 | 55,85 | 7,9 | +3, +2 | 1535 | 9002 2 27501,8 | 757 | 1,17 | |
| Кобальт (Co) | 27 | 58,93 | 8,9 | +3, +2 | 1495 | 2870 | 1,8 | 757 | 1,16 |
| Никель (Ni) | 28 | 58,96 | 8,9 | +2 | 1453 | 2732 | 1,8 | 736 | 1,15 |
| Медь (Cu) | 29 | 63,55 | 8,9 | +2, +1 | 1083 | 900 22 25671,9 | 745 | 1,17 | |
| Цинк (Zn) | 30 | 65,39 | 7. 1 1 | +2 | 420 | 907 | 90 022 1,6908 | 1,25 |
 22
22| Элемент (sym) | # | Масса | плотность | оксид #’s | mp | bp | EN | Энергия ионизации | рад. |
|---|---|---|---|---|---|---|---|---|---|
| Ниобий (Nb) | 41 | 92,21 | 8,57 | +5, +4 | 2468 | 4742 | 1,6 | 665 | 1,43 |
| Молибден (Mo) | 42 | 95,94 | 10,22 | +6 | 2610 | 5560 | 1,8 | 686 | 1,36 |
| Техникум (ТС) | 43 | (98) | – | +7 | 2171 | 487 6 | 1,9 | 703 | 1,36 |
| Рутений (Ru) | 44 | 101. 07 07 | 12.41 | +3 | 2310 | 3900 | 2,2 | 711 | 1,33 |
| Родий (Rh) | 45 | 102,91 | 12,4 | +3 | 1966 | 372 7 | 2,2 | 720 | 1,35 |
| Палладий (Pd) | 46 | 106,42 | 12,26 | +2 | 1551 | 9 0022 31402,2 | 803 | 1,38 | |
| Серебро (Ag) | 47 | 107,87 | 10,5 | +1 | 962 | 2212 | 1,9 | 732 | 1,44 |
| Кадмий (Cd) | 48 | 112,41 | 8,65 | +2 | 321 | 90 022 7651,7 | 866 | 1,49 | |
| Индий (In) | 49 | 114,82 | 7,30 | +3 | 157 | 9002 2 20801,7 | 558, 1821, 2704, 5200 | 1,62 | |
| Олово (Sn) | 50 | 118,71 | 7,28 | +4, +2 | 232 | 90 022 22601,8 | 709 | 1,40 |

| Элемент (sym) | # | Масса | плотность | оксид #’s | т. пл. пл. | 903 84 п.н.EN | Энергия ионизации | рад. | |
|---|---|---|---|---|---|---|---|---|---|
| Прометий (Pm) | 61 | (145) | 7,26 | +3 | 1042 9000 6 | 3000 | 1,1 | 536 | 1,81 |
| Самарий (см) | 62 | 150.36 | 7.52 | +2, +3 | – | – | 1.1 | 544 | 1,8 |
| Европий (Eu) | 63 | 151,97 | 5,25 | +2, +3 | 822 | 1529 | 1,1 | 548 | 2,04 |
| Гадолиний (Gd) | 64 | 157,25 | 7,9 | +3 | 1312 | 90 022 32731.1 | 594 | 1,8 | |
| Тербий (Tb) | 65 | 158,93 | 8,23 | +3, +4 | 1365 | 3230 | 1,1 | 565 | 1,78 |
| Диспрозий (Dy) | 66 | 162,50 | 8,55 | +3 | 1412 | 2567 | 1,1 | 573 | 1,77 |
| Гольмий (Но) | 67 | 164,93 | 8,80 | +3 | 1472 | 2700 | 1,1 | 582 | 1,77 |
| Эрбий (Er) | 68 | 167,26 | 9,07 | +3 | 1529 | 90 022 28681,1 | 590 | 1,76 | |
| Тулий (Tm) | 69 | 168,93 | 9,32 | +2, +3 | 1545 9000 6 | 1950 | 1,1 | 598 | 1,75 |
| Иттербий (Yb) | 70 | 173,04 | 6,97 | +3 | 819 | 9 0022 11961,1 | 602 | 1,94 |

| Элемент (sym) | № | Масса | плотность | оксид № | т. пл. пл. | п.н. | EN | Энергия ионизации | рад. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Таллий (Tl) | 81 | 204,38 | 11,85 | +3, +1 | 304 | 1457 | 1,8 | 589, 1971, 2875, 4890 | 1,71 | |||
| Свинец (Pb) | 82 | 207,2 | 11,3 | +2, +4 | 328 | 9002 2 17401,8 | 716 | 1,47 | ||||
| Висмут (Би) | 83 | 208,98 | 9,80 | +3 | 271 | 90 022 15601,9 | 703 | 1,46 | ||||
| Полоний (Po) | 84 | (209) | 9,32 | +2 | 254 | 962 | 2,0 | 812 | 1,46 | |||
| Астатин (Ат) | 85 | (210) | – | -1 | 302 | 377 | 2,2 | – | 1,45 | |||
| Радон (Rn) | 86 | (222) | 9,76 | – | -71 | -62 | – | 1038 | – | |||
| Франций (Fr) | 87 | (223) | 2,4 | +1 | 27 | 677 | 0,7 | – | 2,7 11 40 | 0,9 | 510 | 2,2 |
| Актиний (Ac) | 89 | 227.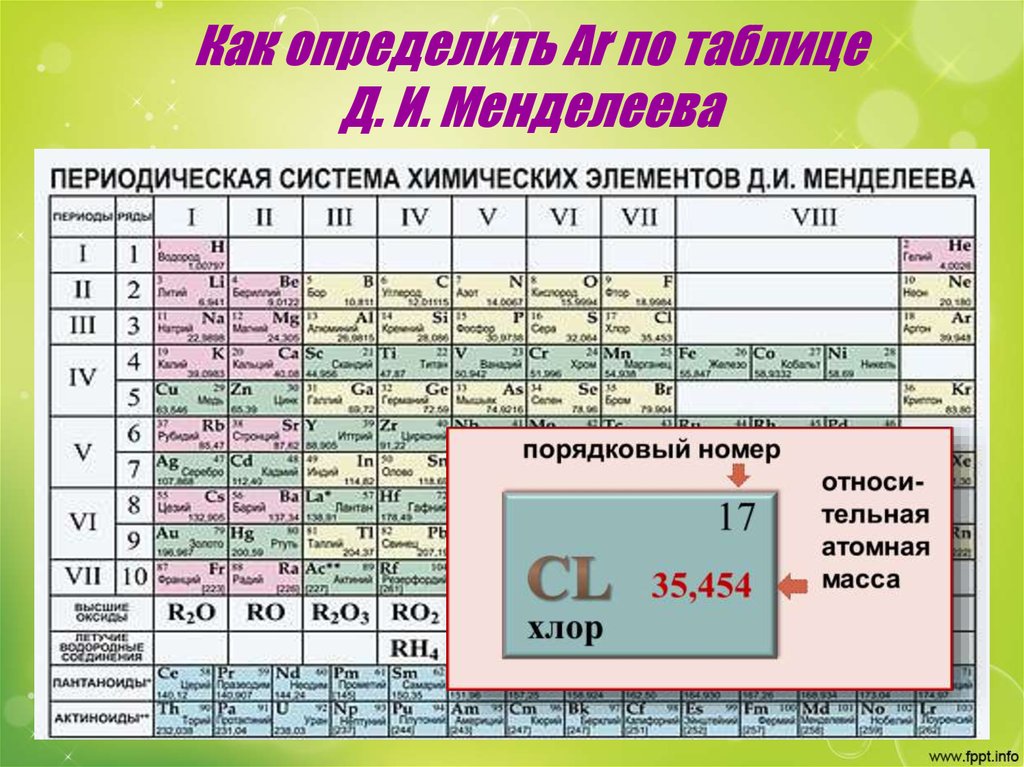 03 03 | – | +3 | 1050 | 3 300 | 1,1 | 665 | 1,88 | |||
| Торий (Th) | 90 | 232,04 | 11,5 | +4 | 1740 | 9002 2 47801,3 | – | 1,8 |
| Элемент (sym) | # | Масса | плотность | количество оксидов | т. пл. пл. | п.н. | |||
|---|---|---|---|---|---|---|---|---|---|
| Менделевий (Md) | 101 | (258) | – | +2, +3 | – | 9 0022 –– | – | – | |
| Нобелий (Нет) | 102 | (259) | – | +2, +3 | – | – 90 006 | – | – | – |
| Лоренсиум (Lr) | 103 | (260) | – | – | – | – 9000 6 | – | – | – |
2.5: Атомные массы – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 16176
- Аноним
- LibreTexts
Цели обучения
- Дать определение атомной массе и единице атомной массы.

- Рассчитать атомную массу.
Несмотря на то, что атомы представляют собой очень маленькие кусочки материи, они обладают массой. Однако их массы настолько малы, что химики часто используют для их выражения другую единицу измерения, а не граммы — атомную единицу массы. 9{12}C\:атом} \label{Eq1} \]
Равно 1,661 × 10 −24 г.
Массы других атомов выражены относительно атомной единицы массы. Например, масса атома 1 H равна 1,008 ед., масса атома 16 O равна 15,995 ед., а масса атома 32 S равна 31,97 ед. Обратите внимание, однако, что эти массы относятся к конкретным изотопам каждого элемента. Поскольку большинство элементов существует в природе в виде смеси изотопов, любой образец элемента на самом деле будет смесью атомов, имеющих немного разные массы (поскольку нейтроны оказывают существенное влияние на массу атома). Как же тогда описать массу данного элемента? Вычисляя среднее значение атомных масс элемента, взвешенное по природному содержанию каждого изотопа, мы получаем средневзвешенную массу, называемую атомной массой (также называемую 9-кратной массой). 3027 атомный вес ) элемента.
3027 атомный вес ) элемента.
Атомная масса представляет собой средневзвешенную массу изотопов
Как указано выше, большинство элементов встречаются в природе в виде смеси двух или более изотопов. Ниже (Таблица \(\PageIndex{1}\)) перечислены встречающиеся в природе изотопы выбранных элементов, а также процентное содержание каждого из них в природе.
| Элемент | Изотоп (символ) | 9{65}Cu}\)30,83 | 64,928 |
|---|
Для некоторых элементов один конкретный изотоп встречается намного больше, чем любые другие изотопы. Например, встречающийся в природе водород почти полностью состоит из водорода-1, а встречающийся в природе кислород почти полностью состоит из кислорода-16.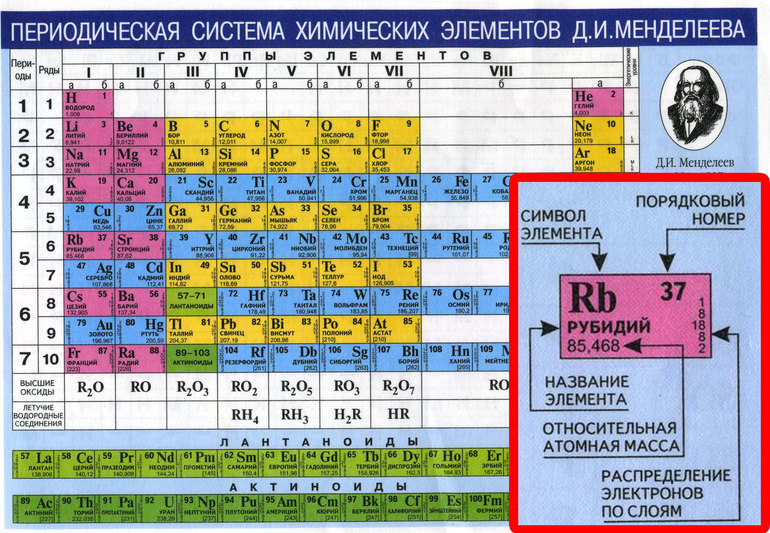 Однако для многих других элементов может существовать более одного изотопа в значительных количествах. Хлор (атомный номер 17) — ядовитый газ желтовато-зеленого цвета. Около трех четвертей всех атомов хлора имеют 18 нейтронов, что дает этим атомам массовое число 35. Около четверти всех атомов хлора имеют 20 нейтронов, что дает этим атомам массовое число 37. Если бы вы просто вычислили среднее арифметическое точных атомных масс, вы получите приблизительно 36,
Однако для многих других элементов может существовать более одного изотопа в значительных количествах. Хлор (атомный номер 17) — ядовитый газ желтовато-зеленого цвета. Около трех четвертей всех атомов хлора имеют 18 нейтронов, что дает этим атомам массовое число 35. Около четверти всех атомов хлора имеют 20 нейтронов, что дает этим атомам массовое число 37. Если бы вы просто вычислили среднее арифметическое точных атомных масс, вы получите приблизительно 36,
\[\frac{34,969 \,u + 36,966 \,u}{2} = 35,968 \,u \nonumber \]
Как видите, средняя атомная масса приведена в последнем столбце таблицы выше ( 35,453) значительно ниже. Почему? Причина в том, что нам нужно принять во внимание естественное процентное содержание каждого изотопа, чтобы вычислить то, что называется средневзвешенным . Атомная масса элемента представляет собой средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента.
\[0,7577 \left( 34,969 \,u \right) + 0,2423 \left( 36,966 \,u \right) = 35,453 \,u \nonnumber \]
Средневзвешенное значение определяется путем умножения процент естественного содержания на фактическую массу изотопа. Это повторяется до тех пор, пока не будет найден термин для каждого изотопа. Для хлора существует только два естественных изотопа, поэтому есть только два термина.
Это повторяется до тех пор, пока не будет найден термин для каждого изотопа. Для хлора существует только два естественных изотопа, поэтому есть только два термина.
Атомная масса = (%1)(масса 1) + (%2)(масса 2) + ⋯
Другой пример: кислород существует в виде смеси, состоящей из 99,759 % 16 O, 0,037 % 17 O и 0,204 % 18 O. Атомная масса кислорода (используйте данные о естественном содержании в процентах из таблицы 2.5.1) будет рассчитана следующим образом:
Атомная масса = ( %1)(масса 1) + (%2)(масса 2) + (%3)(масса 3)
\[0,99759 \влево( 15,995 ед \вправо) + 0,00037 \влево( 16,995 ед \вправо) +0,00204 \left( 17,999 u \right)= 15,999 u \nonumber \]
Чтобы подтвердить свой ответ, сравните вычисленное значение с массой взвешенного вещества, отображаемой в периодической таблице.
Пример \(\PageIndex{1}\)
Рассчитайте атомную массу кислорода. Кислород существует в виде смеси 3-х изотопов. Их соответствующие массы и естественная численность показаны ниже.
- 16 О: 15,995 ед. (99,759%)
- 17 О: 16,995 ед. (0,037%)
- 18 О: 17,999 ед. (0,204%)
Решение
Умножьте содержание изотопа на фактическую массу изотопа, а затем просуммируйте произведения.
\[0,99759 \влево( 15,995\, и \вправо) + 0,00037 \влево( 16,995 \,и \вправо) +0,00204 \влево( 17,999\, и \вправо) = 15,999\, и \номер \]
Упражнение \(\PageIndex{1}\)
Вычислите атомную массу меди. Медь существует в виде смеси двух изотопов. Их соответствующие массы и естественная численность показаны ниже.
- 63 Cu: 62,930 ед. (69,17%)
- 65 Cu: 64,928 ед. (30,83%)
- Ответ
63,546 и
Атомная масса каждого элемента находится под символом элемента в периодической таблице . Примеры показаны ниже. Атомная масса олова (Sn) составляет 118,71 ед., тогда как атомная масса углерода (С) составляет 12,011 ед. С другой стороны, атомный номер (Z) каждого элемента находится на выше атомного символа.
Атомная масса олова (Sn) составляет 118,71 ед., тогда как атомная масса углерода (С) составляет 12,011 ед. С другой стороны, атомный номер (Z) каждого элемента находится на выше атомного символа.
Атомная масса, указанная в записях Периодической таблицы. (общественное достояние; Pubchem)
Периодическую таблицу можно найти по этой ссылке:
https://pubchem.ncbi.nlm.nih.gov/periodic-table/png/Periodic_Table_of_Elements_w_Atomic_Mass_PubChem.png
Пример \(\PageIndex{ 2}\) : Масса углерода
Какова средняя масса атома углерода в граммах? Атомная масса находится в периодической таблице. Пожалуйста, используйте два десятичных знака.
Решение
Это простое одношаговое преобразование, подобное преобразованиям, которые мы делали в главе 1. Мы используем тот факт, что 1 u = 1,661 × 10 9{-22}\:g}\)
Упражнения по обзору концепции
- Дайте определение атомной массе.
 Почему он считается средневзвешенным?
Почему он считается средневзвешенным? - Что такое атомная единица массы?
Ответы
- Атомная масса – это среднее значение атомных масс элемента, взвешенное по природному содержанию каждого изотопа этого элемента. Это средневзвешенное значение, потому что разные изотопы имеют разные массы.
- Атомная единица массы равна 1/12 массы 12 С атом.
Key Takeaway
- Масса атомов в значительной степени зависит от количества протонов и нейтронов в их ядре.
- Атомная масса каждого элемента в Периодической таблице представляет собой средневзвешенную массу всех его изотопов.
Эта страница под названием 2.5: Atomic Masses распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована Anonymous с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Аноним
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Программа ООР или издатель
- Издатель, имя которого нельзя называть
- Показать страницу Содержание
- нет на странице
- Теги
- source@https://2012books.

- source@https://2012books.


 Почему он считается средневзвешенным?
Почему он считается средневзвешенным?