Таблица Менделеева online – Te
Te
52
6
18
18
8
2
127.60±3
5s25p4
Теллур
| Относительная электроотрицательность (по Полингу): | 2,01 |
| Температура плавления: | 449,5°C |
| Температура кипения: | 989,9°C |
| Теплопроводность: | 0 |
| Плотность: | 6,24 г/см3 |
| Открыт: | Мюллер фон Рейхенштейн |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Неметалл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f05s25p4 |
| Электронная формула: |
Te – 1s2 2s2 2p6 3s2 Te – [Kr] 5s2 4d10 5p4 |
| Валентность: | -2, (+2), +4, +6 |
| Степени окисления: | -II, 0, +IV, VI |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 9,01 В 18,6 В 27,96 В |
Электропроводность в тв. фазе: фазе: |
6,25*102 при 273K |
| Ковалентный радиус: | |
| Атомный объем: | 20,5 см3/моль |
| Атомный радиус: | 1,42 Å |
| Теплота распада: | 17,49 Кдж/моль |
| Теплота парообразования: | 52,55 Кдж/моль |
| Кристаллическая структура: | Гексагональная. Радиус описанной вокруг основания окружности не равен высоте фигуры. Боковая сторона перпендикулярна основанию |
Реклама
Изотопы
| Символ нуклида |
N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 105Te | 52 | 53 | 104,94364 | 1 мкс | 5/2+ |
| 106Te | 52 | 54 | 105,93750 | 70 мкс | 0+ |
| 107Te | 52 | 55 | 106,93501 | 3,1 мс | 5/2+ |
| 108Te | 52 | 56 | 107,92944 | 2,1 с | 0+ |
| 109Te | 52 | 57 | 108,92742 | 4,6 с | 5/2+ |
| 110Te | 52 | 58 | 109,92241 | 18,6 с | 0+ |
| 111Te | 52 | 59 | 110,92111 | 19,3 с | 5/2+ |
| 112Te | 52 | 60 | 111,91701 | 2,0 мин | 0+ |
| 52 | 61 | 112,91589 | 1,7 мин | 7/2+ | |
| 114Te | 52 | 62 | 113,91209 | 15,2 мин | 0+ |
| 115Te | 52 | 63 | 114,91190 | 5,8 мин | 7/2+ |
| 115m1Te | 10 кэВ | 6,7 мин | 1/2+ | ||
| 115m2Te | 280,05 кэВ | 7,5 мкс | 11/2- | ||
| 116Te | 52 | 64 | 115,90846 | 2,49 ч | 0+ |
| 117Te | 52 | 65 | 116,908645 | 62 мин | 1/2+ |
| 117mTe | 296,1 кэВ | 103 мс | 11/2- | ||
| 118Te | 52 | 66 | 117,905828 | 6,00 сут | 0+ |
| 119Te | 52 | 67 | 118,906404 | 16,05 ч | 1/2+ |
| 119mTe | 260,96 кэВ | 4,70 сут | 11/2- | ||
| 120Te | 52 | 119,90402 | стабилен | 0+ | |
| 121Te | 52 | 69 | 120,904936 | 19,16 сут | 1/2+ |
| 121mTe | 293,991 кэВ | 154 сут | 11/2- | ||
| 122Te | 52 | 70 | 121,9030439 | стабилен | 0+ |
| 123Te | 52 | 71 | 122,9042700 | стабилен | 1/2+ |
| 123mTe | 247,47 кэВ | 119,2 сут | 11/2- | ||
| 124Te | 52 | 72 | 123,9028179 | стабилен | 0+ |
| 125Te | 52 | 73 | 124,9044307 | стабилен | 1/2+ |
| 125mTe | 144,772 кэВ | 57,40 сут | 11/2- | ||
| 126Te | 52 | 74 | 125,9033117 | стабилен | 0+ |
| 127Te | 52 | 75 | 126,9052263 | 9,35 ч | 3/2+ |
| 127mTe | 88,26 кэВ | 109 сут | 11/2- | ||
| 128Te | 52 | 76 | 127,9044631 | 2,2·1024 лет | 0+ |
| 128mTe | 2,7907 МэВ | 370 нс | 10+ | ||
| 129Te | 52 | 77 | 128,9065982 | 69,6 мин | 3/2+ |
| 129mTe | 105,50 кэВ | 33,6 сут | 11/2- | ||
| 130 |
52 | 78 | 129,9062244 | 7,9·1020 лет | 0+ |
| 130m1Te | 2,14641 МэВ | 115 нс | 7- | ||
| 130m2Te | 2,661 МэВ | 1,90 мкс | 10+ | ||
| 130m3Te | 4,3754 МэВ | 261 нс | |||
| 131Te | 52 | 79 | 130,9085239 | 25,0 мин | 3/2+ |
| 131mTe | 182,250 кэВ | 30 ч | 11/2- | ||
| 132Te | 52 | 80 | 131,908553 | 3,204 сут | 0+ |
| 133Te | 52 | 81 | 132,910955 | 12,5 мин | 3/2+ |
| 133mTe | 334,26 кэВ | 55,4 мин | 11/2- | ||
| 134Te | 52 | 82 | 133,911369 | 41,8 мин | 0+ |
| 134mTe | 1,69134 МэВ | 164,1 нс | 6+ | ||
| 135Te | 52 | 83 | 134,91645 | 19,0 с | 7/2- |
| 135mTe | 1,55488 МэВ | 510 нс | 19/2- | ||
| 136Te | 52 | 84 | 135,92010 | 17,63 с | 0+ |
| 137Te | 52 | 85 | 136,92532 | 2,49 с | 3/2- |
| 138Te | 52 | 86 | 137,92922 | 1,4 с | 0+ |
| 139Te | 52 | 87 | 138,93473 | 500 мс | 5/2- |
| 140Te | 52 | 88 | 139,93885 | 300 мс | 0+ |
| 141Te | 52 | 89 | 140,94465 | 100 мс | 5/2- |
| 142Te | 52 | 90 | 141,94908 | 50 мс | 0+ |
Теллур
| Теллур | |
|---|---|
| Атомный номер | 52 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
127,6 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 160 пм |
|
Энергия ионизации (первый электрон) |
869,0 (9,01) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p4 |
| Химические свойства | |
| Ковалентный радиус | 136 пм |
| Радиус иона | (+6e) 56 211 (-2e) пм |
|
Электроотрицательность (по Полингу) |
2,1 |
| Электродный потенциал | 0 |
| Степени окисления | +6, +4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 6,24 г/см³ |
| Молярная теплоёмкость | 25,8 Дж/(K·моль) |
| Теплопроводность | 14,3 Вт/(м·K) |
| Температура плавления | 722,7 K |
| Теплота плавления | 17,91 кДж/моль |
| Температура кипения | 1 263 K |
| Теплота испарения | 49,8 кДж/моль |
| Молярный объём | 20,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | 4,450 Å |
| Отношение c/a | 1,330 |
| Температура Дебая | n/a K |
| Te | 52 |
| 127,60 | |
| 5s25p4 | |
| Теллур | |
Теллур —химический элемент с атомным номером 52 в периодической системе и атомной массой 127,60; обозначается символом Te (Tellurium), относится к семейству металлоидов.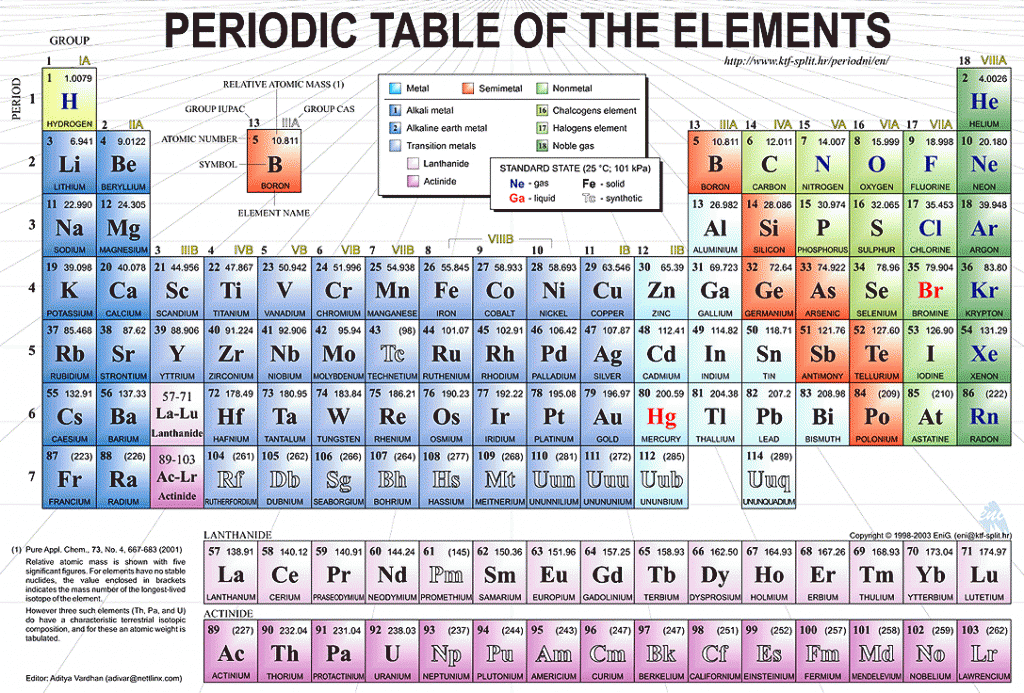
История
Впервые был найден в1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
Происхождение названия
От латинского tellus, родительный падеж telluris, Земля.
Нахождение в природе
Содержание в земной коре 1·10-6 % по массе. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, тетрадимит Bi2Te2S. Встречаются кислородные соединения теллура, например ТеО2 — теллуровая охра.
Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Важный источник теллура — медные и свинцовые руды.
Получение
Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO2.
Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO2.
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО2, а H2SeO3 остается в растворе.
Из оксида ТеО2 теллур восстанавливают углем.
Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na2Te2:
- 6Te + 2Al + 8NaOH = 3Na2Te2 + 2Na[Al(OH)4].
Для осаждения теллура через раствор пропускают воздух или кислород:
- 2Na2Te2 + 2H2O + O2 = 4Te + 4NaOH.
Для получения теллура особой чистоты его хлорируют
-
Te + 2Cl2 = TeCl4.

Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой:
- TeCl4 + 2H2O = TeO2 + 4HCl,
а образовавшийся ТеО2 восстанавливают водородом:
- TeO2 + 4H2 = Te + 2H2O.
Цены
Теллур — редкий элемент, и значительный спрос при малом объёме добычи определяет высокую его цену (около 200—300 долл. за кг в зависимости от чистоты), но, несмотря на это, диапазон областей его применения постоянно расширяется.
Физико-химические свойства
Теллур — хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвет красно-коричневый, в парах — золотисто-жёлтый.
Химически теллур менее активен, чем сера. Он растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100°С, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te02.
С водой металлический теллур начинает реагировать при 100°С, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te02.
При нагреве на воздухе теллур сгорает, образуя Te02. Это прочное соединение обладает меньшей летучестью, чем сам теллур. Поэтому для очистки теллура от оксидов их восстанавливают проточным водородом при 500-600 °С.
В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Применение
Сплавы
Теллур применяется в производстве сплавов свинца с повышенной пластичностью и прочностью (применяемых, например, при производстве кабелей). При введении 0,05 % теллура потери свинца на растворение под воздействием серной кислоты снижаются в 10 раз, и это используется при производстве свинцово-кислотных аккумуляторов. Так же важно то обстоятельство, что легированный теллуром свинец при обработке пластической деформацией не разупрочняется, и это позволяет вести технологию изготовления токоотводов аккумуляторных пластин методом холодной высечки и значительно увеличить срок службы и удельные характеристики аккумулятора.
Термоэлектрические материалы
Монокристалл теллурида висмута
Также велика его роль в производстве полупроводниковых материалов и, в частности, теллуридов свинца, висмута, сурьмы, цезия. Очень важное значение в ближайшие годы приобретёт производство теллуридов лантаноидов, их сплавов и сплавов с селенидами металлов для производства термоэлектрогенераторов с весьма высоким (до 72—78 %) КПД, что позволит применить их в энергетике и в автомобильной промышленности.
Так, например, недавно обнаружена очень высокая термо-ЭДС в теллуриде марганца (500 мкВ/К) и в его сочетании с селенидами висмута, сурьмы и лантаноидов, что позволяет не только достичь весьма высокого КПД в термогенераторах но и осуществить уже в одной ступени полупроводникового холодильника охлаждение вплоть до области криогенных (температурный уровень жидкого азота) температур и даже ниже. Лучшим материалом на основе теллура для производства полупроводниковых холодильников в последние годы явился сплав теллура, висмута и цезия, который позволил получить рекордное охлаждение до −237 °C. В то же время, как термоэлектрический материал, перспективен сплав теллур-селен (70 % селена), который имеет коэффициент термо-ЭДС около 1200 мкВ/К.
В то же время, как термоэлектрический материал, перспективен сплав теллур-селен (70 % селена), который имеет коэффициент термо-ЭДС около 1200 мкВ/К.
Узкозонные полупроводники
Совершенно исключительное значение также получили сплавы КРТ (кадмий-ртуть-теллур), которые обладают фантастическими характеристиками для обнаружения излучения от стартов ракет и наблюдения за противником из космоса через атмосферные окна (не имеет значение облачность). КРТ является одним из наиболее дорогих материалов в современной электронной промышленности.
Высокотемпературная сверхпроводимость
Ряд систем, имеющих в своем составе теллур, недавно обнаружили существование в них трёх (возможно четырёх) фаз, сверхпроводимость в которых не исчезает при температуре несколько выше температуры кипения жидкого аммиака.
Производство резины
Отдельной областью применения теллура является его использование в процессе вулканизации каучука.
Производство халькогенидных стёкол
Варке специальных марок стекла (где он применяется в виде двуокиси), кроме того, некоторые стёкла на основе теллура являются полупроводниками (достоинство таких стёкол — прозрачность, легкоплавкость и электропроводность), что, в свою очередь, нашло применение в конструировании специальной химической аппаратуры (реакторов).
Источники света
Ограниченное применение теллур находит для производства ламп с его парами — они имеют спектр, очень близкий к солнечному.
CD-RW
Сплав теллура применяется в перезаписываемых компакт-дисках (в частности, фирмы Mitsubishi Chemical Corporation марки «Verbatim») для создания деформируемого отражающего слоя.
Биологическая роль
Микроколичества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена.
Физиологическое действие
Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. ПДК в воздухе колеблется для различных соединений 0,007—0,01 мг/м³, в воде 0,001—0,01 мг/л.
При отравлениях теллур выводится из организма в виде отвратительно пахнущих теллурорганических соединений — алкилтеллуридов.
теллур | химический элемент | Британика
теллур
См. все СМИ
все СМИ
- Связанные темы:
- химический элемент элемент кислородной группы
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
теллур (Te) , полуметаллический химический элемент группы кислорода (группа 16 [VIa] периодической таблицы), близкий по химическим и физическим свойствам элементу селену. Теллур — серебристо-белый элемент со свойствами, промежуточными между металлами и неметаллами; он составляет примерно одну часть на миллиард земной коры. Подобно селену, он реже встречается в несвязанном виде, чем в виде соединений таких металлов, как медь, свинец, серебро или золото, и получается в основном как побочный продукт рафинирования меди или свинца. Большого применения теллуру не нашли.
| Атомная номер | 52 |
|---|---|
| Атомальный вес | 127,60 |
| MASSES of STABLE ISOTOPES | |
| MASSES of STABLE ISOTOPES | |
| MASSES of STABLE ISOTOPES | |
| MASSES STABLE ISOTOPES | |
. | |
| melting point | 449.8 °C (841.6 °F) |
| boiling point | 989.9 °C (1,813.8 °F) |
| oxidation states | −2, +2, +4, +6 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 4 d 10 5 s 2 5 p 4 |
History
Элемент теллур был выделен до того, как стало известно, что он представляет собой элементарную разновидность. Около 1782 года австрийский минералог Франц Йозеф Мюллер фон Райхенштейн работал с рудой, называемой немецким золотом. Из этой руды он получил материал, неподдающийся его попыткам анализа и названный им 9. 0067 проблемный металл . В 1798 году Мартин Генрих Клапрот подтвердил наблюдения Мюллера и установил элементарную природу вещества. Он назвал элемент в честь человеческого «небесного тела» Теллуса, или Земли.
0067 проблемный металл . В 1798 году Мартин Генрих Клапрот подтвердил наблюдения Мюллера и установил элементарную природу вещества. Он назвал элемент в честь человеческого «небесного тела» Теллуса, или Земли.
Возникновение и подготовка
Спрос на теллур не соответствует спросу на селен. Эти два элемента вместе встречаются во многих рудах; их можно выделить, применяя способы, описанные в связи с селеном, получая растворы, содержащие соли как селенистой, так и теллуровой кислот, H 2 SeO 3 и H 2 TeO 3 . При обработке этих растворов серной кислотой из-за малой растворимости выделяется диоксид теллура TeO 2 , а селенистая кислота остается растворенной. Диоксид теллура можно превратить в элементарный теллур обработкой диоксидом серы; электролитический процесс используется для очистки продукта.
Япония, США и Канада являются крупнейшими производителями теллура в мире.
Физические и химические свойства
В теллуре практически отсутствует ковалентная связь, необходимая для образования больших кольцевых и цепных молекул за счет катетенации. Элемент кристаллизуется в ромбоэдрической форме. Он серебристо-белый и изоморфен серому селену, т. е. строение и размеры кристаллов очень похожи. Он хрупкий, но не очень твердый. Атомы теллура образуют в кристалле спиральные цепочки с расстояниями Te–Te 3,74 Å.
Элемент кристаллизуется в ромбоэдрической форме. Он серебристо-белый и изоморфен серому селену, т. е. строение и размеры кристаллов очень похожи. Он хрупкий, но не очень твердый. Атомы теллура образуют в кристалле спиральные цепочки с расстояниями Te–Te 3,74 Å.
Элемент плохо проводит тепло и хорошо проводит электричество. Теллур горит на воздухе или в кислороде сине-зеленым пламенем, образуя двуокись (TeO 2 ). На него не действует соляная кислота, но азотная кислота или царская водка (смесь азотной и соляной кислот) окисляют его до теллуровой кислоты (H 2 TeO 3 ). Он реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и соединяется с большинством металлов при повышенных температурах с образованием теллуридов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Несмотря на то, что запасы этого элемента достаточны, не было разработано ни одного одноразового применения, создающего большой спрос на него.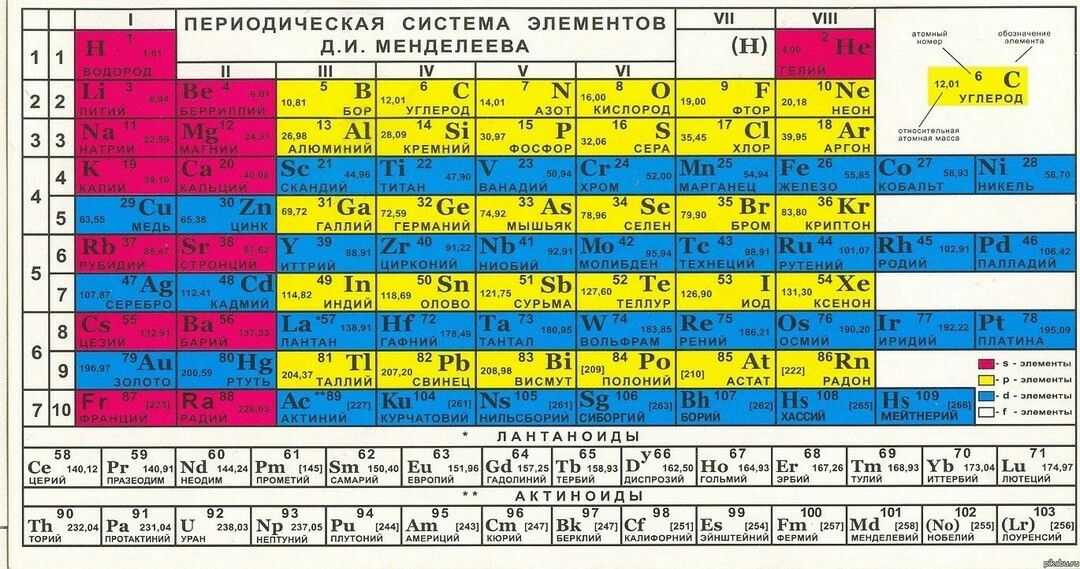 Небольшие количества теллура повышают пластичность алюминиевых сплавов, твердость и прочность на растяжение сплавов олова, обрабатываемость нержавеющей стали и меди; в свинце и в марганцево-магниевых сплавах повышает коррозионную стойкость. Теллурид висмута и теллурид свинца представляют собой полупроводниковые материалы, которые использовались в термоэлектрических устройствах либо в качестве источников электричества, либо для целей охлаждения.
Небольшие количества теллура повышают пластичность алюминиевых сплавов, твердость и прочность на растяжение сплавов олова, обрабатываемость нержавеющей стали и меди; в свинце и в марганцево-магниевых сплавах повышает коррозионную стойкость. Теллурид висмута и теллурид свинца представляют собой полупроводниковые материалы, которые использовались в термоэлектрических устройствах либо в качестве источников электричества, либо для целей охлаждения.
Te Информация об элементе теллура: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура теллура
Твердотельная структура теллура Простая тригональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| A | B | C | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 445,72 PM | 445.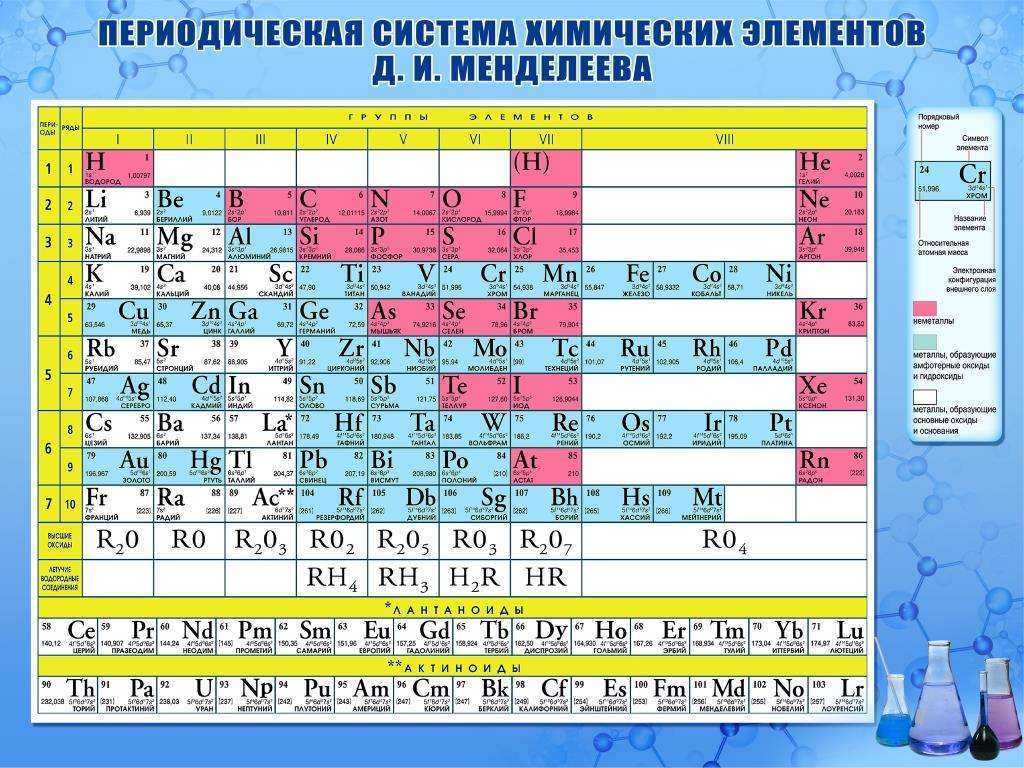 72. 72. | 592.9 PM |
| Alpha | Beta | Гамма | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| π/2 | π/2 | 2 π/3 | 9030 π/2 | 2 π/3 | 9030 π/2 | 2 π/3 | π/2 | 2 π/3 | π/2 | 2 π/3 | π/2 | 2 π/3 | π/2 | 2 π/3 | π/2 | . набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.Космическая группа номер | 152 | |||||
| Кристаллическая структура | Простой тригональный |
Атомная атомная и орбитальная свойства
. 6] с символом атомного термина (квантовые числа) 3 P 2 .
6] с символом атомного термина (квантовые числа) 3 P 2 .
| Атомный номер | 52 |
| Число электронов (бесплатно) | 52 |
| Number of Protons | 52 |
| Mass Number | 128 |
| Number of Neutrons | 76 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 18, 6 |
| Электронная конфигурация | [KR] 4D10 5S2 5P4 |
| Валентные электроны | 5S2 5P4 |
| Валентность (валентность) | |
| (валантность) | 7|
| (Vally) | 7|
| (Vally) | |
| .0031 | |
| Основные степени окисления | -2, 2, 4, 6 |
| Степени окисления | -2, -1, 0, 1, 2, 3, 4, 5, 6 Atomic 90 | 3 P 2 |
Atomic Model of Electron -Electron -Electrium на уровне
.
 Теллур
ТеллурСокращенная электронная конфигурация основного состояния нейтрального атома теллура [Kr] 4d10 5s2 5p4. Часть конфигурации теллура, эквивалентная благородному газу предшествующего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5s2 5p4, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального теллура
Полная электронная конфигурация основного состояния атома теллура. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p4 Правило Хунда.
 …
…Атомная структура теллура
Атомный радиус теллура составляет 123 пм, а его ковалентный радиус составляет 135 пм.
| Вычисленный атомный радиус | 123 пм (1,23 Å) | |||||||
| Atomic Radius Empirical | 140 pm (1.4 Å) | |||||||
| Atomic Volume | 20.449 cm3/mol | |||||||
| Covalent Radius | 135 pm (1.35 Å) | |||||||
| Van der Радиус Waals | 206 PM | |||||||
| Нейтронный сечение | 5,4 | |||||||
ОБСЛУЖИВАНИЕ НЕТРОННА0165Теллур Химические свойства: Энергия ионизации теллура и сродство к электрону Сродство к электрону теллура составляет 190,2 кДж/моль.
Ionization energy number | Enthalpy – kJ/mol | | ||||||
| 1st | 869.3 | |||||||
| 2nd | 1790 | |||||||
| 3rd | 2698 | |||||||
| 4th | 3610 | |||||||
| 5th | 5668 | |||||||
| 6th | 6820 | |||||||
| 7th | 13200 |
Tellurium Physical Proterties
Tellurium.0117
Refer to below table for Tellurium Physical Properties
| Density | 6.24 g/cm3(when liquid at m.p density is $5. 7 g/cm3) 7 g/cm3) |
| Molar Volume | 20.449 cm3/mol |
Elastic Properties
| Young Modulus | 43 |
| Shear Modulus | 16 GPa |
| Bulk Modulus | 65 GPa |
| Poisson Ratio | – |
Hardness of Tellurium – Tests to Measure of Hardness of Element
| Mohs Hardness | 2.25 MPa |
| Vickers Hardness | – |
| Brinell Hardness | 180 МПа |
Теллур Электрические свойства
Теллур является проводником электричества. Электрические свойства теллура 9 см. в таблице ниже.0003
| Electrical Conductivity | 10000 S/m |
| Resistivity | 0.0001 m Ω |
| Superconducting Point | – |
Tellurium Heat and Conduction Properties
| Thermal Conductivity | 3 Вт/(м·К) |
| Тепловое расширение | – |
Магнитные свойства теллура
| Magnetic Type | Diamagnetic |
| Curie Point | – |
| Mass Magnetic Susceptibility | -3. 9e-9 m3/kg 9e-9 m3/kg |
| Molar Magnetic Susceptibility | -4.98e-10 m3/ моль |
| Объемная магнитная восприимчивость | -0,0000243 |
Оптические свойства теллура
| Показатель преломления 9,0030 9,003091 |
Акустические свойства Tellurium
| Скорость звука | 2610 м/с |
.
Enthalpies of Tellurium
| Heat of Fusion | 17.5 kJ/mol |
| Heat of Vaporization | 48 kJ /моль |
| Теплота сгорания | – |
Изотопы теллура.
 Ядерные свойства теллура
Ядерные свойства теллураТеллур имеет 38 изотопов, содержащих от 105 до 142 нуклонов. Теллур имеет 5 стабильных естественных изотопов.
Изотопы теллура – Встречающиеся в природе стабильные изотопы: 120Te, 122Te, 124Te, 125Te, 126Te.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 105Te | 52 | 53 | 105 | Synthetic | |||||||||||||||||
| 106Те | 52 | 54 | 106 | Synthetic | |||||||||||||||||
| 107Te | 52 | 55 | 107 | Synthetic | |||||||||||||||||
| 108Te | 52 | 56 | 108 | Synthetic | |||||||||||||||||
| 109Te | 52 | 57 | 109 | Синтетический | |||||||||||||||||
| 110TE | 52 | 58 | 110 | 58 | 110 | 58 | 110 | 110 | 110 | 110 | 0031 | ||||||||||
| 111Te | 52 | 59 | 111 | Synthetic | |||||||||||||||||
| 112Te | 52 | 60 | 112 | Synthetic | |||||||||||||||||
| 113Te | 52 | 61 | 113 | Синтетический | |||||||||||||||||
| 114TE | 52 | 62 | 114 | 0027 | 115Te | 52 | 63 | 115 | Synthetic | ||||||||||||
| 116Te | 52 | 64 | 116 | Synthetic | |||||||||||||||||
| 117Te | 52 | 65 | 117 | Synthetic | |||||||||||||||||
| 118Te | 52 | 66 | 118 | Synthetic | |||||||||||||||||
| 119Te | 52 | 67 | 119 | Synthetic | |||||||||||||||||
| 120Te | 52 | 68 | 120 | 0. 09% 09% | Stable | N/A | |||||||||||||||
| 121Te | 52 | 69 | 121 | Synthetic | |||||||||||||||||
| 122Te | 52 | 70 | 122 | 2.55% | Stable | N/A | |||||||||||||||
| 123Te | 52 | 71 | 123 | 0.89% | Stable | N/A | |||||||||||||||
| 124Te | 52 | 72 | 124 | 4.74% | Stable | N/A | |||||||||||||||
| 125te | 52 | 73 | 125 | 7,07% | Стабильная | N/A | |||||||||||||||
| 126TE | 52 | 126TE | 52 | 126TE | 52 | 126TE | 131313131313131313131313131313131313131313131313131313131313 гг.0031 | N/A | |||||||||||||
| 127Te | 52 | 75 | 127 | Synthetic | |||||||||||||||||
| 128Te | 52 | 76 | 128 | 31. |


