Строение атома теллура (Te), схема и примеры
Общие сведения о строении атома теллура
Относится к элементам p-семейства. Металлоид. Обозначение – Te. Порядковый номер – 52. Относительная атомная масса – 127,60 а.е.м.
Электронное строение атома теллура
Атом теллура состоит из положительно заряженного ядра (+52), внутри которого есть 52 протона и 76 нейтронов, а вокруг, по пяти орбитам движутся 52 электрона.
Рис.1. Схематическое строение атома теллура.
Распределение электронов по орбиталям выглядит следующим образом:
+52Te)2)8)18)18)6;
1s22s22p63s23p63d104s24p64d105s25p4.
Внешний энергетический уровень атома теллура содержит 6 электронов, которые являются валентными.
Валентные электроны атома теллура можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
|
p |
5 |
1 |
+1 |
+1/2 |
|
|
5 |
1 |
-1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ТЕЛЛУР (лат.
 Tellurium) – Полуметаллы – Элементы – Каталог статей
Tellurium) – Полуметаллы – Элементы – Каталог статейСимвол элемента: Te.
Атомный номер: 52.
Положение в таблице: 5-й период, группа – VIA(16).
Относительная атомная масса: 127,60.
Степени окисления: –2, +2, +4, +6.
Валентности: II,IV и VI.
Электроотрицательность:2,10.
Электронная конфигурация: [Kr]5 s2 p4.
Теллур — хрупкое серебристо-белое вещество с металлическим блеском.
Природный теллур состоит из восьми стабильных изотопов: 120 Te (содержание 0,089% по массе), 122 Te (2,46%), 123 Te (2,46%), 124 Te (4,74%), 125 Te (7,03%), 126 Te (18,72%),
Строение атома
Число электронов: 52.
Число протонов: 52.
Радиус нейтрального атома: 0,17 нм.
Радиусы ионов Te 2–— 0,207 нм (координационное число 6), Te4+ — 0,066 нм (3), 0,08 нм (4), 0,111 нм (6), Te 6+ — 0,057 (4) и 0,070 нм (6).
Энергии последовательной ионизации атома 9,009, 18,6, 28,0,
История открытия
Впервые был обнаружен в 1782 в золотоносных рудах Трансильвании горным инспектором Ф. И. Мюллером, принявшем его за новый металл. В 1798 М. Г. Клапрот выделил теллур и определил важнейшие его свойства.
Нахождение в природе
Содержание в земной коре 1·10 –6 % по массе. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe 4 , калаверит AuTe 2 , тетрадимит Bi 2 Te 2 S. Встречаются кислородные соединения теллура, например ТеО 2 — теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17% Те и 0,06% Se).
Вaжный источник теллура — медные и свинцовые руды.
Получение
Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2 , а селенистая кислота остается в растворе.
Для выделения Te из шламов используют их спекание с содой с последующим выщелачиванием. Те переходит в щелочной раствор, из которого при нейтрализации он осаждается в виде TeO 2 :
Na 2 TeO 3 +2HC=TeO 2 (осадок)+2NaCl.
Из оксида ТеО
Для очистки теллура от S и Se используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2 :
6Te+2Al+8NaOH=3Na 2 Te 2 +2Na[Al(OH) 4 ].
Для осаждения теллура через раствор пропускают воздух или кислород:
2Na 2 Te 2 +2H 2 O+O 2 =4Te+4NaOH.
Для получения теллура особой чистоты его хлорируют:
Te+2Cl 2 =TeCl 4.
Образующийся тетрахлорид очищают дистилляцей или ректификацией. Затем тетрахлорид гидролизуют водой:
а образовавшийся ТеО 2 восстанавливают водородом:
TeO 2 +4H 2 =Te+2H 2 O.
Физические и химические свойства
Тaллур — хрупкое серебристо-белое вещество с металлическим блеском. Кристаллическая решетка гексагональная, a=0,44566 нм, c=0,59268 нм. Структура состоит из параллельно расположенных спиральных цепочек. Плотность 6,247 г/см 3 . Температура плавления 449,8°C, кипения 990°C. В тонких слоях на просвет красно-коричневый, в парах — золотисто-желтый.
Полупроводник p-типа. Ширина запрещенной зоны 0,32 эВ. Электропроводность увеличивается при освещении.
При осаждении из растворов выделяется аморфный теллур, плотность 5,9 г/см 3 . При 4,2 ГПа и 25°C образуется модификация со структурой типа b -Sn (Тe-II). При 6,3 ГПа получена модификация Те-III с ромбоэдрической структурой. Те-II и Te-III проявляют свойства металлов.
Устойчив на воздухе при комнатной температуре даже в мелкодисперсном состоянии. При нагревании на воздухе сгорает голубовато-зеленым пламенем с образованием диоксида TeO 2 . Стандартный потенциал полуреакции:
TeO 32– +3H 2 O+4e=Te+6OH – : 0,56В.
При 100–160°C окисляется водой:
Te+2H 2 O= TeO 2 +2H 2
При кипячении в щелочных растворах теллур диспропорционирует с образование теллурида и теллурита:
8Te+6KOH=2K 2 Te+ K 2 TeO 3 +3H 2 O.
С соляной и разбавленной серной кислотами Te не взаимодействует.
 Концентрированная H 2 SO 4 растворяет Te, образующиеся катионы Te 4 2+ окрашивают раствор в красный цвет. Разбавленная HNO 3 окисляет Te до теллуристой кислоты H 2 TeO 3 :
Концентрированная H 2 SO 4 растворяет Te, образующиеся катионы Te 4 2+ окрашивают раствор в красный цвет. Разбавленная HNO 3 окисляет Te до теллуристой кислоты H 2 TeO 3 :Сильные окислители (HClO 3 , KMnO 4 ) окисляют Te до слабой теллуровой кислоты H 6 TeO 6 :
Te+HClO 3 +3H 2 O=HCl+H 6 TeO 6 .
С галогенами (кроме фтора) образует тетрагалогениды. Фтор окисляет Te до гексафторида TeF6.
Теллуроводород H 2 Te — бесцветный ядовитый газ с неприятным запахом образуется при гидролизе теллуридов.
Соединения теллура (+2) неустойчивы и склонны к диспропорционированию:
2TeCl 2 =TeCl 4 +Te.
Применение
Основное применение Te и его соединений — полупроводниковая техника. Добавки Te в чугун и сталь, свинец или медь повышают их механическую и химическую стойкость. Те и его соединения применяют в производстве катализаторов, специальных стекол, инсектицидов, гербицидов.
Добавки Te в чугун и сталь, свинец или медь повышают их механическую и химическую стойкость. Те и его соединения применяют в производстве катализаторов, специальных стекол, инсектицидов, гербицидов.
Физиологическая роль
Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. ПДК в воздухе 0,01 мг/м3 , в воде 0,01 мг/л. При отравлениях теллур выводится из организма в виде отвратительно пахнущих теллурорганических соединений.
Микроколичества Te всегда содержатся в живых организмах, его биологическая роль не выяснена.
Элементы главной подгруппы VI группы. Задачи 840
Задача 840.
Исходя из строения атомов серы, селена и теллура, указать, какие валентные состояния и степени окисленности характерны для этих элементов. Каковы формулы их высших гидроксидов? Ответ пояснить.
Решение:
Атомы S, Se и Te на внешнем энергетическом уровне содержат по шесть электронов (ns2р4) – два на s-орбитали и четыре на р-орбитали. Графически это можно представить так:
Графически это можно представить так:
Поэтому в стационарном состоянии эти элементы, имея по два неспаренных р-электрона, проявляют ковалентность равную 2. У S, Se и Te число неспаренных электронов в атоме может быть увеличено путём перевода s- и р-электронов на d-подуровень внешнего слоя. В связи с этим, указанные элементы проявляют ковалентность, равную не только 2, но также и 4, и 6. Так, при возбуждении атомов S, Se и Te р-электрон может быть переведён на свободную d-орбиталь и, тогда атом приобретает четыре неспаренных электрона. В связи с этим, указанные элементы проявляю ковалентность равную 4. Графически это можно представить так:
путём перевода, при возбуждении атома, р- и s-электронов на d-подуровень внешнего слоя, что приводит к образованию шести неспаренных электронов у атома во внешнем электронном слое. В связи с этим, указанные элементы проявляю ковалентность равную 6. Графически это можно представить так:
Таким образом, S, Se и Te в своих соединениях могут проявлять как отрицательную (-2), так и положительную степень окисления (+2, +4 и 6). В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами – она может быть +4 и +6. Поэтому в соединениях с кислородом данные элементы могут проявлять степень окисления равную как +4, так и +6, при этом образуются два вида оксидов с формулой.
В соединениях с металлами и водородом степень окисления равна -2, а в соединениях с неметаллами – она может быть +4 и +6. Поэтому в соединениях с кислородом данные элементы могут проявлять степень окисления равную как +4, так и +6, при этом образуются два вида оксидов с формулой.
Задача 841.
Дать сравнительную характеристику водородных соединений элементов главной подгруппы VI группы, указав и объяснив характер изменения: а) термической устойчивости; б) температур плавления и кипения; в) кислотно-основных и окислительно-восстановительных свойств. Какие из этих соединений могут быть получены взаимодействием водорода с соответствующим простым веществом?
Решение:
а) Прочность химической связи в молекулах водородных соединений элементов главной подгруппы VI группы падает в ряду
H2O — H2S — H2Se — H2Te, что проявляется изменении энтальпии диссоциации молекул на атомы. Причины этого заключаются в том, что с увеличением размеров внешних электронных облаков атомов степень их перекрывания уменьшается. Поэтому при переходе от Н2О к Н2Те уменьшается степень перекрывания электронных облаков атомов водорода и атома элемента главной подгруппы VI группы, а область перекрывания располагается на большем расстоянии от ядра атома элемента (О, S, Se, Te) и сильнее экранируется возросшим числом промежуточных электронных слоёв. Кроме того, в ряду O — S — Se — Te электроотрицательность атома элемента уменьшается. Поэтому в молекуле Н2О электронное облако атома водорода смещается в сторону атома кислорода в наибольшей степени, а в молекулах Н2S. H2Se и Н2Те – всё меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы падает устойчивость к нагреванию в ряду H2O — H2S — H2Se — H2Te.
Причины этого заключаются в том, что с увеличением размеров внешних электронных облаков атомов степень их перекрывания уменьшается. Поэтому при переходе от Н2О к Н2Те уменьшается степень перекрывания электронных облаков атомов водорода и атома элемента главной подгруппы VI группы, а область перекрывания располагается на большем расстоянии от ядра атома элемента (О, S, Se, Te) и сильнее экранируется возросшим числом промежуточных электронных слоёв. Кроме того, в ряду O — S — Se — Te электроотрицательность атома элемента уменьшается. Поэтому в молекуле Н2О электронное облако атома водорода смещается в сторону атома кислорода в наибольшей степени, а в молекулах Н2S. H2Se и Н2Те – всё меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. С уменьшением прочности связи в молекулах водородных соединений элементов главной подгруппы VI группы падает устойчивость к нагреванию в ряду H2O — H2S — H2Se — H2Te.
б) В ряду H2O — H2S — H2Se — H2Te температуры кипения и плавления изменяются весьма закономерно, они в данном ряду плавно возрастают, тогда как при переходе к Н2О – они резко возрастают. Это обусловлено ассоциацией молекул воды в результате возникновения между ними водородных связей.
Закономерное возрастание температур плавления и кипения в ряду H2O — H2S — H2Se — H2Te объясняется увеличением радиусов атомов с возрастанием порядкового номера элемента. При этом возрастает поляризуемость молекул, что приводит к усилению межмолекулярного дисперсионного взаимодействия, т. е. к усилению их притяжения друг к другу (силы Ван-дер-ваальса), что и обуславливает возрастание температур плавления и кипения (исключение составляет Н2О).
в) Кислотные свойства в ряду H2O — H2S — H2Se — H2Te закономерно усиливаются. Вода имеет очень маленькую степень диссоциации, потому что молекулы её образуют ассоциаты за счёт водородных связей, так что диссоциация молекулы Н2О требует значительной затраты в энергии. Поэтому вода типичный слабый электролит-амфолит, молекулы которого распадаются на ионы:
Поэтому вода типичный слабый электролит-амфолит, молекулы которого распадаются на ионы:
Н2О ↔ Н+ + ОН–
H2O, H2S, H2Se, H2Te – типичные кислоты. Кислотные свойства в ряду закономерно усиливаются. Объясняется это тем, что в пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. При переходе от H2S к H2Te уменьшается степень перекрывания электронных облаков атомов водорода с атомами S, Se и Те, а сама область перекрывания электронных облаков располагается на большем расстоянии от ядра атома элемента и сильнее экранируется возросшим числом промежуточных слоёв. Кроме того, в ряду S — Se — Te электроотрицательность атомов уменьшается. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков, и тем самым, к ослаблению связи между атомами. Таким образом, в ряду H2S — H2Se — H2Te расстояние между атомами элемента и атомами водорода увеличивается, поэтому при растворении в воде их диссоциация по кислотному типу возрастает. Окислительная активность в ряду H2O — H2S — H2Se — H2Te последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду , что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель. В ряду H2O — H2S — H2Se — H2Te усиливаются восстановительные свойства. При действии сильных окислителей они окисляются до диоксидов или до соответствующих кислот состава H2RO3 или даже до H2RO4.
Таким образом, в ряду H2S — H2Se — H2Te расстояние между атомами элемента и атомами водорода увеличивается, поэтому при растворении в воде их диссоциация по кислотному типу возрастает. Окислительная активность в ряду H2O — H2S — H2Se — H2Te последовательно уменьшается, а восстановительные свойства – усиливаются. Объясняется это закономерным увеличением радиусов ионов ряду , что облегчает отдачу электронов. Поэтому кислород очень сильный окислитель, теллур – сильный восстановитель. В ряду H2O — H2S — H2Se — H2Te усиливаются восстановительные свойства. При действии сильных окислителей они окисляются до диоксидов или до соответствующих кислот состава H2RO3 или даже до H2RO4.
Вода и сероводород могут быть получены непосредственным взаимодействием водорода с кислородом или серой при достаточно высоких температурах. H2Se и H2Te получают косвенным путём, например, действием на селениды или теллуриды сильными кислотами:
H2Se и H2Te получают косвенным путём, например, действием на селениды или теллуриды сильными кислотами:
Na2Se + H2SO4 = Na2SO4 + H2Se;
Na2Te + H2SO4 = Na2SO4 + H2Te.
Задача 842.
Какое вещество легче окисляется: сульфид натрия или теллурид натрия? Ответ пояснить.
Решение:
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Такая закономерность объясняется увеличением числа электронных слоёв и растущим удалением внешних электронов от ядра. Поэтому ион Те2- будет легче отдавать электроны, чем ион S2-. Процесс отдачи электронов, сопровождающийся повышением степени окисления элемента, называется окислением. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем.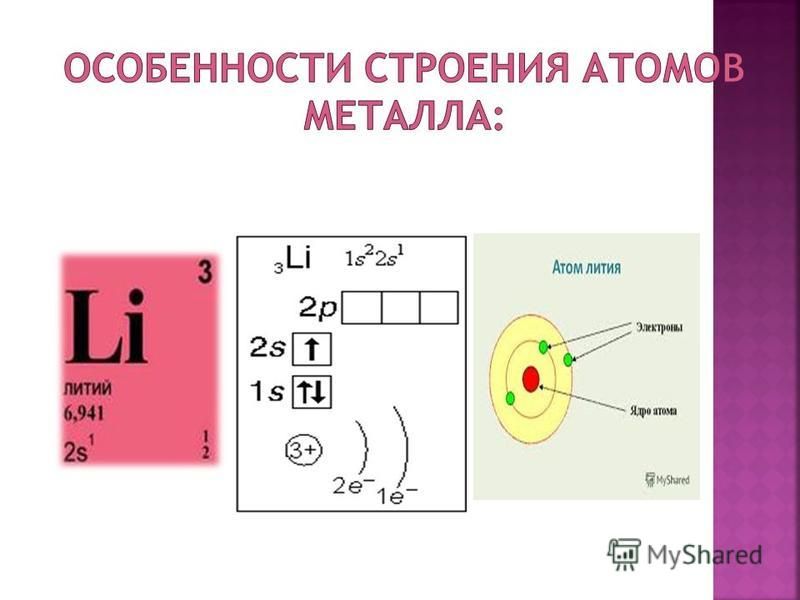 Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
Таким образом, теллурид натрия будет легче окисляться, чем сульфид натрия.
химический элемент Теллур Tellurium — “Химическая продукция”
Что такое
Теллур, tellurium, характеристики, свойстваТеллур — это химический элемент Te химический элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы, халькогены), 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium), относится к семейству металлоидов.
Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францем Йозефом Мюллером (впоследствии барон фон Райхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
Теллур класс химических элементов
Элемент Te — относится к группе, классу хим элементов (элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы, халькогены), 5-го периода в периодической системе, имеет атомный номер 52)
Элемент Te свойство химического элемента Теллур Tellurium
Основные характеристики и свойства элемента Te…, его параметры.
Происхождение названия
От латинского tellus , родительный падеж telluris , Земля (название предложил М.Г. Клапрот)
Нахождение в природе
Содержание в земной коре 1⋅10 −6 % по массе. Известно около 100 минералов теллура. Наиболее часты теллуриды меди , свинца , цинка , серебра и золота . Изоморфная примесь теллура наблюдается во многих сульфидах , однако изоморфизм Te — S выражен хуже, чем в ряду Se — S, и в сульфиды входит ограниченная примесь теллура. Среди минералов теллура особое значение имеют алтаит (PbTe), сильванит (AgAuTe 4 ), калаверит (AuTe 2 ), гессит (Ag 2 Te), креннерит [(Au, Ag)Te], петцит (Ag 3 AuTe 2 ), мутманнит [(Ag, Au)Te], монбрейит (Au 2 Te 3 ), нагиагит ([Pb 5 Au(Te, Sb)] 4 S5 ), тетрадимит (Bi 2 Te 2 S). Встречаются кислородные соединения теллура, например, ТеО 2 — теллуровая охра .
Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Типы месторождений
Большая часть упомянутых минералов развита в низкотемпературных золото-серебряных месторождениях, где они обычно выделяются после основной массы сульфидов совместно с самородным золотом, сульфосолями серебра, свинца, а также с минералами висмута .
Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен , входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медноколчеданных гидротермальных месторождениях. Теллур находится также в составе пирита , халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8—53 г/т, в халькопирите 9—31 г/т, в пирите — до 70 г/т.
Содержание теллура в молибдените колеблется в пределах 8—53 г/т, в халькопирите 9—31 г/т, в пирите — до 70 г/т.
Получение
Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2 .
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2 , а H2 SeO 3 остается в растворе.
Из оксида ТеО 2 теллур восстанавливают углём.
Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al, Zn) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2 :
Для осаждения теллура через раствор пропускают воздух или кислород:
Для получения теллура особой чистоты его хлорируют
Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой:
Затем тетрахлорид гидролизуют водой:
- ,
а образовавшийся ТеО 2 восстанавливают водородом:
Цены
Теллур — редкий элемент, и значительный спрос при малом объёме добычи определяет высокую его цену (около $200–300 за кг в зависимости от чистоты), но, несмотря на это, диапазон областей его применения постоянно расширяется.
Физические свойства
Теллур — хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвет красно-коричневый, в парах — золотисто-жёлтый. При нагревании приобретает пластичность. Кристаллическая решётка — гексагональная . Коэффициент теплового расширения — 1,68·10 −5 K−1 . Диамагнетик . Полупроводник с шириной запрещённой зоны 0,34 эВ , тип проводимости — p в нормальных условиях и при повышенной температуре, n — при пониженной температуре (граница перехода — от −80 °C до −100 °C в зависимости от чистоты)
Изотопы теллураИзвестны 38 нуклидов и 18 ядерных изомеров теллура с атомными числами от 105 до 142.
Теллур — самый лёгкий элемент, чьи известные изотопы подвержены альфа-распаду (изотопы от 106 Te до 110 Te). Атомная масса теллура (127,60 г/моль) превышает атомную массу следующего за ним элемента — иода (126,90 г/моль).
В природе встречается восемь изотопов теллура. Шесть из них, 120 Te, 122 Te, 123 Te, 124 Te, 125 Te и 126 Te — стабильны. Остальные два — 128 Te и 130 Te — радиоактивны, оба они испытывают двойной бета-распад, превращаясь в изотопы ксенона 128 Xe и 130 Xe, соответственно. Стабильные изотопы составляют лишь 33,3 % от общего количества теллура, встречающегося в природе, что является возможным благодаря чрезвычайно долгим периодам полураспада природных радиоактивных изотопов. Они составляют от 7,9⋅10 20 до 2,2⋅10 24 лет. Изотоп 128 Te имеет самый долгий подтверждённый период полураспада из всех радионуклидов — 2,2⋅10 24 лет или 2,2 септиллиона лет, что примерно в 160 триллионов раз больше оценочного возраста Вселенной.
Химические свойства
В химических соединениях теллур проявляет степени окисления −2; +2; +4; +6. Является аналогом серы и селена, но химически менее активен, чем сера. Растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100 °C
С кислородом образует соединения TeO, TeO 2 , TeO 3 . В виде порошка окисляется на воздухе даже при комнатной температуре, образуя оксид TeO 2 . При нагреве на воздухе сгорает, образуя TeO 2 — прочное соединение, обладающее меньшей летучестью, чем сам теллур. Это свойство используется для очистки теллура от оксидов, которые восстанавливают проточным водородом при температуре 500—600 °C. Диоксид теллура плохо растворим в воде, хорошо — в кислых и щелочных растворах
В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Теллур образует соединение с водородом при нагревании, легко реагирует с галогенами, взаимодействует с серой, фосфором и металлами. При взаимодействии с концентрированной серной кислотой образует сульфит. Образует слабые кислоты: теллурводородную (H 2 Te), теллуристую (H 2 TeO 3 ) и теллуровую (H 6 TeO 6 ), большинство солей которых плохо растворимы в воде
Применение
Сплавы
Теллур применяется в производстве сплавов свинца с повышенной пластичностью и прочностью (применяемых, например, при производстве кабелей). При введении 0,05 % теллура потери свинца на растворение под воздействием серной кислоты снижаются в 10 раз, и это используется при производстве свинцово-кислотных аккумуляторов. Также важно то обстоятельство, что легированный теллуром свинец при обработке пластической деформацией не разупрочняется, и это позволяет вести технологию изготовления токоотводов аккумуляторных пластин методом холодной высечки и значительно увеличить срок службы и удельные характеристики аккумулятора.
В составе сплава CZT (теллурид кадмия-цинка, CdZnTe) применяется в производстве детекторов рентгеновского и гамма- излучений, которые работают при комнатной температуре.
Термоэлектрические материалы
Монокристалл теллурида висмута
Также велика его роль в производстве полупроводниковых материалов и, в частности, теллуридов свинца , висмута , сурьмы , цезия . Очень важное значение в ближайшие годы приобретёт производство теллуридов лантаноидов, их сплавов и сплавов с селенидами металлов для производства термоэлектрогенераторов с весьма высоким (до 72—78 %) КПД , что позволит применить их в энергетике и в автомобильной промышленности.
Обнаружена очень высокая термо-ЭДС в теллуриде марганца (500 мкВ/К) и в его сочетании с селенидами висмута, сурьмы и лантаноидов , что позволяет не только достичь весьма высокого КПД в термогенераторах, но и осуществить уже в одной ступени полупроводникового холодильника охлаждение вплоть до области криогенных (температурный уровень жидкого азота) температур и даже ниже. Лучшим материалом на основе теллура для производства полупроводниковых холодильников в последние годы явился сплав теллура, висмута и цезия, который позволил получить рекордное охлаждение до −237 °C. В то же время, как термоэлектрический материал, перспективен сплав теллур- селен (70 % селена), который имеет коэффициент термо-ЭДС около 1200 мкВ/К.
Лучшим материалом на основе теллура для производства полупроводниковых холодильников в последние годы явился сплав теллура, висмута и цезия, который позволил получить рекордное охлаждение до −237 °C. В то же время, как термоэлектрический материал, перспективен сплав теллур- селен (70 % селена), который имеет коэффициент термо-ЭДС около 1200 мкВ/К.
Узкозонные полупроводники
Совершенно исключительное значение также получили сплавы КРТ ( кадмий — ртуть -теллур), которые обладают фантастическими характеристиками для обнаружения излучения от стартов ракет и наблюдения за противником из космоса через атмосферные окна (не имеет значения облачность). КРТ является одним из наиболее дорогих материалов в современной электронной промышленности.
Высокотемпературная сверхпроводимость
Ряд систем, имеющих в своем составе теллур, недавно обнаружили существование в них трёх (возможно, четырёх) фаз, сверхпроводимость в которых не исчезает при температуре несколько выше температуры кипения жидкого азота.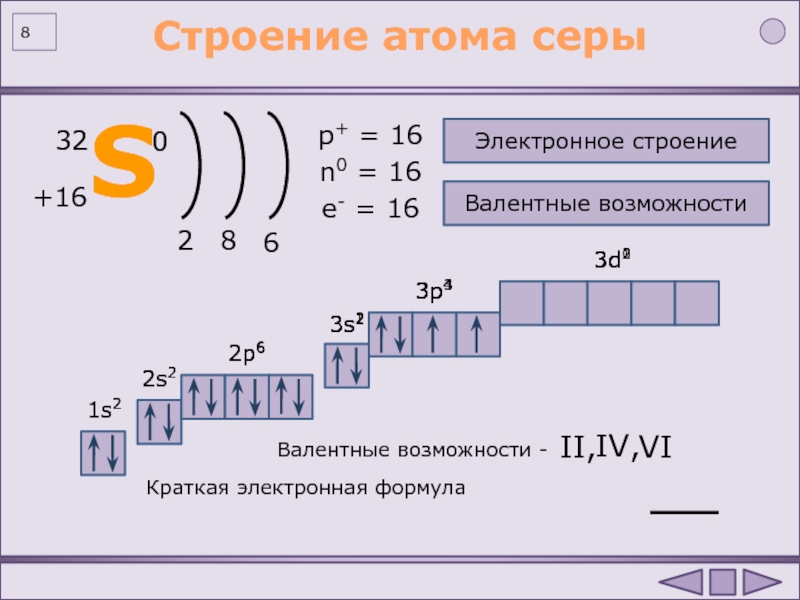
Производство резины
Отдельной областью применения теллура является его использование в процессе вулканизации каучука .
Производство халькогенидных стёкол
Теллур используется при варке специальных марок стекла (где он применяется в виде диоксида), специальные стёкла, легированные редкоземельными металлами , применяются в качестве активных тел оптических квантовых генераторов.
Кроме того, некоторые стёкла на основе теллура являются полупроводниками, это свойство находит применение в электронике.
Специальные сорта теллурового стекла (достоинство таких стёкол — прозрачность, легкоплавкость и электропроводность), применяются в конструировании специальной химической аппаратуры (реакторов).
Источники света
Ограниченное применение теллур находит для производства ламп с его парами — они имеют спектр, очень близкий к солнечному.
CD-RW
Сплав теллура применяется в перезаписываемых компакт-дисках (в частности, фирмы Mitsubishi Chemical Corporation марки «Verbatim») для создания деформируемого отражающего слоя.
Биологическая роль
Микроколичества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена
Физиологическое действие
Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. ПДК в воздухе колеблется для различных соединений 0,007—0,01 мг/м³, в воде 0,001—0,01 мг/л. Канцерогенность теллура не подтверждена
В целом соединения теллура менее токсичны, чем соединения селена
При отравлениях теллур выводится из организма в виде отвратительно пахнущих летучих теллурорганических соединений — алкилтеллуридов, в основном диметилтеллурида (CH 3 )2 Te. Их запах напоминает запах чеснока, поэтому при попадании в организм даже малых количеств теллура выдыхаемый человеком воздух приобретает этот запах, что является важным симптомом отравления теллуром
формула химического элемента Теллур Tellurium
Химическая формула Теллура:
Атомы Теллур Tellurium химических элементов
Атомы Tellurium хим. элемента
элемента
Tellurium Теллур ядро строение
Строение ядра химического элемента Tellurium — Te,
История открытия Теллур Tellurium
Открытие элемента Tellurium —
Теллур Tellurium происхождение названия
Откуда произошло название Tellurium …
Распространённость Теллур Tellurium
Как любой хим. элемент имеет свою распространенность в природе, Te …
Получение Теллур Tellurium
Tellurium — получение элемента
Физические свойства Теллур Tellurium
Основные свойства Tellurium
Изотопы Tellurium Теллур
Наличие и определение изотопов Tellurium
Te свойства изотопов Теллур Tellurium
…
Химические свойства Теллур Tellurium
Определение химических свойств Tellurium
Меры предосторожности Теллур Tellurium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Tellurium
Стоимость Теллур Tellurium
Рыночная стоимость Te, цена Теллур Tellurium
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Te
элемент Te
Что такое теллур. Строение атома теллура. Электронное строение атома теллура
Теллур Теллур (лат. Tellurium) это химический элемент с атомным номером 52 в периодической системе и атомным весом 127,60; обозначается символом Te, относится к семейству металлоидов. В природе встречается в виде восьми стабильных изотопов с массовыми числами 120, 128, 130, из которых наиболее распространены 128Тe и 130Тe. Из искусственно полученных радиоактивных изотопов широкое применение в качестве меченых атомов имеют 127Тe и 129Te.
Из истории Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства. Первые систематические исследования химии теллура выполнены в 30-х гг. 19 в. И. Я. Берцелиусом.
“Аурум парадоксум” – парадоксальное золото, так называли теллур, после того как в конце XVIII столетия он был открыт Рейхенштейном в соединении с серебром и желтым металлом в минерале сильваните. Неожиданным явлением казался факт, когда золото, обычно всегда встречающееся в самородном состоянии, было обнаружено в соединении с теллуром. Вот почему, приписав свойства, подобные желтому металлу, его назвали желтым металлом парадоксальным.
Неожиданным явлением казался факт, когда золото, обычно всегда встречающееся в самородном состоянии, было обнаружено в соединении с теллуром. Вот почему, приписав свойства, подобные желтому металлу, его назвали желтым металлом парадоксальным.
Происхождение названия Позднее (1798 г.), когда М. Клапрот детальнее исследовал новое вещество, он в честь Земли, носительницы химических “чудес”, назвал его теллурием (от латинского слова “теллус” – земля). Это название и вошло в обиход химиков всех стран.
Нахождение в природе Содержание в земной коре 1·10-6 % по массе. Металлический теллур можно встретить разве что в лаборатории, но его соединения можно найти вокруг нас гораздо чаще, чем может показаться. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe 4, калаверит AuTe 2, тетрадимит Bi 2 Te 2 S, креннсрит AuTe 2, петцит AgAuТе 2. Встречаются кислородные соединения теллура, например ТеО2 теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Модуль Пельтье Многие знакомы с термоэлектрическими модулями Пельтье, которые используют в портативных холодильниках, термоэлектрических генераторах и иногда для экстремального охлаждения компьютеров. Основной материал полупроводников в таких модулях это теллурид висмута. В настоящее время это самый ходовой полупроводниковый материал. Если посмотреть сбоку на термоэлектрический модуль, можно заметить ряды маленьких «кубиков».
Физические свойства Теллур серебристо-белого цвета с металлическим блеском, хрупок, при нагреве становится пластичным. Кристаллизуется в гексагональной системе. Теллур – полупроводник. При обычных условиях и вплоть до температуры плавления чистый Теллур имеет проводимость p-типа. С понижением температуры в интервале (100 °С) – (-80 °С) происходит переход: проводимость Теллура становится n-типа. Температура этого перехода зависит от чистоты образца, и она тем ниже, чем чище образец. Плотность = 6,24 г / см ³ Температура плавления = 450°C Температура кипения = 990°C Теплота плавления = 17,91 кДж/моль Теплота испарения = 49,8 кДж/моль Молярная теплоемкость = 25,8 Дж/(K·моль) Молярный объем = 20,5 см³/моль
Теллур – неметалл. В соединениях теллур проявляет степени окисления: -2, +4, +6 (валентность II, IV, VI). Химически теллур менее активен, чем сера и кислород. Теллур устойчив на воздухе, но при высокой температуре горит с образованием двуокиси TeO 2. С галогенами Те взаимодействует на холоде. При нагревании реагирует со многими металлами, давая теллуриды. Растворим в щелочах. При действии азотной кислоты Те превращается в теллуристую, а при действии царской водки или 30%-ной перекиси водорода – в теллуровую кислоту. Химические свойства 128 Те))))) е = 52, р = 52, n = е 8е 8е 8е 6е
В соединениях теллур проявляет степени окисления: -2, +4, +6 (валентность II, IV, VI). Химически теллур менее активен, чем сера и кислород. Теллур устойчив на воздухе, но при высокой температуре горит с образованием двуокиси TeO 2. С галогенами Те взаимодействует на холоде. При нагревании реагирует со многими металлами, давая теллуриды. Растворим в щелочах. При действии азотной кислоты Те превращается в теллуристую, а при действии царской водки или 30%-ной перекиси водорода – в теллуровую кислоту. Химические свойства 128 Те))))) е = 52, р = 52, n = е 8е 8е 8е 6е
Физиологическое действие При нагревании Теллур взаимодействует с водородом с образованием теллуроводорода – H 2 Te бесцветного ядовитого газа с резким, неприятным запахом. Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. Предельно допустимая концентрация в воздухе колеблется для различных соединений 0,0070,01 мг/м³, в воде 0,0010,01 мг/л.
Получение Основной источник шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2. Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2, а H 2 SeO 3 остается в растворе. Из оксида ТеО 2 теллур восстанавливают углем. Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2: 6Te + 2Al + 8NaOH = 3Na 2 Te 2 + 2Na. Для осаждения теллура через раствор пропускают воздух или кислород: 2Na 2 Te 2 + 2H 2 O + O 2 = 4Te + 4NaOH. Для получения теллура особой чистоты его хлорируют Te + 2Cl 2 = TeCl 4. Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой: TeCl 4 + 2H 2 O = TeO 2 + 4HCl, а образовавшийся ТеО 2 восстанавливают водородом: TeO 2 + 4H 2 = Te + 2H 2 O.
Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2. Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2, а H 2 SeO 3 остается в растворе. Из оксида ТеО 2 теллур восстанавливают углем. Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2: 6Te + 2Al + 8NaOH = 3Na 2 Te 2 + 2Na. Для осаждения теллура через раствор пропускают воздух или кислород: 2Na 2 Te 2 + 2H 2 O + O 2 = 4Te + 4NaOH. Для получения теллура особой чистоты его хлорируют Te + 2Cl 2 = TeCl 4. Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой: TeCl 4 + 2H 2 O = TeO 2 + 4HCl, а образовавшийся ТеО 2 восстанавливают водородом: TeO 2 + 4H 2 = Te + 2H 2 O.
Теллур – химический элемент 16-й группы (по устаревшей классификации – главной подгруппы VI группы, халькогены), 5-го периода в периодической системе, имеет атомный номер 52; обозначается символом Te (лат. Tellurium), относится к семейству металлоидов.
Tellurium), относится к семейству металлоидов.
Содержание в земной коре 1·10-6 % по массе. Известно около 100 минералов теллура. Наиболее часты теллуриды меди, свинца, цинка, серебра и золота.
Изоморфная примесь теллура наблюдается во многих сульфидах, однако изоморфизм Te – S выражен хуже, чем в ряду Se – S, и в сульфиды входит ограниченная примесь теллура. Среди минералов теллура особое значение имеют алтаит (PbTe), сильванит (AgAuTe4), калаверит (AuTe2), гессит (Ag2Te), креннерит [(Au, Ag)Te], петцит (Ag3AuTe2), мутманнит [(Ag, Au)Te], монбрейит (Au2Te3), нагиагит (4S5), тетрадимит (Bi2Te2S). Встречаются кислородные соединения теллура, например ТеО2 – теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17% Те и 0,06% Se).
 Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен, входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медноколчеданных гидротермальных месторождениях. Теллур находится также в составе пирита, халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8 – 53 г/т, в халькопирите 9 – 31 г/т, в пирите до 70 г/т.
Несмотря на развитие большого числа теллуровых минералов, главная масса теллура, извлекаемого промышленностью, входит в состав сульфидов других металлов. В частности, теллур в несколько меньшей степени, чем селен, входит в состав халькопирита медно-никелевых месторождений магматического происхождения, а также халькопирита, развитого в медноколчеданных гидротермальных месторождениях. Теллур находится также в составе пирита, халькопирита, молибденита и галенита месторождений порфировых медных руд, полиметаллических месторождений алтайского типа, галенита свинцово-цинковых месторождений, связанных со скарнами, сульфидно-кобальтовых, сурьмяно-ртутных и некоторых других. Содержание теллура в молибдените колеблется в пределах 8 – 53 г/т, в халькопирите 9 – 31 г/т, в пирите до 70 г/т.Запасы на месторождениях теллура в 2012 году, тонн *
| Перу | 3,600.0 |
| США | 3,500. 0 0 |
| Канада | 800.0 |
| Прочие страны | 16,100.0 |
| Всего запасы | 24,000.0 |
* данные US Geological Survey
Основной источник теллура – шламы, произведенные во время электролитической очистки черновой (анодной) меди. На 500 тонн медной руды, как правило, приходится один фунт (0,45 кг) теллура. Теллур производится, главным образом, в Соединенных Штатах, Китае, Бельгии, России, Японии и Канаде.
Анодный шлам содержит селениды и теллуриды благородных металлов в составах с формулой M2Se или M2Te (M = Cu, Ag, Au). При температурах 500 °C анодные шламы нагреваются с карбонатом натрия в присутствии воздуха. Металлические ионы восстанавливаются до металлов, в то время как теллурид преобразуется в теллурит натрия – M2Te + O2 + Na2CO3 > Na2TeO3 + 2М + CO2.
Теллуриты выщелачиваются из смеси с водой и обычно присутствуют как гидротеллуриты HTeO3– в растворе. Селениты также формируются во время этого процесса, но они могут быть отделены, при добавлении серной кислоты. Гидротеллуриты преобразуются в нерастворимый диоксид теллура, в то время как селениты остаются в растворе – HTeO3- + ОH– + h3SO4 > TeO2 + SO42- + 2h3O.
Селениты также формируются во время этого процесса, но они могут быть отделены, при добавлении серной кислоты. Гидротеллуриты преобразуются в нерастворимый диоксид теллура, в то время как селениты остаются в растворе – HTeO3- + ОH– + h3SO4 > TeO2 + SO42- + 2h3O.
Восстановление до металла делается или электролизом или реакцией диоксида теллура с двуокисью серы в серной кислоте – TeO2 + 2 SO2 + 2h3O > Те + SO42- + 4H+.
Теллур товарного сорта обычно продается как порошок, а также доступен в виде плит, слитков или прутков.
Крупнейший потребитель теллура – металлургия, где он используется в железных, медных и свинцовых сплавах. Добавление теллура к нержавеющей стали и меди делает эти металлы более пригодными для обработки. Добавление теллура позволяет получить ковкий чугун, обладающий при его выплавке преимуществами серого чугуна: жидким литьем, литейными качествами, обрабатываемостью. В свинце теллур улучшает силу и длительность и уменьшает коррозийное действие серной кислоты.
Полупроводники и электроника. Теллурид кадмия (CdTe) используется в солнечных батареях. Тесты лаборатории Лаборатории возобновляемой энергии в США показали, что этот материал дает много полезного для работы нового поколения солнечных батарей. Массивное коммерческое производство солнечных батарей с применением CdTe в последние годы, привело к значительному увеличению спроса на теллур. Если часть кадмия в CdTe заменяется цинком, формируется отношение (Cd,Zn), которое используется в датчиках рентгена твердого состояния.
Совершенно исключительное значение получили сплавы КРТ (кадмий-ртуть-теллур), которые обладают фантастическими характеристиками для обнаружения излучения от стартов ракет и наблюдения за противником из космоса через атмосферные окна (не имеет значение облачность). КРТ является одним из наиболее дорогих материалов в современной электронной промышленности.
Органотеллуры, такие как теллурид этана, диэтиловый теллурид, диизопропил теллурид, диэтил и метил теллурид, аллиловый теллурид используются в качестве основы для металорганического роста эпитаксии фазы для получения многослойных полупроводниковых соединений.
Ряд систем, имеющих в своем составе теллур, недавно обнаружили существование в них трёх (возможно четырёх) фаз, сверхпроводимость в которых не исчезает при температуре несколько выше температуры кипения жидкого азота.
Теллур в качестве подокиси теллура используется для создания слоев перезаписываемых оптических дисков, включая компакт-диски ReWritable (CD-RW), ReWritable Цифровые видео диски blu-ray ReWritable и (DVD-RW).
Теллур используется в новых микросхемах памяти фазового перехода, разработанных компанией Intel. Теллурид висмута (Bi2Te3) и теллурид свинца применяется в элементах термоэлектрических устройств. Теллурид свинца используется также в инфракрасных датчиках.
Другое применение. Теллур используется, чтобы окрасить керамику. Явление сильного увеличения оптического преломления после добавления селенидов и теллуридов в стекло используется в производстве стеклянных волокон для телекоммуникаций. Смеси селена и теллура используются с пероксидом бария в качестве окислителя в порошке задержки электрических капсюлей-детонаторов.
Органические теллуриды используются как инициаторы для радикальной полимеризации, богатые электронами моно- и дителлуриды обладают антиокислительной деятельностью. Для вулканизации резины вместо серы или селена может использоваться теллур. Резина, произведенная таким образом, демонстрирует улучшенное тепловое сопротивление. Теллуриты используются, чтобы идентифицировать болезнетворные микроорганизмы, ответственные за дифтерию.
Потребление теллура в странах мира распределено следующим образом: Китай – 80-100 тонн, Россия – 10 тонн, США – 50-60 тонн. Всего в мире в целом ежегодно потребляется около 400 тонн теллура. В таблице ниже представлены приблизительные данные по производству теллура в мире (данные USGS, различных обзоров и статей по рынку).
Производство теллура в мире, тонн*
| год | 2008 | 2009 | 2010 | 2011 | 2012 |
| Бельгия | 50. 0 0 | 50.0 | 50.0 | 50.0 | 50.0 |
| Канада | 19.0 | 16.0 | 8.0 | 6.0 | 6.0 |
| Китай | 65.0 | 60.0 | 65.0 | 70.0 | 70.0 |
| Япония | 46.5 | 49.2 | 47.0 | 40.0 | 35.0 |
| Казахстан | 18.0 | 17.0 | 18.0 | 18.0 | 17.0 |
| Перу | 28.0 | 7.0 | — | — | — |
| Россия | 34. 0 0 | 33.0 | 34.0 | 34.0 | 35.0 |
| США | 50.0 | 50.0 | 50.0 | 50.0 | 45.0 |
| Прочие страны | 79.5 | 97.8 | 128.0 | 132.0 | 122.0 |
| Всего | 390.0 | 380.0 | 400.0 | 400.0 | 380.0 |
* данные US Geological Survey
Теллур – редкий элемент, и значительный спрос при малом объёме добычи определяет его высокую цену (около $200-300 за кг в зависимости от чистоты), но, несмотря на это, диапазон областей его применения постоянно расширяется.
Цена на теллур в 2000 году составляла около 30 US$ за килограмм. В период с 2004 по 2011 год цен на теллур непрерывно росла за исключением 2009 года. В эти годы цена на теллур определялась существенным ростом спроса и ограниченным предложением. В 2011 году цена на теллур достигла 350 US$ за килограмм. Однако, в 2012 году цены на теллур резко упали – примерно до 150 US$ за килограмм.
В период с 2004 по 2011 год цен на теллур непрерывно росла за исключением 2009 года. В эти годы цена на теллур определялась существенным ростом спроса и ограниченным предложением. В 2011 году цена на теллур достигла 350 US$ за килограмм. Однако, в 2012 году цены на теллур резко упали – примерно до 150 US$ за килограмм.
Рынок теллура в настоящее время стоит перед целым рядом проблем. Будучи побочным продуктом производства меди, рынок теллура очень зависит от тенденций на основном (медном) рынке. Уменьшение производства меди вместе с применением новых альтернативных технологий получения данного металла, например, повлияют объемы поставок теллура.
Поскольку объемы поставки находятся под вопросом, цена на материал взлетает. Согласно многим прогнозам рынка цена на теллур снова повысится в ближайшие 2-3 года. Известно, что на рынке существует спектр различных продуктов замены для теллура, которые уже начинают использоваться на фоне нехватки поставок. Однако, как отмечают эксперты, ни одна из замен не обладает равноценными свойствами, что и теллур. Кроме того, потенциальное повышение спроса на теллур может следовать из событий в секторе производства тонкой пленки для солнечных батарей.
Кроме того, потенциальное повышение спроса на теллур может следовать из событий в секторе производства тонкой пленки для солнечных батарей.
ОПРЕДЕЛЕНИЕ
Теллур расположен в пятом периоде VI группе главной (А) подгруппе Периодической таблицы.
Относится к элементам p -семейства. Металлоид. Обозначение – Te. Порядковый номер – 52. Относительная атомная масса – 127,60 а.е.м.
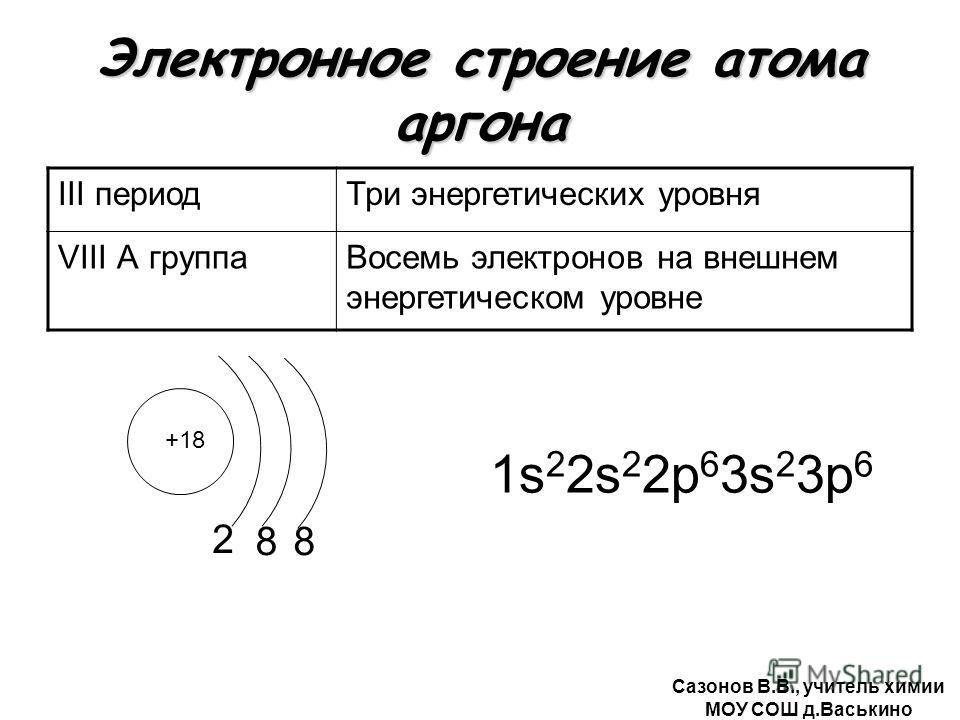
Электронное строение атома теллура
Атом теллура состоит из положительно заряженного ядра (+52), внутри которого есть 52 протона и 76 нейтронов, а вокруг, по пяти орбитам движутся 52 электрона.
Рис.1. Схематическое строение атома теллура.
Распределение электронов по орбиталям выглядит следующим образом:
52Te) 2) 8) 18) 18) 6 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 4 .
Внешний энергетический уровень атома теллура содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома теллура можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), m l (магнитное) и s (спиновое):
Примеры решения задач
ПРИМЕР 1
Таким образом, для частиц S +6 , S 0 , S +4 и S -2 общее количество электронов в электронных оболочках будет равно 10, 16, 12 и 18, соответственно. Тогда, таблица примет следующий вид:
ПРИМЕР 2
 е. количество увеличивается.
е. количество увеличивается.Таким образом, для частиц C +4 , Al +3 , F и C 0 общее количество электронов в электронных оболочках будет равно 2, 10, 10 и 6, соответственно. Тогда, таблица примет следующий вид:
Теллур существует в двух модификациях – кристаллической и аморфной.
Кристаллический теллур получается охлаждением паров теллура, а аморфный – при восстановлении теллуровой кислоты сернистым газом или другим подобным реагентом:
Аморфный теллур – это тонкий черный порошок, который при нагревании переходит в металлический теллур. Плотность аморфного теллура 5,85-5,1 г/см3.
Для кристаллического теллура известны две полиморфные разновидности: α-Te и β-Те. Переход α→β происходит при 354° С. Кристаллический теллур имеет бело-серебряный цвет. Плотность его 6,25 г/см2. Твердость кристаллического теллура 2,3; при обыкновенной температуре он хрупок, легко разбивается в порошок, а при более высокой температуре становится настолько пластичным, что может быть подвергнут прессованию.
Температура плавления теллура 438-452° С, а температура кипения 1390° С. Теллур характеризуется высокой упругостью пара, которая в зависимости от температуры выражается следующими цифрами:
Теллур имеет полупроводниковый характер проводимости. Электросопротивление поликристаллического теллура при 0° C составляет 0,102 ом*см. С повышением температуры удельное электрическое сопротивление теллура уменьшается:
В противоположность селену электросопротивление теллура мало чувствительно к освещению. Однако при низких температурах влияние освещения все же сказывается; так, при -180° С электросопротивление теллура под влиянием освещения снижается на 70%.
Химические свойства
По своим химическим свойствам теллур похож на селен, но имеет более резко выраженный металлический характер. При комнатной температуре компактный теллур устойчив к воздуху и кислороду, при нагревании же окисляется и горит синим пламенем с зеленой каймой, образуя TeO2.
В дисперсном состоянии и в присутствии влаги теллур окисляется при обыкновенной температуре.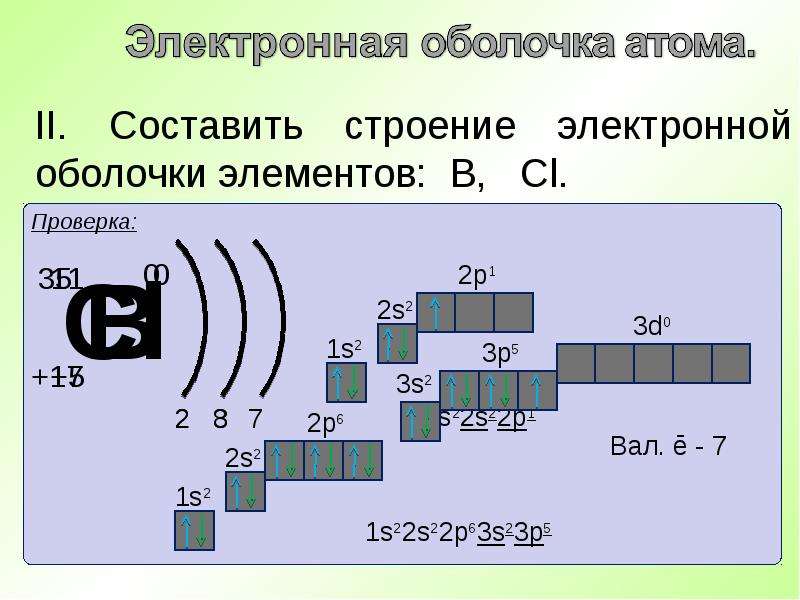 Теллур при комнатной температуре реагирует с галогенами и образует химически более прочные галогениды (TeCl4; TeBr4), чем селен.
Теллур при комнатной температуре реагирует с галогенами и образует химически более прочные галогениды (TeCl4; TeBr4), чем селен.
С водородом теллур непосредственно в обычных условиях не соединяется, но при нагревании образует h3Te. При нагревании со многими металлами теллур образует теллуриды: K2Te, Ag2Te, MgTe, Al2Te и др.
Металлический теллур реагирует с водой при 100-160° С, а свежеосажденный (аморфный теллур) – при комнатной температуре:
Te + 2Н2О → TeO2 + 2Н2.
Теллур не растворяется в CS2; в разбавленной HCl растворяется очень медленно. В концентрированной и разбавленной HNO3 теллур окисляется с образованием h3TeO3:
3Те + 4HNО3 + h3O = 3Н2ТеО3 + 4NO.
Теллуристая кислота легко разлагается сернистым газом с выделением теллура:
h3TeO3 + 2SО2 + h3O → Te + 2h3SО4.
Эта реакция используется при получении чистого теллура.
Теллур является почти постоянным спутником тяжелых цветных металлов в сульфидах (железный и медный колчедан, свинцовый блеск), но встречается и в виде минералов сильванита, калаверита (Au, Ag)Te2 и др.
Основным источником получения промышленного теллура служат отходы переработки сульфидных руд меди и свинца – пыли, в которых теллур присутствует в виде TeO2, получаемые при обжиге сульфидных руд; а также анодный шлам, получаемый при электролитическом рафинировании меди и свинца.
17.03.2020
Создание объемных моделей сегодня является актуальным не только для анимации, но и в технических целях. Также часто с помощью 3D-моделирования создают модели интерьера….
16.03.2020
Как и популярный в настоящий момент ламинат, современная паркетная доска достаточно проста в монтаже. Настелить ее на пол в жилом или в техническом помещении у владельца…
16.03.2020
Регистрация на портале практически мгновенна, аккаунт можно завести, введя адрес электронной почты или воспользоваться собственной учетной записью в одной из 20…
16.03.2020
Неважно, какой у вас гаджет, играть через мобильную версию можно даже с самого старого смартфона. Чтобы приступить к игре, в первую очередь предстоит пройти регистрацию….
16.03.2020
Среди напольных покрытий ковролин особенно интересен, поскольку он сочетает превосходные изоляционные качества, роскошный внешний вид и простую технологию укладки….
16.03.2020
Для начала следует разобраться в том, как работают промышленные чиллеры. Такое устройство напоминает обычный холодильник, специальный насос откачивает жидкость, охлаждая…
15.03.2020
Планируя ремонтные работы в своем жилище, сначала необходимо определиться со спектром действия. В зависимости состояния помещения, площади, будут зависеть…
14.03.2020
Воспользоваться панелями гипсокартона владельцы могут в различных случаях. Особенно часто гипсокартон используют для обшивки стен….
13.03.2020
В современном мире сложно представить хоть одно громкое праздничное событие без использования различной пиротехники, которая представлена, простыми словами, красочными…
13.03.2020
Тротуарная плитка – применяется для создания твердого покрытия улиц, оформления пешеходных зон, дорог и тд. Может быть сформирована из различных материалов. Они…
| Ответ | Сера – 16 по счету элемент Периодической таблицы Д.И. Менделеева. При образовании катионов элемент выступает донором протонов, т.е. общее количество электронов уменьшается, а при образовании анионов – акцептором протонов, т.е. количество увеличивается. Таким образом, для частиц S +6 , S 0 , S +4 и S -2 общее количество электронов в электронных оболочках будет равно 10, 16, 12 и 18, соответственно. Тогда, таблица примет следующий вид: |
| Ответ | При образовании катионов элемент выступает донором протонов, т.е. общее количество электронов уменьшается, а при образовании анионов – акцептором протонов, т.е. количество увеличивается. Таким образом, для частиц C +4 , Al +3 , F и C 0 общее количество электронов в электронных оболочках будет равно 2, 10, 10 и 6, соответственно. Тогда, таблица примет следующий вид: |
| Теллур | |
|---|---|
| Атомный номер | 52 |
| Внешний вид простого вещества | |
| Свойства атома | |
| Атомная масса (молярная масса) | 127,6 а. е. м. (г/моль) |
| Радиус атома | 160 пм |
| Энергия ионизации (первый электрон) | 869,0 (9,01) кДж/моль (эВ) |
| Электронная конфигурация | 4d 10 5s 2 5p 4 |
| Химические свойства | |
| Ковалентный радиус | 136 пм |
| Радиус иона | (+6e) 56 211 (-2e) пм |
| Электроотрицательность (по Полингу) | 2,1 |
| Электродный потенциал | 0 |
| Степени окисления | +6, +4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 6,24 /см ³ |
| Молярная теплоёмкость | 25,8 Дж /( ·моль) |
| Теплопроводность | 14,3 Вт/( ·) |
| Температура плавления | 722,7 |
| Теплота плавления | 17,91 кДж /моль |
| Температура кипения | 1 263 |
| Теплота испарения | 49,8 кДж /моль |
| Молярный объём | 20,5 см ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | 4,450 |
| Отношение c/a | 1,330 |
| Температура Дебая | n/a |
Теллур —химический элемент с атомным номером 52 в периодической системе и атомной массой 127,60; обозначается символом Te (Tellurium), относится к семейству металлоидов.
История
Впервые был найден в1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
Происхождение названия
От латинского tellus , родительный падеж telluris , Земля.
Нахождение в природе
Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Важный источник теллура — медные и свинцовые руды.
Получение
Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2 .
Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2 , а H 2 SeO 3 остается в растворе.
Из оксида ТеО 2 теллур восстанавливают углем.
Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2:
6Te + 2Al + 8NaOH = 3Na 2 Te 2 + 2Na.
Для осаждения теллура через раствор пропускают воздух или кислород:
2Na 2 Te 2 + 2H 2 O + O 2 = 4Te + 4NaOH.
Для получения теллура особой чистоты его хлорируют
Te + 2Cl 2 = TeCl 4 .
Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой:
TeCl 4 + 2H 2 O = TeO 2 + 4HCl,
а образовавшийся ТеО 2 восстанавливают водородом:
TeO 2 + 4H 2 = Te + 2H 2 O.
Цены
Теллур — редкий элемент, и значительный спрос при малом объёме добычи определяет высокую его цену (около 200—300 долл. за кг в зависимости от чистоты), но, несмотря на это, диапазон областей его применения постоянно расширяется.
Физико-химические свойства
Теллур — хрупкое серебристо-белое вещество с металлическим блеском. В тонких слоях на просвет красно-коричневый, в парах — золотисто-жёлтый.
Химически теллур менее активен, чем сера. Он растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100°С, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te0 2 .
При нагреве на воздухе теллур сгорает, образуя Te0 2 . Это прочное соединение обладает меньшей летучестью, чем сам теллур. Поэтому для очистки теллура от оксидов их восстанавливают проточным водородом при 500-600 °С.
В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Применение
Сплавы
Теллур применяется в производстве сплавов свинца с повышенной пластичностью и прочностью (применяемых, например, при производстве кабелей). При введении 0,05 % теллура потери свинца на растворение под воздействием серной кислоты снижаются в 10 раз, и это используется при производстве свинцово-кислотных аккумуляторов . Так же важно то обстоятельство, что легированный теллуром свинец при обработке пластической деформацией не разупрочняется, и это позволяет вести технологию изготовления токоотводов аккумуляторных пластин методом холодной высечки и значительно увеличить срок службы и удельные характеристики аккумулятора.
Термоэлектрические материалы
Монокристалл теллурида висмута
Также велика его роль в производстве полупроводниковых материалов и, в частности, теллуридов свинца , висмута , сурьмы , цезия . Очень важное значение в ближайшие годы приобретёт производство теллуридов лантаноидов, их сплавов и сплавов с селенидами металлов для производства термоэлектрогенераторов с весьма высоким (до 72—78 %) КПД , что позволит применить их в энергетике и в автомобильной промышленности.
Так, например, недавно обнаружена очень высокая термо-ЭДС в теллуриде марганца (500 мкВ/К) и в его сочетании с селенидами висмута, сурьмы и лантаноидов , что позволяет не только достичь весьма высокого КПД в термогенераторах но и осуществить уже в одной ступени полупроводникового холодильника охлаждение вплоть до области криогенных (температурный уровень жидкого азота) температур и даже ниже. Лучшим материалом на основе теллура для производства полупроводниковых холодильников в последние годы явился сплав теллура,
Теллур Теллур (лат. Tellurium) это химический элемент с атомным номером 52 в периодической системе и атомным весом 127,60; обозначается символом Te, относится к семейству металлоидов. В природе встречается в виде восьми стабильных изотопов с массовыми числами 120, 128, 130, из которых наиболее распространены 128Тe и 130Тe. Из искусственно полученных радиоактивных изотопов широкое применение в качестве меченых атомов имеют 127Тe и 129Te.
Из истории Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом Мюллером (впоследствии барон фон Рейхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства. Первые систематические исследования химии теллура выполнены в 30-х гг. 19 в. И. Я. Берцелиусом.
“Аурум парадоксум” – парадоксальное золото, так называли теллур, после того как в конце XVIII столетия он был открыт Рейхенштейном в соединении с серебром и желтым металлом в минерале сильваните. Неожиданным явлением казался факт, когда золото, обычно всегда встречающееся в самородном состоянии, было обнаружено в соединении с теллуром. Вот почему, приписав свойства, подобные желтому металлу, его назвали желтым металлом парадоксальным.
Происхождение названия Позднее (1798 г.), когда М. Клапрот детальнее исследовал новое вещество, он в честь Земли, носительницы химических “чудес”, назвал его теллурием (от латинского слова “теллус” – земля). Это название и вошло в обиход химиков всех стран.
Нахождение в природе Содержание в земной коре 1·10-6 % по массе. Металлический теллур можно встретить разве что в лаборатории, но его соединения можно найти вокруг нас гораздо чаще, чем может показаться. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe 4, калаверит AuTe 2, тетрадимит Bi 2 Te 2 S, креннсрит AuTe 2, петцит AgAuТе 2. Встречаются кислородные соединения теллура, например ТеО2 теллуровая охра. Встречается самородный теллур и вместе с селеном и серой (японская теллуристая сера содержит 0,17 % Те и 0,06 % Se).
Модуль Пельтье Многие знакомы с термоэлектрическими модулями Пельтье, которые используют в портативных холодильниках, термоэлектрических генераторах и иногда для экстремального охлаждения компьютеров. Основной материал полупроводников в таких модулях это теллурид висмута. В настоящее время это самый ходовой полупроводниковый материал. Если посмотреть сбоку на термоэлектрический модуль, можно заметить ряды маленьких «кубиков».
Физические свойства Теллур серебристо-белого цвета с металлическим блеском, хрупок, при нагреве становится пластичным. Кристаллизуется в гексагональной системе. Теллур – полупроводник. При обычных условиях и вплоть до температуры плавления чистый Теллур имеет проводимость p-типа. С понижением температуры в интервале (100 °С) – (-80 °С) происходит переход: проводимость Теллура становится n-типа. Температура этого перехода зависит от чистоты образца, и она тем ниже, чем чище образец. Плотность = 6,24 г / см ³ Температура плавления = 450°C Температура кипения = 990°C Теплота плавления = 17,91 кДж/моль Теплота испарения = 49,8 кДж/моль Молярная теплоемкость = 25,8 Дж/(K·моль) Молярный объем = 20,5 см³/моль
Теллур – неметалл. В соединениях теллур проявляет степени окисления: -2, +4, +6 (валентность II, IV, VI). Химически теллур менее активен, чем сера и кислород. Теллур устойчив на воздухе, но при высокой температуре горит с образованием двуокиси TeO 2. С галогенами Те взаимодействует на холоде. При нагревании реагирует со многими металлами, давая теллуриды. Растворим в щелочах. При действии азотной кислоты Те превращается в теллуристую, а при действии царской водки или 30%-ной перекиси водорода – в теллуровую кислоту. Химические свойства 128 Те))))) е = 52, р = 52, n = е 8е 8е 8е 6е
Физиологическое действие При нагревании Теллур взаимодействует с водородом с образованием теллуроводорода – H 2 Te бесцветного ядовитого газа с резким, неприятным запахом. Теллур и его летучие соединения токсичны. Попадание в организм вызывает тошноту, бронхиты, пневмонию. Предельно допустимая концентрация в воздухе колеблется для различных соединений 0,0070,01 мг/м³, в воде 0,0010,01 мг/л.
Получение Основной источник шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в огарке, который промывают соляной кислотой. Из полученного солянокислого раствора теллур выделяют, пропуская через него сернистый газ SO 2. Для разделения селена и теллура добавляют серную кислоту. При этом выпадает диоксид теллура ТеО 2, а H 2 SeO 3 остается в растворе. Из оксида ТеО 2 теллур восстанавливают углем. Для очистки теллура от серы и селена используют его способность под действием восстановителя (Al) в щелочной среде переходить в растворимый дителлурид динатрия Na 2 Te 2: 6Te + 2Al + 8NaOH = 3Na 2 Te 2 + 2Na. Для осаждения теллура через раствор пропускают воздух или кислород: 2Na 2 Te 2 + 2H 2 O + O 2 = 4Te + 4NaOH. Для получения теллура особой чистоты его хлорируют Te + 2Cl 2 = TeCl 4. Образующийся тетрахлорид очищают дистилляцией или ректификацией. Затем тетрахлорид гидролизуют водой: TeCl 4 + 2H 2 O = TeO 2 + 4HCl, а образовавшийся ТеО 2 восстанавливают водородом: TeO 2 + 4H 2 = Te + 2H 2 O.
Теллур – неметалл, который обладает металлическим блеском. Цвет его серебристо-белый. Этот элемент является очень редким и рассеянным. Его открыл горный инспектор Франц Йозеф Мюллер в1782 году. Извлекают теллур из полиметаллической руды. Содержится данное вещество в виду соединений в гидротермальных месторождениях золота и другие .
Таллий – хрупкий материал, который в процессе нагрева приобретает пластические свойства. Значение плотности данного неметалла – 6,25 г/см3. Теллий начинает плавиться при достижении температуры значения 450 °C, а кипеть при 990 °С. Материал обладает свойствами диамагнетика и при 18 °С значение удельной магнитной восприимчивости составляет -0,31.10-6.
Теллур является полупроводником р-типа, когда условия окружающей среды нормальные или же при нагреве материала до кипения. Когда неметалл охлаждать, при переходе около -100 °С он изменяет свое свойства и обретает проводимость n-типа. Запрещенная зона по ширине составляет 0,34 эв. Температура перехода снижается в зависимости от чистоты вещества.
Таллий используется как легирующая добавка при производстве свинца. Она способствует улучшению прочности и химической стойкости. Свинцово-теллуровый сплав используют в кабельном и химическом производстве. Легируют теллуром, также, медь и сталь. Это позволяет улучшить их механическую обработку.
Теллур применяют и в стекольном производстве. Стекло, благодаря такой примеси, обретает коричневый окрас, и коэффициент лучепреломления его увеличивается. В промышленности по производству резины теллур применяется для проведения процесса по вулканизации каучука.
Значительному спросу на теллур способствуют его полупроводниковые свойства. Он считается, как типичным, так и технологичным полупроводником. Это вещество используется в микроэлектронике. Из него получают тонкую пленку, которая способна плавится при более низких температурах, по сравнению с множеством металлов.
В чистом виде теллур, в виде полупроводника, применяется редко из-за его ограниченного запаса в недрах Земли. В большинстве случаев его используют при изготовлении транзисторов и приборов, которые предназначены для измерения интенсивности гамма-излучений.
Чаще всего в промышленности используется не чистый неметалл, а его соединения с металлами, которые называют теллуридами. С их применением производят важные части термоэлектрогенераторов.
Продажа цветных металлов в Москве – .
ОПРЕДЕЛЕНИЕ
Теллур – пятьдесят второй элемент Периодической таблицы. Обозначение – Te от латинского «tellurium». Расположен в пятом периоде, VIA группе. Относится к семейству металлоидов. Заряд ядра равен 52.
Теллур принадлежит к числу редких элементов: содержание его в земной коре составляет всего 0,000001% (масс.).
В свободном виде теллур представляет собой металлоподобное кристаллическое вещество серебристо-белого цвета (рис. 1) с гексагональной решеткой. Хрупкий, легко истирается в порошок. Полупроводник. Плотность 6,25 г/см 3 . Температура плавления 450 o С, кипения 990 o С.
Известно существование в аморфном состоянии.
Рис. 1. Теллур. Внешний вид.
Атомная и молекулярная масса теллура
Относительной молекулярная масса вещества (M r) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии теллур существует в виде одноатомных молекул Te, значения его атомной и молекулярной масс совпадают. Они равны 127,60.
Изотопы теллура
Известно, что в природе теллур может находиться в виде восьми стабильных изотопов, двое из которых являются радиоактивными (128 Te и 130 Te): 120 Te, 122 Te, 123 Te, 124 Te, 125 Te и 126 Te. Их массовые числа равны 120, 122, 123, 124, 125, 126, 128 и 130 соответственно. Ядро атома изотопа теллура 120 Te содержит пятьдесят два протона и шестьдесят восемь нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы теллура с массовыми числами от 105-ти до 142-х, а также восемнадцать изомерных состояния ядер.
Ионы теллура
На внешнем энергетическом уровне атома теллура имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5р 4 .
В результате химического взаимодействия теллур отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион либо принимает электроны от другого атома, т.е. является их акцептором и превращается в отрицательно заряженный ион:
Te 0 -2e → Te + ;
Te 0 -4e → Te 4+ ;
Te 0 -6e → Te 6+ ;
Te 0 +2e → Te 2- .
Молекула и атом теллура
В свободном состоянии теллур существует в виде одноатомных молекул Te. Приведем некоторые свойства, характеризующие атом и молекулу теллура:
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Рассчитайте массовые доли элементов, входящих в состав диоксида теллура, если его молекулярная формула имеет вид TeO 2 . |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: ω (Х) = n × Ar (X) / Mr (HX) × 100%. |
Рекомендуем также
11 класс Контрольная “Строение атома”
Контрольная работа по химии за 11 класс.
«Строение атома. Периодический закон.»
Вариант 1
Задание 1
Расположите следующие элементы в порядке возрастания электроотрицательности:
Sr, I, Sb, Rb, Te.
Задание 2
Расположите следующие элементы в порядке уменьшения атомарного радиуса:
Po, S, Se, O, Te.
Задание 3
Определите, каким элементам соответствуют данные комбинации валентных электронов. Изобразите электронные схемы данных элементов.
2s2; 3s23p2; 4d25s2; 5s25p4.
Задание 4
Выберете элементы, обладающие одинаковым количеством валентных электронов. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
B, Sc, Ge, Sr, Ga, Cl.
Задание 5
Выберете элементы, обладающие одним неспаренным электроном на внешнем s-подуровне. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Be, Zn, Cu, Na, Cl, Rb
Контрольная работа по химии за 11 класс.
«Строение атома. Периодический закон.»
Вариант 2
Задание 1
Расположите следующие элементы в порядке возрастания мольной доли кислорода в высшем оксиде:
I, Sb, Te, Sn, In.
Задание 2
Расположите следующие элементы в порядке увеличения электроотрицательности:
Ra, Ca, Sr, Ba, Be.
Задание 3
Определите, каким элементам соответствуют данные комбинации валентных электронов. Изобразите электронные схемы данных элементов.
6s1; 2s22p4; 5d46s2; 4s24p2.
Задание 4
Выберете элементы, обладающие одинаковым количеством валентных электронов. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Sb, Zr, S, Zn, V, P.
Задание 5
Выберете элементы, обладающие одним неспаренным электроном на внешнем s-подуровне. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Cs, Li, Cd, F, Cl, Ag
Контрольная работа по химии за 11 класс.
«Строение атома. Периодический закон.»
Вариант 3
Задание 1
Расположите следующие элементы в порядке уменьшения электроотрицательности:
F, Be, Li, O, B.
Задание 2
Расположите следующие элементы в порядке увеличения атомарного радиуса:
Rn, Kr, Xe, Ne, Ar.
Задание 3
Определите, каким элементам соответствуют данные комбинации валентных электронов. Изобразите электронные схемы данных элементов.
3s23p1; 2s22p5; 4d55s2; 5s25p3.
Задание 4
Выберете элементы, обладающие одинаковым количеством валентных электронов. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Mn, Cl, Mg, Sr, Ti, Br.
Задание 5
Выберете элементы, обладающие одним неспаренным электроном на внешнем s-подуровне. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Cu, Li, Ba, K, Br, Se.
Контрольная работа по химии за 11 класс.
«Строение атома. Периодический закон.»
Вариант 4
Задание 1
Расположите следующие элементы в порядке уменьшения мольной доли кислорода в высшем оксиде:
Br, As, Ga, Se, Ge.
Задание 2
Расположите следующие элементы в порядке уменьшения электроотрицательности:
Si, Pb, Sn, C, Ge.
Задание 3
Определите, каким элементам соответствуют данные комбинации валентных электронов. Изобразите электронные схемы данных элементов.
5s2; 3s23p5; 3d34s2; 4s24p5.
Задание 4
Выберете элементы, обладающие одинаковым количеством валентных электронов. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
K, P, Si, Sn, Br, Ti.
Задание 5
Выберете элементы, обладающие одним неспаренным электроном на внешнем s-подуровне. Ответ обоснуйте, изобразив электронные формулы или схемы выбранных элементов.
Mg, K, Cl, S, Cr, Cs
Te Информация об элементе теллура: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История теллура
Элемент теллур был открыт Франц-Йозефом Мюллером фон Райхенштейном в год. 1783 г. в Румынии . Теллур получил свое название от латинского tellus, что означает «земля».
Присутствие теллура: изобилие в природе и вокруг нас
В таблице ниже показано содержание теллура во Вселенной, Солнце, метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура теллура
Твердотельная структура теллура – это простой тригональный образец .
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
| 445.72 | 445,72 | 592,9 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства теллура
Атомы теллура имеют 52 электрона и структура электронной оболочки [2, 8, 18, 18, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура теллура – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | |
| 5 | O | 2 | 4 |
Электронная конфигурация теллура в основном состоянии – нейтраль Атом теллура
Электронная конфигурация нейтрального атома теллура в основном состоянии [Кр] 4д10 5с2 5п4.Часть конфигурации теллура, которая эквивалентна благородному газу предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 4d10 5s2 5p4, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального теллура
Полная электронная конфигурация основного состояния для атома теллура, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п4
Атомная структура теллура
Атомный радиус теллура 123 пм, а его ковалентный радиус 135 пм.
Атомный спектр теллура
Химические свойства теллура: Энергии ионизации теллура и сродство к электрону
Электронное сродство теллура составляет 190,2 кДж / моль.
Энергия ионизации теллура
Энергия ионизации теллура
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 869.3 |
| 2 | 1790 |
| 3 | 2698 |
| 4 | 3610 |
| 5 | 5668 |
| 6 | 6820 |
| 7 | 1.32 × 104 |
Физические свойства теллура
Физические свойства теллура см. В таблице ниже.
| Плотность | 6,24 г / см3 |
| Молярный объем | 20,4487179487 см3 |
Эластичные свойства
Твердость теллура – Испытания для измерения твердости элемента
Электрические свойства теллура
Теллур – это полупроводник электричества.Ссылаться на стол ниже электрические свойства теллура
Теплопроводность теллура
Магнитные свойства теллура
Оптические свойства теллура
Акустические свойства теллура
Тепловые свойства теллура – энтальпии и термодинамика
Термические свойства теллура
см. В таблице ниже.Энтальпии теллура
Изотопы теллура – ядерные свойства теллура
Изотопы родия.Встречающийся в природе теллур имеет 5 стабильный изотоп – 120Te, 122Te, 124Te, 125Te, 126Te.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 105Te | ||||
| 106Te | ||||
| 107Te | ||||
| 108Te | ||||
| 109Te | ||||
| 110Te | ||||
| 111Te | ||||
| 112Te | ||||
| 113Te | ||||
| 114Te | ||||
| 115Te | ||||
| 116Te | ||||
| 117Te | ||||
| 118Te | ||||
| 119Te | ||||
| 120Te | 0.09% | Стабильный | N / A | |
| 121Te | ||||
| 122Te | 2.55% | Стабильный | N / A | |
| 123Te | 0.89% | |||
| 124Te | 4.74% | Стабильный | N / A | |
| 125Te | 7.07% | Стабильный | N / A | |
| 126Te | 18.84% | Стабильный | N / A | |
| 127Te | ||||
| 128Te | 31.74% | |||
| 129Te | ||||
| 130Te | 34.08% | |||
| 131Te | ||||
| 132Te | ||||
| 133Te | ||||
| 134Te | ||||
| 135Te | ||||
| 136Te | ||||
| 137Te | ||||
| 138Te | ||||
| 139Te | ||||
| 140Te | ||||
| 141Te | ||||
| 142Te |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Расшифровка: Химия в ее элементе: теллур(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (конец акции) Крис Смит Здравствуйте! На этой неделе доктор Кто упоминает, поскольку мы открываем историю о слизистом элементе, от которого люди воняют чесноком и делают их пальцы черными. А вот и Питер Уотерс, рассказывающий о теллуре. Питер Уотерс Теллур, он звучит как чудовище из Доктора Кто, и во многих отношениях этот элемент действительно обладает некоторыми свойствами, которые сделали бы его подходящим для любого хорошего космического научно-фантастического фильма ужасов.Для начала, как и многие космические монстры, он происходит из слизи; если быть точным, он извлекается из анодного шлама, отходов электролитического рафинирования меди. Благодаря своей особой мощности, в форме теллурида кадмия, он может улавливать солнечную энергию. Однако это соединение не использовалось во зло, оно использовалось в некоторых из самых эффективных солнечных элементов для выработки электроэнергии. У каждого хорошего монстра должно быть секретное оружие, и теллур не исключение. Он дает своим врагам чесночное дыхание, действительно неприятный чесночный запах изо рта.Едва заметная доза в половину микрограмма даст вам чесночное дыхание на 30 часов, о! И он также оставляет своей жертве черные пятна на перепонке между пальцами, но мало кто может подойти достаточно близко, чтобы заметить это. Как и некий известный вампир, теллур был впервые обнаружен в Трансильвании. Это было в 1783 году Францем Иосифом Мюллером фон Райхенштейном, главным инспектором шахт. У него были особые проблемы с анализом необычной золотосодержащей руды.В конце концов ему удалось выделить новый металл из руды, и он назвал его aurum problematicum. Он отправил образец немецкому химику Мартину Клапроту, который подтвердил, что это новый элемент, и назвал его теллуром. Но чтобы правильно понять, почему он назвал это так, нам нужно вернуться в прошлое и заглянуть в космос. Когда древний человек взглянул на звезды ночью, он заметил некоторые небесные тела, которые двигались по фиксированной схеме звезд. Это были планеты Меркурий, Венера, Марс, Юпитер и Сатурн.Два других больших тела, казалось, также вращались вокруг Земли, а именно Солнце и Луна. Всего таких небесных тел было семь, и семь было магическим числом. Древний человек также знал всего лишь о семи металлах: золоте, серебре, меди, железе, олове, свинце и ртути; конечно, это не могло быть совпадением. Считалось, что так же, как солнечные лучи питают растения и необходимы для их роста, невидимые лучи планет помогают питать металлические руды в земле. Считалось, что каждая планета оказывает определенное влияние на один металл или его руды.Чосер описал эту связь в 14 -м гг. Солнце ассоциируется с золотом, Луна с серебром, Марс с железом, Сатурн со свинцом, Юпитер с оловом и Венера с медью, и даже сегодня мы сохраняем одно и то же имя как для планеты, так и для элемента, Меркурия. Связь между золотом и Солнцем кажется довольно очевидной по их цветам, так же как и связь между серебром и Луной. Остальные связи немного более расплывчаты. В тексте 17 -го века года цитируется: « Железо названо именем Марса, независимо от того, используется ли оно для изготовления оружия войны, богом которого был Марс, или из-за влияний, от которых железо получает с этой планеты. . Интересно, что теперь мы знаем, что цвет этой красной планеты обусловлен оксидами железа. Химики назвали медь Венерой как из-за влияний, которые она, возможно, получает от этой планеты, так и из-за ее достоинств. в болезнях, связанных с целью зарождения. Это относится к раннему лечению венерических болезней, болезней Венеры. Будучи ближайшей к Солнцу планетой, Меркурий движется в космосе быстрее, чем любой другой. Меркурий занимает всего 88 дней, чтобы вращаться вокруг Земли. Солнце, по сравнению с нашими 365 днями.Возможно, это быстрое движение было одной из причин длительной связи между металлом и планетой, или, возможно, это так, как описано в одной книге «из-за того факта, что элемент имеет способность изменять свою форму, свойство, приписываемое язычники к Меркурию, одному из их ложных богов ». Связь между элементами олова и свинца с Юпитером и Сатурном была еще более сомнительной. К сожалению, магическое число 7 металлов длилось недолго. Какое-то время ранние химики просто обходились без сурьмы, мышьяка, висмута, цинка и кобальта.В конце концов, это не настоящие металлы, но с открытием платины они больше не могли игнорировать ее. Некоторое время платина даже называлась восьмым металлом. Было открыто еще больше металлов, но затем, в 1781 году, была открыта новая планета – Уран. Так же, как древний Бог, Сатурн или Кронос был отцом Юпитера или Зевса, новая планета должна быть названа в честь отца Сатурна, следовательно, Урана, в честь греческого бога неба. В знак признания этого открытия в 1789 году Клапрот назвал обнаруженный им новый металл в честь этого элемента – уран.Поэтому в 1798 году, когда Клапрот получил возможность назвать другой элемент, он назвал его в честь единственной известной на тот момент планеты в Солнечной системе, у которой не было элемента, названного в ее честь, – Земли. В древней мифологии Теллус или Терра или Гея были богиней Земли и женой Урана, Бога Небес. Так родился теллур. Крис Смит Химик, вдохновленный небесами, Питер Уотерс из Кембриджского университета, рассказывал историю теллура.В следующий раз – поучительная история о газе, на который, как все считали, не стоит тратить время суток. Victoria Gill И изначально отсутствие реактивности означало, что у Неона не было очевидных применений. Это потребовало немного воображения от французского инженера, химика и изобретателя Жоржа Клода, который в начале 20 годов века впервые применил электрический разряд к запечатанной трубке с неоновым газом. Создаваемое им красное свечение натолкнуло Клода на идею создания источника света совершенно новым способом.Он сделал стеклянные трубки, которые можно было использовать как лампочки. Клод представил публике первую неоновую лампу 11 декабря 1910 года на выставке в Париже. Его поразительный дисплей вскружил голову, но, к сожалению, неоновые лампы не продавались. Люди просто не хотели освещать свои дома красным светом. Крис Смит Но они действительно хотели, чтобы их имена были написаны светом, и именно это сделал Жорж Клод, о чем Виктория Гилл нам расскажет в следующий раз.Я надеюсь, ты сможешь присоединиться к нам. Я Крис Смит, спасибо за внимание. И до свидания! (Промо) (Окончание промо) |
WebElements Периодическая таблица »Теллур» Свойства свободных атомов
Атомы теллура имеют 52 электрона, а структура оболочки – 2.8.18.18.6.
Электронная конфигурация основного состояния газообразного нейтрального теллура в основном состоянии – это [ Kr ]. 4д 10 . 5с 2 . 5p 4 , а символ термина – 3 P 2 .
Схематическая электронная конфигурация теллура. Оболочечная структура Косселя теллура.Атомный спектр
Представление атомного спектра теллура.
Энергии ионизации и сродство к электрону
Электронное сродство теллура 190.2 кДж моль ‑1 . Энергии ионизации теллура приведены ниже.
Энергии ионизации теллура.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1 с | 50.96 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 38.33 | 2 пол | 47,86 | ||||
| 3 с | 34,00 | 3 пол. | 34.01 | 3d | 37,84 | ||
| 4с | 24,41 | 4 пол | 23,12 | 4д | 19,96 | 4f | (нет данных) |
| 5с | 12,54 | 5 пол | 10,81 | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 31814 [1] |
| L I | 2s | 4939 [1] |
| L II | 2p 1/2 | 4612 [1] |
| L III | 2p 3/2 | 4341 [1] |
| M I | 3s | 1006 [3] |
| M II | 3 пол. 1/2 | 870.8 [3] |
| M III | 3p 3/2 | 820,8 [3] |
| M IV | 3d 3/2 | 583,4 [3] |
| M V | 3d 5/2 | 73 [3] |
| N I | 4s | 169,4 [3] |
| N II | 4p 1 / 2 | 103,3 [3, одночастичное приближение недопустимо из-за короткого срока службы сердечника] |
| N III | 4p 3/2 | 103.3 [3, одночастичное приближение недействительно из-за короткого срока службы сердечника] |
| N IV | 4d 3/2 | 41,9 [3] |
| N V | 4d 5/2 | 40,4 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Теллур – Атомный номер – Атомная масса – Плотность теллура
Атомный номер теллура
Теллур – это химический элемент с атомным номером 52 , что означает, что в атомной структуре 52 протона и 52 электрона. Химический символ для теллура – Te .
Атомная масса теллура
Атомная масса теллура 127,6 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому полученная атомная масса рассчитывается на основе встречающихся в природе изотопов и их содержания.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 x 10 -24 граммов. Одна унифицированная атомная единица массы составляет приблизительно массы одного нуклона (либо одиночного протона, либо нейтрона) и численно эквивалентна 1 г / моль.
Для 12 C атомная масса равна точно 12u, так как от нее определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 u от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62, ед.
Существует две причины разницы между массовым числом и изотопной массой, известной как дефект массы:
- Нейтрон немного тяжелее , чем протон .Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы атомных единиц массы, основанной на 12 C с равным количеством протонов и нейтронов.
- Энергия связи ядра варьируется от ядра к ядру. Ядро с большей энергией связи имеет более низкую полную энергию и, следовательно, на меньшую массу согласно соотношению эквивалентности массы и энергии Эйнштейна E = mc 2 . Для 63 Cu атомная масса меньше 63, поэтому это должен быть доминирующий фактор.
См. Также: Массовое число
Плотность теллура
Плотность теллура 6,24 г / см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, разделенная на объем:
ρ = m / V
На словах плотность (ρ) вещества – это общая масса (m) этого вещества. деленное на общий объем (V), занимаемый этим веществом.Стандартная единица СИ составляет килограммов на кубический метр ( кг / м 3 ). Стандартная английская единица – фунтов массы на кубический фут ( фунт / фут 3 ).
См. Также: Что такое плотность
См. Также: Самые плотные материалы Земли
Теллур – сводка свойств
| Элемент | Теллур | ||
|---|---|---|---|
| Атомный номер | 30 52 | Символ | Te |
| Категория элемента | Металлоиды | ||
| Фаза в STP | Твердое тело | ||
| Атомная масса [а.е.м.] | 127.6 | ||
| Плотность при STP [г / см3] | 6,24 | ||
| Электронная конфигурация | [Kr] 4d10 5s2 5p4 | ||
| Возможные состояния окисления | + 4,6 / -2 | ||
| Сродство к электрону [кДж / моль] | 190,2 | ||
| Электроотрицательность [шкала Полинга] | 2,1 | ||
| Энергия первой ионизации [эВ] | 9,0096 | ||
| Год открытия | 1782 | ||
| Первооткрыватель | Мюллер фон Райхенштейн, Франц Иосиф | ||
| Тепловые свойства | |||
| Точка плавления [шкала Цельсия] | 449.5 | ||
| Точка кипения [шкала Цельсия] | 989,8 | ||
| Теплопроводность [Вт / м К] | 3 | ||
| Удельная теплоемкость [Дж / г К] | 0,2 | ||
| Теплота Термоядерный синтез [кДж / моль] | 17,49 | ||
| Теплота испарения [кДж / моль] | 52,55 |
–
–
–
Теллур | Периодическая таблица | The Guardian
Элементом этой недели является теллур, который имеет символ Те и атомный номер 52.Его название происходит от латинского tellus , что означает «земля». Несмотря на свое название, этот блестящий бледно-серый металлоид довольно редко встречается на Земле, на самом деле, реже, чем где-либо еще во Вселенной. Причина его сравнительной редкости связана с образованием H 2 Te, летучего газа, который был утерян в космос во время раннего образования Земли.
Теллур используется в ряде промышленных и коммерческих приложений. Он легирован нержавеющей сталью и медью для улучшения их обрабатываемости, а теллур используется в качестве полупроводника, теллурид кадмия используется в солнечных панелях, поскольку он имеет самый высокий КПД для выработки электроэнергии, теллур ускоряет отверждение резины и снижает ее подверженность старению. и к смягчающим эффектам масла, и оксид теллура, TeO, используется в некоторых перезаписываемых компакт-дисках и DVD-дисках.
Когда я был микробиологом, одним из многих типов питательных сред, которые я использовал для диагностики патогенов человека, был агар, сделанный из сыворотки и теллурита калия (K 2 TeO 3 ). Этот агар используется специально для диагностики респираторного патогена человека Corynebacterium diphtheriae . Теллуритовый агар является селективной средой, потому что теллур подавляет рост различных бактерий, и это дифференциальная среда, потому что Corynebacterium восстанавливает теллурит до металлического теллура, образуя характерные черные или коричневато-черные колонии на бледно-соломенных и прозрачных агар.
У людей и других животных теллур не имеет известной биологической роли, но организм действительно метаболизирует его с образованием летучего газообразного соединения, диметилтеллурида (CH 3 ) 2 Te, которое выделяется с потом и выдыхается. и является источником очаровательно мощного «чесночного дыхания», подобного тому, что происходит при приеме селена в пищу. (Что заставляет меня задаться вопросом, почему ни один из этих элементов не заставляет людей пахнуть мятой или фруктами? Почему всегда должен пахнуть туалетным лотком?) Я должен отметить, что прием витамина С может уменьшить эти пахучие эффекты.
Теллур может быть токсичным при проглатывании в достаточно больших количествах. *
С химической точки зрения открытие теллура вызвало у изобретателя периодической таблицы элементов Дмитрия Менделеева много головной боли. Это потому, что теллур имеет атомную массу 127,6, в то время как элемент, следующий за ним, йод, на легче с атомным весом 126,9. Менделеев пришел к выводу, что атомная масса одного из этих двух элементов должна быть неправильной, потому что теллур явно предшествовал йоду в периодической таблице.После 50 лет головокружительного разочарования и усилий ряда химиков по точному определению атомной массы этих двух элементов была открыта концепция химических изотопов. Изотопы – это варианты формы элемента, которые поддерживают характерное количество протонов элемента, но содержат переменное количество нейтронов. Как оказалось, наиболее распространенные изотопы теллура имеют атомные массы 128 и 130, в то время как наиболее распространенный изотоп йода имеет атомную массу 127. Таким образом, теллур имеет среднюю атомную массу 127.6, в то время как йод имеет среднюю атомную массу 126,9.
Вот наш любимый профессор химии, рассказывающий нам больше о теллуре:
Посетите канал PeriodicVideos на YouTube [ссылка на видео].
* [добавлено 1430 от 2 марта 2012 г.] Теллур «[h] очень токсичен, может быть смертельным при вдыхании, проглатывании или абсорбции через кожу. Избегайте любого контакта с кожей. Эффекты контакта или вдыхания могут быть отложены». [ссылка]. Теллурит натрия также токсичен: «Этот материал представляет опасность как для орального, так и для кожного воздействия.Материал токсичен при проглатывании. Пероральный прием соединений теллура обычно считается чрезвычайно токсичным. Вероятная летальная доза при пероральном приеме составляет 5-50 мг / кг или от 7 капель до 1 чайной ложки для человека весом 70 кг (150 фунтов). Соединения теллура считаются сверхтоксичными для воздействия на кожу ». [Ссылка].
.. .. .. .. .. .. .. .. .. .. .. ..
Видеожурналист Брэди Харан Человек с фотоаппаратом, а Ноттингемский университет – это место, где живут химики. Вы можете следить за Брэди в твиттере @periodicvideos и за Ноттингемским университетом в твиттере @UniNottingham
Вы уже встречали эти элементы:
Сурьма: Sb , атомный номер 51
Олово: Sn , атомный номер 50
Индий: In , атомный номер 49
Кадмий: Cd , атомный номер 48
Серебро: Ag , атомный номер 47
Палладий: Pd , атомный номер 46
Родий: Rh , атомный номер 45
Рутений: Ru , атомный номер 44
Технеций: Tc , атомарный номер 9 0013 43
Молибден: Mo , атомный номер 42
Ниобий: Ni , атомный номер 41
Цирконий: Zr , атомный номер 40
Иттрий: Y , атомный номер 39
Стронций: Sr , атомный номер 38
Рубидий: Rr , атомный номер 37
Криптон: Kr , атомный номер 36
Бром: Br , атомный номер 35
Селен: Se , атомный номер 34
Мышьяк: As , атомный номер 33
Германий: Ge , атомный номер 32
Галлий: Ga , атомный номер 31
Цинк: Zn , атомный номер 30
Медь: Cu , атомный номер 29
Никель: Ni , атомный номер 28
Кобальт: Co , атомный номер 27
Железо: Fe , атомный номер 26
Марганец: Mn , атомный номер 25
Хром: Cr , атомный номер 24
Ванадий: V , атомный номер 23
Титан: Ti , атомный номер 22
Скандий: Sc , атомный номер 21
Кальций: Ca , атомный номер 20
Калий: K , атомарный номер 19
Аргон: Ar , атомный номер 18
Хлор: Cl , атомный номер 17
Сера: S , атомный номер 16
Фосфор: P , атомный номер 15
Кремний: Si , атомный номер 14
Алюминий: Al , атомный номер 13
Магний: Mg , атомный номер 1 2
Натрий: Na , атомный номер 11
Неон: Ne , атомный номер 10
Фтор: F , атомный номер 9
Кислород: O , атомный номер 8
Азот: N , атомный номер 7
Углерод: C , атомный номер 6
Бор: B , атомный номер 5
Бериллий: Be , атомный номер 4
Литий : Li , атомный номер 3
Гелий: He , атомный номер 2
Водород: H , атомный номер 1
Вот замечательная интерактивная Периодическая таблица элементов, которая на самом деле действительно весело играть!
.. .. .. .. .. .. .. .. .. .. .. .. ..
twitter: @GrrlScientist
facebook: grrlscientist
зло google +: grrlscientist
электронная почта: [email protected]
Теллур (Te ) – Химические свойства, воздействие на здоровье и окружающую среду
Теллур – это полуметаллический, блестящий, кристаллический, хрупкий, серебристо-белый элемент. Обычно он выпускается в виде темно-серого порошка, обладающего свойствами как металлов, так и неметаллов. Теллур образует множество соединений, соответствующих соединениям серы и селена.При горении на воздухе теллур приобретает зеленовато-голубое пламя и в результате образует двуокись теллура. Теллур не подвержен действию воды или соляной кислоты, но растворяется в азотной кислоте.
Области применения
Теллур часто используется в качестве добавки к стали и часто легирован алюминием, медью, свинцом или оловом. Теллур добавлен для повышения его долговечности, прочности и устойчивости к коррозии. Его можно использовать для чугуна, керамики, капсюлей-детонаторов, солнечных батарей, халькогенидных стекол.При добавлении в резину теллур ускоряет процесс отверждения и делает продукт менее подверженным старению и менее подверженным влиянию масла, которое смягчает обычную резину.
Теллур в окружающей среде
Теллур присутствует в угле в количестве до 2 частей на миллион. Вероятно, это основной источник этого металла, который растения могут получать из почвы. Уровень теллура в растениях может достигать 6 частей на миллион, хотя некоторые пищевые растения содержат более 0,5 частей на миллион, а большинство – менее 0.05 промилле.
Иногда можно найти образцы несоединенного теллура, но они крайне редки. Есть некоторые минералы теллура (калаверит, сильванит, теллурит), но ни один из них не добывается как источник этого элемента. Мировое производство составляет около 220 тонн в год. Основные производители – США, Канада, Перу и Япония. Запасы этого элемента не оценивались.
К счастью, большинство людей редко встречается с соединениями теллура. Они обладают тератогенным действием, и с ними должны обращаться только компетентные химики, поскольку проглатывание даже в небольших количествах вызывает ужасный запах изо рта и ужасный запах тела.
Пути воздействия: Вещество может всасываться в организм при вдыхании аэрозоля.
Риск при вдыхании: Испарение при 20 ° C незначительно; однако опасная концентрация частиц в воздухе может быть быстро достигнута при распылении. Эффекты от вдыхания: Сонливость. Сухость во рту. Металлический вкус. Головная боль. Запах чеснока. Тошнота.
Последствия кратковременного воздействия: Аэрозоль этого вещества раздражает глаза и дыхательные пути.Вещество может оказывать действие на печень и центральную нервную систему. Воздействие может вызвать ощущение чеснока изо рта. Показано медицинское наблюдение. Проглатывание: Боль в животе. Запор. Рвота.
Химическая опасность: При нагревании образуются токсичные пары. Реагирует бурно с галогенами или интергалогенами с опасностью пожара. Реагирует с цинком с накалом. Силицид лития поражает теллур накалением. Горючие. Мелкодисперсные частицы образуют в воздухе взрывоопасные смеси.
Не вредно или легко становится безвредным в результате естественных процессов.
При нагревании до разложения хлорид теллура может выделять токсичные пары теллура и хлора.
Вернуться к периодическим элементам диаграммы .
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.