Удельная теплоёмкость: расчет количества теплоты
Как вы думаете, что быстрее нагревается на плите: литр воды в кастрюльке или же сама кастрюлька массой 1 килограмм? Масса тел одинакова, можно предположить, что нагревание будет происходить с одинаковой скоростью.
А не тут-то было! Можете проделать эксперимент – поставьте пустую кастрюльку на огонь на несколько секунд, только не спалите, и запомните, до какой температуры она нагрелась. А потом налейте в кастрюлю воды ровно такого же веса, как и вес кастрюли. По идее, вода должна нагреться до такой же температуры, что и пустая кастрюля за вдвое большее время, так как в данном случае нагреваются они обе – и вода, и кастрюля.
Однако, даже если вы выждете втрое большее время, то убедитесь, что вода нагрелась все равно меньше. Воде потребуется почти в десять раз большее время, чтобы нагреться до такой же температуры, что и кастрюля того же веса. Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.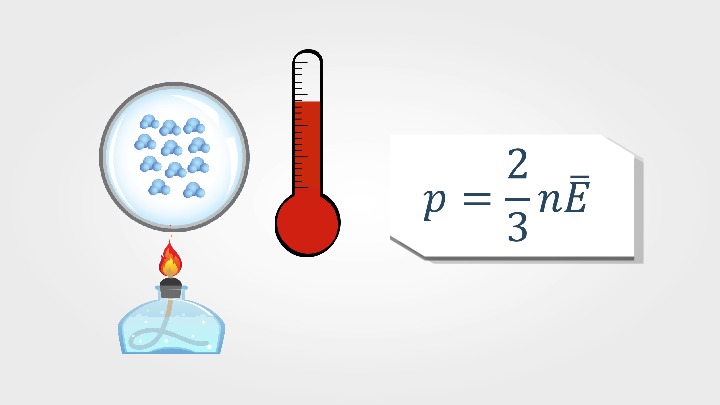
Удельная теплоемкость вещества
Эта величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С). Существует эта величина не по собственной прихоти, а по причине разности свойств различных веществ.
Удельная теплоемкость воды примерно в десять раз выше удельной теплоемкости железа, поэтому кастрюля нагреется в десять раз быстрее воды в ней. Любопытно, что удельная теплоемкость льда в два раза меньше теплоемкости воды. Поэтому лед будет нагреваться в два раза быстрее воды. Растопить лед проще, чем нагреть воду. Как ни странно звучит, но это факт.
Расчет количества теплоты
Обозначается удельная теплоемкость буквой c и применяется в формуле для расчета количества теплоты:
Q = c*m*(t2 – t1),
где Q – это количество теплоты,
c – удельная теплоемкость,
m – масса тела,
t2 и t1 – соответственно, конечная и начальная температуры тела.
Формула удельной теплоемкости: c = Q / m*(t2 – t1)
По этой формуле можно рассчитать количество тепла, которое нам необходимо, чтобы нагреть конкретное тело до определенной температуры. Удельную теплоемкость различных веществ можно найти из соответствующих таблиц.
Также из этой формулы можно выразить:
- m = Q / c*(t2-t1) – массу тела
- t1 = t2 – (Q / c*m) – начальную температуру тела
- t2 = t1 + (Q / c*m) – конечную температуру тела
- Δt = t2 – t1 = (Q / c*m) – разницу температур (дельта t)
А что насчет удельной теплоемкости газов? Тут все запутанней. С твердыми веществами и жидкостями дело обстоит намного проще. Их удельная теплоемкость – величина постоянная, известная, легко рассчитываемая. А что касается удельной теплоемкости газов, то величина эта очень различна в разных ситуациях.
При этом, при увеличении температуры, газ увеличивается в объеме, и нам надо ввести еще одно значение – постоянного или переменного объема, что тоже повлияет на теплоемкость. Поэтому при расчетах количества теплоты для воздуха и других газов пользуются специальными графиками величин удельной теплоемкости газов в зависимости от различных факторов и условий.
Нужна помощь в учебе?
Предыдущая тема: Количество теплоты: формула, расчет
Следующая тема:   Энергия топлива: удельная теплота сгорания + ПРИМЕРЫ
Урок 19. температура. энергия теплового движения молекул – Физика – 10 класс
Физика, 10 класс
Урок №19. Температура. Энергия теплового движения молекул
На уроке рассматриваются понятия: температура и тепловое равновесие; шкалы Цельсия и Кельвина; абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества, зависимость давления от концентрации молекул и температуры.
Глоссарий по теме:
Макроскопические параметры – величины объём V, давление p и температура t, характеризующие состояние макроскопических тел без учёта их молекулярного строения.
Температура характеризует степень нагретости тела (холодное, тёплое, горячее).
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Тепловым равновесием называют – такое состояние тел, при котором температура во всех точках системы одинакова.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
Абсолютная температура Т прямо пропорциональна температуре Θ (тета), выражаемой в энергетических единицах (Дж).
Абсолютный нуль – предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или объём идеального газа стремится к нулю при неизменном давлении.
Абсолютная шкала температур (Шкала Кельвина) – здесь нулевая температура соответствует абсолютному нулю, а каждая единица температуры равна градусу по шкале Цельсия.
Кельвин – единица абсолютной температуры в Международной системе измерений (СИ).
Постоянная Больцмана – коэффициент, связывает температуру Θ энергетических единицах (Дж) с абсолютной температурой Т (К).
Абсолютная температура есть мера средней кинетической энергии молекул.
Давление газа прямо пропорционально концентрации его молекул и абсолютной температуре Т

Закон Авогадро – в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул
Обязательная литература:
- Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. Физика.10 класс. Учебник для общеобразовательных организаций М.: Просвещение, 2017. – С. 195 – 203.
Дополнительная литература:
- Смородинский Я.А. Температура. – 3-е издание. – М.: Бюро Квантум, 2007. (Библиотечка «Квант». Вып. 103. Приложение к журналу «Квант» № 5/2007.) С. 5— 25.
- Кирик Л.А., Генденштейн Л.Э., Гельфгат И.М.. Задачи по физике. 10-11 классы для профильной школы. – М.: Илекса, 2010. – С. 111-115.
- Рымкевич А.П. Физика. Задачник. 10-11 классы. – М.: Дрофа, 2013. – С. 65 – 67.
- Орлов В.А., Сауров Ю.А. Практика решения физических задач. 10-11классы. – М.: Вентана-Граф, 2014. – С. 98-99.
- http://kvant.mccme.ru/1991/09/idealnyj_gaz_-_universalnaya_f.htm
Теоретический материал для самостоятельного изучения
Измеряя расположение звёзд на небе, расстояния на земле, время, люди знали, для чего они это делают и изобретали, телескопы, часы, прототипы современных линеек. О температуре такого же сказать было нельзя. О том, что такое тепловое равновесие и что означает степень нагрева тела (температура), существовали разные мнения. Но человек с незапамятных времен точно знал, что, когда два тела плотно соприкасаются, между ними устанавливается, выражаясь современным языком, тепловое равновесие.
О температуре такого же сказать было нельзя. О том, что такое тепловое равновесие и что означает степень нагрева тела (температура), существовали разные мнения. Но человек с незапамятных времен точно знал, что, когда два тела плотно соприкасаются, между ними устанавливается, выражаясь современным языком, тепловое равновесие.
Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходят в состояние теплового равновесия.
Тепловым равновесием называют такое состояние тел, при котором температура во всех точках системы одинакова.
Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние) – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
К числу характеристик состояния макроскопических тел (твёрдых тел, жидкостей, газов) и процессов изменения их состояний, относят объём, давление и температуру. Эти величины описывают в целом тела, состоящие из большого числа молекул, а не отдельные молекулы. При этом микроскопические процессы внутри тела не прекращаются при тепловом равновесии: расположения молекул всё время меняются и меняются их скорости при столкновениях.
При этом микроскопические процессы внутри тела не прекращаются при тепловом равновесии: расположения молекул всё время меняются и меняются их скорости при столкновениях.
Величины объём, давление и температуру, характеризующие состояние макроскопических тел без учёта их молекулярного строения, называют макроскопическими параметрами.
Тепловым или термодинамическим равновесием, изолированной системы тел, называют состояние, при котором все макроскопические параметры в системе остаются неизменными.
Для точной характеристики нагретости тела, необходим прибор, способный измерить температуры тел и дать возможности их сравнения.
Термометр — это прибор для измерения температуры путём контакта с исследуемым телом. Различают жидкостные, газовые термометры, термопары, термометры сопротивления.
В 1597 году Галилей создал термоскоп, в собственных сочинениях учёного нет описания этого прибора, но его ученики засвидетельствовали этот факт. Аппарат представлял собой устройство для поднятия воды при помощи нагревания.
Изобретение термометра, данные которого не зависели бы от перепадов атмосферного давления, произошли благодаря экспериментам физика Э. Торричелли, ученика Галилея.
Во всех приборах, изобретённых в XVIII веке, измерение температуры было относительно расширению столбика воды, спирта или ртути и произвольности выбора начала отсчёта, т.е. нулевой температуры. Наполняющие их вещества замерзали или кипели и этими термометрами нельзя было измерять очень низкие или очень высокие температуры. Необходимо было изобрести такую шкалу, чтобы избавиться от зависимости выбранного вещества, на основе которого формировалось градуирование.
Шкала, предложенная шведским учёным Андерсом Цельсием в 1742 г., точно устанавливала положение двух точек: 0 и 100 градусов. По шкале Цельсия температура обозначается буквой t, измеряется в градусах Цельсия (ºС).
На территории Англии и США используется шкала Фаренгейта. Такая шкала была предложена немецким учёным Даниелем Габриелем Фаренгейтом в 1724 г. : 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
: 0 °F — температура смеси снега с нашатырём или поваренною солью, 96 °F —температура здорового человеческого тела, во рту или под мышкой.
Рене Антуан де Реомюр не одобрял применения ртути в термометрах вследствие малого коэффициента расширения ртути. В 1730 году изобрёл водно-спиртовой термометр и предложил шкалу от 0 до 80°.
Шкала Реомюра очень долго использовалась на родине учёного во Франции вплоть до настоящего времени.
Различные жидкости при нагревании расширяются не одинаково. Поэтому расстояния на шкале между нулевой отметкой 0 °C и 100 °C будут разными.
Однако существует способ создать тело, которое приближенно обладает нужными качествами. Это идеальный газ. Было замечено, что в отличие от жидкостей все разряжённые газы – водород, гелий, кислород – расширяются при нагревании одинаково и одинаково меняют своё давление при изменении температуры. Это свойство газов позволяет избавиться в термометрах от одного существенного недостатка шкалы Цельсия – произвольности выбора начала отсчёта, то есть нулевой температуры.
При тепловом равновесии, если давление и объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура.
Практически такую проверку произвести непосредственно невозможно, но с помощью основного уравнения молекулярно-кинетической теории её можно выразить через макроскопические параметры:
; ; ; ;
Если кинетическая энергия действительно одинакова для всех газов в состоянии теплового равновесия, то и значение давления р должно быть тоже одинаково для всех газов при постоянном значении отношения объёма к числу молекул. Подтвердить или опровергнуть данное предположение может только опыт.
Возьмём несколько сосудов, заполненных различными газами, например, водородом, гелием и кислородом. Сосуды имеют определённые объёмы и снабжены манометрами, для измерения давления газов в сосудах. Массы газов известны, тем самым известно число молекул в каждом сосуде. Приведём газы в состояние теплового равновесия. Для этого поместим их в тающий лёд и подождём, пока не установится тепловое равновесие и давление газов перестанет меняться.
Для этого поместим их в тающий лёд и подождём, пока не установится тепловое равновесие и давление газов перестанет меняться.
Здесь устанавливается тепловое равновесие и все газы имеют одинаковую температуру 0 °С. При этом показания манометра показывают разное давление р, объёмы сосудов V изначально были разными и число молекул N различно, так как газы, закаченные в баллоны разные. Найдём отношение для водорода всех параметров для одного моля вещества:
Такое значение отношения произведения давления газа на его объём к числу молекул получается для всех газов при температуре тающего льда. Обозначим это отношение через Θ0 (тета нулевое):
Таким образом, предположение, что средняя кинетическая энергия, а также давление р в состоянии теплового равновесия одинаковы для всех газов, если их объёмы и количества вещества одинаковы или если отношение
Если же сосуды с газами поместить в кипящую воду при нормальном атмосферном давлении, то согласно эксперименту, отношение макроскопических параметров будет также одинаковым для всех газов, но значение будет больше предыдущего
Отсюда следует, что величина Θ растёт с повышением температуры и не зависит от других параметром, кроме температуры. Этот опытный факт позволяет рассматривать величину Θ тета как естественную меру температуры и измерять в энергетических единицах — джоулях.
Этот опытный факт позволяет рассматривать величину Θ тета как естественную меру температуры и измерять в энергетических единицах — джоулях.
А теперь вместо энергетической температуры введём температуру, которая будет измеряться в градусах. Будем считать величину тета Θ прямо пропорциональной температуре Т, где k- коэффициент пропорциональности
Так как , то тогда
По этой формуле вводится температура, которая даже теоретически не может быть отрицательной, так как все величины левой части этого равенства больше или равны нулю. Следовательно, наименьшим значением этой температуры является нуль, при любом другом параметре p, V, N равным нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объёме или при которой объём идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулём температуры.
Тепловое движение молекул непрерывно и бесконечно, а при абсолютном нуле молекулы поступательно не двигаются. Следовательно, абсолютный нуль температур при наличии молекул вещества не может быть достигнут. Абсолютный нуль температур — это самая низкая температурная граница, верхней не существует, та «наибольшая или последняя степень холода», существование которой предсказывал М.В. Ломоносов.
Следовательно, абсолютный нуль температур при наличии молекул вещества не может быть достигнут. Абсолютный нуль температур — это самая низкая температурная граница, верхней не существует, та «наибольшая или последняя степень холода», существование которой предсказывал М.В. Ломоносов.
В 1848 г. английскому физику Вильяму Томсону (лорд Кельвин) удалось построить абсолютную температурную шкалу (её в настоящее время называют шкалой Кельвина), которая имеет две основные точки 0 К (или абсолютный нуль) и 273К, точка в которой вода существует в трёх состояниях (в твёрдом, жидком и газообразном).
Абсолютная температурная шкала — шкала температур, в которой за начало отсчёта принят абсолютный нуль. Температура здесь обозначается буквой T и измеряется в кельвинах (К).
На шкале Цельсия, есть две основные точки: 0°С (точка, в которой тает лёд) и 100°С (кипение воды). Температура, которую определяют по шкале Цельсия, обозначается t. Шкала Цельсия имеет как положительные, так и отрицательные значения.
Из опыта мы определили значения величины Θ (тета) при 0 °С и 100 °С. Обозначим абсолютную температуру при 0 °С через Т1, а при 100 °С через Т2. Тогда согласно формуле:
Отсюда можно вычислить коэффициент k, который связывает температуру в Θ энергетических единицах (Дж) с абсолютной температурой Т (К)
k = 1,38 • 10-23 Дж/К – постоянная Больцмана.
Зная постоянную Больцмана, можно найти значение абсолютного нуля по шкале Цельсия. Для этого найдём сначала значение абсолютной температуры, соответствующее 0°С:
значение абсолютной температуры.
Один кельвин и один градус шкалы Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию:
Теперь выведем ещё одну зависимость температуры от средней кинетической энергии молекул. Из основного уравнения молекулярно-кинетической теории и уравнения для определения абсолютной температуры
Здесь видно, что левые части этих уравнений равны, значит правые равны тоже.
Средняя кинетическая энергия хаотического поступательного движения молекул газа пропорциональна абсолютной температуре.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
Из выведенных формул мы можем получить выражение, которое показывает зависимость давления газа от концентрации молекул и температуры
Из этой зависимости вытекает, что при одинаковых давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный нам из курса химии.
Закон Авогадро: в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Рассмотрим задачи тренировочного блока урока.
1. При температуре _______ (370C; 2830C; 270C) средняя кинетическая энергия поступательного движения молекул равна 6,21·10-21Дж.
Дано:
k = 1,38 • 10-23 Дж/К – постоянная Больцмана
t -?
Решение:
Запишем значение средней кинетической энергии хаотического поступательного движения молекул с зависимостью от абсолютной температуры:
Отсюда выразим Т:
Соотношение между абсолютной температурой и температурой в градусах Цельсия:
Подставим значение абсолютной температуры:
Правильный вариант ответа:
2. При температуре 290 К и давлении 0,8 МПа, средняя кинетическая энергия молекул равна __________ Дж, а концентрация составляет молекул ___________ м-3.
При температуре 290 К и давлении 0,8 МПа, средняя кинетическая энергия молекул равна __________ Дж, а концентрация составляет молекул ___________ м-3.
Дано:
Т = 290К
р = 0,8 МПа =0,8·106 Па
k = 1,38 • 10-23 Дж/К – постоянная Больцмана
Ек -? n – ?
Решение:
Значение средней кинетической энергии хаотического поступательного движения молекул:
Подставив значение абсолютной температуры, найдём ответ:
Определим концентрацию газа из соотношения:
Правильный вариант ответа: 6·10-21; 2·1026 м-3.
Температура (в физике) – это… Что такое Температура (в физике)?
- Температура (в физике)
- Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние), физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
 Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы.
Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы. В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.
В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.Строго определённой Т. характеризуется лишь равновесное состояние тел. Существуют, однако, системы, состояние которых можно приближённо охарактеризовать несколькими не равными друг другу температурами. Например, в плазме, состоящей из лёгких (электроны) и тяжёлых (ионы) заряженных частиц, при столкновении частиц энергия быстро передаётся от электронов к электронам и от ионов к ионам, но медленно от электронов к ионам и обратно.
 Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.
Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.В телах, частицы которых обладают магнитным моментом, энергия обычно медленно передаётся от поступательных к магнитным степеням свободы, связанным с возможностью изменения направления магнитного момента. Благодаря этому существуют состояния, в которых система магнитных моментов характеризуется Т., не совпадающей с кинетической Т., соответствующей поступательному движению частиц. Магнитная Т. определяет магнитную часть внутренней энергии и может быть как положительной, так и отрицательной (см. Отрицательная температура). В процессе выравнивания Т. энергия передаётся от частиц (степеней свободы) с большей Т. к частицам (степеням свободы) с меньшей Т., если они одновременно положительны или отрицательны, но в обратном направлении, если одна из них положительна, а другая отрицательна. В этом смысле отрицательная Т.
 «выше» любой положительной.
«выше» любой положительной.Понятие Т. применяют также для характеристики неравновесных систем (см. Термодинамика неравновесных процессов). Например, яркость небесных тел характеризуют яркостной температурой, спектральный состав излучения — цветовой температурой и т. д.
Л. Ф. Андреев.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Температура (в астрофизике)
- Температура замерзания растворов
Смотреть что такое “Температура (в физике)” в других словарях:
Температура (в физике) — … Википедия
ТЕМПЕРАТУРА — • ТЕМПЕРАТУРА, в биологии интенсивность тепла. У теплокровных (ГОМОЙОТЕРМНЫХ) животных, таких, как птицы и млекопитающие, температура тела поддерживается в узких пределах независимо от температуры окружающей среды. Это обусловлено мышечной… … Научно-технический энциклопедический словарь
Температура — Размерность Θ Единицы измерения СИ К … Википедия
Температура кипения — Температура кипения, точка кипения температура, при которой происходит кипение жидкости, находящейся под постоянным давлением.
 Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как … Википедия
Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как … ВикипедияТемпература воздуха* — Главнейшим элементом, характеризующим погоду, является Т. газовой среды, окружающей земную поверхность, правильнее Т. того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Температура воздуха — Главнейшим элементом, характеризующим погоду, является Т. газовой среды, окружающей земную поверхность, правильнее Т. того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
температура — 1) Величина, характеризующая физ.тела в состоянии теплового равновесия, связана с интенсивностью теплового движения частей тела; 2) степень теплоты человеческого тела как показатель здоровья; разг.
 повышенная степень теплоты тела при… … Историко-этимологический словарь латинских заимствований
повышенная степень теплоты тела при… … Историко-этимологический словарь латинских заимствованийСписок обозначений в физике — Необходимо проверить качество перевода и привести статью в соответствие со стилистическими правилами Википедии. Вы можете помочь … Википедия
Важнейшие открытия в физике — История технологий По периодам и регионам: Неолитическая революция Древние технологии Египта Наука и технологии древней Индии Наука и технологии древнего Китая Технологии Древней Греции Технологии Древнего Рима Технологии исламского мира… … Википедия
Отрицательная абсолютная температура — температура, характеризующая равновесные состояния термодинамической системы, в которых вероятность обнаружить систему в микросостоянии с более высокой энергией выше, чем в микросостоянии с более низкой. В квантовой статистике это значит, что… … Википедия
Книги
- Спектральная пирометрия, Магунов Александр Николаевич.
 Рассматривается новый экспериментальный метод измерения температуры нагретых объектов по непрерывному спектру теплового излучения, регистрируемому в широком интервале длин волн (например, от… Подробнее Купить за 1896 грн (только Украина)
Рассматривается новый экспериментальный метод измерения температуры нагретых объектов по непрерывному спектру теплового излучения, регистрируемому в широком интервале длин волн (например, от… Подробнее Купить за 1896 грн (только Украина) - Механика и молекулярная физика. Учебное пособие, Ландау Лев Давидович, Ахиезер Александр Ильич, Лифшиц Евгений Михайлович. Трудно писать о книге Л. Д. Ландау, А. И. Ахиезера, Е. М. Лифшица, потому что это как раз тот случай, когда ни книга, ни, тем более, её авторы, как принято говорить,`в рекламене нуждаются`.… Подробнее Купить за 1849 грн (только Украина)
- Статистическая физика сложных систем. От фракталов до скейлинг-поведения. Выпуск 57, Абаимов С.Г.. Многообразие происходящих в природе явлений, на первый взгляд, не подчиняется каким-то унифицированным принципам, и каждое явление требует введения своих законовописания поведения. Однако… Подробнее Купить за 1225 грн (только Украина)
Температура.
 Абсолютная температура – материалы для подготовки к ЕГЭ по Физике
Абсолютная температура – материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: тепловое равновесие, абсолютная температура.Мы часто используем слово “температура” в повседневной речи. А что такое температура? В данной статье мы объясним физический смысл этого понятия.
В молекулярной физике и термодинамике рассматриваются макроскопические тела, т. е. тела, состоящие из огромного числа частиц. Например, в стакане воды содержится порядка молекул. Такое грандиозное число с трудом поддаётся осмыслению.
Термодинамическая система
Термодинамической системой называется макроскопическое тело или система тел, которые могут взаимодействовать друг с другом и с окружающими телами. Стакан с водой — пример термодинамической системы.
Термодинамическая система состоит из столь большого числа частиц, что совершенно невозможно описывать её поведение путём рассмотрения движения каждой молекулы в отдельности. Однако именно грандиозность числа молекул делает ненужным такое описание.
Оказывается, что состояние термодинамической системы можно характеризовать небольшим числом макроскопических параметров — величин, относящимся к системе в целом, а не к отдельным атомам или молекулам. Такими макроскопическими параметрами являются давление, объём, температура, плотность, теплоёмкость, удельное сопротивление и др.
Состояние термодинамической системы, при котором все макроскопические параметры остаются неизменными с течением времени, называется тепловым равновесием. В состоянии теплового равновесия прекращаются все макроскопические процессы: диффузия, теплопередача, фазовые переходы химические реакции и т. д.(Следует отметить, что тепловое равновесие является динамическим равновесием. Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с окружающими телами. Чай в термосе — типичный пример изолированной системы.
Тепловое равновесие
Фундаментальный постулат, вытекающий из многочисленных опытных данных, гласит: каково бы ни было начальное состояние тел изолированной системы, со временем в ней устанавливается тепловое равновесие. Таким образом, тепловое равновесие — это состояние, в которое любая система, изолированная от окружающей среды, самопроизвольно переходит через достаточно большой промежуток времени.
Температура как раз и является величиной, характеризующей состояние теплового равновесия термодинамической системы.
Температура — это макроскопический параметр, значения которого одинаковы для всех частей термодинамической системы, находящейся в состоянии теплового равновесия. Попросту говоря, температура — это то, что является одинаковым для любых двух тел, которые находятся в тепловом равновесии друг с другом. При тепловом контакте тел с одинаковыми температурами между ними не будет происходить обмен энергией (теплообмен).
В общем же случае при установлении между телами теплового контакта теплообмен начнётся. Говорят, что тело, которое отдаёт энергию, имеет более высокую температуру, а тело, которое получает энергию — более низкую температуру. Температура, таким образом, указывает направление теплообмена между телами. В процессе теплообмена температура первого тела начнёт уменьшаться, температура второго тела — увеличиваться; при выравнивании температур теплообмен прекратится — наступит тепловое равновесие.
Особенность температуры заключается в том, что она не аддитивна: температура тела не равна сумме температур его частей. Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Измеряют температуру с помощью термометра.
Для создания термометра выбирают какое-либо вещество (термометрическое вещество), какую-либо характеристику этого вещества (термометрическую величину), и используют зависимость термометрической величины от температуры. При этом выбор термометрического вещества и термометрической величины может быть весьма произвольным.
Так, в бытовых жидкостных термометрах термометрическим веществом является ртуть (или спирт), а термометрической величиной — длина столбика жидкости. Здесь используется линейная зависимость объёма жидкости от температуры.
В идеально-газовых термометрах используется линейная зависимость давления разреженного газа (близкого по своим свойствам к идеальному) от температуры.
Действие электрических термометров (термометров сопротивления) основано на температурной зависимости сопротивления чистых металлов, сплавов и полупроводников.
В процессе измерения температуры термометр приводится в тепловой контакт(В области температур выше (раскалённые газы, расплавленные металлы) используются бесконтактные высокотемпературные термометры — пирометры. Их действие основано на измерении интенсивности теплового излучения в оптическом диапазоне.) с телом, температура которого определяется. Показания термометра после наступления теплового равновесия — это и есть температура тела. При этом термометр показывает свою температуру!
Температурная шкала. Абсолютная температура
При установлении единицы температуры чаще всего поступают следующим образом. Берут две температуры (так называемые реперные точки) — температуру таяния льда и температуру кипения воды при нормальном атмосферном давлении. Первой температуре приписывают значение , второй — значение , а интервал между ними делят на равных частей. Каждую из частей называют градусом (обозначают ), а полученную таким образом температурную шкалу — шкалой Цельсия.
При измерениях по шкале Цельсия с помощью жидкостных термометров возникает одна трудность: разные жидкости при изменении температуры изменяют свой объём по-разному. Поэтому два термометра с различными жидкостями, приведённые в тепловой контакт с одним и тем же телом, могут показать разные температуры. От данного недостатка свободны идеально-газовые термометры — зависимость давления разреженного газа от температуры не зависит от вещества самого газа.
Кроме того, для температурной шкалы идеально-газового термометра существует естественное начало отсчёта (исчезает произвол выбора реперной точки!): это та предельно низкая температура, при которой давление идеального газа постоянного объёма обращается в нуль. Эта температура называется абсолютным нулём температур.
Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной температурной шкалой.
Температура, измеряемая по абсолютной шкале, называется абсолютной температурой и обозначается буквой . Единица абсолютной температуры называется кельвином ().
Единица абсолютной температуры называется кельвином ().
Абсолютному нулю () соответствует температура . Поэтому связь абсолютной температуры и температуры по шкале Цельсия даётся формулой:
В задачах достаточно использовать формулу
Шкала температуры. Шкала Цельсия, Фаренгейта, Кельвина, Реомюра
История
Слово «температура» возникло в те времена, когда люди считали, что в более нагретых телах содержится большее количество особого вещества — теплорода, чем в менее нагретых. Поэтому температура воспринималась как крепость смеси вещества тела и теплорода. По этой причине единицы измерения крепости спиртных напитков и температуры называются одинаково — градусами.
Из того, что температура – это кинетическая энергия молекул, ясно, что наиболее естественно измерять её в энергетических единицах (т.е. в системе СИ в джоулях). Однако измерение температуры началось задолго до создания молекулярно-кинетической теории, поэтому практические шкалы измеряют температуру в условных единицах — градусах.
Шкала Кельвина
В термодинамике используется шкала Кельвина, в которой температура отсчитывается от абсолютного нуля (состояние, соответствующее минимальной теоретически возможной внутренней энергии тела), а один кельвин равен 1/273.16 расстояния от абсолютного нуля до тройной точки воды (состояния, при котором лёд, вода и водяной пар находятся в равновесии). Для пересчета кельвинов в энергетические единицы служит постоянная Больцмана. Используются также производные единицы: килокельвин, мегакельвин, милликельвин и т.д.
Шкала Цельсия
В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15 °C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. В этой шкале на 100 градусов раздёлен интервал от температуры самой холодной зимы в городе, где жил Фаренгейт, до температуры человеческого тела. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а градус Фаренгейта равен 5/9 градуса Цельсия.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F – 32), то есть изменение температуры на 1 °F соответствует изменению на 5/9 °С. Предложена Г. Фаренгейтом в 1724.
Шкала Реомюра
Предложенна в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)
1 °R = 1,25 °C.
В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
|
Пересчёт температуры между основными шкалами |
|||
|
|
Кельвин |
Цельсий |
Фаренгейт |
|
Кельвин (K) |
= K |
= С + 273,15 |
= (F + 459,67) / 1,8 |
|
Цельсий (°C) |
= K − 273,15 |
= C |
= (F − 32) / 1,8 |
|
Фаренгейт (°F) |
= K · 1,8 − 459,67 |
= C · 1,8 + 32 |
= F |
Сравнение температурных шкал
|
Описание |
Кельвин | Цельсий |
Фаренгейт |
Ньютон | Реомюр |
|
Абсолютный ноль |
0 |
−273. |
−459.67 |
−90.14 |
−218.52 |
|
Температура таяния смеси Фаренгейта (соли и льда в равных количествах) |
255.37 |
−17.78 |
0 |
−5.87 |
−14.22 |
| Температура замерзания воды (нормальные условия) |
273.15 |
0 |
32 |
0 |
0 |
|
Средняя температура человеческого тела¹ |
310.0 |
36.8 |
98.2 |
12. |
29.6 |
|
Температура кипения воды (нормальные условия) |
373.15 |
100 |
212 |
33 |
80 |
| Температура поверхности Солнца |
5800 |
5526 |
9980 |
1823 |
4421 |
¹ Нормальная температура человеческого тела — 36.6 °C ±0.7 °C, или 98.2 °F ±1.3 °F. Приводимое обычно значение 98.6 °F – это точное преобразование в шкалу Фаренгейта принятого в Германии в XIX веке значения 37 °C. Поскольку это значение не входит в диапазон нормальной температуры по современным представлениям, можно говорить, что оно содержит избыточную (неверную) точность. Некоторые значения в этой таблице были округлены.
Некоторые значения в этой таблице были округлены.
Сопоставление шкал Фаренгейта и Цельсия
(oF – шкала Фаренгейта, oC – шкала Цельсия)
|
oF |
oC |
|
oF |
oC |
|
oF |
oC |
|
oF |
oC |
|
-459. |
-273.15 |
|
-60 |
-51.1 |
|
-4 |
-20.0 |
|
20 |
-6.7 |
Для перевода градусов цельсия в кельвины необходимо пользоваться формулой T=t+T0 где T- температура в кельвинах, t- температура в градусах цельсия, T0=273.15 кельвина. По размеру градус Цельсия равен Кельвину.
Тепловые явления – Формулы по физике
Общая теория теплоты является аксиоматической наукой, Она не вводит специальных гипотез и конкретных представлений о строении вещества и физической природы теплоты. Ее выводы основаны на общих принципах или началах, являющихся обобщением опытных фактов. Она рассматривает теплоту как род какого-то внутреннего движения, но не пытается конкретизировать, что это за движение.В авиации особое место уделяется двум ее элементам: тепловому расширению тел и явлению теплообмена.
Значимость процесса теплообмена как в природе, так и в технике определяется тем, что свойства тел самым существенным образом зависят от температуры, т.е. от их теплового состояния. Последнее же, в свою очередь, определяется условиями теплообмена, которые поэтому оказывают решающее влияние на процессы изменения агрегатного состояния вещества, на течение химических реакций (в частности, процесса горения), механические, элетроизоляционные, магнитные и другие свойства тел.
Последнее же, в свою очередь, определяется условиями теплообмена, которые поэтому оказывают решающее влияние на процессы изменения агрегатного состояния вещества, на течение химических реакций (в частности, процесса горения), механические, элетроизоляционные, магнитные и другие свойства тел.
Именно этими обстоятельствами и объясняются бурное развитие теории теплообмена в ХХ веке и то исключительное внимание, которое ей уделяется в физике планетарных процессов, энергетике, химической технологии и в ряде других отраслей науки и техники.
2
1. ОБЩИЕ ПОНЯТИЕ ТЕОРИИ ТЕПЛОВЫХ ЯВЛЕНИЙ
В отличие от механической энергии, которая может изменяться только за счет работы, внутренняя энергия может изменяться как за счет работы, так и при контакте с телами, имеющими другую температуру, т.е. в процессе теплообмена. Энергия, переданная при теплообмене (подведении тепла), называется количеством теплоты или теплотой. Теплота считается положительной, если система получает энергию, и отрицательной, если отдает. При соприкосновении двух тел, имеющих различную температуру, происходит обмен энергией движения структурных частиц ( молекул, атомов, свободных электронов), вследствие чего интенсивность движения частиц тела, имеющего меньшую температуру, увеличивается, а интенсивность движения частиц тела с более высокой температурой уменьшается. В результате одно из соприкасающихся тел нагревается, а другое остывает. Поток энергии, передаваемой частицами более горячего тела частицам тела более холодного, называется тепловым потоком.
При соприкосновении двух тел, имеющих различную температуру, происходит обмен энергией движения структурных частиц ( молекул, атомов, свободных электронов), вследствие чего интенсивность движения частиц тела, имеющего меньшую температуру, увеличивается, а интенсивность движения частиц тела с более высокой температурой уменьшается. В результате одно из соприкасающихся тел нагревается, а другое остывает. Поток энергии, передаваемой частицами более горячего тела частицам тела более холодного, называется тепловым потоком.
Таким образом, для возникновения теплового потока, т.е. процесса теплообмена между различными областями пространства, заполненного вещественной средой, необходимо и достаточно, чтобы в этих областях имели место неодинаковые температуры. Иначе говоря, единственным условием возникновения теплообмена является наличие разности температур между рассматриваемыми телами. При этом тепловой поток направлен в сторону меньших температур.
Предметом теории теплообмена являются процессы переноса тепла из одной части пространства и другую.
Наряду с рассмотренным случаем теплообмена непосредственно в вещественной среде, являющегося следствием движения структурных частиц, имеет место также перенос теплоты посредством лучеиспускания (например, в космических процессах). Поэтому следует различать теплообмен путем
3
непосредственного соприкосновения тел и лучистый теплообмен, когда энергия передается от одного тела к другому посредством электромагнитного поля.
В вещественной среде распространение тепла, в конечном счете, всегда связано с тепловым движением структурных частиц. Однако непосредственный перенос определенных порций теплоты из одной области в другую может происходить не только в результате последовательного обмена энергией частиц,заполняющих пространство между рассматриваемыми областями, но и в результате перемещения состоящих из большого количества молекул объемов среды.
Процесс распространения тепла только вследствие движения структурных частиц называется тепопроводностью, а процесс теплопередачи, обусловленный перемещениями молярных объемов среды, – конвекцией.
Таким образом, существует три способа переноса тепла: теплопроводность (кондукция), перемешивание (конвекция) и излучение (радиация). В действительных процессах все эти три способа теплообмена обычно сопутствуют друг другу и частично связаны с переносом массы (диффузией), т.е. имеет место сложный тепло- и массобмен.
В теории теплопередачи расчет сложного теплообмена осуществляется с помощью методов, обощающих результаты раздельного излучения каждого из трех первичных способов переноса тепла. Следовательно, основным методом теории теплопередачи является расчленение сложного теплообмена на его составляющие по способу (механизму) переноса тепла и излучение этих составляющих методами математической физики и научного опыта.
При рассмотрении сложного теплообмена с сильно меняющими
ся в пространстве и времени температурными полями могут возникать задачи, которые не сводятся к моделям с квазиавтономными частными процессами теплообмена. В этих случаях понятия коэффициентов теплопередачи и теплоотдачи вообще лишены отчетливого смысла. Необходима постановка
Необходима постановка
4
задачи, в достаточно общей форме описывающей как механизмы теплопереноса в отдельных элементах системы. Так и их взаимодействия на границах раздела тел и фаз. Такие задачи называются сопряженными, и их конкретное рассмотрение, как правило, весьма индивидуализировано конкретными краевыми условиями. Общая же их постановка всегда опирается на основные уравнения.
Практически большинство процессов, рассматриваемых теорией теплообмена, протекает при взаимодействии твердых тел и жидких сред в областях, размеры которых чрезвычайно велики по сравнению с длиной свободного пробега структурных частиц (атомов, молекул). Так, в объеме газа, равном 10-3 мм3, при давлении 9,8*104 Па и температуре 273 К содержится примерно 1016 молекул. Поэтому такие статистические понятия, как температура, давление, теплоемкость, вязкость и т.п., могут быть приписаны даже таким малым элементам системы, которые с физико-математической точки зрения могут рассматриваться в данном случае как дифференциалы ее объема.
Это означает, что в большинстве проблем теплообмена твердые и жидкие среды, составляющие систему, рассматриваются как непрерывные. Исключение приходится делать только для взаимодействия тел с весьма разряженным газом, когда размеры тела становятся соизмеримыми с длиной пути свободного пробега молекул.
5
2.ТЕПЛОВОЕ РАСШИРЕНИЕ ТЕЛ
Простые опыты и наблюдения убеждают нас, что при повышении температуры размеры тел немного увеличиваются, а по охлаждении – уменьшаются до прежней величины. При нагревании увеличивается нетолько длина тела, но другие линейные размеры. Изменение линейных размеров тела при нагревании называют тепловым линейным расширением. Увеличение линейных размеров сопровождается увеличением объемов тел (объемное расширение тел).
Линейное расширение тел
Измерения показывают, что одного и тоже тело расширяется при различных температурах по разному: при высоких температурах тепловое расширение обычно сильнее, чем при низких. Однако разница в расширении невелика, и при относительно небольших изменениях температуры мы можем ее принебречь и считать, что изменение размеров тела пропорционально изменению температуры.
Для того чтобы получить характеристику теплового расширения материала, из которого сделано тело, надо взять относительное удлинение, т.е. отношение
наблюденного удлинения к длине нашего тела при определенных “нормальных” условиях. “Нормальной” длиной считают длину тела при О0С, обозначанмую 0.
Итак, величина, характеризующая тепловое расширение
– называется коэффициентом линейного расширения и показывает, на какую
долю своей нормальной длины увеличивается длина тела при нагревании на 10С.
При практическом применении этой формулы, достаточно измерить длину стержня из исследуемого материала, поддерживая по всему его объему одну и ту же температуру t. Затем следует с той же относительной точностью измерить удлинение ` – , вызванное изменением температуры от t до t`. Чтобы увеличить точность измерения удлинения ` – , которое обычно бывает очень малым, приходится прибегать к особым приемам.
Зная коэффициент линейного расширения, можно рассчитать длину тела при любой температуре в пределах не очень большого температурного интервала. Преобразуем выше приведенную формула. Где для краткости приращение температуры t` – t обозначим одной буквой ,
` = (1 + ) (1.2)
перед нами формула линейного расширения. Выражение, стоящее в скобках носит название бинома расширения.
Бином расширения показывает, во сколько раз увеличилась длина тела при нагревании его на градусов.
Формулой можно пользоваться и для того случая, когда нужно найти длину тела после его охлаждения.
Объемное расширение тел
Аналогично коэффициенту линейного расширения можно ввести коэффициент объемного расширения материала, характеризующий изменение объема при изменении температуры. Эмперическим путем было показано, что как и в случае линейного
7
расширения, можно без заметной ошибки принять, что приращение объема тела пропорционально приращению температуры, в пределах не слишком большого температурного интеравала.
Обозначим объем тела при начальной температуре t через V, объем при конечной температуре t` через V`, объем при 00С через V0 и коэффициент объемного расширения через , найдем:
= (V` – V ) / V0 (t` – t) (1.3)
Так как для твердых и жидких тел тепловое расширение незначительно, то объем V 0 при 00С очень мало отличается от объема при другой температуре, например комнатной. Поэтому в выражении коэффициента объемного расширения можно заменить V 0 через V, что практически удобнее.
= (V` – V) / V (t` – t) (1.4)
Уместно отметить, что тепловое расширение газов настолько значительно, что замена на влечет уже заметное изменение, и поэтому в случае газов такое упрощение можно делать только для малых интервалов температур. Преобразую формулу (1.2), путем обозначения выражения (t`-t) на , напишем
– данная формула позволяет рассчитать объем тела, если известны начальный объем и приращение температуры. Выражение (1+) – носит название бинома объемного расширения.
При увеличении объема тела плотность их уменьшается во столько раз, во сколько увеличился объем.
8
Между коэффициентами линейного и объемного расширений существует определенная связь, которая расчетным и опытным путем была доказана и расчитана многими учеными и представляет собой следующее выражение
Отсюда видно, что коэффициент объемного расширения равен утроенному коэффициенту линейного расширения.
9
3. ОБЩАЯ ТЕОРИЯ ТЕПЛООБМЕНА
При теплообмене энергия переходит от тела с большой температурой к телу с меньшей температурой. Любая температурная шкала должна удовлетворять этому свойству. Эпирические температурные шкалы основаны на косвенных измерениях, т.е. на измерениях параметров, монотонно зависящих от температуры. Газовая шкала температур опирается на уравнение состояния идеального газа V = RT.
Термодинамическая, или абсолютная шкала температур определяется на основе второго начала термодинамики.
3.1 Виды теплообмена
Теплообмен осуществляется тремя различными способами. При теплообмене посредством теплопроводности перенос тепловой энергии происходит только путем взаимодействия частиц, находящихся в непосредственном соприкосновении друг с другом и имеющих различную температуру. Теплообмен путем теплопроводности в чистом виде имеет место толко в твердых телах.
Теплообмен посредством конвекции совершается путем перемещения материальных частиц и может иметь место только в жидкостях или газах. Если
причиной движения потоков жидкости или газа является неодинаковая плотность среды, вызванная разностью температур, то говорят о естественной конвекции. Движение потоков под действием внешних причин вызывает вынужденную конвекцию.
Третьим способом теплообмена является теплообмен посредством излучения.
Тепловое излучение представляет собой поток электромагнитных волн, излучаемых телом за счет его тепловой энергии и полностью или частично поглощаемых другими телами.
10
Теплопроводность. Распространение теплоты путем теплопроводности определяется законом Фурье q = – grad , где q- тепловой поток, представляющий собой количество теплоты, переданной в единицу времени через единицу поверхности, grad – градиент температуры; – теплопроводность.
Теплопроводность зависит от природы и физического состояния вещества. В анизотропных телах она зависит, кроме того, от направления распространения теплоты. Лучшими проводниками теплоты являются металлы. Наименьшей теплопроводностью обладают газы. Для газов теплопроводность зависит не только от состава газа, но и от температуры и при большом разрежении – от давления.
Полный тепловой поток, создаваемый разностью температур, определяется формулой
q = G = /R (1.14)
где G– тепловая проводимость среды; R – тепловое сопротивление среды.
Тепловая проводимость среды зависит от теплопроводности, определяемой по справочным данным из геометрических соотношений, и для расчета можно использовать аналогичные формулы электрической проводимости, заменив удельную проводимость теплопроводностью.
Конвекция. Полный тепловой поток в результате теплоотдачи определяется формулой Ньютона
q= S, (1.15)
где – коэффициент теплоотдачи, S – поверхность тела; – разность температур окружающей среды и тела. Коэффициент тепоотдачи при
11
естественной и вынужденной конвекции рассчитывается на основании теорий теплового и геометрического подобий.
При искусственной конвекции при поперечном омывании цилиндра (рис. 1-а)
коэффициент теплоотдачи для газов выражается формулой:
газ = c/d *(vd/)n = c/d * Ren (1.16)
Где d – диаметр цилиндра; v- скорость движения газа; – кинематическая вязкость, равная абсолютной вязкости, отнесенной к плотности вещества; – теплопроводность газа; c и n являются функциями скорости газа и размеров цилиндра и определяются по предварительно рассчитанной величине, назывемой критерием Рейнольдса Re = vd/ из приведенных ниже таблиц
Re | c | N |
5-80 | 0,93 | 0,40 |
80-5*103 | 0,715 | 0,46 |
5*103 | 0,226 | 0,60 |
, 0C
, 1*10-6
м2/с
,1*10-2
Вт/(мК)
0
13,70
2,33
20
15,70
2,56
100
23,78
3,02
500
80,40
5,46
При расчете коэффициента теплоотдачи для жидкости в формулу (1.16) входит критерий Прандтля Pr:
12
жидк = с/d RenPr 0,4 (1.17)
Критерий Прандтля Pr = / зависит от кинематической вязкости и температуропроводности , физический смысл которой состоит в том, что она
является мерой скорости выравнивания температур различных точек жидкости. Температуропроводность зависит от теплопроводности , плотности и удельной теплоемкости вещества с и определяется формулой
= / (с ) (1.18)
Приведенные формулы для теплоотдачи цилиндра в поперечном потоке справедливы для случая, когда угол , составленный осью цилиндра и направленния потока и называемый углом атаки, равен 900. Зависимость коэффициента теплоотдачи от угла атаки представленна на (рис. 1-б).
В таблицах, приведенных выше содержатся основные параметры соответственно сухого воздуха при P=105 Па и воды, необходимые для расчета коэффициентов теплоотдачи. Температура, при которой определены параметры в таблицах 1-2 и 1-3,считается как среднеарифметическая температура тела и среды.
13
Тепловое излучение свойственно всем телам, и каждое из них непрерывно излучает и поглощает энергию. Разность между излучаемой и поглощаемой телом лучистой энергией отлична от нуля, если температура тел, участвующих во взаимном обмене лучистой энергией, различна. По закону Стефана-Больцмана полное количество энергии, излучаемое в единицу времени единицей поверхности, имеющей температуру , равно E0=04, где 0=5.7*10-8 Вт/(м2*К4) – константа излучения абсолютно твердого тела.
В технических расчетах этот закон применяется в более удобной форме :
E0=C0(/100)4, где C0– коэффициент лучеиспускания абсолютно черного тела:
C0=5.7 Вт/(м2*К4). Закон Стефана-Больцмана применим и к реальным серым телам,
Но их коэффициент лучеиспускания С рассчитывается с учетом относительной излучательной способности или степени черноты тела , т.е. С=С0.
Количество поглощаемой телом лучистой энергии также зависит от степени черноты тела и определяется формулой Е = Еэф, где Еэф – извне падающее эффективное излучение окружающих тел. При выводе формул лучистого теплообмена между телами необходимо учитывать, кроме лучеиспускательной, поглощательной и отражательной способности тел, их размеры и направление излучений.
На практике обычно имеет место комбинация различных способов теплообмена, которые могут быть учтены приводимыми ниже формулами.
3.2 Физические параметры теплообмена
Общий закон сохранения энергии с учетом процесса теплообмена и внутренней энергии имеет вид:
Е мех + U = Ае + Q (1.7)
14
т.е. изменение полной (механической + внутренней) энергии системы равно работе внешних сил и теплоте, полученной при теплообмене с внешними телами. Иногда закон сохранения энергии формулируют как невозможность создания вечного двигателя первого рода (который производил бы работу из ничего). Первым началом термодинамики называют обычно применение этого закона к термодинамической системе, механическая энергия которой не меняется. Кроме того, в термодинамике удобнее использовать работу системы против внешних сил: А = – Ае. Получаем
Q = U+ А (1.8)
подведенная к термодинамической системе теплота идет на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
Второе начало термодинамики позволяет вывести важное соотношение для внутренней энергии простой системы, которое не может быть получено в рамках первого начала:
( U/V)T = T ( p/T) V – p (1.9)
таким образом, невозможен процесс, единственым результатом которого было бы совершение работы за счет теплоты, взятой у теплового резервуара при постоянной температуре. Эквивалентна этому заключению и формулировка Клаузиуса: невозможен процесс, единственным результатом которого была бы передача энергии от более холодного тела к более горячему.
Клаузиус вывел неравенств относящееся к любому замкнутому циклу. Если в замкнутом цикле система получает теплоты Q1 ……,QN от внешних резервуаров, имеющих температуры Те1, …….ТеN , то удовлетворяет неравенство
Тепловое равновесие
1. В термос с большим количеством льда при температуре заливают 0,5 кг воды при температуре . При установлении теплового равновесия в сосуде расплавится лед массой
1) 90 г 2) 280 г 3) 420 г 4) 0, 44 кг
Так как льда в термосе много, то при добавлении воды он не растает весь, а значит, температура теплового баланса равна нулю градусов – такая температура будет у смеси, когда баланс установится. Значит, доливаемая вода изменит свою температуру на 66 . Зная теплоемкость воды ( Дж/(кг*К)), определим, какое количество теплоты она передала смеси:
, здесь m – масса воды, .
Дж.
Теперь определим, какое количество льда сможет растопить такое количество теплоты:
, – масса льда, – удельная теплота плавления льда, Дж/кг. Выражаем массу льда из формулы:
кг, или 420 г.
Ответ: 3.
2. В термос с большим количеством воды при температуре кладут 3 кг льда с температурой . При установлении теплового равновесия в сосуде замерзнет вода массой
1) 66 г 2) 300 г 3) 420 г 4) 3 кг
Определим, какое количество теплоты “заберет” лед, чтобы нагреться до – раз воды много, значит, она вся не замерзнет и окончательная температура смеси будет именно такой:
, здесь . – масса льда, Дж/(кг*К) – удельная теплоемкость льда.
Дж.
Узнаем, какое количество воды с температурой превратится в лед, если от нее отобрать такое количество теплоты:
, здесь – масса воды, превратившейся в лед, Дж/кг – удельная теплоемкость плавления льда (она же – кристаллизации воды).
кг, или 420 г
Ответ: 3.
3. В кастрюлю с 2 л воды температурой 25 °С долили 3 л кипятка температурой 100 °С. Какова будет температура воды после установления теплового равновесия? Теплообмен с окружающей средой и теплоемкость кастрюли не учитывайте.
1) 50 °С
2) 63 °С
3) 70 °С
4) 75 °С
Составим уравнение теплового баланса:
, здесь – удельная теплоемкость воды, которую, впрочем, можно сократить, так как фазовых переходов нет, а только устанавливается тепловой баланс. Тогда:
, ,
,
,
.
Ответ: 3.
4. В калориметр с водой бросают кусочки тающего льда. В некоторый момент кусочки льда перестают таять. К концу процесса масса воды увеличилась на 84 г. Какова начальная масса воды, если ее первоначальная температура 20 °С?
1) 660 г
2) 420 г
3) 216 г
4) 330 г
Как правило, если в задаче говорится о калориметре, то имеется в виду, что теплообмена с окружающей средой нет.То, что кусочки льда “тающие” означает, что температура льда . 84 г, на которые увеличилась масса воды – это вода, образовавшаяся в результате таяния льда. То есть льда было тоже 84 г. Конечная температура воды равна , так как лед уже не тает в ней. Теперь можем составить уравнение теплового баланса:
, здесь все величины с индексом 1 относятся к воде, а с индексом 2 – ко льду.
– удельная теплоемкость воды,
– исходная температура воды,
– конечная температура воды,
– масса льда,
– удельная теплота плавления льда.
Тогда: , , кг, или 330 г
Ответ: 4.
Учебник по физике
На предыдущей странице мы узнали, что тепло делает с объектом, когда оно накапливается или выделяется. Прирост или потеря тепла приводят к изменениям температуры, изменению состояния или выполнения работы. Тепло – это передача энергии. Когда объект приобретается или теряется, внутри этого объекта будут происходить соответствующие изменения энергии. Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта. Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект.А когда работа сделана, происходит полная передача энергии объекту, над которым она выполняется. В этой части Урока 2 мы исследуем вопрос . Как измерить количество тепла, полученного или выделенного объектом?
Удельная теплоемкость
Предположим, что несколько объектов, состоящих из разных материалов, нагреваются одинаково. Будут ли предметы нагреваться одинаково? Ответ: скорее всего, нет.Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы – Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения – Дж / г / ° C. Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов.Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.) И нажмите кнопку «Отправить»; результаты будут отображены в отдельном окне.
Удельная теплоемкость твердого алюминия (0,904 Дж / г / ° C) отличается от удельной теплоемкости твердого железа (0,449 Дж / г / ° C). Это означает, что для повышения температуры данной массы алюминия на 1 ° C потребуется больше тепла, чем для повышения температуры той же массы железа на 1 ° C.Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Теплоемкость указана из расчета на грамм или на килограмм . Иногда значение указывается из расчета на моль, и в этом случае оно называется молярной теплоемкостью. Тот факт, что они перечислены на основе на количество , является показателем того, что количество тепла, необходимое для повышения температуры вещества, зависит от того, сколько в нем вещества.Эту истину, несомненно, знает всякий, кто варил на плите кастрюлю с водой. Вода закипает при температуре 100 ° C на уровне моря и при слегка пониженной температуре на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее сначала нужно поднять до 100 ° C. Это изменение температуры достигается за счет поглощения тепла горелкой печи. Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды.
Удельная теплоемкость также указана из расчета на K или на ° C. Тот факт, что удельная теплоемкость указана из расчета на градус , указывает на то, что количество тепла, необходимое для повышения данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20 ° C до 100 ° C (изменение на 80 ° C) требуется больше тепла, чем для повышения температуры того же количества воды с 60 ° C до 100 ° C (изменение на 40 ° C). ° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной.
Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» в некоторой степени похож на , неправильное наименование . Этот термин подразумевает, что вещества могут иметь способность содержать вещь , называемую теплотой. Как уже говорилось ранее, тепло – это не то, что содержится в объекте. Тепло – это то, что передается к объекту или от него. Объекты содержат энергию в самых разных формах. Когда эта энергия передается другим объектам с разной температурой, мы называем переданную энергию тепловой или тепловой энергией .Хотя это вряд ли приживется, более подходящим термином будет удельная энергоемкость.
Удельная теплоемкость позволяет математически связать количество тепловой энергии, полученной (или потерянной) образцом любого вещества, с массой образца и ее результирующим изменением температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением.
Q = м • C • ΔT
где Q – количество тепла, переданного объекту или от объекта, m – масса объекта, C – удельная теплоемкость материала, из которого состоит объект, а ΔT – результирующее изменение температуры объекта. Как и во всех других ситуациях в науке, значение дельта (∆) для любой величины рассчитывается путем вычитания начального значения количества из окончательного значения количества. В этом случае ΔT равно T конечный – T начальный .При использовании приведенного выше уравнения значение Q может быть положительным или отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает на то, что объект получил тепловую энергию от окружающей среды; это соответствовало бы повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это соответствовало бы снижению температуры и отрицательному значению ΔT.
Знание любых трех из этих четырех величин позволяет человеку вычислить четвертое количество. Обычная задача на многих уроках физики включает решение проблем, связанных с отношениями между этими четырьмя величинами. В качестве примеров рассмотрим две проблемы ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы.
Пример задачи 1 |
Как и любая проблема в физике, решение начинается с определения известных величин и соотнесения их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее:
м = 450 г
C = 4,18 Дж / г / ° C
Т начальная = 15 ° С
T окончательная = 85 ° C
Мы хотим определить значение Q – количество тепла.Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре.
T = T окончательный – T начальный = 85 ° C – 15 ° C = 70 ° C
Зная три из четырех величин соответствующего уравнения, мы можем подставить и решить для Q.
Q = m • C • ΔT = (450 г) • (4,18 Дж / г / ° C) • (70 ° C)
Q = 131670 Дж
Q = 1.3×10 5 J = 130 кДж (округлено до двух значащих цифр)
Пример задачи 2 |
По сравнению с предыдущей проблемой это гораздо более сложная проблема. По сути, эта проблема похожа на две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, теряемого водой (Q вода ), равно количеству тепла, полученного металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно рассчитать Q water .Это значение воды Q равно значению металла Q . Как только значение металла Q известно, его можно использовать вместе со значением m и ΔT металла для расчета металла Q . Использование этой стратегии приводит к следующему решению:
Часть 1: Определение потерь тепла водой
Дано:
м = 50,0 г
C = 4,18 Дж / г / ° C
Т начальная = 88,6 ° С
Т финал = 87.1 ° С
ΔT = -1,5 ° C (T конечный – T начальный )
Решение для воды Q :
Q вода = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (-1,5 ° C)
Q вода = -313,5 Дж (без заземления)
(Знак – означает, что вода теряет тепло)
Часть 2: Определите стоимость металла C
Дано:
Q металл = 313.5 Дж (используйте знак +, так как металл нагревается)
m = 12,9 г
Т начальная = 26,5 ° С
T окончательная = 87,1 ° C
ΔT = (T конечный – T начальный )
Решить для металла C :
Переставьте металл Q = m металл • C металл • ΔT металл , чтобы получить металл C = Q металл / (м металл • ΔT металл )
C металл = Q металл / (м металл • ΔT металл ) = (313.5 Дж) / [(12,9 г) • (60,6 ° C)]
C металл = 0,40103 Дж / г / ° C
C металл = 0,40 Дж / г / ° C (округлено до двух значащих цифр)
Тепло и изменения состояния
Приведенное выше обсуждение и соответствующее уравнение (Q = m • C • ∆T) связывает тепло, полученное или потерянное объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло накапливается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количества тепла.
Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца вещества. В таблице ниже перечислены несколько изменений состояния и указаны имена, обычно связанные с каждым процессом.
Процесс | Изменение состояния |
Плавка | От твердого до жидкого |
Заморозка | От жидкости к твердому веществу |
Испарение | От жидкости к газу |
Конденсация | Газ – жидкость |
Сублимация | Твердое тело в газ |
Депонирование | Газ – твердое вещество |
В случае плавления, кипения и сублимации к образцу вещества должна быть добавлена энергия, чтобы вызвать изменение состояния.Такие изменения состояния называют эндотермическими. Замораживание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; энергия приобретается льдом, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Есть ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Безусловно, есть.
Количество энергии, необходимое для изменения состояния образца материи, зависит от трех вещей. Это зависит от того, что это за вещество, от того, сколько вещества претерпевает изменение состояния, и от того, какое изменение состояния происходит. Например, для плавления льда (твердая вода) требуется другое количество энергии, чем для плавления железа. И для таяния льда (твердая вода) требуется другое количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется другое количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества – это три переменные, которые влияют на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления – это изменение энергии, связанное с изменением состояния твердое-жидкое.)
Значения удельной теплоты плавления и удельной теплоты парообразования указаны из расчета на количество .Например, удельная теплота плавления воды составляет 333 Дж / грамм. Чтобы растопить 1,0 грамм льда, требуется 333 Дж энергии. Чтобы растопить 10 граммов льда, требуется в 10 раз больше энергии – 3330 Дж. Такое рассуждение приводит к следующим формулам, связывающим количество тепла с массой вещества и теплотой плавления и испарения.
Для плавления и замораживания: Q = m • ΔH сварка
Для испарения и конденсации: Q = m • ΔH испарение
где Q представляет количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH плавления представляет собой удельную теплоту плавления (на грамм) и ΔH испарения представляет собой удельную теплоемкость плавления. испарение (из расчета на грамм).Подобно обсуждению Q = m • C • ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и испарения; это согласуется с тем фактом, что образец вещества должен набирать энергию, чтобы плавиться или испаряться. Значения Q отрицательны для процесса замораживания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или конденсироваться.
В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач.
Пример задачи 3 |
Уравнение, связывающее массу (48,2 грамма), теплоту плавления (333 Дж / г) и количество энергии (Q): Q = m • ΔH fusion .Подстановка известных значений в уравнение приводит к ответу.
Q = м • ΔH сварка = (48,2 г) • (333 Дж / г)
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Пример Задачи 3 включает в себя довольно простое вычисление типа «подключай и исправляй». Теперь мы попробуем пример задачи 4, который потребует более глубокого анализа.
Пример задачи 4 |
В этой задаче тает лед и остывает жидкая вода. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, на каждый грамм льда необходимо передать 333 Дж энергии. Эта передача энергии от жидкой воды ко льду охлаждает жидкость.Но жидкость может охладиться только до 0 ° C – точки замерзания воды. При этой температуре жидкость начнет затвердевать (замерзнуть), а лед полностью не растает.
Мы знаем следующее о льду и жидкой воде:
Информация о льду:
м = 50,0 г
ΔH плавление = 333 Дж / г
Информация о жидкой воде:
С = 4.18 Дж / г / ° C
Т начальная = 26,5 ° С
T окончательная = 0,0 ° C
ΔT = -26,5 ° C (T конечный – T начальный )
Энергия, полученная льдом, равна энергии, потерянной из воды.
Q лед = -Q жидкая вода
Знак – указывает, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом:
Q лед = m • ΔH плавление = (50.0 г) • (333 Дж / г)
Q лед = 16650 Дж
Теперь мы можем установить правую часть уравнения равной m • C • ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение:
16650 Дж = -Q жидкая вода
16650 Дж = -м жидкая вода • C жидкая вода • ΔT жидкая вода
16650 Дж = -м жидкая вода • (4.18 Дж / г / ° C) • (-26,5 ° C)
16650 Дж = -м жидкая вода • (-110,77 Дж / ° C)
м жидкая вода = – (16650 Дж) / (- 110,77 Дж / ° C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр)
Еще раз о кривых нагрева и охлаждения
На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагрева показывала, как температура воды повышалась с течением времени по мере нагрева образца воды в твердом состоянии (т. Е. Льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает преобразование воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает преобразование воды из жидкого состояния в газообразное.Эти изменения состояния произошли без каких-либо изменений температуры. Однако добавление тепла к образцу воды, не имеющей температуры фазового перехода, приведет к изменению температуры.
Теперь мы можем подойти к теме кривых нагрева на более количественной основе. На диаграмме ниже представлена кривая нагрева воды. На нанесенных линиях есть пять помеченных участков.
Три диагональных участка представляют собой изменения температуры образца воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Две горизонтальные секции представляют изменения в состоянии воды. На участке 2 проба воды тает; твердое вещество превращается в жидкость. В секции 4 образец воды подвергается кипению; жидкость превращается в газ. Количество тепла, передаваемого воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m • C • ΔT. А количество тепла, переданного воде в секциях 2 и 4, связано с массой образца и теплотой плавления и испарения формулами Q = m • ΔH fusion (секция 2) и Q = m • ΔH испарение (раздел 4).Итак, теперь мы попытаемся вычислить количество тепла, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0 ° C в газообразное состояние при 120,0 ° C. Для расчета потребуется пять шагов – по одному шагу для каждого раздела приведенного выше графика. Хотя удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
Твердая вода: C = 2,00 Дж / г / ° C
Жидкая вода: C = 4,18 Дж / г / ° C
Газообразная вода: C = 2.01 Дж / г / ° C
Наконец, мы будем использовать ранее сообщенные значения ΔH fusion (333 Дж / г) и ΔH испарения (2,23 кДж / г).
Раздел 1 : Изменение температуры твердой воды (льда) с -20,0 ° C до 0,0 ° C.
Используйте Q 1 = m • C • ΔT
, где m = 50,0 г, C = 2,00 Дж / г / ° C, T начальная = -200 ° C и T конечная = 0,0 ° C
Q 1 = m • C • ΔT = (50.0 г) • (2,00 Дж / г / ° C) • (0,0 ° C – -20,0 ° C)
Q 1 = 2,00 x10 3 J = 2,00 кДж
Раздел 2 : Таяние льда при 0,0 ° C.
Используйте Q 2 = m • ΔH сварка
, где m = 50,0 г и ΔH плавление = 333 Дж / г
Q 2 = м • ΔH плавление = (50,0 г) • (333 Дж / г)
Q 2 = 1,665 x10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Раздел 3 : Изменение температуры жидкой воды с 0,0 ° C на 100,0 ° C.
Используйте Q 3 = m • C • ΔT
, где m = 50,0 г, C = 4,18 Дж / г / ° C, T начальная = 0,0 ° C и T конечная = 100,0 ° C
Q 3 = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (100,0 ° C – 0,0 ° C)
Q 3 = 2.09 x10 4 J = 20,9 кДж
Раздел 4 : Кипячение воды при 100,0 ° C.
Использовать Q 4 = m • ΔH испарение
, где m = 50,0 г и ΔH испарение = 2,23 кДж / г
Q 4 = m • ΔH испарение = (50,0 г) • (2,23 кДж / г)
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр)
Раздел 5 : Изменение температуры жидкой воды со 100.От 0 ° C до 120,0 ° C.
Используйте Q 5 = m • C • ΔT
, где m = 50,0 г, C = 2,01 Дж / г / ° C, T начальная = 100,0 ° C и T конечная = 120,0 ° C
Q 5 = m • C • ΔT = (50,0 г) • (2,01 Дж / г / ° C) • (120,0 ° C – 100,0 ° C)
Q 5 = 2,01 x10 3 J = 2,01 кДж
Общее количество тепла, необходимое для превращения твердой воды (льда) при -20 ° C в газообразную воду при 120 ° C, является суммой значений Q для каждого участка графика.То есть
Q итого = Q 1 + Q 2 + Q 3 + Q 4 + Q 5
Суммирование этих пяти значений Q и округление до нужного количества значащих цифр приводит к значению 154 кДж в качестве ответа на исходный вопрос.
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься:
- Первое: длинная задача была разделена на части, каждая из которых представляет собой одну из пяти частей графика.Поскольку было вычислено пять значений Q, они были обозначены как Q 1 , Q 2 и т. Д. Этот уровень организации требуется в многоступенчатой задаче, такой как эта.
- Секунда: Внимание было уделено знаку +/- на ΔT. Изменение температуры (или любой величины) всегда рассчитывается как конечное значение величины за вычетом начального значения этой величины.
- Третий: На протяжении всей задачи внимание уделялось подразделениям.Единицы Q будут либо в Джоулях, либо в килоджоулях, в зависимости от того, какие количества умножаются. Отсутствие внимания к устройствам – частая причина сбоев в подобных проблемах.
- Четвертый: На протяжении всей задачи внимание уделялось значащим цифрам. Хотя это никогда не должно становиться основным акцентом какой-либо проблемы в физике, это, безусловно, деталь, на которую стоит обратить внимание.
Здесь, на этой странице, мы узнали, как рассчитать количество тепла, задействованного в любом процессе нагрева / охлаждения и в любом процессе изменения состояния.Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице Урока 2, посвященной калориметрии. Калориметрия – это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Проверьте свое понимание
1. Вода имеет необычно высокую удельную теплоемкость. Какое из следующих утверждений логически следует из этого факта?
а.По сравнению с другими веществами, горячая вода вызывает сильные ожоги, потому что хорошо проводит тепло.
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
c. По сравнению с другими веществами, образец воды требует значительного количества тепла, чтобы изменить ее температуру на небольшое количество.
2. Объясните, почему в больших водоемах, таких как озеро Мичиган, в начале июля может быть довольно прохладно, несмотря на то, что температура наружного воздуха около или выше 90 ° F (32 ° C).
3. В таблице ниже описан термический процесс для различных объектов (выделен красным жирным шрифтом). Для каждого описания укажите, набирается или теряется тепло объектом, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением.
| Процесс | Получено или потеряно тепло? | Эндо- или экзотермический? | Вопрос: + или -? | |
а. | Кубик льда помещают в стакан с лимонадом комнатной температуры, чтобы охладить напиток. | |||
г. | Холодный стакан лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32 ° F. | |||
г. | Конфорки на электроплите выключаются и постепенно остывают до комнатной температуры. | |||
г. | Учитель вынимает из термоса большой кусок сухого льда и опускает его в воду. Сухой лед возгоняется, образуя газообразный диоксид углерода. | |||
e. | Водяной пар в увлажненном воздухе ударяется о окно и превращается в каплю росы (каплю жидкой воды). |
4. Образец металлического цинка массой 11,98 грамма помещают в баню с горячей водой и нагревают до 78,4 ° C. Затем его удаляют и помещают в чашку из пенополистирола, содержащую 50,0 мл воды комнатной температуры (T = 27,0 ° C; плотность = 1,00 г / мл). Вода прогревается до температуры 28.1 ° С. Определите удельную теплоемкость цинка.
5. Джейк достает из туалета банку с газировкой и выливает ее в чашку со льдом. Определите количество тепла, теряемого содой комнатной температуры при плавлении 61,9 г льда (ΔH fusion = 333 Дж / г).
6. Теплота сублимации (ΔH сублимация ) сухого льда (твердый диоксид углерода) составляет 570 Дж / г. Определите количество тепла, необходимое для превращения 5,0-фунтового мешка сухого льда в газообразный диоксид углерода.(Дано: 1,00 кг = 2,20 фунта)
7. Определите количество тепла, необходимое для повышения температуры 3,82-граммового образца твердого пара-дихлорбензола с 24 ° C до жидкого состояния при 75 ° C. Пара-дихлорбензол имеет температуру плавления 54 ° C, теплоту плавления 124 Дж / г и удельную теплоемкость 1,01 Дж / г / ° C (твердое состояние) и 1,19 Дж / г / ° C (жидкое состояние).
домашних заданий и упражнений – Теплоотдача рассчитывается по формуле удельной теплоемкости в градусах Кельвина
dmckee уже сказал это, но я считаю, что стоит повторить, потому что мы действительно действительно уверены.{\ circ} \ mathrm {C} $ для разницы температур, потому что разность температур и «относительные» температуры не работают одинаково. Обратите внимание, что разница температур вообще не зависит от $ T_3 $. Фактически, если бы мы использовали совершенно другое ссылочное значение вместо $ T_3 $, разница все равно была бы такой же.
Если у вас есть разница температур , вы можете умножить ее или разделить на другие значения. Вы также можете добавить или вычесть другие температурные различия. Это очень похоже на такие вещи, как потенциальная энергия, где значима только разница между двумя энергиями, а не фактическое количество энергии.\ circ \ mathrm {C} $$ Таким образом, очевидно, что природа придает особое значение разнице температур относительно $ T_0 $: разница $ t – T_0 $ в некотором роде важна, чем никакая другая разница температур (например, $ t – T_3 $). Основываясь на этом результате, физики подумали, что имеет смысл разработать температурную шкалу, которая установила бы $ T_0 = 0 $, чтобы нам не приходилось постоянно ее вычитать. Первым, кто пришел к такому выводу, был лорд Кельвин, поэтому термодинамическая шкала температуры и ее единица были названы в его честь.\ circ \ mathrm {C}} $$ то есть вы добавляете 273,15 к числовому значению.
С другой стороны, когда у вас есть разница температур, на самом деле у вас есть $ t_f – t_i $, который не зависит от какой-либо контрольной точки. Итак, чтобы преобразовать градусы Цельсия в градусы Кельвина, вам не нужно ничего делать.
Приложение
Вот как это применимо к вашему примеру. У вас есть формула $$ Q = C_p m \ Delta t = C_p m (t_f – t_i) $$ Но вы не можете подключиться к $ t_f $ и $ t_i $ напрямую . Единственная информация, которая у вас есть, относится к $ T_3 $: $$ t_i – T_3 = 49.\ circ \ mathrm {C}) $$ Больше ничего добавлять или вычитать не нужно.
В качестве альтернативы вы можете преобразовать температуры в Кельвины перед их подключением. Преобразование в Кельвины означает, что теперь у вас есть $$ t_i – T_0 = 323.2 \ text {K} $$ $$ t_f – T_0 = 333.2 \ text {K} $$ Опять же, вам нужно вставить в формулу пару дополнительных членов: $$ Q = C_p m \ bigl [(t_f – T_0) – (t_i – T_0) \ bigr] = C_p m \ bigl [333. \ circ \ mathrm {C} = \ Delta \ mathrm {K} $, поэтому эти два результата совпадают.Но из-за особых свойств температуры $ T_0 $ вы также можете показать, что $ \ Delta \ mathrm {K} = 1 \ text {K} $; Другими словами, , когда вы имеете дело с Kelvins , можно безопасно отказаться от дельт и не слишком беспокоиться о том, когда $ t $ является температурой, а когда это разница температур. Однако это работает только для Кельвина, а не для градусов Цельсия.
Пример задачи
Свинцовый шар массой 300 г при температуре 80 ° C помещается в 300 г вода температурой 20С.Когда система достигает равновесия, что равновесная температура? Предположим, что нет обмена энергией с окружение.
- чуть меньше 80C
- около 50 ° C
- чуть больше 20С
- недостаточно информации дано
Давайте посчитаем, чтобы убедиться. Позволять
T w = начальная температура воды
T Pb = начальная температура свинца
T f = конечная температура при равновесии
Поскольку тепло не обменивается с окружающей средой:
тепло, полученное водой = тепло, потерянное свинцом
mc w (T f – T w ) = mc Pb (T Pb – T f ) (1)
Мы можем провести эксперимент двумя способами:
- От конечной температуры и удельной тепло воды, определите удельную теплоемкость свинца.
- Вычислите конечную температуру с учетом удельной теплоты воды и свинца.
1. Решение относительно c Pb в уравнении теплового баланса (1) дает:
| c Pb | = c w | ( |
| ) |
Теперь используйте c w = 4186 Дж / (кг C) для удельной теплоемкости воды и измеренное значение T f для вычисления c Pb .
Значение c Pb составляет 130 Дж / (кг C).
2. В качестве альтернативы мы используем c w = 4186 Дж / (кг C) и c Pb = 130 Дж / (кг C) и решите для T f в уравнении теплового баланса (1). Это дает:
| T f = | ( |
| ) |
Конечная температура является средневзвешенной. двух начальных температур, при этом вес смещен к материал с большей теплоемкостью.
3.12: Расчеты энергоемкости и теплоемкости
Цели обучения
- Для связи теплопередачи с изменением температуры.
Тепло – знакомое проявление передачи энергии. Когда мы прикасаемся к горячему объекту, энергия перетекает от горячего объекта к нашим пальцам, и мы воспринимаем эту поступающую энергию как «горячий» объект. И наоборот, когда мы держим кубик льда в ладонях, энергия перетекает из руки в кубик льда, и мы воспринимаем эту потерю энергии как «холод».«В обоих случаях температура объекта отличается от температуры нашей руки, поэтому мы можем сделать вывод, что разница температур является основной причиной теплопередачи.
Удельную теплоемкость вещества можно использовать для расчета изменения температуры, которому подвергнется данное вещество при нагревании или охлаждении. Уравнение, связывающее тепло \ (\ left (q \ right) \) с удельной теплоемкостью \ (\ left (c_p \ right) \), массой \ (\ left (m \ right) \) и изменением температуры \ (\ left (\ Delta T \ right) \) показан ниже.
\ [q = c_p \ times m \ times \ Delta T \]
Поглощаемое или выделяемое тепло измеряется в джоулях. Масса измеряется в граммах. Изменение температуры определяется выражением \ (\ Delta T = T_f – T_i \), где \ (T_f \) – конечная температура, а \ (T_i \) – начальная температура.
Каждое вещество имеет характерную удельную теплоемкость, которая выражается в единицах кал / г • ° C или кал / г • К, в зависимости от единиц, используемых для выражения Δ T .\text{o} \text{C} \right)\)”> 0.233
Направление теплового потока не отображается в heat = mc Δ T . Если энергия поступает в объект, общая энергия объекта увеличивается, и значения тепла Δ T положительны. Если энергия исходит из объекта, общая энергия объекта уменьшается, а значения тепла и Δ T являются отрицательными.
Пример \ (\ PageIndex {1} \)
A \ (15.0 \: \ text {g} \) кусок металлического кадмия поглощает \ (134 \: \ text {J} \) тепла, поднимаясь из \ (24.\ text {o} \ text {C} \]
Пример \ (\ PageIndex {2} \)
Какое количество тепла передается при нагревании блока металлического железа весом 150,0 г с 25,0 ° C до 73,3 ° C? Какое направление теплового потока?
Раствор
Мы можем использовать heat = mc Δ T , чтобы определить количество тепла, но сначала нам нужно определить Δ T . Поскольку конечная температура утюга составляет 73,3 ° C, а начальная температура составляет 25,0 ° C, Δ T имеет следующий вид:
Δ T = T конечный – T начальный = 73.\ circ C) = 782 \: cal} \]
Обратите внимание, как единицы измерения грамм и ° C отменяются алгебраически, оставляя только единицу калорий, которая является единицей тепла. Поскольку температура железа увеличивается, энергия (в виде тепла) должна переходить в металл .
Упражнение \ (\ PageIndex {1} \)
Какое количество тепла передается при охлаждении блока металлического алюминия массой 295,5 г с 128,0 ° C до 22,5 ° C? Какое направление теплового потока?
- Ответ
- Тепло уходит из алюминиевого блока.
Пример \ (\ PageIndex {2} \)
Образец красновато-коричневого металла массой 10,3 г выделил 71,7 кал тепла при снижении его температуры с 97,5 ° C до 22,0 ° C. Какова удельная теплоемкость металла? Можете ли вы идентифицировать металл по данным в Таблице \ (\ PageIndex {1} \)?
Раствор
Вопрос дает нам тепло, конечную и начальную температуры и массу образца. Значение Δ T составляет:
Δ T = T конечный – T начальный = 22.\ circ C)}} \)
c = 0,0923 кал / г • ° C
Это значение удельной теплоемкости очень близко к значению, приведенному для меди в таблице 7.3.
Упражнение \ (\ PageIndex {2} \)
Кристалл хлорида натрия (NaCl) массой 10,7 г имеет начальную температуру 37,0 ° C. Какова конечная температура кристалла, если на него было подано 147 кал тепла?
- Ответ
Сводка
Проиллюстрированы расчеты удельной теплоемкости.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Теплопередача и тепловое равновесие
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса – изображению, ссылке, тексту и т. д. – относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; а также Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
11.1 Температура и тепловая энергия – Физика
Температура
Что такое температура? Это одна из тех концепций, которые настолько укоренились в нашей повседневной жизни, что, хотя мы интуитивно знаем, что она означает, ее бывает трудно определить.Заманчиво сказать, что температура измеряет тепло, но это не совсем так. Тепло – это передача энергии из-за разницы температур. Температура определяется с точки зрения инструмента, который мы используем, чтобы сказать нам, насколько горячий или холодный объект, на основе механизма и шкалы, изобретенных людьми. Температура буквально определяется как то, что мы измеряем термометром.
Тепло часто путают с температурой. Например, мы можем сказать, что жара была невыносимой, когда на самом деле имели в виду, что температура была высокой.Это потому, что мы более чувствительны к потоку энергии за счет тепла, чем к температуре. Поскольку тепло, как и работа, передает энергию, в системе СИ единица измерения – джоуль (Дж).
Атомы и молекулы постоянно находятся в движении, отражаясь друг от друга в случайных направлениях. Напомним, что кинетическая энергия – это энергия движения, и она увеличивается пропорционально квадрату скорости. Не вдаваясь в математические подробности, мы можем сказать, что тепловая энергия – энергия, связанная с теплом, – это средняя кинетическая энергия частиц (молекул или атомов) в веществе.Молекулы, движущиеся быстрее, обладают большей кинетической энергией, поэтому вещество имеет большую тепловую энергию и, следовательно, более высокую температуру. Полная внутренняя энергия системы – это сумма кинетической и потенциальной энергий ее атомов и молекул. Тепловая энергия является одной из подкатегорий внутренней энергии, как и химическая энергия.
Поддержка учителей
Поддержка учителей
Демонстрация учителей
Вы можете показать, что температура связана с кинетической энергией молекул, с помощью простой демонстрации.Возьмите ластик и сильно потрите им любую поверхность. Затем почувствуйте это на своей коже. Горячо?
Для измерения температуры необходимо использовать шкалу в качестве эталона. Три наиболее часто используемых температурных шкалы – это шкала Фаренгейта, Цельсия и Кельвина. И шкала Фаренгейта, и шкала Цельсия являются относительными температурными шкалами, что означает, что они построены вокруг контрольной точки. Например, шкала Цельсия использует точку замерзания воды в качестве точки отсчета; все измерения либо ниже точки замерзания воды на заданное количество градусов (и имеют отрицательный знак), либо выше точки замерзания воды на заданное количество градусов (и имеют положительный знак).Температура кипения воды составляет 100 ° C ° C по шкале Цельсия, а ее единицей является градус Цельсия (° C (° C).
По шкале Фаренгейта точка замерзания воды составляет 32 ° F ° F, а точка кипения – 212 ° F ° F. Единицей измерения температуры на этой шкале является градус Фаренгейта (° F (° F). Обратите внимание, что разница в градусах между точками замерзания и кипения больше для шкалы Фаренгейта, чем для шкалы Цельсия. Следовательно, разница температур составляет единицу градус Цельсия больше, чем разница температур в один градус Фаренгейта.Поскольку 100 градусов Цельсия охватывают тот же диапазон, что и 180 градусов по Фаренгейту, один градус по шкале Цельсия в 1,8 раза больше, чем один градус по шкале Фаренгейта (потому что 180100 = 95 = 1,8180100 = 95 = 1,8). Это соотношение можно использовать для преобразования температуры в градусы Фаренгейта и Цельсия (см. Рисунок 11.2).
Рис. 11.2 Соотношение температурных шкал по Фаренгейту, Цельсию и Кельвину, округленное до ближайшего градуса. Также показаны относительные размеры чешуек.
Шкала Кельвина – это шкала температур, которая обычно используется в науке, поскольку это шкала абсолютных температур.Это означает, что теоретически минимально возможной температуре присваивается нулевое значение. Ноль градусов по шкале Кельвина называется абсолютным нулем; Теоретически это точка, в которой нет движения молекул для производства тепловой энергии. В оригинальной шкале Кельвина, впервые созданной лордом Кельвином, все температуры имеют положительные значения, что делает ее полезной для научной работы. Официальная единица измерения температуры на этой шкале – кельвин, сокращенно К. Точка замерзания воды – 273.15 К, а температура кипения воды 373,15 К.
Поддержка учителей
Поддержка учителей
[BL] [OL] [AL] Спросите учащихся, в каком случае каждая шкала будет наиболее удобной для использования.
Хотя абсолютный ноль теоретически возможен, на практике он не может быть достигнут. Самая низкая температура, когда-либо созданная и измеренная во время лабораторного эксперимента, составляла 1,0 × 10–101,0 × 10–10 К в Хельсинкском технологическом университете в Финляндии. Для сравнения, самая низкая зарегистрированная температура для места на поверхности Земли составляла 183 K ( – 89 ° C). ), на Востоке, Антарктида, а самым холодным известным местом (за пределами лаборатории) во Вселенной является туманность Бумеранг с температурой 1 К.К счастью, большинству из нас, людей, никогда не придется сталкиваться с такими крайностями.
Поддержка учителей
Поддержка учителей
[AL] Спросите, почему никогда не записывался абсолютный ноль. Обсудите, могут ли атомы и молекулы когда-либо быть полностью неподвижными.
Средняя нормальная температура тела составляет 98,6 ° F ° F (37,0 ° C ° C), но люди, как известно, выживают при температуре тела от 75 ° F до 111 ° F ° F (от 24 ° C до 111 ° F). 44 ° С ° С).
Watch Physics
Сравнение температурных шкал по Цельсию и Фаренгейту
В этом видео показано, как сравниваются температурные шкалы по Фаренгейту и Цельсию.
Проверка захвата
Даже без числовых меток на термометре вы можете определить, какая сторона обозначена по Фаренгейту, а какая по Цельсию, по тому, как расположены градусные метки. Почему?
- Разделение между двумя последовательными делениями по шкале Фаренгейта больше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Фаренгейта равен 1,8 градусам Цельсия.
- Разделение между двумя последовательными делениями по шкале Фаренгейта меньше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Цельсия равен 1.8 градусов по Фаренгейту.
- Разделение между двумя последовательными делениями по шкале Фаренгейта больше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Фаренгейта равен 3,6 градуса Цельсия.
- Разделение между двумя последовательными делениями по шкале Фаренгейта меньше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Цельсия равен 3,6 градуса по Фаренгейту.
Поддержка учителей
Поддержка учителей
Учащиеся могут использовать процесс, описанный в этом видео, как средство сравнения различных температурных шкал.Укажите им, что все, что им нужно знать, – это температуры по каждой шкале одного свойства, например, точки кипения и замерзания жидкости, будь то вода, этанол или тетрахлорметан.
Онлайн калькулятор: Количество тепла
Начнем с пары определений:
- Тепло – это количество энергии, перетекающее от одного тела материи к другому, спонтанно из-за разницы температур или любым другим способом, кроме работы или передачи материи.Исторически для измерения тепла использовалось много единиц энергии. Единицей измерения в Международной системе единиц (СИ) является джоуль (Дж).
- Теплоемкость или теплоемкость – это измеримая физическая величина, равная отношению тепла, добавленного (или удаленного) к объекту, к результирующему изменению температуры. Удельная теплоемкость, часто называемая просто , удельная теплоемкость – это теплоемкость на единицу массы материала.
Из этого определения имеем следующую формулу для удельной теплоемкости:
,
где c – удельная теплоемкость,
Q – тепло, добавляемое или отводимое телу,
m – масса тела,
ΔT – изменение температуры.
На теплоемкость могут влиять многие переменные состояния, которые описывают исследуемую термодинамическую систему. К ним относятся начальная и конечная температура, а также давление и объем системы до и после добавления тепла. Таким образом, приведенная ниже формула будет несколько более правильной:
Однако в школьных задачах мы обычно используем постоянную удельную теплоемкость при стандартном давлении. Таким образом, взаимосвязь между теплом и изменением температуры обычно выражается в форме, показанной ниже:
Обратите внимание, что это соотношение не применяется, если происходит фазовое изменение, потому что тепло, добавленное или удаленное во время фазового перехода, не изменяет температуру.
Калькулятор ниже может найти пропущенное значение в приведенной выше формуле, если указаны все остальные значения. Он может найти добавленное или отведенное тепло, удельную теплоемкость, массу, начальную или конечную температуру:
Количество тепла
Значение для поиска ТеплоУдельная теплоемкость Масса Начальная температура Конечная температура Точность вычисленияЦифры после десятичной точки: 1
content_copy Ссылка сохранить Сохранить расширение Виджет
.
 Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы.
Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом. Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы. В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.
В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр. Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.
Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой. «выше» любой положительной.
«выше» любой положительной. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как … Википедия
Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как … Википедия повышенная степень теплоты тела при… … Историко-этимологический словарь латинских заимствований
повышенная степень теплоты тела при… … Историко-этимологический словарь латинских заимствований Рассматривается новый экспериментальный метод измерения температуры нагретых объектов по непрерывному спектру теплового излучения, регистрируемому в широком интервале длин волн (например, от… Подробнее Купить за 1896 грн (только Украина)
Рассматривается новый экспериментальный метод измерения температуры нагретых объектов по непрерывному спектру теплового излучения, регистрируемому в широком интервале длин волн (например, от… Подробнее Купить за 1896 грн (только Украина) 15
15 21
21 67
67 6
6 3
3