Глава 13. Газовые законы
Задачи на газовые законы часто предлагаются школьникам на едином государственном экзамене. Для решения этих задач вполне достаточно знать уравнение состояния идеального газа (закон Клапейрона-Менделеева) и уметь использовать его алгебраически и геометрически (для построения графиков зависимости одних параметров газа от других) в простейших ситуациях. Кроме того, нужно понимать, как описываются смеси идеальных газов (закон Дальтона).
Уравнение, связывающее параметры газа друг с другом, называется уравнением состояния. Для идеального газа, взаимодействие молекул которого мало, уравнение состояния имеет вид
(13.1) |
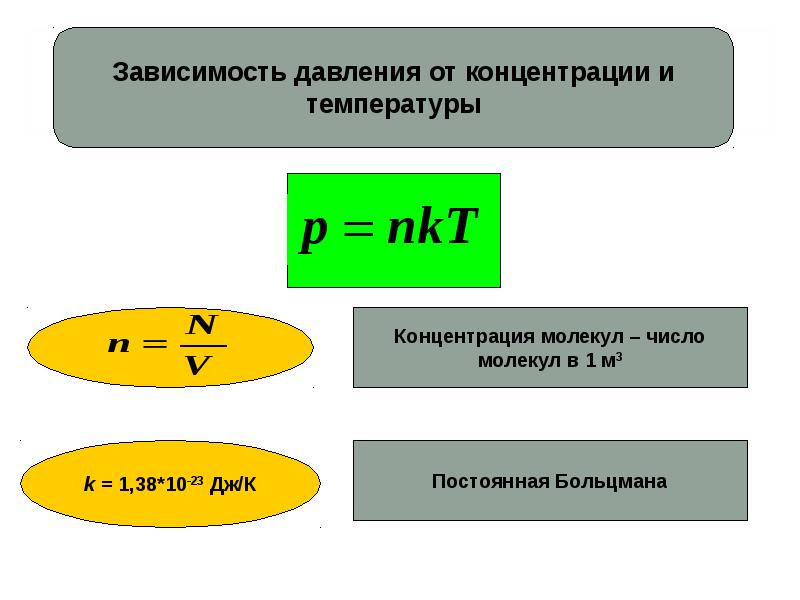
где — давление газа, — концентрация молекул газа (число молекул в единице объема), — постоянная Больцмана, — абсолютная (в шкале Кельвина) температура. Учитывая, что , где — число молекул газа, — объем сосуда, в котором находится газ (часто говорят объем газа), получим из (13.
(13.2) |
Число молекул можно связать с количеством вещества газа : , где — число Авогадро. Поэтому формулу (13.2) можно переписать в виде
(13.2) |
где произведение постоянных Авогадро и Больцмана обозначено как . Постоянная = 8,31 Дж/(К•моль) называется универсальной газовой постоянной. Количество вещества газа можно также выразить через его массу и молярную массу этого газа
(13.3) |
С учетом (13.3) закон (13.2) можно переписать и в таком виде
(13.4) |
Уравнение состояния идеального газа (13.1)-(13.4), которое также называется уравнением (или законом) Клапейрона-Менделеева, позволяет связывать параметры идеального газа и проследить за их изменением в тех или иных процессах.
В школьном курсе физики рассматриваются три изопроцесса, в которых один из трех параметров газа (давление, температура и объем) не изменяется. В изобарическом процессе не изменяется давление газа, в изотермическом — температура, в изохорическом — объем. Изопроцессам отвечают следующие графики зависимости давления от объема, давления от температуры, объема от температуры.
Для изобарического процесса
Первые два графика очевидны. Последний получается так. Из закона Клапейрона-Менделеева следует, что зависимость объема от температуры при постоянном давлении имеет вид
(13.5) |
где — постоянная. Графиком функции (13.5) является прямая, продолжение которой проходит через начало координат.
Для изохорического процесса
Второй график следует из соотношения
(13. |
где — постоянная при постоянном объеме.
Для изотермического процесса
Первый график следует из закона Клапейрона-Менделеева, который при постоянной температуре газа можно привести к виду
(13.7) |
где — постоянная. Отсюда следует, что графиком зависимости от в изотермическом процессе является гипербола.
Важнейшее свойство уравнения состояния идеального газа (13.1)-(13.4) заключается в том, что «индивидуальность» газа никак не проявляется в этих законах — единственный параметр собственно газа, входящий в уравнение состояния, — это число молекул. Например, 1 моль гелия и 1 моль азота, находящиеся в одинаковых объемах и имеющие одинаковые температуры, оказывают одинаковое давление. Отсюда следует, что и давление смеси идеальных газов определяется суммарным числом молекул всех компонент смеси:
(13. |
где — число молекул первой, второй, третьей и т.д. компонент смеси, — постоянная Больцмана, — абсолютная температура смеси, — объем сосуда. Величины , имеющие смысл давления каждой компоненты смеси при условии, что она имела бы такую же температуру и занимала бы весь объем, называются парциальными давлениями компонент. Закон (13.8) называется законом Дальтона. Рассмотрим теперь в рамках этих законов предложенные выше задачи.
В
т.е. давление газа увеличилось в 6 раз (ответ 1).
Применяя закон Клапейрона-Менделеева (13.2) к первому и второму газам (задача 13.1.2), получаем
где — искомый объем. Сравнивая первую и вторую формулы, заключаем, что (ответ 1).
Закон Клапейрона-Менделеева для газа в начальном и конечном состояниях (
где — неизвестная температура. Из сравнения этих формул получаем , т.е. температуру газа в сосуде нужно повысить вдвое (ответ 2).
Из закона Клапейрона-Менделеева для начального и конечного состояний газа в задаче 13.1.4 имеем
Отсюда , т.е. количество вещества газа в сосуде увеличилось в 1,25 раза (ответ 3).
Первым, кто понял, почему жидкость поднимается вместе с трубкой (задача 13.1.5), и почему «природа боится пустоты» (Аристотель), но только до определенного предела, был знаменитый итальянский физик, современник Г. Галилея Э. Торричелли. Давайте рассмотрим рассуждения Торричелли подробно. Основная идея Торричелли заключалась в том, что атмосферный воздух оказывает давление на все поверхности, с которыми он контактирует.

Сравнивая графики процессов 1, 2, 3 и 4, данные в условии задачи 13.1.6, с графиками изопроцессов, приведенными во введении к настоящей главе, заключаем, что: процесс 1 — изотермический, 2 — изохорический, 3 — изобарический. |
В изотермическом процессе давление зависит от объема как ; на диаграмме этот процесс изображается гиперболой. Поэтому изотермическими являются процессы 1 и 3 ( |
Изохорическим охлаждением в задаче 13.1.8 является процесс 4 (см. рисунок) В двух последних задачах этого варианта нужно с помощью закона Клапейрона-Менделеева вычислить один из параметров газа, если даны остальные параметры. В задаче 13.1.9 из закона Клапейрона-Менделеева |
получим
(ответ 1).
В задаче 13.1.10 при вычислениях следует не забыть перевести температуру газа в Кельвины. Из закона Клапейрона-Менделеева находим
(ответ 1).
Из уравнения состояния в форме (13.2) следует, что при одинаковых объемах и температурах давление идеального газа определяется только полным числом молекул. Поэтому отношение давления водорода и гелия в задаче 13.2.1 равно 2 (ответ 2).
Поскольку перегородка в задаче 13.2.2 подвижная и находится в равновесии, давления газа в отсеках сосуда слева и справа от перегородки равны. Применяя к ним при этом условии закон Клапейрона-Менделеева, получим
для гелия |
для азота |
где температуры и массы газов по условию одинаковы. Деля эти уравнения друг на друга, находим отношение объемов частей сосуда
(ответ 4).
Если бы точки, отвечающие состояниям 1 и 2 в задаче 13.2.3, лежали на одной прямой, продолжение которой проходит через начало координат, то эти состояния принадлежали бы одной и той же изохоре, и, следовательно, объем газа в этих состояниях был одинаковым (см. формулу (13.6)). Поэтому для сравнения объемов этих состояний построим изохоры, проходящие через точки 1 и 2, и сравним отвечающие им объемы (см. рисунок; изохоры, проходящие через точки 1 и 2, показаны пунктиром).
Из формулы (13.6) следует, что чем больше объем, тем меньше коэффициент перед в зависимости (13.6), и, следовательно, меньше наклон соответствующей изохоры к оси температур. Поэтому изохоре 1 отвечает больший объем, чем изохоре 2, и, следовательно, объем газа в процессе 1-2 уменьшается (ответ 2).
Аналогичные рассуждения в задаче 13.2.4 показывают, что наибольшему давлению отвечает изобара, проходящая через точку (поскольку соответствующая прямая имеет наименьший наклон к оси температур; см. рисунок ниже). Поэтому правильный ответ в этой задаче — 3.
рисунок ниже). Поэтому правильный ответ в этой задаче — 3.
В закон Клапейрона-Менделеева входит абсолютная температура газа, поэтому данные в задаче 13.2.5 значения нужно перевести в Кельвины. В результате для отношения давлений газа в конечном и начальном состояниях получаем
(ответ 4).
Как следует из опыта, при приведении тел в тепловой контакт выравниваются их температуры. Это же касается и частей одного тела или даже компонент смеси газов (задача 13.2.6). Поэтому температуры компонент смеси будут одинаковы (ответ 1). Что касается парциальных давлений, плотностей или концентрации компонент смеси, то их значения зависят от количества молекул каждой компоненты смеси и могут быть различны.
Парциальное давление компонент смеси – это давление, которое оказывают только молекулы каждой компоненты. Как следует из формулы (13.8) парциальное давление любой компоненты можно найти, применяя только к ней закон Клапейрона-Менделеева и считая, что она имеет такую же температуру, как и вся смесь, и занимает такай же объем, как и вся смесь газов. Поэтому отношение парциальных давлений отдельных компонент смеси равно отношению количеств вещества (или числа молекул) этих компонент. Поэтому для отношения парциальных давлений углекислого газа и гелия в сосуде в задаче 13.2.7 имеем (ответ 2).
Как следует из формулы (13.8) парциальное давление любой компоненты можно найти, применяя только к ней закон Клапейрона-Менделеева и считая, что она имеет такую же температуру, как и вся смесь, и занимает такай же объем, как и вся смесь газов. Поэтому отношение парциальных давлений отдельных компонент смеси равно отношению количеств вещества (или числа молекул) этих компонент. Поэтому для отношения парциальных давлений углекислого газа и гелия в сосуде в задаче 13.2.7 имеем (ответ 2).
Как следует из закона Дальтона, давление смеси газов определяется полным количеством молекул в ней. Поэтому для анализа изменения давления смеси газов при протекании в ней химической реакции (задача 13.2.8) необходимо исследовать изменение числа молекул. Гелий не участвует в химической реакции — один моль гелия был и в начальном, и в конечном состоянии смеси. С озоном происходила реакция
т. е. из двух молекул озона в результате реакции получились три молекулы кислорода. Поэтому два моля озона превратились в три моля кислорода, и общее количество вещества смеси стало равно четырем молям. Поэтому давление смеси увеличивается в 4/3 раза (ответ 2).
е. из двух молекул озона в результате реакции получились три молекулы кислорода. Поэтому два моля озона превратились в три моля кислорода, и общее количество вещества смеси стало равно четырем молям. Поэтому давление смеси увеличивается в 4/3 раза (ответ 2).
Поскольку объемы и температуры газов одинаковы (задача 13.2.9), для сравнения их давлений необходимо сравнить число молекул в них. По условию в одном сосуде находится один моль азота, в другом 1 г водорода (т.е. половина моля) и 3 • 1023 молекул гелия (тоже половина моля). Поэтому и в одном и в другом сосуде находятся одинаковые количества молекул, и, следовательно, давление газов в них одинаково (ответ 3).
Плотность газа (задача 13.2.10) можно найти из следующей цепочки формул
(ответ 4). Здесь — масса газа, — масса одной молекулы газа.
Абсолютная температура и средняя кинетическая энергия молекул
1.
 Основное уравнение молекулярно-кинетической теории
Основное уравнение молекулярно-кинетической теорииИдеальный газ. Если потенциальной энергией взаимодействия молекул в газе можно пренебречь по сравнению с кинетической энергией их хаотического движения, то можно считать, что вся внутренняя энергия газа – это сумма кинетических энергий его молекул. Такую упрощенную модель реального газа называют идеальным газом.
Молекулярно-кинетическая теория идеального газа объясняет свойства газов, рассмотренные в предыдущем параграфе.
Согласно этой теории давление газа обусловлено частыми ударами молекул.
Поставим опыт
Будем сыпать на лист тонкого картона песок (рис. 41.1).
Мы увидим, что лист картона согнется, будто на него действует постоянная сила, хотя его деформация обусловлена ударами отдельных песчинок. Таким образом, частые удары мелких частиц создают постоянную силу.
Исходя из того, что давление газа создается ударами молекул, немецкий физик Рудольф Клаузиус вывел соотношение
где p – давление газа, n – концентрация его молекул, m0 – масса молекулы, – среднее значение квадрата скорости молекул, которое определяется формулой
Здесь N – число молекул в газе.
Уравнение (1) называют основным уравнением молекулярно-кинетической теории идеального газа.
Запишем это уравнение с учетом того, что средняя кинетическая энергия поступательного движения молекулы связана со средним квадратом ее скорости соотношением
(Если молекула состоит более чем из одного атома, у нее есть также кинетическая энергия вращательного движения. Расчет, выходящий за рамки нашего курса, показывает, что при нахождении давления газа ее учитывать не нужно.)
Отсюда следует, что m0 = 2. Подставляя это выражение в формулу (1), получаем другую форму записи основного уравнения молекулярно-кинетической теории идеального газа:
Значение основного уравнения молекулярно-кинетической теории идеального газа состоит в том, что оно выражает макроскопический параметр (давление газа) через микроскопические параметры – концентрацию молекул, массу молекулы и средний квадрат скорости или среднюю кинетическую энергию молекул.
Вывод основного уравнения
План наших действий таков.
- Найдем число ударов молекул о стенку сосуда за короткий промежуток времени ∆t.
- Найдем импульс, передаваемый стенке одной молекулой при ударе.
- Найдем импульс, передаваемый стенке молекулами за промежуток времени ∆t.
- Найдем силу давления, используя второй закон Ньютона в импульсной форме.
- Найдем давление.
Направим ось x перпендикулярно стенке сосуда, давление на которую мы рассматриваем. Ее площадь обозначим S. Предположим сначала для простоты, что у всех молекул одинаковое по модулю значение проекции скорости на ось x.
Сколько молекул ударятся о стенку за коротким промежуток времени ∆t? За этот промежуток времени молекулы пролетают по направлению к стенке или от нее расстояние, равное vx∆t (рис. 41.2). Следовательно, успеет долететь до стенки и удариться о нее половина молекул, находящихся у стенки в слое толщиной vx∆t (см. рис. 41.2).
Почему только половина? Потому, что со стенкой столкнутся только молекулы, у которых проекция скорости vx положительна – они движутся к стенке. А к стенке и от стенки летит примерно равное число молекул.
А к стенке и от стенки летит примерно равное число молекул.
? 1. Докажите, что в объеме слоя толщиной vx∆t и площадью S находится nSvx∆t молекул, а число Z ударов молекул о стенку за время ∆t выражается формулой
Какой импульс передает стенке при ударе одна молекула? Перед ударом проекция скорости молекулы равна vx, а после дара она равна –vx (молекула летит от стенки). Поэтому для одуля импульса, переданного стенке одной молекулой, получаем:
2m0vx.
Чему равен импульс, переданный стенке молекулами за время ∆t? Для ответа на этот вопрос надо просто умножить число Z ударов молекул на импульс, передаваемый одной молекулой. Мы получим:
В этой формуле мы учли, что на самом деле молекулы движутся с различными скоростями, поэтому в ней стоит среднее значение квадрата проекции скорости.
С какой силой газ давит на стенку? Согласно второму закону Ньютона, записанному в виде (см. § 25), сила давления газа равна отношению импульса, переданного стене за время ∆t, к этому промежутку времени. Следовательно,
§ 25), сила давления газа равна отношению импульса, переданного стене за время ∆t, к этому промежутку времени. Следовательно,
Чему равно давление газа на стенку? По определению, давление p равно силе давления F, деленной на площадь поверхности S, на которую действует эта сила. Следовательно,
По теореме Пифагора (в трехмерном пространстве) квадрат модуля скорости равен сумме квадратов проекций скорости:
v2 = vx2 + vy2 + vz2.
Учтем, что все направления скоростей молекул равновероятны. Поскольку молекул очень много и их движение хаотично, то средние значения квадратов проекций скорости молекул на оси координат x, y и z равны:
Выполнив усреднение (см. формулу (2)), получим:
Из формул (6) и (7) следует, что
Подставляя это выражение в формулу (5), получаем:
Это и есть основное уравнение молекулярно-кинетической теории идеального газа.
2. Связь между температурой и средней кинетической энергией молекул
Напишем теперь рядом основное уравнение молекулярно-кинетической теории и уравнение состояния идеального газа в удобной для сравнения форме
Левые части этих уравнений совпадают. Значит, их правые части равны. Приравнивая их, получаем:
Значит, их правые части равны. Приравнивая их, получаем:
Эта формула раскрывает физический смысл абсолютной температуры:
абсолютная температура является мерой средней кинетической энергии движения молекул.
Таким образом, температура является энергетической характеристикой газа.
Обратите внимание: средняя кинетическая энергия поступательного движения молекул газа зависит только от абсолютной температуры. Она не зависит ни от массы молекул, ни от давления газа. Например, молекулы кислорода и водорода при одинаковой температуре имеют одинаковые средние кинетические энергии поступательного движения (независимо от того, равны ли давления этих газов).
? 2. В воздухе содержится небольшое количество аргона (молярная масса 40 * 10-3 кг/моль) и неона (молярная масса 20 * 10-3 кг/моль). Чему равна средняя кинетическая энергия молекул каждого из этих газов при нормальных условиях? Есть ли в условии задания лишние данные? (Это одноатомные молекулы)
3.
 Скорости молекул
Скорости молекулСреднеквадратичной скоростью молекул называют корень квадратный из среднего квадрата скорости молекул:
Ее можно использовать для оценки среднего значения модуля скорости молекул. (Расчет, выходящий за рамки нашего курса, показывает, что среднее значение модуля скорости примерно равно среднеквадратичной скорости.)
Среднеквадратичную скорость молекул газа можно выразить через микроскопические параметры газа: абсолютную температуру T и молярную массу M, а также через давление p и плотность ρ.
? 3. Объясните, почему справедлива формула
? 4. Чему равны среднеквадратичные скорости молекул водорода, кислорода и радона при комнатной температуре?
Обратите внимание: при одной и той же температуре среднеквадратичные скорости молекул разных газов не равны это следствие того, что у них одинаковая средняя кинетическая энергия. Чем меньше масса молекулы, тем больше ее среднеквадратичная скорость при той же температуре.
? 5. Объясните, почему справедлива формула
Объясните, почему справедлива формула
? 6. В сосуде объемом 10 л находится 14 г азота. Давление в сосуде 2 * 105 Па. Чему равна среднеквадратичная скорость молекул газа? Есть ли в условии лишние данные?
Выполнив это задание, вы убедитесь, что молекулы действительно движутся со скоростями артиллерийских снарядов!
Измерение скоростей молекул
Значения скоростей молекул, предсказываемые молекулярно-кинетической теорией, казались некоторым ученым слишком большими, что было одним из возражений против этой теории.
В начале 20-го века немецкий физик Отто Штерн поставил опыт, в котором скорости молекул были измерены непосредственно. Вдоль общей оси двух жестко соединенных цилиндров А и В расположена покрытая серебром проволока (рис. 41.3). Воздух из пространства между цилиндрами откачан. Проволоку нагревают электрическим током, вследствие чего атомы серебра начинают испаряться. Из цилиндра А они могут вылететь только через узкую щель. В результате через некоторое время на внутренней поверхности цилиндра В появлялась узкая серебряная полоса 1 точно напротив щели.
В результате через некоторое время на внутренней поверхности цилиндра В появлялась узкая серебряная полоса 1 точно напротив щели.
Затем ток выключали, раскручивали соединенные цилиндры вокруг их общей оси и снова включали ток. На этот раз вместо узкой полосы напротив щели возникала довольно широкая и к тому же смещенная полоса 2.
Чем же обусловлены смещение полосы и ее расширение?
Смещение полосы было обусловлено тем, что за то время, пока атомы серебра пролетали от щели в цилиндре А до поверхности цилиндра В, сами цилиндры успевали повернуться на заметный угол.
Расширение же полосы было обусловлено тем, что скорости атомов при одной и той же температуре различны. Поэтому можно говорить только о средних значениях модуля скорости или о среднеквадратичной скорости.
Результаты опыта Штерна полностью подтвердили предсказания молекулярно-кинетической теории.
Дополнительные вопросы и задания
7. Температура воздуха повысилась от 0 ºС до 20 ºС. На сколько процентов увеличилась при этом:
На сколько процентов увеличилась при этом:
а) средняя кинетическая энергия молекул в воздухе?
б) среднеквадратичная скорость молекул?
8. При нагревании водорода от 300 К до 1350 К все его молекулы распались на атомы.
а) Во сколько раз увеличилась средняя кинетическая энергия частиц?
б) Во сколько раз увеличилась среднеквадратичная скорость частиц?
9. При повышении температуры газа на 900 К среднеквадратичная скорость молекул газа увеличилась в 2 раза. Чему равна начальная температура газа?
10. На Луне есть атмосфера, хотя и очень разреженная. Когда поверхность Луны не освещена Солнцем, концентрация газа вблизи поверхности Луны составляет 2 * 105 м-3. Температура газа при этом равна -150 ºС.
а) Чему равно давление газа?
б) Во сколько раз это давление меньше земного атмосферного давления?
в) Во сколько раз средняя кинетическая энергия молекул этого газа меньше средней кинетической энергии молекул при нормальных условиях?
г) Во сколько раз среднеквадратичная скорость молекул газа на поверхности Луны меньше среднеквадратичной скорости молекул того же газа при нормальных условиях?
11.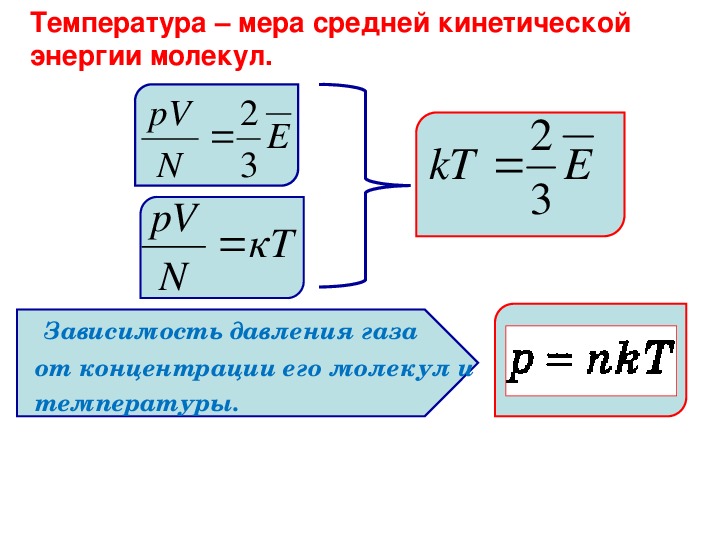 В первом сосуде содержится гелий, а во втором – кислород. Температура гелия равна –100 ºС. При какой абсолютной температуре кислорода:
В первом сосуде содержится гелий, а во втором – кислород. Температура гелия равна –100 ºС. При какой абсолютной температуре кислорода:
а) средняя кинетическая энергия молекул кислорода равна средней кинетической энергии молекул гелия?
б) среднеквадратичная скорость молекул кислорода равна среднеквадратичной скорости атомов гелия?
Идеальный газ
Задачи на эту тему кому-то могут показаться чуть более сложными, но вместе разберемся!
1.Как изменится температура идеального газа заданной массы, если его объем уменьшить вдвое, а давление вдвое увеличить?
Из уравнения идеального газа выразим температуру: . Введем в эту формулу объем: ведь концентрация – это количество молекул в данном объеме: . Теперь запишем температуру так: . Запишем отношение температур: . Объем уменьшился вдвое: , а давление увеличилось вдвое: . Подставляем: . Тогда . Температура не изменилась.
2. При повышении абсолютной температуры идеального газа в 2 раза давление газа увеличилось на 25%. Во сколько раз при этом изменился объем?
Во сколько раз при этом изменился объем?
Решение аналогично предыдущей задаче: опять воспользуемся уравнением состояния идеального газа , только выразим из него объем газа, для этого опять заменим концентрацию на : , или , откуда . Запишем изменения давления и температуры: , . Изменение объема можно записать как отношение: .
Подставляем: , то есть объем увеличился в 1,6 раза.
3. При уменьшении объема газа в два раза давление увеличилось на 120 кПа и абсолютная температура возросла на 10%. Каким было первоначальное давление?
Запишем изменение давления: , объема и температуры: , Запишем отношение давлений, для этого воспользуемся уравнением состояния идеального газа: . Отношение давлений: . Теперь обратимся к давлениям: . Это простое линейное уравнение, перепишем его: . Тогда , откуда кПа.
4. Газ при давлении 0,2 МПа и температуре имеет объем 5 л. Чему равен объем газа этой массы при нормальных условиях?
Сначала вспомним, что такое “нормальные условия”: это температура , или и давление 101325 Па (760 мм рт. ст.). В задаче 2 уже получена нами формула для отношения двух объемов: , остается подставить старые и новые значения температур и давлений, не забыв при этом, что это 288 K: . Тогда новый объем, занимаемый газом, л.
ст.). В задаче 2 уже получена нами формула для отношения двух объемов: , остается подставить старые и новые значения температур и давлений, не забыв при этом, что это 288 K: . Тогда новый объем, занимаемый газом, л.
5. Укажите среднеквадратичную скорость движения молекул неона при температуре 150 К.
1) 250 м/c
2) 105 м/c
3) 312 м/c
4) 432 м/c
Вспоминаем формулу среднеквадратичной скорости: , где – масса молекулы. Надо найти эту массу. Молярную массу неона найдем по таблице Менделеева – она равна кг/моль, а в одном моле молекул, или . Масса молекулы: . Рассчитываем теперь скорость: м/с.
Ответ: 4
6. На рисунке изображен циклический процесс 1-2-3-4-1, совершаемый над идеальным газом. Можно утверждать, что
1) на участке 1-2 газ работу не совершает
2) на участке 4-1 внутренняя энергия газа увеличивается
3) на участке 1-2 газу сообщают некоторое количество теплоты
4) на участке 2-3 газ совершает положительную работу
Разберемся, что происходит с газом на каждом участке. На участке 1-2 газ расширяется, при этом его температура остается неизменной. Раз объем увеличивается, значит, газ работает, так что первое утверждение неверно. Также к этому участку относится утверждение 3, оно правильно, так как где-то же надо газу брать энергию, чтобы совершать работу? Просто подводимого тепла ему хватает только на работу, а на нагрев самого себя уже не остается.
На участке 1-2 газ расширяется, при этом его температура остается неизменной. Раз объем увеличивается, значит, газ работает, так что первое утверждение неверно. Также к этому участку относится утверждение 3, оно правильно, так как где-то же надо газу брать энергию, чтобы совершать работу? Просто подводимого тепла ему хватает только на работу, а на нагрев самого себя уже не остается.
Следующий участок 2-3, к нему относится 4 утверждение. На этом участке объем неизменен, значит, работы газ не совершает, и утверждение неверно. Далее участок 3-4. Очевидно, что объем уменьшается при одной и той же температуре, значит, давление растет. Наконец, участок 4-1, относительно которого сделано второе утверждение. Внутренняя энергия теплового движения молекул газа зависит от температуры, и если она падает, то и внутренняя энергия уменьшается.
Ответ: 3.
7. В таблице указана плотность газов при нормальном атмосферном давлении.
| Газ | Плотность газа, кг/м. куб куб |
|---|---|
| Азот | 1,25 |
| Водород | 0,09 |
| Ксенон | 5,9 |
| Хлор | 3,2 |
При этом наибольшую среднеквадратичную скорость имеют молекулы
1) азота
2) водорода
3) ксенона
4) хлора
Так как среднеквадратичная скорость зависит от массы молекулы , а значит, от молярной массы, то чем больше молярная масса (знаменатель), тем меньше скорость. Осталось найти из предложенных газ с наименьшей молярной массой: это водород.
Ответ: 2.
8. В закрытом сосуде с сухими стенками воздух немного нагрели. Как при этом изменились концентрация молекул воды и относительная влажности воздуха в сосуде?
1) и концентрация молекул, и относительная влажность уменьшились
2) концентрация увеличилась, а относительная влажность не изменилась
3) концентрация уменьшилась, а относительная влажность увеличилась
4) концентрация не изменилась, а относительная влажность уменьшилась
Концентрация не изменилась никак – ведь она зависит от количества молекул, а оно не изменялось. Теперь разбираемся с влажностью. Что такое относительная влажность? Это отношение абсолютной влажности (плотности пара, которая постоянна, так как не меняется ни масса пара, ни объем) к плотности насыщенного пара при той же температуре: , и вот именно последняя зависит от температуры, и с повышением температуры тоже растет. То есть растет знаменатель.Тогда относительная влажность – уменьшается. Выбираем ответ 4.
Теперь разбираемся с влажностью. Что такое относительная влажность? Это отношение абсолютной влажности (плотности пара, которая постоянна, так как не меняется ни масса пара, ни объем) к плотности насыщенного пара при той же температуре: , и вот именно последняя зависит от температуры, и с повышением температуры тоже растет. То есть растет знаменатель.Тогда относительная влажность – уменьшается. Выбираем ответ 4.
9. В каком из четырех состояний, показанных для некоторой массы идеального газа точками на pV –диаграмме, идеальный газ обладает максимальной внутренней энергией?
1) 1
2) 2
3) 3
4) 4
5) 5
Из уравнения состояния идеального газа , или . Так как внутренняя энергия зависит от температуры, и только от нее, а температура, как мы только что показали – от величины произведения pV, то наибольшая внутренняя энергия у газа в такой точке, в которой это произведение максимально. Это точка 4.
Ответ: 4.
Калькулятор закона состояния идеального газа (давление–объем–температура–количество) • Термодинамика — теплота • Онлайн-конвертеры единиц измерения
Калькулятор закона состояния идеального газа определяет одну из четырех величин, входящих в уравнение состояния (давление, объем, температура или количество), если известны три другие величины.
Пример: Рассчитать давление в паскалях в 70-литровом баке работающего на метане автомобиля, если в нем хранится 800 молей метана при 30 °С.
Еще несколько примеров решения задач о состоянии идеального газа под приводится калькулятором.
Выберите неизвестную величину для решения уравнения состояния идеального газа:
PVTn
Абсолютное давление
Pпаскаль (Па)мегапаскаль (МПа)килопаскаль (кПа)гектопаскаль (гПа)ньютон на кв. метр (Н/м²)бар (бар)килограмм-сила на кв. метр (кгс/м²)торр (торр)psi (psi)миллиметр ртутного столба (0°C) (мм рт. ст.)мм вод. столба (4°C) (мм вод. ст., мм H₂O)техническая атмосфера (ат)физическая атмосфера (атм)
ст.)мм вод. столба (4°C) (мм вод. ст., мм H₂O)техническая атмосфера (ат)физическая атмосфера (атм)
Объем
Vкубический метр (м³)кубический дециметр (дм³)кубический сантиметр (см³)литр (л)миллилитр (мл)галлон американскийкварта СШАунция жидкая СШАунция жидкая британскаякубический фут (фут³)кубический дюйм (дюйм³)
Температура
Tградус Цельсия (°C)градус Фаренгейта (°F)градус Ранкина (°Ra)кельвин (К)
ИЛИ
Для расчета выберите неизвестную величину и введите три известные величины из четырех имеющихся в уравнении состояния газа (давление, объем, температура, количество). Четвертая величина будет рассчитана после нажатия на кнопку Рассчитать. Количество можно ввести в молях или указать молярную массу и массу газа. Для определения молярной массы любого газа можно использовать калькулятор молярной массы. Если нужно определить молярную массу смеси газов, например, сухого воздуха, нужно определить молярные массы каждого газа и умножить их на процентное содержание по массе каждого газа в воздухе.
Примеры решения задач по уравнению состояния идеального газа (уравнению Менделеева — Клапейрона)
Задача 1: Плотность воздуха при нормальных условиях (температура 0 °С и атмосферное абсолютное давление 100 кПа) составляет 1,28 кг/м³. Определить среднюю молярную массу воздуха.
Решение: Поскольку плотность воздуха задана, это означает, что в калькулятор можно ввести массу одного кубического метра воздуха, равную 1,28 кг. Введите в калькулятор данные:
- Выберите n (Количество в молях) в селекторе Выберите неизвестную величину.
- Введите абсолютное давление P = 100 кПа.
- Введите объем V = 1 м³.
- Введите температуру T = 0 °C.
- Нажмите кнопку Рассчитать.
- Калькулятор покажет количество молей в 1 м3 воздуха.
- Введите массу воздуха m = 1,28 кг и нажмите кнопку Рассчитать.
- Калькулятор рассчитает молярную массу воздуха M = 0,029 кг/моль
Задача 2: Молярная масса газа кислорода (O₂) M = 32 г/моль. Определить абсолютную температуру 128 г. кислорода, находящегося в 10-литровом сосуде под давлением P = 3 МПа.
Определить абсолютную температуру 128 г. кислорода, находящегося в 10-литровом сосуде под давлением P = 3 МПа.
Решение: Нажмите кнопку Reset и введите в калькулятор данные задачи:
- Выберите T (Температура) в селекторе Выберите неизвестную величину.
- Введите молярную массу кислорода N = 32 г/моль.
- Введите массу кислорода m = 128 г.
- Калькулятор рассчитает количество кислорода в молях.
- Введите объем V = 4 л и давление P = 3 МПа.
- Нажмите кнопку Рассчитать.
- Считайте температуру в кельвинах.
Задача 3: В сосуде высокого давления находится газ под давлением P = 0.5 МПа при температуре T = 15 °С. Объем газа V = 5 л. Рассчитать объем этой массы газа при нормальных условиях (P = 100 кПа, T = 0 °С).
Решение: Нажмите кнопку Reset и введите в калькулятор данные задачи:
- Выберите T (Температура) в селекторе Выберите неизвестную величину.
- Введите давление P = 500 кПа.

- Введите температуру T = 15 °C.
- Введите объем V = 5 л.
- Нажмите кнопку Рассчитать.
- Калькулятор рассчитает количество в молях, которое будет использовано в следующем шаге.
- Выберите Объем в селекторе Выберите неизвестную величину.
- Введите температуру и давление P = 100 kPa, T = 0 °C (нормальные условия) и нажмите кнопку Рассчитать.
- Калькулятор рассчитает новый объем газа V = 23.69 л при нормальных условиях.
Задача 4: Рассчитать давление в паскалях в 70-литровом баке работающего на метане автомобиля, если в нем хранится 12,8 кг метана (молярная масса 16 г/моль) при 30 °С.
Определения и формулы
Идеальный газ
Идеальный газ — теоретическая модель, в которой газ представляется в виде множества свободно движущихся частиц бесконечно малого размера, которые взаимодействуют друг с другом абсолютно упруго, то есть при столкновении двух частиц их кинетическая энергия не изменяется и не превращается ни в какую другую форму энергию, например, в потенциальную энергию или в тепло. Считается, что суммарный размер частиц настолько мал, что занимаемый ими объем в сосуде пренебрежимо мал. Эта теоретическая модель полезна, так как она упрощает многие расчеты, а также в связи с тем, что идеальный газ подчиняется законам классической механики. Идеальный газ можно представить себе в виде множества абсолютно твердых сфер, которые только сталкиваются друг с другом и больше никак не взаимодействуют.
Считается, что суммарный размер частиц настолько мал, что занимаемый ими объем в сосуде пренебрежимо мал. Эта теоретическая модель полезна, так как она упрощает многие расчеты, а также в связи с тем, что идеальный газ подчиняется законам классической механики. Идеальный газ можно представить себе в виде множества абсолютно твердых сфер, которые только сталкиваются друг с другом и больше никак не взаимодействуют.
В обычных условиях, например, при стандартных условиях (при температуре 273,15 К и давлении в 1 стандартную атмосферу) большинство реальных газов ведут себя как идеальный газ. В общем случае, газ ведет себя как идеальный при низком давлении и высокой температуре, когда расстояния между молекулами газа относительно велики. В этих условиях потенциальная энергия вследствие действия межмолекулярных сил намного меньше кинетической энергии частиц. Размер молекул также незначителен по сравнению с расстоянием между ними. Идеальная модель не работает при низких температурах и высоких давлениях, а также для тяжелых газов. При понижении температуры и повышении давления реальный газ может стать жидкостью или даже перейти в твердое состояние, то есть может произойти фазовый переход. В то же время, модель идеального газа не допускает жидкого или твердого состояния.
При понижении температуры и повышении давления реальный газ может стать жидкостью или даже перейти в твердое состояние, то есть может произойти фазовый переход. В то же время, модель идеального газа не допускает жидкого или твердого состояния.
Закон идеального газа
Идеальный газ, как и любой другой газ, можно охарактеризовать четырьмя переменными и одной константой, а именно:
- давление (P),
- объем (V),
- количество в молях (n),
- температура (T), and
- универсальная газовая постоянная (R)
Эти четыре переменные и одна константа объединены в приведенном ниже уравнении, которое называется уравнением состояния идеального газа:
Это уравнение также известно под названием закона идеального газа и уравнения Менделеева — Клапейрона или уравнения Клапейрона, так как уравнение было впервые выведено в 1834 г. французским инженером Эмилем Клапейроном (1799–1864). О вкладе Д. И. Менделеева — чуть ниже. В этом уравнении:
В этом уравнении:
- P — абсолютное давление, измеряемое в СИ в паскалях (Па),
- V — объем, измеряемый в СИ в кубических метрах (м³),
- n — количество вещества (газа) в молях (сокращение моль). Один моль любого вещества в граммах численно равен средней массы одной молекулы в соединении, выраженной в атомных единицах массы. Например, один моль кислорода с атомной массой 16 соответствует 16 граммам. Один моль идеального газа при стандартных условиях занимает 22,4 литра.
- T — абсолютная температура.
- R — универсальная газовая постоянная, являющаяся физическим коэффициентом пропорциональности уравнения состояния идеального газа.
Приведенное выше уравнение показывает, что при нулевой абсолютной температуре получается нулевой объем. Однако это не означает, что объем реального газа действительно исчезает. При очень низких температурах все газы становятся жидкостями и уравнение идеального газа к ним неприменимо.
Универсальная газовая постоянная соответствует работе, выполненной при расширении одного моля идеального газа при нагревании на 1 К при постоянном давлении. Размерность постоянной — работа на количество вещества на температуру. Постоянная в точности равна 8,31446261815324 Дж⋅К⁻¹⋅моль⁻¹. Универсальная газовая постоянная также определяется как произведение числа Авогадро NA и постоянной Больцмана k:
Входящая в уравнение состояния идеального газа универсальная газовая постоянная была предложена и введена в уравнение Дмитрием Менделеевым в 1877 г. Поэтому уравнение состояния идеального газа в литературе на русском языке и ее переводах на другие языки, называется уравнением Менделеева — Клапейрона.
Количество газа в молях часто бывает удобно заменить массой газа. Количество газа в молях n, его масса m в граммах и молярная масса M в граммах на моль связаны формулой:
Заменяя в уравнении состояния идеального газа n на m/M, имеем:
Для определения молярной массы элемента, его относительная атомная масса умножается на коэффициент молярной массы в кг/моль
Например, молярная масса кислорода в единицах системы СИ
Если ввести в уравнение состояния идеального газа плотность ρ = m/V, мы получим:
Теперь введем понятие удельной газовой постоянной, которая представляет собой отношение универсальной газовой постоянной R к молярной массе M:
Например, удельная газовая постоянная сухого воздуха приблизительно равна 287 Дж·кг⁻¹·К⁻¹. Подставив удельную газовую постоянную в уравнение состояния идеального газа, получим:
Подставив удельную газовую постоянную в уравнение состояния идеального газа, получим:
Закон идеального газа объединяет четыре более простых эмпирических газовых закона, открытых в XVII–XIX вв. несколькими учеными, которые аккуратно измеряли свойства газа. Простые газовые законы можно также вывести из уравнения состояния идеального газа (PV=nRT). Поскольку в этом уравнении R является постоянной величиной, можно записать
Поскольку PV/NT — постоянная величина, можно записать это иначе:
Здесь индексы 1 и 2 показывают начальное и конечное состояние газа в системе. Мы будем использовать это уравнение ниже при описании четырех газовых законов.
Отметим, что исторически именно эмпирические законы поведения газа, описанные ниже, привели к открытию обобщенного закона состояния идеального газа. Эти законы были открыты несколькими учеными, которые проводили эксперименты, изменяя только две переменные состояния газа и оставляя две другие переменные постоянными.
Закон Бойля — Мариотта (
T=const, n=const)Роберт Бойль
Изменим предыдущее уравнение с учетом, что количество газа в молях n и его температура Т остаются неизменными:
или
Эдм Мариотт
Это закон Бойля — Мариотта, описывающий зависимость объема V фиксированного количества газа в молях n от давления P при постоянной температуре T. Давление фиксированной массы газа при неизменной температуре обратно пропорционально его объему. Закон был сформулирован англо-ирландским химиком и физиком Робертом Бойлем в 1662 г. В России и континентальной Европе это закон называют законом Бойля — Мариотта с учетом вклада в открытие закона французского физика и священника Эдма Мариотта.
Закон Авогадро (
T=const, P=const)Амедео Авогадро
Если температура и давление остаются неизменными, можно записать
Это закон Авогадро, указывающий, что при неизменных температуре и давлении равные объемы любых газов содержат одинаковое количество молекул. Это уравнение показывает, что, если количество газа увеличивается, объем газа пропорционально растет. Иными словами, количество атомов или молекул газа не зависит от их размеров или от молярной массы газа. Закон назван в честь итальянского ученого Амедео Авогадро, который опубликовал гипотезу об отношениях объема газа и его количества в молях в 1811 году. Число Авогадро также носит его имя.
Это уравнение показывает, что, если количество газа увеличивается, объем газа пропорционально растет. Иными словами, количество атомов или молекул газа не зависит от их размеров или от молярной массы газа. Закон назван в честь итальянского ученого Амедео Авогадро, который опубликовал гипотезу об отношениях объема газа и его количества в молях в 1811 году. Число Авогадро также носит его имя.
Закон Гей-Люссака (
P=const, n=const)Жак Шарль
При постоянном давлении объем фиксированного количества газа в молях пропорционален абсолютной температуре системы с газом.
В англоязычной литературе этот закон называется законом объемов и законом Шарля. Закон описывает как расширяется любой газ при увеличении его абсолютной температуры. Закон был сформулирован в неопубликованной работе французским ученым Жаком Шарлем в 80-х гг. XVIII в. Его соотечественник Жозеф Луи Гей-Люссак опубликовал этот закон в 1803 г. и указал, что приоритет открытия принадлежит Жаку Шарлю. Поэтому этот закон в литературе не на английском языке часто называют законом Гей-Люссака. В русскоязычной литературе закон носит имя Гей-Люссака. Итальянцы называют этот закон первым законом Гей-Люссака (ит. prima legge di Gay-Lussac).
Поэтому этот закон в литературе не на английском языке часто называют законом Гей-Люссака. В русскоязычной литературе закон носит имя Гей-Люссака. Итальянцы называют этот закон первым законом Гей-Люссака (ит. prima legge di Gay-Lussac).
Закон Шарля (или второй закон Гей-Люссака) (
V=const, n=const)Жозеф Луи Гей-Люссак
Закон Шарля (называемый также вторым законом Гей-Люссака) гласит, что давление фиксированного количества газа в молях при его неизменном объеме прямо пропорционально абсолютной температуре газа:
Закон был сформулирован Гей-Люссаком в 1802 г. В литературе на других языках этот закон также называют законом Амонтона по имени французского ученого Гийома Амонтона, который на сто лет раньше обнаружил количественную зависимость объема газа от его температуры. Иногда закон называют вторым законом Гей-Люссака и законом Шарля, так как сам Гей-Люссак считал, что закон открыт Шарлем. Закон зависимости давления от температуры был также независимо открыт английским физиком Джоном Дальтоном в 1801 г. Итальянцы называют этот закон вторым законом Вольта–Гей-Люссака (ит. seconda legge di Volta – Gay-Lussac), потому что итальянец Алессандро Вольта независимо проводил исследования газов и получил аналогичные результаты.
Итальянцы называют этот закон вторым законом Вольта–Гей-Люссака (ит. seconda legge di Volta – Gay-Lussac), потому что итальянец Алессандро Вольта независимо проводил исследования газов и получил аналогичные результаты.
При нагревании воздуха в оболочке воздушного шара его плотность уменьшается и становится меньше плотности окружающего воздуха; в результате шар приобретает положительную плавучесть
Расчет температуры и давления газа: онлайн калькулятор
Комбинированный газовый закон — это формула, которая связывает основные параметры идеального газа и позволяет вычислять неизвестные в случаях, если заданы пять остальных величин.
Идеальный газ
Идеальный газ — это математическая модель с определенными допущениями, которая позволяет исследовать свойства газообразных веществ с достаточной точностью. К допущениям, которые используются в модели идеального газа, относятся:
- пренебрежение размерами молекул;
- силы молекулярного взаимодействия не учитываются;
- соударение атомов и молекул абсолютно упруго;
- газ находится в термодинамическом равновесии.

Благодаря этим допущениям ученые изучили основные свойства газообразных веществ и вывели основные законы, которым подчиняются любые газы. Комбинированный закон объединяет все перечисленные ниже зависимости.
Газовые законы
Любое газообразное вещество характеризуется тремя простыми параметрами: объемом, давлением и температурой. Газ тем и хорош, что он заполняет весь предоставленный объем или может сжиматься до минимальных объемов, иногда переходя в состояние жидкости. Сжимать газ можно двумя способами:
- при постоянном давлении уменьшить температуру;
- при постоянной температуре увеличить давление.
Эти две простые формулировки отражают в себе два известных газовых закона: изобару и изотерму. В изобарном процессе изменение температуры приводит к прямо пропорциональному изменению объема. Вспомните жидкий азот: он занимает минимум места, при этом его температура составляет 63,29 К, что соответствует –209 градусам Цельсия. Если температуру азота поднять до 20 градусов Цельсия, то 1 литр жидкого азота превратится в 700 литров газа. Увеличивается температура, увеличивается объем и наоборот. Эти изменения обусловлены тем, что соотношение объема к температуре газа остается статичным.
Увеличивается температура, увеличивается объем и наоборот. Эти изменения обусловлены тем, что соотношение объема к температуре газа остается статичным.
В изотермическом процессе температура не изменяется и для сжатия газа придется увеличить давление. Это процесс проще для понимания, так как сдавливая газ мы уменьшаем его объем подобно тому, как утрамбовывание грунта или снега позволяет уложить их более плотно и с меньшим объемом. В этом изотермическом процессе изменение давления приводит к обратно пропорциональному изменению объема. Больше давление, меньше объем и наоборот. Такая динамика обусловлена тем, что произведение давления на объем — это всегда постоянная величина.
Если же объем газа не изменяется, то процесс называется изохорным и в этом процессе отображается взаимосвязь давления и температуры. Согласно закону, изменение одного параметра вызывает прямо пропорциональное изменение другого. Это означает, что увеличение давления в сосуде вызывает рост температуры находящегося там газа. Верно и обратное утверждение.
Верно и обратное утверждение.
Комбинированный закон
Все перечисленные законы подчиняются общей формулировке: при постоянстве одного параметра, отношение двух других также постоянно. Обобщая эти законы в динамике получаем комбинированный газовый закон, который описывается формулой:
P1×V1/T1 = P2×V2/T2,
где P1, V1 и T1 — соответственно начальные давление, объем и температура, а P2, V2 и T2 — конечные.
Используя данную формулу легко определить динамику параметров во время нагрева газа или его сжатия.
Наша программа позволяет рассчитать соотношение параметров идеального газа при их изменении. Для использования калькулятора требуется задать пять известных величин, после чего программа определит последнее неизвестное. Рассмотрим небольшой пример.
Пример использования калькулятора
Представим баллон газа объемом 15 л под давлением 120 кПа и при температуре –20 градусов Цельсия. Определим температуру газа, если баллон будет заменен на емкость объемом 10 л и давлением 150 кПа. На первый взгляд у нас есть все параметры, однако в газовых законах температура обязательно указывается в кельвинах, а не градусах. Для перевода температуры в систему Си достаточно прибавить к значению величину 273. Получаем, что температура газа составляет 253 К. Теперь вводим данные в соответствующие ячейки и смотрим на результат: конечная температура теперь равна 210 К или –63 градуса Цельсия. Очевидно, что газ подчинился приведенным выше законам и при уменьшении объема его температура также уменьшилась.
На первый взгляд у нас есть все параметры, однако в газовых законах температура обязательно указывается в кельвинах, а не градусах. Для перевода температуры в систему Си достаточно прибавить к значению величину 273. Получаем, что температура газа составляет 253 К. Теперь вводим данные в соответствующие ячейки и смотрим на результат: конечная температура теперь равна 210 К или –63 градуса Цельсия. Очевидно, что газ подчинился приведенным выше законам и при уменьшении объема его температура также уменьшилась.
Заключение
Газовые законы — серьезная тема школьного курса физики, которую более подробно разбирают на первом году обучения в вузах. Комбинированный закон газа прост на первый взгляд, но обилие параметров может запутать школьника, а выведение пропорций и вовсе способно превратить задачу в ад. Для упрощения расчетов используйте наш онлайн-калькулятор, не забывая переводить все заданные параметры в систему СИ.
Критические и приведённые термодинамические параметры
Критическим состоянием называется такое состояние вещества, при котором плотность вещества и его насыщенного пара равны друг другу. Параметры, соответствующие этому состоянию, называются критическими параметрами.
Параметры, соответствующие этому состоянию, называются критическими параметрами.
Критической Ткр называется такая температура, выше которой газ под действием давления любого значения не может быть превращён в жидкость.
Критическое давление ркр, – зто давление необходимое для сжижения газа при критической температуре.
Критическим объёмом vкр называют объём, равный объёму одного моля газа при критических значениях давления и температуры.
Для природных газов значения Ткр и ркр при известных параметрах компонент xi, pкрi, Ткрi определяются как среднекритические (псевдокритические).
pкр= å(Pкрi xi) , Ткр = å(Tкрi xi) при хС5+10%. (1.8)
Если известна относительная плотность газа `r, то средние значения критических давления и температуры природного газа можно определить по графикам, приведенным на рис. 1.1 и 1.2.
При содержании в природном газе N2, СО2 или Н2S в значения Ткр и ркр вводятся соответствующие поправки.
Когда содержание N2, СО2 или Н2S превышает 15% об., вместо графиков для определения Ткр и ркр следует пользоваться формулой (1.8).
Для приближенных расчетов при изменении относительной плотности `r от 0,5 до 0,9 значения ркр и Ткр можно определить по формулам:
давление в кгс/см2
температура в К
которые справедливы для кривых 1 на рис. 1.1 и 1.2.
Часто в расчетах, например при определении вязкости и коэффициента сверхсжимаемости газа, пользуются так называемыми приведенными давлениями и температурами.
Приведенным давлением рпр называется отношение давления газа р к его критическому давлению ркр : pпр=p/ pкр
Приведенной температурой газа Тпр называется отношение абсолютной температуры газа Т к его критическому значению: Тпр=Т/Ткр.
Объем, масса, плотность, удельный объем. Приведение к нормальным и стандартным условиям и пересчет
Приведение к нормальным и стандартным условиям
Единицей измерения объема газа является кубический метр (м³). Измеренный объем приводится к нормальным физическим условиям.
Измеренный объем приводится к нормальным физическим условиям.
Нормальные физические условия: давление 101 325 Па, температура 273,16 К (0 °С).
Стандартные условия: давление 101 325 Па, температура 293,16 К (+20 °С).
В настоящее время эти обозначения выходят из употребления. Поэтому в дальнейшем следует указывать те условия, к которым относятся объемы и другие параметры газа. Если эти условия не указываются, то это значит, что параметры газа даны при 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²). Иногда объем газа (особенно в иностранной литературе и нормах) при пользовании системой СИ приводится к 288,16 °К (+15 °С) и давлению 1 бар (105 Па).
Если известен объем газа при одних условиях, то пересчитать его в объемы при других условиях можно с помощью коэффициентов, приведенных следующей таблице.
Коэффициенты для пересчета объемов газа из одних условий в другие
| Температура и даление газа | 0 °С и 760 мм рт. ст. ст. |
15 °С и 760 мм рт. ст. | 20 °С и 760 мм рт. ст. | 15 °С (288,16 °К) и 1 бар |
| 0 °С и 760 мм рт. ст. (норм. условия) | 1 | 1,055 | 1,073 | 1,069 |
| 15 °С и 760 мм рт. ст. (в зар. литературе) | 0,948 | 1 | 1,019 | 1,013 |
| 20 °С и 760 мм рт. ст. (ст. условия) | 0,932 | 0,983 | 1 | 0,966 |
| 15 °С (288,16 °К) и 1 бар (СИ) | 0,936 | 0,987 | 1,003 | 1 |
Для приведения объемов газа к 0 °С (273,16 °К) и 760 мм рт. ст. (1,033 кгс/см²), а также к 20 °С (293,16 °К) и 760 мм рт. ст. (1,033 кгс/см²) могут быть применены следующие формулы:
где V0 °С и 760 мм рт. ст. — объем газа при 0 °С и 760 мм рт. ст., м³;
V20° С и 760 мм рт. ст. — объем газа при 20 °С и 760 мм рт. ст., м³;
ст. — объем газа при 20 °С и 760 мм рт. ст., м³;
VP — объем газа в рабочих условиях, м³;
р — абсолютное давление газа в рабочих условиях, мм рт. ст.;
Т — абсолютная температура газа в рабочих условиях, °К.
Пересчет объемов газа, приведенных к 0 °С и 760 мм рт. ст., а также к 20 °С и 760 мм рт. ст., в объемы при других (рабочих) условиях можно производить по формулам:
Любой газ способен расширяться. Следовательно, знание объема, который занимает газ, недостаточно для определения его массы, так как в любом объеме, целиком заполненном газом, его масса может быть различной.
Масса — это мера вещества какого-либо тела (жидкости, газа) в состоянии покоя; скалярная величина, характеризующая инерционные и гравитационные свойства тела. Единицы массы в СИ — килограмм (кг).
Плотность, или масса единицы объема, обозначаемая буквой p, — это отношение массы тела m, кг, к его объему, V, м³:
p = m/V
или с учетом химической формулы газа:
p = M/VМ = M/22,4,
где M — молекулярная масса,
VМ — молярный объем.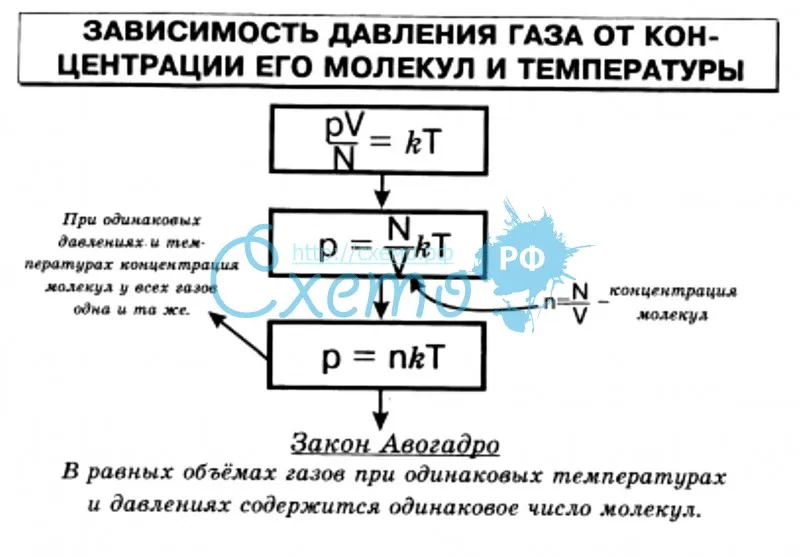
Единица плотности в СИ — килограмм на кубический метр (кг/м³).
Зная состав газовой смеси и плотность ее компонентов, определяем по правилу смешения среднюю плотность смеси:
pсм = (p1V1 + p2V2 + … + pnVn)/100,
где p1, p2, …, pn — плотность компонентов газового топлива, кг/м³;
V1, V2, …, Vn — содержание компонента, об. %.
Величину, обратную плотности, называют удельным, или массовым, объемом (ν) и измеряют в кубических метрах на килограмм (м³/кг).
Как правило, на практике, чтобы показать, на сколько 1 м³ газа легче или тяжелее 1 м³ воздуха, используют понятие относительная плотность d, которая представляет собой отношение плотности газа к плотности воздуха:
d = p/1,293
и
d = M/(22,4×1,293).
Калькулятор закона идеального газа
Этот калькулятор закона идеального газа поможет вам определить свойства идеального газа при изменении давления, температуры или объема. Прочтите, чтобы узнать о характеристиках идеального газа, о том, как использовать уравнение закона идеального газа и об определении постоянной идеального газа.
Что такое идеальный газ
Идеальный газ – это особый случай любого газа, который удовлетворяет следующим условиям:
- Газ состоит из большого количества молекул, которые перемещаются беспорядочно.
- Все молекулы – точечные частицы (они не занимают места).
- Молекулы не взаимодействуют, кроме столкновения.
- Все столкновения между частицами газа совершенно упругие.
- Частицы подчиняются законам движения Ньютона.
Уравнение закона идеального газа
Свойства идеального газа можно обобщить в одной формуле вида:
pV = nRT где:
-
p– давление газа, измеренное в Па; -
V– объем газа, измеряемый в м³; -
n– количество вещества, измеренное в молях; -
R– идеальная газовая постоянная; и -
T– температура газа, измеряемая в Кельвинах.
Чтобы найти любое из этих значений, просто введите другие в калькулятор закона идеального газа.
Например, если вы хотите рассчитать объем 40 моль газа под давлением 1013 гПа и при температуре 250 K, результат будет равен:
V = nRT / p = 40 * 8,3144598 * 250/101300 = 0,82 м³ .
Постоянная идеального газа
Газовая постоянная (символ R) также называется молярной или универсальной постоянной. Он используется во многих фундаментальных уравнениях, таких как закон идеального газа.
Значение этой постоянной составляет 8,3144626 Дж / (моль · К) .
Газовая постоянная часто определяется как произведение постоянной Больцмана k (которая связывает кинетическую энергию и температуру газа) на число Авогадро (количество атомов в моль вещества):
R = N A k = (6,02214076 × 10 23 / моль) * (1,38064852 × 10 -23 Дж / К) = 8,3144626 Дж / (моль · К)
Этот калькулятор атмосферного давления на высоте может оказаться полезным и для вас.
Законы о газе
Законы о газеГазовые законы
Нижеследующее содержание является сутью лекции 18. В этой лекции мы рассматриваем законы газа: законы Шарля, Бойля, Авагадро и Гей-Люссака, а также законы идеального и комбинированного газа.
Законы о свойствах газа
Есть 4 общих закона, которые связывают 4 основных характерных свойства газов друг с другом. Каждый закон назван его первооткрывателем. Хотя важно понимать отношения, охватываемые каждым законом, знание отправителя не так важно и будет лишним после введения закона о комбинированном газе.Так что сосредоточьтесь на понимании отношений, а не на запоминании имен.
Закон Чарльза – дает соотношение между объемом и температурой , если давление и количество газа поддерживаются постоянными :
1) Если температура газа по Кельвину увеличивается, объем газа увеличивается. (Постоянная P, n)
2) Если температура газа по Кельвину понижается, объем газа уменьшается.(Постоянная P, n)
Это означает, что объем газа прямо пропорционален его температуре Кельвина.Подумайте об этом так: если вы увеличиваете объем газа и должны поддерживать постоянное давление, единственный способ добиться этого – это также повысить температуру газа.
Расчеты с использованием закона Чарльза включают изменение температуры (T 2 ) или объема (V 2 ) от известного начального количества каждого из них (V 1 и T 1 ):
Закон Бойля – гласит, что объем заданного количества газа, удерживаемого при постоянной температуре, изменяется обратно пропорционально приложенному давлению, когда температура и масса постоянны.
Уменьшение объема газа означает, что молекулы ударяются о стенки чаще, увеличивая давление, и наоборот, если объем увеличивается, расстояние, которое молекулы должны пройти, чтобы столкнуться со стенками, увеличивается, и они реже ударяются о стенки, таким образом уменьшая давление.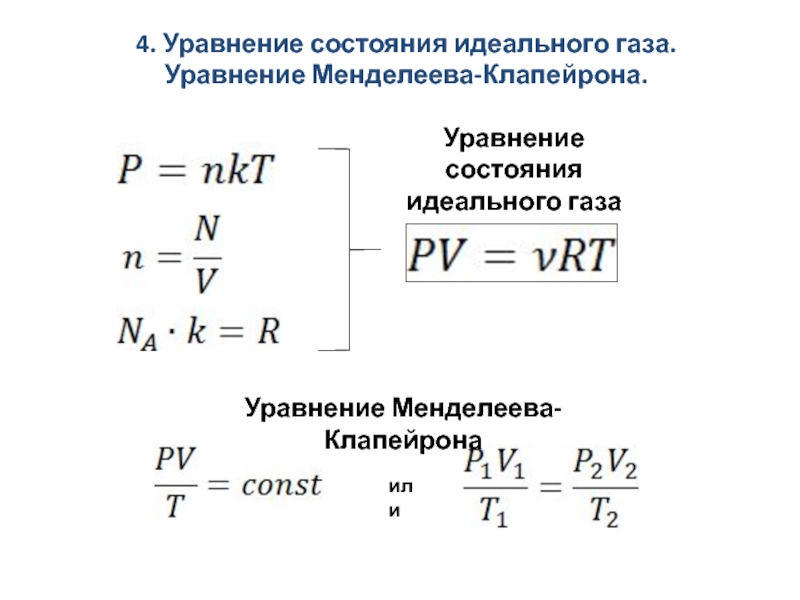
Как и закон Чарльза, закон Бойля можно использовать для определения текущего давления или объема газа, если известны начальные состояния и одно из изменений:
Закон Авагадро – Дает соотношение между объемом и количеством газа в молях, когда давление и температура поддерживаются постоянными.
Если количество газа в баллоне увеличивается, объем увеличивается. Если количество газа в баллоне уменьшается, объем уменьшается. Это, конечно, при условии, что контейнер имеет расширяемые стенки.
Соотношение снова прямо пропорционально, поэтому уравнение для расчетов –
.Закон Гей-Люссака – гласит, что давление данного количества газа, удерживаемого в постоянном объеме, прямо пропорционально температуре Кельвина.
Если вы нагреете газ, вы дадите молекулам больше энергии, и они будут двигаться быстрее. Это означает большее воздействие на стенки емкости и увеличение давления. И наоборот, если вы охладите молекулы, они замедлятся, и давление снизится.
Это означает большее воздействие на стенки емкости и увеличение давления. И наоборот, если вы охладите молекулы, они замедлятся, и давление снизится.
Для расчета изменения давления или температуры с использованием закона Гей-Люссака уравнение выглядит следующим образом:
Чтобы немного поиграть с отношениями, попробуйте эту симуляцию.
Закон об идеальном газе:
Комбинация представленных выше законов порождает закон идеального газа:
Добавление константы пропорциональности, называемой идеальной или универсальной газовой постоянной (R), завершает уравнение.
Как видите, для константы возможно множество единиц. Единственное постоянное значение константы – это то, что шкала температуры во всем – KELVIN.
При использовании закона идеального газа для расчета любого свойства газа вы должны сопоставить единицы с газовой постоянной, которую вы выбираете для использования, и вы всегда должны указывать свою температуру в градусах Кельвина.
Чтобы использовать уравнение, вам просто нужно уметь определить, чего не хватает в вопросе, и изменить уравнение, чтобы решить его.
Типичный вопрос: 6,2 литра идеального газа содержится при 3,0 атм и температуре 37 ° C. Сколько молей этого газа присутствует?
Поскольку единицы газовой постоянной задаются в атмосфере, молях и градусах Кельвина, важно убедиться, что вы конвертируете значения, указанные в других шкалах температуры или давления.Для этой задачи преобразуйте температуру ° C в K с помощью уравнения:
Т = ° С + 273
Т = 37 ° С + 273
Т = 310 К
Теперь вы можете вставить значения. Решите относительно количества родинок
n = PV / RT
n = (3,0 атм x 6,2 л) / (0,08206 л атм / моль K x 310 K)
n = 0,75 моль
Вот некоторые практические проблемы с использованием Закона об идеальном газе: Практика
Закон о комбинированном газе
Я сказал выше, что запоминание всех уравнений для каждого из отдельных законов газа станет неуместным после введения последующих законов.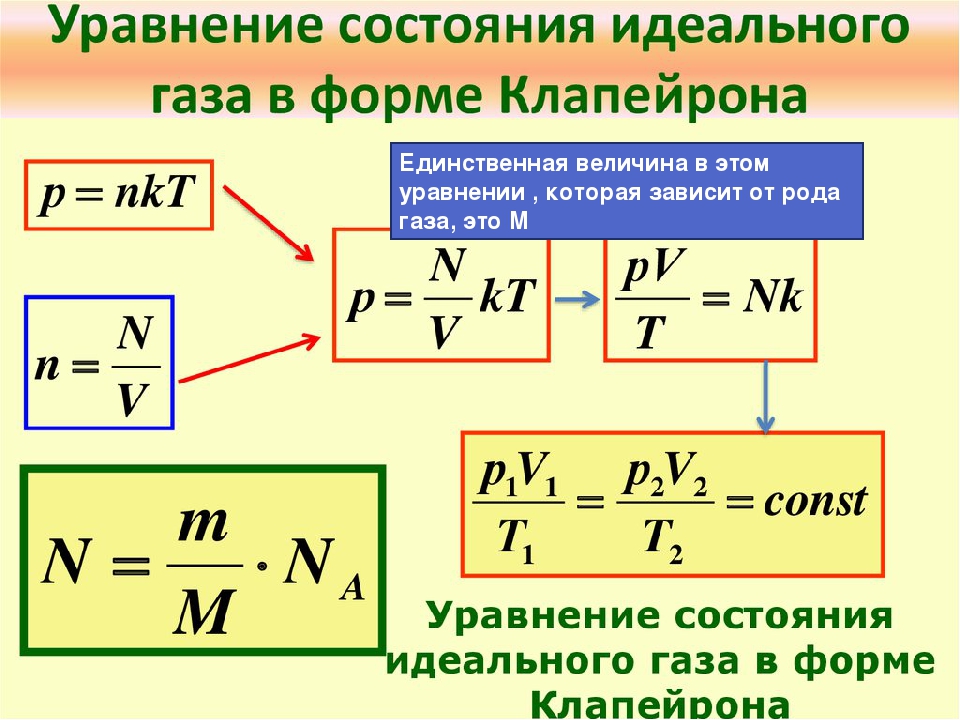 Закон, о котором я говорил, – это Закон о комбинированном газе:
Закон, о котором я говорил, – это Закон о комбинированном газе:
Закон комбинированного газа позволяет вывести любое из необходимых соотношений, объединив все изменяемые элементы в законе идеального газа: а именно давление, температуру и объем. R и число молей не фигурируют в уравнении, поскольку они обычно постоянны и поэтому сокращаются, поскольку они появляются в равных количествах по обе стороны уравнения.
Как вы можете видеть выше, уравнение может быть решено для любого из входящих в него параметров.Но что еще более важно, вы можете исключить из уравнения все, что останется постоянным.
Например, если в вопросе говорится, что система с давлением 1 атм и объемом 2 литра претерпела изменение до 3,5 литров, вычислите новое давление, вы можете просто исключить температуру из уравнения и получить:
P 2 = P 1 V 1 / V 2 = (1 атм) (2 л) / 3,5 л) = 0,6 атм
Поскольку в вопросе никогда не упоминается температура, мы можем предположить, что она остается постоянной и поэтому будет отменена при вычислении. Вы также должны подумать над ответом, который вы получите с точки зрения того, что вы знаете о газах и о том, как они действуют. Мы увеличили объем, поэтому давление должно снизиться. Проверяя наш ответ, он кажется правильным, поскольку давление упало с 1 атм до 0,6 атм.
Вы также должны подумать над ответом, который вы получите с точки зрения того, что вы знаете о газах и о том, как они действуют. Мы увеличили объем, поэтому давление должно снизиться. Проверяя наш ответ, он кажется правильным, поскольку давление упало с 1 атм до 0,6 атм.
Итак, единственное уравнение, которое вам действительно нужно знать, – это закон комбинированного газа для расчета изменений свойств газа.
Вот некоторые практические проблемы с решениями: Практика
Вот некоторые проблемы для других газовых законов, которые вы можете вывести из закона о комбинированном газе: Практика и ПОЗ.
Использование закона идеального газа: расчет давления, объема, температуры или количества газа – Science Class [2021 Video]
Использование закона идеального газа
Давайте начнем с очень простого примера, чтобы увидеть, как это работает.Допустим, мы хотим вычислить объем 1 моля газа при 273 K (что равно 0 ° C) и давлении в 1 атмосферу. Вот как выглядит наше уравнение, когда мы вводим известные нам переменные:
1 атм * V = 1 моль * 0,0821 атм л / моль K * 273 K
Если мы хотим найти объем (V), мы просто переставьте уравнение, чтобы получить эту переменную отдельно. Делаем это делением на давление 1 атм (атмосфера). Итак, теперь наше уравнение выглядит так:
Делаем это делением на давление 1 атм (атмосфера). Итак, теперь наше уравнение выглядит так:
V = (1 моль * 0.0821 атм л / моль K * 273 K) / 1 атм
Моли взаимно компенсируются, как и атмосферы и градусы Кельвина. Все, что у нас осталось в единицах измерения, – это литры, а затем, чтобы получить наш объем, мы просто вычисляем. Наш окончательный ответ – 22,4 л. Имеет смысл?
Давайте попробуем другой пример, на этот раз реальный. Предположим, вы хотите рассчитать температуру газа в шине велосипеда. Пока вы знаете другие переменные, вы можете сделать это довольно легко! В этом случае давление равно 1.14 атм, объем шины 5,00 л, а у нас 0,225 моль газа. Итак, наше исходное уравнение выглядит так:
1,14 атм * 5,00 л = 0,225 моль * 0,0821 атм л / моль K * T
Чтобы получить только температуру, мы просто разделим на n и R и получим:
(1,14 атм * 5,00 л) / (0,225 моль * 0,0821 атм л / моль K) = T
После того, как мы посчитаем, мы получим с 310 К, потому что все наши другие устройства сокращаются. А что такое 310 К? Ну, это около 37 ° C, или около 98.6 ° F. Довольно тепло!
А что такое 310 К? Ну, это около 37 ° C, или около 98.6 ° F. Довольно тепло!
Самое лучшее в этом уравнении – то, что вы можете найти любую переменную, если у вас есть остальные три! Итак, если вы знаете температуру, давление и количество молей, вы легко можете найти объем. Точно так же, если вы знаете объем, а также температуру и давление, вы можете решить уравнение, чтобы вычислить, сколько в нем молей. Это делает закон идеального газа «идеальным» для работы!
Краткое содержание урока
Мы знаем, что идеальные газы – это просто идеальные газы.Но поскольку реальные газы могут вести себя как идеальные газы при правильных условиях, это позволяет нам использовать закон идеального газа для прогнозирования их поведения. Закон идеального газа гласит, что PV = nRT , или, говоря простым языком, что давление, умноженное на объем, равно количеству молей, умноженных на константу закона газа, умноженную на температуру. Если вы знаете три из четырех переменных, вы можете легко переставить и вычислить недостающую, независимо от того, какая из них может быть!
Результаты обучения
По завершении этого урока вы сможете:
- Определить закон идеального газа и определить его формулу
- Вычислите недостающую переменную, используя уравнение закона идеального газа, когда вам предоставлены другие необходимые переменные
Док Брауна Химия KS4 science GCSE / IGCSE / AS Chemistry Revision Notes Часть 2 Подробнее продвинутые темы об идеальном газе законы, расчеты, теория кинетических моделей частиц (разделы 4a – 4b) Более продвинутые идеи, связанные с
газы расчет газового закона с использованием закона Бойля, закона Чарльза, закона Гей-Люссака, P1V1 / T1 = P2V2 / T2. Основная теория частиц и свойства газов, жидкости и твердые тела, изменения состояния и решения описаны на Заметки GCSE / IGCSE по моделям частиц газов, жидкостей и твердых тел, описание и объяснение их свойств, и продвинутые студенты должны быть знакомы со ВСЕМ его содержанием перед изучением этой страницы …. Субиндекс для части 2: Раздел 4 Поведение идеального газа и законы газа: Введение кинетическая теория частиц идеального газа * Температурная шкала Кельвина * 4а Закон Бойля * 4b.Закон Чарльза и Гей-Люссака и уравнение комбинированного закона газа * 4c. Уравнение идеального газа PV = nRT * 4d. Закон Дальтона о парциальных давлениях * 4e. Закон диффузии Грэма * 5а. Отклонения газов от идеального поведение и их причины * 5b. Уравнение состояния Ван-дер-Ваальса * 5c Коэффициенты сжимаемости * 5d В Критическая точка Критическая температура и критическое давление * Для других расчетов см. И молярный объем газа и объемные соотношения реагирующих газов. Максвелл Больцмановское распределение кинетических энергий частиц обсуждается в КИНЕТИКА страницы. Док Брауна Заметки о пересмотре химии: химия в основной школе, химия GCSE, химия IGCSE, уровень O & ~ Школьные курсы естественных наук для 8, 9 и 10 классов в США или их эквиваленты для детей от 14 до 16 лет студенты-естественники на государственных экзаменах по химии 4.Идеальное поведение газа и газовые законы Введение в кинетическую модель частиц идеального газа
Температурная шкала Кельвина Раньше проводилось много измерений.
сделано, чтобы исследовать, как (i) давление и объем данной массы изменяются при
постоянная температура и как (ii) давление и объем газа фиксированной массы
газ меняется в зависимости от температуры (см. два графика слева и справа). Однако перед этим, если вы посмотрите на эти два графика поведения газа при изменении давления или объема в зависимости от температуры, одна вещь становится ясной, когда линии графика экстраполируются обратно на x по оси они дают значение 273 o C. Это породило идею, что была минимально возможная температура 273 o C и дальнейшие эксперименты подтверждали это снова и снова.При 273 o C все вещества твердые и с точки зрения кинетической теории частиц материи, при 273 o C частицы практически не двигаются т.е. ~ нет колебания атомов в твердом теле. Следовательно, как и , установлен
Шкала Цельсия (шкала Цельсия), новая шкала температуры была предложена в
наименьшее значение которого было 0 (известное как абсолютный ноль ), а не 273. K = o C + 273 и o C = K 273 , и это температура в К, которую вы должны использовать в расчетах по закону газа (4b.) Некоторые примеры разработаны ниже и потренируйтесь в чтении термометра Цельсия, который вы используете в школе или колледж лаборатория!
Некоторые знакомые температуры указаны ниже. связь двух температурных шкал
Кажется немного странным сказать, что ваше тело температура 310, поэтому всегда важно указывать и единицы измерения! НАЧАЛО СТРАНИЦЫ 5.
Подробнее о расчетах давления и объема газа 4а. Закон Бойля для объема и газа давление
НАЧАЛО СТРАНИЦЫ Расчеты 4б. Закон Чарльза / Закон Гей-Люссака для давления / объема и температура и комбинированный уравнение закона газа
Закон комбинированного газа уравнение (только для продвинутых студентов)
НАЧАЛО СТРАНИЦЫ ДРУГИЕ ПОЛЕЗНЫЕ СТРАНИЦЫ Передовой примечания по расчетам газового закона, кинетические модельная теория ИДЕАЛЬНОГО ГАЗА и неидеальных газов См. Также расчеты по газу Моли и молярный объем газа, закон Авогадро Объем реагирующего газа отношения, закон Авогадро Вычисления по закону Гей-Люссака Остальные страницы расчетов
НАЧАЛО СТРАНИЦЫ |
Калькулятор законов о газе – EniG.Инструменты
Общее уравнение газа
Закон идеального газа – это уравнение состояния гипотетического идеального газа. Это уравнение было впервые сформулировано французским инженером и физиком Эмилем Клапейроном (1799-1864) в 1834 году как комбинация трех эмпирических газовых законов, предложенных Робертом Бойлем, Жозефом Луи Гей-Люссаком и Амедео Авогадро.
PV = nRT
, где p – давление, V – объем, n – количество вещества газа, R – универсальная газовая постоянная и T – термодинамическая температура.
Универсальная газовая постоянная R определяется как произведение постоянной Авогадро N A (количество частиц в одном моль газа) и постоянной Больцмана k (она связывает кинетическую энергию частиц в газе) .
R = k · N A = 1,38064852 · 10 -23 JK -1 · 6.022140857 · 10 23 моль -1 = 8,3144598 Дж моль -1 K -1
Закон о комбинированных газах
( n = const.)
Закон Чарльза
( p = константа, n = константа)
Закон Гей-Люссака
( V = константа, n = константа)
Закон Бойля
( T = константа, n = константа)
п. 1 В 1 знак равно п. 2 В 2
Закон Авогадро
Закон Авогадро гласит, что равные объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество молекул.
Закон Дальтона
Закон парциальных давлений Дальтона гласит, что давление смеси газов просто является суммой парциальных давлений отдельных компонентов.
p = p 1 + p 2 + p 3 + … p n знак равно n ∑ и = 1 p i
Формула закона идеального газа
Закон идеального газа был создан, чтобы показать взаимосвязь между давлением, объемом, количеством молей газа и температурой.Это комбинация закона Бойля и закона Чарльза. Он показывает уравнение гипотетического идеального газа. Давление и объем имеют обратную зависимость друг от друга (когда 1 повышается, другой понижается), но имеют прямую связь с температурой (когда они повышаются, температура повышается)
Уравнение закона идеального газа:
PV = nRT
P = Давление ( атм )
V = Объем ( литров – L )
n = Количество моль ( моль )
R = идеальная газовая постоянная ( 0.08206 Л-атм / моль-К )
T = Температура ( Кельвин )
Формула закона идеального газа Вопросы:
1.) Сколько молей газа содержится в 890,0 мл при 21 ° C и 750 мм рт.
Ответ: Объем V = 890,0 мл , температура T = 21 ° C и давление P = 750 мм рт.ст. .
Чтобы использовать уравнение закона идеального газа, необходимо преобразовать объем в литры, температуру в градусы Кельвина и давление в атмосферу.
V = 890 мл / 1000 = 0,89 L
T = 21 ° C + 273 = 294 K
P = 750 мм рт. Ст. / 760 = 0,987 атм
Включите уравнение закона идеального газа
PV = nRT
0,987 атм (0,890 L ) = n (0,08206L- атм / моль-K ) (294 K )
n = 0,037 моль
Содержит 0,037 моля газа.
2.) Рассчитайте объем, который займет 3,00 моля газа при 24 ° Цельсия и 762,4 мм рт.
Ответ: Количество моль n = 3,00 моль , температура T = 24 ° C и давление P = 762,4 мм рт. Ст.
Чтобы использовать уравнение закона идеального газа, необходимо преобразовать температуру в Кельвин, а давление в атмосферы.
Т = 24 + 273 = 297 К
P = 762.4/760 = 1,003 атм
Включите уравнение закона идеального газа
PV = nRT
1,003 атм (V) = 3,00 моль (0,08206 л-атм / моль-K ) (297 K )
В = 72,897 L
Объем газа будет 72,897 литров
Уравнение состояния
Газы имеют различные свойства, которые мы можем наблюдать с помощью наших чувства, в том числе газ давление р , температура T , масса м , а объем В который содержит газ.Тщательное научное наблюдение показало, что эти переменные связаны друг с другом, и значения этих свойства определяют состояние газа.
Если мы исправим любые два свойства, мы сможем определить природу отношения между двумя другими. Вы можете изучить взаимосвязь между переменными на анимированный газ лаборатория. Если давление и температура поддерживаются постоянными, Объем газа напрямую зависит от массы или количества газа.Это позволяет нам определить одно дополнительное свойство, называемое газом. плотность r , которая является отношением массы к объем. Если масса и температура остаются постоянными, произведение давление и объем почти постоянны для реального газ. Произведение давления и объема в точности постоянное для идеальный газ . Это соотношение между давлением и объемом названный законом Бойля в честь Роберта Бойля кто впервые заметил это в 1660 году.Наконец, если масса и давление равны постоянным, объем прямо пропорционален температуре для идеального газа. Эти отношения называются Чарльзом и закон Гей-Люссака в честь двух французских ученых, которые обнаружил отношения.
Газовые законы Бойля, Шарля и Гей-Люссака можно объединить. в единое уравнение состояния, выделенное красным цветом в центре горка:
p * V / T = n * Rбар
где * обозначает умножение, а / обозначает деление.Чтобы учесть влияние массы, мы определили константа состоит из двух частей: универсальной константы Rbar (на рисунке буква R с полосой сверху) и масса газа в молях n . Занимаясь небольшой алгеброй, мы получить более привычную форму:
p * V = n * Rбар * T
Трехмерный график этого уравнения показан в нижнем левом углу.Перекресток точка любых двух линий на графике дает уникальное состояние для газ.
Инженеры используют несколько иную форму уравнения состояние, которое специализируется на конкретном газе. Если разделить обе стороны общее уравнение массой газа, объем становится удельный объем, который является обратной величиной плотность газа. Мы также определяем новую газовую постоянную R , которая равна равной универсальной газовой постоянной, деленной на массу на моль газ.Значение новой постоянной зависит от типа газа как в отличие от универсальной газовой постоянной, которая одинакова для всех газы. Значение уравнения состояния воздуха указано на понизить как 0,286 килоджоуля на килограмм на Кельвин. Уравнение состояния можно записать в терминах конкретного объем или плотность воздуха как
р * v = R * T
р = г * R * Т
Обратите внимание, что уравнение приведенное здесь состояние применимо только к идеальному газу или реальному газу, ведет себя как идеальный газ.На самом деле существует много разных форм для уравнение состояния для разных газов. Также имейте в виду, что температура, указанная в уравнении состояния, должна быть абсолютная температура который начинается с абсолютного нуля. В метрической системе единиц, мы должны указать температуру в Кельвинах (а не в градусах Цельсия).

 6)
6) 8)
8) В процесс 4 меняются и давление, и объем, и температура газа (ответ 4).
В процесс 4 меняются и давление, и объем, и температура газа (ответ 4).


 (Постоянная P, n)
(Постоянная P, n)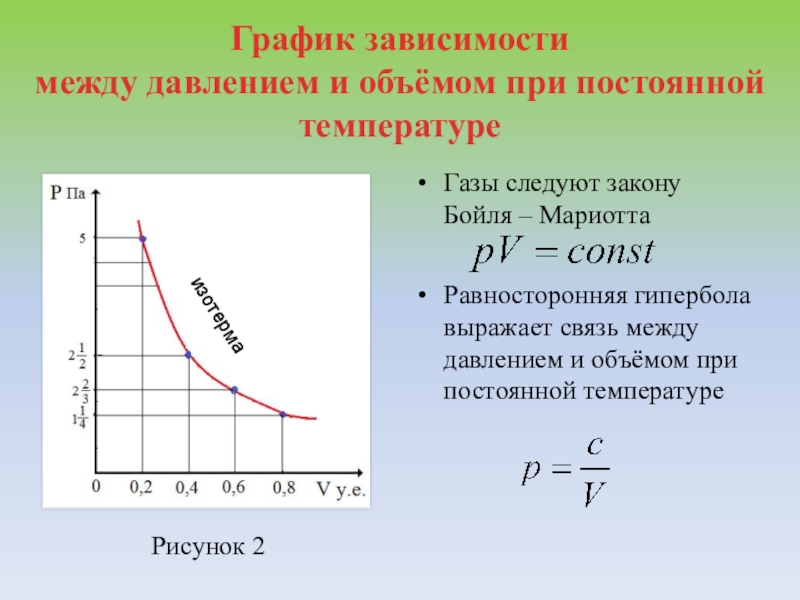 Газовые законы, касающиеся давления, объема и
температура очень важна как для GCSE, так и для A level Chemistry
Газовые законы, касающиеся давления, объема и
температура очень важна как для GCSE, так и для A level Chemistry страница “Индекс расчетов”
включая определение родинки и
Константа Авогадро
страница “Индекс расчетов”
включая определение родинки и
Константа Авогадро
 е. KE (J) Т (К)
е. KE (J) Т (К) Это привело
в формулировке законов газов, описанных в следующем разделе 4а. вдоль
как использовать их в расчетах и решении задач.
Это привело
в формулировке законов газов, описанных в следующем разделе 4а. вдоль
как использовать их в расчетах и решении задач. Это называется шкалой температуры Кельвина, или абсолютной температурой .
Температурная шкала , обозначается единицей К .Между прочим, вы не говорите градусы Кельвина, как вы говорите градусы Цельсия, вы просто
говорит Кельвин. Температурная шкала Кельвина также была разработана таким образом, чтобы 1 K
изменение температуры или интервал, точно равно 1 o C Изменение по Цельсию
или интервал. Таким образом, вы можете легко переключаться между двумя температурными шкалами.
простым расчетом
Это называется шкалой температуры Кельвина, или абсолютной температурой .
Температурная шкала , обозначается единицей К .Между прочим, вы не говорите градусы Кельвина, как вы говорите градусы Цельсия, вы просто
говорит Кельвин. Температурная шкала Кельвина также была разработана таким образом, чтобы 1 K
изменение температуры или интервал, точно равно 1 o C Изменение по Цельсию
или интервал. Таким образом, вы можете легко переключаться между двумя температурными шкалами.
простым расчетом 5 или С
5 или С  Модель частиц газа – движение и давление газа
Модель частиц газа – движение и давление газа 


 грамм. кислород для больниц, может быть
хранятся под высоким давлением, что обеспечивает достаточно эффективное хранение. Так как
внутреннее давление в цилиндре намного больше, чем внешнее
давление, при установке клапана большой объем газа может быть выпущен в поток
медленно в контролируемых условиях для дыхания пациента.
грамм. кислород для больниц, может быть
хранятся под высоким давлением, что обеспечивает достаточно эффективное хранение. Так как
внутреннее давление в цилиндре намного больше, чем внешнее
давление, при установке клапана большой объем газа может быть выпущен в поток
медленно в контролируемых условиях для дыхания пациента.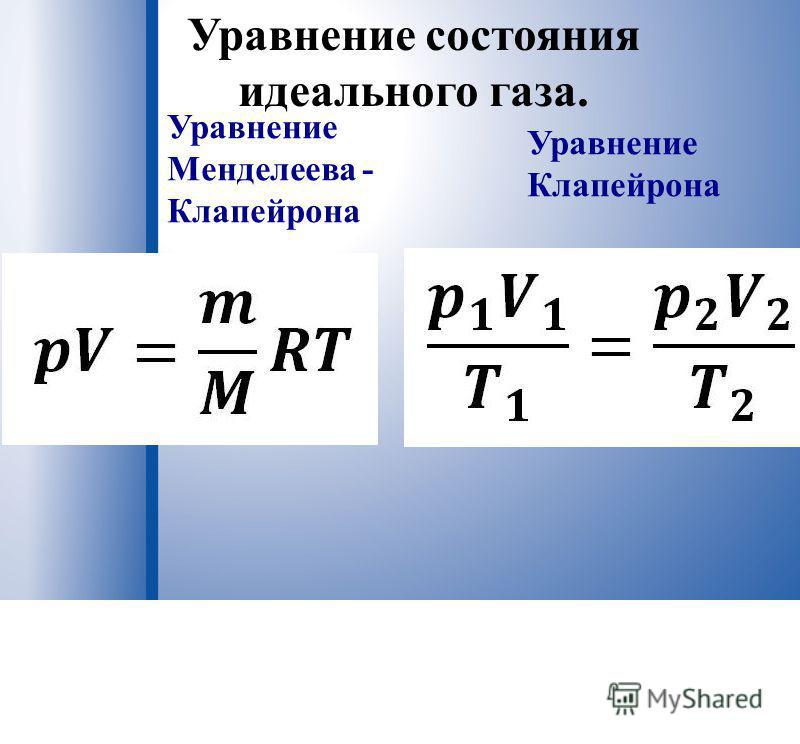 2 = p 1 x V 1 / V 2 = 100 x 240/150 = 160 кПа
2 = p 1 x V 1 / V 2 = 100 x 240/150 = 160 кПа  Если атмосферное давление составляет 101325 Па, а температура остается постоянной,
какое давление газа в шприце после сжатия.
Если атмосферное давление составляет 101325 Па, а температура остается постоянной,
какое давление газа в шприце после сжатия.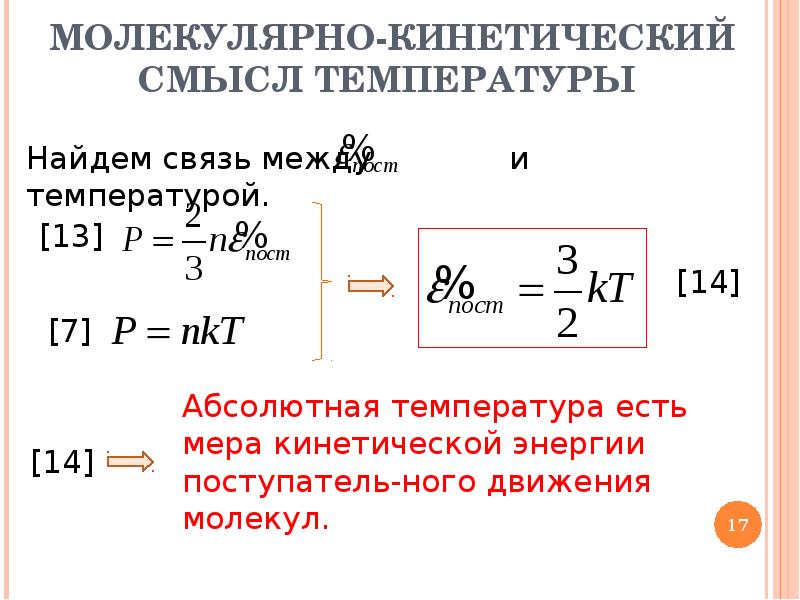 52 x 100 / 1,01 = 546,5 дм 3
52 x 100 / 1,01 = 546,5 дм 3 

 ..
..
 4b 1 квартал
4b 1 квартал  4b 2 квартал
4b 2 квартал  Объем углекислого газа, собранный через 5 минут в
100см 3 газовый шприц использовали для определения скорости реакции.Все эксперименты проводились за одно занятие при температуре 22 o C кроме последнего. Это было сделано на следующем уроке, давая углеродный
объем диоксида 47,0 см 3 через 5 минут, но при более высоком
температура 27 o C (в градусах Кельвина звоните по этому номеру T 1 ,
а другая температура T 2 ).
Объем углекислого газа, собранный через 5 минут в
100см 3 газовый шприц использовали для определения скорости реакции.Все эксперименты проводились за одно занятие при температуре 22 o C кроме последнего. Это было сделано на следующем уроке, давая углеродный
объем диоксида 47,0 см 3 через 5 минут, но при более высоком
температура 27 o C (в градусах Кельвина звоните по этому номеру T 1 ,
а другая температура T 2 ). 0 см 3 , T 1 = 273 + 27 = 300K, T 2 = 273 +
22 = 295 КБ
0 см 3 , T 1 = 273 + 27 = 300K, T 2 = 273 +
22 = 295 КБ е.е. 27 o C)
есть второй источник ошибок. При более высокой температуре реакция
быстрее, поэтому вы обязательно получите больший объем газа, образованный за пять
минут. Поэтому вы рассчитаете более высокую скорость реакции, например, в см 3 газа в минуту при 27 o C, что могло бы произойти / было бы измерено при 22 o C
и поэтому несправедливое сравнение со всеми остальными результатами предыдущего
урок.
е.е. 27 o C)
есть второй источник ошибок. При более высокой температуре реакция
быстрее, поэтому вы обязательно получите больший объем газа, образованный за пять
минут. Поэтому вы рассчитаете более высокую скорость реакции, например, в см 3 газа в минуту при 27 o C, что могло бы произойти / было бы измерено при 22 o C
и поэтому несправедливое сравнение со всеми остальными результатами предыдущего
урок.