Строение атома
К содержанию
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Модель Томсона
Хотя слово атом в первоначальном значении — частица, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, которые называют субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны. Не сразу ученые пришли к правильным представлениям о строении атома. Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом — атом водорода — представляет собой положительно заряженный шар радиусом около 10 У более сложных атомов в положительно заряженном шаре находятся несколько электронов.
Однако модель Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
У более сложных атомов в положительно заряженном шаре находятся несколько электронов.
Однако модель Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
Опыт Резерфорда
Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906
 Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы.
Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на бо́льшие углы. Для этого он окружил фольгу сцинтилляционными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одно из двух тысяч) отклонилось на углы, большие 90º. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на бо́льшие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы.
Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на бо́льшие углы. Для этого он окружил фольгу сцинтилляционными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одно из двух тысяч) отклонилось на углы, большие 90º. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на бо́льшие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Другие заметки по физике
Полезная информация?
2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
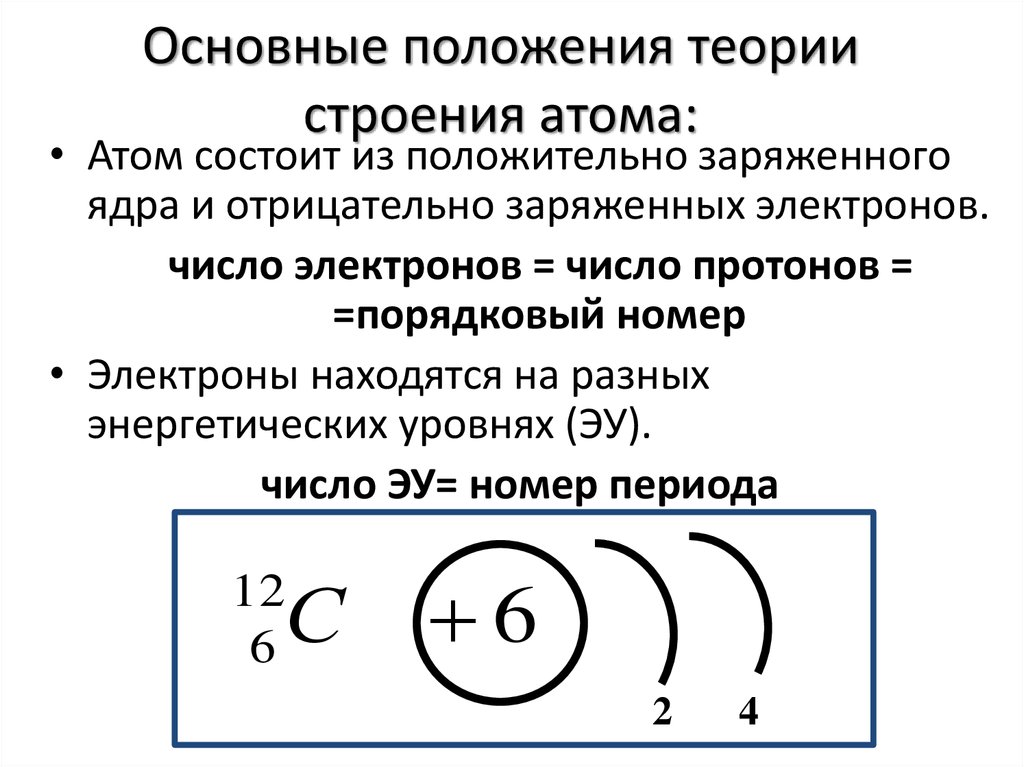
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций,
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 2.1.
Таблица 2. 1
1
Сведения о некоторых элементарных частицах.
Частица | Символ | Масса | Заряд | |||
кг | а.е.м. | Кл. | Усл. | |||
протон | p | 1, 673 10-27 | 1, 007276 | +1 | ||
нейтрон | n | 1, 675 10-27 | 1, 008665 | 0 | 0 | |
электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | -1 | |
Каждый
протон несёт положительный заряд,
численно равный заряду электрона. Нейтрон же не несёт никакого электрического
заряда. Отсюда следует вывод: заряд
ядра определяется числом протонов.
Количество протонов в ядре атома
совпадает с порядковым номером элемента
(Z)
в периодической системе элементов Д.И.
Менделеева.
Нейтрон же не несёт никакого электрического
заряда. Отсюда следует вывод: заряд
ядра определяется числом протонов.
Количество протонов в ядре атома
совпадает с порядковым номером элемента
(Z)
в периодической системе элементов Д.И.
Менделеева.
Как видно из данных табл. 2.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны
в ядре, называют ядерными. Это чрезвычайно
большие силы, действующие на очень
коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Природу этих сил изучает ядерная физика.
Исследования показали, что в природе атомы одного и того же элемента имеют различные атомные массы. Так, атомы хлора имеют массу 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавив к ним слева вверху индекс, указывающий массовое число изотопа, внизу – индекс, указывающий количество протонов, равное порядковому номеру (Z) элемента (). Пример – изотопы водорода:
–протий (1р, 0n)
–дейтерий (1р, 1n)
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы
с различным числом протонов Z и нейтронов
N, но с одинаковым числом нуклонов (Z+N)
называются изобарами, а с одинаковым
числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны
Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
Атомная теория – Структура атома
Атомы Молекулы, Атомная теория Джона Дальтона, Атомная, Молекулярная масса, Молекулярная концепция, Структура атома, Валентность, Атомный номер, Массовое число, Изотопы.
- Источник | Кредиты | Кредиты на фотографии: NCERT General Science
- Атомы большинства элементов не способны существовать независимо. Атомы образуют молекул

- Молекула — это, как правило, группа из двух или более атомов, которые химически связаны друг с другом, то есть прочно удерживаются вместе силами притяжения.
- Молекула может быть определена как мельчайшая частица элемента или соединения, способная к самостоятельному существованию и проявляющая все свойства этого вещества.
- Атомы одного и того же элемента или разных элементов могут соединяться вместе, образуя молекулы.
- Закон сохранения массы: Закон сохранения массы гласит, что масса не может быть ни создана, ни уничтожена в результате химической реакции.
- Закон постоянных пропорций: Лавуазье вместе с другими учеными отметил, что многие соединения состоят из двух или более элементов, и каждое такое соединение имеет одни и те же элементы в одинаковых пропорциях, независимо от того, откуда произошло соединение или кто его приготовил. .
- В таком соединении, как вода, отношение массы водорода к массе кислорода всегда равно 1:8.
 Таким образом, при разложении 9 г воды всегда получается 1 г водорода и 8 г кислорода.
Таким образом, при разложении 9 г воды всегда получается 1 г водорода и 8 г кислорода. - Закон постоянных пропорций также известен как закон определенных пропорций . Этот закон был сформулирован Прустом как «в химическом веществе элементы всегда присутствуют в определенных соотношениях по массе ».
- Проблема, с которой столкнулись ученые, заключалась в том, чтобы дать соответствующие объяснения вышеуказанным законам.
- Британский химик Джон Дальтон создал основную теорию о природе материи.
- Он взял название «атомы», данное греками, и сказал, что мельчайшие частицы материи — это атомы. Его теория основывалась на законах химического соединения.
- Теория атома Дальтона дала объяснение закону сохранения массы и закону определенных пропорций.
- В 1808 году он представил свою атомистическую теорию, ставшую поворотным пунктом в изучении материи.
- Согласно атомной теории Дальтона, вся материя, будь то элемент, соединение или смесь, состоит из маленьких частиц, называемых атомами.
 Постулаты этой теории можно сформулировать следующим образом:
Постулаты этой теории можно сформулировать следующим образом:
- Вся материя состоит из мельчайших частиц, называемых атомами.
- Атомы — неделимые частицы, которые не могут образоваться или разрушиться в результате химической реакции.
- Атомы данного элемента идентичны по массе и химическим свойствам
- Атомы разных элементов имеют разные массы и химические свойства.
- Атомы соединяются в соотношении небольших целых чисел, образуя соединения
- Относительное число и виды атомов в данном соединении постоянны.
- Дальтон был первым ученым, который использовал символы для обозначения элементов в особом смысле. Когда он использовал символ для обозначения элемента, он также имел в виду определенное количество этого элемента, то есть один атом этого элемента.
- Берзилиус предложил составлять символы элементов из одной или двух букв названия элемента.
- Вначале названия элементов производились от названия места, где они были впервые обнаружены.
 Например, название медь было взято с кипра.
Например, название медь было взято с кипра. - Некоторые названия были взяты из определенных цветов. Например, слово «золото» произошло от английского слова, означающего «желтый».
- В настоящее время IUPAC (Международный союз теоретической и прикладной химии) утверждает названия элементов.
- Многие символы представляют собой первые одну или две буквы имени элемента на английском языке.
- Первая буква символа всегда пишется как заглавная (верхний регистр), а вторая буква как строчная (нижний регистр).
- Молекулы элементов: Молекулы элемента состоят из атомов одного типа.
- Молекулы многих элементов, таких как аргон (ar), гелий (he) и т. д. состоят только из одного атома этого элемента. Но это не относится к большинству неметаллов.
- Например, молекула кислорода состоит из двух атомов кислорода и поэтому известна как двухатомная молекула. Если в молекулу соединить 3 атома кислорода вместо обычных 2, получится озон.
 Число атомов, составляющих молекулу, известно как ее атомность .
Число атомов, составляющих молекулу, известно как ее атомность . - Молекулы металлов и некоторых других элементов, например углерода, не имеют простой структуры, а состоят из очень большого и неопределенного числа атомов, связанных между собой.
- Молекулы соединений: Атомы различных элементов соединяются вместе в определенных пропорциях, образуя молекулы соединений.
- Соединения, состоящие из металлов и неметаллов, содержат заряженные частицы. Заряженные частицы известны как ионы.
- Ион — заряженная частица, которая может быть заряжена отрицательно или положительно. Отрицательно заряженный ион называется « анион », а положительно заряженный ион — « катион ».
- Возьмем, к примеру, хлорид натрия (NaCl). Составляющими его частицами являются положительно заряженные ионы натрия (na+) и отрицательно заряженные ионы хлора (cl–).
- Ионы могут состоять из одного заряженного атома или группы атомов, имеющих общий заряд.
 Группа атомов, несущих заряд, известна как многоатомный ион .
Группа атомов, несущих заряд, известна как многоатомный ион .
Написание химических формул
- Химическая формула соединения представляет собой символическое представление его состава.
- Комбинирующая способность (или емкость) элемента известна как его валентность . Валентность можно использовать, чтобы выяснить, как атомы элемента будут соединяться с атомом (атомами) другого элемента, образуя химическое соединение. Валентность атома элемента можно рассматривать как руки или руки этого атома.
- Правила, которым вы должны следовать при написании химической формулы, следующие:
- Валентность или заряды иона должны быть сбалансированы.
- Если соединение состоит из металла и неметалла, сначала пишется название или символ металла. Например: оксид кальция (CaO), хлорид натрия (NaCl), сульфид железа (FeS), оксид меди (CuO) и т. д.
- В соединениях, образованных многоатомными ионами, ион заключен в скобки перед записью числа, чтобы указать соотношение.
 Обратите внимание, что формула гидроксида кальция Ca(Oh)2, а не CaOh3. Мы используем скобки, когда у нас есть два или более одинаковых ионов в формуле. Здесь скобка вокруг oh с нижним индексом 2 указывает на то, что к одному атому кальция присоединены две гидроксильные (Oh) группы. Другими словами, в гидроксиде кальция имеется по два атома кислорода и водорода.
Обратите внимание, что формула гидроксида кальция Ca(Oh)2, а не CaOh3. Мы используем скобки, когда у нас есть два или более одинаковых ионов в формуле. Здесь скобка вокруг oh с нижним индексом 2 указывает на то, что к одному атому кальция присоединены две гидроксильные (Oh) группы. Другими словами, в гидроксиде кальция имеется по два атома кислорода и водорода.
- Наиболее замечательной концепцией, предложенной Дальтоном в атомной теории, была атомная масса.
- По его словам, каждый элемент имел характерную атомную массу. Одна атомная единица массы — это единица массы, равная ровно одной двенадцатой (1/12-й) массы одного атома углерода-12 .
- Найдены относительные атомные массы всех элементов по отношению к атому углерода-12.
- Молекулярная масса вещества представляет собой сумму атомных масс всех атомов в молекуле вещества. Следовательно, это относительная масса молекулы, выраженная в атомных единицах массы (u).
- Формульная единица массы вещества представляет собой сумму атомных масс всех атомов в формульной единице соединения.
 23 [10 в степени 23]. Это экспериментально полученное значение. Это число называется 923 определяется как количество атомов ровно в 12 г углерода-12.
23 [10 в степени 23]. Это экспериментально полученное значение. Это число называется 923 определяется как количество атомов ровно в 12 г углерода-12. - Моль – это количество вещества, которое содержит такое же количество частиц (атомов/ионов/молекул/формульных единиц и т. д.), сколько атомов содержится ровно в 12 г углерода-12.
- К 1900 году было известно, что атом не является простой неделимой частицей, но содержит по крайней мере одну субатомную частицу – электрон , идентифицированный Дж. Томсоном .
- Еще до того, как был идентифицирован электрон, Гольдштейн в 1886 году обнаружил наличие протонов , которые были заряжены положительно.
- Протоны имели заряд, равный по величине, но противоположный по знаку заряду электрона. Его масса была примерно в 2000 раз больше массы электрона.
- Масса электрона считается незначительной, а его заряд равен минус единице.
 Казалось весьма вероятным, что атом состоит из протонов и электронов, взаимно уравновешивающих свои заряды.
Казалось весьма вероятным, что атом состоит из протонов и электронов, взаимно уравновешивающих свои заряды. - Также оказалось, что протоны находятся внутри атома, тогда как электроны можно легко отделить, но не протоны.
- Атомная теория Дальтона предполагала, что атом неделим и неразрушим. Но открытие двух фундаментальных частиц (электронов и протонов) внутри атома привело к провалу этого аспекта атомной теории Дальтона.
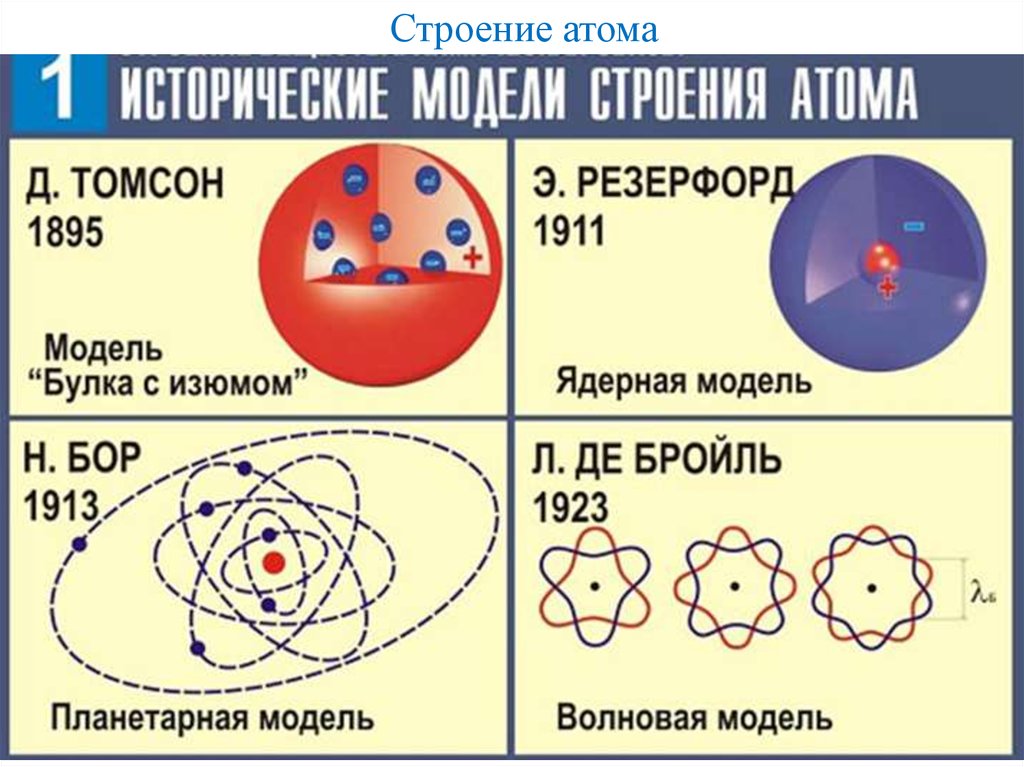
- Тогда считалось необходимым знать, как электроны и протоны расположены внутри атома. Для объяснения этого многие ученые предлагали различные модели атома. Дж.Дж. Томсон был первым, кто предложил модель строения атома 9.0006
Модель атома Томсона
- Дж. Томсон (1856-1940), британский физик. В 1906 году он был удостоен Нобелевской премии по физике за работу по открытию электронов.
- Томсон предложил модель атома, аналогичную модели арбуза. Положительный заряд в атоме разбросан повсюду, как красная съедобная часть арбуза, а электроны усеяны положительно заряженной сферой, как семечки в арбузе .

Томсон предположил, что:
- Атом состоит из положительно заряженной сферы, в которую встроены электроны.
- Отрицательный и положительный заряды равны по величине. Итак, атом в целом электрически нейтрален.
- Хотя модель Томсона объясняла, что атомы электрически нейтральны, результаты экспериментов, проведенных другими учеными, не могли быть объяснены этой моделью, как мы увидим ниже.
Модель атома Резерфорда
- Резерфорд был известен как «отец» ядерной физики. Он известен своей работой по радиоактивности и открытием ядра атома с помощью эксперимента с золотой фольгой. Он получил Нобелевскую премию по химии в 1908 году.
- Эрнест Резерфорд (эксперимент с золотой фольгой) интересовался, как электроны расположены внутри атома. Резерфорд разработал для этого эксперимент. В этом эксперименте быстро движущиеся альфа-(α)-частицы падали на тонкую золотую фольгу.
- Он выбрал золотую фольгу, потому что хотел, чтобы слой был как можно тоньше.
 Эта золотая фольга имела толщину около 1000 атомов. (α)-частицы представляют собой двухзарядные ионы гелия. Поскольку они имеют массу 4 u, быстро движущиеся α-частицы обладают значительной энергией.
Эта золотая фольга имела толщину около 1000 атомов. (α)-частицы представляют собой двухзарядные ионы гелия. Поскольку они имеют массу 4 u, быстро движущиеся α-частицы обладают значительной энергией. - Ожидалось, что α-частицы будут отклоняться субатомными частицами в атомах золота. Поскольку α-частицы были намного тяжелее протонов, он не ожидал увидеть больших отклонений.
- Но эксперимент по рассеянию α-частиц дал совершенно неожиданные результаты. Были сделаны следующие наблюдения:
- Большинство быстро движущихся α-частиц прошли прямо через золотую фольгу.
- Часть α-частиц отклонялась фольгой на малые углы.
- Удивительно, но одна из каждых 12000 частиц отскакивала.
- По словам Резерфорда, «этот результат был почти таким же невероятным, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас».
Из эксперимента по рассеянию α-частиц Резерфорд пришел к выводу, что–
- Большая часть пространства внутри атома пуста, потому что большая часть α-частиц прошла сквозь золотую фольгу, не отклонившись.

- Очень немногие частицы отклонились от своего пути, что указывает на то, что положительный заряд атома занимает очень мало места.
- Очень небольшая часть α-частиц была отклонена, что указывает на то, что весь положительный заряд и масса атома золота были сосредоточены в очень маленьком объеме внутри атома.
- В атоме есть положительно заряженный центр, называемый ядром . Почти вся масса атома находится в ядре.
- Электроны вращаются вокруг ядра по четко определенным орбитам.
- Размер ядра очень мал по сравнению с размером атома.
Недостатки модели атома Резерфорда
- Ожидается, что орбитальное вращение электрона не будет стабильным. Любая частица на круговой орбите претерпела бы ускорение.
 Во время ускорения заряженные частицы будут излучать энергию. Таким образом, вращающийся электрон потеряет энергию и в конце концов упадет на ядро. Если бы это было так, то атом был бы крайне нестабилен и, следовательно, материя не существовала бы в той форме, которую мы знаем. Мы знаем, что атомы достаточно стабильны.
Во время ускорения заряженные частицы будут излучать энергию. Таким образом, вращающийся электрон потеряет энергию и в конце концов упадет на ядро. Если бы это было так, то атом был бы крайне нестабилен и, следовательно, материя не существовала бы в той форме, которую мы знаем. Мы знаем, что атомы достаточно стабильны.
Модель атома Бора
- Чтобы преодолеть возражения, выдвинутые против модели атома Резерфорда, Нильс Бор выдвинул следующие постулаты о модели атома:
- Внутри атома разрешены только определенные особые орбиты, известные как дискретные орбиты электронов
- При вращении по дискретным орбитам электроны не излучают энергию
- Эти орбиты или оболочки называются энергетическими уровнями. Уровни энергии в атоме показаны на рис. ниже.
- Эти орбиты или оболочки обозначаются буквами k,l,m,n,… или цифрами, n=1,2,3,4,….
Как электроны распределены по разным орбитам (оболочкам)?
- Распределение электронов по различным орбитам атома было предложено Бором и Бери.

- При записи количества электронов на различных энергетических уровнях или оболочках соблюдаются следующие правила:
- максимальное количество электронов, присутствующих в оболочке, определяется формулой 92 = 32 и так далее.
- Максимальное количество электронов, которое может разместиться на самой внешней орбите, равно 8 .
- Электроны не размещаются в данной оболочке, если внутренние оболочки не заполнены. То есть оболочки заполняются ступенчато.
Нейтроны
- В 1932 году Чедвик открыл еще одну субатомную частицу, не имевшую заряда и массу, почти равную массе протона. В конечном итоге он был назван нейтрон .
- Нейтроны присутствуют в ядре всех атомов, кроме водорода . В общем случае нейтрон обозначается буквой «n». Таким образом, масса атома определяется суммой масс протонов и нейтронов, присутствующих в ядре [массой электронов можно пренебречь].

- Мы узнали, как электроны в атоме расположены на разных оболочках/орбитах.
- Электроны, присутствующие во внешней оболочке атома, известны как валентных электронов .
- Из схемы Бора-бери мы также знаем, что на самой внешней оболочке атома может разместиться максимум 8 электронов.
- Было замечено, что атомы элементов, имеющие полностью заполненную внешнюю оболочку, проявляют небольшую химическую активность. Другими словами, их комбинирующая способность или валентность равна нулю. Из этих инертных элементов атом гелия имеет два электрона на самой внешней оболочке, а все остальные элементы имеют атомы с восемью электронами на самой внешней оболочке.
- Объединяющая способность атомов других элементов, то есть их склонность реагировать и образовывать молекулы с атомами одного и того же или разных элементов, объяснялась, таким образом, попыткой достичь полностью заполненной самой внешней оболочки .

- Говорят, что самая внешняя оболочка с восемью электронами обладает октетом . Таким образом, атомы будут реагировать, чтобы получить октет в самой внешней оболочке. Это было сделано путем обмена, получения или потери электронов.
- Количество электронов, полученных, потерянных или разделенных, чтобы образовать октет электронов в самой внешней оболочке, дает нам непосредственно комбинирующую способность элемента, то есть валентность. Например, атомы водорода/лития/натрия содержат по одному электрону на внешней оболочке, поэтому каждый из них может потерять один электрон. Итак, говорят, что они имеют валентность один.
- Скажите, какая валентность у магния и алюминия? Это два и три, соответственно, потому что у магния два электрона на внешней оболочке, а у алюминия три электрона на самой внешней оболочке.
- Если число электронов в самой внешней оболочке атома близко к его полной емкости, то валентность определяется по-другому. Например, атом фтора имеет 7 электронов на внешней оболочке, и его валентность может быть равна 7.
 Но фтору легче получить один электрон, чем потерять семь электронов. Следовательно, его валентность определяется вычитанием семи электронов из октета, и это дает вам валентность фтора, равную единице. Поэтому атом каждого элемента обладает определенной объединяющей способностью, называемой его валентностью.
Но фтору легче получить один электрон, чем потерять семь электронов. Следовательно, его валентность определяется вычитанием семи электронов из октета, и это дает вам валентность фтора, равную единице. Поэтому атом каждого элемента обладает определенной объединяющей способностью, называемой его валентностью.
- Мы знаем, что протоны присутствуют в ядре атома. Именно число протонов атома определяет его атомный номер. Обозначается буквой «з».
- Все атомы элемента имеют одинаковый атомный номер z. Фактически, элементы определяются количеством протонов, которыми они обладают.
- Для водорода z = 1, потому что в атоме водорода в ядре присутствует только один протон. Аналогично, для углерода z = 6, .
- Следовательно, 9Атомный номер 0010 определяется как общее количество протонов, присутствующих в ядре атома
- Изучив свойства субатомных частиц атома, мы можем заключить, что масса атома практически обусловлена только протонами и нейтронами.
 Они присутствуют в ядре атома. Поэтому протоны и нейтроны также называются нуклонами . Следовательно, масса атома находится в его ядре.
Они присутствуют в ядре атома. Поэтому протоны и нейтроны также называются нуклонами . Следовательно, масса атома находится в его ядре. - Например, масса углерода равна 12 ед., потому что он имеет 6 протонов и 6 нейтронов, 6 ед. + 6 ед. = 12 ед. Точно так же масса алюминия составляет 27 единиц (13 протонов + 14 нейтронов).
- Массовое число определяется как сумма общего числа протонов и нейтронов, присутствующих в ядре атома .
- В обозначении атома атомный номер, массовое число и символ элемента должны быть записаны как:
- В природе идентифицирован ряд атомов некоторых элементов, которые имеют одинаковый атомный номер, но разные массовые числа .
- Например, возьмем атом водорода, он состоит из трех видов атомов, а именно протий ( 1h2), дейтерий ( 2h2 или d) и тритий ( 3h2 или t) . Атомный номер каждого из них равен 1, а массовое число равно 1, 2 и 3 соответственно.
 Другими такими примерами являются (i) углерод, 12C6 и 14C6 (ii) хлор, 35Cl17 и 37Cl17 и т. д.
Другими такими примерами являются (i) углерод, 12C6 и 14C6 (ii) хлор, 35Cl17 и 37Cl17 и т. д. - На основании этих примеров изотопы определяются как атомы одного и того же элемента, имеющие одинаковый атомный номер, но разные массовые числа. Следовательно, мы можем сказать, что существует три изотопа атома водорода, а именно протий, дейтерий и тритий.
- Многие элементы состоят из смеси изотопов. Каждый изотоп элемента является чистым веществом .
- Химические свойства изотопов сходны , но их физические свойства различны .
- Хлор встречается в природе в двух изотопных формах с массами 35 ед. и 37 ед. в соотношении 3:1. Очевидно, возникает вопрос: что же принять за массу атома хлора?
- Масса атома любого природного элемента принимается за средняя масса всех встречающихся в природе атомов этого элемента . Если бы у элемента не было изотопов, то масса его атома была бы равна сумме протонов и нейтронов в нем.
 Но если элемент встречается в изотопных формах, то мы должны знать процентное содержание каждой изотопной формы, а затем вычисляется средняя масса.
Но если элемент встречается в изотопных формах, то мы должны знать процентное содержание каждой изотопной формы, а затем вычисляется средняя масса.
Применение изотопов
- Поскольку химические свойства всех изотопов элемента одинаковы, обычно нас не интересует смесь. Но некоторые изотопы обладают особыми свойствами, которые делают их полезными в различных областях. Некоторые из них:
- Изотоп урана используется в качестве топлива в ядерных реакторах.
- Изотоп кобальта используется при лечении рака.
- Изотоп йода используется при лечении зоба.
Изобары
- Рассмотрим два элемента — кальций, атомный номер 20, и аргон, атомный номер 18. Число электронов в этих атомах разное, но массовое число обоих этих элементов равно 40. То есть общее число нуклонов одинаково в атомах этой пары элементов.
- Атомы различных элементов с разными атомными номерами, которые имеют одинаковое массовое число, известны как изобары .

- Кредит за открытие электронов и протонов принадлежит Дж. Томсону и Э. Гольдштейну соответственно. Дж.Дж. Томсон предположил, что электроны погружены в положительную сферу.
- Эксперимент Резерфорда по рассеянию альфа-частиц привел к открытию атомного ядра .
- Модель атома Резерфорда предполагала, что внутри атома находится очень маленькое ядро, вокруг которого вращаются электроны. Эта модель не могла объяснить стабильность атома.
- Модель атома Нильса Бора оказалась более удачной. Он предположил, что электроны распределены по различным оболочкам с дискретной энергией вокруг ядра . Если атомные оболочки полные, то атом будет стабильным и менее реактивным.
- Чедвик обнаружил присутствие нейтронов в ядре атома.
- Итак, тремя субатомными частицами атома являются: (i) электроны, (ii) протоны и (iii) нейтроны.

- Электроны заряжены отрицательно, протоны заряжены положительно, а нейтроны не имеют заряда. Масса электрона примерно в 1/2000 раза больше массы атома водорода. Массы протона и нейтрона приняты за одну единицу.
- Оболочки атома обозначаются как k,l,m,n,….
- Валентность – это объединяющая способность атома.
- Атомный номер элемента равен количеству протонов в ядре его атома.
- Массовое число атома равно количеству нуклонов в его ядре
- Изотопы — это атомы одного и того же элемента, имеющие разные массовые числа.
- Изобары — это атомы, имеющие одинаковое массовое число, но разные атомные номера.
- Элементы определяются количеством протонов, которыми они обладают.
Делиться – значит заботиться !!
Обновления информационного бюллетеня
Подпишитесь на нашу рассылку и не пропустите важное обновление!!
Универсальное решение для защиты окружающей среды
PMF IAS Environment — это универсальное решение для всех ваших потребностей, связанных с охраной окружающей среды для экзамена UPSC по гражданской службе! Это самая продаваемая книга по окружающей среде с самым высоким рейтингом на Amazon со средней оценкой 4,6/5
PMF IAS Environment PDF-файл доступен на странице загрузок Environment
Печатная копия PMF IAS Environment доступна на Amazon, Flipkart и JioMart
образец файла
Только что выпущенный. Получи это сейчас
!
Получи это сейчас
!
Получить на Amazon
Получить на Flipkart
Получить на JioMart
Лучшее, что вы можете получить для окружающей среды!Доступно как Красочный PDF Твердая копия
Доступно как Красочный PDF Твердая копия
PMF IAS Physical Geography
PMF IAS Physical Geography — единственный в своем роде! Благодаря многочисленным красочным диаграммам и картам книга оживляет концепции!
PMF IAS Physical Geography PDF-файл доступен на странице загрузки географии
PMF IAS Physical Geography Печатная копия доступна на Amazon, Flipkart и JioMart
Только что выпущенный. Получи это сейчас !
образец файла
Получить на Amazon
Получить на Flipkart
Получить на JioMart
Актуальные
PMF IAS Geography Hardcopy: Physical (выпущено), Indian, World & Economic (где-то в июле 2023 г. ) Download Environment Second Edition PDF. Печатная копия доступна в Дели, Amazon, Flipkart (продавец: Booksmania) и JioMart (продавец: Delhi Open Books) Прямые и косвенные источники для понимания внутреннего строения Земли Парниковый эффект, глобальное потепление, связывание углерода
) Download Environment Second Edition PDF. Печатная копия доступна в Дели, Amazon, Flipkart (продавец: Booksmania) и JioMart (продавец: Delhi Open Books) Прямые и косвенные источники для понимания внутреннего строения Земли Парниковый эффект, глобальное потепление, связывание углеродаYear(s) = Срок действия загрузок
Срок действия 1 год == Срок действия ссылок для скачивания (как статических, так и текущих событий ) составляет 1 год с даты покупки1 9000
2 года действия == Срок действия ссылок для скачивания (как статических, так и текущих событий ) составляет 2 года с даты покупки .
Мы настоятельно рекомендуем 2-летний план, так как цикл UPSC длится около 2, Годы .
СКИДКА 10 % на 1-летний план действия 30 % СКИДКА на 2-летний план действия
Например,Если вы приобрели банкноты с надписью « Срок действия загрузки == 1 год », по номеру 14/0010 2023 , то вы сможете загрузить файлы Статические файлы + Текущие события до 14/04/2024 .
Если вы приобрели банкноты со значением « Срок действия загрузки == 2 года », по номеру 14/04/2023 , то вы сможете загрузить файлы Статические файлы + Текущие события до 15/04/2025 .
Если мы выпустим обновленные (новые) выпуски статических файлов в течение периода вашего членства , вы сможете загрузить их без дополнительной оплаты .
Независимо от выбранного вами пакета, актуальные новости географии, окружающей среды, науки и техники и индийского сельского хозяйства доступны от , январь 2022 г.
Текущие события 2021 г. и ранее доступны бесплатно в папке Google Диска PMF IAS.
После оплаты вам необходимо войти на страницу загрузки для загрузки файлов ( проверьте свою электронную почту для получения данных для входа ).
Atomic Theory and Structure of the Atom
Select country/regionUnited States of AmericaUnited KingdomAfghanistanÅland IslandsAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntigua and BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelgiumBelizeBeninBermudaBhutanBoliviaBonaire, Sint Eustatius and SabaBosnia and HerzegovinaBotswanaBrazilBritish Indian Ocean TerritoryBritish Virgin IslandsBruneiBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCanary IslandsCape VerdeCayman IslandsCentral African RepublicChadChileChinaChristmas IslandCocos (Keeling) IslandsColombiaComorosCongoCook IslandsCosta RicaCroatiaCubaCuraçaoCyprusCzech RepublicDemocratic Republic of the CongoDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland Islands (Malvinas)Faroe IslandsFederated States of MicronesiaFijiFinlandFranceFrench GuianaFrench PolynesiaGabonGambiaGeorgiaGermanyGhanaGibraltarGreeceGreenlandGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHondurasHong KongHungaryIcelandIndiaIndonesiaIranIraqIrelandIsle of ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKuwaitKyrgyzstanLaoLatviaLesothoLiberiaLibyaLiechtensteinLuxembourgMacaoMacedoniaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMoldovaMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNiueNorfolk IslandNorth KoreaNorthern Mariana IslandsNorwayOmanPakistanPalauPanamaPapua New GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarRéunionRomaniaRwandaSaint BarthélemySaint HelenaSaint Kitts and NevisSaint LuciaSaint Martin (French part)Saint Pierre and MiquelonSaint Vincent and the GrenadinesSamoaSan MarinoSao Tome and PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Maarten (Dutch part)SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Georgia and the South Sandwich IslandsSouth KoreaSouth SudanSpainSri LankaSudanSurinameSvalbard and Jan MayenSwazilandSwedenSwitzerlandSyriaTaiwanTajikistanTanzaniaThailandTimor LesteTogoTokelauTongaTrinidad and TobagoTunisiaTurkeyTurkmenistanTurks and Caicos IslandsTuvaluUgandaUkraineUnited Arab EmiratesUruguayUS Virgin IslandsUzbekistanVanuatuVatican CityVenezuelaVietnamWallis and FutunaWestern SaharaYemenZambiaZimbabwe
Варианты покупки недоступны.
Бесплатная доставка по всему миру
Нет минимального заказа
Описание
Атомная и ядерная химия, том 1: Атомная теория и строение атома представляет современные представления об атомной теории и строении атома на фоне их исторического развития . Рассматриваемые темы включают классификацию элементов; атомы и электроны; волновая механическая модель атома; и определение атомных весов. Этот том состоит из шести глав и начинается с обсуждения происхождения атомной теории, с акцентом на роль Джона Дальтона, гипотезу Авогадро и введение в законы химических соединений. В следующих главах рассматривается работа первых ученых, которая привела к разработке периодической таблицы элементов; использование числа Авогадро для определения реальных масс атомов и молекул; и строение атома. Основные результаты простой волновой механической обработки суммированы в следующей главе. Эта книга завершается рассмотрением достижений в области определения атомных весов. Включены некоторые краткие заметки о характере и личности великих ученых, которые упоминаются в тексте. Книга предназначена для студентов и специалистов-практиков в области химии и физики.
Включены некоторые краткие заметки о характере и личности великих ученых, которые упоминаются в тексте. Книга предназначена для студентов и специалистов-практиков в области химии и физики.
СОДЕРЖАНИЕ
-
ПРЕДИСЛОВИЕ
ПРЕДИСЛОВИЕ
1 Классическая теория атомной теории
Происхождение атомной теории
Dalton
СООБЩЕНИЯ 9069. СООБЩЕНИЯ 9069. СОМЕРЖА
. СОМЕРЖА 9069. СОМЕРИИ ГОЛОВА 9069. Люссак
Авогадро
Берцелиус
Дюма
Каннизаро
2 Классификация элементов
Доберейнер и Закон Триад
Ньюлендс и Закон
Октав
Периодический закон, Менделеев и Лотар Мейер
Сравнение «экакремния» с германием
Атомный
Объем
Периодическая таблица Менделеева
Обсуждение основных характеристик таблицы
Состояние окисления
3 Атомы и электроны
Броуновское движение
Проводимость электричества через газы
Катодные лучи и рентгеновские лучи
Положительные лучи
Работа Томсона по определению e/m для катодных лучей
e/m только с поперечным магнитным полем
e/m с тонкой лучевой трубкой
Масса электрона
Определение e Таунсендом
Определение e Милликена
Измерение радиусов молекул и атомов: (i) уравнение Ван-де-Ваальса, (ii) работа Ленгмюра с поверхностью Фильмы, (iii) рентгеновская дифракция
Определение числа Авогадро: (i) метод Резерфорда и Гейгера с использованием радиоактивности, (ii) метод Перрина из броуновского движения, (iii) метод Милликена с использованием значения e, (iv) метод решетчатых интервалов
4 Структура атома
Модель Томсона
Рассеяние α-частиц золотой фольгой
Модель ядра Резерфорда
Работа Мозли по измерению рентгеновских спектров
Значение атомного номера
Оптические спектры
Возбуждение спектров
Излучение и Спектры поглощения
Спектр водорода
Серия спектров
Тонкая структура
Излучение черного тела
Квантовая теория Планка
Наблюдение Ленардом фотоэлектрического эффекта
Постулат Эйнштейна о фотоне
Теория атома Резерфорда-Бора
5 Развитие волновой механической модели атома
Расширение теории Бора
Электронная структура атома Резерфорда-Бора-Зоммерфельда, принцип запрета Паули, квантовая теория Числа, уровни энергии
Потенциалы ионизации
Кривые энергии ионизации
Энергии ионизации и химические свойства
Слабые стороны трактовки Бора-Зоммерфельда
Теория де Бройля о двойственной природе материи
Принцип неопределенности Гейзенберга
Волновой механический атом
Теория Шредингера и расширение Борна
6 Определение атомного веса
Разработка эталонов атомного веса
Постоянство атомного веса
Физические методы определения атомного веса, методы определения плотности пара
Предельная плотность
Определение атомарности
Измерения плотности газа Рейно
Развитие баланса плавучести Уитлоу-Грея
Определение атомного веса радона Рамзи и Уитлоу-Грея
Работа Томсона по анализу положительных лучей
Разработка масс-спектрографа Астона
Масс-спектрометры
Фракция упаковки Астона
Энергия связи ядер
Химические методы определения атомных весов
Анализ воды Дюма
Анализ воды Морли
Определение атомного веса Ричарда 9090 Определение атомного веса
Приложение 1.


 Таким образом, при разложении 9 г воды всегда получается 1 г водорода и 8 г кислорода.
Таким образом, при разложении 9 г воды всегда получается 1 г водорода и 8 г кислорода. Постулаты этой теории можно сформулировать следующим образом:
Постулаты этой теории можно сформулировать следующим образом: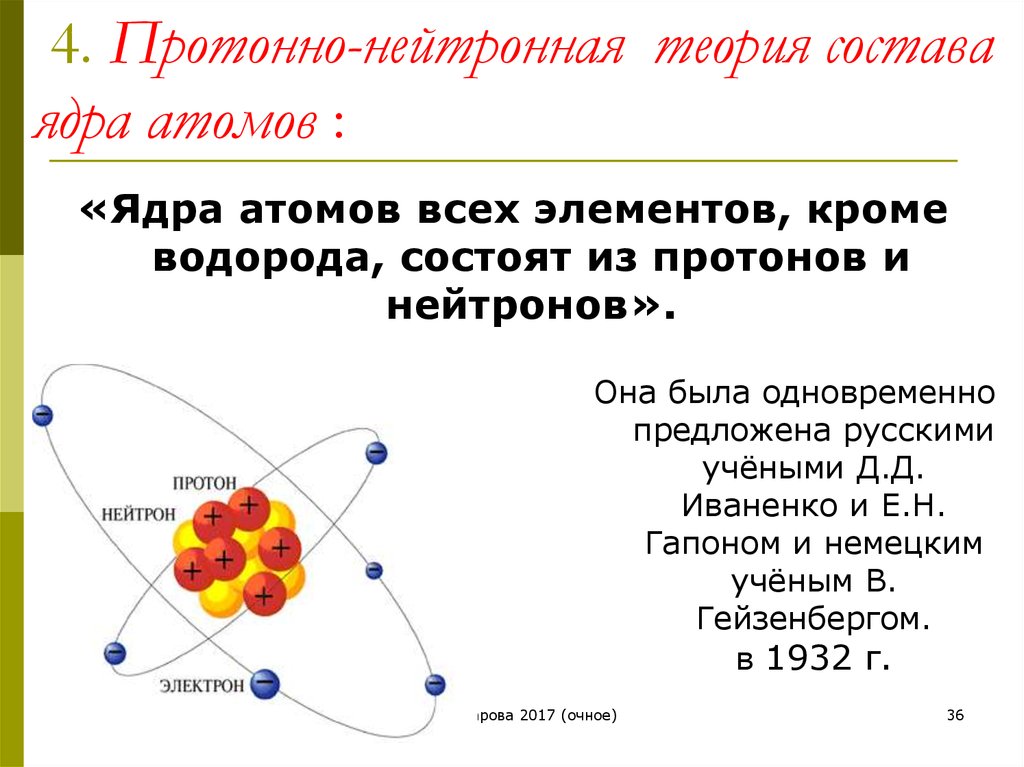 Например, название медь было взято с кипра.
Например, название медь было взято с кипра. Число атомов, составляющих молекулу, известно как ее атомность .
Число атомов, составляющих молекулу, известно как ее атомность . Группа атомов, несущих заряд, известна как многоатомный ион .
Группа атомов, несущих заряд, известна как многоатомный ион . Обратите внимание, что формула гидроксида кальция Ca(Oh)2, а не CaOh3. Мы используем скобки, когда у нас есть два или более одинаковых ионов в формуле. Здесь скобка вокруг oh с нижним индексом 2 указывает на то, что к одному атому кальция присоединены две гидроксильные (Oh) группы. Другими словами, в гидроксиде кальция имеется по два атома кислорода и водорода.
Обратите внимание, что формула гидроксида кальция Ca(Oh)2, а не CaOh3. Мы используем скобки, когда у нас есть два или более одинаковых ионов в формуле. Здесь скобка вокруг oh с нижним индексом 2 указывает на то, что к одному атому кальция присоединены две гидроксильные (Oh) группы. Другими словами, в гидроксиде кальция имеется по два атома кислорода и водорода. 23 [10 в степени 23]. Это экспериментально полученное значение. Это число называется 923 определяется как количество атомов ровно в 12 г углерода-12.
23 [10 в степени 23]. Это экспериментально полученное значение. Это число называется 923 определяется как количество атомов ровно в 12 г углерода-12. Казалось весьма вероятным, что атом состоит из протонов и электронов, взаимно уравновешивающих свои заряды.
Казалось весьма вероятным, что атом состоит из протонов и электронов, взаимно уравновешивающих свои заряды. Эта золотая фольга имела толщину около 1000 атомов. (α)-частицы представляют собой двухзарядные ионы гелия. Поскольку они имеют массу 4 u, быстро движущиеся α-частицы обладают значительной энергией.
Эта золотая фольга имела толщину около 1000 атомов. (α)-частицы представляют собой двухзарядные ионы гелия. Поскольку они имеют массу 4 u, быстро движущиеся α-частицы обладают значительной энергией.
 Во время ускорения заряженные частицы будут излучать энергию. Таким образом, вращающийся электрон потеряет энергию и в конце концов упадет на ядро. Если бы это было так, то атом был бы крайне нестабилен и, следовательно, материя не существовала бы в той форме, которую мы знаем. Мы знаем, что атомы достаточно стабильны.
Во время ускорения заряженные частицы будут излучать энергию. Таким образом, вращающийся электрон потеряет энергию и в конце концов упадет на ядро. Если бы это было так, то атом был бы крайне нестабилен и, следовательно, материя не существовала бы в той форме, которую мы знаем. Мы знаем, что атомы достаточно стабильны.

 Но фтору легче получить один электрон, чем потерять семь электронов. Следовательно, его валентность определяется вычитанием семи электронов из октета, и это дает вам валентность фтора, равную единице. Поэтому атом каждого элемента обладает определенной объединяющей способностью, называемой его валентностью.
Но фтору легче получить один электрон, чем потерять семь электронов. Следовательно, его валентность определяется вычитанием семи электронов из октета, и это дает вам валентность фтора, равную единице. Поэтому атом каждого элемента обладает определенной объединяющей способностью, называемой его валентностью.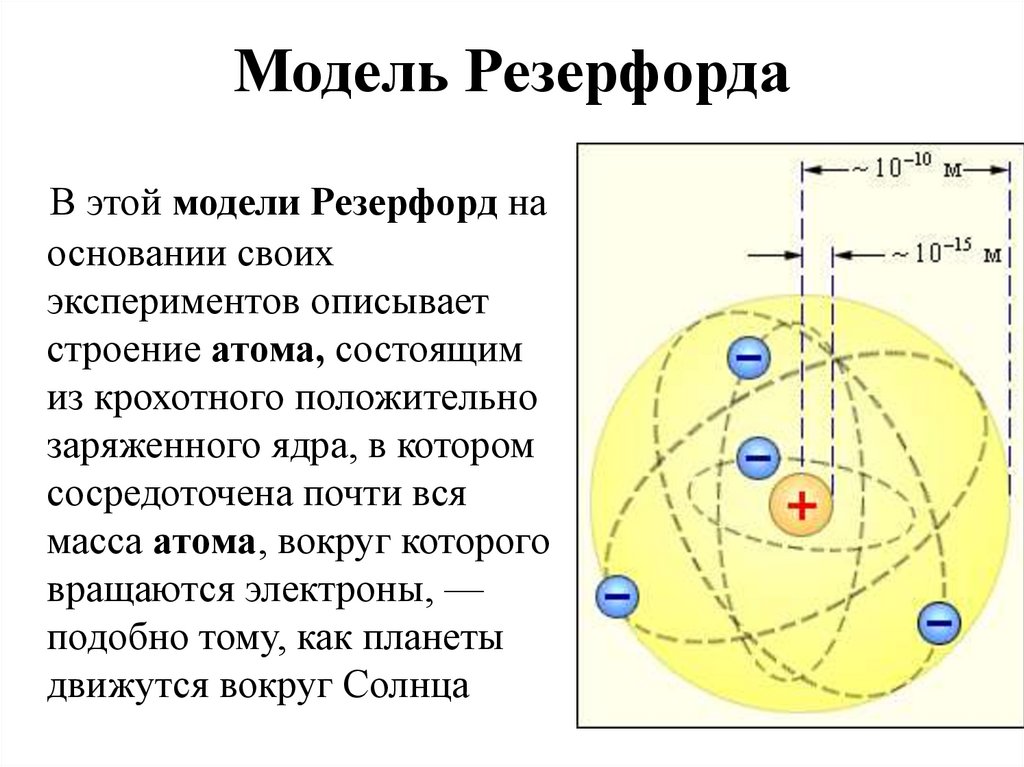 Они присутствуют в ядре атома. Поэтому протоны и нейтроны также называются нуклонами . Следовательно, масса атома находится в его ядре.
Они присутствуют в ядре атома. Поэтому протоны и нейтроны также называются нуклонами . Следовательно, масса атома находится в его ядре.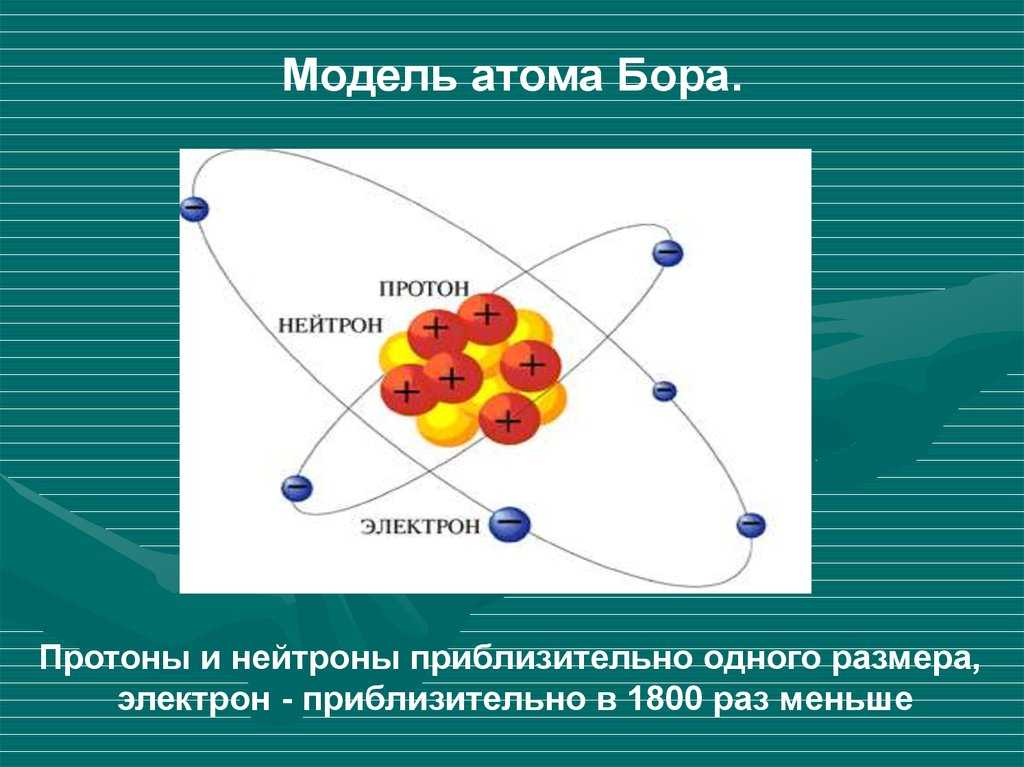 Другими такими примерами являются (i) углерод, 12C6 и 14C6 (ii) хлор, 35Cl17 и 37Cl17 и т. д.
Другими такими примерами являются (i) углерод, 12C6 и 14C6 (ii) хлор, 35Cl17 и 37Cl17 и т. д. Но если элемент встречается в изотопных формах, то мы должны знать процентное содержание каждой изотопной формы, а затем вычисляется средняя масса.
Но если элемент встречается в изотопных формах, то мы должны знать процентное содержание каждой изотопной формы, а затем вычисляется средняя масса.