Химия. Для школьников старших классов и поступающих в вузы
Химия. Для школьников старших классов и поступающих в вузы
ОглавлениеВВЕДЕНИЕГлава I.  § 1. Предмет химии. Важнейшие понятия и законы химии Основные стехиометрические законы химии ЗАДАЧИ И УПРАЖНЕНИЯ § 2. Строение атома Электронные конфигурации атомов Ядро атома и радиоактивные превращения ЗАДАЧИ И УПРАЖНЕНИЯ § 3. Строение молекул. Химическая связь. Валентность элементов ЗАДАЧИ И УПРАЖНЕНИЯ § 4. Агрегатные состояния вещества Характерные свойства газов, жидкостей и твердых тел Газообразное состояние. Газовые законы ЗАДАЧИ И УПРАЖНЕНИЯ § 5. Закономерности протекания химических реакций Химическая кинетика Химическое равновесие ЗАДАЧИ И УПРАЖНЕНИЯ § 6. Растворы. Электролитическая диссоциация. Гидролиз солей Гидролиз солей ЗАДАЧИ И УПРАЖНЕНИЯ § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз Окислительно-восстановительные реакции Электролиз ЗАДАЧИ И УПРАЖНЕНИЯ Глава II.  НЕОРГАНИЧЕСКАЯ ХИМИЯ НЕОРГАНИЧЕСКАЯ ХИМИЯ§ 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения Оксиды Основания (гидроксиды металлов) Кислоты Соли § 9. Водород. Галогены и их соединения Галогены и их соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 10. Подгруппа кислорода ЗАДАЧИ И УПРАЖНЕНИЯ § 11. Подгруппа азота Фосфор и его соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 12. Подгруппа углерода Углерод и его соединения Кремний и его соединения ЗАДАЧИ И УПРАЖНЕНИЯ § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений ЗАДАЧИ И УПРАЖНЕНИЯ § 14. Алюминий — типичный р-металл Соединения алюминия и их свойства ЗАДАЧИ И УПРАЖНЕНИЯ § 15. Главные переходные металлы (d-элементы) и их соединения Химические свойства d-элементов ЗАДАЧИ И УПРАЖНЕНИЯ § 16. Задачи для повторения по неорганической химии Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ § 17. Основные понятия и закономерности в органической химии.  Классификация и номенклатура органических соединений Изомерия органических соединений Взаимное влияние атомов в молекуле и реакционная способность органических соединений Общая характеристика органических реакций ЗАДАЧИ И УПРАЖНЕНИЯ § 18. Предельные (насыщенные) углеводороды Циклоалканы ЗАДАЧИ И УПРАЖНЕНИЯ § 19. Алкены. Диеновые углеводороды Диеновые углеводороды (алкадиены) ЗАДАЧИ И УПРАЖНЕНИЯ § 20. Алкины ЗАДАЧИ И УПРАЖНЕНИЯ § 21. Ароматические углеводороды (арены) § 22. Спирты и фенолы Многоатомные спирты Фенолы ЗАДАЧИ И УПРАЖНЕНИЯ § 23. Карбонильные соединения — альдегиды и кетоны ЗАДАЧИ И УПРАЖНЕНИЯ § 24. Карбоновые кислоты. Сложные эфиры. Жиры Сложные эфиры. Жиры ЗАДАЧИ И УПРАЖНЕНИЯ Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ Определение молекулярной формулы веществ Определение состава и разделение смесей Задачи на газовые законы Способы выражения концентрации растворов Ионные реакции в растворах Задачи на окислительно-восстановительные реакции Разные задачи ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ ОТВЕТЫ Рекомендуемая литература |
ПСХЭ в свете теории строения атом | Презентация к уроку по химии:
Слайд 1
Периодический Закон и периодическая система в свете учения о строении атомов. Автор: Симонов Виталий уч-ся 9 класса МАОУ СОШ №4 п. Новоорск. Руководитель: Шурыгина Галина Александровна учитель химии – биологии.
Автор: Симонов Виталий уч-ся 9 класса МАОУ СОШ №4 п. Новоорск. Руководитель: Шурыгина Галина Александровна учитель химии – биологии.
Слайд 2
Цели: Проследить общие закономерности структуры периодической системы химических элементов в свете учения о строения атома.
Слайд 3
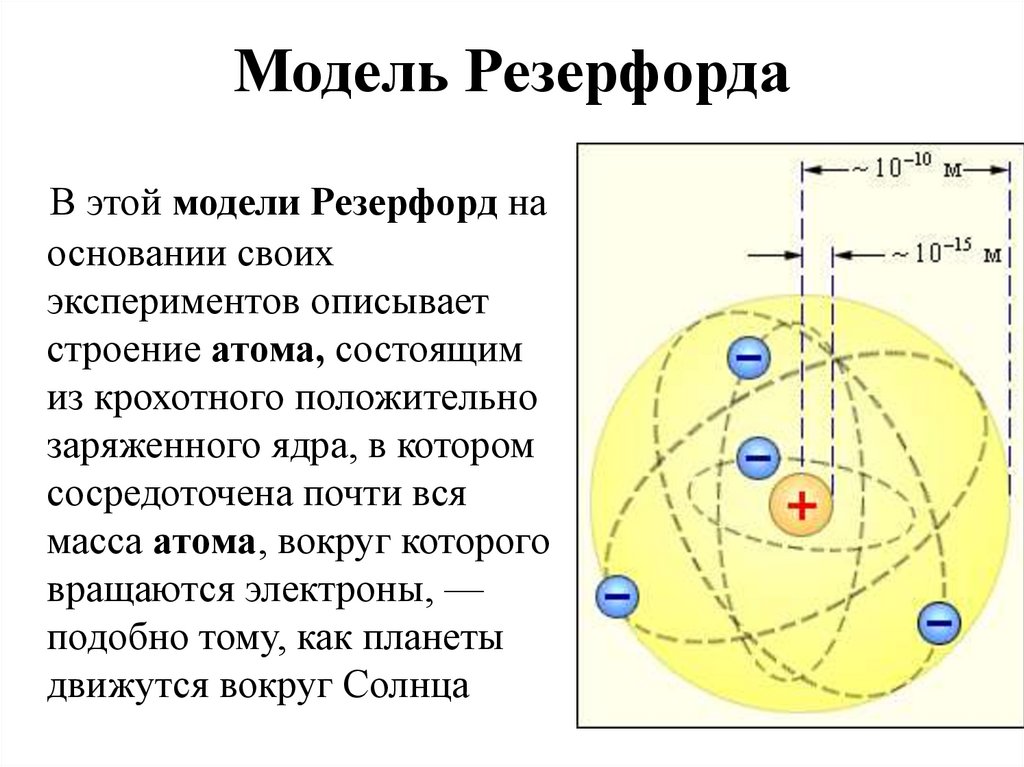
Заряд ядра – главная характеристика химических элементов. Учение о строении атомов вскрыло глубокий физический смысл периодического закона. Главной характеристикой атома является положительный заряд ядра, определяющий число электронов в электронной оболочке атома, её строение, а тем самым все свойства элемента и его положение в периодической системе.
Слайд 4
Электроны не падают на положительно заряженное ядро, т.к. вращаются с очень большой скоростью вокруг ядра. Так, а атоме водорода электрон за одну секунду делает 7 триллионов оборотов. Число протонов в ядре атома равно числу электронов, вращающихся вокруг ядра, поэтому суммарный положительный заряд атома равен суммарному отрицательному: атом в целом электрически нейтрален
Слайд 5
В связи с этим претерпела изменение и формулировка закона: Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядер их атомов. Такая формулировка нисколько не противоречит формулировке, данной Менделеевым, а только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. Периодическая система элементов Д.И. Менделеева отражает периодический закон, а вместе с тем и строение атомов элементов.
Такая формулировка нисколько не противоречит формулировке, данной Менделеевым, а только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. Периодическая система элементов Д.И. Менделеева отражает периодический закон, а вместе с тем и строение атомов элементов.
Слайд 6
Физический смысл периодического закона: Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 109 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются.
Слайд 7
С ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 – в I периоде, и от 1 до 8 – во II и III периодах), что объясняет изменение свойств элементов: в начале периода (кроме I ) находятся щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются неметаллические свойства. В малых периодах:
В малых периодах:
Слайд 8
С ростом заряда ядер заполнение уровней электронами происходит сложнее т. к. изменение свойств элементов по сравнению с элементами малых периодов тоже сложное. Так, в чётных рядах больших периодов с ростом заряда число электронов на внешнем уровне остаётся постоянным и равно – 2 или 1. Поэтому, пока идёт заполнение электронами предвнешнего уровня, свойства элементов в этих рядах изменяются крайне медленно. В больших периодах:
Слайд 9
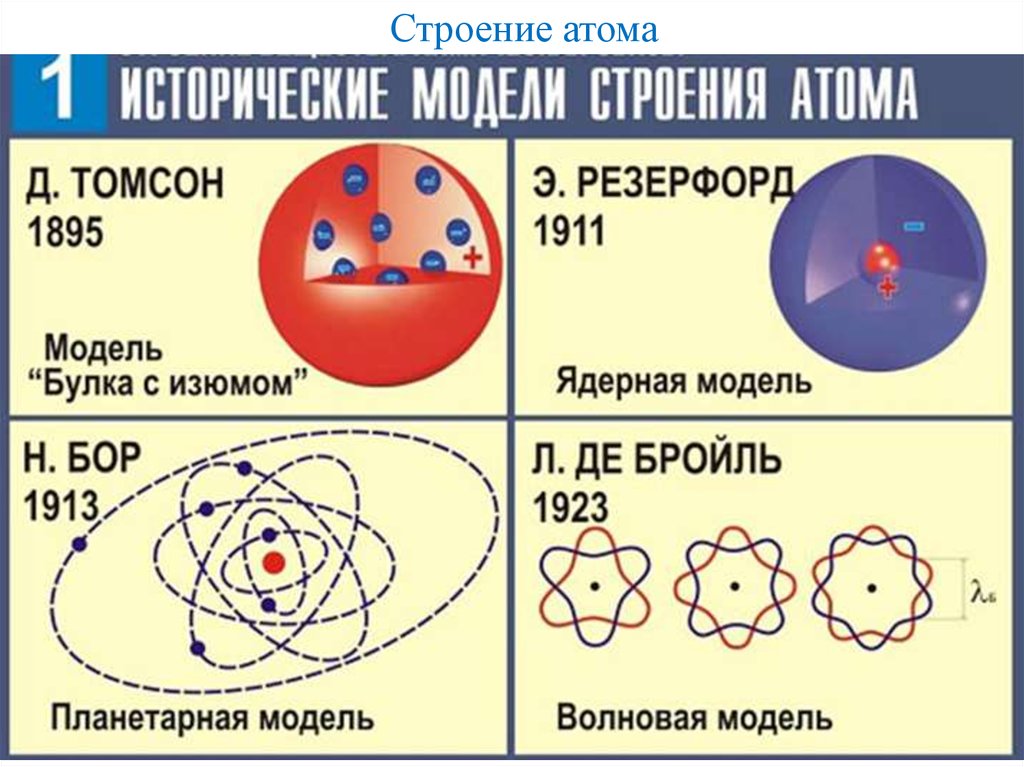
В свете учения о строении атомов становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому S – элементы имеются во всех периодах, P – элементы – во II и последующих, d – элементы – в IV и последующих И f – элементы – в VI и VII периодах.
Слайд 10
Легко объяснимо деление групп на подгруппы: Основано оно на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняется или s – подуровни или p – подуровни внешних уровней.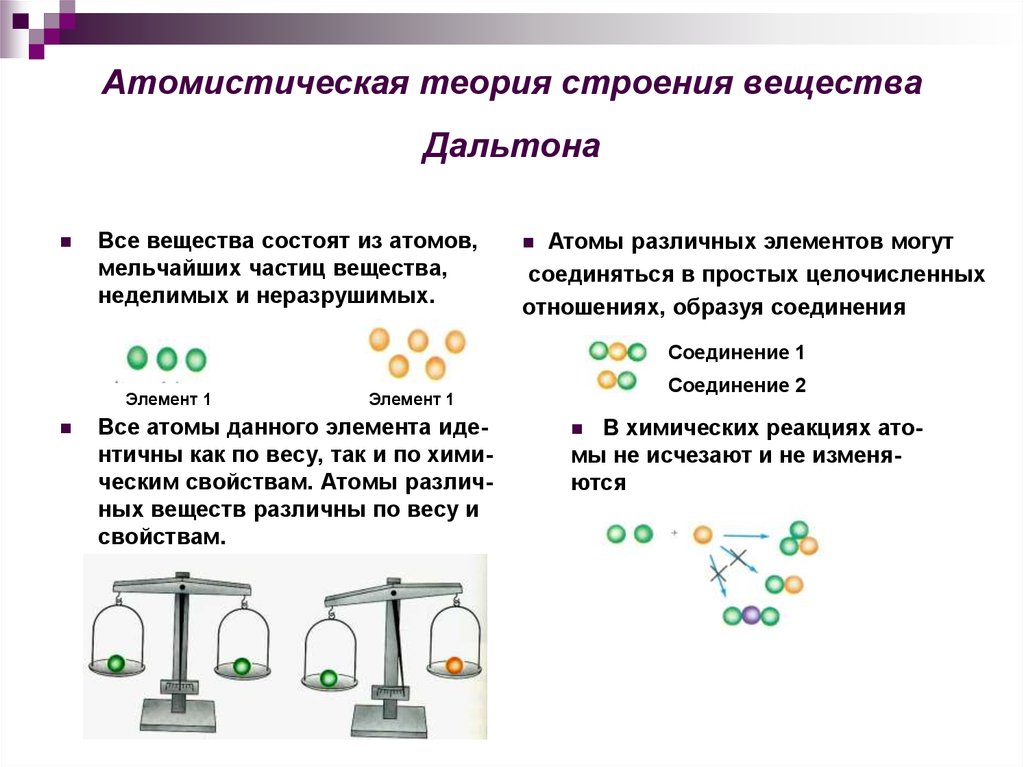 У элементов побочных подгрупп заполняется d – подуровень предвнешнего уровня. У лантаноидов и актиноидов заполняется соответственно 4 f – и 5 f – подуровни. Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня.
У элементов побочных подгрупп заполняется d – подуровень предвнешнего уровня. У лантаноидов и актиноидов заполняется соответственно 4 f – и 5 f – подуровни. Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходное строение внешнего электронного уровня.
Слайд 11
Различия в строении обусловливает и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов, а подгруппы марганца – по два электрона. Первые – типичные неметаллы, а вторые – металлы. Почему есть металлы и неметаллы?
Слайд 12
Таким образом, у элементов побочных подгрупп валентными являются электроны не только внешних, но и предвнешних уровней – в чём и состоит основное различие в свойствах элементов главных и побочных подгрупп. Отсюда следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химической связи. Физический смысл номера группы:
Слайд 13
Итак, строение атома обусловливает две закономерности: Изменение свойств по горизонтали – в периоде слева направо ослабляет металлические и усиливает неметаллические свойства; Изменение свойств по вертикали – в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. Вывод:
Вывод:
Слайд 14
Ресурсы: Балезин С.А., Бесков С.Д . Выдающиеся русские ученые-химики. М.: Просвещение, 1972, 222 с.; Габриелян О.С . Химия. 8 класс. М.: Дрофа, 2000; Гузей Л.С., Сорокин В.В., Суровцева Р.П . Химия. 8 класс. М.: Дрофа, 2000; Химия в школе, 1993, № 2, с. 74–75; № 3, с. 24–28; № 5, с. 33; Ватаману И . Приключения Атомика. Повесть. Кишинев: Литература артистикэ, 1989; Куликова Е.Л . Вечера занимательной химии. Минск: Народная асвета, 1986.
Атомная теория – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1320
Атомная теория утверждает, что материя состоит из дискретных единиц, называемых атомами, в противоположность устаревшему представлению о том, что материю можно разделить на любое произвольно малое количество.
- Атомная масса
- Масса — это основное физическое свойство материи. Масса атома или молекулы называется атомной массой. Атомная масса используется для нахождения средней массы элементов и молекул и для решения задач стехиометрии.
- Атомная структура
- Атом состоит из положительно заряженного ядра, окруженного одной или несколькими отрицательно заряженными частицами, называемыми электронами. Положительные заряды равны отрицательным зарядам, поэтому атом не имеет общего заряда; он электрически нейтрален. Большая часть массы атома находится в его ядре; масса электрона составляет всего 1/1836 массы самого легкого ядра, атома водорода.

- Атомная теория
- Атомная теория Дальтона
- Джон Дальтон, британский школьный учитель, опубликовал свою теорию об атомах в 1808 году. Его открытия были основаны на экспериментах и законах химического соединения.
- Ранняя атомная теория
- Закон Гей-Люссака для объемов газа
- Закон сохранения массы Лавуазье
- Закон кратных пропорций
- Закон обратных пропорций 0003 Постулаты атомной теории Дальтона
- Закон постоянной пропорции Пруста
- Энергии ионизации двухатомных молекул
- Энергии электронов, измеряющие энергию ионизации на молекулярных орбиталях, можно наблюдать непосредственно с помощью измерения энергии ионизации на молекулярных орбиталях. Это энергия, необходимая для удаления электрона, в данном случае, из молекулы.

- Изотопы
- Атомы, имеющие одинаковый атомный номер (количество протонов), но разные массовые числа (количество протонов и нейтронов), называются изотопами. Существуют изотопы естественного происхождения и изотопы искусственного происхождения. Изотопы разделяют с помощью масс-спектрометрии; Кривые МС показывают относительное содержание изотопов в зависимости от массового числа (отношение массы к заряду).
- Изотопы II
- Нуклид, атомный номер, массовое число
- Атом – это наименьшая единица элемента, которая может существовать. Каждый атом состоит из протонов, нейтронов и электронов. Эти частицы определяют нуклид и его химические свойства, были обнаружены в начале 20 века и описаны современной атомной теорией.
- Простое представление атомной структуры
- Размеры ионов
- Атом
- Атом — наименьшая единица материи, состоящая из трех субатомных частиц: протона, нейтрона и электрона.

- Субатомные частицы
Atomic Theory распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Атомная структура — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1326
Атом состоит из положительно заряженного ядра, окруженного одной или несколькими отрицательно заряженными частицами, называемыми электронами. Положительные заряды равны отрицательным зарядам, поэтому атом не имеет общего заряда; он электрически нейтрален. Большая часть массы атома находится в его ядре; масса электрона составляет всего 1/1836 массы самого легкого ядра, атома водорода. Хотя ядро тяжелое, оно довольно мало по сравнению с общим размером атома.
Хотя ядро тяжелое, оно довольно мало по сравнению с общим размером атома.
Радиус типичного атома составляет от 1 до 2,5 ангстрем (Å), тогда как радиус ядра составляет примерно 10 -5 Å. Если бы атом был увеличен до размеров Земли, его ядро было бы всего 200 футов в диаметре и могло бы легко поместиться внутри небольшого футбольного стадиона. Ядро атома содержит протоны и нейтроны. Протоны и нейтроны имеют почти равные массы, но различаются по заряду. Нейтрон не имеет заряда, тогда как протон имеет положительный заряд, который в точности уравновешивает отрицательный заряд электрона. В таблице \(\PageIndex{1}\) перечислены заряды этих трех фундаментальных частиц и приведены их массы, выраженные в атомных единицах массы.
| Частица | Плата | Масса (а. е.м.) е.м.) |
|---|---|---|
| Электроны | -1 | 0,000549 |
| Протоны | +1 | 1.00782 |
| Нейтроны | 0 | 1.00867 |
Атомная единица массы (а.е.м.) определяется как ровно одна двенадцатая массы атома углерода, имеющего в ядре шесть протонов и шесть нейтронов. В этом масштабе протоны и нейтроны имеют массы, близкие, но не точно, к 1 u каждый (в 1 грамме 6,022 x 10 90 223 23 90 224 u). число может быть рассчитано, обсуждается ниже). Количество протонов в ядре атома известно как атомный номер Z. Он равен количеству электронов вокруг ядра, потому что атом электрически нейтрален.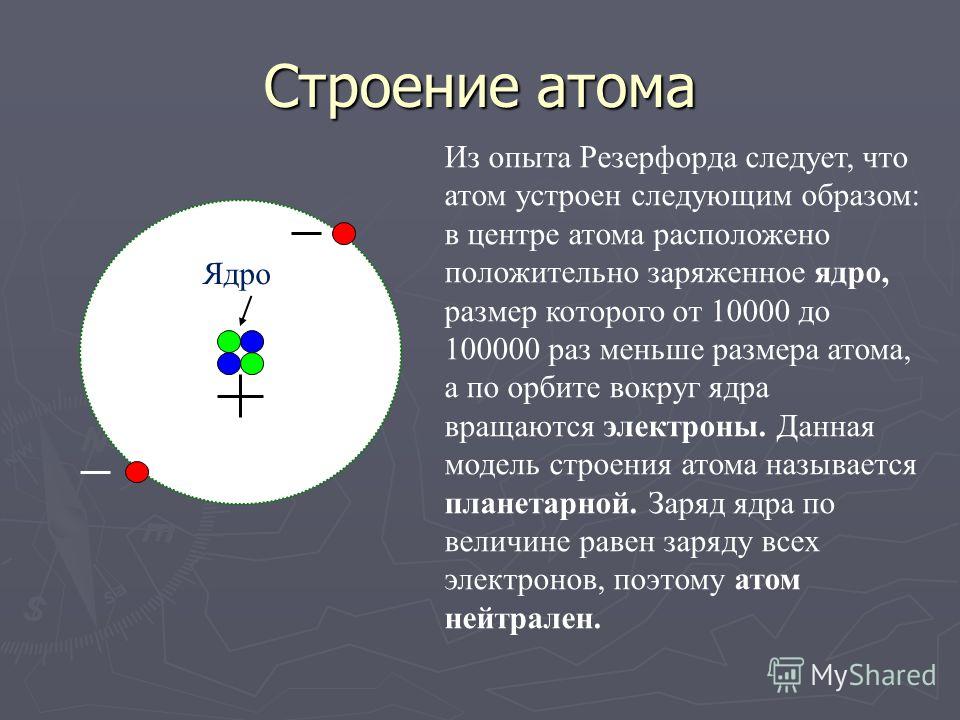 Массовое число атома равно общему количеству тяжелых частиц: протонов и нейтронов.
Массовое число атома равно общему количеству тяжелых частиц: протонов и нейтронов.
Когда два атома находятся достаточно близко, чтобы соединиться химически — чтобы образовать химические связи друг с другом — каждый атом в первую очередь «видит» самые внешние электроны другого атома. Таким образом, эти внешние электроны являются наиболее важными факторами химического поведения атомов. Нейтроны в ядре мало влияют на химическое поведение, а протоны важны только потому, что они определяют, сколько электронов окружает ядро в нейтральном атоме.
Все атомы с одинаковым атомным номером химически ведут себя примерно одинаково и классифицируются как один и тот же химический элемент. Каждый элемент имеет собственное имя и однобуквенный или двухбуквенный символ (обычно производный от английского или латинского названия элемента). Например, символ углерода — C, а символ кальция — Ca. Символом натрия является Na — первые две буквы его латинского (и немецкого) названия, 9.0279 натрий , , чтобы отличить его от азота, N и серы, S.