Гончаров Е.Г., Афиногенов Ю.П. – Химическая термодинамика в курсе неорганической химии(2008, Изд-во ВГУ)
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Е.Г. Гончаров, Ю.П. Афиногенов
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА В КУРСЕ НЕОРГАНИЧЕСКОЙ ХИМИИ
Учебно-методическое пособие
Издательско-полиграфический центр Воронежского государственного университета
2008
Утверждено научно-методическим советом химического факультета
Рецензент – профессор В.Ф. Селеменев
Учебно-методическое пособие подготовлено на кафедре общей химии химического факультета Воронежского государственного университета. Рекомендуется для студентов 1 курса дневного и вечернего отделений естественных факультетов.
2
Введение
Предлагаемое студентам 1 курса данное методическое пособие не претендует на последовательное изложение основ термодинамики – это уже сделано в учебнике ″Общая химия″. По замыслу авторов предлагаемая разработка позволит по новому взглянуть на некоторые проблемы термодинамики и с помощью конкретных примеров более подробно рассказать о тех сторонах этой дисциплины, которые из-за ограниченного объема не смогли войти в учебник.
По замыслу авторов предлагаемая разработка позволит по новому взглянуть на некоторые проблемы термодинамики и с помощью конкретных примеров более подробно рассказать о тех сторонах этой дисциплины, которые из-за ограниченного объема не смогли войти в учебник.
Авторы старались достаточно строго и в то же время доступно изложить некоторые вопросы химической термодинамики – так, чтобы ″за лесом формул″ не терялась сама химическая проблема.
Авторы также попытались сказать несколько слов о термодинамике неравновесных процессов – дисциплине, объединяющей классическую (равновесную) термодинамику и химическую кинетику. Насколько удался этот первый опыт, покажут отзывы преподавателей и студентов.
Некоторые основные понятия химической термодинамики.
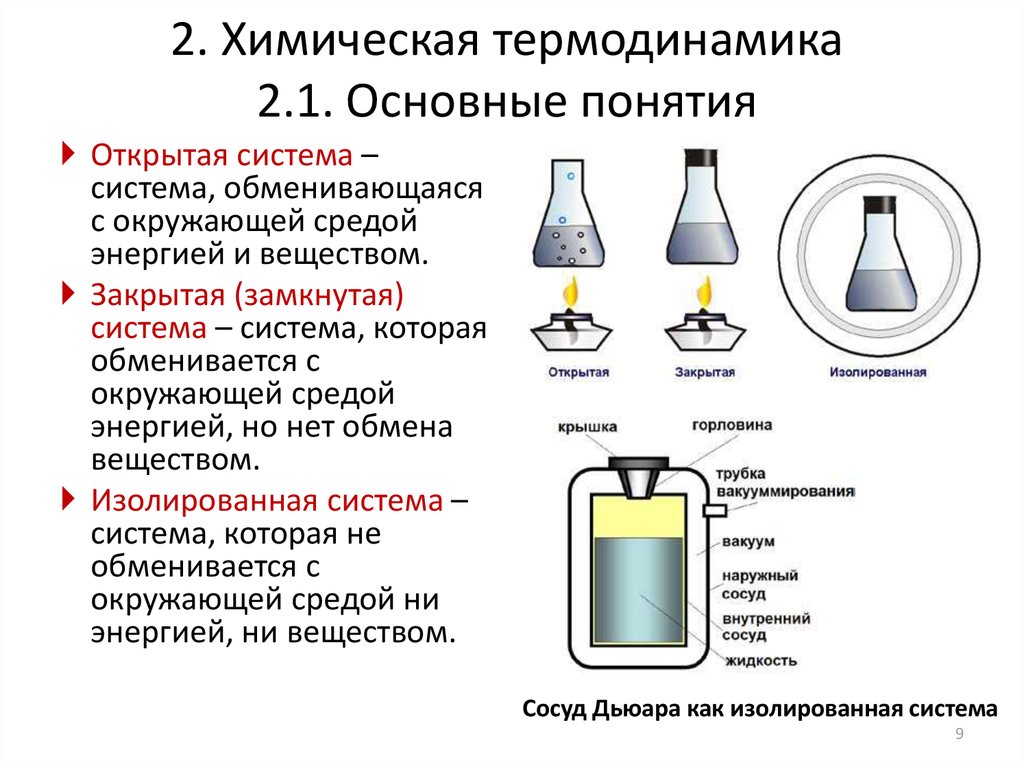
1.Термодинамическая система (в дальнейшем – система) – совокупность тел, выделенных из окружающей среды для термодинамического анализа. Она отделена от окружающей среды реальной (физической) или мысленной поверхностью раздела. В зависимости от степени изолированности системы делятся на изолированные, закрытые и открытые.
В зависимости от степени изолированности системы делятся на изолированные, закрытые и открытые.
Изолированная система соответствует предельному случаю, когда с внешней средой отсутствует обмен массой и энергией.
Закрытая система может обмениваться энергией с внешней средой, но масса ее остается постоянной (массообмен не осуществляется).
Открытая система может обмениваться с окружающей средой как энергией, так и массой.
2.Функции состояния.
Состояние системы характеризуется термодинамическими величинами, которые являются функциями ее состояния. Любая физическая величина, однозначно определяющая состояние данной системы в положении
равновесия, является функцией состояния. Функциями состояния являются
3
температура, давление, мольный объем, внутренняя энергия, энтальпия, энтропия, энергия Гиббса и многие другие величины, однозначно определяющие состояние системы в момент установления равновесия.
Важным свойством функции состояния является независимость ее от предыстории системы, т.
Высота |
|
|
над |
| В |
уровнем | I |
|
моря | U2 | |
| А | II |
|
|
U1
путь
Рис.1.
Потенциальная энергия автомобиля с путником будет определяться высотой подъема h и совершенно не будет зависеть от пути перехода из пункта А в пункт В. Следовательно, потенциальная энергия является функцией состояния системы. Но, перемещаясь по разным траекториям, машина совершает разное количество работы, что никак не отражается на состоянии системы в пункте В.
Она (теплота) также не является функцией состояния, т.к. ее поглощение (потребление топлива) не отражается на конечном состоянии системы. Здесь интересно отметить, что разность между поглощенной теплотой и произведенной работой (Q-А) уже является функцией состояния, т.к. она отражает изменение внутренней энергии системы на пройденном пути: Q- А= U=U2-U1 (это выражение, отражающее закон сохранения энергии, по-
4
лучило название I начала термодинамики). Отсюда следует, что при А=0, Q= U, т.е. становится функцией состояния.
Самопроизвольный процесс. Обратимые процессы. Равновесие
Самопроизвольные химические процессы протекают без какого-либо внешнего воздействия на реакционную систему. Например, сгорание бензина С7Н16 +11О2 =7СО2 +8Н2О представляет собой самопроизвольную химическую реакцию.
Однако, существуют многочисленные процессы, которые самопроизвольно протекают в обоих направлениях. К их числу относится реакция синтеза аммиака:
3Н2+N2 ↔ 2NН3
По мере накопления продукта прямой реакции (аммиака) ускоряется его разложение на исходные компоненты и в определенный момент времени скорости прямой и обратной реакции становятся равными. Это и есть состояние химического (динамического) равновесия.
Обратимые процессы. Это понятие в термодинамике имеет более глубокий смысл по сравнению с принятым в химии. Обычно считается, что признак обратимости – это возможность протекания химической реакции в противоположных направлениях. В термодинамике обратимыми процессами считаются только равновесные процессы , т.е. процессы, при которых бесконечно малое воздействие на систему, находящуюся в состоянии равновесия, выводит ее из этого состояния. При этом система последовательно переходит в новые состояния и, что самое главное, при этом совершает максимальную работу.
Строго говоря, понятие обратимости процесса является более общим по сравнению с понятием равновесности, но в первом приближении их можно отождествить.
5
оказывается полностью ″запертым″ и выходить из него не будет. Наконец, | ||
если уменьшить противодавление на бесконечно малую величину, то газ | ||
начнет преодолевать внешнее противодействие и при этом совершит макси- | ||
мальную работу. Оказывается, что чем ″резче″ уменьшать внешнее противо- | ||
действие (противодавление), тем больше будет потерь при совершении га- | ||
зом работы (вспомним, что газ, выходящий из открытого баллона, не совер- | ||
шает никакой работы). | ||
мальной работы в равновесном процессе, не происходит потерь энергии в | ||
окружающую среду. |
|
|
|
| Иллюстрацией к сказанному слу- |
|
| жит процесс (рис. 2) совершения рабо- |
|
| ты расширяющимся газом при Т=const. |
|
| Предположим, что в результате хими- |
|
| ческой реакции растворения цинка в |
|
| серной кислоте выделился 1 моль водо- |
|
| рода. Если процесс происходит при по- |
|
| стоянном давлении (давление груза на |
F | h | поршень сверху вниз), то для сохране- |
| ния давления газа неизменным поршень | |
|
| должен переместиться вверх на рас- |
|
| стояние |
|
| h3-h2= h. |
h3 |
| работу А=F h (произведение силы на |
| путь). Если р – внешнее давление на | |
|
| |
|
| поршень и площадь поперечного сече- |
|
| ния поршня равна S, то F=pS и выпол- |
Рис. 2 |
| ненная системой работа А=F h=pS h. |
| Но S h есть изменение объема системы | |
|
| ( V) при перемещении поршня, отсюда |
|
| работа А=p V. |
Следует обратить внимание, что величина совершенной системой | ||
работы будет зависеть от внешнего давления. | ||
давлению выделившегося в результате реакции водорода. В этом случае | ||
поршень перемещаться не будет. При снятии определенной части груза | ||
(гирек) система начнет совершать работу, перемещая вверх поршень. Ве- | ||
|
| 6 |
личина этой работы будет зависеть от механизма уменьшения противодавления (массы каждой снятой гирьки). Эти механизмы отражены на рис. 3 (а,б,в).
p | I | p | I | p | I |
| V |
|
|
|
|
|
| p |
|
|
|
|
| II |
| II | II |
|
| V |
| V | V |
| а |
| б | в |
|
|
|
|
| Рис. |
|
Рис.3,а иллюстрирует явно необратимый процесс, когда уменьшение противодавления (снятие грузов) происходит большими порциями и каждая ″ступенька″ ( р) влечет за собой значительное увеличение объема под поршнем ( V). Такой процесс описывается нисходящей ломаной линией, где число ступенек равно числу снятых с поршня грузов. На рис.3б тот же процесс проведен более ″мягко″, т.е. число ступенек (снятых грузов) увеличено и величина совершенной системой работы (заштрихованная площадь под ломаной линией) увеличилась по сравнению с рис.3а. В пределе, когда каждый снятый грузик имеет бесконечно малую массу, число ступенек стремится к бесконечности, а работа системы – к максимальному значению (рис.3в).
Математически любой необратимый процесс выражается соотноше-
нием
V2
Анеобр. = ∑ pi Vi ,
V1
где pi – давление груза на каждой ступеньке, а Vi – изменение объема при снятии соответствующего груза с поршня.
7
По мере приближения процесса к равновесному (с уменьшением степени необратимости) число членов этой суммы (число ступенек pi Vi) растет и в пределе ( V→0, pi Vi→∞) работа достигает максимальной величины и процесс становится обратимым:
V2
Аобр. = ∫ pdV
= ∫ pdV
V1
На рис.3в заштрихованная площадь под прямой соответствует максимальной (предельной) работе системы, а сам процесс становится обратимым, т.к. теперь бесконечно малое изменение давления (увеличение, или уменьшение) может сместить равновесие системы в ту или иную сторону (поднять поршень, или опустить его).
Следовательно, одним из признаков равновесного процесса является возможность протекания реакции в любую сторону при изменении знака внешнего воздействия. Например, равновесную систему 3Н2 +N2 ↔2Nh4 можно вывести из состояния равновесия в ту или иную сторону бесконечно малым изменением температуры, давления и концентрации реагирующих веществ.
Подводя итоги, можно констатировать, что система, совершающая равновесный процесс, может вернуться в исходное состояние, пройдя тот же путь, ту же последовательность равновесных состояний. Таким образом, равновесные процессы являются обратимыми, а неравновесные – необратимыми. Признаком необратимости процесса является невозможность возврата системы в исходное состояние по тому же пути и при этом в системе (или окружающей среде) остаются какие-либо изменения (например, выделение тепла при протекании тока через проводник, или потери на трение при совершении механической работы).
8
Изохорные и изобарные процессы. Внутренняя энергия и энтальпия
Термохимические реакции записываются с учетом сопровождающего теплового эффекта и при этом фиксируются условия проведения процесса, при постоянном объеме (V=const) или при постоянном давлении
(Р=const). Например:
Zn(к)+Н2SO4=ZnSO4(р)+h3(г)+165,7 кДж/моль, (V=const) (1)
h3SO4
Zn | Zn |
| Рис.4 |
Эта реакция протекает при постоянном объеме (изохорный процесс), т.е. в герметично закрытом сосуде (рис.4). При этом продукты реакции не удаляются из сферы взаимодействия и потому возможна обратная реакция и наступление равновесия в определенный момент времени. После окончания реакции взаимодействия цинка с серной кислотой можно определить величину изохорного теплового эф-фекта (QV). Очевидно, что выделившаяся в этой реакции теплота приводит к изменению внутренней энергии системы (U), т. е. QV =U2-U1=- U. Здесь индексы 1 и 2 обозначают начальное и конечное состояние системы, причем в термодинамике принято разность функций состояния получать, вычитая начальное состояние из конечного. Итак, выделение тепла при изохорном процессе (экзотермическая реакция) соответствует уменьшению внутренней энергии (рис.5).
е. QV =U2-U1=- U. Здесь индексы 1 и 2 обозначают начальное и конечное состояние системы, причем в термодинамике принято разность функций состояния получать, вычитая начальное состояние из конечного. Итак, выделение тепла при изохорном процессе (экзотермическая реакция) соответствует уменьшению внутренней энергии (рис.5).
9
исходные в-ва (Zn + h3SO4)
U
U1 – U = QV
продукты
(ZnSO4 + h3)
U2
Рис.5
Из этой энергетической диаграммы видно, что продукты реакции потеряли часть своей внутренней энергии, которая выделилась в виде тепла и рассеялась в окружающей среде. Из равенства QV=- U следует, что тепловой эффект в термохимической шкале положителен (экзотермический процесс), но в термодинамической шкале потеря системой энергии соответствует отрицательному знаку ее изменения: U2–U1= U<0.
Если растворение цинка в серной кислоте проводить при постоянном давлении (Р=const), то величина теплового эффекта QР будет другой. Из рис.2 видно, что неизменность давления в системе достигается за счет увеличения объема при выделении газообразного продукта. В этом эксперименте сосуд содержит свободно перемещающуюся пробку (поршень), что дает возможность выделяющемуся в результате реакции водороду совершать работу расширения, преодолевая внешнее давление.
В этом эксперименте сосуд содержит свободно перемещающуюся пробку (поршень), что дает возможность выделяющемуся в результате реакции водороду совершать работу расширения, преодолевая внешнее давление.
Термохимическая реакция изобарного процесса запишется так:
Zn(к)+h3SO4(р)=ZnSO4(р)+h3(г)+163,2 кДж/моль (Р=const) (2)
Из сопоставления реакций (1) и (2) видно, что QV>QР. Это является следствием того, что часть выделяющегося тепла при изобарном процессе расходуется на совершение работы реакционной системой против внешнего давления. QV=QP+p V, где p V – работа расширения.
Однако, если реакция идет с уменьшением объема, то QP>QV. Это происходит, когда объем (число моль) газообразных продуктов меньше объема (числа моль) исходных газообразных веществ. Например, при осуществлении реакции 3Н2(г)+N2(г)=2NН3(г) объем реакционной системы уменьшается, т.е. работа производится внешней средой над системой, поэтому
QV = QP-p V QV < QP
10
Термодинамика: Учебник.
 — 2-е изд., стер. Гончаров С.А. ISBN 5-7410-0010-6
— 2-е изд., стер. Гончаров С.А. ISBN 5-7410-0010-6Категории
Среднее профессиональное образование (14+) (1965)Среднее профессиональное образование
СПО: Учебники и учебные пособия из списка ПООП (117)
Астрономия (8)
Биология (19)
Военное дело (10)
География, метеорология и картография (6)
Геология, геодезия и разведка полезных ископаемых (9)
Иностранные языки (88)
Информатика и вычислительная техника (116)
Информационная безопасность (2)
История и философия (31)
Лесное, парковое и охотничье хозяйство (18)
Математика и геометрия (13)
Медицина (104)
Обществознание (36)
Психология (17)
Русский язык и литература (41)
Социология и социальная работа (17)
Физика и математика (78)
Физкультура и спорт (5)
Философия (3)
Химия и технологии химической промышленности (21)
Экология и природопользование (19)
Электроника, радио-, электро- и схемотехника (83)
Юриспруденция и правоведение (78)
Естествознание (2)
Технология деревообрабатывающих производств, столярное дело. Мебельное производство. (6)
Мебельное производство. (6)
Укрупненная группа специальностей
01.00.00 Математика и механика (1049)
02.00.00 Компьютерные и информационные науки (3006)
03.00.00 Физика и астрономия (508)
04.00.00 Химия (352)
05.00.00 Науки о Земле (335)
06.00.00 Биологические науки (315)
07.00.00 Архитектура (386)
08.00.00 Техника и технологии строительства (385)
09.00.00 Информатика и вычислительная техника (3807)
10.00.00 Информационная безопасность (346)
11.00.00 Электроника, радиотехника и системы связи (1200)
12.00.00 Фотоника, приборостроение, оптические и биотехнические системы и технологии (305)
13.00.00 Электро- и теплоэнергетика (321)
14.00.00 Ядерная энергетика и технологии (125)
15.00.00 Машиностроение (486)
16.00.00 Физико-технические науки и технологии (1202)
17.00.00 Оружие и системы вооружения (69)
18.00.00 Химические технологии (232)
19. 00.00 Промышленная экология и биотехнологии (251)
00.00 Промышленная экология и биотехнологии (251)
20.00.00 Техносферная безопасность и природообустройство (305)
21.00.00 Прикладная геология, горное дело, нефтегазовое дело и геодезия (951)
22.00.00 Технологии материалов (334)
23.00.00 Техника и технологии наземного транспорта (159)
24.00.00 Авиационная и ракетно-космическая техника (155)
25.00.00 Аэронавигация и эксплуатация авиационной и ракетно-космической техники (159)
26.00.00 Техника и технологии кораблестроения и водного транспорта (75)
27.00.00 Управление в технических системах (391)
28.00.00 Нанотехнологии и наноматериалы (185)
29.00.00 Технологии легкой промышленности (363)
30.00.00 Фундаментальная медицина (252)
31.00.00 Клиническая медицина (491)
32.00.00 Науки о здоровье и практическая медицина (224)
33.00.00 Фармация (88)
34.00.00 Сестринское дело (45)
35.00.00 Сельское, лесное и рыбное хозяйство (366)
36.00.00 Ветеринария и зоотехния (136)
37. 00.00 Психологические науки (1878)
00.00 Психологические науки (1878)
38.00.00 Экономика и управление (6170)
39.00.00 Социология и социальная работа (711)
40.00.00 Юриспруденция (4004)
41.00.00 Политические науки и регионоведение (897)
42.00.00 Средства массовой информации и информационно-библиотечное дело (281)
43.00.00 Сервис и туризм (113)
44.00.00 Образование и педагогические науки (3036)
45.00.00 Языкознание и литературоведение (3801)
46.00.00 История и археология (707)
47.00.00 Философия, этика и религиоведение (773)
48.00.00 Теология (166)
49.00.00 Физическая культура и спорт (462)
50.00.00 Искусствознание (428)
51.00.00 Культуроведение и социокультурные проекты (566)
52.00.00 Сценические искусства и литературное творчество (74)
53.00.00 Музыкальное искусство (133)
54.00.00 Изобразительное и прикладные виды искусств (304)
55.00.00 Экранные искусства (114)
56.00.00 Военное управление (162)
57.00.00 Обеспечение государственной безопасности (64)
Остаться в выбранном разделе
Назад к каталогу
ISBN 5-7410-0010-6
Авторы:
Гончаров С. А.
А.
Тип издания:
Учебник
Издательство:
Москва: Горная книга (МГГУ)
Год:
2002
Аннотация
Учебник состоит нэ трех разделов. В первом приведены сведениа об основных законах термодинамики, фазовых переходах, химической термодинамики, тепловых свойствах твердых тел и их изменении в зависимости or температуры. Во втором разделе (тепломассоперенос) приведены уравнение, описывающие потоки жидких и газовых теплоносителей, теплообмена и распространения тепла в твердых телах. Третий раздел посвящен термодинамическим процессам горного производства (тепло земных недр, теплообмен в горных выработках, промерзание и оттаивание свиных пород при открытой разработке месторождений, замораживание пород при строительстве подземных сооружений, подземная выплавка серы, подземная газификации твердого топлива, термическое разрушение скальных и мерзлых связных пород, сушка горной массы).
Для студентов горных вузов и факультетов, обучающихся по направлению «Горное дело», а также аспирантов и специалистов в области термодинамических процессов горного производства.
Библиографическое описание Скопировать библиографическое описание
Гончаров С.А. Термодинамика: Учебник. — 2-е изд., стер. / С.А. Гончаров. – Москва : Горная книга (МГГУ), 2002. – 440 с. – ISBN 5-7410-0010-6. – URL: https://ibooks.ru/bookshelf/370190/reading (дата обращения: 06.01.2023). – Текст: электронный.
Термодинамика, искусство печи и печи – Mn Artists
Отзывы
Дизайн 5 декабря 2008 г.
Ханна Дентингер
Писательница Ханна Дентингер предлагает красноречивое исследование стильного и искусного мастерства, представленного на новой выставке DAI, посвященной искусству из стекла и керамики, «From Out of the Flames».
Теги: художественный процесскерамикамастерствоDuluth Art InstituteFiringglassglazegreater Minnesota
12 Я ВСТРЕЧАЛСЯ С ТОМАСОМ МАРМОЙ, УЧАСТНИКОМ ДУЛУТСКОГО АРТ-ИНСТИТУТА , новой выставки From Out of the Flames , вскоре после того, как он переехал в этот район. Судя по всему, неряшливый студент колледжа, он носил в кармане своей толстовки нечто, по форме и размеру напоминавшее бутылку Nalgene. На самом деле я так и предполагал, пока он не вытащил ее, и оказалось, что это ваза, которую он взорвал накануне вечером, тонкая и элегантная, ярко-фиолетового цвета. Цвета Marma беззастенчивы: голубой и розовый с медным оттенком. Изюминкой здесь, однако, является неглубокая чаша в приглушенных зеленых и коричневых тонах, покрытая паутиной молочного цвета. Внешний вид вращается против часовой стрелки, как мутный водоворот в пруду, полном водорослей и земли. Интерьер блестит, как полированная бронза.
Судя по всему, неряшливый студент колледжа, он носил в кармане своей толстовки нечто, по форме и размеру напоминавшее бутылку Nalgene. На самом деле я так и предполагал, пока он не вытащил ее, и оказалось, что это ваза, которую он взорвал накануне вечером, тонкая и элегантная, ярко-фиолетового цвета. Цвета Marma беззастенчивы: голубой и розовый с медным оттенком. Изюминкой здесь, однако, является неглубокая чаша в приглушенных зеленых и коричневых тонах, покрытая паутиной молочного цвета. Внешний вид вращается против часовой стрелки, как мутный водоворот в пруду, полном водорослей и земли. Интерьер блестит, как полированная бронза.
Практическое отношение Мармы к своей собственной (крайне хрупкой) работе, по-видимому, отражает образ мышления, характерный для гончаров и стеклодувов: они, возможно, больше, чем художники, работающие в других медиа, заинтересованы в ручном аспекте своей работы в расходных материалах, инструментах и процессах. На это обратил внимание куратор DAI Дэвид Ходжес во время экскурсии по выставке.
«Стеклодувы влюбляются в этот процесс», — объясняет он, обращая мое внимание на работу Боба Хасби. «Они используют то, как расплавленное стекло оседает и оседает. Эти произведения — результат этого процесса». Действительно, каждое из произведений Хасби, казалось, кукарекало: Посмотри, на что способно стекло .
Джим Сейдж вместе с Хасби владеет стеклодувной студией. Помимо стекла, он работает с металлом. Сейдж пишет о своем увлечении этими двумя очень разными веществами: «Я получаю удовольствие от адреналина и сосредоточенности, которые я испытываю, работая с этими материалами при экстремальных температурах», которые «изменяют эти твердые материалы, изменяя их первоначальную форму, в результате чего получается готовое изделие, которое , при охлаждении возвращается в свое жесткое состояние в измененной форме.0015 joie de vivre коллажей Матисса: декоративный чайник — прозрачное стекло с красными, розовыми и голубыми пятнами и непрозрачными белыми пятнами, похожими на снежинки.
Дэвид Ходжес отмечает, что Сейдж и Хасби сумели вызвать новый интерес к стеклу в регионе, уже известном искусными гончарами, многие из которых представлены в этом шоу. Янис Андлер много лет работала в студии DAI, производя мелкие детали тонкой работы (большинство из них не больше 5″-6 на стороне). Раскрашенные цветочные и животные мотивы соперничают с узорами, отпечатанными в глине, как пурпурные синяки. На одном изящном горшке небесно-голубые рыбки с нежным розовым узором чешуи гоняются друг за другом за хвостами. Забавная деталь: горлышко горшка образует горловину рубашки с отложным воротником и тремя пуговицами. Присмотревшись, вы заметите крошечные карманы по обеим сторонам горшка.
Аналогично пошиву, трубчатые вазы Linda Powless обернуты пластырями из глины, которые выворачиваются наподобие лацканов на передней части смокинга. Между загнутыми краями растут наросты, похожие на оборки на рубашке, надетой на выпускной бал 1970-х годов. Мгновенно узнаваемая работа Кима Уиттакера также имеет стыки, искусно замаскированные глиняными кругами, которые напоминают плетеные кожаные пуговицы на винтажном бушлате.
Ходжес отмечает, что работа Уиттакер отсылает к китайцам, использующим глину в качестве холста: она рисует «хипстеров 19-го века».20-х или 50-х, но вот в темных очках. Может быть, это 90-е годы. На одной из настенных тарелок на одном конце изображена груда человеческих лиц, а с противоположного края выглядывает один-единственный лик.
Работа Уиттакер, в которой, как указывает Ходжес, принимает традиционные формы жардиньерок и чайников, сочетает форму и функциональность, как и работа Анны Стербенз-Дуус, которая описывает свою задачу с привлекательной прямотой: «создавать функциональную керамику, которая улучшает нашу повседневную жизнь».
– Я мог бы смешать сюда тесто для блинов, – с усмешкой соглашается Ходжес, указывая на большую красновато-коричневую миску с зеленым, коричневым и золотым внутренностями. Но эти прилагательные предполагают цвета гораздо более уверенные в себе, чем эти пробные глазури. Это оттенки бутонов и усиков, а не летних листьев. С одной стороны — горловина для наливания, с другой — ручка, которая так же естественно растет из бока чаши, как ухо из головы. Узор из перекрещивающихся веточек украшает внешнюю поверхность – черные мазки, словно железо, выдавленное из кондитерской трубки.
Узор из перекрещивающихся веточек украшает внешнюю поверхность – черные мазки, словно железо, выдавленное из кондитерской трубки.
Каждое изделие Sterbenz-Duus дополняет соседнее. То же самое можно сказать и о том, что Ходжес назвал «торнадо-коконами-стручками» Маргарет Киртли-Штернберг. Эта серия больших ваз словно выросла из пола за одну ночь. Зубчатый внешний вид каждой части напоминает мускулатуру со снятой кожей. Цвета приглушены. Но когда вы заглядываете внутрь горловины вазы, местами скапливается полупрозрачная темно-синяя глазурь.
Не что иное, как мускулистые, большие керамические трубы Брока Аллена, похожие на взорванные пни, собираются в том, что куратор называет «своего рода садом». Серия приобретает грациозность, которая не поражает вас, не видя этих произведений в массе . Кристаллическая искра улавливает свет на определенных поверхностях, что, как объясняет Ходжес, свидетельствует о «жестокой деятельности, происходящей в печи». Расплавленная зола, брошенная на горшок, превращается в стекло. На одном из них пепел затвердел и превратился в пятно цвета морской волны, напоминающее отложения известняка на стене пещеры. В сочетании с руническими царапинами и отметинами, нанесенными на его глиняную посуду, это усиливает первозданность, на которую Аллен намекает в прямолинейной оценке предпочитаемого им средства: «Я люблю огонь, — пишет он, — особенно большой огонь».0003
На одном из них пепел затвердел и превратился в пятно цвета морской волны, напоминающее отложения известняка на стене пещеры. В сочетании с руническими царапинами и отметинами, нанесенными на его глиняную посуду, это усиливает первозданность, на которую Аллен намекает в прямолинейной оценке предпочитаемого им средства: «Я люблю огонь, — пишет он, — особенно большой огонь».0003
Блестящие инкрустации пепельного стекла приятно контрастируют с матовой глиной в работах Аллена. То же самое можно сказать и о разрозненных произведениях Джейн Флисон. Мои любимые — две баночки, похожие на горшочки с медом Винни-Пуха, украшенные каплями. Вариации цвета и текстуры, крошечные манипуляции с глиной, искажающие симметрию, требуют более пристального внимания, обнаруживая крошечные бороздки, в которых скапливается глазурь.
Гейл Розенквист приняла стиль и мудро придерживалась его, создавая характерные дровяные сосуды в оттенках шоколада, мяты и веснушчатых сливок. Зубчатые ободки отражают витиеватые основания, как свитки на вершине коринфской колонны, перевернутые вверх дном.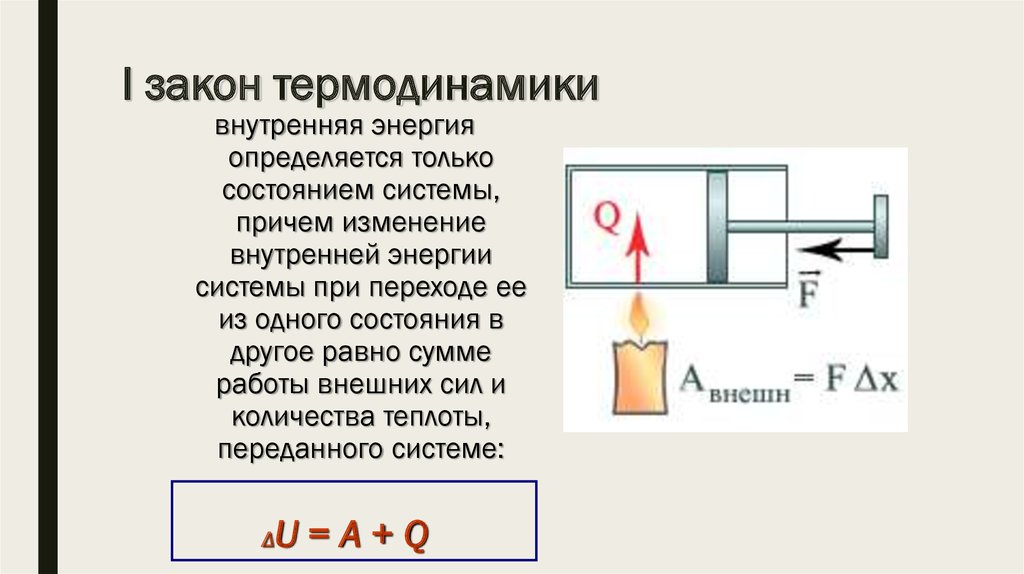 Вполне уместно, что Розенквист цитирует испанского архитектора Антонио Гауди, оказавшего влияние.
Вполне уместно, что Розенквист цитирует испанского архитектора Антонио Гауди, оказавшего влияние.
Фарфоровые тюбики, отлитые в женские формы, — вклад Роальда Моберга в выставку. Три гладких торса — один с беременным животом — неотразимо напоминают Венеру Милосскую . По словам Ходжеса, небольшие различия в цвете были вызваны не глазурью, а размещением каждого изделия в печи. Отсутствующие руки влияют на крутящий момент каждого туловища и на то, как опускается грудь — влияние невидимого на видимое. Небольшие следы на стенках ваз предполагают вдавленные в глину ногти: отсутствующий художник также оказывает незримое влияние на то, что мы видим.
Возможно, это то, что может предложить нам гончарное дело: двумерные носители часто не оставляют физического отпечатка художника на произведении. Физическость медиума также связана с его практической функцией. Хотя не все работы на этой выставке предназначены для использования, каждая форма обязана своей первоначальной утилитарной цели. Но опять же, у искусства есть цель. Это цель.
Но опять же, у искусства есть цель. Это цель.
О рецензенте: Ханна Дентингер пишет об искусстве и литературе. Она также является исследователем средневековой валлийской литературы.
Что: From Out of the Flames
Где: Duluth Art Institute, Duluth, MN
Когда: выставка продлится до 8 июня 2008 г.
Вход БЕСПЛАТНЫЙ и открыт для публики
Автор
Ханна Дентингер вновь открывает для себя культурную жизнь Миннесоты после периода изгнания где-то на Среднем Западе. Пишет об искусстве и литературе. … читать дальше
Гарри Поттер и термодинамика магии – Девка Дарвина
Химия Оставить комментарий мстителиБаффи — истребительница вампировхаосхимияколледжсозданныйуничтожитьДоктор. StrangedragonDresden FilesгномыэнергияэнтальпиэнтропияфуэгоИгра престоловкомпьютерщикБогGoTГарри ДрезденГарри ПоттержараДжим БатчерДжо АберкромбиКинг убийца хроникасквоВластелин колецмагиячудоМистборнмагглесботаникПатрик Ротфуссфизикачитатькрасныйditsалая ведьманаукасимпатическая магияучебникипервая трилогия законатермодинамика Удивительно, но эта тема не обсуждалась ботаниками на Reddit, так что, пожалуй, я начну тренд. Не знаю, как вы, а мой любимый жанр фэнтези — это тот, который пытается объяснить магию через физику и химию. Думаю, именно поэтому я люблю серию «Досье Дрездена», Брендона Сандерсона и «Хроники убийцы королей» (скоро будет ) трилогии так много. Не то чтобы мне не нравились странные, случайные объяснения магии (Игра престолов, Гарри Поттер), но я полагаю, что чем более научное объяснение, тем более «настоящей» является магия.
Не знаю, как вы, а мой любимый жанр фэнтези — это тот, который пытается объяснить магию через физику и химию. Думаю, именно поэтому я люблю серию «Досье Дрездена», Брендона Сандерсона и «Хроники убийцы королей» (скоро будет ) трилогии так много. Не то чтобы мне не нравились странные, случайные объяснения магии (Игра престолов, Гарри Поттер), но я полагаю, что чем более научное объяснение, тем более «настоящей» является магия.
Давайте начнем с разбора основных идей термодинамики (буквально переводится как «движение энергии»). Система и окружение — это два термина, которые описывают два компонента, участвующих в термодинамических реакциях, система — это «рассматриваемая нами часть Вселенной», а окружение — это «все во Вселенной, кроме системы». Эти определения очень сбивают с толку, поэтому позвольте мне сказать так: система — это носитель магии (чернокнижник/ведьма/волшебник), а окружение — это остальная вселенная (дракон, с которым они сражаются, воздух, с которым они борются). дыхание, гномы, сопровождающие их в путешествии, и т. д.).
дыхание, гномы, сопровождающие их в путешествии, и т. д.).
Другим важным компонентом этих реакций является энергия. Энергия определяется как способность совершать работу и/или передавать тепло. Энергия может принимать различные формы: кинетическая (движение), тепло, свет, звук, электричество и т. д. Это может показаться знакомым, поскольку «магия» часто представляется как некоторые из этих форм. Например: Гарри Дрезден высвобождает энергию в виде огня, когда использует заклинание «фуэго». Квоут использует кинетическую энергию, применяя симпатическую магию к объектам, чтобы заставить их двигаться. Вин может использовать потенциальную энергию, храня свою магию в различных металлах.
Последнее, что кому-то нужно выучить на ускоренном курсе термодинамики, — это первый закон (о котором вы, вероятно, слышали раньше). В любом процессе энергия может переходить из одной формы в другую; но его нельзя ни создать, ни разрушить. В тех «странных» объяснениях магии, о которых я упоминал ранее (в основном о Гарри Поттере), люди способны создавать магию (энергию), казалось бы, из ниоткуда (или, по крайней мере, передача этой энергии не описана), тем самым нарушая это первое правило.
Говоря о движении энергии, есть два разных его аспекта: энтальпия и энтропия (офигенное название группы, если вы спросите меня). Проще говоря, энтальпия – это изменение энергии (обычно тепла) до реакции и после того, как реакция произошла. Таким образом, энтальпия в системе Гарри Дрездена может быть выше (сохранено больше энергии) до того, как он произнесет заклинание, и ниже после того, как заклинание было произнесено. Кроме того, если энергия выполнения заклинания (вселенная) больше, чем энергия внутри Гарри (системы) перед произнесением заклинания, это может вызвать обморок или даже смерть (что обсуждалось в сериале). Кроме того, если Гарри хранит кучу энергии внутри себя (системы), не высвобождая ее через заклинание (во вселенную), это также может вызвать болезнь.
Энтропия — более запутанный термин, его определение — измерение хаоса в системе. Проще говоря, система энергетически более выгодна, если энергия распределена более беспорядочно. Например, в чистом кристаллическом веществе молекулы плотно упакованы, оно более упорядочено (и, следовательно, менее неупорядочено), энтропия равна 0, а потенциальная энергия ниже. Энтропия увеличивается, потенциальная энергия увеличивается, а система превращается из твердой в жидкую и в газообразную, потому что молекулы начинают двигаться более беспорядочно. Принцип энтропии в магии исследовался во многих вселенных и часто упоминается как «магия хаоса». Те, кто использует магию хаоса, обычно чрезвычайно сильны и разрушительны, но заклинания часто бывают случайными и не такими точными.
Энтропия увеличивается, потенциальная энергия увеличивается, а система превращается из твердой в жидкую и в газообразную, потому что молекулы начинают двигаться более беспорядочно. Принцип энтропии в магии исследовался во многих вселенных и часто упоминается как «магия хаоса». Те, кто использует магию хаоса, обычно чрезвычайно сильны и разрушительны, но заклинания часто бывают случайными и не такими точными.
Способности Алой Ведьмы часто определяют как «способность изменять вероятности». Она может изменять вероятность того, что что-то произойдет, и поэтому ее сила является воплощением принципа энтропии. В книге Дрезденского файла «Кровавые обряды» Гарри нанят для расследования многих странных смертей (например, попадание под машину во время катания на водных лыжах), которые, как он в конце концов выясняет, являются «проклятием энтропии». Руин в сериале «Рожденный туманом» — это Бог разрушения, который стремится разрушить мир посредством разрушения. Конечно, Итан Рейн из «Баффи — истребительницы вампиров» также является прекрасным примером энтропийной магии, он поклоняется Богу Хаоса и использует свои силы для создания хаоса в мире природы.

 Следовательно, при совершении системой макси-
Следовательно, при совершении системой макси-
 Допустим, оно точно равно
Допустим, оно точно равно 3.
3.