Формулы термодинамики, основные определения
Термодинамикой называют обширный раздел физики, посвященный многочисленным процессам, которые происходят в системах, а также их состояниям. Основой для данного научного направления являются обобщенные факты, полученные в ходе проведения опытов и экспериментов. Для описания явлений, происходящих в термодинамических процессах, используются макроскопические величины.
Что изучает термодинамика
Объектом изучения термодинамики являются тепловые свойства тел, а также систем, которые находятся в состоянии теплового равновесия. Оно объясняется законом сохранения энергии, при этом не учитывается внутреннее строение тел, включенных в систему.
В термодинамике не рассматриваются такие микроскопические величины, как размеры молекул и атомов, их количество и масса. Этот раздел физики рассматривает процессы в большом масштабе
Благодаря созданию законов термодинамики удалось установить связь между несколькими наблюдаемыми физическими величинами, которые характеризуют состояние системы. К ним относится следующие параметры:
К ним относится следующие параметры:
- объем;
- давление;
- концентрация;
- температура;
- энергия.
Указанные параметры не применимы к отдельным молекулам, поскольку используются для детального описания систем в общем виде. Решения, основанные на термодинамических законах, встречаются в различных сферах, в том числе теплотехнике и электроэнергетике. Это свидетельствует о важности понимания химических процессов и фазовых переносов. Принципы термодинамики тесно связаны с квантовой механикой. Эти независимые теории обращаются к физическим явлениям материи и света.
Уравнение идеального газа в термодинамике
Понятие «Идеальный газ» в термодинамике используется для обозначения некой идеализации по аналогии с материальной точкой.
Молекулы элемента в этом случае являются материальными точками. При этом соударения частиц признаются абсолютно упругими и постоянными. Для решения многих задач в термодинамике реальные газы целесообразно принимать за идеальные.
Благодаря этому появляется возможность составлять формулы в упрощенном виде, поскольку не приходится вводить в уравнение большое количество новых величин.
Итак, все молекулы идеального газа находятся в движении. Для того чтобы определить с какой скоростью и массой они движутся, можно применить уравнение состояния идеального тела.
Формула
Формула Клайперона-Менделеева имеет следующий вид:
\[\boldsymbol{P} V=\frac{m}{M} R T\]
Где:
m – масса исследуемого газа;
R – универсальная постоянная, равная 8,3144598 Дж/(моль*кг)
M – начальная молекулярная масса.
Для вычисления точной массы идеального газа используется произведение его объема и плотности. Формула выглядит так:
\[\boldsymbol{m=pV}\]
Между давлением газа и средней кинетической энергией существует некая взаимосвязь. В термодинамике ее называют основным уравнением молекулярно-кинетической теории и представляют в следующем виде:
\[p=\frac{2}{3} n E\]
Где:
n – концентрация молекул, находящихся в движении, по отношению к объему газа;
E – коэффициент средней кинетической энергии.
Первое начало термодинамики. Формулы для изопроцессов
Один из основных законов, который используется для конкретизации общефизического закона сохранения энергии для термодинамических систем, называют первым началом термодинамики. Он учитывает химические, массобменные и термические процессы, происходящие в этих системах. Часто его формулируют как невозможность появления вечного двигателя первого рода, поскольку при совершении работы исчерпывается энергия какого-либо источника.
Итак, первый закон термодинамики звучит следующим образом: количество внутренней теплоты, которое передается газу, расходуется только на совершение работы А и изменение общей энергии газа U.
Формула
Формула первого начала термодинамики имеет следующий вид:
\[Q=\Delta U+A\]
Поскольку газ при необходимости можно нагревать или сжимать, в системе с ним постоянно происходят какие-то изменения. Рассмотрим вариант, когда протекание процессов происходит при одном стабильном параметре, величина которого не меняется.
В изотермическом случае, когда постоянным остается температурный параметр, первое начало термодинамики задействует закон Бойля-Мариотта. Это экспериментальный газовый закон, использующийся для описания тенденции увеличения давления газа при уменьшении его объема.
При изотермическом процессе давление газа будет обратно пропорционально его начальному объему:
\[Q=A\]
В случае с изохорным процессом, когда постоянным остается только объем, применяется закон Шарля. Он описывает соотношение давления и температуры для идеального газа.
Согласно закону, давление газа прямо пропорционально его общей температуре. Изохорный процесс отличается тем, что все количество тепла, подведенного к газу, расходуется на изменение внутренней энергии.
Формула
формула закона Шарля:
\[Q=\Delta A\]
Процесс, происходящий при постоянном давлении, называется изобарным. К нему применяется закон Гей-Люсакка, который гласит, что начальный объем идеального газа прямо пропорционален конечной температуре при условии, что давление остается неизменным. Этот закон применим ко всем газам, а также парам летучих жидкостей, когда их температура выше точки кипения.
Этот закон применим ко всем газам, а также парам летучих жидкостей, когда их температура выше точки кипения.
При изобарном процессе все тепло расходуется на совершение газом работы, а также изменение внутреннего энергетического потенциала. Формула для этого изопроцесса записывается в следующем виде:
\[Q=\Delta U+p \Delta V\]
Этот закон является подтверждением того, что одинаковые объемы газов при постоянном давлении и температуре содержат одинаковое количество молекул.
Второй и третий законы термодинамики
Второй закон термодинамики гласит, что прохождение процесса будет невозможным, если единственным его результатом будет передача энергии с помощью теплообмена к телу с более высокой температурой от тела с низкой. Этот закон позволяет объяснить некоторые явления, которые не противоречат первому началу. Формула второго закона термодинамики используется для определения возрастания энтропии в изолированных системах.
В отличие от первого закона термодинамики, третий позволяет определить, как будет вести себя термодинамическая система около абсолютного нуля температур. Третье начало термодинамики называют теоремой Нернста — Планка.
Третье начало термодинамики называют теоремой Нернста — Планка.
Нет времени решать самому?
Наши эксперты помогут!
Контрольная
| от 300 ₽ |
Реферат
| от 500 ₽ |
Курсовая
| от 1 000 ₽ |
Формула теплоемкости и определение КПД в термодинамике
Удельной теплоемкостью в термодинамике называют теплоемкость образца вещества, поделенную на общую массу образца. Иногда этот термин используется для обозначения массовой теплоемкости.
В термодинамической системе удельная теплоемкость всегда равна количеству, выделенному при нагревании на один градус Цельсия одного килограмма вещества.
Формула
Уравнение теплоемкости в термодинамике зависит от теплоты и определяется по формуле:
\[c=Q m \Delta t\]
Когда в системе остаются неизменными давление и объем, используется показатель – молярная теплоемкость. Ее действие отражается следующей формулой:
\[C v=Q i 2 R\]
Где:
i – число степеней свободы молекул газа.
В самом простейшем варианте тепловая машина состоит из таких элементов, как нагреватель, холодильник и материальное тело.
Тепло передается от нагревателя физическому веществу, за счет чего совершается определенная работа. Затем оно охлаждается с помощью холодильника и процесс повторяется заново.
Наиболее наглядный пример тепловой машины – это двигатель внутреннего сгорания.
Формула
В термодинамике для определения КПД этого устройства, используется формула:
\[\mathbf{n}=\mathbf{Q h}-\mathbf{Q} \times \mathbf{Q h}\]
Изучая основы и уравнения термодинамики, очень важно понять, к настоящему моменту разработано два метода, позволяющих описать физические процессы, которые происходят в макроскопических телах. Это статистический и термодинамический методы.
Представленные в виде формул термодинамики, они позволяют раскрыть смысл экспериментальных закономерностей в виде уравнения идеального газа (закон Менделеева-Клайперона).
Важным отличием термодинамических концепций от систем молекулярной физики является то, что они не предусматривают изучение конкретных взаимодействий, которые происходят с отдельными атомами или молекулами. В термодинамике рассматриваются только постоянные взаимопревращения, а также связь различных видов теплоты, работы и энергии.
В термодинамике рассматриваются только постоянные взаимопревращения, а также связь различных видов теплоты, работы и энергии.
Основные функции состояния
Функции состояния применяются в термодинамике для исследования макросостояний. В них используются показатели, отражающие определенные состояния термодинамического равновесия. Они не зависят от предыстории концепции метода, а также не связаны с переходом в абсолютное состояние.
К основным функциям состояния, которые применяются для газов в термодинамике, относятся:
- температура;
- энтропия;
- внутренняя энергия;
- термодинамические потенциалы.
Следует отметить, что все перечисленные функции состояния не являются абсолютно независимыми. В случае с однородными системами любой термодинамический принцип можно записать в виде выражения с двумя самостоятельными переменными. Таким образом уравнениями общего состояния называют функциональные взаимосвязи термодинамических систем.
В настоящее время используется несколько видов таких уравнений:
- Термическое уравнение состояния – применяется для определения связей между, объемом, температурой и давлением.

- Каноническое уравнение – записывается в виде термодинамического потенциала с использованием соответствующих переменных.
- Калорическое уравнение состояния – соответствует внутреннему энергетическому потенциалу, выраженному в виде функции от объема и температуры.
Знание принципов термодинамики позволяет применять уравнения состояния на практике при возникновении такой необходимости. Для различных термодинамических концепций выражения могут определяться из опыта или с применением способов статистической механики. В пределах термодинамики выражение будет считаться заданным, если система определена изначально.
Второй закон термодинамики – формула, определение кратко
4.4
Средняя оценка: 4.4
Всего получено оценок: 379.
4.4
Средняя оценка: 4.4
Всего получено оценок: 379.
Все процессы в природе происходят с сохранением энергии. Об этом говорит Первый Закон термодинамики. При этом энергия может изменять свою форму, и передаваться между телами. Направление передачи энергии устанавливает Второй Закон термодинамики (иногда говорят Второе Начало термодинамики). Кратко рассмотрим его суть.
Направление передачи энергии устанавливает Второй Закон термодинамики (иногда говорят Второе Начало термодинамики). Кратко рассмотрим его суть.
Направление потоков энергии
Изучая процессы передачи энергии между телами, можно заметить, что энергия всегда передается от тела, обладающего большей энергией, к телу, у которого энергии меньше. Нагретое тело при контакте нагревает холодное, само при этом остывая. В пределах одного тела энергия также распространяется из областей с более высокой температурой в области с более низкой.
Рис. 1. Виды теплопередачи.При этом Первый Закон термодинамики вовсе не запрещает и обратные процессы. Холодное тело, температура которого выше абсолютного нуля, обладает некоторой внутренней энергией, а значит, эту энергию можно передать телу с более высокой температурой, нарушения Первого Закона не произойдет.
Однако опыт говорит о том, что таких процессов в Природе не бывает. Следовательно, существует закон, определяющий направление передачи энергии. Этот закон получил название Второго Закона (начала) термодинамики.
Этот закон получил название Второго Закона (начала) термодинамики.
Второй Закон термодинамики
Второй Закон термодинамики был сформулирован в работах физика Р.Клаузиуса. Он дал ему следующее определение:
Невозможно перенести тепло от более холодной системы к более горячей без других изменений в обеих системах или окружающих телах.
Замечание «без других изменений» принципиально. Оно говорит о том, что передача тепла от более холодного тела к горячему все же возможна, но при этом необходимо затратить дополнительную энергию.
Второй Закон термодинамики распространяется на любые процессы, в которых изменяется внутренняя энергия тел. Превращение механической энергии в тепло также подчиняется этому закону. Обратный процесс, когда внутренняя энергия тела превратится в механическую, возможен только с затратами дополнительной энергии.
Обратимые и необратимые процессы
Следствием Второго Закона термодинамики является необратимость всех процессов в Природе.
Обратимый процесс – это процесс, который может происходить в прямом и обратном направлении, проходя через одни и те же промежуточные состояния без изменений в окружающих телах. Процесс, который может самопроизвольно протекать только в одном направлении, а для протекания в обратном направлении необходимо внешнее воздействие, называется необратимым.
Поскольку практически во всех процессах в Природе происходит изменение внутренней энергии, все они являются необратимыми. Обратимыми они являются только с некоторой степенью точности. Например, процесс одного колебания маятника можно считать обратимым – прямое и обратное качание груза практически полностью зеркальны.
Энтропия системы
Действие Второго Закона термодинамики объясняется его статистическим характером. Теплота тела характеризует среднюю энергию большого числа его молекул. Среди этих молекул могут быть и более энергичные, и менее энергичные.
Но, для того, чтобы одна часть тела стала теплее, а другая холоднее – необходимо чтобы все более энергичные молекулы оказались в одной части, а все менее энергичные – в другой.
Поэтому, хотя отдельные движения молекул могут быть любыми, макроскопическое состояние системы всегда переходит к более вероятному, более хаотичному. Мерой хаоса системы является специальное понятие – энтропия системы $S$.
Рис. 3. Мера беспорядка энтропия.Чем выше энтропия системы, тем более беспорядочно движутся ее составляющие. Все процессы в природе текут в сторону увеличения энтропии, поскольку это направление более вероятно.
Таким образом, если тело имеет температуру $T$, и ему передано количество тепла $ΔQ$, то формула второго закона термодинамики будет выражена соотношением:
$$ΔS \geq { ΔQ \over T}$$
Что мы узнали?
Второй Закон термодинамики гласит, что тепло более горячей системы переходит только в сторону более холодной. Это необратимый процесс, который идет всегда в сторону большего хаоса (в сторону увеличения энтропии). Чтобы тепло перешло от более холодной системы к более горячей, необходимо внешнее воздействие.
Это необратимый процесс, который идет всегда в сторону большего хаоса (в сторону увеличения энтропии). Чтобы тепло перешло от более холодной системы к более горячей, необходимо внешнее воздействие.
Тест по теме
Доска почёта
Николай Поликарпов
10/10
Кристина Иконникова
10/10
Лариса Еремия
10/10
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 379.
А какая ваша оценка?
15.1: Первый закон термодинамики
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1594
- OpenStax
- OpenStax
Цели обучения
К концу этого раздела вы сможете:
- Дать определение первому закону термодинамики.

- Опишите, как сохранение энергии связано с первым законом термодинамики.
- Определить случаи применения первого закона термодинамики в повседневных ситуациях, включая биологический метаболизм.
- Рассчитать изменения внутренней энергии системы после учета теплопередачи и выполненной работы.
Если нас интересует, как теплопередача преобразуется в работу, то важен принцип сохранения энергии. первый закон термодинамики применяет принцип сохранения энергии к системам, в которых передача тепла и выполнение работы являются методами передачи энергии в систему и из нее.
Рисунок \(\PageIndex{1}\): Этот кипящий чайник представляет энергию в движении. Вода в чайнике превращается в водяной пар, потому что тепло передается от плиты к чайнику. По мере того, как вся система нагревается, совершается работа — от испарения воды до свиста чайника. (кредит: Джина Гамильтон) Первый закон термодинамики гласит, что изменение внутренней энергии системы равно чистому переносу тепла  В форме уравнения первый закон термодинамики равен
В форме уравнения первый закон термодинамики равен
\[\Delta U = Q – W. \label{first}\]
Здесь \(\Delta U\) есть изменение внутренней энергии \(U\) системы. \(Q\) – чистого тепла, переданного в систему — то есть \(Q\) представляет собой сумму всего теплопереноса в систему и из нее. \(W\) — это чистая работа, проделанная системой , то есть \(W\) — это сумма всей работы, проделанной системой или над ней. Мы используем следующие соглашения о знаках: если \(Q\) положительна, то в систему имеет место чистый теплообмен; если \(W\) положительно, то система совершает чистую работу. Таким образом, положительный \(Q\) добавляет энергию системе, а положительный \(W\) забирает энергию у системы. Таким образом, \(\Delta U = Q – W\). Обратите также внимание, что если в систему передается больше тепла, чем совершается работа, разница сохраняется в виде внутренней энергии. Хорошим примером этого являются тепловые двигатели — в них происходит передача тепла, чтобы они могли совершать работу (рис.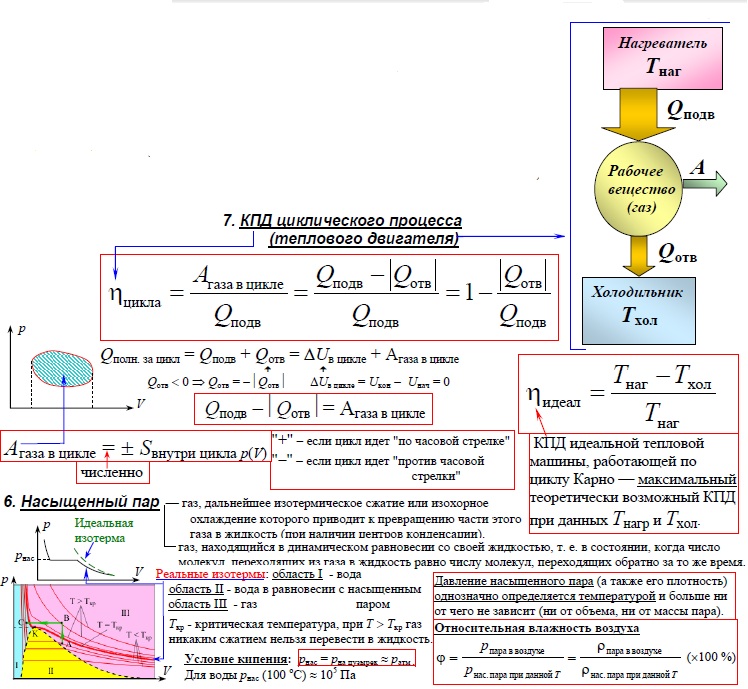
ЗАКОН ТЕРМОДИНАМИКИ И ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ
Первый закон термодинамики на самом деле является законом сохранения энергии, сформулированным в форме, наиболее полезной в термодинамике. Первый закон устанавливает связь между теплопередачей, выполненной работой и изменением внутренней энергии системы.
Теплота
Q и Работа Вт Теплопередача \(Q\) и выполнение работы \(Вт\) – это два повседневных способа подачи энергии в систему или получения энергии из нее. Процессы совсем другие. Теплопередача, менее организованный процесс, обусловлена разницей температур. Работа, вполне организованный процесс, включает в себя действие макроскопической силы на расстоянии. Тем не менее, теплота и работа могут давать одинаковые результаты. Например, и то, и другое может вызвать повышение температуры. Передача тепла в систему, например, когда солнце нагревает воздух в велосипедной шине, может повысить его температуру, и, таким образом, над системой может совершаться работа, например, когда велосипедист накачивает воздух в шину. После того, как произошло повышение температуры, невозможно сказать, было ли оно вызвано теплопередачей или совершением работы. Эта неопределенность является важным моментом. Теплопередача и работа — это энергия в пути — ни одна из них не хранится как таковая в системе. Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Однако и то, и другое может изменить внутреннюю энергию \(U\) системы. Внутренняя энергия — это форма энергии, совершенно отличная от теплоты или работы.
Внутренняя энергия
U Мы можем думать о внутренней энергии системы двумя разными, но непротиворечивыми способами. Первый — это атомно-молекулярный взгляд, который исследует систему в атомном и молекулярном масштабе. внутренняя энергия \(U\) системы есть сумма кинетической и потенциальной энергий ее атомов и молекул. Напомним, что кинетическая плюс потенциальная энергия называется механической энергией. Таким образом, внутренняя энергия представляет собой сумму атомной и молекулярной механической энергии. Поскольку невозможно уследить за всеми отдельными атомами и молекулами, мы должны иметь дело со средними значениями и распределениями. Второй способ представления внутренней энергии системы — ее макроскопические характеристики, которые очень похожи на средние атомные и молекулярные значения.
Макроскопически мы определяем изменение внутренней энергии \(\Delta U\) как соответствующее первому закону термодинамики (уравнение \ref{first}): \[\Delta U = Q – W \nonumber\]
Многие детальные эксперименты подтвердили, что \(\Delta U = Q – W\), где \(\Delta U\) — изменение полной кинетической и потенциальной энергии всех атомов и молекул в системе. Экспериментально установлено также, что внутренняя энергия \(U\) системы зависит только от состояния системы и не как дошло до этого состояния . В частности, установлено, что \(U\) является функцией нескольких макроскопических величин (например, давления, объема и температуры), не зависящих от прошлой истории, например, от того, происходил ли теплообмен или совершалась работа. Эта независимость означает, что если мы знаем состояние системы, мы можем вычислить изменения ее внутренней энергии \(U\) по нескольким макроскопическим переменным.
МАКРОСКОПИЧЕСКОЕ и МИКРОСКОПИЧЕСКОЕ
В термодинамике мы часто используем макроскопическую картину при расчетах поведения системы, в то время как атомарная и молекулярная картина дает основные объяснения в терминах средних значений и распределений. Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Мы еще увидим это в следующих разделах этой главы. Например, в теме энтропии расчеты будут производиться с использованием атомарно-молекулярного представления.
Чтобы получить лучшее представление о внутренней энергии системы, давайте рассмотрим систему, переходящую из состояния 1 в состояние 2. Система имеет внутреннюю энергию \(U_1\) в состоянии 1, и у нее есть внутренняя энергия энергия \(U_2\) в состоянии 2, независимо от того, как она попала в любое состояние. Таким образом, изменение внутренней энергии
\[\Delta U = U_2 – U_1\]
не зависит от того, что вызвало это изменение. Другими словами, \(\delta U\) не зависит от пути . Под путем мы подразумеваем способ добраться из начальной точки в конечную. Почему важна эта независимость? И \(Q\), и \(W\) зависит от пути , но \(\Delta U\) не зависит (уравнение \ref{first}). Эта независимость от пути означает, что внутреннюю энергию \(U\) легче учитывать, чем теплопередачу или выполненную работу.
Пример \(\PageIndex{1}\): расчет изменения внутренней энергии – одно и то же изменение \(U\) вызывается двумя различными процессами система совершает работу 10,00 Дж. Затем из системы передается 25,00 Дж тепла, а над системой совершается работа 4,00 Дж. Каково чистое изменение внутренней энергии системы?

Стратегия
В части (a) мы должны сначала найти чистую теплопередачу и чистую работу, выполненную на основе данной информации. Затем первый закон термодинамики (уравнение \ref{first}).
можно использовать для определения изменения внутренней энергии. В части (b) даны чистая теплопередача и проделанная работа, поэтому уравнение можно использовать напрямую.
Решение для (a)
Чистая теплопередача – это теплопередача в систему за вычетом теплопередачи из системы, или
\[ \begin{align*} Q &= 40.00 \, J – 25.00 \, J \\[5pt] &= 15.00 \, J \end{align*}\]
Аналогично, общая работа равна работе, выполненной системой, за вычетом работы, выполненной системой, или
\[ \begin{align*} W &= 10.00 \, J – 4.00 \, J \\[5pt] &= 6.00 \, J. \end{align*}\]
Обсуждение (а)
Независимо от того, смотрите ли вы на общий процесс или разбиваете его на этапы, изменение внутренней энергии одинаково.
Решение для (b)
Здесь чистая теплопередача и полная работа непосредственно равны \(Q = -150,00 \, Дж\) и \(W = -159,00 \, Дж\), так что
\[ \begin{align*} \Delta U &= Q – W = -150.00 – (-159.00) \\[5pt] &= 9.00 \, J. \end{align*}\]
Обсуждение на (b)
Совершенно другой процесс в части (b) дает те же 9Изменение внутренней энергии на 0,00 Дж, как в части (а). Обратите внимание, что изменение в системе в обеих частях связано с \(\Дельта U\), а не с отдельными задействованными \(Q\) или \(W\). Система оказывается в том же состоянии как в (a), так и в (b). Части (а) и (б) представляют два разных пути, по которым система должна следовать между одними и теми же начальной и конечной точками, и изменение внутренней энергии для каждого одинаково — оно не зависит от пути.
Метаболизм человека и первый закон термодинамики
Метаболизм человека – это преобразование пищи в теплопередачу, работу и накопление жира. Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q – W\) отрицательна.
Метаболизм — интересный пример действия первого закона термодинамики. Теперь мы еще раз взглянем на эти темы через первый закон термодинамики. Рассматривая тело как интересующую нас систему, мы можем использовать первый закон для изучения теплопередачи, выполнения работы и внутренней энергии в различных видах деятельности, от сна до тяжелых упражнений. Каковы некоторые из основных характеристик теплообмена, совершения работы и энергии в организме? Во-первых, температура тела обычно поддерживается постоянной за счет передачи тепла в окружающую среду. Это означает, что \(Q\) отрицательно. Другой факт заключается в том, что тело обычно воздействует на внешний мир. Это означает, что \(W\) положительно. В таких ситуациях тело теряет внутреннюю энергию, так как \(\Delta U = Q – W\) отрицательна.
Теперь рассмотрим последствия еды. Прием пищи увеличивает внутреннюю энергию тела за счет добавления химической потенциальной энергии (это неромантичный взгляд на хороший стейк). Тело усваивает всю пищу, которую мы потребляем. По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
По сути, обмен веществ представляет собой процесс окисления, при котором высвобождается химическая потенциальная энергия пищи. Это означает, что потребление пищи осуществляется в форме работы. Энергия пищи сообщается в специальной единице, известной как калория. Эта энергия измеряется путем сжигания пищи в калориметре, так определяются единицы измерения.
В химии и биохимии одна калория (обозначается строчными буквами как с) определяется как энергия (или теплопередача), необходимая для повышения температуры одного грамма чистой воды на один градус Цельсия. Диетологи и люди, следящие за весом, обычно используют диетических калорий, которые часто называют калориями ( пишется с большой буквы C). Одна пищевая калория — это энергия, необходимая для повышения температуры одного килограммов воды на один градус Цельсия. Это означает, что для химика одна диетическая калория равна одной килокалории, и нужно быть осторожным, чтобы не путать их.
Опять же, рассмотрим внутреннюю энергию, потерянную телом. Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Эта внутренняя энергия может быть использована в трех направлениях: для теплопередачи, для выполнения работы и для накопления жира (крошечная часть также идет на восстановление и рост клеток). Теплообмен и совершение работы забирают внутреннюю энергию из организма, а пища возвращает ее. Если вы едите только нужное количество пищи, то ваша средняя внутренняя энергия остается постоянной. Все, что вы теряете при теплопередаче и выполнении работы, заменяется пищей, так что в долгосрочной перспективе \(\Delta U = 0\). Если вы постоянно переедаете, то \(\Дельта U\) всегда положительна, и ваше тело откладывает эту дополнительную внутреннюю энергию в виде жира. Обратное верно, если вы едите слишком мало. Если значение \(\Delta U\) отрицательное в течение нескольких дней, то организм метаболизирует собственный жир для поддержания температуры тела и выполнения работы, требующей энергии от тела. Этот процесс заключается в том, как диета приводит к потере веса.
Жизнь не всегда так проста, как знает каждый, кто сидит на диете. Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа.
Организм накапливает жир или усваивает его, только если потребление энергии изменяется в течение нескольких дней. После того, как вы сели на основную диету, следующая будет менее успешной, потому что ваше тело меняет реакцию на низкое потребление энергии. Ваш основной уровень метаболизма (BMR) — это скорость, с которой пища преобразуется в теплопередачу и совершается работа, когда тело находится в полном покое. Организм регулирует скорость основного обмена, чтобы частично компенсировать переедание или недоедание. Тело снизит скорость метаболизма, а не устранит собственный жир, чтобы заменить потерянное потребление пищи. Вы будете легче остывать и чувствовать себя менее энергичным в результате более низкой скорости обмена веществ, и вы не будете терять вес так быстро, как раньше. Упражнения помогают похудеть, потому что они производят как теплопередачу от вашего тела, так и работу, а также повышают скорость метаболизма, даже когда вы находитесь в состоянии покоя. Снижению веса способствует также довольно низкая эффективность преобразования внутренней энергии тела в работу, так что потери внутренней энергии в результате выполнения работы намного больше, чем выполненная работа. Следует, однако, отметить, что живые системы не в тепловом равновесии.
Следует, однако, отметить, что живые системы не в тепловом равновесии.
Тело дает нам отличный показатель того, что многие термодинамические процессы являются необратимыми . Необратимый процесс может идти в одном направлении, но не в обратном, при заданном наборе условий. Например, хотя жировые отложения могут быть преобразованы для выполнения работы и передачи тепла, работа, совершаемая над телом, и перенос тепла в него не могут быть преобразованы в жировые отложения. В противном случае мы могли бы пропустить обед, загорая или спускаясь по лестнице. Другим примером необратимого термодинамического процесса является фотосинтез. Этот процесс представляет собой поглощение растениями одной формы энергии — света — и преобразование ее в химическую потенциальную энергию. Оба применения первого закона термодинамики проиллюстрированы на рисунке \(\PageIndex{4}\). Одним из больших преимуществ законов сохранения, таких как первый закон термодинамики, является то, что они точно описывают начальную и конечную точки сложных процессов, таких как метаболизм и фотосинтез, без учета промежуточных осложнений.
Резюме
В таблице представлена сводка терминов, относящихся к первому закону термодинамики.
| Срок | Определение |
|---|---|
| \(У\) | Внутренняя энергия — сумма кинетической и потенциальной энергий атомов и молекул системы. Можно разделить на множество подкатегорий, таких как тепловая и химическая энергия. Зависит только от состояния системы (например, от ее \(P\), \(V\) и \(T\), а не от того, как энергия поступила в систему. Изменение внутренней энергии не зависит от пути9.0221 Изменение внутренней энергии не зависит от пути9.0221 |
| \(Q\) | Тепло — энергия, передаваемая из-за разницы температур. Характеризуется беспорядочным движением молекул. Сильно зависит от пути. Вход \(Q\) в систему положителен. |
| \(Вт\) | Работа — энергия, переданная силой, движущейся на расстояние. Организованный, упорядоченный процесс. Зависит от пути. \(W\), совершаемая системой (либо против внешней силы, либо для увеличения объема системы), положительна. |
- Первый закон термодинамики записывается как \(\Delta U = Q – W\), где \(\Delta U\) – изменение внутренней энергии системы, \(Q\) – чистая теплопередача (сумма всей теплопередачи в систему и из системы), а \(W\) – чистая выполненная работа (сумма всей работы, выполненной системой или системой).
- И \(Q\), и \(W\) представляют собой транзитную энергию; только \(\Delta U\) представляет собой независимую величину, которую можно сохранить.

- Внутренняя энергия \(U\) системы зависит только от состояния системы, а не от того, как она достигла этого состояния.
- Обмен веществ живых организмов и фотосинтез растений являются специализированными видами теплообмена, совершения работы и внутренней энергии систем.
Глоссарий
- первый закон термодинамики
- утверждает, что изменение внутренней энергии системы равно чистому переносу тепла в система минус чистая работа, выполненная система
- внутренняя энергия
- сумма кинетической и потенциальной энергий атомов и молекул системы
- метаболизм человека
- преобразование пищи в теплопередачу, работу и накопленный жир
Эта страница под названием 15. 1: Первый закон термодинамики распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
1: Первый закон термодинамики распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- первый закон термодинамики
- метаболизм человека
- внутренняя энергия
- источник@https://openstax.
 org/details/books/college-physics
org/details/books/college-physics
Проверить определение, уравнения, законы и формулы
Термодинамика — это раздел физики, который занимается концепциями теплового потока и изменения температуры в системе, а также взаимопревращением тепла и других форм энергии. Чтобы понять термодинамику, вы должны знать о тепловых свойствах материи. Термодинамика подчиняется четырем законам. В этой статье мы подробно изучим эти законы и поймем, как мы можем представить систему, используя термодинамические свойства на примерах. Мы также изучим, как мы можем предсказать исход конкретного процесса с помощью термодинамики. Во-первых, давайте разберемся с термодинамической системой.
Термодинамика — это раздел физики, изучающий концепции теплового потока и изменения температуры в системе, а также взаимопревращения тепла и других форм энергии.
Узнайте о двойной природе материи и излучения здесь.
Термодинамическая система- Термодинамическая система изучает поведение газов, это макроскопическая наука.
 Он имеет дело с объемными системами и не касается молекулярного строения материи.
Он имеет дело с объемными системами и не касается молекулярного строения материи. - Для термодинамической системы можно сказать, что система находится в равновесном состоянии, если макроскопические переменные, характеризующие систему, не изменяются во времени.
- Либо, если газ внутри замкнутой системы, которая полностью изолирована от окружающей среды, при некоторых фиксированных значениях P, V, T, m не меняется со временем, можно считать, что он находится в тепловом равновесии.
Узнайте о звуковых волнах здесь.
Содержание
- Основы термодинамики
- Законы термодинамики
- Первый закон термодинамики
- Энтропия
- Второй закон термодинамики
- Третий закон термодинамики
- Законы термодинамики
- 0
 В отличие от кинетики, которая имеет дело со скоростью реакции, термодинамика занимается только начальным и конечным состояниями системы, претерпевающей изменения. Следует отметить, что законы термодинамики применимы только к тем системам, которые находятся в равновесии.
В отличие от кинетики, которая имеет дело со скоростью реакции, термодинамика занимается только начальным и конечным состояниями системы, претерпевающей изменения. Следует отметить, что законы термодинамики применимы только к тем системам, которые находятся в равновесии.Как вы знаете, существуют три фундаментальных закона термодинамики. Но прежде чем обсуждать их подробно, остановимся на некоторых важных терминах, которые будут использоваться при обсуждении термодинамики.
1. СистемаОпределенная часть Вселенной, находящаяся под наблюдением, называется системой.
Типы систем
- Открытая система: Система , которая может обмениваться веществом, а также энергией с окружающей средой, называется открытой системой.
- Закрытая система: Система, которая может обмениваться с окружающей средой энергией, но не материей, называется закрытой системой.
- Изолированная система: Система, которая не может обмениваться с окружающей средой ни веществом, ни энергией, называется изолированной системой.

Оставшаяся часть Вселенной, не являющаяся частью системы, называется окружением.
3. Макроскопические свойства системыЭто свойства любой системы, возникающие в результате объемного поведения материи. Эти свойства можно разделить на два типа:
- Экстенсивные свойства: Свойства системы, значение которых зависит от количества или размера вещества, присутствующего в системе. Например, масса, объем, молярные свойства (молярный объем, молярная теплоемкость и т. д.), площадь поверхности, внутренняя энергия, энтальпия, энтропия, свободная энергия, теплоемкость, сила и т. д.
- Интенсивные свойства: Свойства системы, значение которых не зависит от количества или размера вещества, присутствующего в системе. Например, температура, давление, вязкость, поверхностное натяжение, диэлектрическая проницаемость, удельная теплоемкость, давление пара, показатель преломления и т.
 д.
д.
переменные состояния. Например, температура, давление, объем, состав и т. д.
5. Функции состоянияЭто свойство системы, значение которого зависит только от состояния системы и не зависит от пути или способа достижения состояния. Изменение значения этих свойств зависит только от начального и конечного состояний системы, а не от пути, по которому осуществляется переход от начального состояния к конечному. Например – давление, объем, температура, внутренняя энергия, энтальпия, энтропия.
6. Изотермический процессОпределяется как процесс, при котором изменение давления или объема не влияет на температуру. Следовательно, температура в этом процессе остается постоянной.
7. Адиабатический процесс Процесс, при котором система не обменивается теплом с окружающей средой. Это означает, что тепло не уходит и не входит в систему.
Определяется как процесс, при котором давление в системе остается постоянным.
9. Изохорный процессКогда объем системы остается постоянным независимо от изменения давления или температуры, тогда этот процесс известен как изохорный процесс.
10. Обратимый процессПроцесс, в котором направление может быть изменено на противоположное на любой стадии путем небольшого изменения такой переменной, как температура, давление и т. д.
11. Необратимый процессПроцесс необратимый процесс называется необратимым. Все природные процессы необратимы.
12. Циклический процессПроцесс, при котором система претерпевает ряд изменений и в конечном итоге возвращается в исходное состояние.
Законы термодинамикиТеперь, чтобы понять тепловой поток и механику термодинамики, есть четыре закона, которые были предложены и называются законами термодинамики, которые можно дать как
Нулевой закон термодинамики Впервые этот закон был предложен в 1931 Р. Х. Фаулера. Он утверждает, что если две термодинамические системы находятся в тепловом равновесии каждая с третьей, то они находятся в тепловом равновесии друг с другом.
Х. Фаулера. Он утверждает, что если две термодинамические системы находятся в тепловом равновесии каждая с третьей, то они находятся в тепловом равновесии друг с другом.
Рис. – (a) Системы A и B разделены адиабатической стенкой, при этом каждая из них контактирует с третьей системой C через проводящую стенку. (b) Адиабатическая стенка между А и В заменена проводящей стенкой, а С изолирована от А и В адиабатической стенкой.
Либо можно сказать, что когда тело А находится в тепловом равновесии с телом В, а также отдельно с телом С, то В и С будут находиться в тепловом равновесии друг с другом. Это основа измерения температуры.
Запишитесь на полный курс термодинамики здесь!
Первый закон термодинамики Первый закон термодинамики является переформулировкой закона сохранения энергии. В нем говорится, что энергия не может быть создана или уничтожена в изолированной системе; энергия может только передаваться или изменяться из одной формы в другую.
Когда к газу подводится тепловая энергия, могут произойти две вещи:
Внутренняя энергия газа может измениться
Газ может совершать внешнюю работу, расширяясь 9{V_2}PdV\)
Итак, отсюда можно сказать, что работа, совершаемая системой, будет полностью зависеть от изменения объема ΔV и давления в системе.
Отсюда можно сказать, что работа, совершаемая системой, целиком зависит от пути, по которому идет система.
Ознакомьтесь с основными и важными физическими единицами и измерениями здесь.
ЭнтропияСтепень случайности системы называется энтропией системы.
т. е. энтропия системы может быть выражена как
\(\Delta S={\Delta Q \over{\Delta T}}\text{ или }\int{dQ \over T}\)
Где,
ΔS = изменение энтропии;
ΔQ/dQ = теплопередача;
T = температура
Итак, для адиабатических процессов ΔQ = 0, следовательно, Энтропия данной системы также будет равна нулю.
Подробнее об электромагнитной индукции см. здесь.
здесь.
- Первый закон термодинамики помог нам понять принцип сохранения энергии. Согласно второму закону термодинамики, в природных системах тепло всегда течет в одном направлении (более высокая температура к более низкой температуре тела), если этому не способствует внешний фактор. Например, если лед тает, тепло всегда будет перетекать от льда в горячую атмосферу окружающей среды, если только он не будет храниться в морозильной камере.
- Следовательно, энтропия всегда будет возрастать для естественных процессов (таких как конвекция течения воды, таяние льда и т. д.)
- Для любого обратимого процесса эти правила также будут верны, поэтому
\(\Delta S=\int{ dQ \over T}\)
- Если система изолирована, энтропия окружения не меняется и ΔS ≥ 0 для изолированной системы. Поэтому энтропия изолированной системы либо возрастает, либо в пределе остается постоянной.
- Знак равенства сохраняется, если процесс, протекающий в системе, обратим, знак неравенства сохраняется, если в процессе присутствует какая-либо необратимость.
 Это утверждение обычно называют принципом возрастания энтропии.
Это утверждение обычно называют принципом возрастания энтропии.
Необратимые или спонтанные процессы могут происходить только в том направлении, в котором увеличивается энтропия Вселенной или изолированной системы. Эти процессы не могут происходить в направлении уменьшения энтропии.
Для изолированной системы,
- ΔS > 0, для необратимых процессов
- ΔS = 0, для обратимых процессов
- ΔS < 0, процесс невозможен
- Для обратимых процессов ΔS = 0 (т.е. энтропия остается постоянной.) Подробно о магнитном эффекте электрического тока. Третий закон термодинамики
Третий закон термодинамики гласит: При температуре абсолютного нуля градусов энтропия идеального и идеально кристаллического твердого тела равна нулю.
Итак, это все о термодинамике. Надеюсь, это помогло вам изучить концепции. Если вы с нетерпением ждете возможности попрактиковаться в этом, то вам будет приятно узнать, что мы предлагаем бесплатные пробные тесты в нашем приложении Testbook.
Часто задаваемые вопросы о законах термодинамики Загрузите его бесплатно прямо сейчас!
Загрузите его бесплатно прямо сейчас!В.1 Что такое нулевой закон термодинамики?
Ответ 1 Он утверждает, что если две термодинамические системы находятся в тепловом равновесии каждая с третьей, то они находятся в тепловом равновесии друг с другом.
Q.2 Что такое первый закон термодинамики?
Ответ 2 Первый закон термодинамики является переформулировкой закона сохранения энергии. В нем говорится, что энергия не может быть создана или уничтожена в изолированной системе; энергия может только передаваться или изменяться из одной формы в другую.
Q.3 Что такое второй закон термодинамики?
Ответ 3 Согласно второму закону термодинамики, в природных системах тепло всегда течет в одном направлении (более высокая температура к более низкой температуре тела), если этому не способствует внешний фактор.





 org/details/books/college-physics
org/details/books/college-physics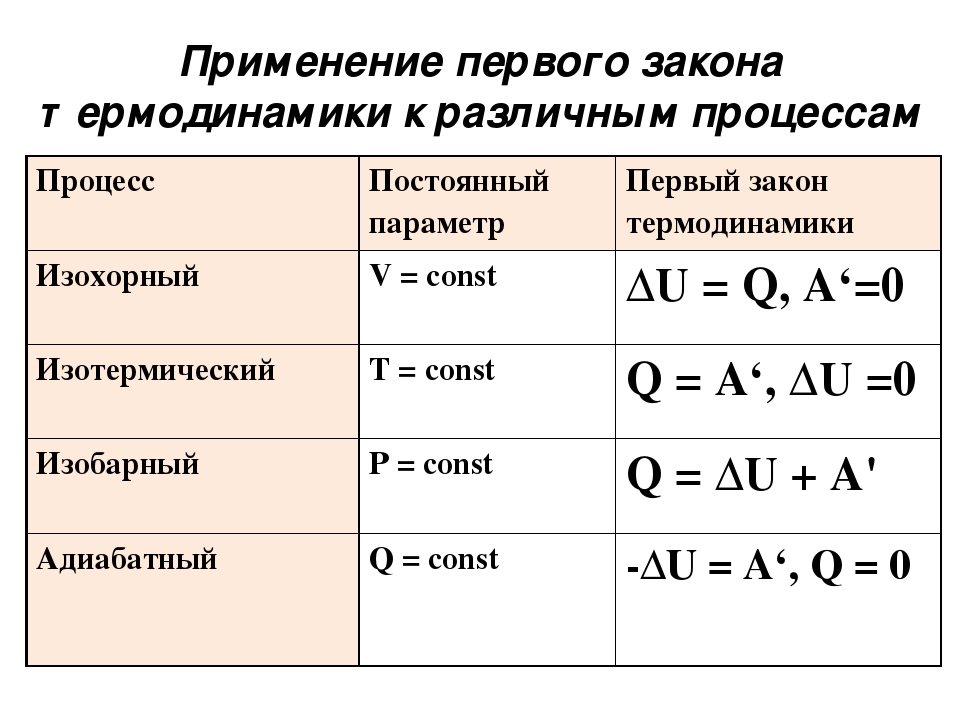 Он имеет дело с объемными системами и не касается молекулярного строения материи.
Он имеет дело с объемными системами и не касается молекулярного строения материи.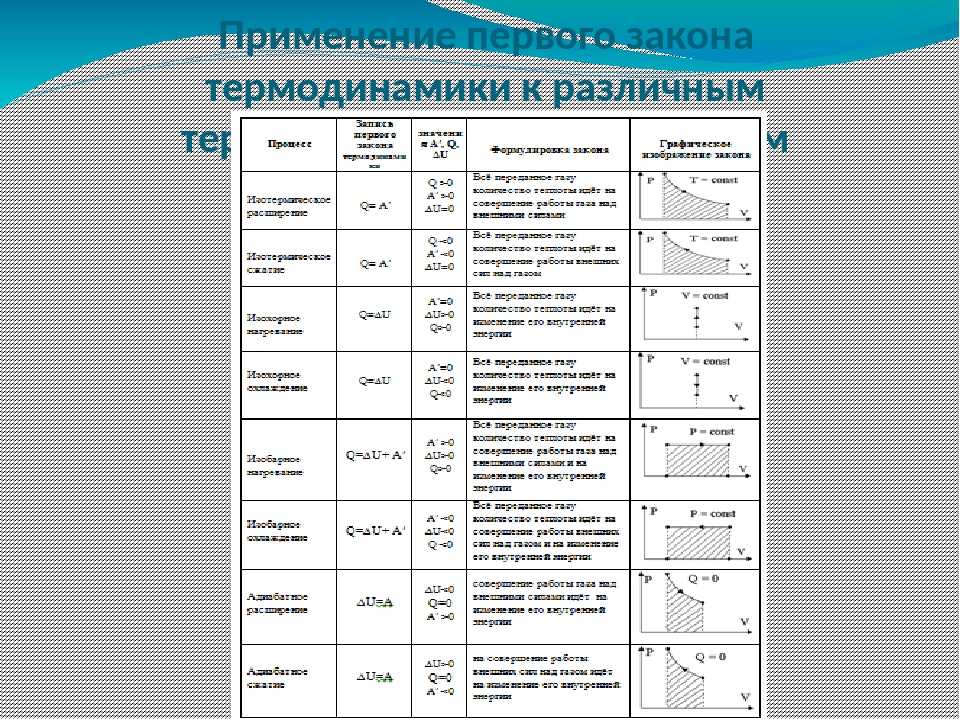
 д.
д. Это утверждение обычно называют принципом возрастания энтропии.
Это утверждение обычно называют принципом возрастания энтропии. Загрузите его бесплатно прямо сейчас!
Загрузите его бесплатно прямо сейчас!