Что такое алюминий
Лёгкий, прочный, стойкий к коррозии и функциональный – именно это сочетание качеств сделало алюминий главным конструкционным материалом нашего времени. Алюминий есть в домах, в которых мы живем, автомобилях, поездах и самолетах, на которых мы преодолеваем расстояния, в мобильных телефонах и компьютерах, на полках холодильников и в современных интерьерах. А ведь еще 200 лет назад об этом металле мало что было известно.
Рубины, сапфиры, изумруды и аквамарин являются минералами алюминия.
Первые два относятся к корундам – это оксид алюминия (Al2O3) в кристаллической форме. Он обладает природной прозрачностью, а по прочности уступает только алмазам. Пуленепробиваемые стекла, иллюминаторы в самолетах, экраны смартфонов производятся именно с применением сапфира.
А один из менее ценных минералов корунда – наждак используется как абразивный материал, в том числе для создания наждачной бумаги.
На сегодняшний день известно почти 300 различных соединений и минералов алюминия – от полевого шпата, являющегося основным породообразующим минералом на Земле, до рубина, сапфира или изумруда, уже не столь распространенных.
Ханс Кристиан Эрстед (1777–1851) – датский физик, почетный член Петербургской академии наук (1830). Родился в городе Рудкёрбинге в семье аптекаря. В 1797 году окончил Копенгагенский университет, в 1806 – стал профессором.
Но каким бы распространенным ни был алюминий, его открытие стало возможным только, когда в распоряжении ученых появился новый инструмент, позволяющий расщеплять сложные вещества на простые, – электрический ток.
И в 1824 году с помощью процесса электролиза датский физик Ханс Кристиан Эрстед получил алюминий. Он был загрязнен примесями калия и ртути, задействованных в химических реакциях, однако это был первый случай получения алюминия.
Используя электролиз, алюминий производят и в наши дни.
Сырьем для производства алюминия сегодня служит еще одна распространенная в природе алюминиевая руда – бокситы. Это глинистая горная порода, состоящая из разнообразных модификаций гидроксида алюминия с примесью оксидов железа, кремния, титана, серы, галлия, хрома, ванадия, карбонатных солей кальция, железа и магния – чуть ли не половины таблицы Менделеева.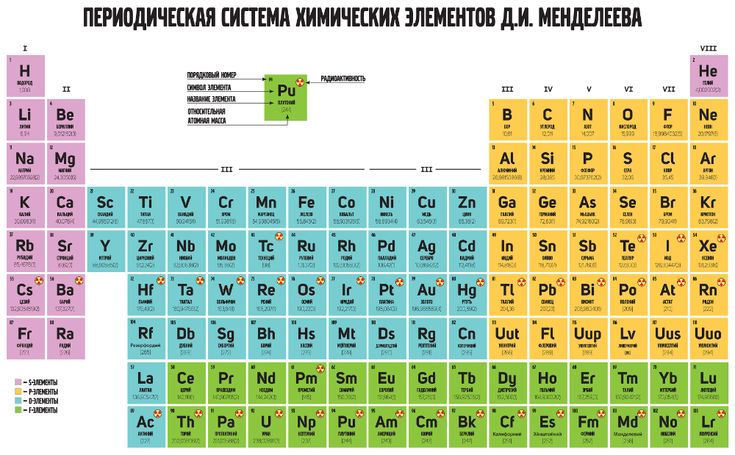 В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
В среднем из 4-5 тонн бокситов производится 1 тонна алюминия.
Бокситы в 1821 году открыл геолог Пьер Бертье на юге Франции. Порода получила свое название в честь местности Ле-Бо (Les Baux), где была найдена. Около 90% мировых запасов бокситов сосредоточено в странах тропического и субтропического поясов – в Гвинее, Австралии, Вьетнаме, Бразилии, Индии и на Ямайке.
Из бокситов получают глинозем. Это оксид алюминия Al2O3, который имеет форму белого порошка и из которого путем электролиза на алюминиевых заводах производят металл.
Производство алюминия требует огромного количества электроэнергии. Для производства одной тонны металла необходимо около 15 МВт*ч энергии – столько потребляет 100-квартирный дом в течение целого месяца.Поэтому разумнее всего строить алюминиевые заводы поблизости от мощных и возобновляемых источников энергии. Самое оптимальное решение – гидроэлектростанции, представляющие самый мощный из всех видов «зеленой энергетики».
Свойства алюминия
Алюминий имеет редкое сочетание ценных свойств. Это один из самых легких металлов в природе: он почти в три раза легче железа, но при этом прочен, чрезвычайно пластичен и не подвержен коррозии, так как его поверхность всегда покрыта тончайшей, но очень прочной оксидной пленкой. Он не магнитится, отлично проводит электрический ток и образует сплавы практически со всеми металлами.
В три раза легче железа
Сравним по прочности со сталью
Поддается всем видам механической обработки
Тонкая оксидная пленка защищает от коррозии
Алюминий легко обрабатывается давлением, причем как в горячем, так и в холодном состоянии. Он поддается прокатке, волочению, штамповке. Алюминий не горит, не требует специальной окраски и не токсичен в отличие от пластика.
Очень высока ковкость алюминия: из него можно изготовить листы толщиной всего 4 микрона и тончайшую проволоку.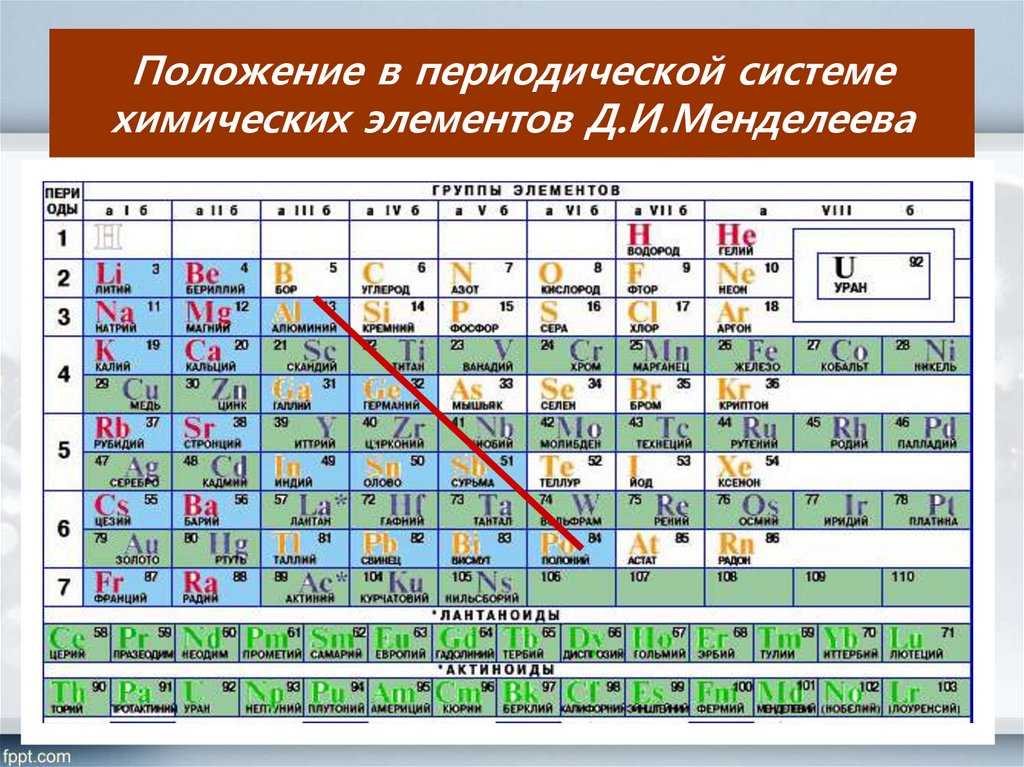 А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
А сверхтонкая алюминиевая фольга втрое тоньше человеческого волоса. Кроме того, по сравнению с другими металлами и материалами он более экономичен.
Высокая способность к образованию соединений с различными химическими элементами породила множество сплавов алюминия. Даже незначительная доля примесей существенно меняет характеристики металла и открывает новые сферы для его применения. Например, сочетание алюминия с кремнием и магнием в повседневной жизни можно встретить буквально на дороге – в форме литых колесных дисков, двигателей, в элементах шасси и других частей современного автомобиля. А если добавить в алюминиевый сплав цинк, то, возможно, вы сейчас держите его в руках, ведь именно этот сплав используется при производстве корпусов мобильных телефонов и планшетов. Тем временем ученые продолжают изобретать новые и новые алюминиевые сплавы.
Сегодня существование строительной, автомобильной, авиационной, космической, электротехнической, энергетической, пищевой и других отраслей промышленности невозможно без алюминия.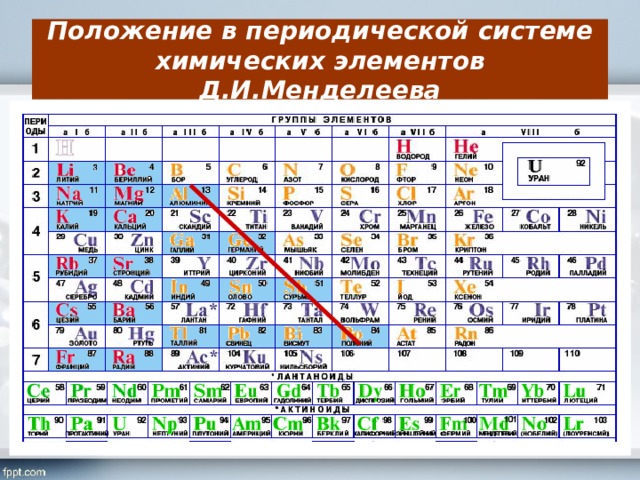 Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Более того, именно этот металл стал символом прогресса – все новейшие электронные устройства, средства передвижения изготавливаются из алюминия.
Если заменить всю медную проводку в автомобиле
на алюминиево-циркониевую, то его общий
вес уменьшится на 12 кг
По расчетам Международного института алюминия (IAI), в мире накопилось около 400 миллионов тонн алюминия в инфраструктуре, быту, транспорте.
Казалось бы, вышеперечисленный набор характеристик уже сам по себе достаточен для того, чтобы алюминий стал металлом приоритетного выбора в индустрии, однако есть еще одна, не менее значимая характеристика. Использование алюминия может быть бесконечно: этот металл и сплавы из него можно неоднократно переплавлять без утраты механических характеристик. Ученые подсчитали, что 1 кг собранных и сданных в переплавку алюминиевых банок позволяет сэкономить 8 кг боксита, 4 кг различных фторидов и 14 кВт/ч электроэнергии.
Около 75% алюминия, выпущенного за все время существования отрасли, используется до сих пор.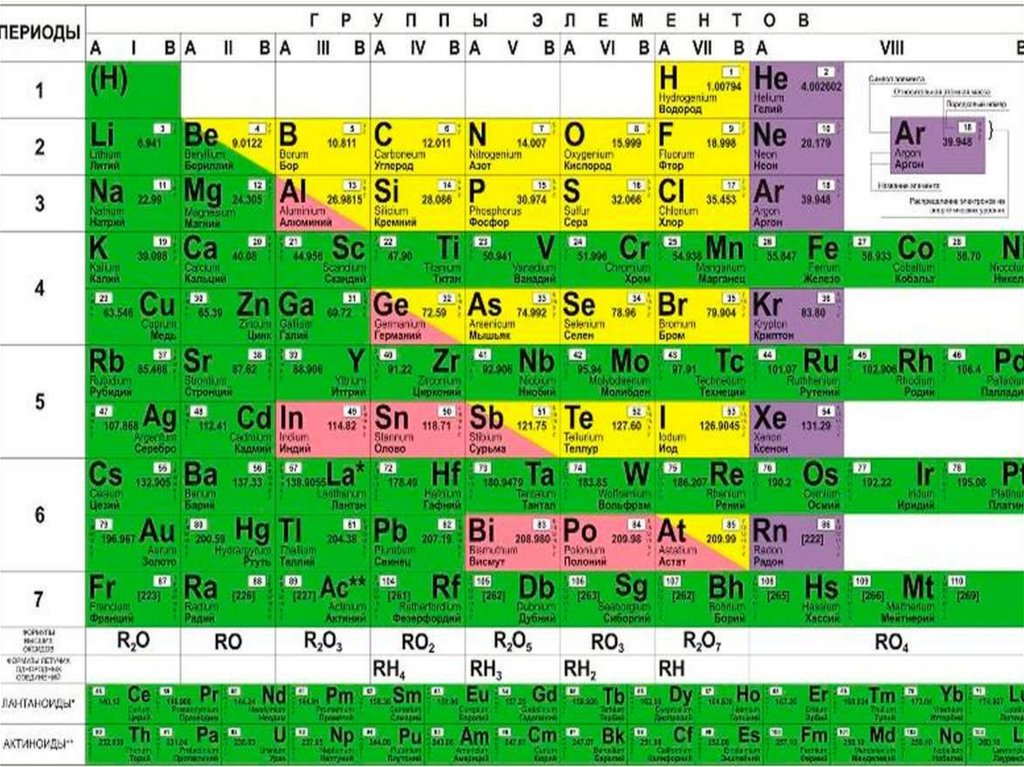
В статье использованы фотоматериалы © Shutterstock и © Rusal.
как определить и что это такое в химии
Слово «валентность» звучит красиво и одновременно загадочно. В этой статье вместе с экспертом разберемся, что скрывается за этим словом: что такое валентность, как ее определить и какова ее роль в химии. Напоследок проверим свои знания с помощью «химического» теста
Игорь Геращенко
Автор КП
Анастасия Чистякова
Старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок»
Термин «валентность» появился еще в Средние века, где в научных трудах он имел значение «препарат», «экстракт». И только в конце ХIХ столетия его стали использовать для обозначения связей между мельчайшими частицами вещества.
В 1852 году английский химик Э. Франкленд ввел в химию понятие «соединительная сила», которое положило начало учению о валентности.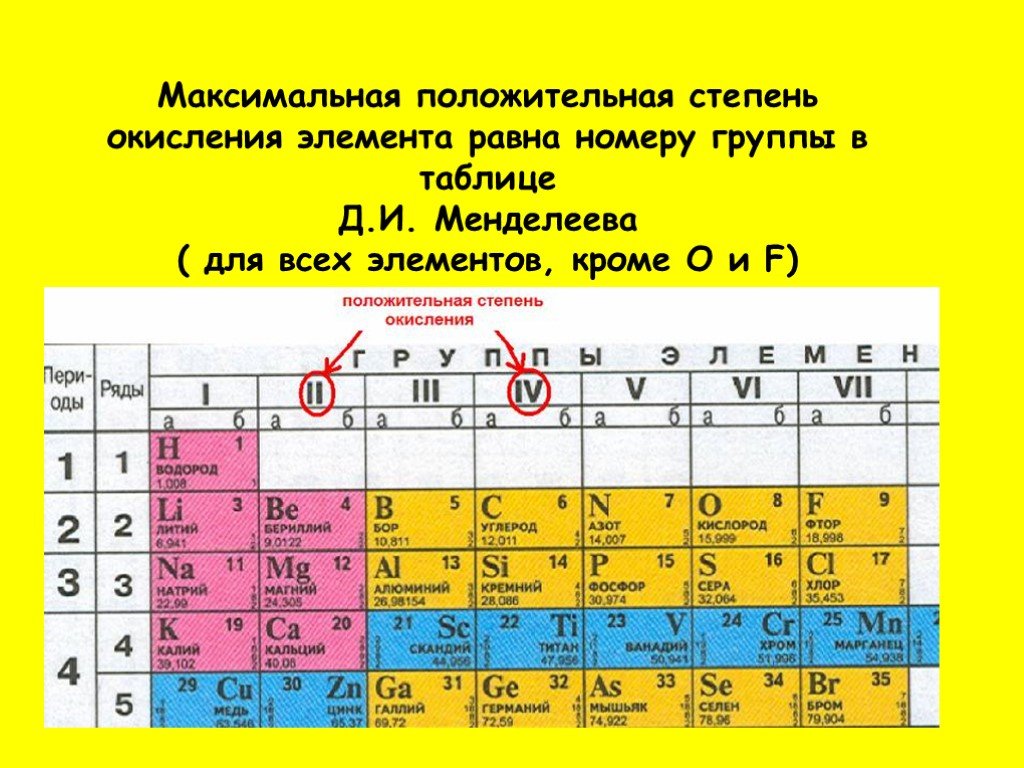 В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
В 1857 году немецкий ученый Ф. А. Кекуле, изучая свойства углерода в метане, пришел к выводу о существовании «основности» атомов – таком же важном и постоянном свойстве, как атомный вес. Спустя три года российский химик А. М. Бутлеров усовершенствовал учение о валентности, распространив его на органические соединения.
Что такое валентность в химии
Валентность – это способность атома образовывать химические связи с другими атомами. Такие связи создаются за счет электронов, расположенных на внешнем электронном слое. Поэтому количественной мерой валентности становится число совместных связей между атомами.
Химические соединения предполагают формирование общих электронных пар. Этот процесс получил наименование «ковалентная химическая связь». В зависимости от числа общих электронных пар выделяют одинарную, двойную и тройную ковалентную связь.
Большим достижением в химии стало наглядное изображение молекул, с помощью которого легко представить себе понятие валентности и ковалентной связи. К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
К примеру, водород имеет сокращенную химическую формулу H₂ и структурную формулу: Н – Н. Во втором случае видно, что водород обладает одновалентностью, поскольку связан в молекуле только с одним своим собратом.
Формула воды H₂O и Н – О – Н наглядно свидетельствует о двухвалентности кислорода, так как он способен создавать две ковалентные связи с атомами водорода.
Углекислый газ CO₂ и О = С = О состоит из двух атомов кислорода и атома углерода, у которого валентность равна четырем. Он может присоединять 2 двухвалентных атома кислорода либо 4 одновалентных атома водорода, как в метане СН₄.
Как определить валентность химических элементов
Существуют разные способы определения валентности химических элементов. Самый простой заключается в том, чтобы обратиться к специальной таблице валентности химических элементов.
Другой способ связан с расчетом валентности по химической формуле. За единицу валентности принимается валентность атома водорода, так как он способен образовывать с другими атомами только одну связь. Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Химические элементы, взаимодействуя с водородом, показывают собственную валентность. Например, в молекуле хлористого водорода (HCl) хлор имеет валентность I. В молекуле аммиака (NН₃) азот соединен с тремя атомами водорода, следовательно, его валентность – III.
Кроме водорода, валентность химических элементов можно определять по кислороду, который во всех своих соединениях двухвалентен. Так, в оксиде серы (IV) SO₂ валентность серы равна IV (валентность кислорода умножаем на 2). А в соединении SO₃ валентность серы уже VI (два умножаем на три).
Когда речь идет о сложных соединениях, где присутствует более двух химических элементов, определить валентность каждого из них становится сложнее. О молекуле HClO₄ можно только сказать, что остаток ClO₄ одновалентен, а в соединении H₂SO₄ остаток SO₄ двухвалентен.
В сложных соединениях, где присутствует более двух химических элементов, определить валентность можно по химическим формулам. Фото: pixabay.com
Таблица валентности химических элементов
Приведем в качестве примера таблицу валентности наиболее распространенных химических элементов. Звездочкой отмечены элементы с постоянной валентностью.
Звездочкой отмечены элементы с постоянной валентностью.
Популярные вопросы и ответы
Отвечает Анастасия Чистякова, старший методист по естественно-научному направлению Домашней школы «ИнтернетУрок»
Что такое постоянная валентность?
– В таблице Менделеева существуют так называемые элементы с постоянной валентностью. Свое название они получили из-за способности образовывать строго определенное количество химических связей. Постоянная валентность чаще всего совпадает с номером группы, где находится элемент. Таких элементов сравнительно немного, поэтому их можно легко запомнить.
Постоянную валентность I (могут присоединять или замещать только один атом другого элемента) имеют щелочные металлы (Li, Na, K, Rb, Cs, Fr) и фтор (F).
Постоянную валентность II (способность присоединить или заместить только два атома других элементов) имеют металлы второй группы, главной подгруппы (Be, Mg, Ca, Sr, Ba, Ra) и кислород (O).
Постоянную валентность III имеет всего лишь один элемент – алюминий (Al), так как только он способен присоединить либо заместить три атома других химических элементов.
Как определить валентность по таблице Менделеева?
– Большинство химических элементов обладают переменной валентностью, и ее можно определить по таблице Менделеева. В этой таблице номер группы соответствует высшей валентности элемента. Если от восьми отнять номер группы, где находится элемент, мы узнаем его низшую валентность. Например, высшая валентность серы (S) – 6, так как она находится в шестой группе, а низшая – 2 (8 – 6 = 2).
Правда, бывают и исключения, которые нужно запомнить. Кремний (Si) находится в IV группе, и можно сделать предположение, что его низшая валентность – IV. Однако это не так. Низшая валентность кремния – II. Азот (N) расположен в V группе, но его низшая валентность также II.
Чем валентность отличается от степени окисления?
– Понятия «валентность» и «степень окисления» являются близкими по своему значению, но далеко не тождественными. Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность определяет количество химических связей, которыми атом элемента связан с другими атомами в молекуле. Степень окисления используется для описания тех реакций, которые сопровождаются присоединением либо отдачей электронов.
Валентность нейтральна, а степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления соответствует количеству отданных электронов, отрицательная – числу присоединенных. Нулевая степень окисления говорит о том, что данный элемент находится или в состоянии простого вещества, или был восстановлен до нуля после окисления, или окислен до нуля после предшествующего восстановления.
Чаще всего валентность и степень окисления количественно равны, однако бывают и исключения, которые необходимо запомнить. Например, в азотной кислоте (HNO₃) валентность атома N равна IV, а степень окисления +5. В молекуле CO углерод имеет валентность II, а степень окисления +2
Валентность элементов
Выполните несложные задания и проверьте, насколько хорошо вы разобрались в теме.
| Пройти тест |
В Древней Греции
В Средние века
В Новое время
| Дальше |
| Проверить |
| Узнать результат |
Способность атома отдавать электроны
Способность атома присоединять электроны
Способность атома образовывать химические связи с другими атомами
| Дальше |
| Проверить |
| Узнать результат |
Водород (Н)
Сера (S)
Хлор (Cl)
| Дальше |
| Проверить |
| Узнать результат |
Железо (Fe)
Кислород (O)
Бром (Br)
| Дальше |
| Проверить |
| Узнать результат |
Ковалентная
Металлическая
Ионная
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
| Дальше |
| Проверить |
| Узнать результат |
Перечитайте статью еще раз. Уверены: результат будет лучше!
Уверены: результат будет лучше!
| Пройти еще раз |
Перечитайте статью еще раз. Уверены: результат будет лучше!
| Пройти еще раз |
Перечитайте статью еще раз. Уверены: результат будет лучше!
| Пройти еще раз |
Вы освоили материал, однако ошибки еще есть.
| Пройти еще раз |
Вы освоили материал, однако ошибки еще есть.
| Пройти еще раз |
Поздравляем! У вас отличный результат.
| Пройти еще раз |
Фото на обложке: pexels.com
Lithium is the 3rd element of the periodic table of elements
| Attribute | Value |
|---|---|
| Name | Lithium |
| Symbol | Li |
| Atomic Number | 3 |
| Atomic Вес [1,3] | 6,94* |
| 0011 | |
| кипящий точке [4,5] | 1342 ° C (Цельсия) 2447,6 ° F (Fahrenheit) 1615.  15K (Kelvin) 15K (Kelvin) |
| Ионизация энергии, EV [2] | |
| Ионизация энергии, EV [2] | |
| . | |
| Плотность [4,5] | 0,534 Грамма на (кубический сантиметр) или 0,308671582848 ун (на кубический дюйм) при 20 ° Com | 1010 литий литий литий. | цена | объем к весу | вес к объему | моль к объему и массе | плотность] |
Легенда:
- Атомный вес:
- [ ] указывает на атомный вес самого долгоживущего изотопа.
- * указывает на условные атомные веса IUPAC; стандартные атомные массы этих элементов выражены через интервалы; см. iupac.org для объяснения и значений.
- ( ) указывает на неопределенность решения, указанную в скобках и следующую за последней значащей цифрой, к которой она относится; см. iupac.org для объяснения и значений.

- Энергия ионизации:
- [ ] указывает, что значение Энергии ионизации получено из известных экспериментальных значений или путем полуэмпирического расчета с абсолютной точностью, отраженной в количестве значащих цифр; см. nist.gov для объяснения и значений.
- ( ) показывает теоретическое значение энергии ионизации ; см. nist.gov для объяснения и значений.
- Общий для любого атрибута:
- н/д указывает, что значения температуры плавления или кипения, энергии ионизации или плотности недоступны.
Литература:
- 1. Периодическая таблица элементов. Национальный институт стандартов и технологий, Министерство торговли США. Последнее обращение: 27 августа 2020 г.
- 2. Периодическая таблица элементов. Лос-Аламосская национальная лаборатория, LLC для NNSA Министерства энергетики США.
 Последнее обращение: 27 августа 2020 г.
Последнее обращение: 27 августа 2020 г. - 3. Выход энергии атомной ионизации. Национальный институт стандартов и технологий, Министерство торговли США. Последнее обращение: 27 августа 2020 г.
- 4. Атомные массы элементов 2018 г. (Технический отчет IUPAC). Последнее обращение: 27 августа 2020 г.
- 5. Проект PubChem. Национальный центр биотехнологической информации, Национальная медицинская библиотека США. Последнее обращение: 27 августа 2020 г.
- 6. Химия элементов Н. Н. Гринвуд (автор), А. Эрншоу (автор). Опубликовано Butterworth-Heinemann; 2-е издание. 9 декабря, 1997 (платная ссылка на amazon.com).
Foods, питательные вещества и калории
Освободившиеся специальные продукты, крекеры трав, UPC: 085996005321 содержат (S) 607 калорий на 100 граммов (≈3,53 OUNCE) [цена]
8 81501501501501501501501501501501501501501501501501501508. Список этих продуктов, начиная с самого высокого содержания ретинола и самого низкого содержания ретинолаГравий, вещества и масла
CaribSea, Freshwater, Eco-Complete Cichlid, Gravel весит 1 153,33 кг/м³ (72,00004 фунта/фут³) с удельным весом 1,15333 относительно чистой воды. Подсчитайте, сколько этого гравия требуется для достижения определенной глубины в цилиндрическом, четвертьцилиндрическом или прямоугольном аквариуме или пруду [вес к объему | объем к весу | цена ]
Подсчитайте, сколько этого гравия требуется для достижения определенной глубины в цилиндрическом, четвертьцилиндрическом или прямоугольном аквариуме или пруду [вес к объему | объем к весу | цена ]
трифторарсин, жидкий [AsF 3 ] весит 2 666 кг/м³ (166,43294 фунта/фут³) [ вес к объему | объем к весу | цена | моль к объему и весу | масса и молярная концентрация | плотность ]
Преобразование объема в вес, веса в объем и стоимости для Тунговое масло с температурой в диапазоне от 10°C (50°F) до 140°C (284°F)
Веса и измерения
Дина на квадратная миля — это единица давления, при которой сила в одну дин (дин) приложена к площади в одну квадратную милю.
Сила, действующая на объект, может вызвать ускорение объекта.
таблица преобразования унций/нм² в унции т/ярд², конвертер единиц унции/нм² в унции т/ярд² или перевод всех единиц измерения поверхностной плотности.
Калькуляторы
Расчет максимальной частоты сердечных сокращений (МЧСС) в зависимости от возраста и пола
AP Chemistry Help
Студенты, нуждающиеся в помощи AP Chemistry, получат большую пользу от нашей интерактивной программы.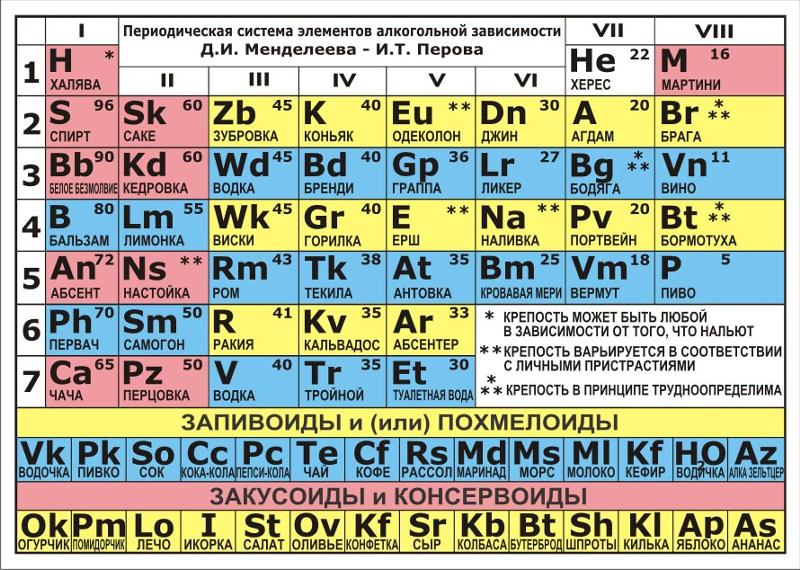 Мы разбираем все ключевые элементы, чтобы вы могли получить адекватную помощь AP Chemistry.
Имея под рукой обязательные концепции обучения и соответствующие практические вопросы, вы мгновенно получите много помощи от AP Chemistry.
Получите помощь сегодня с нашей обширной коллекцией важной информации AP Chemistry.
Мы разбираем все ключевые элементы, чтобы вы могли получить адекватную помощь AP Chemistry.
Имея под рукой обязательные концепции обучения и соответствующие практические вопросы, вы мгновенно получите много помощи от AP Chemistry.
Получите помощь сегодня с нашей обширной коллекцией важной информации AP Chemistry.
Если вам нужна помощь в подготовке к экзамену AP по химии, ознакомьтесь с бесплатными ресурсами, предоставляемыми университетскими репетиторами, чтобы получить представление о многочисленных способах обучения. Вы можете начать с прохождения бесплатного диагностического теста AP по химии, чтобы понять, какие концепции вы хорошо знаете, а какие вам еще предстоит изучить. После этого вы можете пройти бесплатные практические тесты AP по химии, чтобы сосредоточиться на изучении тем, которые вы понимаете хуже всего. Если у вас нет времени пройти весь практический тест AP Chemistry, вы можете использовать бесплатные карточки AP Chemistry Flashcards от Varsity Tutors, чтобы учиться в течение более коротких периодов времени.
AP Химия
Атомная структура и свойства
Атомная структура и электронная конфигурация
Состав смесей
Элементный состав чистых веществ
Масс-спектроскопия элементов
Моль и молярная масса
Фотоэлектронная спектроскопия
Химические реакции
Введение в реакции
Чистые ионные уравнения
Соединения и молекулы
Склеивание и силы
Межмолекулярные силы
Внутримолекулярная сила и потенциальная энергия
Другие концепции склеивания
Полярность и диполь
Типы химических связей
Гибридизация VSEPR и Bond
Соединения
Масса
Органические соединения
Многоатомные ионы и функциональные группы
Молекулы
Диаграммы Льюиса
Другие молекулярные концепции
Структура ионных твердых тел
Элементы и атомы
Электроны и квантовая теория
История и эксперименты с электронами
Элементы, ионы и изотопы
Другие концепты Atomic
Радиоактивный распад и ядерная химия
Периодическая таблица
История периодической таблицы
Периодические тренды
Специальные группы
Лабораторные методы и анализ
Расчеты
Анализ данных и другие расчеты
Интерпретация графиков и таблиц
Важные цифры
Выход и ошибка
Лабораторное оборудование и процедура
Выводы из наблюдений
Гипотезы и процедуры
Лабораторное оборудование
Безопасность
Реакции и равновесие
Химическое равновесие
Равновесие и термодинамика
Константа равновесия и коэффициент реакции
Принцип Ле Шателье
Свойства константы равновесия
Равновесие системы
Типы реакций
Кислотно-основные реакции
Буферы
Молекулярная структура кислот и оснований
рН
РН и ПКА
pH и POH сильных кислот и оснований
Титрование и индикаторы
Окислительно-восстановительные реакции
Уравновешивание окислительно-восстановительных реакций
Горение
Половинные реакции
Степень окисления
Основы окислительно-восстановительных реакций
Потенциал восстановления
Растворы и состояния вещества
Газы
Отклонения от закона идеального газа
Выпот
Закон идеального газа
Другие газовые концепты
Фазовые изменения
Энергия фазовых переходов
Фазовые диаграммы
Типы фазовых переходов
Твердые вещества, жидкости и газы
Решения
Коллигативные свойства
Концентрация и единицы
Другие концепции решения
Осадки и расчеты
Представления решений
Растворимость
Растворимость и равновесие
Спектроскопия и электромагнитный спектр
Стехиометрия
Уравнения баланса
Ограничивающий реагент
Другие стехиометрические расчеты
Стехиометрия с реакциями
Преобразование единиц измерения
Термохимия и кинетика
Кинетика и энергия
Ферменты и катализаторы
Законы об интегрированных тарифах
Кинетическая молекулярная теория
Принципы кинетики реакций
Энергетический профиль реакции
Механизмы реакции
Скорость реакции и закон скорости
Термодинамика
Калориметрия, удельная теплоемкость и расчеты
Потенциал клетки и свободная энергия
Потенциал клеток в нестандартных условиях
Электролиз и закон Фарадея
Эндергонические и экзергонические реакции
Эндотермические и экзотермические реакции
Энтальпия
Энтропия
Гальванические (Вольтаи) и электролитические ячейки
Свободная энергия Гиббса и спонтанность
Закон Гесса
Законы термодинамики
Учебные инструменты университетских преподавателей Ресурс AP Chemistry Learn by Concept представляет собой бесплатную интерактивную онлайн-программу, которая предоставляет вам инструменты, необходимые для повторения экзамена AP. «Learn by Concept» представлен в интуитивно понятном и простом в использовании формате и может стать отличным дополнением к вашему набору инструментов для учебы. Нужны ли вам лучшие репетиторы по химии в Ричмонде, репетиторы по химии в Талсе или лучшие репетиторы по химии в Сан-Диего, работа с профессионалом может вывести ваше обучение на новый уровень.
«Learn by Concept» представлен в интуитивно понятном и простом в использовании формате и может стать отличным дополнением к вашему набору инструментов для учебы. Нужны ли вам лучшие репетиторы по химии в Ричмонде, репетиторы по химии в Талсе или лучшие репетиторы по химии в Сан-Диего, работа с профессионалом может вывести ваше обучение на новый уровень.
Занятия на уровне AP — отличный вариант для старшеклассников, которые хотят выделиться среди своих сверстников в процессе поступления в колледж. Тем не менее, экзамены в конце года в таких классах, как AP Chemistry, могут быть сложными. Вы можете найти ресурс Learn by Concept удобным, так как к нему можно получить доступ в любом месте, поскольку он полностью онлайн. Это означает, что где бы вы ни находились, у вас всегда будет доступ к бесплатным учебным материалам AP Chemistry. В дополнение к справочному разделу AP Chemistry и репетиторству по химии AP вы также можете рассмотреть возможность прохождения некоторых наших практических тестов AP Chemistry.
Учебные инструменты Varsity Tutors Learn by Concept предлагают помощь в изучении химии AP в уникальном формате и включают в себя множество примеров вопросов и пояснений. Learn by Concept содержит исчерпывающий список тем, которые вам необходимо изучить, и множество вопросов, относящихся к конкретным концепциям, чтобы вы могли увидеть, как эти темы и идеи будут преобразованы в вопросы. Это даст вам окно понимания, которое может быть очень полезным при настройке вашего обзора. Вы можете просмотреть учебный план и ответить на вопросы для себя, а затем сравнить их с прилагаемыми пояснениями. При этом вы получите хорошее представление о том, как продвигаетесь в своем обзоре AP Chemistry.
Некоторые из наиболее популярных тем, охватываемых ресурсом AP Chemistry Learn by Concept, включают:
— Соединения и молекулы
— Элементы и атомы
— Лабораторные методы и анализ
— Реакции и равновесие
– Растворы и состояния вещества
– Термохимия и кинетика
– Стехиометрия
– И многие другие.
В дополнение к интерактивному ресурсу AP Chemistry Learn by Concept, инструменты обучения Varsity Tutors’ также предлагают множество других продуктов, помогающих на каждом этапе учебного процесса. Вы можете найти полные практические тесты и практические тесты для конкретных концепций, а также вопрос дня, которые помогут вам усвоить материал. Возможно, вам будет полезно начать с изучения всеобъемлющего ресурса «Учись по концепции», а затем пройти практический тест по завершении. Результаты дадут вам представление о том, где вы находитесь в своем обзоре AP Chemistry, и дадут вам знать, какие концепции вы, возможно, захотите изучить с помощью карточек. Кроме того, вы можете использовать полноценные практические тесты, чтобы имитировать реальный экзамен AP. «Вопрос дня» предлагает вам примерный вопрос из одного из этих средств обучения каждый день, чтобы вы могли оставаться свежими в своих знаниях обо всех обсуждаемых концепциях. Varsity Tutors также предлагает такие ресурсы, как бесплатные карточки AP Chemistry Flashcards, помогающие в самостоятельном обучении, или вы можете подумать о репетиторе AP Chemistry.


 Последнее обращение: 27 августа 2020 г.
Последнее обращение: 27 августа 2020 г.