ПЗ и ПСХЭ Д. И. Менделеева в свете учения о строении атома
Периодический закон является основой современной химии и всего естествознания. Он был открыт Дмитрием Ивановичем Менделеевым 1 марта 1869 года. Дмитрий Иванович Менделеев — великий русский учёный, один из основоположников современной химии, создатель Периодической системы элементов.
Он также является создателем учебника «Основы химии», в котором вся неорганическая химия изложена на основе Периодического закона. Менделеев является автором химической теории растворов.
В 1955 году группа американских учёных во главе с Гленом Сиборгом получила новый 101 элемент, которому присвоено название «менделевий» в честь выдающегося русского учёного.
Периодическая система
является графическим выражением периодического закона. Д.И. Менделеев изначально
расположил все химические элементы в ряд по увеличению их атомных масс и отметил
там отрезки, в которых свойства элементов и их соединений изменялись сходным образом.
На основании этого, им была предложена следующая формулировка закона: свойства химических элементов и образованных ими веществ, находятся в периодической зависимости от их относительных атомных масс.
Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
На развитие периодического закона оказала влияние не только теория строения атома, но и открытие явления существования изотопов, а также закон Мозли.
Согласно этому закону, заряд ядра атома каждого элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего элемента. Поэтому заряд атомного ядра совпадает с порядковым номером элемента в таблице Менделеева. Закон Мозли вскрыл истинный принцип, по которому Менделеев интуитивно расположил химические элементы.
Согласно теории строения
атома, его главной характеристикой является положительный заряд ядра. Заряд ядра
определяет положение атома в Периодической системе, число электронов в атоме, его
электронное строение и все свойства атомов.
Заряд ядра
определяет положение атома в Периодической системе, число электронов в атоме, его
электронное строение и все свойства атомов.
Таким образом, современная формулировка периодического закона звучит следующим образом:
Все химические элементы в Периодической системе расположены в порядке возрастания атомного, или порядкового номера. В каждой ячейке этой Периодической таблицы расположен химический элемент, где есть его название, порядковый номер и относительная атомная масса.
Численная величина атомного номера равна положительному заряду ядра атома соответствующего химического элемента. Кроме этого, порядковый номер указывает число протонов в нём и число электронов
Количество нейтронов
в атоме можно найти по разности между массовым числом и количеством протонов.
Например, для изотопа фосфора тридцать один число нейтронов равно шестнадцати (тридцать один минус пятнадцать).
В Периодической системе химических элементов Д.И. Менделеева семь горизонтальных рядов, которые называются периодами и восемь вертикальных столбов, которые называются группами. Поэтому каждый химический элемент имеет свой порядковый номер, находится в определенном периоде и в определённой группе.
Известно около семи сот форм графического изображения периодической системы. Но их объединяет то, что элементы в них располагаются в порядке возрастания их атомных ядер. Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп.
По мере увеличения
атомного номера происходит постепенное заполнение электронами соответствующих орбиталей.
Таким образом, структура Периодической системы связана с электронной структурой
атомов элементов.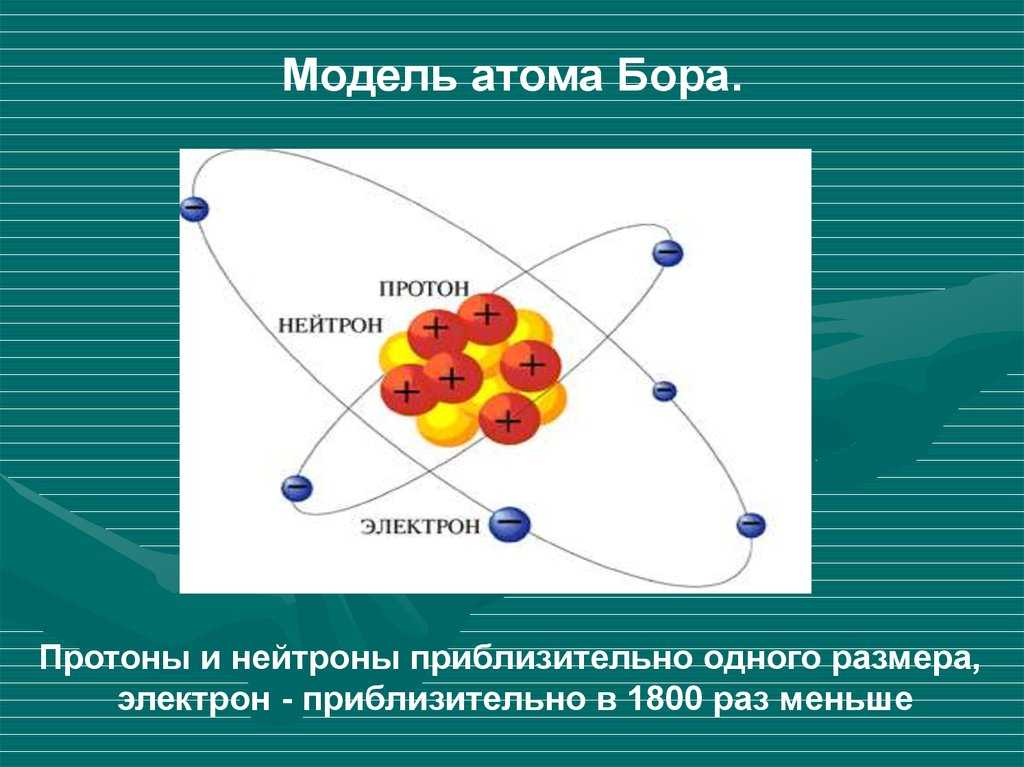
В зависимости от того, какой энергетический подуровень заполняется последним, различают четыре семейства элементов: это эс-элементы, у которых последним заполняется эс-подуровень внешнего энергетического уровня, как например, у лития, поэтому литий – эс-элемент.
У элементов пэ-семейства последним заполняется пэ-подуровень, как, например, у фосфора, поэтому фосфор – пэ-элемент, у дэ-элементов последним заполняется дэ-подуровень, как у титана, поэтому титан – дэ-элемент, а у элементов эф-семейства последним заполняется эф-подуровень, как у эйнштэйния, поэтому эйнштэйний является эф-элементом.
Периодом называют последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от эн-эс-один до эн-эс-два эн-пэ-шесть (кроме первого периода).
Номер периода совпадает с номером внешнего энергетического уровня. Поэтому физический смысл
номера периода заключается в том, что он указывает число энергетических уровней,
на которых находятся электроны в атомах данного элемента.
Малыми считаются с первого по третий период, а большими
В первом периоде два элемента, во втором и третьем – по восемь элементов, в четвёртом и пятом – по восемнадцать элементов, в шестом и седьмом – по тридцать два элемента.
Каждый период начинается щелочным металлом и заканчивается благородным газом. Первые три периода содержат только эс- и пэ-элементы. Четвёртый, пятый и последующие периоды включают элементы, у которых происходит заполнение дэ-подуровня внешнего энергетического уровня. У элементов шестого и седьмого периодов, кроме эс-, пэ-, дэ-подуровней, заполняются и эф-подуровни третьего снаружи электронного слоя. К эф-элементам относятся лантаниды и актиниды, которые вынесены за пределы таблицы.
В группах находятся
элементы, атомы которых имеют схожее электронное строение. Группы делят на А и Б
подгруппы: это главная и побочная. А группа содержит больше элементов, чем побочная.
Заполнение внешнего энергетического уровня
У элементов А-групп последними заполняются эс- и пэ-подуровни внешних энергетических уровней, а у Б-групп последними заполняются дэ-подуровни второго снаружи или эф-подуровни третьего снаружи энергетического уровня.
Элементы первой А группы имеют один валентный электрон. Элементы второй А группы имеют два валентных электрона.
Некоторые главные подгруппы имеют свои названия: первая А группа – щелочные металлы, вторая А группа – щелочноземельные металлы, пятая А группа – пниктогены, шестая А группа – халькогены, седьмая А группа – галогены, восьмая А группа – благородные или инэртные газы.
Физический смысл номера группы заключается в том, что он показывает число электронов в атоме, которые могут участвовать в образовании химических связей.
Электроны, которые
участвуют в образовании химической связи называются валентными.
Следовательно, группа – вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
У каждой группы есть формула высшего оксида, то есть оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов пятой А группы формула высшего оксида – эр-два-о-пять. В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы от четвёртой по седьмую группу.
Каждому элементу в Периодической системе отведено своё место. Однако для водорода в Периодической системе есть 2 места: в первой и седьмой группах. Водород, как и щелочные металлы, имеет один электрон на внешнем энергетическом уровне и относится к эс-семейству, поэтому он, как и щелочные металлы проявляет восстановительные свойства.
Но до завершения внешнего
энергетического уровня водороду не хватает одного электрона, как и галогенам,
поэтому он может проявлять и окислительные свойства.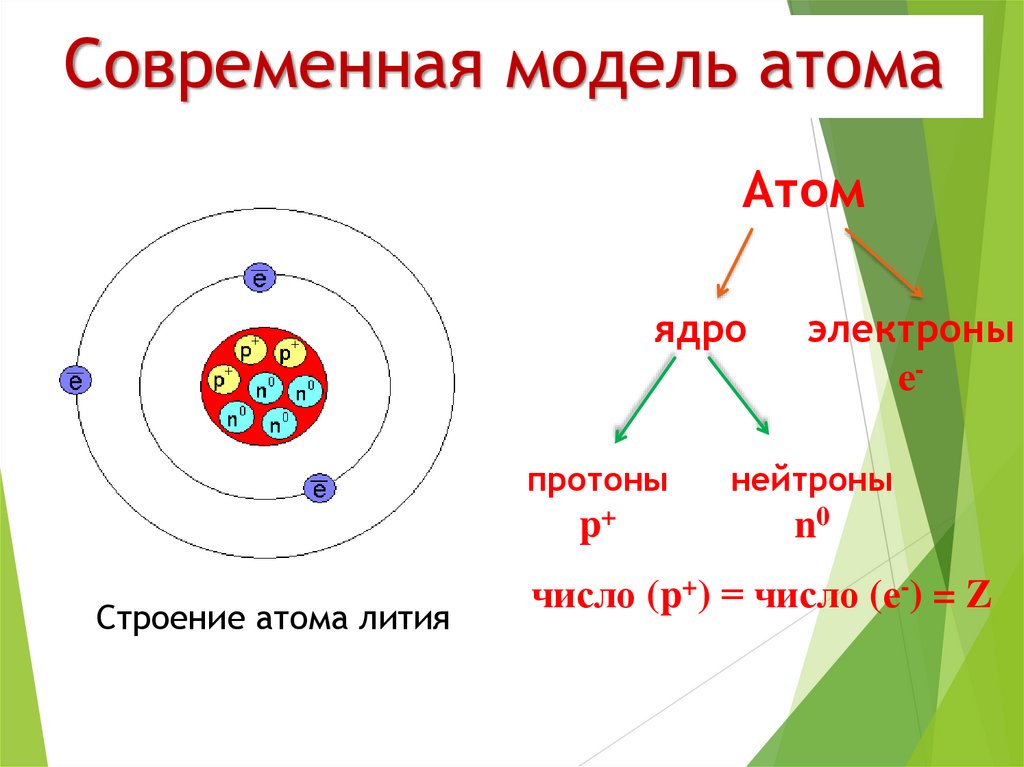
Молекула водорода, как и молекулы галогенов, состоит из двух атомов, связь между атомами ковалентная неполярная.
Но в космосе существует металлический водород, который имеет металлическую кристаллическую решётку и обладает электропроводимостью. Как и у щелочных металлов, у водорода в соединениях степень окисления плюс один, но в гидридах у водорода степень окисления минус один.
Как известно, Берцэлиус определил атомные массы сорока пяти химических элементов и в 1818 году опубликовал их в виде таблицы. Для обозначения химических элементов Берцэлиус предложил использовать начальные буквы их латинских названий. Берцелиус открыл новые химические элементы: цэрий, селен и торий. Ему первому удалось получить в свободном состоянии кремний, титан, тантал, цирконий, а также ванадий.
Таким образом, периодический закон стал важным звеном в эволюции
атомно-молекулярного учения, оказав значительное влияние на разработку теории строения
атома. Он также способствовал формулировке современного понятия “химический
элемент” и уточнению представлений о простых и сложных веществах.
Периодический закон и Периодическая система позволили:
· установить взаимосвязь между элементами и объединить их по свойствам;
· обнаружить повторяемость свойств элементов и их соединений и объяснить их причину;
· исправить и уточнить значения относительных атомных масс некоторых элементов;
· исправить и уточнить степени окисления некоторых элементов;
· предсказать существование ещё неоткрытых элементов, описать их свойства, указать пути их открытия.
Следовательно, главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный номер, находится в определённом периоде и определённой группе.
Развитие учения о строении атома.
Все
тела живой и неживой природы, несмотря
на их разнообразие, состоят из мельчайших
частиц — атомов. Первым, кто высказал
предположение об этом, считается
древнегреческий философ Демокрит. Именно он назвал атомом мельчайшую
неделимую частицу образующую вещество
(атом в переводе с др.греч «неделимый»).
Именно он назвал атомом мельчайшую
неделимую частицу образующую вещество
(атом в переводе с др.греч «неделимый»).
Демокрит считал, что если разделить, например, яблоко на две половины, затем одну из них еще на две части, и продолжать деление таким образом до тех пор пока результат деления перестанет быть яблоком, то мельчайшая частица которая все еще сохраняет свойство яблока является атомом яблока (т.е. неделимой частью яблока). Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению.
Основы
атомной теории строения вещества В 1808
г. физик Дальтон Джон (1766–1844) возродил
атомизм, доказал реальность существования
атомов. Он писал: «Атомы — химические
элементы, которые нельзя создать заново,
разделить на более мелкие частицы,
уничтожить путем каких-либо химических
превращений. Джон Дальтон ввёл понятие
«атомный вес», первым рассчитал атомные
веса (массы) ряда элементов и составил
первую таблицу их относительных атомных
весов, заложив тем самым основу атомной
теории строения.
Строение электронных оболочек атомов.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы.
•Атом состоит из ядра и электронной оболочки
•Электронная оболочка – совокупность движущихся вокруг ядра электронов
•Ядра атомов заряжены положительно, они состоят из протонов (положительно заряженных частиц) p+ и нейтронов (не имеющих заряда) no
•Атом в целом электронейтрален, число электронов е– равно числу протонов p+, равно порядковому номеру элемента в таблице Менделеева.
Согласно квантовой механике электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью
Квадратик
— это орбиталь или квантовая ячейка,
стрелочкой обозначается электрон,
направление стрелочки — это особая
характеристика движения электрона —
спин. Нужно знать то, что на одной орбитали
не может быть двух электронов с одинаковыми
спинами (в одном квадратике нельзя
рисовать две стрелочки в одном
направлении!). Это и есть принцип запрета
В.Паули: «В атоме не может быть даже двух
электронов, у которых все четыре квантовых
числа были бы одинаковыми»
Нужно знать то, что на одной орбитали
не может быть двух электронов с одинаковыми
спинами (в одном квадратике нельзя
рисовать две стрелочки в одном
направлении!). Это и есть принцип запрета
В.Паули: «В атоме не может быть даже двух
электронов, у которых все четыре квантовых
числа были бы одинаковыми»
Существует ещё одно правило (правило Гунда), по которому электроны расселяются на одинаковых по энергии орбиталях сначала по одиночке, и лишь когда в каждой такой
орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными.
Периодический закон и периодическая система элементов.
Основной закон химии – Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно.
В
основу Периодического закона Д.И.
Менделеев положил атомные массы (ранее
– атомные веса) и химические свойства
элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F – у элементов хлор Cl, бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия – галлия Ga, аналога кремния – германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
Периодический закон в формулировке Д.И. Менделеева:
Свойства
простых тел, а также формы и свойства
соединений элементов находятся в
периодической зависимости от величины
атомных весов элементов.
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов.
Атомизм | Определение, философия, история и факты
Эпикур
Смотреть все СМИ
- Ключевые люди:
- Демокрит Левкипп
- Похожие темы:
- атом атомная теория Логический атомизм холизм пустота
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
атомизм , любая доктрина, объясняющая сложные явления с точки зрения агрегатов неподвижных частиц или единиц. Эта философия нашла свое наиболее успешное применение в естествознании: согласно атомистическому взгляду, материальная вселенная состоит из мельчайших частиц, которые считаются относительно простыми и неизменными и слишком маленькими, чтобы быть видимыми. Таким образом, множественность видимых форм в природе основана на различиях в этих частицах и в их конфигурациях; следовательно, любые наблюдаемые изменения должны быть сведены к изменениям в этих конфигурациях.
Основная природа атомизма
Атомизм по своей сути является аналитической доктриной. Он рассматривает наблюдаемые формы в природе не как внутренние целостности, а как агрегаты. В отличие от холистических теорий, которые объясняют части с точки зрения качеств, проявляемых целым, атомизм объясняет наблюдаемые свойства целого свойствами его компонентов и их конфигураций.
Чтобы понять историческое развитие атомизма и, в особенности, его отношение к современной атомной теории, необходимо различать атомизм в строгом смысле слова и другие формы атомизма. Атомизм в строгом смысле характеризуется тремя моментами: атомы абсолютно неделимы, качественно тождественны (т. е. различны только по форме, величине и движению) и соединяются друг с другом только путем сопоставления. Другие формы атомизма менее строги в этих вопросах.
Атомизм обычно ассоциируется с «реалистичным» и механистическим взглядом на мир. Это реалистично в том смысле, что атомы не рассматриваются как субъективные конструкции разума, используемые для лучшего понимания явлений, которые необходимо объяснить; вместо этого атомы существуют в реальной реальности. Точно так же механистический взгляд на вещи, согласно которому все наблюдаемые изменения могут быть сведены к изменениям конфигурации, — это не просто вопрос использования полезной объяснительной модели; вместо этого механистический тезис утверждает, что все наблюдаемые изменения вызваны движением атомов. Наконец, как аналитическое учение атомизм противостоит организмистическим учениям, которые учат, что природа целого не может быть открыта путем разделения его на составные части и изучения каждой части в отдельности.
Точно так же механистический взгляд на вещи, согласно которому все наблюдаемые изменения могут быть сведены к изменениям конфигурации, — это не просто вопрос использования полезной объяснительной модели; вместо этого механистический тезис утверждает, что все наблюдаемые изменения вызваны движением атомов. Наконец, как аналитическое учение атомизм противостоит организмистическим учениям, которые учат, что природа целого не может быть открыта путем разделения его на составные части и изучения каждой части в отдельности.
Различные значения атомизма
Термин атомизм происходит от греческого слова atoma — «вещи, которые нельзя разрезать или разделить».
Два основных типа атомизма
Историю атомизма можно разделить на два более или менее обособленных периода, один философский и другой научный, с переходным периодом между ними (с XVII по XIX век). Этот исторический факт оправдывает различие между философским и научным атомизмом.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться
Подписаться
Философский атомизм
В философском атомизме, столь же древнем, как греческая философия, внимание было сосредоточено не на подробном объяснении всякого рода конкретных явлений, а на некоторых основных общих сторонах этих явлений и на общих линиях по что рациональное объяснение этих аспектов было возможно. Этими основными аспектами были существование в природе многообразия различных форм и непрерывного изменения. Как можно объяснить эти особенности? Философский атомизм дал общий ответ на этот вопрос. Однако она не ограничивалась строго общей проблемой объяснения возможности изменения и множественности — даже в древнегреческом атомизме, ибо в греческой мысли философия и наука еще составляли единство. Следовательно, атомисты также пытались дать более подробные объяснения конкретных явлений, таких как испарение, хотя эти объяснения предназначались скорее для подтверждения общей доктрины атомизма, чем для установления физической теории в современном смысле этого слова. Такая теория была еще невозможна, потому что физическая теория должна была основываться на косвенной или прямой информации о конкретных свойствах вовлеченных атомов, а такой информации тогда не было.
Такая теория была еще невозможна, потому что физическая теория должна была основываться на косвенной или прямой информации о конкретных свойствах вовлеченных атомов, а такой информации тогда не было.
Раздавленные ядра подрывают давнюю доктрину строения ядра
- ОСНОВНЫЕ ИССЛЕДОВАНИЯ
Стабильные ядра кадмия могут изменять форму даже при низкой энергии.
Данные, собранные 8π-спектрометром (на фото) в центре ускорителей частиц TRIUMF в Ванкувере, Канада, позволяют предположить, что некоторые ядра кадмия могут принимать форму, подобную форме мяча для регби. Кредит: ТРИУМФ
Ядро атома кадмия меняет форму, даже когда его энергия низка — открытие, опровергающее широко распространенное мнение о структуре атомных ядер.
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за выпуск
Подписаться
Расчет налога будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны НЕТТО.
Nature 574 , 299 (2019)
doi: https://doi.org/10.1038/d41586-019-03006-4
References
Физ. Преподобный Летт. (2019)
Скачать ссылки
Темы
- Атомная и молекулярная физика
Последнее:
Работа
Научный сотрудник – Химические исследования и инновации
MRC Национальный институт медицинских исследований
Кампус Харуэлл, Оксфордшир, Соединенное Королевство
ПОСТ-ДОКТОРСКИЕ ПОЗИЦИИ В ОБЛАСТИ «Автоматизированная миниатюрная химия» под руководством проф.


