Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации, физические и химические свойства углерода. Адсорбция
Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации, физические и химические свойства углерода. Адсорбция
Урок посвящен изучению свойств химического элемента углерода и образуемых им простых веществ. Сравниваются физические свойства аллотропных модификаций углерода: алмаза и графита. На примере угля рассматриваются химические свойства простых веществ, образованных углеродом.
I. Общая характеристика химических элементов подгруппы углерода
Подгруппа углерода – IV группа, главная подгруппа «А» – углерод, кремний, германий, олово, свинец.
1. Строение атомов химических элементов углерода и кремния
|
Название химического элемента |
Схема строения атома |
Электронное строение последнего энергоуровня |
Формула высшего оксидаRO2 |
Формула летучего водородного соединения RH4 |
|
1. |
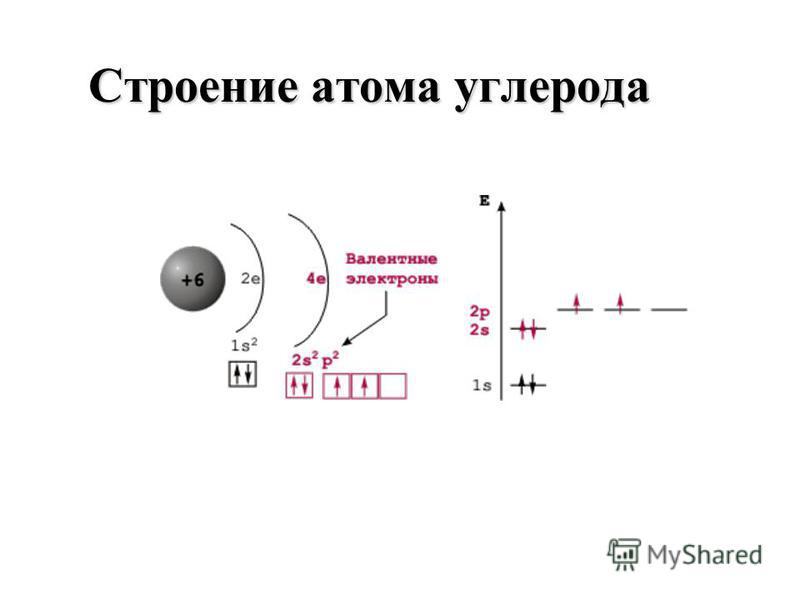
C+6 )2 )4 |
…2s22p2 |
C+4O2 |
C-4H4 |
|
2. Кремний |
Si +14)2 )8 )4 |
|
Si+4O2 |
Si-4H4 |
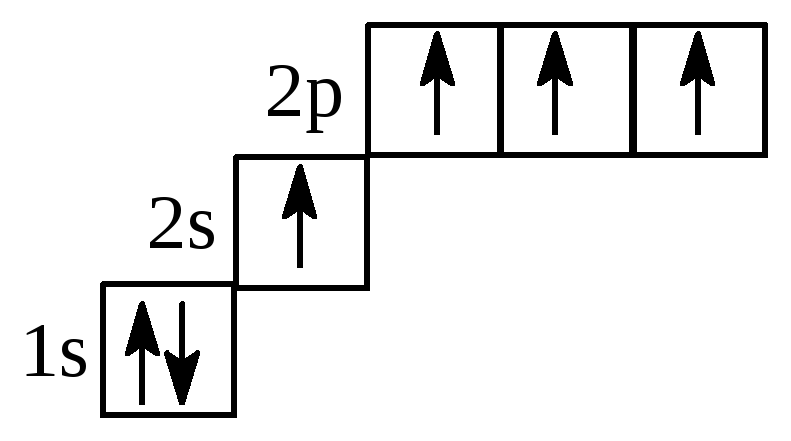
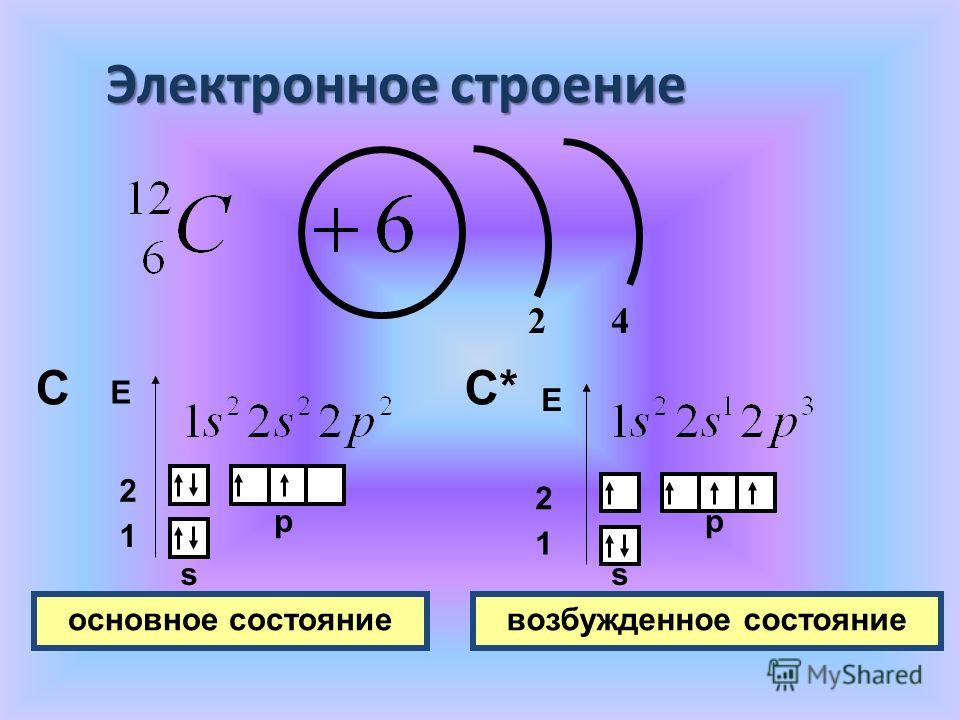
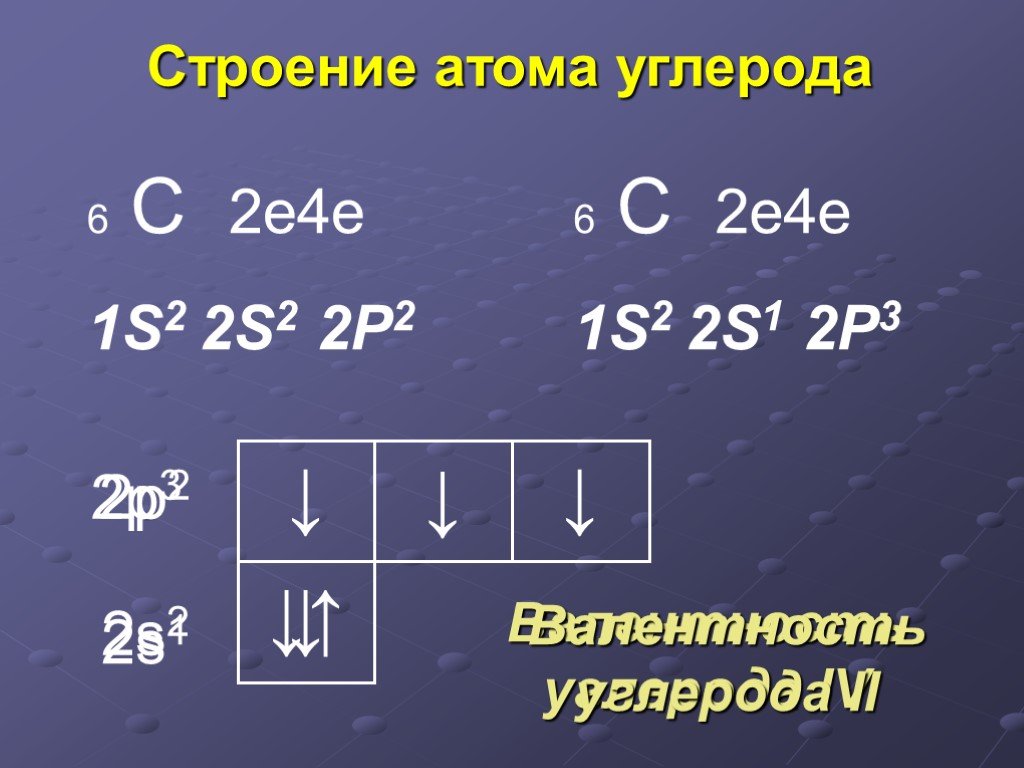
Как видно из схем строения атомов, на внешнем энергетическом уровне этих элементов находится 4 электрона, поэтому, углерод и кремний проявляют степень окисления +4 и -4.
Из схемы видно, что у тома углерода два неспаренных электрона на внешнем уровне ( аналогично и у кремния). Этим объясняется, что углерод и кремний могут иметь степень окисления +2 (Например, СО – угарный газ).+15+Atomic+Number+=+-+-+Atomic+Mass+=+31+-+-+-.jpg)
2. Изменение свойств в подгруппе
В подгруппе углерода с ростом порядкового номера заряд ядра атомов увеличивается, число электронов на внешнем уровне постоянно, число энергетических уровней в атомах растёт и радиус атома увеличивается от углерода к свинцу, притяжение отрицательных электронов к положительному ядру ослабевает и способность к отдаче электронов увеличивается, и, следовательно, в подгруппе углерода с ростом порядкового номера неметаллические свойства убывают, а металлические усиливаются.
С и Si – неметаллы, Ge – полупроводник, Sn и Pb – металлы.
II. Углерод
1. Научно-популярный фильм: “Углерод”
2. Аллотропия углерода
Аллотропия углерода
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
Слайд – шоу
Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Применение:
Шлифовальный порошок, буры, стеклорезы, после огранки – бриллианты.
Графит
Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3.
Применение:
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Карбин
Чёрный порошок; ρ = 2 г/см3; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
При нагревании переходит в графит.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др).
Фуллерены
“Пасьянс фуллеренового паука”
Свойства алмаза и графита
3. Химические свойства
Углерод – малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
Памятка:“Химические свойства”
|
С – восстановитель С0 – 4 е–→ С+4 или С0 – 2 е–→ С+2 |
С – окислитель С0 + 4 е–→ С-4 |
|
1) Взаимодействие с кислородом C0 + O2 t˚C → CO2 углекислый газ Опыт: “Горение угля в кислороде” при недостатке кислорода наблюдается неполное сгорание образуется угарный газ: 2C0 + O2 t˚C → 2C+2O С + 2F2 → CF4 3) Взаимодействие с водяным паром C0 + H2O t˚C → С+2O + H2 водяной газ 4) Взаимодействие с оксидами металлов С + MexOy = CO2 + Me C0 + 2CuO t˚C → 2Cu + C 5) Взаимодействие с кислотами – окислителями: C0 + 2H2SO4(конц. С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O |
1) Взаимодействие с некоторыми металлами (образует карбиды) 4Al + 3C0 t˚C → Al4C3-4 Ca + 2C0 t˚C 2) Взаимодействие с водородом C0 + 2H2 t˚C → CH4
|
4. Применение углерода
Алмазы широко применяются для резки горных пород и шлифования особо твердых материалов. Из алмазов при огранке делают ювелирные украшения. Графит применяют для изготовления инертных электродов и грифелей карандашей. В смеси с техническими маслами в качестве смазочного материала. Из смеси графита с глиной изготавливают плавильные тигли. Графит используют в ядерной промышленности, как поглотитель нейтронов.
Из смеси графита с глиной изготавливают плавильные тигли. Графит используют в ядерной промышленности, как поглотитель нейтронов.
Кокс применяют в металлургии, как восстановитель. Древесный уголь – в кузнечных горнах, для получения пороха (75%KNO3 + 13%C + 12%S), для поглощения газов (адсорбция), а также в быту. Сажу применяют, как наполнитель резины, для изготовления черных красок – типографская краска и тушь, а также в сухих гальванических элементах. Стеклоуглерод применяют для изготовления аппаратуры для сильно агрессивных сред, а также в авиации и космонавтике.
Активированный уголь поглощает вредные вещества из газов и жидкостей: им заполняют противогазы, очистительные системы, его применяют в медицине при отравлениях.
III. Адсорбция
Адсорбция – поглощение газообразных или растворённых веществ поверхностью твёрдого вещества.
Опыт: “Адсорбционная способность угля”
Обратный процесс – выделение этих поглощённых веществ – десорбция.
Применение адсорбции
Очистка от примесей (в производстве сахара и др.), для защиты органов дыхания (противогазы), в медицине (таблетки “Карболен”) и др.
IV. Древесный уголь
Древесный уголь — микропористый высокоуглеродистый продукт, образующийся при разложении древесины без доступа воздуха. Применяется в производстве кристаллического кремния, сероуглерода, чёрных и цветных металлов, активированного угля и т. д., а также как бытовое топливо (удельная теплота сгорания 31,5—34 МДж/кг).
V. Тренажеры
Тренажёр №1. “Характеристика углерода по положению в Периодической системе элементов Д. И. Менделеева”
Тренажёр №2. “Положение неметаллов IV группы в периодической системе. Строение их атомов”
Тренажёр №3. “Свойства аллотропных видоизменений углерода”
VI. Закрепление
Задание №1.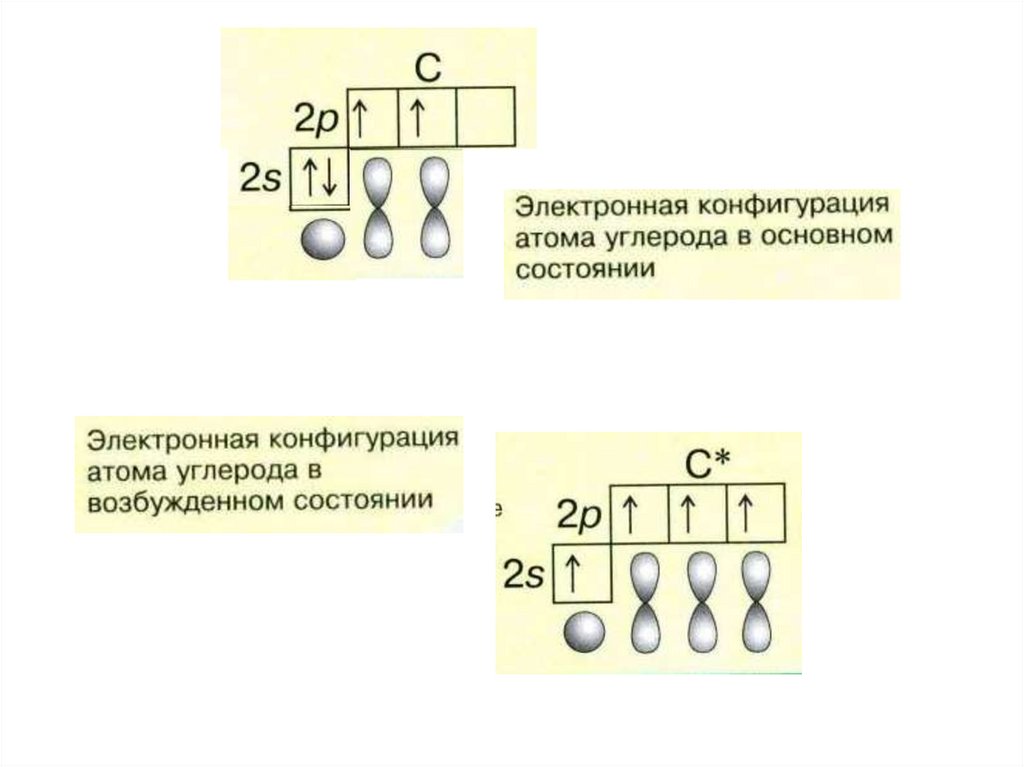 Закончите уравнения реакций, составьте электронный баланс, укажите окислитель и восстановитель для каждой реакции:
Закончите уравнения реакций, составьте электронный баланс, укажите окислитель и восстановитель для каждой реакции:
С+О2 (изб) =
С+О2 (недост)=
С + H2 =
C + Ca =
C + Al =
Задание №2. Составьте уравнения реакций, протекающих при нагревании угля со следующими оксидами: оксидом железа (III) и оксидом олова (IV). Составьте электронный баланс для каждой реакции, укажите процессы окисления и восстановления; окислитель и восстановитель.
ЦОРы
Научно-популярный фильм: “Углерод”
Опыт: “Горение угля в кислороде”
“Пасьянс фуллеренового паука”
Урок №33. Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации, физические свойства углерода.
Урок №33.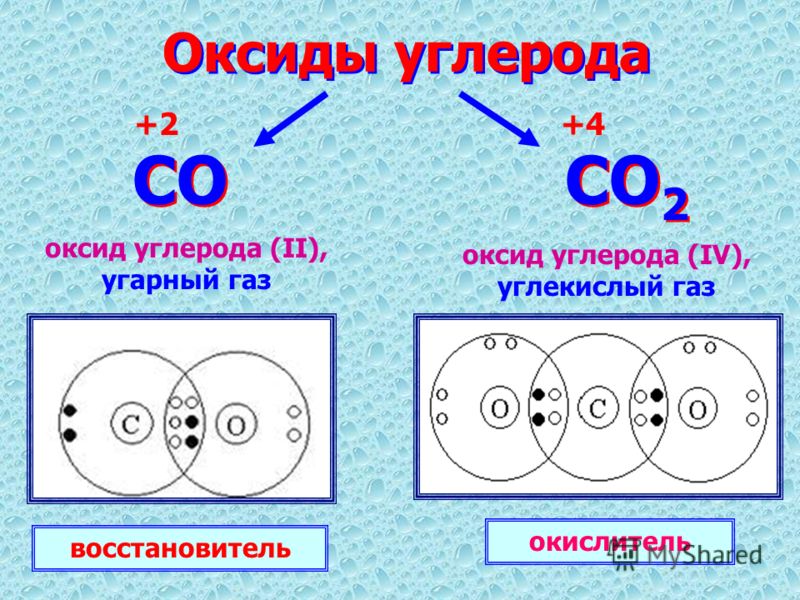 Положение углерода и
кремния в ПСХЭ, строение их
атомов. Углерод, аллотропные модификации, физические свойства углерода. Положение углерода и
кремния в ПСХЭ, строение их
атомов. Углерод, аллотропные модификации, физические свойства углерода.Общая характеристика химических элементов подгруппы углерода Подгруппа углерода – IV группа, главная подгруппа «А» – углерод, кремний, германий, олово, свинец. 1. Строение атомов химических элементов углерода и кремния
Как видно из схем строения атомов, на внешнем
энергетическом уровне этих элементов находится 4 электрона, поэтому, углерод и
кремний проявляют степень окисления +4 и -4. Из схемы видно, что у тома углерода два неспаренных электрона на внешнем уровне ( аналогично и у кремния). Этим объясняется, что углерод и кремний могут иметь степень окисления +2 (Например, СО – угарный газ). Переходя в возбуждённое состояние, один из s-электронов может перейти на свободную p-орбиталь. Тогда в атомах появляется 4 неспаренных электрона и степень окисления равна +4 и – 4. 2. Изменение свойств в подгруппе В подгруппе углерода с
ростом порядкового номера заряд ядра атомов увеличивается, число электронов на
внешнем уровне постоянно, число энергетических уровней в атомах растёт и радиус
атома увеличивается от углерода к свинцу, притяжение отрицательных электронов к
положительному ядру ослабевает и
способность к отдаче электронов увеличивается, и, следовательно, в
подгруппе углерода с ростом порядкового номера неметаллические свойства
убывают, а металлические усиливаются. С и Si
– неметаллы, Ge
– полупроводник, Sn
и Pb
– металлы. УГЛЕРОД. АЛЛОТРПОПИЯ УГЛЕРОДА Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен. Слайд – шоу Алмаз Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C. Можно получить из графита при p > 50 тыс. атм; t° = 1200°C. Применение: Шлифовальный порошок, буры, стеклорезы, после огранки – бриллианты. Графит Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3. Применение: Электроды, карандашные грифели, замедлитель
нейтронов в ядерных реакторах, входит в состав некоторых смазочных
материалов. Карбин Чёрный порошок; ρ = 2 г/см3; полупроводник. Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=. При нагревании переходит в графит. В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку. Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего. Соединения углерода весьма распространены: все живые
организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в
состав многих неорганических веществ (известняк, мел, мрамор и др). Алмаз Бриллиант Графит Фуллерены Уголь Свойства алмаза и графита ТРЕНАЖЁРЫ Тренажёр №1. Тренажёр №2. “Положение неметаллов IV группы в периодической системе. Строение их атомов” Тренажёр №3. “Свойства аллотропных видоизменений углерода” |
Углерод, атомная структура – Стоковая фотография – C018/3687
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3687
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Надпись
Углерод (C). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома углерода-12 (атомный номер: 6), наиболее распространенного изотопа элемента углерода. Ядро состоит из 6 протонов (красный) и 6 нейтронов (оранжевый). Шесть электронов (белые) занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Углерод, составляющий основу жизни на Земле, является неметаллом 14-й группы, периода 2 и р-блока периодической таблицы. В элементарной форме это твердое вещество, которое горит при нагревании с кислородом.
Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома углерода-12 (атомный номер: 6), наиболее распространенного изотопа элемента углерода. Ядро состоит из 6 протонов (красный) и 6 нейтронов (оранжевый). Шесть электронов (белые) занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Углерод, составляющий основу жизни на Земле, является неметаллом 14-й группы, периода 2 и р-блока периодической таблицы. В элементарной форме это твердое вещество, которое горит при нагревании с кислородом.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 2p
- 2п2
- 2 с
- 2с2
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- с
- углерод
- углерод-12
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 14
- иллюстрация
- изотоп
- уровень
- уровней
- нейтрон
- нейтрон номер
- нейтронов
- неметаллический
- неметаллический
- неметаллы
- неметалл
- неметаллический
- неметаллы
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- р блок
- р-блок
- период 2
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- валентная орбиталь
- волновая функция
14.
 4A: Графит и алмаз – структура и свойства
4A: Графит и алмаз – структура и свойства- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34175
Covalent Network Solids — это гигантские ковалентные вещества, такие как алмаз, графит и диоксид кремния (оксид кремния (IV)). Эта страница связывает структуры твердых тел с ковалентной сетью с физическими свойствами веществ.
Diamond
Carbon имеет электронную схему 2,4. В алмазе каждый углерод делит электроны с четырьмя другими атомами углерода, образуя четыре одинарные связи.
На диаграмме кажется, что некоторые атомы углерода образуют только две связи (или даже одну связь), но на самом деле это не так. Мы показываем только небольшую часть всей структуры. Это гигантская ковалентная структура — она продолжается в трех измерениях. Это не молекула, потому что количество атомов, соединенных в реальном алмазе, совершенно изменчиво — в зависимости от размера кристалла.
Мы показываем только небольшую часть всей структуры. Это гигантская ковалентная структура — она продолжается в трех измерениях. Это не молекула, потому что количество атомов, соединенных в реальном алмазе, совершенно изменчиво — в зависимости от размера кристалла.
Как нарисовать структуру алмаза
Не пытайтесь слишком умудриться, пытаясь нарисовать слишком много структуры! Научитесь рисовать схему, приведенную выше. Делайте это в следующие этапы:
Практикуйтесь, пока не сможете сделать нормальный набросок от руки примерно за 30 секунд.
Физические свойства алмаза
- имеет очень высокую температуру плавления (почти 4000°C). Очень прочные ковалентные связи углерод-углерод должны быть разрушены по всей структуре, прежде чем произойдет плавление.
- очень сложно. Это опять-таки связано с необходимостью разорвать очень прочные ковалентные связи, действующие в трех измерениях.
- не проводит электричество. Все электроны плотно удерживаются между атомами и не могут свободно двигаться.
- нерастворим в воде и органических растворителях. Не существует возможных притяжений между молекулами растворителя и атомами углерода, которые могли бы перевешивать притяжения между ковалентно связанными атомами углерода.
Графит
Графит имеет слоистую структуру, которую довольно сложно изобразить убедительно в трех измерениях. На приведенной ниже диаграмме показано расположение атомов в каждом слое и расстояние между слоями.
Обратите внимание, что вы не можете на самом деле нарисовать вид сбоку слоев в том же масштабе, что и атомы в слое, без того, чтобы одна или другая часть диаграммы была либо очень растянута, либо сильно сплющена. В этом случае важно дать некоторое представление о соответствующих расстояниях. Расстояние между слоями примерно в 2,5 раза больше расстояния между атомами внутри каждого слоя. Слои, конечно же, охватывают огромное количество атомов, а не только те немногие, что показаны выше.
Вы можете возразить, что углерод должен образовывать 4 связи из-за своих 4 неспаренных электронов, тогда как на этой диаграмме кажется, что он образует только 3 связи с соседними атомами углерода.
Эта диаграмма несколько упрощена и показывает расположение атомов, а не связи.
Связь в графите
Каждый атом углерода использует три своих электрона для образования простых связей с тремя ближайшими соседями. Это оставляет четвертый электрон на связывающем уровне. Эти «запасные» электроны в каждом атоме углерода делокализуются по всему листу атомов в одном слое. Они больше не связаны непосредственно с каким-либо конкретным атомом или парой атомов, а могут свободно перемещаться по всему листу. Важно то, что делокализованные электроны могут свободно перемещаться в любом месте листа — каждый электрон больше не привязан к конкретному атому углерода. Однако прямого контакта между делокализованными электронами одного листа и электронами соседних слоев нет. Атомы внутри листа удерживаются вместе сильными ковалентными связями — фактически более сильными, чем в алмазе, из-за дополнительной связи, вызванной делокализованными электронами.
Так что же скрепляет простыни? В графите у вас есть окончательный пример дисперсионных сил Ван-дер-Ваальса. По мере того, как делокализованные электроны перемещаются по листу, могут образовываться очень большие временные диполи, которые индуцируют противоположные диполи в слоях выше и ниже — и так далее по всему кристаллу графита.
По мере того, как делокализованные электроны перемещаются по листу, могут образовываться очень большие временные диполи, которые индуцируют противоположные диполи в слоях выше и ниже — и так далее по всему кристаллу графита.
Графит имеет высокую температуру плавления, как у алмаза. Чтобы расплавить графит, недостаточно отделить один лист от другого. Вы должны разорвать ковалентную связь во всей структуре. Он мягкий, скользкий на ощупь и используется в карандашах и в качестве сухой смазки для таких вещей, как замки. Вы можете думать о графите скорее как о колоде карт — каждая карта прочная, но карты будут скользить друг по другу или даже вообще выпадать из колоды. При использовании карандаша листы стираются и прилипают к бумаге. Графит имеет меньшую плотность, чем алмаз. Это происходит из-за относительно большого количества пространства, которое «пропадает» между листами.
Графит нерастворим в воде и органических растворителях по той же причине, что и алмаз. Притяжение между молекулами растворителя и атомами углерода никогда не будет достаточно сильным, чтобы преодолеть прочные ковалентные связи в графите.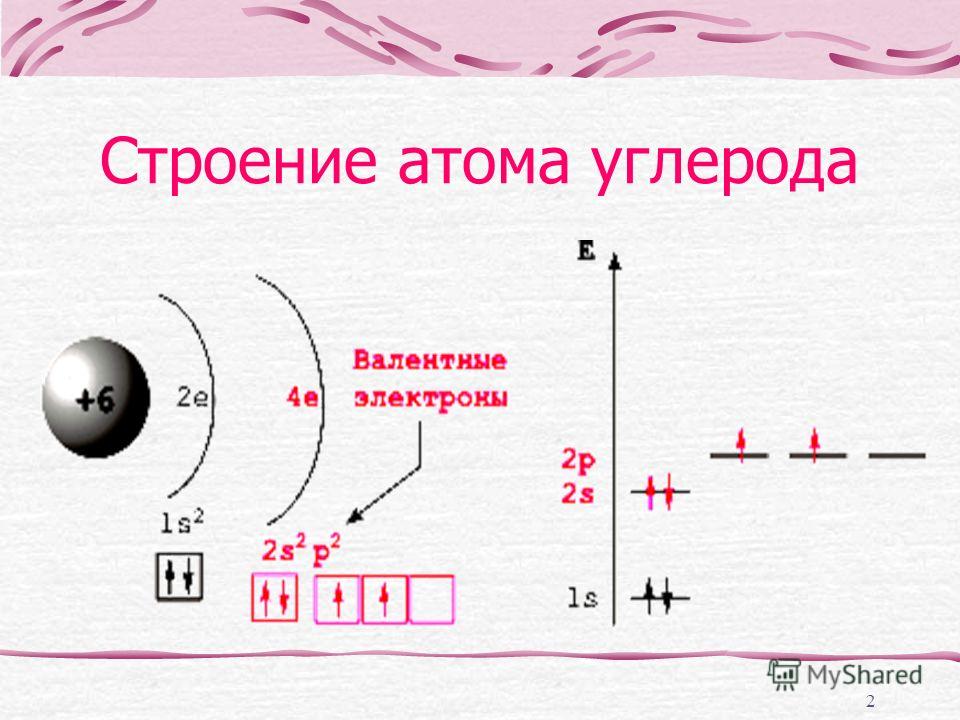 проводит электричество. Делокализованные электроны могут свободно перемещаться по слоям. Если кусок графита подключить к цепи, электроны могут упасть с одного конца листа и замениться новыми на другом конце.
проводит электричество. Делокализованные электроны могут свободно перемещаться по слоям. Если кусок графита подключить к цепи, электроны могут упасть с одного конца листа и замениться новыми на другом конце.
Диоксид кремния: SiO
2Диоксид кремния, также известный как диоксид кремния или оксид кремния (IV), имеет три различные кристаллические формы. Самый простой для запоминания и рисования основан на ромбовидной структуре. Кристаллический кремний имеет ту же структуру, что и алмаз. Чтобы превратить его в диоксид кремния, все, что вам нужно сделать, это изменить структуру кремния, включив в него несколько атомов кислорода.
Обратите внимание, что каждый атом кремния связан со своими соседями атомом кислорода. Не забывайте, что это всего лишь крошечная часть гигантской структуры, простирающейся во всех трех измерениях.
Диоксид кремния имеет высокую температуру плавления, варьирующуюся в зависимости от конкретной структуры (помните, что данная структура является лишь одной из трех возможных структур), но около 1700°C. Очень прочные ковалентные связи кремний-кислород должны быть разрушены по всей структуре, прежде чем произойдет плавление. Более того, это сложно из-за необходимости разрывать очень прочные ковалентные связи. Диоксид кремния не проводит электричество, поскольку в нем нет делокализованных электронов, и все электроны плотно удерживаются между атомами и не могут свободно перемещаться. Диоксид кремния нерастворим в воде и органических растворителях. Нет никаких возможных притяжений, которые могли бы возникнуть между молекулами растворителя и атомами кремния или кислорода, которые могли бы преодолеть ковалентные связи в гигантской структуре.
Очень прочные ковалентные связи кремний-кислород должны быть разрушены по всей структуре, прежде чем произойдет плавление. Более того, это сложно из-за необходимости разрывать очень прочные ковалентные связи. Диоксид кремния не проводит электричество, поскольку в нем нет делокализованных электронов, и все электроны плотно удерживаются между атомами и не могут свободно перемещаться. Диоксид кремния нерастворим в воде и органических растворителях. Нет никаких возможных притяжений, которые могли бы возникнуть между молекулами растворителя и атомами кремния или кислорода, которые могли бы преодолеть ковалентные связи в гигантской структуре.
Авторы
Введение
- Соединений углерода больше, чем соединений любого другого элемента, кроме водорода. Большая часть химии углерода рассматривается в различных курсах (органическая и биохимия).
- Не существует соединений, содержащих что-либо подобное C 4+ , но некоторые карбиды содержат соединения, приближающиеся к C 4-.
- Существуют переходные ионные частицы: ионы карбония, такие как F 3 C + , и карбанионы, такие как (NC) 3 С – . Обратите внимание на прикрепленные группы, которые помогут стабилизировать эти виды.
- Переходный двухвалентный углерод встречается в карбенах, R 2 C:
- Прочная одинарная связь С—С и способность образовывать двойные, С=С, и тройные, СºС, связи способствуют огромной универсальности углерода.
Химия и физические свойства алмазного графита и фуллеренов
Карбиды
Они бывают трех основных типов:
Ионные карбиды образованы элементами 1, 2 группы и алюминием. Фактическое содержание углерода варьируется, например, карбид алюминия, судя по продукту его гидролиза, содержит единицы «C 4-»:
\[\ce{Al4C3 + 6h3O -> 2Al(OH)3 + 3Ch5 }\]
но карбид кальция, по-видимому, содержит [CºC] 2- единиц:
\[\ce{CaC + 2h3O -> Ca(OH)2 + HCºH}\]
Промежуточные карбиды являются соединениями переходных металлов с металлическими свойствами и C в тетраэдрических дырках в решетке атомов металла.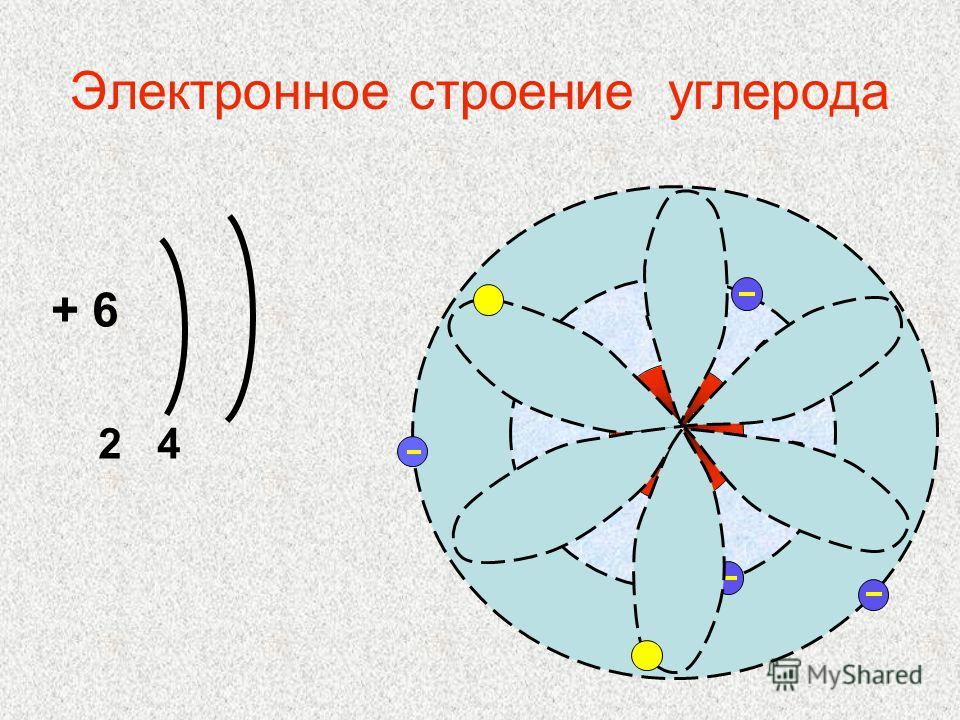

 Углерод
Углерод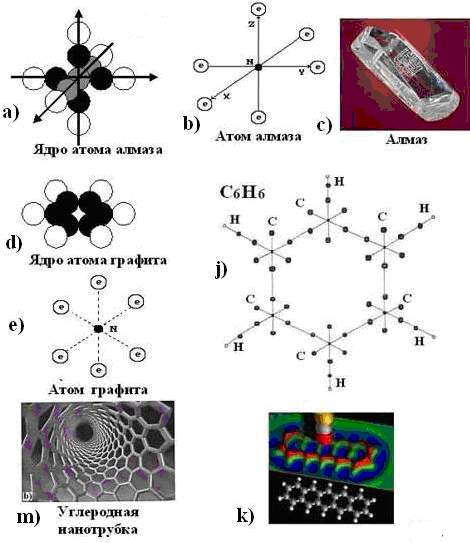 ) → С+4O2 + 2SO2 + 2H2O
) → С+4O2 + 2SO2 + 2H2O Кремний
Кремний

 “Характеристика углерода по положению в Периодической системе элементов Д. И. Менделеева”
“Характеристика углерода по положению в Периодической системе элементов Д. И. Менделеева”