Таблица Менделеева online – Ar
Ar
18
8
8
2
39.948±1
3s23p6
Аргон
| Относительная электроотрицательность (по Полингу): | |
| Температура плавления: | -189,2°C |
| Температура кипения: | -185,7°C |
| Теплопроводность: | 0 |
| Плотность: | 0,0017824 г/см3 |
| Открыт: | В. Рамзай, Д. Рэлей |
| Цвет в твёрдом состоянии: | Бесцветный |
| Тип: | Благородный газ |
| Орбитали: | 1s22s22p63s23p6 |
| Электронная формула: |
Ar – 1s2 2s2 2p6 3s2 3p6 Ar – [Ne] 3s |
| Валентность: | 0 |
| Степени окисления: | 0 |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 15,759 В 27,629 В 40,74 В |
Электропроводность в тв. фазе: фазе: |
|
| Ковалентный радиус: | 0,98 Å |
| Атомный объем: | 28,5 см3/моль |
| Атомный радиус: | 0,88 Å |
| Теплота распада: | 1,188 КДж/моль |
| Теплота парообразования: | 6,447 КДж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Избыток массы (кэВ) |
Период полураспада |
Спин и чётность ядра |
Распространённость изотопа в природе (%) |
|---|---|---|---|---|---|---|---|
| Энергия возбуждения (кэВ) | |||||||
| 30Ar | 18 | 12 | 30,021560(320)# | 20080(300)# | < 20 нс | 0+ | |
| 31Ar | 18 | 13 | 31,012120(220)# | 11290(210)# | 14,4(6) мс | 5/2(+#) | |
| 32Ar | 18 | 14 | 31,9976380(19) | −2200,2(18) | 98(2) мс | 0+ | |
| 32Arm | 5600(100)# | 3400(100)# | ? | 5− | |||
| 33Ar | 18 | 15 | 32,9899257(5) | −9384,1(4) | 173,0(20) мс | 1/2+ | |
| 34Ar | 18 | 16 | 33,9802712(4) | −18377,2(4) | 845(3) мс | 0+ | |
| 18 | 17 | 34,9752576(8) | −23047,4(7) | 1,775(4) с | 3/2+ | ||
| 36Ar | 18 | 18 | 35,967545106(29) | −30231,540(27) | Стабильный | 0+ | 0,3365(30) |
| 37Ar | 18 | 19 | 36,96677632(22) | −30947,66(21) | 35,04(4) дня | 3/2+ | |
| 38Ar | 18 | 20 | 37,9627324(4) | −34714,6(3) | Стабильный | 0,0632(5) | |
| 39Ar | 18 | 21 | 38,964313(5) | −33242(5) | 269(3) лет | 7/2− | |
| 40Ar | 18 | 22 | 39,9623831225(29) | −35039,8960(27) | Стабильный | 0+ | 99,6003(30) |
| 41Ar | 18 | 23 | 40,9645006(4) | −33067,5(3) | 109,61(4) мин | 7/2− | |
| 42Ar | 18 | 24 | 41,963046(6) | −34423(6) | 32,9(11) лет | 0+ | |
| 43Ar | 18 | 25 | 42,965636(6) | −32010(5) | 5,37(6) мин | (5/2−) | |
| 44Ar | 18 | 26 | 43,9649240(17) | −32673,1(16) | 11,87(5) мин | 0+ | |
| 45Ar | 18 | 27 | 44,9680400(6) | −29770,6(5) | 21,48(15) с | (1,3,5)/2− | |
| 46 |
18 | 28 | 45,968090(40) | −29720(40) | 8,4(6) с | 0+ | |
| 47Ar | 18 | 29 | 46,972190(110) | −25910(100) | 580(120) мс | 3/2−# | |
| 48Ar | 18 | 30 | 47,974540(320)# | −23720(300)# | 500# мс | 0+ | |
| 49Ar | 18 | 31 | 48,980520(540)# | −18150(500)# | 170(50) мс | 3/2−# | |
| 50Ar | 18 | 32 | 49,984430(750)# | −14500(700)# | 85(30) мс | 0+ | |
| 51Ar | 18 | 33 | 50,991630(750)# | −7800(700)# | 60(>200 нс)# мс | 3/2−# | |
| 52Ar | 18 | 34 | 51,996780(970)# | −3000(900)# | 10# мс | 0+ | |
| 53Ar | 18 | 35 | 53,004940(1070)# | 4600(1000)# | 3# мс | 5/2−# | |
Химическая характеристика аргона.
 Аргон – это особенный элемент периодической системы
Аргон – это особенный элемент периодической системыОПРЕДЕЛЕНИЕ
Аргон – восемнадцатый элемент Периодической таблицы. Обозначение – Ar от латинского «argon». Расположен в третьем периоде, VIIIА группе. Относится к группе благородных (инертных) газов. Заряд ядра равен 18.
Самый распространенный в природе элемент VIIIA-группы. Содержание аргона в воздухе 0,932% (об.), 1,28% (масс).
Представляет собой бесцветный газ. Плохо растворяется в воде (растворимость понижается в присутствии сильных электролитов), лучше — в органических растворителях. Образует клатрат состава 8Ar×46Н 2 О. Не реагирует со всеми другими веществами (простыми и сложными).
Атомная и молекулярная масса аргона
ОПРЕДЕЛЕНИЕ
Относительной молекулярная масса вещества (M r) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии аргон существует в виде одноатомных молекул Ar, значения его атомной и молекулярной масс совпадают. Они равны 39,948.
Изотопы аргона
Известно, что в природе аргон может находиться в виде трех стабильных изотопов 36 Ar (0,337%), 38 Ar (0,063%) и 40 Ar (99,6%). Их массовые числа равны 36, 38 и 40 соответственно. Ядро атома изотопа аргона 36 Ar содержит восемнадцать протонов и восемнадцать нейтронов, а изотопов 38 Ar и 40 Ar- такое же количество протонов, двадцать и двадцать два нейтронов/а соответственно.
Существуют искусственные изотопы аргона с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 39 Ar с периодом полураспада равным 269 лет.
Ионы аргона
Как гелий и неон при сильном возбуждении атомов аргон образует молекулярные ионы типа Ar 2 + .
Молекула и атом аргона
В свободном состоянии аргон существует в виде одноатомных молекул Ar.
Примеры решения задач
ПРИМЕР 1
АРГОН, Ar (лат.
Аргон в природе
В природе аргон существует только в свободном виде. При обычных условиях аргон — газ без цвета, запаха и вкуса. Твёрдый аргон кристаллизуется в кубические . аргона 1,78 кг/м3, t плавления — 189,3°С, t кипения — 185,9°С, критическое давление 48 МПа, критическая температура — 122,44°С. Первый потенциал ионизации 15,69 эВ. Атомный радиус 0,188 нм (1,88Е).
Свойства аргона
Химические соединения не получены (известны лишь соединения включения). В 1 л дистиллированной воды при нормальных условиях растворяется 51,9 см 3 аргона. Образует кристаллогидраты типа Ar . 6Н 2 О. Весовой кларк в земной коре 4 . 10 -4 ; содержание в атмосфере 0,9325 объёмных % (6,5 . 10 16 кг), в изверженных породах 2,2 . 10 -5 см 3 /г, в океанической воде 0,336 см 3 /л. В мантии продуцировано 5,3. 10 19 кг 40 Ar, средняя скорость накопления 40 Ar в земной коре 2 .10 7 кг/год.
10 16 кг), в изверженных породах 2,2 . 10 -5 см 3 /г, в океанической воде 0,336 см 3 /л. В мантии продуцировано 5,3. 10 19 кг 40 Ar, средняя скорость накопления 40 Ar в земной коре 2 .10 7 кг/год.
Из минералов атомы аргона мигрируют по дислокациям в зоны нарушения кристаллической структуры и затем по микротрещинам и порам поступают в , нефтяные и газовые залежи. На измерении отношения содержаний 40 Ar/ 40 K в калийсодержащих минералах основан метод определения возраста геологических объектов. Аргоновым методом определяют возрасты изверженных (по слюдам, амфиболам), осадочных (по глауконитам, сильвинам), метаморфизованных пород, для которых также с известным приближением даётся возраст . Разработан активационный метод датирования, основанный на измерении отношения 40 Ar/ 39 Ar.
Получение и применение аргона
В промышленности аргон получают в процессе разделения воздуха при глубоком охлаждении. Возможно получение аргона из продувочных газов колонн синтеза аммиака. Отделение аргона от других инертных газов наиболее полно осуществляется газохроматографическим методом.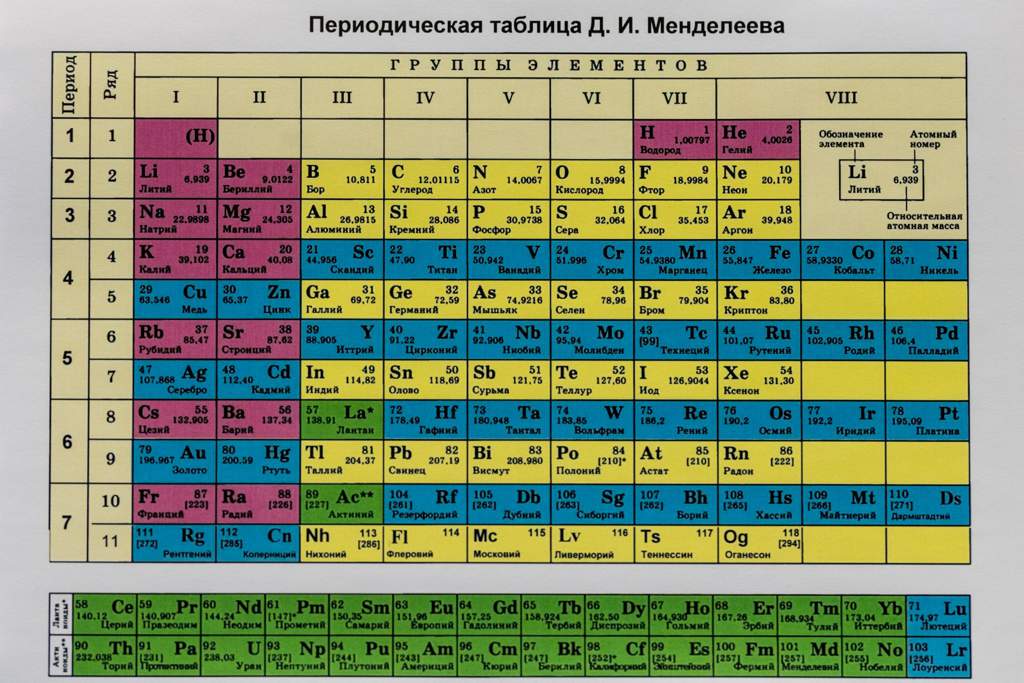
Аргон используется при термической обработке легко окисляющихся металлов. В защитной атмосфере аргона проводят сварку и резку редких и цветных металлов, плавку , и др., выращивают кристаллы полупроводниковых материалов. Радиоактивный изотоп (37 Ar) применяют для контроля вентиляционных систем.
В переводе с греческого «argon» означает «медленный» или «неактивный». Такое определение газ аргон получил благодаря своим инертным свойствам, позволяющим широко его использовать во многих промышленных и бытовых целях.
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.

На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Как добывают аргон
Ar не поддается изменениям в процессе его использования и всегда возвращается в атмосферу. Поэтому ученые считают данный источник неисчерпаемым. Он добывается как сопутствующий продукт при разделении воздуха на кислород и азот посредством низкотемпературной ректификации.
Для реализации этого метода применяются специальные воздухоразделительные аппараты, состоящие из колонн высокого, низкого давления и конденсатора-испарителя. В результате процесса ректификации (разделения) получается аргон с небольшими примесями (3-10%) азота и кислорода. Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Чтобы произвести очистку, примеси убираются с помощью дополнительных химических реакций. Современные технологии позволяют достичь 99,99% чистоты данного продукта.
Представлены установки по производству данного химического элемента
Хранится и транспортируется газ аргон в стальных баллонах (ГОСТ 949-73), которые имеют серый окрас с полосой и соответствующей надписью зеленого цвета. При этом процесс наполнения емкости должен полностью соответствовать технологическим нормам и правилам безопасности. Детальную информацию о специфике заполнения газовых баллонов можно прочитать в статье: баллоны со сварочной смесью – технические особенности и правила эксплуатации .
Где применяется газ аргон
Данный элемент имеет достаточно большую сферу применения. Ниже приведены основные области его использования:
- заполнение внутренней полости ламп накаливания и стеклопакетов;
- вытеснение влаги и кислорода для долгого хранения пищевых продуктов;
- огнетушащее вещество в некоторых системах тушения пожара;
- защитная среда при сварочном процессе;
- плазмообразующий газ для плазменной сварки и резки.

В сварочном производстве он применяется как защитная среда в процессе сварки редких металлов (ниобия, титана, циркония) и их сплавов, легированный сталей разных марок, а также алюминиевых, магниевых и хромоникелевых сплавов. Для черных металлов, как правило, применяют смесь Ar с другими газами – гелием, кислородом, углекислотой и водородом.
Вид защитной среды при сварочном процессе, которую создает аргон
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу. Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Все мы знаем, что аргон применяется для сварки разных металлов, но не каждый задумывался, о том, что представляет собой этот химический элемент. А между тем его история богата событиями. Что характерно, аргон – это исключительный экземпляр периодической таблицы Менделеева, который не имеет аналогов. Сам ученый удивлялся в свое время, как он вообще мог сюда попасть.
В атмосфере присутствует примерно 0,9 % этого газа. Как и азот, он имеет нейтральный характер без цвета и запаха. Для поддержания жизни он не подходит, но зато просто незаменим в некоторых областях человеческой деятельности.
Небольшой экскурс в историю
Впервые его обнаружил англичанин и физик по образованию Г. Кавендиш, который заметил присутствие в воздухе чего-то нового, стойкого к химическому воздействию. К сожалению, Кавендиш так и не узнал природу нового газа. Чуть более ста лет спустя это заметил и другой ученый – Джон Уильям Страт. Он пришел к выводу, что в азоте из воздуха есть какая-то примесь газа неизвестного происхождения, но аргон это или что-то еще, он пока не мог понять.
Чуть более ста лет спустя это заметил и другой ученый – Джон Уильям Страт. Он пришел к выводу, что в азоте из воздуха есть какая-то примесь газа неизвестного происхождения, но аргон это или что-то еще, он пока не мог понять.
При этом газ не вступал в реакцию с различными металлами, хлором, кислотами, щелочами. То есть с химической точки зрения носил инертный характер. Еще одной неожиданностью стало открытие – молекула нового газа включает в себя лишь один атом. А на тот момент подобный состав газов был еще неизвестен.
Публичное сообщение о новом газе привело в шок многих ученых со всего мира – как можно было проглядеть новый газ в воздухе на протяжении многих научных исследований и опытов?! Но в открытие поверили не все ученые, включая Менделеева. Судя по атомной массе нового газа (39,9), он должен расположиться между калием (39,1) и кальцием (40,1), но позиция уже была занята.
Как уже упоминалось, аргон – с богатой и детективной историей. На некоторое время он был забыт, но после открытия гелия новый газ признали официально. Было решено отвести для него отдельную нулевую позицию, расположенную в между галогенов и щелочных металлов.
Было решено отвести для него отдельную нулевую позицию, расположенную в между галогенов и щелочных металлов.
Свойства
Среди прочих инертных газов, которые входят в тяжелую группу, аргон считается самым легким. Его масса превышает вес воздуха в 1,38 раза. В жидкое состояние газ переходит при температуре -185,9 °С, а при -189,4 °С и нормальном давлении твердеет.
От гелия и неона аргон отличается тем, что способен растворяться в воде – при температуре 20 градусов в количестве 3,3 мл в ста граммах жидкости. Но в ряде органических растворов газ растворяется лучше. Воздействие электрического тока заставляет его светиться, благодаря чему он стал широко применяться в осветительном оборудовании.
Биологами обнаружено другое полезное свойство, которым обладает аргон. Это своего рода среда, где растение прекрасно себя чувствует, что доказано опытами. Так, находясь в атмосфере газа, посаженые семена риса, кукурузы, огурцов и ржи дали свои ростки. В другой атмосфере, где 98 % приходится на аргон и 2 % – на кислород, хорошо прорастает такая овощная культура, как морковь, салат и лук.
Что особенно характерно, содержание этого газа в земной коре намного больше, чем других элементов, находящихся в его группе. Его примерное содержание – 0,04 г на одну тонну. Это в 14 раз превышает количество гелия и в 57 раз – неона. Что касается окружающей нас Вселенной, его там еще больше, в особенности на разных звездах и в туманностях. По некоторым подсчетам, аргона на просторах космоса больше, чем хлора, фосфора, кальция или калия, которых полно на Земле.
Получение газа
Тот аргон в баллонах, в которых мы его чаще встречаем, является неисчерпаемым источником. К тому же он в любом случае возвращается в атмосферу в силу того, что при использовании не меняется в физическом или химическом плане. Исключением могут быть случаи расхода малого количества изотопов аргона на получение новых изотопов и элементов в ходе ядерных реакций.
В промышленности газ получают путем разделения воздуха на кислород и азот. В результате чего и рождается газ как побочный продукт. Для этого используется специальное промышленное оборудование двукратной ректификации с двумя колоннами высокого и низкого давления и промежуточным конденсатором-испарителем. Помимо этого, для получения аргона могут быть использованы отходы аммиачного производства.
Для этого используется специальное промышленное оборудование двукратной ректификации с двумя колоннами высокого и низкого давления и промежуточным конденсатором-испарителем. Помимо этого, для получения аргона могут быть использованы отходы аммиачного производства.
Область применения
Сфера применения аргона насчитывает несколько областей:
- пищевая промышленность;
- металлургия;
- научные исследования и опыты;
- сварочные работы;
- электроника;
- автомобильная промышленность.
Этот нейтральный газ находится внутри электрических лапочек, что замедляет испарение вольфрамовой спирали внутри. Благодаря этому свойству широко применяется основанный на данном газе сварочный аппарат. Аргон позволяет надежно соединять детали из алюминия и дюраля.
Широкое распространение газ получил при создании защитной и инертной атмосферы. Это обычно необходимо для термической обработки тех металлов, которые легко подвержены окислению. В атмосфере аргона хорошо растут кристаллы для получения полупроводниковых элементов или сверхчистых материалов.
В атмосфере аргона хорошо растут кристаллы для получения полупроводниковых элементов или сверхчистых материалов.
Преимущества и недостатки применения аргона в сварке
Касательно области сварки аргон дает определенные преимущества. Прежде всего, металлические детали в ходе сварки не так сильно нагреваются. Это позволяет избежать деформации. К прочим достоинствам относятся:
- надежная защита сварного шва;
- скорость на порядок выше;
- процесс легко контролировать;
- сварку можно механизировать либо полностью перевести в автоматический режим;
- возможность соединять детали из разнородных металлов.
В то же время сварочный аргон подразумевает и ряд недостатков:
- при сварке возникает ультрафиолетовое излучение;
- для использования высокоамперной дуги необходимо качественное охлаждение;
- сложная работа на открытом воздухе или сквозняке.
Тем не менее при наличии стольких достоинств трудно недооценить значение аргонной сварки.
Меры предосторожности
При использовании аргона стоит проявлять осторожность. Хоть газ нетоксичен, но способен вызывать удушье, замещая собой кислород или сжижая его. Поэтому крайне важно контролировать объем O 2 в воздухе (не менее 19 %) при помощи специальных приборов, ручных или автоматических.
Работа с жидким газом требует предельной осторожности, поскольку низкая температура аргона может вызвать сильное обморожение кожного покрова и повреждение глазной оболочки. Необходимо использовать очки и спецодежду. Лицам, которым необходимо проводить работы в аргонной атмосфере, нужно надевать противогазы либо прочие изолирующие кислородные приборы.
| Внешний вид простого вещества | |
|---|---|
| Инертный газ без цвета, вкуса и запаха | |
| Свойства атома | |
| Имя, символ, номер | Аргон / Argon (Ar), 18 |
| Атомная масса (молярная масса) | 39,948 а. е. м. (г/моль) е. м. (г/моль) |
| Электронная конфигурация | 3s 2 3p 6 |
| Радиус атома | 71пм |
| Химические свойства | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 1519,6(15,75) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (при 186 °C) 1,40 г/см 3 |
| Температура плавления | 83,8 K |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см 3 /моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 A |
| Температура Дебая | 85 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 0,0177 Вт/(м·К) |
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется.
В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г. ). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота.
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы).
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней.
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Основное применение
Пищевая отрасль
В контролируемой среде аргон может во многих процессах использоваться в качестве замены для азота. Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Высокая растворимость (в два раза превышающая растворимость азота) и определенные молекулярные характеристики обеспечивают его особые свойства при хранении овощей. При определенных условиях он способен замедлять метаболические реакции и значительно сокращать газообмен.
Производство стекла, цемента и извести
При использовании для заполнения ограждений с двойным глазурованием аргон обеспечивает превосходную тепловую изоляцию.
Металлургия
Аргон используется для предупреждения контакта и последующего взаимодействия между расплавленным металлом и окружающей атмосферой.
Использование аргона позволяет оптимизировать такие производственные процессы как перемешивание расплавленных веществ, продувка поддонов реакторов для предупреждения повторного окисления стали и обработка стали узкого применения в вакуумных дегазаторах, включая вакуумно-кислородное обезуглероживание, окислительно-восстановительных процессы и процессы открытого сжигания. Однако наибольшую популярность аргон приобрел в процессах аргоно-кислородного обезуглероживания нерафинированной высокохромистой стали, позволяя минимизировать окисление хрома.
Лабораторные исследования и анализы
В чистом виде и в соединениях с другими газами аргон используется для проведения промышленных и медицинских анализов и испытаний в рамках контроля качества.
В частности аргон выполняет функцию газовой плазмы в эмиссионной спектрометрии индуктивно-связанной плазмой (ICP), газовой подушки в атомно-абсорбционной спектроскопии в графитной печи (GFAAS) и газа-носителя в газовой хроматографии с использованием различных газоанализаторов.
В соединении с метаном аргон используется в счетчиках Гейгера и детекторах рентгеновского флуоресцентного анализа (XRF), где он выполняет функцию гасящего газа.
Сварка, резка и нанесение покрытия
Аргон используется в качестве защитной среды в процессах дуговой сварки, при поддуве защитного газа и при плазменной резке.
Аргон предупреждает окисление сварных швов и позволяет сократить объем дыма, сбрасываемого в процессе сварки.
Электроника
Сверхчистый аргон служит в качестве газа-носителя для химически активных молекул, а также в качестве инертного газа для защиты полупроводников от посторонних примесей (например, аргон обеспечивает необходимую среду для выращивания кристаллов силикона и германия).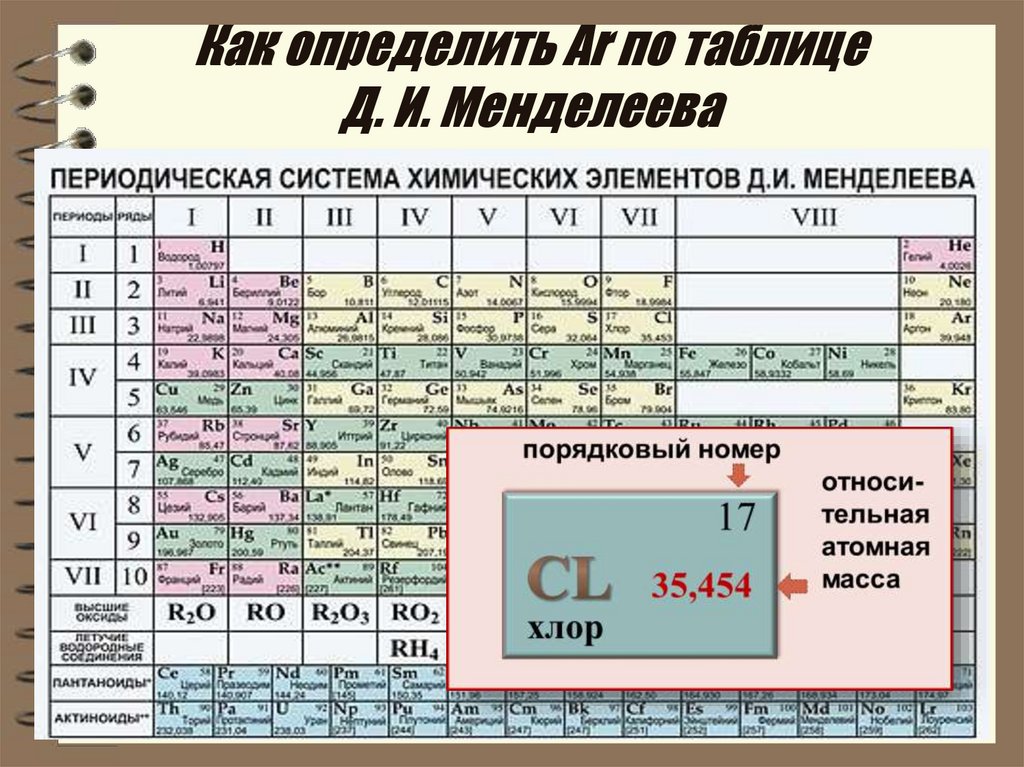
В ионном состоянии аргон используется в процессах металлизации напылением, ионной имплантации, нормализации и травления при производстве полупроводников и высокоэффективном производстве материалов.
Автомобильная и транспортная отрасль
Затаренный герметизированный аргон служит для наполнения подушек безопасности в автомобилях.
Аргон | Свойства, использование, атомный номер и факты
аргон
Посмотреть все СМИ
- Ключевые люди:
- сэр Уильям Рамзи Лорд Рэлей
- Похожие темы:
- химический элемент благородный газ воздуха аргон-40
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, наиболее распространенный на Земле и наиболее часто используемый в промышленности из благородных газов. Бесцветный, без запаха и вкуса газообразный аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамзи. Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 г. пришел к выводу, что не более 1 / 120 часть азота может быть каким-то инертным компонентом. Его работа была забыта, пока лорд Рэлей более века спустя не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента более плотный, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления из воздуха кислорода и азота, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за его химической инертности. (Гелий был обнаружен спектроскопически на Солнце в 1868 г.)
Бесцветный, без запаха и вкуса газообразный аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамзи. Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 г. пришел к выводу, что не более 1 / 120 часть азота может быть каким-то инертным компонентом. Его работа была забыта, пока лорд Рэлей более века спустя не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента более плотный, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления из воздуха кислорода и азота, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за его химической инертности. (Гелий был обнаружен спектроскопически на Солнце в 1868 г.)
По распространенности в космосе аргон занимает примерно 12-е место среди химических элементов. Аргон составляет 1,288 % атмосферы по весу и 0,934 % по объему и содержится в горных породах. Несмотря на то, что стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента аргона Земли соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Несмотря на то, что стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента аргона Земли соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Аргон выделяют в больших масштабах фракционной перегонкой жидкого воздуха. Он используется в газонаполненных электрических лампочках, радиолампах и счетчиках Гейгера. Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при -185,8 °C (-302,4 °F) и в кристаллическое твердое вещество при -189,4 °C (-308,9 °F). Газ нельзя сжижать под давлением выше температуры -122,3 ° C (-188,1 ° F), и в этот момент для его сжижения требуется давление не менее 48 атмосфер. При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд в аргоне при низком давлении выглядит бледно-красным, а при высоком давлении — сине-стальным.
Самая внешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, таким образом, химически инертной. Атомы аргона не соединяются друг с другом; также не наблюдалось их химического соединения с атомами любого другого элемента. Атомы аргона были механически захвачены в подобных клеткам полостях среди молекул других веществ, как, например, в кристаллах льда или органического соединения гидрохинона (называемого клатратами аргона).
Атомы аргона были механически захвачены в подобных клеткам полостях среди молекул других веществ, как, например, в кристаллах льда или органического соединения гидрохинона (называемого клатратами аргона).
| atomic number | 18 |
|---|---|
| atomic weight | [39.792, 39.963] |
| melting point | −189.2 °C (−308.6 °F) |
| точка кипения | −185,7 ° C (–302,3 ° F) |
| Плотность (1 атм, 0 ° C) | 1,784 г/литр |
| Электрит. | 5956 0|
| ЭЛЕКТРИЧЕСКИЙ ЭЛЕКТРИЧЕСКИЙ. | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 |
The Editors of Encyclopaedia BritannicaThis article was последний раз переработанный и обновленный Эриком Грегерсеном.
Аргон (Ar) — Периодическая таблица
| Из Википедии, свободной энциклопедии Аргон — химический элемент с символом Ar и атомным номером 18. благородный газ. Аргон является третьим по распространенности газом в атмосфере Земли с 0,934% (9340 частей на миллион по объему), что делает его более чем в два раза более распространенным, чем следующий по распространенности атмосферный газ, водяной пар (который в среднем составляет около 4000 частей на миллион по объему, но сильно варьируется), и в 23 раза больше, чем следующий по распространенности неконденсирующийся атмосферный газ. , двуокись углерода (400 частей на миллион по объему) и более чем в 500 раз больше, чем следующий по распространенности благородный газ, неон (18 частей на миллион по объему). Подробнее в Википедии | ||||||||||||||||||||||||||||||||||||||||||||||
Аргон в периодической таблице | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbol | Ar | |||||||||||||||||||||||||||||||||||||||||||||
| Atomic number | 18 | |||||||||||||||||||||||||||||||||||||||||||||
| Group | 18 | |||||||||||||||||||||||||||||||||||||||||||||
| Period | 3 | |||||||||||||||||||||||||||||||||||||||||||||
| Block | p | |||||||||||||||||||||||||||||||||||||||||||||
| Element category | Noble Gas | |||||||||||||||||||||||||||||||||||||||||||||
Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||
| Фаза при СТП | Газ | Плотность0057 | 1. 784 g/cm 3 784 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||
| Atomic weight | 39.9481 u | |||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 83.81 K -189.34 °C -308.812 °F | |||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 87.302 K -185,848 ° C -302,5264 ° F | |||||||||||||||||||||||||||||||||||||||||||||
Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||
| ЭЛЕКТРОНЕГО.0056 -96 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0 | |||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||



