Водород H в таблице Менделеева
Водород — это самый лёгкий и самый распространённый химический элемент. В наше время каждый слышал о нём, а ведь совсем недавно он представлял из себя великую тайну даже для лучших учёных. Согласитесь, этого достаточно, чтобы узнать побольше о химическом элементе водород.
Водород: распространение в природе
Как мы уже сказали выше, водород – это самый распространенный элемент. Причем не только на Земле, но и во всей Вселенной! Солнце почти наполовину состоит из этого химического элемента, да и большинство звёзд имеют в своей основе водород. В межзвездных пространствах водород также является самым распространенным элементом. На Земле водород находится в виде соединений. Он входит в состав нефти, газов, даже живых организмов. Мировой Океан содержит около 11% водорода по массе. В атмосфере его совсем немного, всего около 5 десятитысячных процента.
История открытия водорода
О существовании водорода догадывались ещё средневековые алхимики. Так, Парацельс в своих трудах указывал, что при действии кислоты и железа выделяются пузырьки “воздуха”. Но что это за “воздух” он понять не мог. В те времена учёные думали, что в каждом горючем веществе есть какая-то мистическая огненная составляющая, которая поддерживает горение. Эта догадка получила название теории “флогистона”. Алхимики считали, например, что дерево состоит из пепла, который остается после сжигания, и флогистона, который освобождается при горении.
Так, Парацельс в своих трудах указывал, что при действии кислоты и железа выделяются пузырьки “воздуха”. Но что это за “воздух” он понять не мог. В те времена учёные думали, что в каждом горючем веществе есть какая-то мистическая огненная составляющая, которая поддерживает горение. Эта догадка получила название теории “флогистона”. Алхимики считали, например, что дерево состоит из пепла, который остается после сжигания, и флогистона, который освобождается при горении.
Впервые же свойства водорода изучили английские химики Генри Кавендиш и Джозеф Пристли в XVIII веке. Но и они полностью не осознали сути своего открытия. Они думали, что легкий газ (а водород легче воздуха в 14 раз) есть ни что иное как мистический флогистон.
И только Антуан Лавуазье доказал, что водород это никакой не флогистон, а самый настоящий химический элемент. Во время своих опытов он сумел получить водород из воды и затем доказал, что обратно вода получается при горении водорода. Поэтому этот химический элемент и получил такое название – “рождающий воду”.
Химические свойства водорода
Водород самый первый химический элемент, в таблице Менделеева обозначается символом H. Представляет собой легкий газ без запаха и цвета. Твердый водород – самое легкое твердое вещество, а жидкий – самая лёгкая жидкость. К тому же жидкий водород при попадании на кожу может вызвать сильнейшее обморожение. Атомы и молекулы водорода – самые маленькие. Поэтому то воздушный шарик, надутый этим газом, очень быстро сдувается – водород просачивается через резину. При смешении водорода с кислородом воздуха образуется очень взрывоопасная смесь. Она называется “гремучий газ”.
При вдыхании газа частота голоса становится намного выше обычной. Например, мужской грубый бас будет похож на голоса Чипа и Дейла. Однако, подобные химические опыты проводить не стоит, по причине указанной выше. Водород и кислород образуют гремучий газ, который при выдохе может легко взорваться!
Применение водорода
Несмотря на свою горючесть, водород широко используется во многих отраслях промышленности.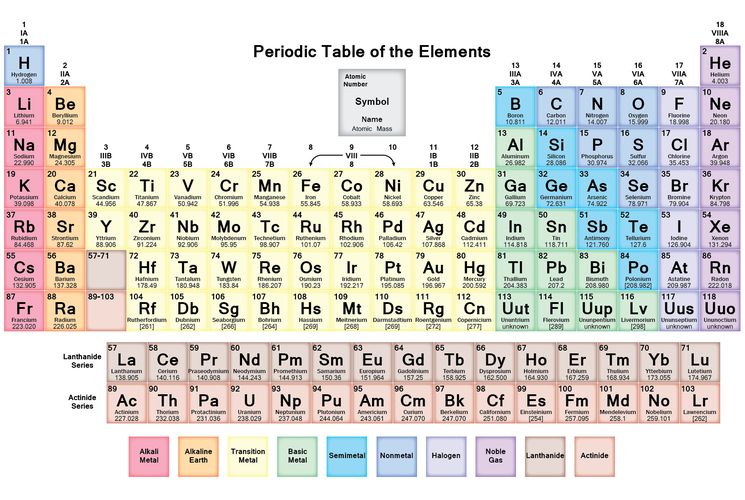 В основном его используют при производства аммиака для минеральных удобрений и при производстве спирта и пластмассы. Когда-то водородом наполняли дирижабли и воздушные шары, этот легкий газ поднимал их в воздух совершенно без труда. Но сейчас в авиации и космической технике он используется только в качестве топлива для космических ракет. Созданы двигатели для автомобилей, работающие на водороде. Они самые экологически чистые, ведь при сгорании выделяется только вода. Однако на данный момент водородные двигатели имеют ряд существенных недостатков, не отвечаю в полной мере требованиям безопасности, поэтому их применение пока совершенно ничтожно. В пищевой промышленности водород используется при производстве маргарина, а также для упаковки продуктов. Он даже зарегистрирован в качестве пищевой добавки E949. В энергетике водород применяется для охлаждения генераторов и для выработки электроэнергии в водородно-кислородных топливных элементах.
В основном его используют при производства аммиака для минеральных удобрений и при производстве спирта и пластмассы. Когда-то водородом наполняли дирижабли и воздушные шары, этот легкий газ поднимал их в воздух совершенно без труда. Но сейчас в авиации и космической технике он используется только в качестве топлива для космических ракет. Созданы двигатели для автомобилей, работающие на водороде. Они самые экологически чистые, ведь при сгорании выделяется только вода. Однако на данный момент водородные двигатели имеют ряд существенных недостатков, не отвечаю в полной мере требованиям безопасности, поэтому их применение пока совершенно ничтожно. В пищевой промышленности водород используется при производстве маргарина, а также для упаковки продуктов. Он даже зарегистрирован в качестве пищевой добавки E949. В энергетике водород применяется для охлаждения генераторов и для выработки электроэнергии в водородно-кислородных топливных элементах.
Водород как источник энергии
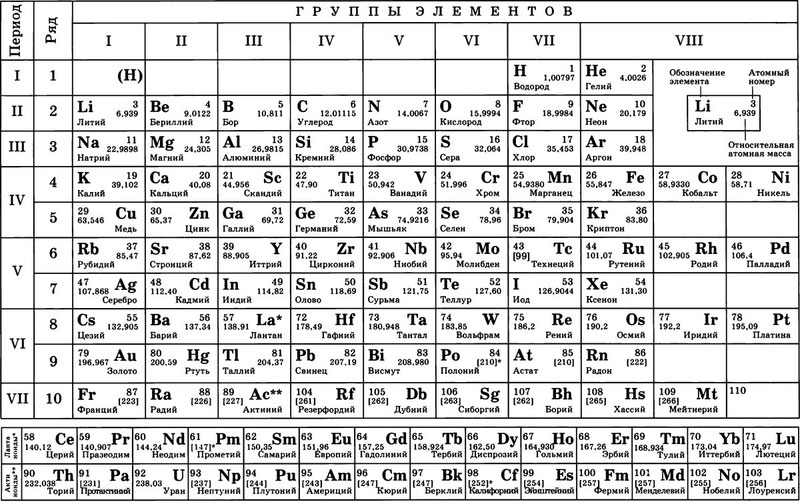
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | ||
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Вернуться к списку элементов
Водород был признан отдельным веществом Генри Кавендишем в 1776 году. Схема простого атома водорода. Схема простого атома водорода. |
| Атомный номер: | 1 | Атомный радиус: | 120 часов (Ван-дер-Ваальс) |
| Атомный символ: | Х | Температура плавления: | -259,16 °С |
| Атомный вес: | 1,008 | Температура кипения: | -252,879 °С |
| Электронная конфигурация: | 1с 1 | Степени окисления: | −1 , +1 (амфотерный оксид) |
История
От греческого слова гидро (вода) и гены (формирование). Водород был признан отдельным веществом Генри Кавендишем в 1776 году.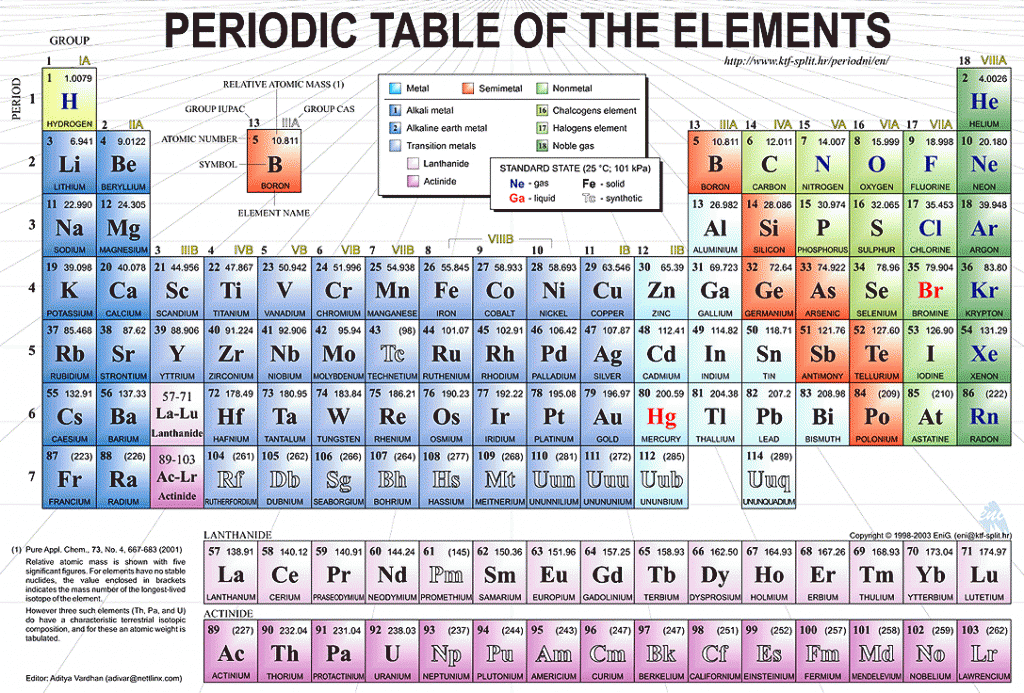 Схема простого атома водорода.
Схема простого атома водорода.
Водород — самый распространенный из всех элементов во Вселенной. более тяжелые элементы первоначально были сделаны из атомов водорода или других элементов, которые были первоначально из атомов водорода.
Источники
По оценкам, водород составляет более 90% всех атомов — три четверти масса Вселенной! Этот элемент содержится в звездах и играет важную роль. в питании Вселенной посредством как протон-протонной реакции, так и углеродно-азотного цикла. Процессы звездного водородного синтеза высвобождают огромное количество энергии, комбинируя водорода с образованием гелия.
Производство водорода только в США составляет около 3 миллиардов кубических футов в год. год. Водород получают паром
- на нагретом угле,
- разложение некоторых углеводородов при нагревании,
- реакция гидроксида натрия или калия на алюминий
- электролиз воды или
- вытеснение из кислот некоторыми металлами.

Жидкий водород играет важную роль в криогенике и изучении сверхпроводимости, т.к. его температура плавления составляет всего 20 градусов выше абсолютного нуля.
Тритий легко производится в ядерных реакторах и используется в производстве водородная бомба.
Водород является основным компонентом Юпитера и других газовых планет-гигантов. На некоторой глубине в недрах планеты давление настолько велико, что твердые молекулярный водород превращается в твердый металлический водород.
В 1973 году группа российских экспериментаторов, возможно, произвела металлический водород при
давление 2,8 мбар. При переходе плотность изменилась от 1,08 до 1,3 г/см 3 . Ранее, в 1972 г.
Ливермор, Калифорния, группа также сообщила о подобном эксперименте, в котором они
наблюдали точку давление-объем с центром в 2 мбар. Прогнозы говорят, что металлик
водород может быть метастабильным; другие предсказывали, что это будет сверхпроводник в комнате
температура.
Соединения
Хотя чистый водород представляет собой газ, его очень мало в нашей атмосфере. Газообразный водород настолько легок, что в несвязанном виде водород наберет достаточную скорость от столкновения с другими газами, что они будут быстро выброшены из атмосферы. На Земле водород встречается главным образом в соединении с кислородом в воде, но он также присутствует в органических веществах, таких как живые растения, нефть, уголь и т. д. Он присутствует как свободный элемент в атмосфере, но только менее 1 ppm на объем. Самый легкий из всех газов, водород соединяется с другими элементами — иногда взрывоопасно – с образованием соединений.
Использование
Большое количество водорода требуется в коммерческих целях для фиксации азота
с использованием аммиачного процесса Габера и для гидрогенизации жиров и масел. Он также используется в
больших количествах в производстве метанола, в гидродеалкилировании, гидрокрекинге и
гидрообессеривание. Другие области применения включают ракетное топливо, сварку, производство соляной кислоты. кислота, восстановление металлических руд и наполнение воздушных шаров.
кислота, восстановление металлических руд и наполнение воздушных шаров.
Подъемная сила 1 кубического фута газообразного водорода составляет около 0,07 фунта при °C, 760 мм давление.
Водородный топливный элемент — это развивающаяся технология, которая позволит электроэнергию, которая будет получена с использованием источника газообразного водорода.
Рассматривается возможность создания всей экономики, основанной на солнечной и ядерной энергии.
водород. Общественное признание, высокие капиталовложения и высокая стоимость водорода с
по отношению к сегодняшним видам топлива — это лишь некоторые из проблем, стоящих перед такой экономикой.
Расположенные в отдаленных районах электростанции будут электролизовать морскую воду; водород
произведенная продукция будет доставляться по трубопроводам в отдаленные города. Чистый водород может
заменить природный газ, бензин и т. д. и может служить восстановителем в металлургии,
химическая переработка, переработка и т. д. Его также можно использовать для преобразования мусора в метан. и этилен.
и этилен.
Формы
Совершенно независимо от изотопов было показано, что при обычных условиях водород газ представляет собой смесь двух типов молекул, известных как орто- и параводород, которые отличаются друг от друга спинами электронов и ядер.
Нормальный водород при комнатной температуре содержит 25% пара-формы и 75% орто-формы форма. Ортоформа не может быть получена в чистом виде. Поскольку эти две формы различаются энергия, физические свойства также различаются. Температуры плавления и кипения параводорода около 0,1 ° C ниже, чем у обычного водорода.
Изотопы
Обычный изотоп водорода H известен как протий, два других изотопа Дейтерий (протон и нейтрон) и Тритий (протрон и два нейтрона). Водород единственный элемент, изотопы которого получили разные названия. Дейтерий и тритий оба используются в качестве топлива в ядерных термоядерных реакторах. Один атом дейтерия содержится примерно в 6000 обычные атомы водорода.
Дейтерий используется в качестве замедлителя для замедления нейтронов.

