Таблица менделеева – Электронный учебник K-tree
Электронный учебник
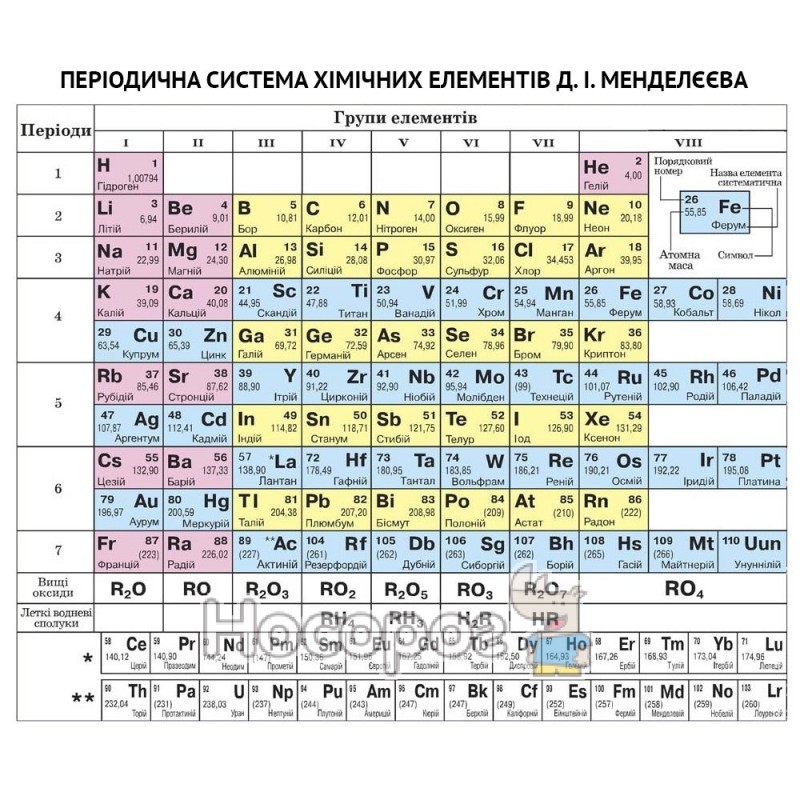
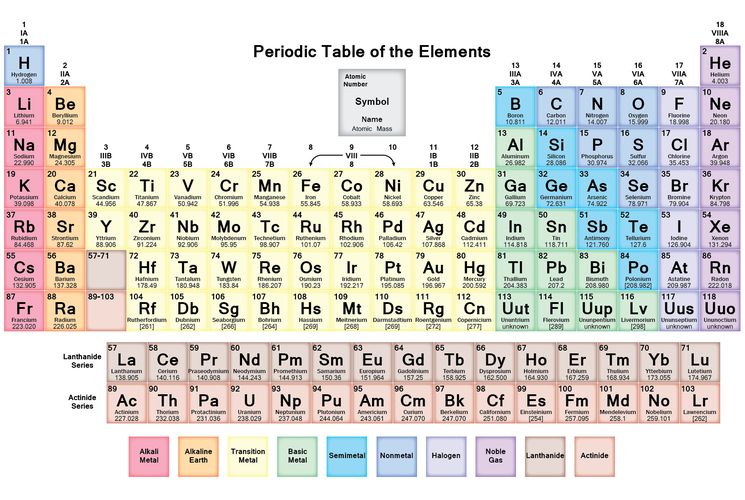
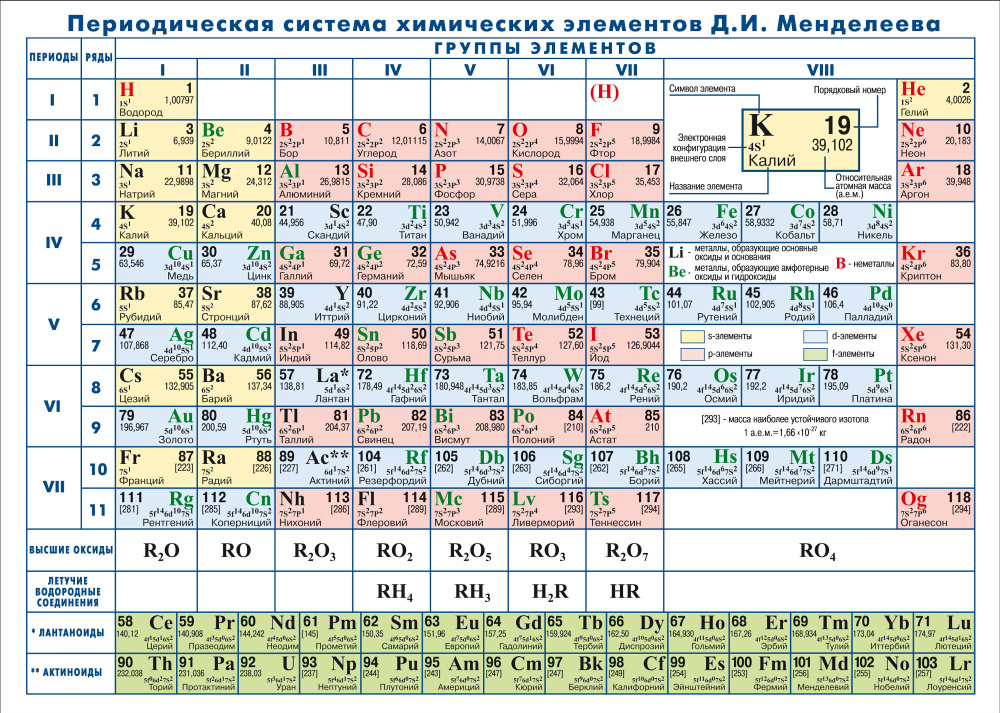
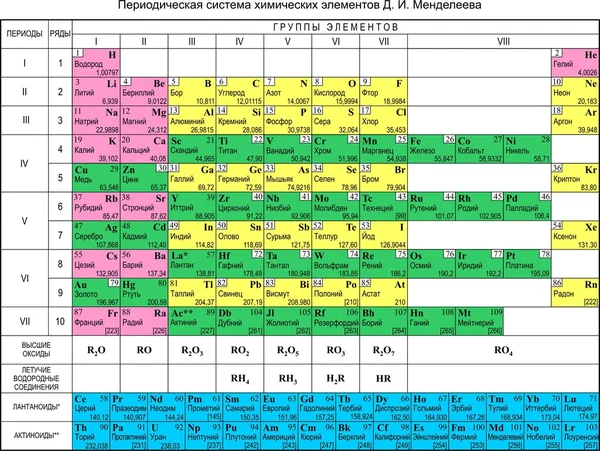
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Фосфор в таблице Менделеева. Электронная формула Фосфора P (графическая схема строения атома)
Содержание
- Что такое фосфор — это металл или неметалл
- Электронная схема фосфора
- Химические свойства
- Взаимодействие с водой
- Взаимодействие с простыми веществами
- Взаимодействие со щелочами
- Восстановительные свойства
- Физические свойства
- Применение
- Получение
- Соединения фосфора, биологическая роль
- Продукты, содержащие фосфор
- Суточная потребность в фосфоре
Что такое фосфор — это металл или неметалл
Фосфор — элемент, расположенный в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д. И. Менделеева, является неметаллом, относится к группе пниктогенов.
И. Менделеева, является неметаллом, относится к группе пниктогенов.
Химический символ элемента — Р. В состав атома фосфора входит ядро с положительным зарядом (+15) и 15 электронов, распределенных по трем энергетическим уровням (по причине расположения элемента в третьем периоде). На первом уровне содержится 2 электрона, на втором — 8, на третьем (внешнем) — 5:
- Первый внутренний уровень содержит 2 электрона на 1s-орбитали.
- Второй уровень включает 2 электрона на 2s-орбитали и 6 электронов на 2р-орбиталях.
- На третьем (внешнем) энергетическом уровне атома фосфора на 3s-орбитали расположена пара спаренных электронов, на 3p-орбитали находятся 3 неспаренных электрона.
Ядро атома фосфора-31 включает в себя:
- 15 протонов;
- 16 нейтронов.
Фосфор относится к элементам p-семейства. Радиус атома фосфора (вычисленный) равен 114 пм. Атомная масса атома фосфора составляет 30,973762(2) а. е. м.
Электронная конфигурация атома фосфора в основном состоянии:
Внешний энергетический уровень атома фосфора содержит 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии.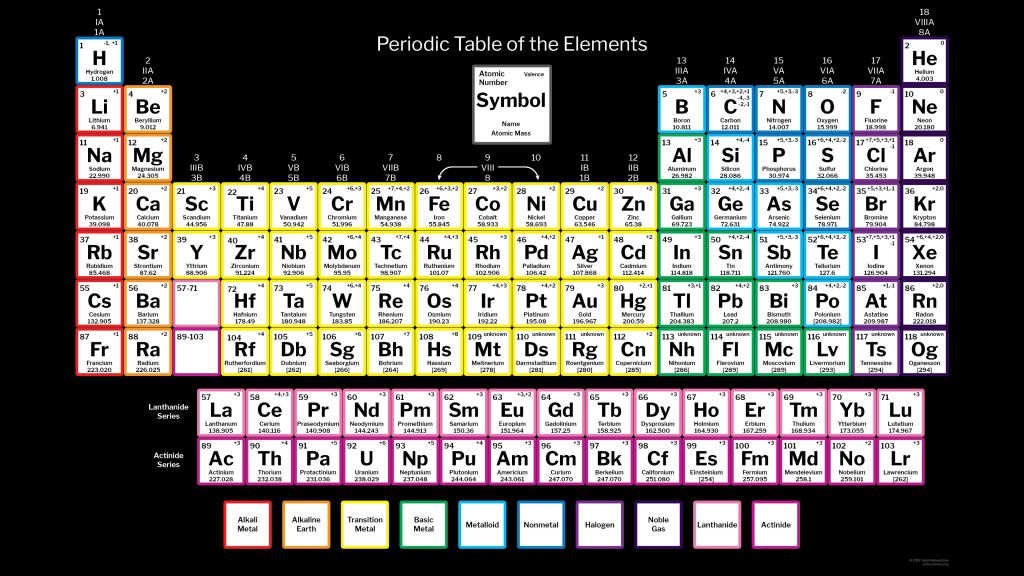 Таким образом, атом фосфора обладает способностью к образованию 3 химических связей по обменному механизму, что соответствует валентности, равной III. В отличие от азота атом фосфора, имея вакантную 3d орбиталь, способен при переходе в возбужденное энергетическое состояние расспаривать 3s-электроны, один из которых переходи на 3d-орбиталь. Таким образом расширяются валентные возможности атома фосфора и он становится способным проявлять в соединениях валентность, равную V.
Таким образом, атом фосфора обладает способностью к образованию 3 химических связей по обменному механизму, что соответствует валентности, равной III. В отличие от азота атом фосфора, имея вакантную 3d орбиталь, способен при переходе в возбужденное энергетическое состояние расспаривать 3s-электроны, один из которых переходи на 3d-орбиталь. Таким образом расширяются валентные возможности атома фосфора и он становится способным проявлять в соединениях валентность, равную V.
Электронная конфигурация фосфора в возбужденном состоянии:
По этой причине, высшая валентность фосфора в соединениях равна V, что отличает его от азота, у которого высшая валентность равна IV.
Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5. Фосфор — химический элемент № 15. Он расположен в VА группе Периодической системы.
Внешний слой атома фосфора включает в себя пять валентных электронов. Для того чтобы его завершить, необходимо еще три электрона. По этой причине в соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, в том числе, кислородом, фтором и другими, — положительные степени окисления +3 или +5. Атом фосфора обладает большим числом электронных слоев, чем атом азота. В связи с этим, электроотрицательность, окислительные и неметаллические свойства фосфора выражены в меньшей степени.
По этой причине в соединениях с металлами и водородом фосфор проявляет степень окисления –3, а при взаимодействии с более электроотрицательными элементами, в том числе, кислородом, фтором и другими, — положительные степени окисления +3 или +5. Атом фосфора обладает большим числом электронных слоев, чем атом азота. В связи с этим, электроотрицательность, окислительные и неметаллические свойства фосфора выражены в меньшей степени.
Электронная схема фосфора
P: 1s2 2s2 2p6 3s2 3p3
Короткая запись:
P: [Ne]3s2 3p3
Одинаковую электронную конфигурацию имеют атом фосфора и -1Si, +1S, +2Cl
Порядок заполнения оболочек атома фосфора (P) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Фосфор имеет 15 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
3 электрона на 3p-подуровне
Химические свойства
Химическая активность фосфора значительно выше, чем у азота.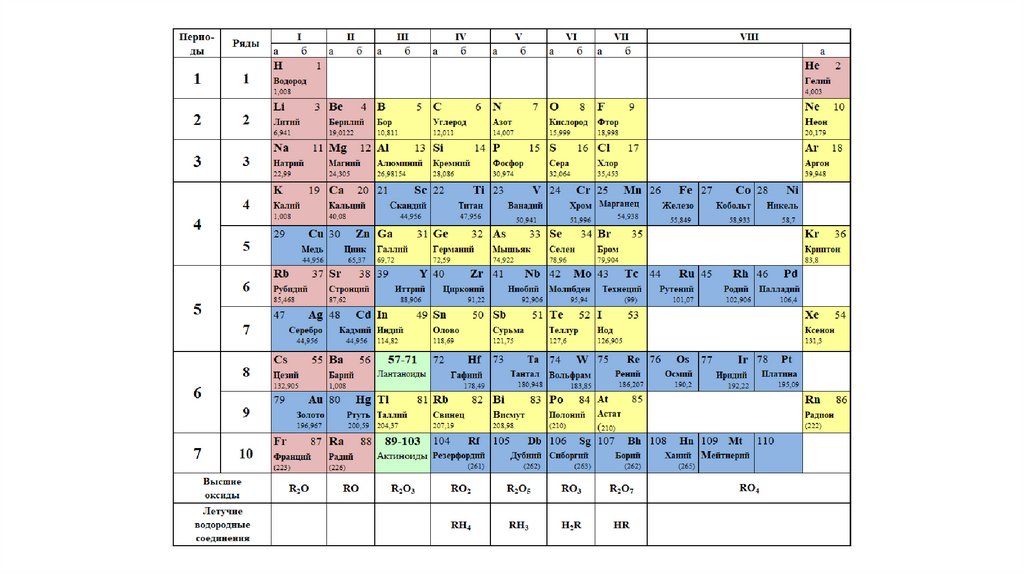 Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с водой
Взаимодействует с водой, при этом диспропорционирует:
- 4Р + 6Н2О → РН3 + 3Н3РО2 (фосфатная кислота).
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
- 4P + 5O2 → 2P2O5 (с избытком кислорода),
- 4P + 3O2 → 2P2O3 (при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
- 2P + 3Ca → Ca3P2,
- 2P + 3Mg → Mg3P2.

с неметаллами — восстановитель:
- 2P + 3S → P2S3,
- 2P + 3Cl2 → 2PCl3.
Не взаимодействует с водородом.
Взаимодействие со щелочами
В растворах щелочей диспропорционирование происходит в большей степени:
- 4Р + 3KOH + 3Н2О → РН3 + 3KН2РО2.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P + 5HNO3 + 2h3O → 3h4PO4 + 5NO;
- 2P + 5h3SO4 → 2h4PO4 + 5SO2 + 2h3O.
Реакция окисления также происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P + 5KClO3 → 5KCl + 3P2O5
Физические свойства
Как и азот, фосфор способен образовывать двухатомные молекулы Р2.. Однако подобные молекулы фосфора могут быть устойчивыми лишь при очень высокой температуре – около 1000 С. В обычных же условиях атомы фосфора соединяются в молекулы других составов. Например, белый фосфор состоит из четырехатомных молекул Р4. Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
Между собой атомы белого фосфора соединены в виде простейшего многогранника тетраэдра.
Сам белый фосфор являет собой практически бесцветное твердокристаллическое вещество, моментально окисляемое кислородом воздуха, при этом во время окисления фосфора идет дым, а в воздухе появляется явный чесночный запах. Своим внешним видом белый фосфор похож на воск, такой же мягкий и легкоплавкий, при этом светится в темноте и является чрезвычайно опасным, так как очень ядовит и огнеопасен.
Помимо белого фосфора физики также различают красный фосфор, черный фосфор, желтый фосфор и металлический фосфор, каждый из них имеет свои особенные физические свойства.
Так если белый фосфор нагревать до температуры 300 С без доступа воздуха и в присутствии катализаторов (ими может быть йод или натрий), то он превратится в красный фосфор. В отличие от белого фосфора его красный собрат не светится в темноте и не является ядовитым и опасным, к слову именно его используют при производстве спичек.
Красный фосфор это аморфное вещество, состоящее из полимерных молекул Px, он нерастворим в воде и других органических растворителях, а при нагревании без доступа воздуха не возгорается.
Если белый фосфор поместить под очень большое давление (в сотни атмосфер) то из него получится черный фосфор, который своими свойствами напоминает металл: он блестит и проводит электрический ток. Если еще больше увеличить давление, то черный фосфор превратится в металлический, его кристаллическая решетка будет такой же плотной как у металлов. Металлический фосфор очень хорошо проводит электрический ток.
Так выглядят разные виды фосфора.
Хотя фосфор и является одним из самых распространенных химических элементов на нашей планете, в чистом виде в природных условиях его не бывает, добыть чистый фосфор возможно лишь в химической лаборатории. Однако фосфор входит в состав многих важных химических и биологических соединений: фосфолипидов, фосфидов (соединения фосфора и металлов), фосфинов (соединений водорода с фосфором), фосфорной кислоты и так далее.
Применение
Научившись добывать фосфор в чистом виде человек нашел ему самое разнообразное применение, причем не только созидательное, но порой и очень разрушительное. Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.
Так еще во время первой мировой войны немецкими химиками был использован желтый фосфор в качестве начинки зажигательных боеприпасов и отравляющих газов.
Впоследствии применение таких газов на поле боя было запрещено Женевской конвенцией. Увы, такая наша глупая человеческая природа – использовать научные открытия в разрушительных целях, как впрочем, и открытие энергии расщепления атома было применено для создания атомной бомбы, и лишь потом для атомной энергетики.
Но вернемся к фосфору, в мирных целях этот химический элемент активно используется в сельском хозяйстве для создания эффективных удобрений для растений. Фосфор входит в состав некоторых лекарственных препаратов, к примеру, в антибиотик фосфомицин, в состав моющих средств, наконец, из безопасного красного фосфора делают спички.
Фосфор имеет свое применение и в металлургии, в качестве сверхпрочных и антикоррозийных покрытий (черный и металлический фосфор). А многие фосфиды (соединения фосфора и металлов) обладают отличными полупроводниковыми свойствами и активно задействуются в микроэлектронике.
Получение
Для получения белого фосфора в чистом виде химики прокалывают природные фосфаты вместе с коксом и песком в электрической печи. Впрочем, вместо фосфатов можно использовать и другие неорганические соединения фосфора, например, метафосфорную кислоту. Красный и черный фосфор получают уже из белого фосфора путем разных манипуляций над последним (нагревание, увеличение давления).
Соединения фосфора, биологическая роль
Типичные соединения фосфора можно представить в виде таблицы:
Соединения фосфора являются неотъемлемым компонентом растительных и животных организмов. Растения формируют запасы данного вещества в семенах и плодах. В организме человека и животных фосфор содержится в тканях скелета, мышц и нервной системы. По усредненным показателям человеческое тело содержит примерно 1,5 кг фосфора:
- из общего объема доля в 1,4 кг находится в костях;
- 130 г вещества приходится на мышцы;
- 12 г фосфора содержит нервная ткань.

У людей во взрослом возрасте около 86% фосфора находится в минеральной части костей и зубов. Оставшийся объем вещества распределен по мышцам, органам, жидкостям организма. Большой концентрацией фосфора обладают ткани нервных клеток и мозга.
Биологическое значение фосфора:
- Фосфор обеспечивает нормальное формирование костной и зубной тканей. В дальнейшем фосфор поддерживает их целостность на протяжении всей жизни человека.
- Входит в состав нуклеиновых кислот, в том числе, ДНК, РНК, молекул, которые хранят и передают наследственную информацию, отвечают за нормальное деление и рост клеток.
- Фосфор, являясь компонентом ферментов, участвует в жировом обмене, синтезе и распаде гликогена и крахмала.
- Как составная часть фосфорной кислоты и фосфатов, фосфор принимает участие в мыслительных процессах, движении, дыхании, обеспечивает нормальный белковый и углеводный обмен.
- Энергетическое питание каждого из процессов жизнедеятельности в составе АТФ.

- Совместно с белками и жирными кислотами фосфор формирует высокоактивные соединения. В качестве примера можно привести лецитин, который необходим для образования клеточных и мозговых оболочек. Большой объем лецитина организм потребляет в процессе физических и психоэмоциональных нагрузок. По этой причине недостаток фосфора снижает защиту клеток.
- Соединения фосфора необходимы, чтобы поддерживать кислотно-щелочное равновесие в организме. Это обусловлено их присутствием в составе крови и других жидкостей. С помощью фосфора формируются активные формы витаминов, так как фосфорсодержащие вещества запускают необходимые для этого ферментные реакции.
- Соединяясь с азотом, жирными кислотами и глицерином, фосфор образует фосфолипиды, которые принимают участие в каждом физиологическом процессе организма.
- Фосфорсодержащие вещества повышают кислотность мочи и снижают вероятность образования камней в почках.
В качестве суточной нормы фосфора для взрослого человека определено количество в 1600 мг. У беременных женщин максимальная потребность в данном элементе увеличивается до 3000 мг. Кормящим матерям необходимо 3800 мг фосфора в сутки. Получить дневную норму вещества человек во взрослом возрасте может, употребляя 130 г сыра, 12 яичных желтков, 6 столовых ложек тыквенных семечек, 500 г мяса или рыбы, либо 400 г овсяных хлопьев. Фосфор усваивается в костях, спустя 4 — 6 часов после попадания в организм с пищей.
У беременных женщин максимальная потребность в данном элементе увеличивается до 3000 мг. Кормящим матерям необходимо 3800 мг фосфора в сутки. Получить дневную норму вещества человек во взрослом возрасте может, употребляя 130 г сыра, 12 яичных желтков, 6 столовых ложек тыквенных семечек, 500 г мяса или рыбы, либо 400 г овсяных хлопьев. Фосфор усваивается в костях, спустя 4 — 6 часов после попадания в организм с пищей.
Продукты, содержащие фосфор
К счастью фосфор содержится во многих доступных продуктах питания: орехах, морепродуктах (особенно в рыбе), в сыре, капусте, моркови, чесноке, куриных яйцах (особенно в желтке). Особенно много фосфора имеется в яблоках, грецких орехах, говяжьей печени, гречке и икре рыб семейства осетровых.
Теперь вы знаете, какие продукты могут увеличить содержание фосфора в вашем организме и организме ваших детей.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки.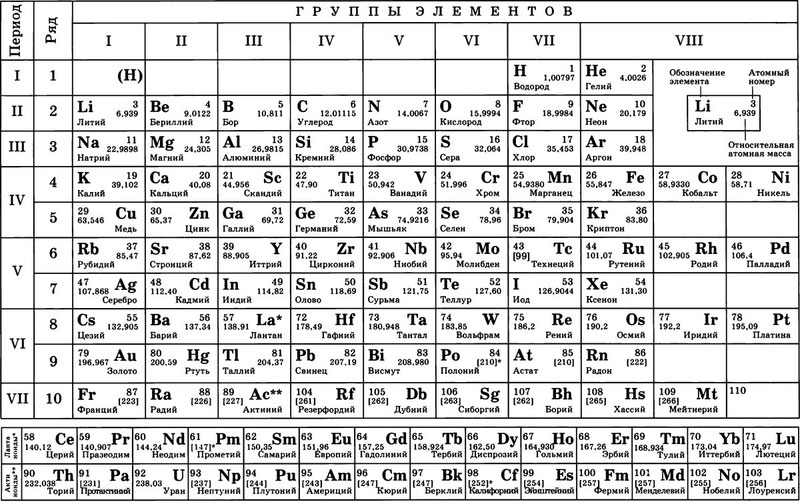 Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Источники
- https://wika.tutoronline.ru/himiya/class/9/fosfor-i-ego-soedineniya-v-himii
- https://k-tree.ru/tools/chemistry/periodic.php?element=P
- http://himsnab-spb.ru/article/ps/p/
- https://www.poznavayka.org/himiya/fosfor/
- https://calorizator.ru/element/p
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Правая часть периодической таблицы
Рон Б. Дэвис-младший, Джорджтаунский университет
Правая часть периодической таблицы или p-блока — это место, где сходятся все типы элементов. Существуют элементы от хрупких и токсичных металлов до полупроводников, от инертных газов до радиоактивных сверхтяжелых элементов.
 Давайте разберемся, что движет этим удивительным разнообразием в p-блоке. P-блок расположен в правой части таблицы Менделеева. (Изображение: Sciencepics/Shutterstock)
Давайте разберемся, что движет этим удивительным разнообразием в p-блоке. P-блок расположен в правой части таблицы Менделеева. (Изображение: Sciencepics/Shutterstock)Ранний регион P-блока
Ранние попытки Менделеева и других свести элементы в таблицу поместили то, что мы сейчас называем элементами p-блока, рядом с s-блоком. Эти ранние таблицы были основаны исключительно на валентности или соотношении, в котором каждый элемент соединяется с другими атомами, такими как кислород и водород. Это, безусловно, правильный подход к организации элементов, потому что валентность напрямую связана с их атомной структурой.
Но еще до того, как строение атома было полностью выяснено, уже в 1904 некоторые предложения таблиц элементов помещают группы с 13 по 18 в противоположный конец таблицы, где они появляются сегодня. Эти таблицы, казалось, признавали, что в группах элементов за пределами группы 2 было что-то другое. Эти группы были беспорядочными, содержали элементы с множеством различных наблюдаемых свойств и необычными тенденциями в каждой группе, которые в то время не поддавались объяснению.
Где расположены элементы P-блока?
Долгое время современная таблица сигнализировала об этой большей сложности, обозначая группы с IIIB по VIIIB для так называемых переходных металлов и другую группу элементов, называемую с IIIA по VIIIA, для правой части основной таблицы. Благодаря вкладу Эрвина Шредингера, Генри Мозли, Дж. Дж. Томпсона и других мы теперь понимаем, что источником этой сложности является сложная структура самого атома.
В данном случае это заполнение p-подоболочки и конечная цель всех атомов — получить октет. Элементы P-блока пересекают ту критическую границу, где потеря электронов в ионных связях и металлических связях начинает уступать место добавлению электронов в их облако, разделяя или принимая их как все более благоприятный способ достижения октета.
А в более современных представлениях современной таблицы римская система счисления часто заменяется системой, рекомендованной IUPAC, которая просто нумерует группы 1-18 прямо. При таком способе нумерации блок элементов справа становится группами с 13 по 18.
В тех же столбцах p-блок определяется как строки со 2 по 7. Помните, что гелий слишком прост, чтобы вообще иметь какие-либо p-электроны, поэтому он не считается элементом p-блока. Итак, именно эти 36 элементов — и только эти 36 элементов — имеют р-электроны в своей валентной оболочке, когда находятся в основном состоянии.
Эта статья взята непосредственно из серии видео Понимание периодической таблицы . Смотрите прямо сейчас на Wondrium .
Все основные классы элементов в одной области
На самом деле удивительно, что всего три дюжины элементов, сгруппированных так близко друг к другу, содержат все следующие элементы: знакомые металлы, такие как свинец и олово, полупроводники, такие как кремний и германий, инертные вещества. такие газы, как неон, и основные строительные блоки жизни, от углерода, азота и кислорода до фосфора и серы.
Инертные газы, кроме гелия, появляются в области р-блока. (Изображение: Ирина Юсупова/Shutterstock)
(Изображение: Ирина Юсупова/Shutterstock)Первое, что должно бросаться в глаза в p-блоке, это то, что он содержит все три основных класса элементов — металлы, металлоиды и неметаллы. Еще более поразительно то, что они расположены довольно аккуратно, но преимущественно по диагонали.
Металлы внизу слева, неметаллы вверху справа. И есть диагональная металлоидная зона, проходящая через p-блок, которую вы можете представить как своего рода дружественную «демилитаризованную зону», где свойства металлов и неметаллов мирным и удивительным образом сходятся воедино.
Нижний левый угол
Элементы строки 7 в p-блоке представляют собой еще один особый случай. Хотя их расположение предсказывает металлоподобные свойства, мы мало что можем с уверенностью сказать о химических свойствах этих так называемых «сверхтяжелых» элементов, поскольку когда-либо было создано лишь несколько их атомов.
Олово — один из металлических элементов, которые появляются в нижнем левом углу р-блока. (Изображение: RHJPhtotos/Shutterstock)
(Изображение: RHJPhtotos/Shutterstock)В левом нижнем углу этой области p-блока появляются некоторые из самых знакомых металлов в нашем мире. К таким металлам относятся свинец, олово и алюминий. Все это классические металлические элементы, которые часто образуют ионные соединения с неметаллами и делят электроны с другими металлами через валентную зону в металлической связи. Как металлы, они податливы и хорошо проводят электричество и тепло, как и большинство других металлов.
Блок с наибольшим разнообразием
Но с другой стороны p-блока находятся неметаллы, такие как углерод, кислород, сера и хлор. Эти элементы предпочитают ковалентно связываться друг с другом, образуя дискретные молекулы в соединениях. Такие соединения, как растворитель хлороформ (CHCl 3 ), газообразный диоксид углерода CO 2 или загрязнитель триоксид серы, вызывающий кислотные дожди.
Через середину p-блока проходят некоторые более знакомые элементы, например кремний.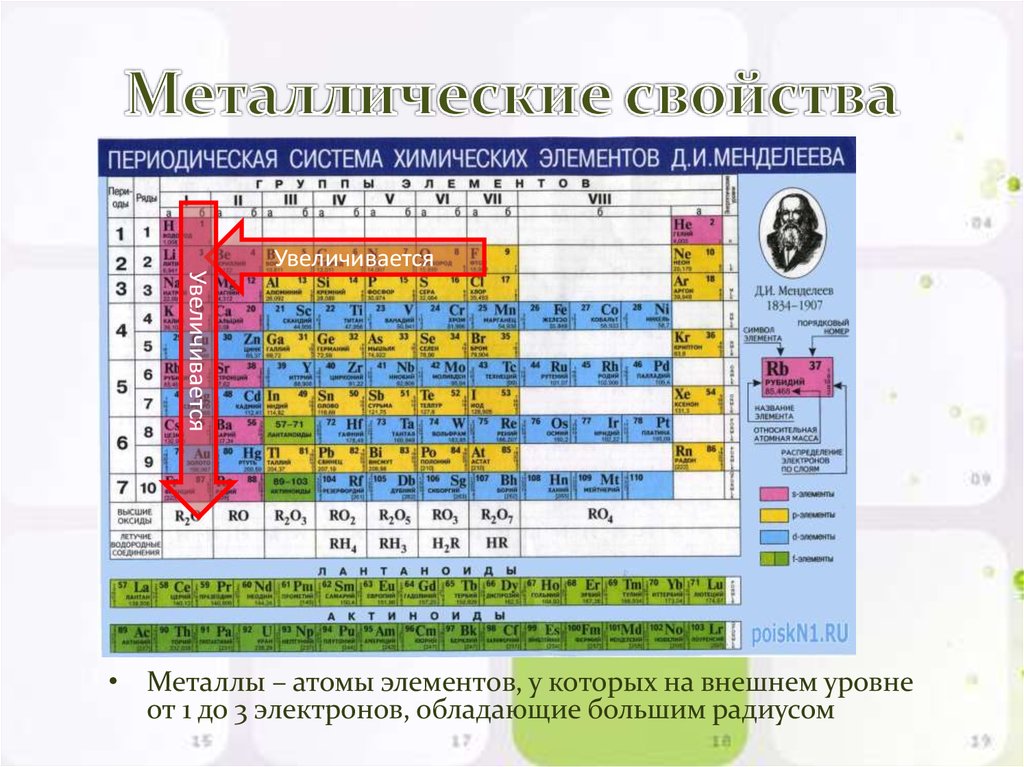 Эти элементы представляют собой серую область p-блока, в которой свойства чем-то похожи на металлы, но другие больше похожи на неметаллы.
Эти элементы представляют собой серую область p-блока, в которой свойства чем-то похожи на металлы, но другие больше похожи на неметаллы.
Общие вопросы о P-блоке Периодической таблицы
В: Какие группы и строки создают область p-блока Периодической таблицы?
В общем, периодическая таблица состоит из 18 групп, из которых элементы групп с 13 по 18 имеют р-электроны в своей валентной оболочке. Таким образом, группы с 13 по 18 образуют p-блочную область периодической таблицы. В группах с 13 по 18 p-блок охватывает строки со 2 по 7, которые в общей сложности содержат 36 элементов.
В: Каковы свойства элементов в левом нижнем углу p-блока?
Некоторые известные в мире металлы расположены в левом нижнем углу p-блока, среди них такие металлы, как алюминий, свинец и олово. Эти классические металлические элементы часто образуют ионную связь с неметаллами и ковалентную связь с другими металлами. Подобно другим металлам, ковкость и проводимость являются некоторыми свойствами этих элементов.
Подобно другим металлам, ковкость и проводимость являются некоторыми свойствами этих элементов.
В: Какие элементы области p-блока склонны связываться и создавать дискретные молекулы?
Некоторые неметаллические элементы в области p-блока имеют тенденцию образовывать ковалентные связи друг с другом, образуя некоторые дискретные молекулы в соединениях. Сера, кислород, углерод и хлор входят в число этих неметаллических элементов, которые вместе могут образовывать такие соединения, как двуокись углерода (CO 2 ), растворитель хлороформ (CHCl 3 ) и загрязняющий триоксид серы.
Продолжайте читать
Периодическая таблица: открытие элементов первого столбца
Удивительные свойства щелочных металлов
Какие металлы группы 1 влияют на нашу повседневную жизнь? Элементы P-блока
| bartleby
Что такое P-Block Elements?
Элементы, находящиеся в правой части периодической таблицы, называются элементами p-блока.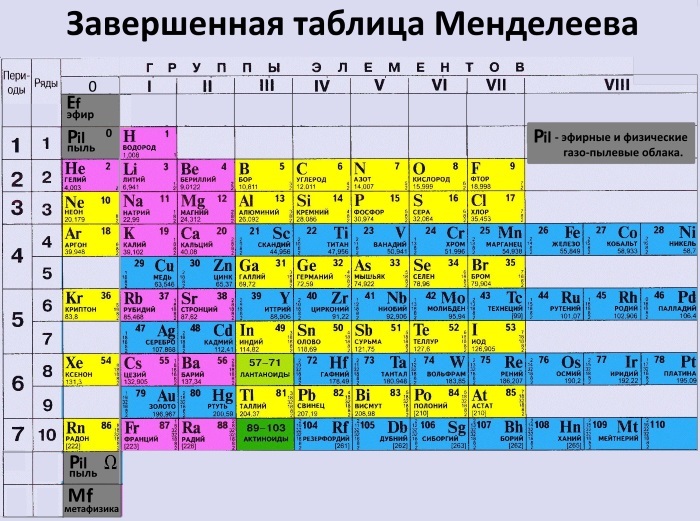 Помимо благородных газов, к ним относятся семейства бора, ртути, азота, кислорода и фтора. Эти элементы имеют различные реализации в реальной жизни, с которыми мы регулярно сталкиваемся.
Помимо благородных газов, к ним относятся семейства бора, ртути, азота, кислорода и фтора. Эти элементы имеют различные реализации в реальной жизни, с которыми мы регулярно сталкиваемся.
Периодическая таблица
Периодическая таблица представляет собой таблицу, показывающую структурированное расположение различных элементов. Периодическая таблица содержит название, атомный номер, атомный вес и символы известных элементов. Он используется для решения задач по химии и делится на строки и столбцы. Строки называются периодами, а столбцы — группами. Элементы p-блока находятся в правой части периодической таблицы.
Пример p-элементов, используемых в повседневной жизни: Алюминий является важным элементом p-блока, используемого в авиационной промышленности. Хлор используется в плавательных бассейнах для дезинфекции воды, которая также является элементом р-блока.
Элементы P-блока в периодической таблице
Элементы P-блока находятся там, где последний электрон достигает двух из трех p-орбиталей соответствующих оболочек. p-подоболочка имеет три вырожденных p-орбитали, каждая из которых может содержать два электрона.
p-подоболочка имеет три вырожденных p-орбитали, каждая из которых может содержать два электрона.
Большое разнообразие элементов образует р-блок периодической таблицы. Элементы P-блока содержат металлы, неметаллы и металлоиды.
Металлы включают алюминий, галлий, индий, таллий, олово, свинец и висмут.
Неметаллы включают гелий, углерод, азот, кислород, фтор, неон и фосфор.
Металлоиды включают бор, кремний, германий, мышьяк, сурьму, теллур, толоний и астат.
Группа 13 известна как икосагены или триэли.
Группа 14 известна как кристаллолегены или терагены.
Группа 15 известна как пноктогены.
Группа 16 состоит из металлов и известна как халькогены.
Элементы группы 17 являются неметаллами и известны как галогены.
Элементы группы 18 известны как благородные газы.
Свойства элементов P-блока
Физические свойства (такие как атомный и ионный радиусы, энтальпия ионизации и т. д.), а также химические свойства существенно зависят от изменения внутреннего ядра элементов. Поэтому обнаруживается большое разнообразие свойств элементов в группе p-блоков.
Поэтому обнаруживается большое разнообразие свойств элементов в группе p-блоков.
Проводник тепла и электричества
Элементы P-блока глянцевые и обычно являются хорошим проводником электричества и тепла, поскольку имеют тенденцию терять электрон. Металл, который может расплавиться на ладони, — это галлий, элемент р-блока. Кремний является одним из наиболее ценных металлоидов в группе р-блоков, поскольку он является важным компонентом стекла.
Электронная конфигурация
Поскольку внутреннее ядро электронной структуры может варьироваться, электронная конфигурация элементов р-блока для полной валентной оболочки составляет ). Каждая группа элемента p-блока известна своим первым элементом.
Пример:
- Группа 13 – ns 2 np 1 (семейство бора)
- Группа 14 – ns 2 np 2 (Carbon family)
- Group 15 – ns 2 np 3 (Nitrogen family)
- Group 16 – ns 2 np 4 (Oxygen family)
- Group 17 – ns 2 np 5 (семейство галогенов)
- Группа 18 – ns 2 np 6 (благородные газы) (кроме гелия 1s 2 ).

Цвет элементов P-Block
Группа 13 – бор коричневого цвета, остальные серебристого цвета.
Группа 14 – Кремний и германий имеют серый цвет, а углерод – черный.
Группа 15 — Все элементы разного цвета.
- Азот бесцветный.
- Фосфор красный и белый.
- Мышьяк желтый.
- Сурьма серая.
- Висмут серебристо-белый.
Группа 16 – В этой группе все тоже разных цветов.
- Кислород бесцветный.
- Сера бледно-желтого цвета.
- Селен красный.
- Теллур серебристо-белый.
- Полоний серебристый.
Группа 17 – элементы, известные как галогены и различающиеся по цвету.
- Фтор бледно-желтого цвета.
- Хлор зеленовато-желтый.
- Бром имеет красновато-коричневый цвет.
- Йод фиолетово-черный
Группа 18 – Существуют различные цвета всех благородных газов.
- Гелий красный.
- Неон зеленый.

- Ксенон белый.
- Радон бесцветен.
- Криптон фиолетовый.
Metallic Character
P-блок является ключевым местом для хранения металлоидов в периодической таблице. Неметаллический характер снижается в группе, но в p-блоке наблюдается устойчивый рост неметаллического характера слева направо. Каждая категория продолжает усиливать металлический характер, хотя он снижается, когда мы проходим диапазон слева направо. Самый тяжелый элемент в каждой категории p-блоков на самом деле является самым металлическим.
Атомная плотность
Из-за увеличения размера атома вниз по группе атомная плотность элементов в p-блоке увеличивается вниз по группе. Хотя он уменьшается по мере прохождения по времени слева направо, это связано с уменьшением ядерного масштаба всех компонентов в p-блоке за период. Алюминий имеет низкую плотность в большом количестве компонентов и обычно используется в качестве конструкционного элемента.
Atomic Radii
Когда мы движемся вниз по группе, всегда добавляется одна дополнительная оболочка, поэтому радиус элементов всегда увеличивается при движении вниз по группе. Но затем размер атома уменьшается при смещении слева направо. Это связано с тем, что за это же время слева направо не вставляется дополнительная оболочка, но увеличивается заряд ядра, поэтому размер уменьшается.
Но затем размер атома уменьшается при смещении слева направо. Это связано с тем, что за это же время слева направо не вставляется дополнительная оболочка, но увеличивается заряд ядра, поэтому размер уменьшается.
Точки плавления и кипения
Точки плавления и кипения неуклонно увеличивают группу, даже несмотря на то, что атомная масса увеличивает группу, и, следовательно, межмолекулярные силы также увеличиваются.
Демонстрация переменных степеней окисления
Максимальная степень окисления, которую демонстрирует элемент p-блока, равна общему количеству валентных электронов (т. е. сумме s- и p-электронов).
В своей первой строке p-блок следует правилу октетов, но элементы в последующих строках показывают гипервалентность. Как правило, реакционная способность элементов в группе уменьшается вниз. В группе 18 увеличивается реактивность: Ne < He Степени окисления различных элементов показаны ниже: Природа почти всех элементов периодической таблицы диамагнетики, кроме астата, йода, полония и радона. Магнитные свойства