Кремний — общая характеристика элемента и химические свойства » HimEge.ru
Место кремния в Периодической системеКремний расположен в 14 группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома углерода содержится 4 электрона, которые имеют электронную конфигурацию 3s2 3p2. Кремний проявляет степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
Аллотропия кремнияКристаллический кремний – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; t°пл. 1415°C; t°кип. 2680°C.
Имеет алмазоподобную структуру (sp3— гибридизация атомов кремния) и образует прочные ковалентные σ- связи. Инертен.
Аморфный кремний — бурый порошок, гигроскопичен, более реакционноспособен.
Получение кремния1) 2С + Si+4O2 –t°→ Si0 + 2CO
2) 2Mg + Si+4O2 –t°
Кремний – второй по распространенности элемент на Земле после кислорода. Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Оксид кремния образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. Составляет основу многих полудрагоценных камней – агат, аметист, яшма и др.
Также кремний входит в состав породообразующих минералов – силикатов и алюмосиликатов – полевых шпатов, глин, слюд и др.
Химические свойства Si
Типичный неметалл средней активности.
Как восстановитель:
1) С кислородом
2) С галогенами, со фтором без нагревания.
Si0 + 2F2 → SiF4
3) С углеродом
Si0 + C –t°→ Si+4C
(SiC — карборунд –твёрдый, используется для шлифовки)
4) С азотом
3Si + 2N2 –t°→ Si3N4.
5) С кислотами не реагирует.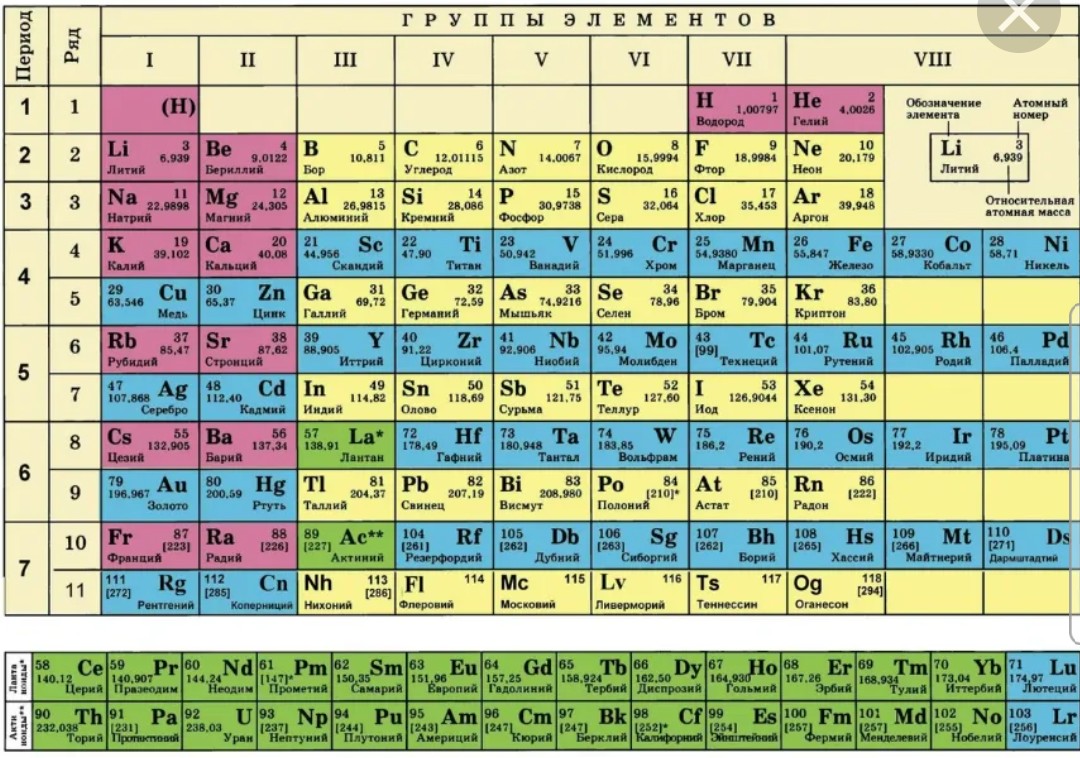 Растворяется только в смеси азотной и плавиковой кислот:
Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O
6) Со щелочами (при нагревании):
Как окислитель:
6) С металлами (образуются силициды):
Si0 + 2Mg –t°→ Mg2Si-4
Разложением силицидов металлов кислотой получают силан (SiH4)
Mg2Si + 2H2SO4 → SiH4 + 2MgSO4
7) С водородом не взаимодействует.
IV группа главная подгруппа периодической таблицы Менделеева (углерод, кремний)
К элементам главной подгруппы IV группы относятся
Углерод С
Кремний Si
Германий Ge
Олово Sn
Свинец Pb
Общая характеристика элементов 4 группы главной подгруппы
От С к Pb (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 4 электрона на внешнем слое ns2np2:
С
Si – 3s23p2
Ge – 4s24p2
Sn – 5s25p2
Pb – 6s26p2
Углерод и кремний
Нахождение в природе углерода и кремния
Углерод в природе распространен и в виде простых веществ (алмаз, графит), и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Кремний — второй по распространенности элемент на Земле после кислорода. Чаще всего в природе кремний встречается в виде соединений на основе SiO2

Углерод
Химические свойства углерода
Качественные реакции
- Обнаружить карбонат-ионы CO32- — можно при помощи взаимодействия солей-карбонатов с сильными кислотами. При этом выделяется углекислый газ — газ без цвета и запаха, не поддерживающий горение:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- Качественная реакция на углекислый газ CO2– помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
При дальнейшем пропускании углекислого газа осадок CaCO3 растворяется:
CaCO3 + CO2 + H2O → Ca(HCO3)2
- Углекислый газ СО2 не поддерживает горение.
- Угарный газ CO горит голубым пламенем.
Взаимодействие углерода с простыми веществами
С кислородом
Горит в недостатке кислорода с образованием угарного газа:
2C + O2 = 2CO
в избытке кислорода – с образованием углекислого газа:
C + O2 = CO2
С галогенами (F, Cl, Br, I)
Углерод реагирует со фтором при нагревании до 900ºС с образованием фторида углерода (IV):
C + 2F2 → CF4
Раскаленный углерод реагирует с другими галогенами:
C + 2Cl2→ CCl4
С водородом
При нагревании в присутствии катализатора (Ni) углерод взаимодействует с водородом с образованием метана:
С + 2Н2 → СН4
С серой
При сильном нагревании углерод взаимодействует с серой с образованием сероуглерода:
C + 2S → CS
С азотом
С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
С углеродом
При нагревании около 2000оС кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
C + Si → SiC
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами углерод выступает в качестве окислителя, образуя карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
Взаимодействие со сложными веществами
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2
С кислотами
Углерод как восстановитель взаимодействует с кислотами-окислителями:
С концентрированной азотной кислотой
3C + 4HNO3 = 3CO2+ 4NO + 2H2O
C концентрированной серной кислотой:
С+2H2SO4=CO2 +2SO2 +2Н2О
С солями
В расплавах KNO3 и NaNO3 измельченный уголь интенсивно сгорает:
5С + 4KNO3 = 2К2СO3
С оксидами
Углерод взаимодействует с многими основными и амфотерными оксидами, с образованием металла и угарного газа:
C + 2ZnO → 2Zn + CO
4С + Fe3O4 → 3Fe + 4CO
Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
При взаимодействии углерода с оксидами активных металлов образуются карбиды:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
Кремний
Способы получения кремния
В промышленности основным сырьем для получения кремния служит кремнезем (диоксид кремния):
- Восстановление SiO2 углеродом в электропечах при температуре 1800ºС:
SiO2 + 2C → Si + 2CO
Таким способом получают технический кремний.
- Особо чистый кремний из технического продукта получают следующим образом:
Si + Cl2 = SiCl4
SiCl4 + 2H2 = Si + 4HCl
или:
Si + 2Mg = Mg2Si
Mg2Si + 4HCl = SiH4 + 2MgCl2
SiH4 → Si + 2H2
В лаборатории кремний можно получить:
- при
прокаливании смеси металлического магния
SiO2 + 2Mg → Si + 2MgO
- восстановление кремния из его оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
Химические свойства кремния
Качественные реакции
Качественная реакция на силикат-ионы
SiO32- — взаимодействие
солей-силикатов с сильными кислотами.
При этом выделяется белый гелеобразный осадок:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
Взаимодействие кремния с простыми веществами
С кислородом
Взаимодействует с кислородом при температуре более 400°С с образованием диоксида кремния:
Si + O2 → SiO2
С галогенами (F, Cl, Br, I)
При обычных условиях кремний реагирует только со фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
С остальными галогенами реакция идет при нагревании до 300-500ºС:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
С водородом
Не взаимодействует
С серой
При температуре выше 600°С кремний взаимодействует с серой с образованием сульфида кремния:
Si + 2S → SiS2
С азотом
С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2→ Si3N4
С углеродом
При нагревании около 2000оС кремний вступает в реакцию с углеродом с образованием карбида кремния (карборунда):
C + Si → SiC
С фосфором
Не взаимодействует
С металлами
В реакциях с активными металлами кремний выступает в качестве окислителя, образуя силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
Взаимодействие кремния со сложными веществами
С водой
Непосредственно с водой не взаимодействует, однако аморфный кремний реагирует с перегретым водяным паром при температуре 400-500°С:
Si + 2H2O = SiO2 + 2H2
С кислотами
- Кремний не взаимодействует с водными растворами
кислот.

- Аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
- При обработке кремния безводным HF комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
- Кремний растворяется в смеси концентрированных азотной и плавиковой кислот (травление кремния кислотами):
3Si + 4HNO3+ 12HF → 3SiF4 + 4NO + 8H2O
С водными растворами щелочей
В водных растворах щелочей при нагревании выше 60ºС кремний растворяется с образованием солей силикатов (травление щелочами):
Si + 2NaOH + H2O → Na2SiO3 + 2H2
С оксидами
При восстановлении SiO2 кремнием при температурах свыше 1200 ºC образуется оксид
кремния (II) — SiO.
Si+SiO2 = 2SiO
Si + SiO2 = SiO
Ученые в России синтезировали 117-й химический элемент
Подпись к фото,Руководитель группы ученых, синтезировавших 117-й элемент, академик Оганесян
Российские и американские ученые успешно синтезировали 117-й элемент таблицы Менделеева, сообщил Русской службе Би-би-си руководитель эксперимента академик Юрий Оганесян.
“Мы достоверно зафиксировали шесть событий рождения ядер 117-го элемента”, – заявил Оганесян. Таким образом, ученые смогли заполнить пустовавшее место в таблице Менделеева между 116-м и 118-м элементами.
Эксперимент был начат в июне 2009 года в Объединенном институте ядерных исследований (ОИЯИ) в подмосковной Дубне, и, как говорят ученые, первые результаты были получены еще в прошлом году.
Для синтеза 117-го элемента был использован ускоритель У-400, который начали строить еще в 1974 году и с тех пор многократно модернизировали.
Чтобы зафиксировать рождение ядра нового элемента ученые обстреливали 97-й элемент периодической таблицы берклий-249 ионами кальция-48.
Для того, чтобы получить искусственный элемент берклий, “продолжительность жизни” которого составляет всего 320 дней, нужен очень мощный реактор. 22 миллиграмма берклия для эксперимента были получены в Окриджской национальной лаборатории в США.
Из полученного американскими учеными берклия в российском лаборатории в Дмитровграде была изготовлена “мишень”, которую и использовали при синтезе.
Академик Оганесян рассказал корреспонденту Би-би-си Илье Беру, что в вопросе синтеза сверхтяжелых элементов “эксперимент идет впереди теории”.
“Пока теория объясняет то, что получается, и таким образом, развивается”, – заявил академик, выразив при этом надежду, что теория сможет объяснять и предсказывать достигаемые опытным путем результаты.
Поиск “острова стабильности”
У нового элемента пока нет названия и, вероятно, не будет еще довольно долго.
Окончательно открытие нового элемента периодической таблицы может быть признано лишь после того, как он будет синтезирован в других лабораториях, что может занять от нескольких месяцев до нескольких лет.
Только после этого Международный союз чистой и прикладной химии (IUPAC – ИЮПАК) может подтвердить открытия, а ученые смогут предложить название для нового элемента. Но это еще не значит, что их предложение будет принято. Существуют традиции называть элементы либо в честь планет (уран, плутоний), либо в честь великих ученых (кюрий, менделевий), либо мест, в которых развивалась наука (берклий, дубний).
Юрий Оганесян говорит, что его группа ученых будет следовать этим традициям, но он сам был бы за то, чтобы одному из новых элементов было присвоено имя академика Георгия Флерова.
“Это был один из пионеров физики тяжелых ионов. Он известный ученый, который открыл спонтанное деление, вместе с Петржаком в 1940 году”, – рассказал Оганесян, уточнив, что лаборатория ядерных реакций, в которой проводились эксперименты по синтезу 117-го элемента, носит имя Флерова
Лаборатория Флерова действует с 1960-х годов. Во времена СССР здесь были получены 104, 105, 106, 107, 108 элементы, а затем были впервые синтезированы сверхтяжелые элементы с атомными номерами со 112 по 116-й и самый тяжелый на сегодня 118-й элемент.
Во времена СССР здесь были получены 104, 105, 106, 107, 108 элементы, а затем были впервые синтезированы сверхтяжелые элементы с атомными номерами со 112 по 116-й и самый тяжелый на сегодня 118-й элемент.
В природе не существует элементов с атомными номерами (числом протонов в ядре атома) больше 92, то есть, тяжелее урана. Более тяжелые элементы, например, плутоний, могут нарабатываться в атомных реакторах, а элементы тяжелее 100-го (фермия) можно получать только на ускорителях, путем бомбардировки мишени тяжелыми ионами.
Поиски сверхтяжелых элементов связаны со стремлением открыть среди них “остров стабильности”, так как большинство сверхтяжелых элементов нестабильны и распадаются.
Стабильные сверхтяжелые элементы потенциально могут обладать уникальными свойствами.
Кремний
| Кремний | |
|---|---|
| Атомный номер | 14 |
| Внешний вид простого вещества |
В аморфной форме — коричневый порошок, в кристаллической — тёмно-серый, слегка блестящий |
| Свойства атома | |
|
Атомная масса (молярная масса) |
28,0855 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 132 пм |
|
Энергия ионизации (первый электрон) |
786,0(8,15) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Химические свойства | |
| Ковалентный радиус | 111 пм |
| Радиус иона | 42 (+4e) 271 (-4e) пм |
|
Электроотрицательность (по Полингу) |
1,90 |
| Электродный потенциал | 0 |
| Степени окисления | +4, −4, +2 |
| Термодинамические свойства простого вещества | |
| Плотность | 2,33 г/см³ |
| Молярная теплоёмкость | 20,16[1]Дж/(K·моль) |
| Теплопроводность | 149 Вт/(м·K) |
| Температура плавления | 1688 K |
| Теплота плавления | 50,6 кДж/моль |
| Температура кипения | 2623 K |
| Теплота испарения | 383 кДж/моль |
| Молярный объём | 12,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая, алмазная |
| Параметры решётки | 5,4307 Å |
| Отношение c/a | — |
| Температура Дебая | 625 K |
| Si | 14 |
| 28,0855 | |
| [Ne]3s23p2 | |
| Кремний | |
История
Схема атома кремния
В чистом виде кре́мний был выделен в 1811 г. французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
французскими учеными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
Происхождение названия
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российский химиком Германом Ивановичем Гессом. В переводе c греческого kremnos — «утес, гора».
Нахождение в природе
По распространённости в земной коре кремний среди всеххимических элементов занимает второе место (после кислорода). Масса земной коры на 27,6—29,5 % состоит из кремния. Кремний входит в состав нескольких сотен различных природных силикатов и алюмосиликатов. Больше всего распространен кремнезём — многочисленные формы диоксида кремния (IV) SiO2 (речной песок, кварц, кремень и др.), составляющий около 12 % земной коры (по массе). В свободном виде кремний в природе не встречается, хотя одна четвертая земли состоит из кремния.
Получение
В промышленности кремний получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99,9 %. Так как для практического использования нужен кремний более высокой чистоты, полученный кремний хлорируют. Образуются соединения состава SiCl4 и SiCl3H. Эти хлориды далее очищают различными способами от примесей и на заключительном этапе восстанавливают чистым водородом. Возможна также очистка кремния за счет предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают летучий моносилан SiH4. Моносилан очищают далее ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C. Содержание примесей в получаемом этими методами кремнии снижается до 10−8-10−6% по массе.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым. Крупнейшим производителем кремния в России является ОК Русал — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Крупнейшим производителем кремния в России является ОК Русал — кремний производится на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Физические свойства
Кристаллическая структура кремния.Кристаллическая решетка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), но из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твердость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Интересно, что кремний прозрачен к инфракрасному излучению, начиная с длины волны 1.1 микрометр.
Схематическое изображение зонной структуры кремния [2]Электрофизические свойства
Элементарный кремний — типичный непрямозонный полупроводник. Ширина запрещенной зоны при комнатной температуре 1,12 эВ, а при Т = 0 К составляет 1,21 эВ. -4)*T
-4)*T
Химические свойства
В соединениях кремний склонен проявлять степень окисления +4 или −4, так как для атома кремния более характерно состояние sp³-гибридизации орбиталей. Поэтому во всех соединениях, кроме оксида кремния (II) SiO, кремний четырёхвалентен.
Химически кремний малоактивен. При комнатной температуре реагирует только с газообразным фтором, при этом образуется летучий тетрафторид кремния SiF4. При нагревании до температуры 400—500 °C кремний реагирует с кислородом с образованием диоксида SiO2, с хлором, бромом и иодом — с образованием соответствующих легко летучих тетрагалогенидов SiHal4.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой SinH2n+2 — получают косвенным путем. Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Моносилан SiH4 (его часто называют просто силаном) выделяется при взаимодействии силицидов металлов с растворами кислот, например:
Ca2Si + 4HCl → 2CaCl2 + SiH4↑.
Образующийся в этой реакции силан SiH4 содержит примесь и других силанов, в частности, дисилана Si2H6 и трисилана Si3H8, в которых имеется цепочка из атомов кремния, связанных между собой одинарными связями (—Si—Si—Si—).
С азотом кремний при температуре около 1000 °C образует нитрид Si3N4, с бором — термически и химически стойкие бориды SiB3, SiB6 и SiB12. Соединение кремния и его ближайшего аналога по таблице Менделеева — углерода — карбид кремния SiC (карборунд) характеризуется высокой твердостью и низкой химической активностью. Карборунд широко используется как абразивный материал.
При нагревании кремния с металлами возникают силициды. Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
Силициды можно подразделить на две группы: ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния типа Ca2Si, Mg2Si и др.) и металлоподобные (силициды переходных металлов). Силициды активных металлов разлагаются под действием кислот, силициды переходных металлов химически стойки и под действием кислот не разлагаются. Металлоподобные силициды имеют высокие температуры плавления (до 2000 °C). Наиболее часто образуются металлоподобные силициды составов MeSi, Me3Si2, Me2Si3, Me5Si3 и MeSi2. Металлоподобные силициды химически инертны, устойчивы к действию кислорода даже при высоких температурах.
При восстановлении SiO2 кремнием при высоких температурах образуется оксид кремния (II) SiO.
Для кремния характерно образование кремнийорганических соединений, в которых атомы кремния соединены в длинные цепочки за счет мостиковых атомов кислорода —О—, а к каждому атому кремния, кроме двух атомов О, присоединены еще два органических радикала R1 и R2 = CH3, C2H5, C6H5, CH2CH2CF3 и др.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 компанией STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для зеркал газовых лазеров.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например, электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
(как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, преимущественно применяемый для склеивания бумаги.
Последнее время очень широко применяются полимеры на основе кремния — силиконы.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10−2% кремния, костная ткань — 17·10−4%, кровь — 3,9 мг/л.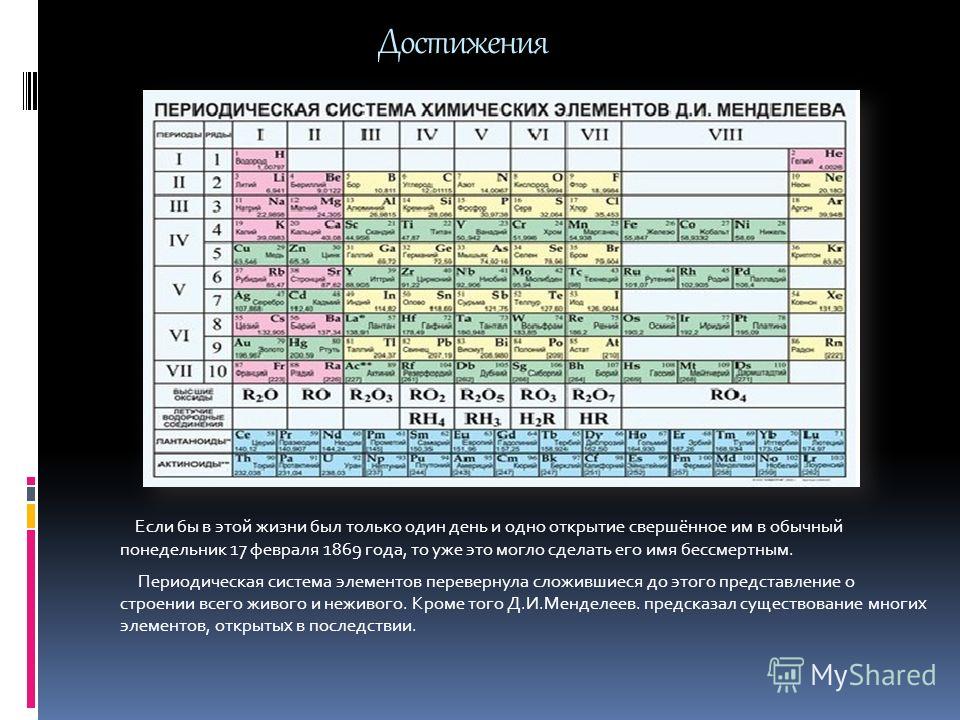 С пищей в организм человека ежедневно поступает до 1 г кремния.
С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
Дополнительная информация
Соединения кремния
Пористый кремний
Кристаллический кремний
Германий
Кремнийорганические соединения
Определения основных единиц системы СИ
СЕКУНДА
Секунда, символ с (s), определяется путем установления фиксированного числового значения частоты сверхтонкого перехода основного состояния атома цезия-133 Dn Cs равным точно 9 192 631 770 Гц (или с –1 ),
Выражение для единицы секунды в терминах определяющей константы Dn Cs :
Из этого определения следует, что секунда равна продолжительности 9 192 631 770 периодов излучения, соответствующего переходу между двумя сверхтонкими уровнями невозмущенного основного состояния атома 133 Cs.
МЕТР
Метр, символ м (m), определяется путем установления фиксированного числового значения скорости света в вакууме c равным 299 792 458 мс – 1 , где секунда определяется в терминах частоты перехода атома цезия Dn Cs .
Выражение для единицы метра в терминах определяющих констант c и Dn Cs :
Из этого определения следует, что один метр – это длина пути, пройденного светом в вакууме в течение интервала времени с длительностью 1/299 792 458 секунды
КИЛОГРАММ
Килограмм, символ кг (kg), определяется путем установления фиксированного числового значения постоянной Планка h равным 6,626 070 15 x 10 –34 в размерности Дж с ( J s) , или кг м 2 с –1 , где метр и секунда определяются через константы C и DnCs .
Точное выражение для килограмма в терминах трех определяющих констант h , DnCs и c :
АМПЕР
Ампер, символ А, является единицей СИ электрического тока. Он определяется путем установления фиксированного числового значения элементарного заряда e равным 1,602 176 634 x 10 -19, в размерности А с (A s), где секунда с определена через DnCs .
Он определяется путем установления фиксированного числового значения элементарного заряда e равным 1,602 176 634 x 10 -19, в размерности А с (A s), где секунда с определена через DnCs .
Точное выражение для ампера в терминах определяющих констант e и DnCs :
Как следует из определения, один ампер является электрическим током, соответствующим потоку 1 / (1.602 176 634 x 10 –19 ) элементарных зарядов в секунду.
КЕЛЬВИН
Кельвин, символ К, является единицей термодинамической температуры. Он определяется путем установления фиксированного числового значения постоянной Больцмана k равным 1,380 649 x 10 –23 в единицах Дж К-1 (J K -1 ), что соответствует кг м 2 с –2 К -1 , где килограмм, метр и секунда определены через константы h , c и DnCs
Точное выражение для кельвина в терминах определяющих констант k , h и DnCs :
Из этого определения следует, что один кельвин равен изменению термодинамической температуры, приводящему к изменению тепловой энергии k T на 1,380 649 x 10 –23 Дж.
МОЛЬ
Моль, символ моль, является единицей количества вещества. Один моль содержит ровно 6,022 140 76 x 10 23 структурных элементов. Это число является фиксированным числовым значением постоянной Авогадро, N A , в размерности моль -1, и называется числом Авогадро.
Количество вещества, символ n , системы является мерой количества указанных структурных элементов. Элементом может быть атом, молекула, ион, электрон, любая другая частица или указанная группа частиц.
Точное выражение для моли в терминах определяющей константы N A :
Из этого определения следует вывод, что моль представляет собой количество вещества системы, которое содержит 6,022 140 76 x 10 23 определенных структурных единиц.
КАНДЕЛА
Кандела, символ cd, представляет собой единицу СИ силы света в заданном направлении. Он определяется посредством установления фиксированнового числового значения световой эффективности монохроматического излучения с частотой 540 x 10 12 Гц, K cd , равным 683 в единицах лм Вт -1 , что равно кд ср Вт -1 , или кд ср кг -1 м -2 с 3 , где килограмм, метр и секунда определяются в единицах h , c и DnCs .
Точное выражение для канделы в терминах определяющих констант K cd , h и DnCs
Из определения следует, что одна кандела это сила света в заданном направлении источника, который испускает монохроматическое излучение с частотой 540 x 10 12 Гц и имеет интенсивность излучения в этом направлении (1/683) Вт / ср.
Задание №2 ЕГЭ по химии
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется.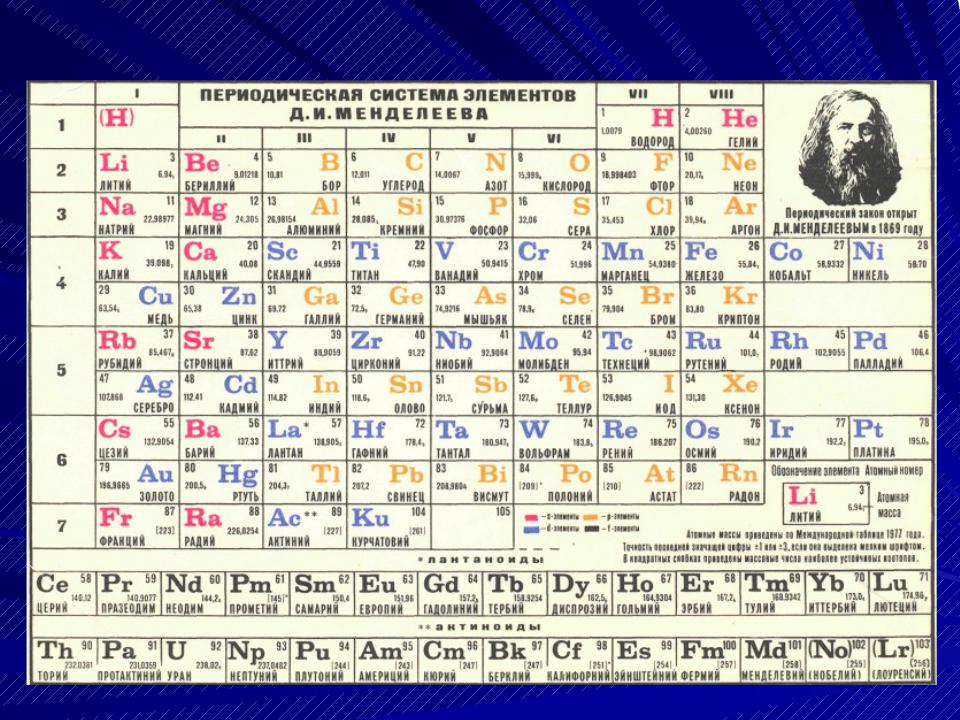 Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.
Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Кремний, подготовка к ЕГЭ по химии
Кремний – неметаллический элемент IVa группы периодической таблицы Д. И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
И. Менделеева. Второй после кислорода элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема – SiO2 – песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 – кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ – цитрин
- SiO2 с примесью Fe2+ и Fe3+ – аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II – несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV – SiO
2Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O
Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты – силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название – силикаты.
Ее соли носят название – силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли – силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
EniG. Периодическая таблица элементов
УГЛЕРОДНАЯ ГРУППА
| Атомный номер: | 14 | ||||||||
| Номера групп: | 14 | ||||||||
| Период: | 3 | ||||||||
| Электронная конфигурация: | [Ne] 3s 2 3p | Формальная степень окисления: | -4 +2 +4 | Электроотрицательность: | 1.9 | Атомный радиус / pm: | 117.6 | Относительная атомная масса: | [28.084, 28.086] | |
Кремний был открыт Йенсом Якобом Берцелиусом (Швеция) в 1824 году. Название происходит от латинского слова silicis , означающего кремень . Аморфная форма кремния – коричневый порошок; кристаллическая форма имеет серый металлический вид. Твердая форма не реагирует с кислородом, водой и большинством кислот. Растворяется в горячей щелочи. Кремнеземная пыль – умеренно токсичный острый раздражитель.Кремний составляет большую часть глины, гранита, кварца (SiO2) и песка. Промышленное производство зависит от реакции между песком (SiO2) и углеродом при температуре около 2200 ° C. Он используется в стекле в виде диоксида кремния (SiO2). Карбид кремния (SiC) – одно из самых твердых веществ, известных и используемых при полировке. Кремний является наиболее широко используемым полупроводником для электроники. Цена гранулированного кремния с чистотой 99,999% составляет 67,40 евро за 1000 г.
Название происходит от латинского слова silicis , означающего кремень . Аморфная форма кремния – коричневый порошок; кристаллическая форма имеет серый металлический вид. Твердая форма не реагирует с кислородом, водой и большинством кислот. Растворяется в горячей щелочи. Кремнеземная пыль – умеренно токсичный острый раздражитель.Кремний составляет большую часть глины, гранита, кварца (SiO2) и песка. Промышленное производство зависит от реакции между песком (SiO2) и углеродом при температуре около 2200 ° C. Он используется в стекле в виде диоксида кремния (SiO2). Карбид кремния (SiC) – одно из самых твердых веществ, известных и используемых при полировке. Кремний является наиболее широко используемым полупроводником для электроники. Цена гранулированного кремния с чистотой 99,999% составляет 67,40 евро за 1000 г.
| Плотность / г дм -3 : | 2329 | (293 K) |
| 2525 | (м. p.) p.) | |
| Молярный объем / см 3 моль -1 : | 12,06 | (293 K) |
| 11,12 | (mp) | |
| µΩ · см | 10 | (20 ° C) |
| Теплопроводность / Вт · м -1 K -1 : | 148 |
| Точка плавления / ° C: | 1414 |
| Точка кипения / ° C: | 3265 |
| Теплота плавления / кДж моль -1 : | 39.6 |
| Теплота испарения / кДж моль -1 : | 383,3 |
| Теплота распыления / кДж моль -1 : | 451,29 |
| Энергия первой ионизации / кДж моль -1 : | 786,52 |
| Энергия второй ионизации / кДж моль -1 : | 1577,15 |
| Энергия третьей ионизации / кДж моль -1 : | 3231.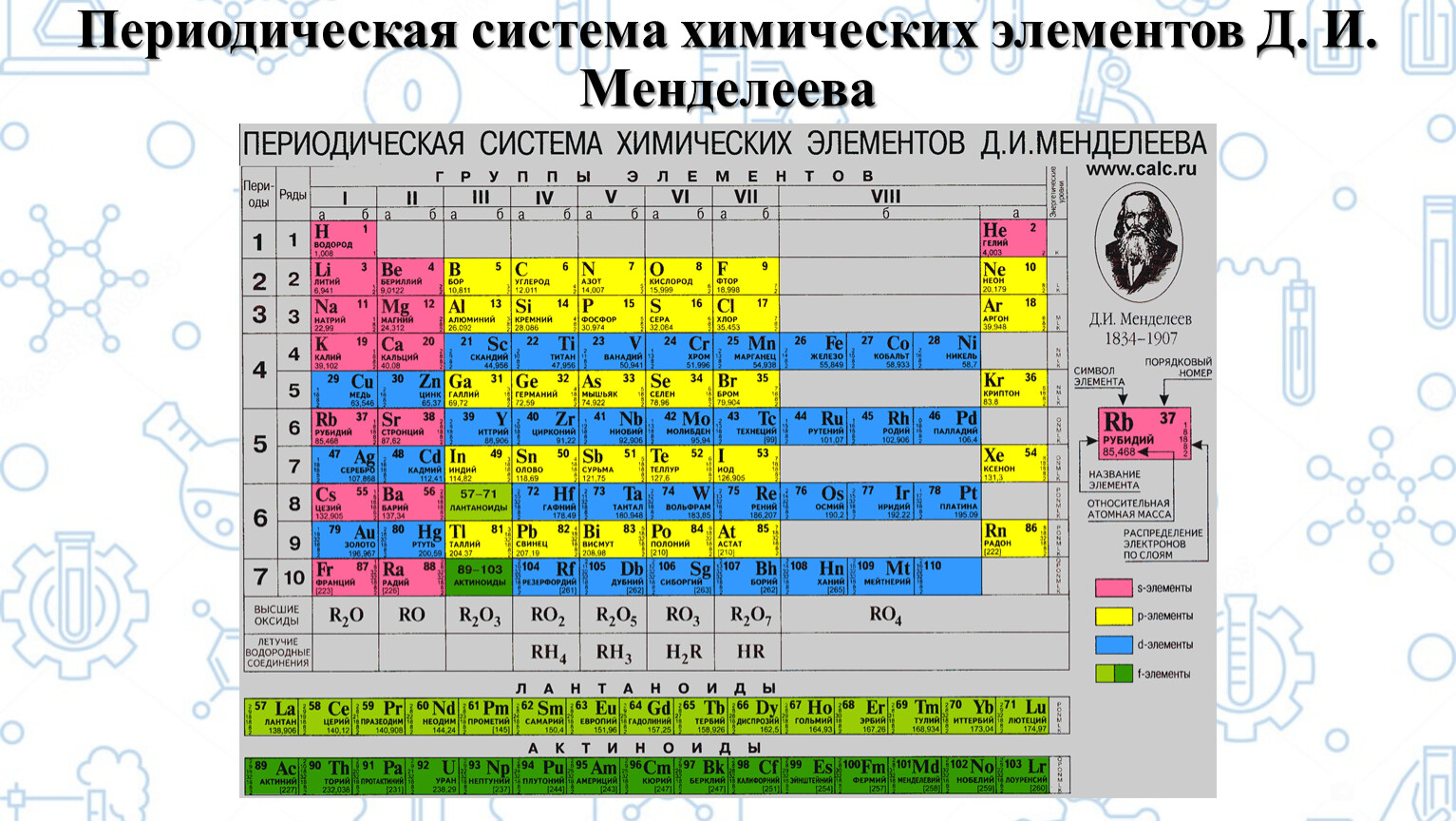 61 61 |
| в атмосфере / ppm: | – |
| в земной коре / ppm: | 267700 |
| в океанах / ppm: | 3 |
| Кристаллическая структура: | гранецентрированная кубическая |
| Размеры элементарной ячейки / пм: | a = 543,07 |
| Пространственная группа: | Fd3m |
| Изотоп | Относительная атомная масса | Массовый процент (%) | |
|---|---|---|---|
| 28 Si | 27.976926533 (2) | 92,23 (1) | |
| 29 Si | 28,97649472 (3) | 4,67 (1) | |
| 30 Si | 29.973770822 |
| Сбалансированная полуреакция | E o / V | |
|---|---|---|
| SiO 2 (s) + 4H + + 4e – → Si (s) + 2H 2 O | – 0. 86 86 | |
| SiO 3 2- + 6H + + 4e – → Si (s) + 3H 2 O | – 0,455 | |
| – + 5H + + 4e – → Si (s) + 3H 2 O | – 0,632 | |
| H 2 SiO 3 + 4H + + 4e – → Si (s) + 3H 2 O | – 0,780 | |
| SiO 2 (s) + 8H + + 8e – → SiH 4 (g) + 2H 2 О | – 0.377 | |
| SiO 3 2- + 10H + + 8e – → SiH 4 (г) + 3H 2 O | – 0,176 | |
| – 0,265 | ||
| H 2 SiO 3 + + + 8e – → SiH 4 (г) + 3H 2 O | – 0. 339 339 | |
| Si (s) + 4H + + 4e – → SiH 4 (g) | +0,102 | |
| SiF 6 2- + 4 – → Si (с) + 6F – | – 1,2 |
– Периодическая таблица видео | GrrlScientist | Наука
Крупным планом фотография очищенного кремния.
Изображение: Enricoros / Википедия (общественное достояние).
Кремний, имеющий символ Si и атомный номер 14 , является вторым по распространенности элементом после кислорода в земной коре. Многие метеориты в основном состоят из кремния, и кремний также содержится в тектитах, которые, вероятно, образовались в результате удара больших метеоритов о поверхность земли. Кремний также является основным компонентом обсидиановой породы, прекрасного камня, созданного вулканами. Поскольку древние народы использовали обсидиан в качестве режущего инструмента, для изготовления оружия и в церемониальных целях, его иногда находят при раскопках. В детстве я собрал небольшой черный обсидиановый наконечник стрелы в Кеттл-Фоллс, Вашингтон, артефакт, оставленный народами салиш.
В детстве я собрал небольшой черный обсидиановый наконечник стрелы в Кеттл-Фоллс, Вашингтон, артефакт, оставленный народами салиш.
Кремний является «старшей сестрой» углерода и обладает многими схожими химическими свойствами. По этой причине кремний известен как химический аналог углерода. Но в отличие от углерода, кремний – это металлоид – на самом деле, это самый распространенный металлоид на Земле. «Металлоид» – это термин, применяемый к элементам, которые являются лучшими проводниками электронного потока – электричества – чем неметаллы, но не так хороши, как металлы.Эта интересная характеристика означает, что он действует как полупроводник: атомы кремния могут либо усиливать, либо блокировать движение электронов. Эта необычная характеристика характерна для другого элемента, который мы уже встречали, – бора. Кремниевые полупроводники можно найти практически во всем, от компьютеров, цифровых фотоаппаратов и сотовых телефонов до холодильников.
Фильм Брэди Харана.
Посетите канал периодических видео на YouTube.
Я еще не писал о периодической таблице элементов, но нашел это замечательное видео, которое знакомит вас со структурой атомов, концепцией валентных электронов и химических связей, а также с тем, как эти основные принципы используются для обеспечения функционирования кремния на солнечной энергии. ячеек:
Посетите канал UCtelevision на YouTube.
Вы уже встречали эти элементы:
Алюминий: Al , атомный номер 13
Магний: Mg , атомный номер 12
Натрий: Na , атомный номер 11
Неон: Ne , атомный номер 9479 10 : F , атомный номер 9
Кислород: O , атомный номер 8
Азот: N , атомный номер 7
Углерод: C , атомный номер 6
Бор: B , атомный номер 5
Бериллий: Be , атомный номер 4
Литий: Li , атомный номер 3
Гелий: He , атомный номер 2
Водород , атомный номер 1
Как и было обещано, вот замечательная интерактивная Периодическая таблица элементов, с которой действительно интересно играть!
.
электронная почта: [email protected]
твиттер: @GrrlScientist
Кремний Si (Элемент 14) Периодической таблицы
14 Si (кремниевый элемент)
Карточка кремния
Кристаллический кремний очень хрупкий, имеет металлический блеск и сероватый цвет.
Это самый распространенный электроположительный элемент (теряют электроны для образования положительных ионов) в земной коре.
Кремний обычно четырехвалентный (образует четыре связи с другими атомами) в своих соединениях, хотя иногда его двухвалентный (два или более атома, связанных вместе как единая молекула), и он является чисто электроположительным по своему химическому поведению.
Hyperpure Silicon – это естественный полупроводник .
Кремний является относительно инертным элементом (атомы не соединяются с другими атомами), но он подвергается воздействию галогенов и разбавленной щелочи.
Не действует кислотами, за исключением плавиковой (HF).
Элемент пропускает более 95% всех длин волн инфракрасного излучения, от 1,3 до 6 мкм.
Он образует различные серии из гидридов (анион водорода, H –), различных галогенидов (многие из которых содержат кремний-кремниевые связи) и многие серии соединений, которые содержат кислорода, , которые могут иметь ионную или ионную структуру. ковалентные свойства.
Кремниевый элемент
Идентификационный номер
Номер CAS: CAS7440-21-3
Номер CID: CID5461123
Класс опасности DOT: 4.1
Номер DOT: 1346
Номер RTECS: RTECSVW0400000
Произношение: Sil-a-kam
Внешний вид: Кристаллический, отражающий с голубоватыми гранями
Массовое число: 28
Стандартный атомный вес: 28,084, 28,086 г / моль
Атомный номер (Z): 14
Электронов: 14
Протонов: 14
Нейтронов: 14
Период: 3
Группа: 14
Блок: p
Категория элемента: Металлоид (полуметалл)
Электронов на оболочку: K2, L8, M4
Конфигурация электронов: 1s 2 2s 2 2p 6 3с 2 3п 2
Кремниевая электронная конфигурация
Тепловые свойства кремния Фаза: твердая
Точка плавления: 1687 K (1414 o C, 2577 o F)
Точка кипения: 3538 K (3265 o C, 5909 o F)
Температура Дебая: 645 K (701 . 33 o C, 371,85 o F)
33 o C, 371,85 o F)
Теплота плавления: 50,21 кДж / моль
Теплота испарения: 383 кДж / моль
Удельная теплоемкость: 710 Дж / (кг K)
Молярная теплоемкость: 19,789 Дж / (моль. K)
Тепловое расширение: 2,6 мкм / (м ∙ K)
Теплопроводность: 149 Вт / (м ∙ K)
Электропроводность: 1000 См / м
A Удельное электрическое сопротивление: 2,3 × 10 3 Ом ∙ м
A Электрический тип: проводник
Ширина запрещенной зоны: 1,12 эВ
A Тип магнитного поля: диамагнитный
Магнитная восприимчивость (x моль ): -3.9 × 10 -6 см 3 / моль
Объемная магнитная восприимчивость: -0,00000373
Массовая магнитная восприимчивость: -1,6 × 10 -9 м 3 / кг
Молярная магнитная восприимчивость: -0045 × 10 – 9 м 3 / моль
Плотность: 2,33 г / см 3 (в твердом ) 2,57 г / см 3 (в жидком при MP)
Молярный объем: 0,000012054 м 3 / моль
Модуль Юнга: 130-185 ГПа
Модуль сдвига: 50-80 ГПа
Твердость по шкале Мооса: 6. 5
5
Объемный модуль: 97,6 ГПа
Коэффициент Пуассона: 0,064-0,28
Твердость по Виккеру: 9630 МПа
Скорость звука: 8433 м / с
Степени окисления: +4, +3, +2, + 1, -1, -2, -3, -4
Валентные электроны: 3s 2 3p 2
Ионизационный потенциал атома: 8.12
Энергия ионизации: 1-я: 786,4 кДж моль 2-я: 1577 кДж / моль 3-я: 3231,5 кДж / моль
Ионный радиус: 40 пм
Атомный радиус: 111 пм (эмпирический)
Ван-дер-Ваальс: 210 Pm
Ковалентный радиус: 111 пм
Орбиталь заполнения: 3p 2
Кристаллическая структура: гранецентрированный кубический алмаз
Углы решетки: π / 2, π / 2, 2π / 3
Постоянная решетки: 543.07, 543.07, 543.07 pm
Параметры сетки: a = 5,4307 Å
Имя пространственной группы: Fd_3m
Номер пространственной группы: 227
Гранеццентрированный алмазный кубик (FCDC)
Реакционная способность кремния Электроотрицательность: 1,9 (полосковая шкала)
Валентность: +4
Сродство к электрону: 133,6 кДж / моль
Half Life: Stable (Infinity)
Lifetime: Stable (Infinity)
Квантовое число: 3 P 0
Нейтронное сечение (Brans): 0. 166
166
Массовое поглощение нейтронов: 0,0002
Изотопы: 28 Si 29 Si 30 Si 31 Si 32 Si
| Изотоп | Численность (%) | Атомная масса г / моль | Период полураспада (т 1/2 ) |
| 28 Si | 92,2 | 27,972 | Конюшня |
| 29 Si | 4.7 | 28,975 | Конюшня |
| 30 Si | 3,1 | 29.977 | Конюшня |
| 31 Si | След | – | 2,62 ч |
| 32 Si | След | – | 153 л |
Кремний не реагирует с Воздух при нормальных условиях:
Если кремний нагревается на выше 900 o C , он реагирует с кислородом и образует диоксид кремния:
Si (s) + O 2 ( г) → SiO 2 (т. 2 SiN (т)
2 SiN (т)
3 Si (т) + 2 N 2 (г) → Si 3 N 4 (т)
Металл Не вступает в реакцию с водой :
Металл реагирует со всеми галогенами с образованием галогенидов кремния (Vl):
Si (т) + 2 F 2 (г) → SiF 4 (т) (фторид кремния (Vl))
Si (т) ) + 2 Cl 2 (г) → SiCl 4 (т) (хлорид кремния (Vl))
Si (т) + 2 Br 2 (г) → SiBr 4 (т) (кремний ( Vl) бромид)
Si (т) + 2 I 2 (г) → SiI 4 (т) (иодид кремния (Vl))
Элемент не вступает в реакцию с большинством кислот, , но растворяется в плавиковой кислоте (HF).
Si (т. Е.) + 6 HF (водн.) ⇌ [SiF 6 ] 2- (водн.) + 2H + (водн.) + 2 H 2 (г)
Производство
Карбид кремния получают восстановлением Кварцевый песок с избытком кокса или антрацита при 2000 o C-2500 o C:
SiO 2 + 2 C → Si + 2 CO
Si + C → SiC
С избытком SiO 2 , используемым для предотвращения накопления карбида кремния:
2 SiC + SiO 2 → 3 Si + 2 CO
Для другой реакции, Иногда используется алюминотермический восстановление диоксида кремния (SiO 2 )
3 SiO 2 + 4 Al → 3 Si + 2 Al 2 0 3
Очистить MG-Si в EG-Si путем преобразования жидкого летучего кремния, такого как дихлорсилан (SiH 2 Cl 2 ), моносилан (SiH 4 ), и трихлорсилан 3 ). Конверсия
Конверсия
осуществляется путем взаимодействия с безводным хлористым водородом (HCl) при 300 o C в реакторе с псевдоожиженным слоем :
MGS + 3 HCl → SiHCl 3 + H 2
Теперь кипит при комнатной температуре, где примесей могут быть легко удалены с помощью дистилляции для получения жидкости трихлорсилана чрезвычайно высокой чистоты (TCS), которая превращается в твердый поликремний с помощью процесса Сименс, , что дает EG-Si с чистотой из 99.999999998%
Обозначение: От латинского «silicis» или «silx» (что означает кремень)
Открытие и первая изоляция: Йенс Якоб Берцелиус (1823)
Имя: Томас Томсон (1817)
Кремний – один из самых полезных элементов для человечества.
В основном он используется для изготовления сплавов , включая ферросиликон (железо-кремний) и алюминий-кремний (AlSi) , чтобы обеспечить большее сопротивление.
Эти сплавы используются для изготовления блоков цилиндров , динамо- и пластин трансформатора , головок цилиндров и станков, а также для раскисления стали.
Кремний также используется для изготовления силиконов (полисилоксанов). Это кремний-кислородный синтетический полимер с присоединенной метильной группой (содержит 1 атом углерода и 3 атома водорода, как CH 3 ).
Его можно получить путем гидролиза (разложения в результате химической реакции с водой) органического хлорида кремния, такого как хлорид диметилкремния (C 2 H 6 Cl 2 Si).
Силиконы довольно устойчивы к экстремальным температурам, воде, окислению и обладают полезными свойствами: диэлектрик , (электроизолятор), , антипригарное покрытие, , и , пеногаситель, .
Силиконовое масло является смазкой и добавляется в кондиционеры для волос и некоторые косметические средства .
Силиконовый каучук используется в качестве водонепроницаемого герметика в ванных комнатах, вокруг окон, крыш и труб.
Силиконовая резина для герметика против проникновения воды и воздуха.
A Силикон – один из двух лучших материалов для изготовления новорожденных младенцев или искусственных игрушек для людей , а другой материал – винил (-CH = CH 2 ).
Силиконовая кукла (Искусственные человеческие игрушки)
Силикагель – это вещество, которое поглощает влагу из воздуха, что делает эти пакеты идеальными для хранения вещей (таких как новая сумочка, обувь, лекарства от головной боли и т. Д.) В очень сухих и сухих .
Пакет с силикагелем
Силиконовая смазка – водостойкая смазка, которая используется для смазки и консервации резиновых деталей, а также используется в сантехнической промышленности для изготовления смесителей и уплотнений.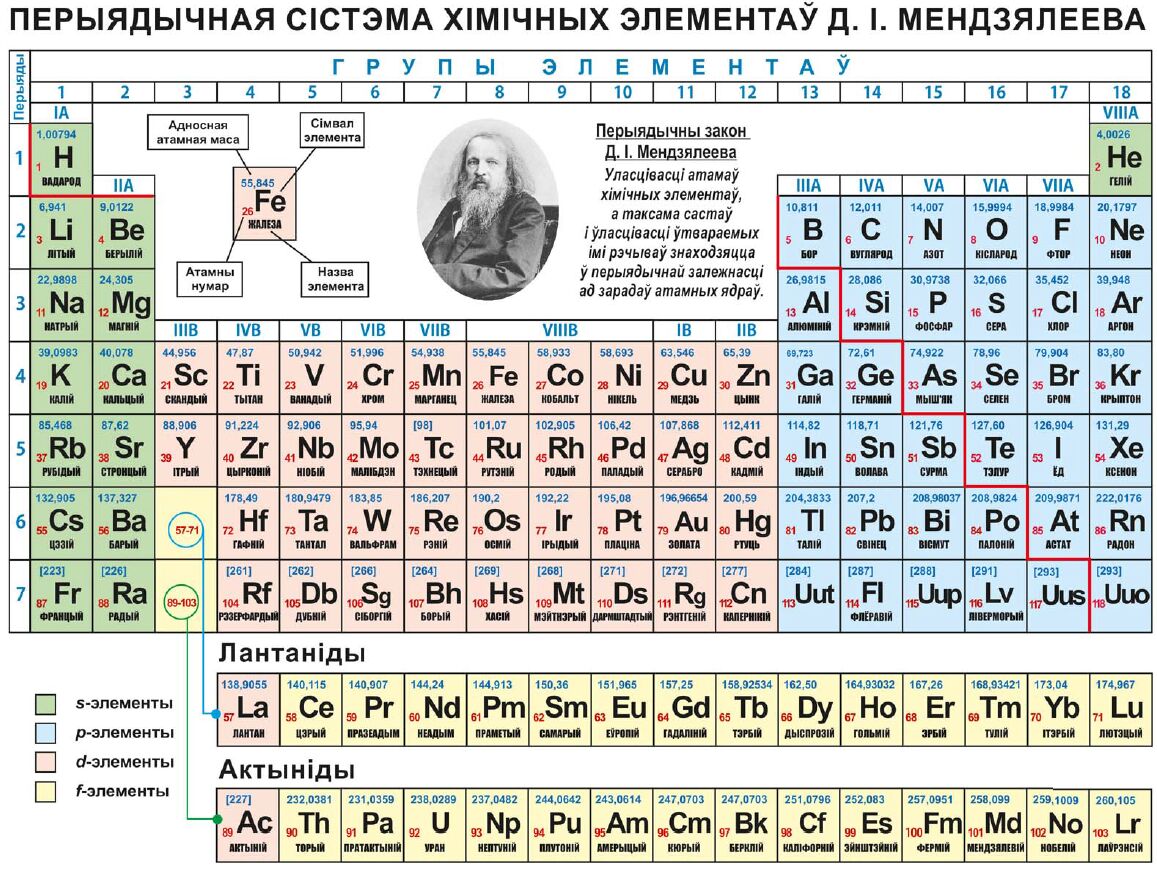
Его получают путем объединения силиконового масла (полидиметилсилоксан, (C 2 H 6 OS) n ) с загустителем (аморфный коллоидный диоксид кремния).
Другое применение силикона – силиконовые кольца, силиконовые маски, силиконовый чехол, силиконовый лист, силиконовые прокладки, и т. Д..
Реалистичные силиконовые маски
Силиконовый чехол
Силиконовые кольца мужские и женские
Кремний электронного класса (EG-Si, очень высокая степень очистки) широко используется в качестве полупроводника в твердотельных устройствах (устройство, в котором электричество проходит через твердый полупроводник. электричество), транзисторы, выпрямители и т. д.) в компьютерах, космической эре и микроэлектронике отраслях.
Кремний может быть легирован небольшими количествами галлия, бора, мышьяка или фосфора для управления его электрическими свойствами .
Модернизированный кремний металлургического сорта (UMG-Si, немного чище MG-Si) может использоваться в более дешевых электронных устройствах.
Кремний металлургического сорта (MG-Si, чистота 98% или выше) используется в качестве сырья при производстве кремнийорганических и кремниевых смол, масел и уплотнений.
Гранит и большинство других горных пород – это сложные силикаты , которые являются полезным огнеупорным материалом для высокотемпературных работ, и они используются для проектов гражданского строительства .
Песок (диоксид кремния или кремнезем, SiO 2 ) и Глина (силикат алюминия, Al 2 SiO 5 ) используются для изготовления бетона, кирпича и цемента.
Песок (кремнезем, SiO 2 ) также является основным ингредиентом стекла , которое имеет тысячи применений, таких как оконное стекло, контейнеры, изоляторы , пилочный камень , шлифование, пескоструйная обработка , паста для дерева, в лабораториях , на химических заводах и т. Д..
Д..
Тетрахлорид кремния (SiCl 4 ) может использоваться в качестве иридизирующего стекла (стекло покрыто тонким металлическим покрытием).
Кремнезем – один из недорогих (недорогих) материалов с превосходными тепловыми, механическими, электрическими и оптическими свойствами.
Благодаря своим хорошим огнеупорным свойствам кремний (в виде силиката) также используется в производстве керамики , эмали и высокотемпературной керамики.
Карбиды кремния ( SiC) являются важными абразивами , который является одним из самых твердых материалов и используется в лазерах для получения когерентного света 4560 Å.
Кремний необходим растениям (рис и т. Д.) Для их роста , и использование клеток животных сомнительно, но есть некоторые доказательства того, что кремний важен для здоровья человека Кости, волосы, ногти , & Ткань для кожи es.
Фитолиты (растительный камень) – это крошечные частицы кремнезема, которые образуются внутри некоторых растений.
Поскольку эти частицы не распадаются / не гниют, они остаются в окаменелостях и предоставляют нам полезные эволюционные свидетельства .
Кремний нетоксичен , но некоторые силикатные минералы, такие как асбест, являются канцерогенными (способствует образованию рака).
Рабочие, такие как каменотесов и горняков, вдыхали кремнеземистой пыли в больших количествах, что может привести к серьезной болезни легких , называемой силикозом .
Изобилие кремния Кремний – 2-й по распространенности элемент (первый – кислород) в земной коре (27.7% по весу), и 7-е место среди самых распространенных во Вселенной.
В природе не встречается свободный , но встречается в основном как Silica (диоксид кремния, SiO 2 ) и как силикаты (SiO 4 2- ).
Это также компонент Tektites (редкое черное природное стекло, образовавшееся при ударе астероида о Землю).
Тектиты
Природный кремний содержит 92,2% изотопа S 28 ,4.7% от S 29 и 3,1% от S 30 .
Песчаник, Горный хрусталь, Кварц, Дымчатый кварц, Аметист, Оникс, Кремень, Опал, Яшма, Гелиотроп, Тридимит, Цитрин, Агат, Хризопраз, Тридимит, Кристобалит, Коэсителерит , и некоторые из форм – Лезшатель. в котором присутствует оксид
Некоторые из многочисленных силикатных минералов – это гранит, асбест, роговая обманка, полевой шпат, глина, слюда и т. д.
Элементный кремний – это , выпускаемый серийно путем нагрева диоксида кремния и углерода в электрической печи с использованием угольных электродов.
Аморфный кремний (a-Si, некристаллическая форма кремния) может быть приготовлен в виде коричневого порошка, который можно легко расплавить или испарить.
Процесс Чохральского – это метод выращивания кристаллов, который обычно используется для производства монокристаллов кремния, используемых для твердотельных или полупроводниковых устройств .
Кремний высокой степени чистоты для электронной промышленности получают термическим разложением сверхчистого тетрахлорсилана или трихлорсилана (HSiCl 3 ) в атмосфере водорода и с помощью процесса вакуумной флотационной зоны.
Процесс Чохральского
Ежегодное мировое производство составляет около 6 400 000 тонн.
0,07% (в Вселенной )
14% (в метеоритах )
0,09% (в Солнце )
27% (в земной коре )
0,0001% (в океанах )
0,026% (В человек )
1) Китай (80%, 4,5 миллиона тонн)
2) Россия (610 000 тонн)
3) Норвегия (330 000 тонн)
4) Бразилия (240 000 тонн)
5) United Штаты (170 000 тонн)
Цена на кремний
Чистый (99. 995%) Цена металла составляет около 170-190 долларов США долларов США за кг (килограмм)
995%) Цена металла составляет около 170-190 долларов США долларов США за кг (килограмм)
# кремний # силиконовый
Другие элементы FlashCards
Кремний (Si) – химические свойства, воздействие на здоровье и окружающую среду
Кремний
Кремний – самый распространенный электроположительный элемент в земной коре. Это металлоид с заметным металлическим блеском и очень хрупкий. Обычно он четырехвалентен по своим соединениям, хотя иногда бывает двухвалентным, и по своему химическому поведению он является чисто электроположительным.Кроме того, также известны пентакоординированные и гексакоординированные соединения кремния.
Природный кремний содержит 92,2% изотопа 28, 4,7% кремния 29 и 3,1% кремния 30. Помимо этих стабильных природных изотопов, известны различные радиационные искусственные изотопы. Элементарный кремний обладает физическими свойствами металлоидов, аналогичными тем, что и германий, находящийся под ним в группе IV периодической таблицы. Кремний является внутренним полупроводником в чистом виде, хотя интенсивность его полупроводимости значительно увеличивается за счет введения небольших количеств примесей.Кремний похож на металлы по своим химическим свойствам.
Кремний является внутренним полупроводником в чистом виде, хотя интенсивность его полупроводимости значительно увеличивается за счет введения небольших количеств примесей.Кремний похож на металлы по своим химическим свойствам.
Он почти такой же электроположительный, как олово, и гораздо более положительный, чем германий или свинец. В соответствии с этим металлическим характером он образует тетраположительные ионы и различные ковалентные соединения; он появляется как отрицательный ион только в некоторых силицидах и как положительный компонент оксикислот или комплексных анионов.
Он образует различные серии гидридов, различные галогениды (многие из которых содержат кремний-кремниевые связи) и многие серии соединений, содержащих кислород, которые могут иметь ионные или ковалентные свойства.
Приложения
Кремний является основным компонентом стекла, цемента, керамики, большинства полупроводниковых приборов и силиконов, причем последний – пластичное вещество, которое часто путают с кремнием. Кремний также является важным компонентом некоторых сталей и основным ингредиентом кирпича. Это тугоплавкий материал, используемый для изготовления эмалей и гончарных изделий.
Кремний также является важным компонентом некоторых сталей и основным ингредиентом кирпича. Это тугоплавкий материал, используемый для изготовления эмалей и гончарных изделий.
Элементарный неочищенный кремний и его интерметаллические соединения используются в качестве интегралов сплава для обеспечения большей устойчивости к алюминию, магнию, меди и другим металлам.Металлургический кремний чистотой 98-99% используется в качестве сырья при производстве кремнийорганических и кремниевых смол, уплотнений и масел. Кремниевые чипы используются в интегральных схемах. В фотоэлементах для прямого преобразования солнечной энергии используются тонкие срезы простых кристаллов кремния электронного качества. Диоксид кремния используется в качестве сырья для производства элементарного кремния и карбида кремния. Для изготовления пьезоэлектрических стекол используются большие кристаллы кремния. Плавленые кварцевые пески превращаются в кремниевые стекла, которые используются в лабораториях и на химических предприятиях, а также в электроизоляторах. Коллоидная дисперсия кремния в воде используется в качестве покрывающего агента и в качестве ингредиента для некоторых эмалей.
Коллоидная дисперсия кремния в воде используется в качестве покрывающего агента и в качестве ингредиента для некоторых эмалей.
Известно, что кремний образует соединения с 64 из 96 стабильных элементов и, возможно, образует силициды с другими 18 элементами. Помимо силицидов металлов, которые в больших количествах используются в металлургии, он образует важные обычно используемые соединения с водородом, углеродом, галогенами, азотом, кислородом и серой. Кроме того, много полезных кремнийорганических побочных продуктов.
Кремний в окружающей среде
Кремний содержится во многих формах диоксида и в бесчисленных вариациях по сравнению с природными силикатами.
Кремния гораздо больше, чем любого другого элемента, кроме кислорода. Он составляет 27,72% твердой земной коры, при этом кислород составляет 46,6%, а следующий элемент после кремния, алюминий, содержится в 8,13%.
В качестве источника кремния, производимого в промышленных масштабах, используется песок. Добывают несколько силикатных минералов, например тальк и слюда. Другие добываемые силикаты – это полевой шпат, нефенил, оливин, вермикулит, перлит, каолинит и т. Д. С другой стороны, существуют формы кремнезема, настолько редкие, что они желательны только по этой причине: опал из драгоценных камней, агат и горный хрусталь.
Добывают несколько силикатных минералов, например тальк и слюда. Другие добываемые силикаты – это полевой шпат, нефенил, оливин, вермикулит, перлит, каолинит и т. Д. С другой стороны, существуют формы кремнезема, настолько редкие, что они желательны только по этой причине: опал из драгоценных камней, агат и горный хрусталь.
Кремний не концентрируется ни в одном конкретном органе тела, но находится в основном в соединительных тканях и коже. Кремний нетоксичен как элемент и во всех его природных формах, например, кремнезем и силикаты, которые являются наиболее распространенными.
Элементарный кремний – инертный материал, который, по-видимому, не обладает свойством вызывать фиброз в легочной ткани. Однако сообщалось о незначительных поражениях легких у лабораторных животных в результате интратрахеальных инъекций кремниевой пыли. Кремниевая пыль оказывает незначительное неблагоприятное воздействие на легкие и, по-видимому, не вызывает серьезных органических заболеваний или токсических эффектов, если уровень воздействия находится ниже пределов воздействия. Кремний может вызывать хронические респираторные заболевания. Кристаллический кремнезем (диоксид кремния) представляет серьезную опасность для органов дыхания. Однако вероятность образования кристаллического кремнезема во время нормальной обработки очень мала. LD50 (перорально) – 3160 мг / кг. (LD50: Смертельная доза 50. Разовая доза вещества, вызывающая смерть 50% популяции животных от воздействия вещества любым путем, кроме ингаляции. Обычно выражается в миллиграммах или граммах вещества на килограмм веса животного.)
Кремний может вызывать хронические респираторные заболевания. Кристаллический кремнезем (диоксид кремния) представляет серьезную опасность для органов дыхания. Однако вероятность образования кристаллического кремнезема во время нормальной обработки очень мала. LD50 (перорально) – 3160 мг / кг. (LD50: Смертельная доза 50. Разовая доза вещества, вызывающая смерть 50% популяции животных от воздействия вещества любым путем, кроме ингаляции. Обычно выражается в миллиграммах или граммах вещества на килограмм веса животного.)
Кремний кристаллический при контакте вызывает раздражение кожи и глаз.Вдыхание вызывает раздражение легких и слизистой оболочки. Раздражение глаз вызовет слезотечение и покраснение. Покраснение, шелушение и зуд – признаки воспаления кожи.
Рак легких связан с профессиональным воздействием кристаллического кремнезема, особенно кварца и кристобалита. Взаимосвязь «воздействие-реакция» была обнаружена в исследованиях горняков, рабочих, занимающихся диатомовой землей, рабочих, работающих с гранитом, керамических рабочих, рабочих из огнеупорного кирпича и других рабочих. заболевания рабочих, подвергшихся воздействию кремнезема.Эти заболевания и расстройства включают склеродермию, ревматоидный артрит, системную красную волчанку и саркоидоз.
заболевания рабочих, подвергшихся воздействию кремнезема.Эти заболевания и расстройства включают склеродермию, ревматоидный артрит, системную красную волчанку и саркоидоз.
Недавние эпидемиологические исследования сообщили о статистически значимой связи профессионального воздействия кристаллического кремнезема с почечными заболеваниями и субклиническими изменениями почек
Кристаллический кремнезем может влиять на иммунную систему, приводя к микобактериальным инфекциям (туберкулезным и нетуберкулезным) или грибковым заболеваниям, особенно у рабочих с силикозом
Профессиональное воздействие дышащего кристаллического кремнезема связано с бронхитом, хронической обструктивной болезнью легких (ХОБЛ) и эмфиземой.Некоторые эпидемиологические исследования показывают, что эти последствия для здоровья могут быть менее частыми или отсутствовать у некурящих.
О негативном воздействии на окружающую среду не сообщалось.
А теперь загляните на нашу страницу о кремнии и воде!
Источники периодической таблицы
Вернуться к периодической таблице элементов.
КРЕМНИЙ РОАЛЬД ХОФМАНН, УНИВЕРСИТЕТ КОРНЕЛЛА История была похожа; он вызвал не меньшую икону аналогического мышления, чем Дмитрий Иванович Менделеев. Кремний находился под углеродом; Разумеется, нельзя было отказать в его менделеевском праве по рождению, чтобы дать нам все, что дает углерод? В период расцвета химии кремния это был всего лишь вопрос времени и химии. Мне очень хотелось выучить английский язык, говорить без акцента, чтобы соответствовать; об улучшающих жизнь различиях, таких как различия между мальчиками и девочками, было только волнение. Я наслаждался этим видением альтернативной, но похожей на вселенную. Но кремний отличается от . Да, можно делать Si-аналоги гексана и циклогексана. Различия проявляются раньше по реакционной способности, чем по структуре.Что наиболее важно, ненасыщенность крайне неблагоприятна для кремния, как и для других элементов основной группы ниже первого ряда. На нормальном расстоянии Si – Si p-связь просто не стоит очень дорого. Таким образом, молекулы с двойными и тройными связями имеют заполненные высоко расположенные и незаполненные низко расположенные орбитали. Это делает его реактивным по отношению к кислотам, основаниям и радикалам. Силилены SiR 2 также очень стабильны; Сложите эти тенденции вместе и получите равновесие, такое как H 2 Si = SiH 2 H 3 Si-SiH, сильно эндотермический для углерода, почти термонейтральный и имеет небольшую энергию активации для кремния. Насколько отличается кремний, проявляется в равновесной структуре Si 2 H 2 . Триумф вычислительной химии (увы, не мной) был предсказан Si 2 H 2 с поразительной неклассической раздвоенной структурой, которая затем была подтверждена экспериментально. Энергии связи C – E и Si – E (E = элемент) схожи (в пределах 50 кДж на моль) для большого разнообразия Es. Исключение составляет Si – O (и Si – F), который почти на 100 кДж на моль сильнее, чем C – O. В сочетании с неудовлетворенностью Si ненасыщенностью, любовь кремния к кислороду приводит к огромной разнице между миром множественных связей CO и вселенной силикатов. Плохой углерод, не имеющий двухмерных полимеров и немногочисленных трехмерных полимеров.Сравните глины, слюды, цеолиты, аэрогели, аметист и сердолик, лазурит, асбест, фарфор и стекло – просто выберите пробоотборник силикатов. Кремний, безусловно, может поддерживать хиральность. Его химия спортивные спирали. Так почему же с этим элементом практически отказались из жизни, по крайней мере, из биохимии животных? По содержанию кремния в земной коре уступает только кислороду. Гораздо менее распространенные элементы – например, медь или молибден – усваиваются жизнью; Можно было бы подумать, что эволюционное вмешательство природы, несомненно, нашло бы широкое применение кремнию. Я не совсем честно. Этот элемент, через диоксид кремния, очень полезен в качестве структурного материала для диатомовых водорослей и радиолярий. Типичный образец, Cyclotella cryptica, , содержит 22% SiO 2 по сухому весу. Но почти нет у бактерий и животных.Это отличная головоломка. Хотя есть сторонники глины, похоже, что путь к жизни пролегал через изомерную изменчивость и уравновешивающий акт метастабильных, но кинетически стойких малых органических молекул и одномерных полимеров. Плохой кремний, способный поддерживать изомерию, но оторванный от цепочки Si – Si этой соблазнительной связью с обильным кислородом! Каким же неожиданным тогда (здесь мало пользы от научной фантастики) оказался наш постоянно растущий мир in silico .Это месть кремния! Или же эволюцию электроники и компьютеров можно рассматривать только как последнее расширение культурного присвоения людьми тех элементов, которые недостаточно используются в биологии. Вслед за кремнием эта постоянная цивилизации – керамика. И стекло. В азарте построения теории, в отчаянном и захватывающем труде попыток понять, первичным побуждением является упрощение. Не только в науке, хотя наше ремесло склонно к особым редуктивным тенденциям.Упрощая до крайности, мы делаем то же самое. Но красота этого мира заключается в том, что он действует случайно, и в бесконечном разнообразии, которое дает не одно и то же. То же самое касается кремния и углерода, как и людей.
Роальд Хоффманн – Франк Х.Т. Родс, профессор гуманитарных наук Корнельского университета. Он получил Нобелевскую премию по химии в 1981 году. Новости химии и машиностроения |
| |||||||
Может ли кремний быть основой для инопланетных форм жизни, как углерод на Земле?
Раймонд Десси – профессор химии Политехнического института Вирджинии и государственного университета в Блэксбурге, штат Вирджиния.Вот его ответ.Группа IV Периодической таблицы элементов содержит углерод (C), кремний (Si) и несколько тяжелые металлы. Углерод, конечно же, является строительным блоком той жизни, которую мы знаем. Возможно ли, что планета существует в каком-то другом солнечная система, где кремний заменяет углерод? В нескольких научно-фантастических рассказах рассказывается о формах жизни на основе кремния – разумные кристаллы, отвратительные золотые песчинки и даже существо, чьи следы или следы были оставленными кирпичиками кремнезема.Повести читают хорошо, но есть несколько проблем с химией.
Изображение: HONG YANG, University of Торонто КРИСТАЛЛИЧЕСКИЕ СОЗДАНИЯ? Кремний может превратиться во множество реалистичных структур, но его химический состав делает маловероятным, что он мог быть основой для инопланетных форм жизни. |
Действительно, углерод и кремний имеют много общих характеристик. У каждого есть так называемая валентность, равная четырем, что означает, что индивидуальный атомы образуют четыре связи с другими элементами, образуя химические соединения.Каждый элемент связывается с кислородом. Каждая образует длинные цепи, называемые полимерами, в которых он чередуется с кислородом. В простейшем случае углерод дает полимер, называемый полиацеталем, пластик, используемый в синтетических волокнах и оборудовании. Из кремния получаются полимерные силиконы, которые мы используем для водонепроницаемой ткани или смазки. металлические и пластиковые детали.
Но когда углерод окисляется или соединяется с кислородом, скажем, во время горения, он становится газовым углеродом. диоксид; Кремний окисляется до твердого диоксида кремния, называемого кремнеземом.Тот факт, что кремний окисляется до твердого состояния, является одной из основных причин того, что почему он не может поддерживать жизнь. Кремнезем, или песок, твердое вещество, потому что кремний слишком хорошо любит кислород, а диоксид кремния образует решетка, в которой один атом кремния окружен четырьмя атомами кислорода. Силикатные составы, имеющие Элементы SiO 4 -4 также присутствуют в таких минералах, как полевые шпаты, слюды, цеолиты или тальки. И эти твердые системы создают проблемы утилизации для живой системы.
Также учтите, что жизненной форме нужен способ собирать, хранить и использовать энергию.Энергия должна исходить из окружающей среды. После поглощения или проглатывания энергия должна высвобождаться точно. где и когда это нужно. В противном случае вся энергия могла бы высвободить свое тепло одновременно, испепелив жизненную форму. В В мире, основанном на углероде, основным запасающим элементом является углевод, имеющий формулу C x (HOH) y . Этот углевод окисляется до воды и углекислого газа, которые затем обмениваются с воздухом; атомы углерода связаны одинарные связи в цепочку – процесс, называемый цепной связью.Форма жизни на основе углерода “сжигает” это топливо контролируемыми шагами, используя регуляторы скорости называются ферментами.
Эти большие сложные молекулы выполняют свою работу с большой точностью только потому, что они иметь свойство, называемое «рукой». Когда какой-либо один фермент «спаривается» с соединениями, он помогает реагировать, два молекулярных формы подходят друг к другу, как замок и ключ или рукопожатие. Фактически, многие молекулы на основе углерода используют правильные и левые формы. Например, природа выбрала один и тот же стабильный шестиуглеродный углевод для хранения энергии в нашей печени (в форме полимера, называемого гликогеном) и в деревьях (в виде полимерной целлюлозы).
Гликоген и целлюлоза различаются в основном за счет направленности одного атома углерода, который образуется при полимеризации углеводов или образует цепочку. Целлюлоза имеет наиболее стабильную форму из двух возможных; гликоген – следующий по стабильности. Потому что у людей нет ферменты, расщепляющие целлюлозу на основной углевод, мы не можем использовать ее в пищу. Но многие низшие формы жизни, такие как бактерии, может.
Короче говоря, маневренность – это характеристика, которая наделяет множество биомолекул их способностью распознавать и регулировать различные биологические процессы.И кремний не образует много соединений, имеющих ручную форму. Таким образом, это Для формы жизни на основе кремния было бы трудно достичь всех замечательных функций регулирования и распознавания, которые ферменты на основе углерода работают на нас.
Тем не менее, химики неустанно работали над созданием новых соединений кремния, с тех пор, как Фредерик Стэнли Киппинг (1863-1949) показал, что можно сделать некоторые интересные. Самый высокий международный Премия в области кремния называется премией Киппинга.Но несмотря на годы работы – и несмотря на все доступные реагенты современный алхимик – многие кремниевые аналоги соединений углерода просто не могут образоваться. Термодинамические данные подтверждают это. аналоги часто бывают слишком нестабильными или слишком реактивными.
Можно думать о микро- и наноструктурах кремния; формы кремния на солнечных батареях для энергии и зрения; силиконовая жидкость, которая может переносить окислители к сокращающимся мышечным элементам из других силиконов; скелетные материалы силикатов; силиконовые мембраны; и даже полости в силикатных цеолитах, ручность.Некоторые из этих построек даже выглядят живыми. Но химии, необходимой для создания формы жизни, просто нет. Сложный танец жизни требует взаимосвязанных цепочек реакций. И эти реакции могут происходить только в узком диапазон температур и уровней pH. При таких ограничениях углерод может, а кремний – нет.
Силикон может делать. Жизнь на Земле преимущественно состоит из правых углеводов и левых аминокислот. Почему у них нет разнонаправленность или у обоих одинаковые? Многие химики считают, что первые «переданные» углеродные соединения образовались в «жидкая» каменная лужа с «ручной» поверхностью из кремнезема.И ручная работа этой поверхности способствовала созданию таких соединения углерода теперь предпочтительны в формах жизни Земли.
Периодическая таблица – КремнийКремний состоит из девяти изотопов с массовыми числами от 25 до 33. 28 Si (самый распространенный изотоп, 92,23%), 29 Si (4,67%) и 30 Si (3,1%) стабильны; 32 Si – радиоактивный изотоп, производимый распад аргона.Его период полураспада после долгих споров был определен как быть примерно 276 лет (ДеМастер, 1980), и он распадается бета-излучением до 32 P (период полураспада 14,28 года), а затем до 32 S. Изотопные отношения кремния сравниваются со стандартом NBS 28 для измерения. 32 Si был использован при датировании биогенного кремнезема, в основном в морском
снаряды. Этот нуклид может быть очень полезен для определения седиментации.
нормы морских отложений, содержащих биогенный кремнезем. 32 Концентрации Si
в дождевой воде меняются в зависимости от сезона. Dansgaard et al. (1966) нашел отношения
между 32 Si и 90 Sr, что означает, что 32 Si
может быть использован для датирования ледниковой активности. Источник текста : Этот обзор был собран Дэном Снайдером, в первую очередь из Faure (1986).
| ||||||||||

 Или, может быть, других условий окружающей среды; Основанная на кремнии жизнь на другой планете имела такой смысл в научной фантастике.
Или, может быть, других условий окружающей среды; Основанная на кремнии жизнь на другой планете имела такой смысл в научной фантастике. Или, если вам нужно что-то еще более поразительное, для диссоциации H 2 Si = SiH 2 на два силилена требуется меньше энергии, чем для разрыва одинарной связи в H 3 Si – SiH 3 . Пяти- и шестикоординатные структуры становятся доступными также для нейтральных соединений Si.
Или, если вам нужно что-то еще более поразительное, для диссоциации H 2 Si = SiH 2 на два силилена требуется меньше энергии, чем для разрыва одинарной связи в H 3 Si – SiH 3 . Пяти- и шестикоординатные структуры становятся доступными также для нейтральных соединений Si. Контрастный газообразный CO 2 и твердый полимерный SiO 2 .
Контрастный газообразный CO 2 и твердый полимерный SiO 2 . Таких маленьких ребят тоже много. Силикаты также необходимы высшим растениям. Хвощи, из которых когда-то выросли высокие деревья, накапливают достаточно кремнезема, чтобы использовать их в качестве чистящих щеток. В рисе и вообще в травах много кремнезема.
Таких маленьких ребят тоже много. Силикаты также необходимы высшим растениям. Хвощи, из которых когда-то выросли высокие деревья, накапливают достаточно кремнезема, чтобы использовать их в качестве чистящих щеток. В рисе и вообще в травах много кремнезема.