Внутренняя энергия. 1-й закон термодинамики.
Основные ссылки
CSS adjustments for Marinelli theme
Объединение учителей Санкт-Петербурга
Форма поиска
Поиск
Вы здесь
Главная » Внутренняя энергия. 1-й закон термодинамики.
Внутренняя энергия 1-й закон термодинамики. | |
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. | |
Внимание!
| U=U(T,V) |
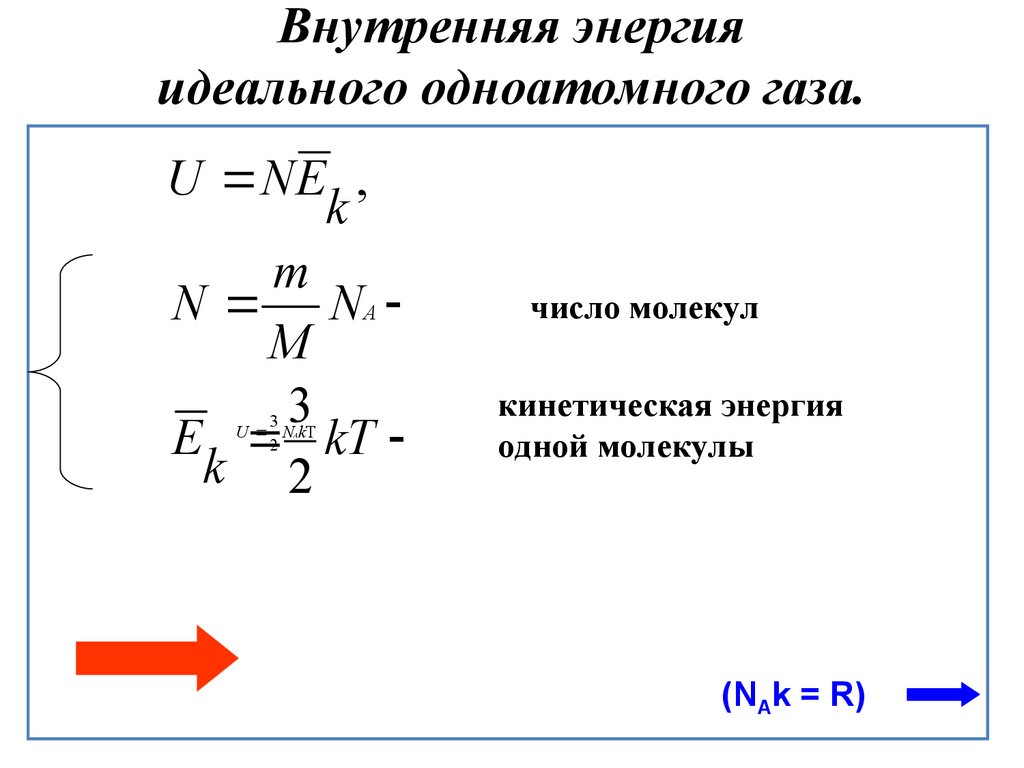
Для идеального газа: U=U(T), т.к. взаимодействием на расстоянии пренебрегаем. – внутренняя энергия идеального одноатомного газа. Внутренняя энергия – однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) – одной и той же энергии могут соответствовать разные состояния. | Идеальный газ:
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т. |
|
Р.Майер, Д.Джоуль, Г.Гельмгольц – закон сохранения энергии для тепловых процессов – 1-й закон термодинамики. |
|
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
| |
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют процесс изменения внутренней энергии  |
|
Если А – работа внешних сил, а А’ – работа газа, то А = – А’ (в соответствии с 3-м законом Ньютона). Тогда: – другая форма записи первого закона термодинамики.Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. | |
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода – устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A’= – ΔU. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|
Теги:
конспект
несколько фактов и подробные объяснения:
«Внутренняя энергия идеального газа» не зависит от пути замкнутой системы, но внутренняя энергия идеального газа зависит от начального состояния и конечного состояния системы.
Из закон термодинамики мы получаем кристально ясное представление о внутренней энергии идеального газа. Внутреннюю энергию идеального газа можно объяснить тем, что общее количество энергии объединяется с движением, которое может быть вибрационным, вращательным или поступательным движением молекул или атомов вещества в системе.
Узнайте больше о Цикл Карно: его важные особенности вместе с 16 часто задаваемыми вопросами
Что такое внутренняя энергия идеального газа?Для идеального газа количество внутренней энергии системы зависит только от температуры. Но для реального газа количество внутренней энергии системы зависит от температуры, объема, давления.
Внутренняя энергия идеального газа является экстенсивным свойством и количество энергии газообразного вещества не может быть определено напрямую. Внутренняя энергия идеального газа – это в системе молекул газообразного вещества сумма внутренней энергии, переходящая в виде термодинамической работы и теплоты. Изображение – Тепловая машина Карно внутренней энергии идеального газа;
Изображение – Тепловая машина Карно внутренней энергии идеального газа;
Кредит изображения – ВикипедияИзображение – Температура;
Кредит изображения – Википедия
Для идеального газа общее количество внутренней энергии прямо пропорционально температуре, а также общему числу молекул на моль вещества, находящегося в газообразном состоянии.
Узнайте больше о Температуропроводность: это все важные факты и часто задаваемые вопросы
Итак, математически внутреннюю энергию идеального газа можно выразить как
dU = нКлvdT…… уравнение (1)
Или U = CvнТ…………. уравнение (2)
Из уравнения (1) член nCvT используется из кинетической энергии идеального газа.
Где,
U = количество внутренней энергии газа
Cv = При постоянном объеме количество теплоемкости газообразного вещества
n = общее количество молей газообразного вещества
T = температура системы
Формула внутренней энергии идеального газа:В термодинамике можно определить изменение полного количества внутренней энергии, которое выражается как ΔU, а для идеального газа можно оценить количество абсолютной внутренней энергии.
Формула внутренней энергии идеального газа равна
Где,
U = внутренняя энергия идеального газа
cv = Теплоемкость удельной изохорной
m = масса идеального газа
Т = температура
Чтобы вычислить количество внутренней энергии идеального газа, сначала нужно представить, что газовое вещество блокируется к цилиндру, в то время как объем идеального газа должен быть в постоянном состоянии и идеальный газ должен остыть и достичь температуры абсолютного нуля.
В этом конкретном состоянии все частицы идеального газа находятся в состоянии покоя и внутренней энергии нет. Общее количество тепла выражается как Q, передаваемое при постоянном объеме до тех пор, пока температура идеального газа не достигнет T. Теперь в этом состоянии общее количество тепла, необходимое для внутренней энергии, достигает U.
Внутренняя энергия образования идеального газа:В термодинамической системе количество внутренней энергии может быть преобразовано в потенциальную энергию или кинетическую энергию. Для системы термодинамики могут содержаться три вида энергии, такие как внутренняя энергия, потенциальная энергия и кинетическая энергия.
Для системы термодинамики могут содержаться три вида энергии, такие как внутренняя энергия, потенциальная энергия и кинетическая энергия.
Для идеального газового вещества внутренняя энергия зависит от кинетической энергии и потенциальной энергии.
Мы знаем это,
М/м = Нa
Kсредний = 1/2 3RT/Нa
Kсредний = 3/2 kT, поскольку k = R/Na
Чем отличается внутренняя энергия идеального газа от энергии реального газа?Идеальный газ объясняют как газообразное вещество, подчиняющееся законам газов при любых условиях температуры и давления. Реальный газ объясняют как газообразное вещество, не подчиняющееся закону газов.
Разница между внутренней энергией идеального газа и реального газа обсуждается ниже.
| параметры | Идеальный газ | Настоящий газ |
| Давление | High | Низкий |
| Сила межмолекулярного притяжения | Не присутствует | Представить |
| Громкости | Нет определенного объема | Определенный объем |
| Существование в окружающей среде | Не существует, и идеальный газ является гипотетическим газом. | Представить |
| Упругое столкновение молекул | Да | Нет |
| Взаимодействие с другими газами | Нет | Да |
| Закон газов | Подчиняться | не подчиняется |
| Скорость | Не присутствует | Представить |
| Масса | Не присутствует | Представить |
| Громкости | Не присутствует | Представить |
Удельная внутренняя энергия идеального газа, которая выражается как u, объясняется как количество внутренней энергии идеального газа на единицу массы конкретного идеального газа.
Узнайте больше о Удельная энтальпия: ее важные свойства и усиление. 8 часто задаваемых вопросов
Формула удельной внутренней энергии идеального газа:
и = Е/м
Где,
u = удельная внутренняя энергия идеального газа в джоулях на килограмм
U = внутренняя энергия идеального газа в джоулях
m = масса идеального газа в килограммах
Единица СИ удельной внутренней энергии идеального газа равна Джоуль за килограмм. Размерность удельной внутренней энергии идеального газа L2T-2.
Изменение внутренней энергии идеального газа:Из законов кинетической энергии ясно видно, что кинетическая энергия частицы имеет прямую связь с температурой, так как непосредственно связано изменение внутренней энергии идеального газа.
Изменение внутренней энергии идеального газа зависит только от температуры и не зависит от других физических параметров, таких как объем, давление. Если для системы известны начальная температура, конечная температура, то легко определить изменение внутренней энергии идеального газа.
Если для системы известны начальная температура, конечная температура, то легко определить изменение внутренней энергии идеального газа.
Может ли система следовать какому-либо процессу, такому как изоэнтропический, изобарический или изохорный, или любому другому методу, изменение внутренней энергии идеального газа не имеет значения. Одним словом можно сказать изменение внутренней энергии идеального газа определяется только состоянием газообразного вещества, а не процессом газообразного вещества. Если температура в системе различна, то только в этом случае внутренняя энергия может быть различна для идеального газообразного вещества. Изменение внутренней энергии идеального газа может быть равно нулю в изотермическом процессе.
Изображение – изотермический процесс;Кредит изображения – Wikimedia Commons
Узнайте больше о Изотермический процесс: все важные факты с 13 часто задаваемыми вопросами
Процессом термодинамики легко может быть исследована четкая связь между изменением внутренней энергии идеального газа и температуры газообразного вещества. В процессе изохора на газе работы не произошло. В процессе изохоры к газу подводится тепло, поэтому увеличивается изменение внутренней энергии идеального газа.
В процессе изохора на газе работы не произошло. В процессе изохоры к газу подводится тепло, поэтому увеличивается изменение внутренней энергии идеального газа.
В термодинамической системе изменение внутренней энергии выводится таким образом, что сумма изменений внутренней энергии газообразного вещества равна чистой работе, совершаемой термодинамической системой, а общее количество тепла отводится системе и окружающей среде. системы.Изображение – Внутренняя энергия и Температура;
Кредит изображения – Wikimedia Commons
Формула изменения внутренней энергии идеального газа:
Δ U = Q + W
Где,
ΔU = общее количество изменений внутренней энергии идеального газа в системе.
Q = количество теплопередача между системой и окружением системы
W = работа, выполненная системой
В некоторых процессах внутренняя энергия не изменяется. Процессы циклические, изотермические и бесплатное расширение. В этих процессах количество внутренней энергии одинаково, потому что температура системы остается неизменной.
Процессы циклические, изотермические и бесплатное расширение. В этих процессах количество внутренней энергии одинаково, потому что температура системы остается неизменной.
Кредит изображения – ВикипедияКак рассчитать изменение внутренней энергии идеального газа?
Из 1-го закона термодинамики мы можем получить представление об изменении внутренней энергии идеального газа. Количество внутренней энергии идеального газа равно тепловому потоку и работе PV, совершаемой системой.
Количество внутренней энергии, которое может быть изменено для газообразного вещества, всегда должно быть равно работе, совершаемой системой, а также количеству подводимой теплоты и количеству отдаваемой теплоты.
Формула для расчета изменения внутренней энергии идеального газа:
Q =ΔU = W…….уравнение (1)
Q = ΔU + PV
Потому что мы знаем, что количество добавленной или удаленной теплоты всегда равно общей сумме измененной внутренней энергии и работы, выполненной PV.
Из уравнения (1) после упорядочивания получаем,
ΔU = Q – PV……. уравнение (2)
Часто задаваемые вопросы: –Вопрос: – Всегда ли сохраняются значения внутренней энергии вещества? положительный или он может быть отрицательным?Решения: – Нет, все время значения внутренней энергии вещества не могут оставаться положительными.
Некоторое время значение внутренней энергии может быть отрицательным. Мы можем вычислить значение внутренней энергии из суммы выполненной работы и теплоты. Отрицательное значение внутренней энергии идеального газа означает, что значение конечной энергии меньше значения начальной энергии.
Вопрос: – Приведите несколько примеров внутренней энергии.Решения: – Некоторые примеры внутренней энергии, перечисленные ниже,
- Пар жидкого вещества
- Встряхивание жидкого вещества
- батареи
- Сжатые газы
- Повышение температуры вещества
домашнее задание и упражнения – Какова внутренняя энергия идеального газа?
$\begingroup$
Меня смущает внутренняя энергия идеального газа. 3$
3$
Итак, $PV = nRT = 101300*.65 = 65 800 \; \mathrm{Джоули}$.
С другой стороны, кинетическая теория говорит, что внутренняя энергия идеального двухатомного газа (как O2, так и N2 являются двухатомными) составляет $5/2nRT$ , что в 2½ раза превышает значение PV, то есть 165 000 Дж.
Оба числа представляют собой энергию по отношению к 1 молю газа при ст. ст., так что же они представляют собой простыми словами?
- домашние задания и упражнения
- термодинамика
- энергия
- идеальный газ
$\endgroup$
$\begingroup$
Анализ размерностей может дать пропорциональности отношений, но ничего не говорит о числовых факторах.
Оказывается, для классического (т.е. нерелятивистского) идеального газа существует связь между $PV$ и внутренней энергией вида
$$
PV=\альфа U
$$
где $\alpha= 2/3$ для одноатомного газа, $2/5$ для двухатомного и вообще зависит от числа внутренних степеней свободы многоатомных молекул.
$\endgroup$
3
$\begingroup$
Существует множество комбинаций параметров с единицами энергии; это не значит, что все они равны внутренней энергии!
$PV$ — это работа, необходимая для помещения объема $V$ некоторого вещества в атмосферу при давлении $P$. Это отличается от внутренней энергии идеального газа $U=nc_VT$, где $c_V$ — молярная теплоемкость ($\frac{5}{2}R$ для двухатомного газа).
$\endgroup$
3
$\begingroup$
К сожалению, ни одна из этих формул не является правильной формулой для внутренней энергии.
Произведение $PV$ не может быть внутренней энергией, поскольку оно не учитывает температуру газа $T$. Теперь для идеального газа внутренняя энергия $u$ зависит не только от температуры, но и только от температуры.
Эта формула:
$$ u(T) = C_V T $$
где $C_V$ — молярная удельная теплоемкость (при постоянном объеме). Но вы должны быть очень осторожны, чтобы удельная теплоемкость выражалась в молях или по массе, в зависимости от необходимости, и чтобы эталонное условие для $u=0$ было постоянным. На практике обычным способом определения удельной теплоемкости и других свойств жидкостей являются просто справочные таблицы, такие как веб-книга NIST или любой учебник по термодинамике, [а именно] 1
Ваша вторая формула удельная теплоемкость:
$$C_V = \frac 5 2 R$$
на основании того факта, что двухатомный газ, такой как $\mathrm N_2$ или $\mathrm O_2$, имеет 5 степеней свободы для хранения энергии.
$\endgroup$
5
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
термодинамика – Расчет внутренней энергии и энтропии идеального газа
$\begingroup$
У меня возникли проблемы с вычислением энтропии и внутренней энергии идеального газа. Все источники, которые предоставляют такие выводы, которые мне удалось найти, либо предполагают априори, что $U$ есть некоторая константа, умноженная на $T$, либо что $C_V$ постоянна. Теперь я задаюсь вопросом, возможен ли этот расчет вообще без априорного предположения одной из этих вещей, или, другими словами: является ли уравнение состояния достаточным физическим входом для получения всех термодинамических величин? Пока мне удалось показать следующее (основываясь только на УРС и принципах термодинамики): 9T\frac{C_V(T’)}{nRT’} \mathrm d T’ -1)$,
Все источники, которые предоставляют такие выводы, которые мне удалось найти, либо предполагают априори, что $U$ есть некоторая константа, умноженная на $T$, либо что $C_V$ постоянна. Теперь я задаюсь вопросом, возможен ли этот расчет вообще без априорного предположения одной из этих вещей, или, другими словами: является ли уравнение состояния достаточным физическим входом для получения всех термодинамических величин? Пока мне удалось показать следующее (основываясь только на УРС и принципах термодинамики): 9T\frac{C_V(T’)}{nRT’} \mathrm d T’ -1)$,
, где $T_0$ и $V_0$ — значения в некотором эталонном состоянии. Но эта формула, кажется, противоречит 1.! Ясно, что это выражение не может быть выражено только через температуру. Что не так в моих рассуждениях? Могу ли я вообще рассчитать $U$ и $S$, если я не предполагаю что-то большее, чем EOS?
Для справки людям, у которых может возникнуть такая же проблема в будущем, я добавляю доказательства пунктов (1-3):
Объявление 1. $\mathrm d S = \frac{1}{T}(\mathrm d T + p \ mathrm d V) = \ frac {1} {T} (p + (\ frac {\ partial U} {\ partial V}) _T) \ mathrm d V + \ frac {1} {T} (\ frac{\partial U}{\partial T})_V \mathrm d T$.
$\mathrm d S = \frac{1}{T}(\mathrm d T + p \ mathrm d V) = \ frac {1} {T} (p + (\ frac {\ partial U} {\ partial V}) _T) \ mathrm d V + \ frac {1} {T} (\ frac{\partial U}{\partial T})_V \mathrm d T$.
Это точный дифференциал, поэтому смешанные частные производные равны. Используя это и уравнение состояния, можно получить гипотезу.
Ad 2. Это верно из первого закона, поскольку $U$ является экстенсивной величиной (формально используется теорема Эйлера об однородных функциях). Для положительного параметра $t$ имеем $U(tS,tV)=tU(S,V)$. Дифференциация с.р.т. $t$, а затем установка его в $1$ дает гипотезу.
Ad 3. Нужно просто использовать первый закон, определение $C_V$ и тот факт, что производная от $U$ относительно . $V$ исчезает.
- термодинамика
- идеальный газ
$\endgroup$
7
$\begingroup$
Условие, что внутренняя энергия идеального газа является функцией только температуры, следует эмпирически из наблюдаемого поведения реальных газов в пределе низких давлений и больших удельных объемов.


 е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты.
е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты.