Окислительно-восстановительные свойства d-элементов 4-го пе
Сравнить физические и химические свойства водородных соединений элементов подгруппы азота, указав как изменяются а) температуры кипения и плавления б) термическая устойчивость в) окислительно-восстановительные свойства г) кислотно-основные свойства. Назвать причины, вызывающие эти изменения, [c.232]Окислительно-восстановительные свойства элементов 429 [c.429]
Изменение окислительно-восстановительных свойств элементов в зависимости от строения их атомов. Способность химических элементов присоединять или Отдавать электроны связана со строением атомов и положением их в периодической системе элементов Д. И. Менделеева [c.143]
Рассмотрим кислотно-основные и окислительно-восстановительные свойства элементов и их соединений по группам периодической системы Д. И. Менделеева, ограничившись лишь наиболее типичными степенями окисления.
Опыт 5. Окислительно-восстановительные свойства элемента в зависимости от его степени окисления [c.93]
Окислительно-восстановительные свойства элементов и их ионов определяются их способностью отдавать или присоединять электроны. Атомы или ионы, присоединяющие электроны, называются окислителями, а отдающие их — восстановителями. [c.17]
Окислительно-восстановительные свойства элементов в большой степени зависят от числа электронов на внешней оболочке и радиуса атома или иона. Если на внешней оболочке находится один, два или три электрона, то элемент может быть только восстановителем — присоединение электронов для него практически невозможно (исключение составляют водород и бор). При наличии четырех, пяти, шести или семи электронов возможно проявление и восстановительных, и окислительных
Об окислительно-восстановительных свойствах элементов и соединений можно судить, руководствуясь периодической системой элементов Д.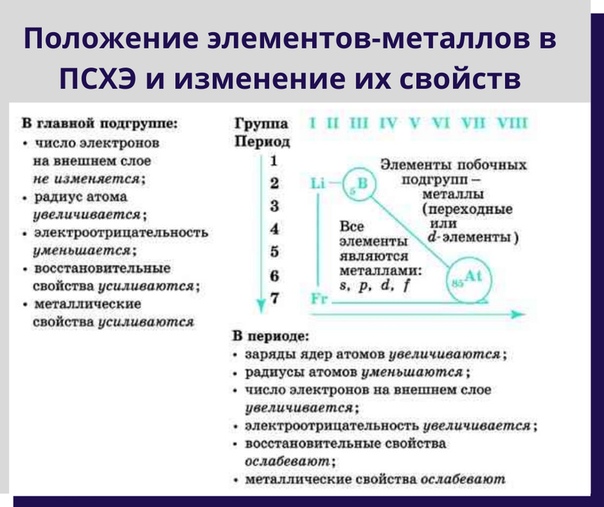 И. Менделеева. [c.91]
И. Менделеева. [c.91]
Как изменяются размеры атомов при переходе от элемента к элементу вдоль периода (слева направо) и вдоль труппы (сверху вниз) Как это отражается на окислительно-восстановительных свойствах элементов
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА -ЭЛЕМЕНТОВ 4-го ПЕРИОДА “ [c.289]
Воспользуйтесь периодической системой элементов Д. И. Менделеева и объясните, как изменяются окислительно-восстановительные свойства элементов в периодах и группах. [c.155]
Окислительно-восстановительные свойства элементов и их соединений можно предсказать, пользуясь периодической системой элементов Д, И. Менделеева. Типичными восстановителями (донорами электронов) являются а) простые вещества, атомы которых обладают наименьшей электроотрицательностью (элементы главных подгрупп I и II групп, а также металлы побочных подгрупп), причем чем меньше потенциал ионизации металла /, тем более сильным восстановителем он является.
Вопросы для самопроверки 1. Дайте общую характеристику элементов V А подгруппы, исходя из их положения в периодической системе. Какие степени окисления характерны для элементов этой подгруппы 2. Как в ряду N—Р—Аз—5Ь—изменяются окислительно-восстановительные свойства элементов 3. Какова максимальная ковалентность азота и какова фосфора Ответ обоснуйте, исходя из положения этих элементов в различных периодах и строения их атомов. 4. По какому типу химической связи построена молекула N2 Какова кратность связи в молекуле азота Как объяснить малую реакционную способность азота 5. Какие степени окисления характерны для азота В каких гибридных состояниях могут находиться валентные орбитали атома азота Приведите примеры соединений азота с различным типом гибридизации его валентных орбиталей 6. При каких условиях осуществляется синтез аммиака Какими свойствами обладает аммиак Какова форма молекулы ЫНз Какую среду имеет водный раствор аммиака 7.
Как это отражается на окислительно-восстановительных свойствах элементов [c.209]
Можно ли на основании данных об ионизационных потенциалах делать заключение об окислительно-восстановительных свойствах элементов [c.140]
Прямую характеристику окислительно-восстановительных свойств элементов дают значения их электроотрицательностей ЭО, зависящих от первых потенциалов ионизации / атомов и от их сродства к электрону е. Периодичность в изменении этих показателей представлена на рис.
Если сделать обзор окислительно-восстановительных свойств элементов третьего периода, то можно заметить плавный переход от сильного восстановителя (натрий) через восстановители и окислители средней силы (фосфор и сера) до сильного окислителя (хлор, восстановительные свойства которого выражены очень слабо). Такой переход полностью согласуется с изменением энергии ионизации и распределением электронов в атоме. Закономерности такого рода помогают запомнить особенности химического поведения элементов и предсказать свойства других элементов периодической таблицы.
Как изменяются радиусы атомов, потенциалы ионизации, окислительно-восстановительные свойства элементов I А подгруппы по группе периодической системы Д.И. Менделеева [c.8]
Опыт 2. Зависимость окислительно-восстановительных свойств элементов от их положения в периодической системе элементов Д. И. Менделеева [c.90]
Окислительно-восстановительные свойства элементов и их соединений.

Окислительно-восстановительные свойства элементов в большой степени зависят от количества электронов на внешней оболочке и радиуса атома или иона. Если на внешней оболочке находятся 1, 2 или 3 электрона, то элемент может быть только восстановителем — присоединение электронов для него практически невозможно (исключение составляют водород и бор). При наличии 4, 5, 6 или 7 внешних электронов возможно проявление и восстановительных, и окислительных свойств, т. е. в зависимости от условий реакции возможна либо отдача этих электронов, либо присоединение электронов до октета.
ВИЮ с другими элементами, строение, состав и свойства образующихся бинарных и более сложных соединений, кислотно-основные и окислительно-восстановительные свойства элементов и т.д. Известно, что Д.И.Менделеев, пользуясь Периодическим законом, предсказал свойства еще не известных в то время элементов. А сила подлинно научной теории определяется не только и не столько возможностью объяснения на ее основе известных фактов, но главным образом предвидением новых фактов. [c.226]
[c.226]
Атомные и ионные радиусы элементов также изменяются периодически с возрастанием порядкового номера. Максимальные величины для этих параметров приходятся на щелочные металлы. В вертикальном направлении сверху вниз величина атомных и ионных радиусов возрастает. Четкая закономерность прослеживается для многих других физических и химических свойств элементов, например атомных объемов, внешнего вида, кристаллической структуры, температур плавления, коэффициентов линейного расширения и объемной сжимаемости в кристаллическом состоянии, характера окислов, водородных соединений, окислительно-восстановительных свойств элементов, их комп-лексообразования.
Окислительно-восстановительные свойства элементов и их положение в периодической системе Д. И. Менделеева. Превращение атомов в положительно заряженные ионы определяются величиной энергии ионизации наружных электронов (стр. 45). Чем меньше энергия ионизации элемента, тем ярче выражены его восстановительные свойства.
Коренное различие в содержании курсов неорганической и аналитической химии, обусловливающее вместе с тем их единство и взаимосвязь, состоит в том, что первый курс на основе периодического закона дает преимущественно представление об общих закономерностях сходства и тенденций изменения свойств элементов и соединений, а второй курс на основе того же закона должен давать сведения о закономерностях индивидуальных свойств химических элементов и специфических соединений, пригодных для обнаружения и разделения этих элементов. Такие сведения уже имеются в очень большом количестве, но степень их обобщения еще далеко не достаточна. Однако направления обобщений определились —это учение о кислотно-основных, комплексообразующих и окислительно-восстановительных свойствах элементов в реакциях их соединений в водных и неводных средах. Химическая индивидуальность — не общее понятие, она может рассматриваться только по отношению к конкретному окружению, в конкретных условиях и эти конкретные условия диктуются в области теоретической химии и в подавляющей массе прикладных задач периодической системой элементов (элементы-спутники, элементы-близнецы среды с определенным уровнем кислотно-основных и окислительно-восстановительных характеристик и т. п.). [c.7]
Такие сведения уже имеются в очень большом количестве, но степень их обобщения еще далеко не достаточна. Однако направления обобщений определились —это учение о кислотно-основных, комплексообразующих и окислительно-восстановительных свойствах элементов в реакциях их соединений в водных и неводных средах. Химическая индивидуальность — не общее понятие, она может рассматриваться только по отношению к конкретному окружению, в конкретных условиях и эти конкретные условия диктуются в области теоретической химии и в подавляющей массе прикладных задач периодической системой элементов (элементы-спутники, элементы-близнецы среды с определенным уровнем кислотно-основных и окислительно-восстановительных характеристик и т. п.). [c.7]
ИЗМЕНЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ ЭЛЕМЕНТОВ В ЗАВИСИМОСТИ ОТ СТРОЕНИЯ ИХ АТОМОВ [c.61]
Окислительно-восстановительные свойства элементов определяются способностью их нейтральных газообразных атомов терять или приобретать электроны. Количественно эту способность выражают энергией ионизации (потенциалом ионизации) и сродством к электрону. Энергией ионизации 1 называется количество энергии, необходимой для [c.77]
Количественно эту способность выражают энергией ионизации (потенциалом ионизации) и сродством к электрону. Энергией ионизации 1 называется количество энергии, необходимой для [c.77]
Реакционная способность ионов, на которой основан химический анализ, свойства образующихся соединений тесно связаны со строением электронных оболочек элементов, атомными и ионными радиусами и зарядами ядер, зависящими от положения элементов в периодической системе. Положение элементов в периодической системе определяет максимальную положительную и отрицательную степени окисления элемента, т. е. зарядность его ионов, кислотный или основный характер гидроксидов, их растворимость, характер электролитической диссоциации, окислительно-восстановительные свойства элементов и ионов, их способность к комплексообразова-нию. Именно эти свойства в значительной степени определяют химико-аналитические свойства ионов и разделение их на аналитические группы. [c.43]
В предыдущих примерах была показана возможность использования периодической зависимости окислительно-восстановительных свойств элементов по ряду (по горизонтали). Не меньшее значение в анализе имеет и периодическая закономерность окислительно-восстановительных свойств по группе (по вертикали). [c.68]
Не меньшее значение в анализе имеет и периодическая закономерность окислительно-восстановительных свойств по группе (по вертикали). [c.68]
Важным свойством -элементов является переменная валентность и, соответственно, разнообразие степеней окисления. Эта особенность связана главным образом с незавершенностью предвнешнего -электронного слоя (кроме элементов 1Б- и ПБ-групп). Возможность существования -элементов в разных степенях окисления определяет широкий диапазон окислительно-восстановительных свойств элементов. В низших степенях окисления -элементы проявляют свойства металлов. С увеличением атомного номера в группах Б металлические свойства закономерно уменьшаются [c.255]
Закономерным образом зависят от строения атома окислительно-восстановительные свойства элементов. Восстановительные свойства атомов уменьшаются в группах снизу вверх и в периодах слева направо. Таким образом, наиболее сильные восстановители — щелочные металлы. Окислительные свойства возрастают в периодах слева направо, а в группах — снизу вверх. Следовательно, наиболее сильными окислителями являются галогены, а также кислородсодержащие ионы неметаллов (N03-, ВгОз и т. д.) и металлов в высшей степени окисления (Сг04 -, М.ПО4 и др.). При этом окислительная способность убывает сверху вниз в группах. Восстановительные свойства, возрастающие сверху вниз в группе, могут проявлять и отрицательно заряженные ионы неметаллов (I”, и т. д.). [c.33]
Следовательно, наиболее сильными окислителями являются галогены, а также кислородсодержащие ионы неметаллов (N03-, ВгОз и т. д.) и металлов в высшей степени окисления (Сг04 -, М.ПО4 и др.). При этом окислительная способность убывает сверху вниз в группах. Восстановительные свойства, возрастающие сверху вниз в группе, могут проявлять и отрицательно заряженные ионы неметаллов (I”, и т. д.). [c.33]
Задание №2 ЕГЭ по химии
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.
Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Как легко определять свойства элементов и их соединений — Российская газета
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Артем Оганов – кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение – выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений – веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость – способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность – способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая – у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности – только расчеты на основе фундаментальных характеристик атомов. Мы назвали это “Универсальной последовательностью элементов”, по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения – молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов. А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Универсальная последовательность элементов (USE)
Журнал “Кот Шрёдингера”
Как вычисляются числа Менделеева
Универсальная последовательность элементов определяется их проекцией на линию, обозначенную синим цветом. Журнал “Кот Шрёдингера”
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И.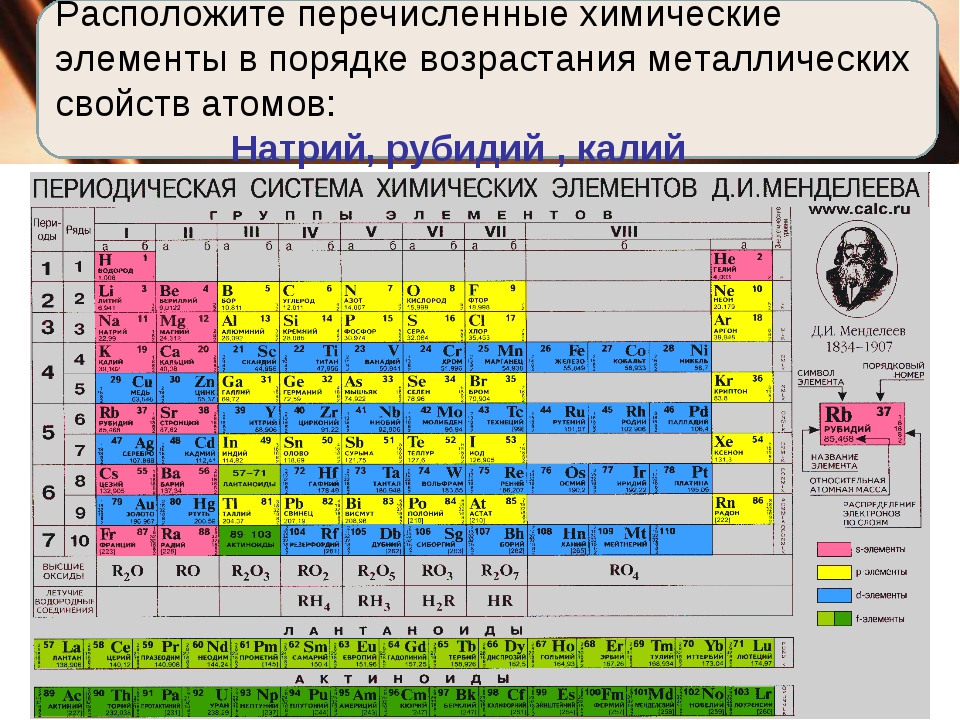 Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в “строки и столбцы” – периоды и группы.
Период – ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 – называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов (“→” слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде “←” справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер – сверху вниз “↓”. Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается – снизу вверх “↑”. Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия – тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует – там нужно считать электроны “вручную”, располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое “сходство”:
- B5 – 1s22s22p1
- Al13 – 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия – 3s23p1, галия – 4s24p1, индия – 5s25p1 и таллия – 6s26p1. За “n” мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода – и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных – только “вручную”.
Длина связи
Длина связи – расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические – усиливаются (слева направо “→”). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические – ослабевают (сверху вниз “↓”).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны – у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера – самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева – металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные – возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные – ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые – убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF – самая слабая из этих кислот, а HI – самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные – усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные – ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные – с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность – способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус “-“.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева – это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости “синонимичны” также понятия сродства к электрону – энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации – количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы – R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми “высшими” оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в “-” отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы – 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы – H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ | Кафедра загальної та неорганічної хімії
Периодическая классификация элементов была предложена в 1869 году Дмитрием Ивановичем Менделеевым, выдающимся ученым — химиком. Он предположил, что если расставить известные элементы в порядке увеличения относительной атомной массы, их химические и другие свойства будут регулярно повторяться. Он разработал удобную и компактную таблицу которая, к тому же, позволяла предвидеть свойства еще неизвестных элементов. В 1871 году он разработал более адекватную версию таблицы, где оставил пробелы, надеясь, что они будут в свое время заполнены элементами, еще неизвестными и предсказал с чрезвычайной точностью свойства таких элементов, как галлий, скандий и германий.
Он также предсказал отсутствующий элемент с относительной атомной массой около 100. Это оказался технеций — самый легкий элемент, не имеющий устойчивых изотопов. Предсказания Менделеева были подтверждены бельгийским химиком-аналитиком Жаном Севре Стасом, который выполнил наиболее точные в то время измерения относительных атомных масс некоторых элементов.
За это открытие Менделеев, вместе с Лотаром Майером, получил медаль Дэви — награду Лондонского Королевского Общества.
В 2016 году стало известно об официальном внесении четырех новых химических элементов в периодической таблице Менделеева, о чем извещает Международный союз теоретической и прикладной химии (IUPAC).
После того, как в январе 2016 официально подтвердили существование этих элементов, исследовательские команды, их открывшие, предложили свои названия и условное обозначение из двух букв. Традиционно химические элементы называют по имени мифологического существа, минерала, геологической формации, страны или местности, в честь ученого или по их свойствам.
Элемент 113 предложили назвать нихонием (до его временной названием был унунтрий). Его синтезировала команда Косуке Мориты в лаборатории RIKEN путем бомбардировки висмутовых мишеней ядрами цинка-70 (эксперименты поставили в 2004 и 2012). Назван в честь Японии, этот элемент впервые может увековечить Восточную Азию в периодической таблице.
Ученые из России и США, открывшие элементы 115 и 117 (до сих пор — унунпентий и унунсептий), предложили для них названия московий (Mc) и теннессин (Ts). Оба элемента получили благодаря сотрудничеству между Институтом ядерных исследований (Россия) и Ок-Риджськой и Ливерморской национальной лабораторией (США) в 2010 году.
Российская команда также предложила название «оганессон» и условное обозначение Og для элемента 118 (временно — унуноктий). Его предлагают в честь академика Юрия Оганесяна, который возглавлял эксперимент по его синтезу.
Ученые получили считанные атомы каждого из этих элементов. Они существовали лишь доли секунды и сразу распались на меньшие, более стабильные ядра. Однако ученых не покидает надежда, что среди группы транфермиевих элементов, то есть элементов с атомным номером> 100, существует так называемый «островок стабильности» — стабильный, долговременный элемент, который может существовать даже в природе. «Островок стабильности» — прямое следствие из оболочечной теории строения атомного ядра, за которую Мария Гелперт-Майер и Ганс Йенсен были удостоены Нобелевской премии по физике 1963 года.
Исследовательские команды, которые открывают новые элементы, вносят предложения относительно названий. Однако официально элементы называет только IUPAC. Международный союз ждет пять месяцев, чтобы получить отзывы на названия от общественности и научных сообществ. Если не будет массовых протестов, то их, скорее всего, утвердят в ноябре. Последний раз периодическая таблица пополнилась флеровием (Fl, 114) и ливерморием (Lv, 116).
Таким образом, седьмой период периодической системы теперь полностью завершен.
Расположение металлов и неметаллов в Периодической системе
Черным цветом изображены металлы,
красным цветом — неметаллы,
зеленым — элементы с амфотерными свойствами.
Расположение семей элементов в Периодической системе
s-элементы — малиновый цвет,
p-элементы — желтый цвет,
d-элементы — голубой цвет,
f-элементы — зеленый цвет.
Пирамидальное расположение элементов
Области применения элементов
Окислительные и восстановительные свойства
2.7 Свойства атомов и их периодичность — ЗФТШ, МФТИ
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус.
Элементы одного и того же периода имеют одинаковое количество электронных слоев. Поэтому в одном периоде по мере увеличения заряда ядра увеличивается сила притяжения электронов к ядру, что вызывает уменьшение радиуса атома. Например, при переходе от лития к фтору заряд ядра атома растет от `3` до `9`, а радиус атома постепенно уменьшается – от `0,152` до `0,064` нм. Согласно закону Кулона, притя-жение электронов ядром в пределах периода слева направо увеличивается, а, следовательно, уменьшается способность атомов элементов отдавать электроны, то есть проявлять восстановительные (металлические) свойства.2)` способность отдавать электроны или присоединять их до полного заполнения электронного слоя примерно одинакова. У атома кислорода преобладает стремление к присоединению электронов, а фтор вообще не проявляет восстановительных свойств и является единственным элементом, который в химических реакциях не проявляет положительных степеней окисления.
В главных подгруппах с увеличением заряда ядра атома элемента увеличивается радиус атома элемента, так как в этом направлении возрастает число электронных слоев в атоме элемента. Поэтому в главной подгруппе сверху вниз нарастают металлические (восстановительные) свойства элементов.
В побочных подгруппах при переходе от первого элемента ко второму происходит увеличение радиуса атома элемента за счет добавления еще одного электронного слоя, а при переходе от второго элемента к третьему – даже некоторое уменьшение. Это объясняется `f`-(лантаноидным) сжатием.
Поэтому в побочных подгруппах с увеличением заряда ядра уменьшаются металлические свойства (за исключение побочной подгруппы третьей группы).(3+)`.
энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она характеризует восстановительные (металлические) свойства атомов и обычно выражается в электронвольтах `(1 “эВ”=96,485 “кДж”//”моль”)`. В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра и уменьшением радиуса атомов. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
Наименьшее значение энергии ионизации имеют щелочные металлы, поэтому они обладают ярко выраженными металлическими свойствами, наибольшая величина энергии ионизации у инертных газов.
энергия, выделяющаяся при присоединении электрона к нейтральному атому. Характеризует окисли-тельные (неметаллические) свойства атомов. Как и энергия ионизации, обычно выражается в электронвольтах. Наибольшее сродство к электрону – у галогенов, наименьшее – у щелочных металлов.
Самый сильный окислитель из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов `”VII”` группы).6`. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
понятие, позволяющее оценить способность атома оттягивать на себя электронную плотность при образовании химического соединения. Согласно одному из определений (Малликен), электроотрицательность можно определить как полусумму энергии ионизации и сродства к электрону:
`X=(I+E)/2`, эВ.
Относительная ЭО (OЭO) фтора по Полингу принята равной четырём. Наименьшими ОЭО обладают элементы `”IА”` подгруппы `(0,7 – 1,0)`, большими азот и хлор `(3)`, кислород `3,5`) и фтор. ОЭО `d` -элементов лежит в пределах `1,2 – 2,2`, а `f` -элементов `1,1 – 1,2`.
В периодах ЭО растёт, а в группах уменьшается с ростом `”Z”`, то есть растёт от `”Cs”` к `”F”` по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сродство элементов.
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Под степенью окисления понимают условный заряд атома элемента в соединении, вычисленный из предположения, что соединение состоит из ионов и валентные электроны оттянуты к наиболее электроотрицательному атому. Иначе говоря, степень окисления показывает, сколько своих электронов атом отдал (положительная), либо притянул к себе чужих (отрицательная).
Напишите электронную конфигурацию атома фосфора и составьте орбитальную диаграмму его валентного уровня. Определите все его возможные степени окисления. Напишите электронные конфигурации всех его заряженных частиц. Расположите данные частицы в порядке увеличения радиуса.
Фосфор находится в третьем периоде, пятой группе, главной подгруппе. Следовательно, его электронная оболочка состоит из трёх уровней. Валентный уровень состоит из внешних `s`- и `p`-подуровней (на это указывает главная группа). Всего валентных электронов у фосфора пять (номер группы `5`). Конфигурация атома $$ {}_{31}\mathrm{P}1{s}^{2}2{s}^{2}2{p}^{6}3{s}^{2}3{p}^{3}$$
Орбитальная диаграмма валентного уровня:
Для того, чтобы принять конфигурацию благородного газа, фосфор может либо принять `3` электрона (тогда он примет конфигурацию аргона), либо отдать все свои валентные пять электронов (тогда он примет конфигурацию неона).(-3))`.
Неметаллы: простые вещества – свойства неметаллов, история открытия – химия 9 класс
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
КупитьФизические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Периодические свойства элементов
Элементы в периодической таблице расположены в порядке возрастания атомного номера. Все эти элементы демонстрируют несколько других тенденций, и мы можем использовать периодический закон и формирование таблицы, чтобы предсказать их химические, физические и атомные свойства. Понимание этих тенденций достигается путем анализа электронной конфигурации элементов; все элементы предпочитают формирование октетов и будут получать или терять электроны, чтобы сформировать эту стабильную конфигурацию.
Атомный радиус
Мы никогда не сможем определить атомный радиус атома, потому что никогда не бывает нулевой вероятности нахождения электрона и, следовательно, никогда не бывает четкой границы с атомом.Все, что мы можем измерить, – это расстояние между двумя ядрами (межъядерное расстояние). Ковалентный радиус составляет половину расстояния между ядрами двух одинаковых атомов. Ионный радиус составляет половину расстояния между ядрами двух ионов в ионной связи. Расстояние должно быть распределено для меньшего катиона и большего аниона. Металлический радиус составляет половину расстояния между ядрами двух соседних атомов в кристаллической структуре. Благородные газы не учитываются в тенденциях изменения атомных радиусов, потому что экспериментальные значения их атомных радиусов вызывают большие споры.Единицами СИ для измерения атомных радиусов являются нанометр (нм) и пикометр (пм). 1 нм = 1 X 10 -9 м; 13:00 = 1 X 10 -12 м.
Рисунок 1: (слева) ковалентные радиусы, (в центре) ионные радиусы, (справа) металлические радиусы. Любезно предоставлено Джессикой Торнтон (UCD)Чтобы объяснить эту тенденцию, необходимо понять концепцию скрининга и проникновения. Проникновение обычно известно как расстояние, на котором электрон находится от ядра. Экранирование определяется как концепция внутренних электронов, блокирующих внешние электроны от заряда ядра.В рамках этой концепции мы предполагаем, что между внешними электронами нет экранирования и что внутренние электроны экранируют внешние электроны от общего положительного заряда ядра. Чтобы понять степень экранирования и проникновения в атом, ученые придумали эффективный ядерный заряд , \ (Z_ {eff} \). Уравнение для расчета эффективного заряда ядра показано ниже.
\ [Z_ {eff} = Z – S \]
В уравнении S представляет количество внутренних электронов, экранирующих внешние электроны.Студенты могут легко найти S, используя атомный номер благородного газа, который находится на одну точку над элементом. Например, S, которое мы будем использовать для хлора, будет 10 (атомный номер неона). Z – общее количество электронов в атоме. Поскольку мы знаем, что нейтральный атом имеет одинаковое количество протонов и электронов, мы можем использовать атомный номер для определения Z. Например, для хлора значение Z будет равно 17 (атомный номер хлора). Продолжая использовать хлор в качестве примера, 10 внутренних электронов (S) будут экранировать положительный заряд десяти протонов.Следовательно, был бы и эффективный ядерный заряд 17-10 или +7. Эффективный заряд ядра показывает, что ядро притягивает внешние электроны с зарядом +7, и поэтому внешние электроны притягиваются ближе к ядру, и атомные радиусы меньше. Таким образом, чем больше заряд ядра, тем большее притяжение ядра оказывает на внешние электроны и тем меньше атомные радиусы. Напротив, чем меньше заряд ядра, тем меньшее притяжение ядра оказывает на внешние электроны и тем больше атомные радиусы.Кроме того, с увеличением атомного номера увеличивается и эффективный заряд ядра. На рисунке 3 показано влияние эффективного заряда ядра на атомные радиусы.
Рисунок 3: Предоставлено Джессикой Торнтон (UCD)Теперь мы готовы описать тенденцию атомного радиуса в периодической таблице. Слева направо через период увеличивается атомный номер, а затем и эффективный заряд ядра. Поэтому, двигаясь слева направо по периоду, ядро сильнее притягивает внешние электроны, и атомные радиусы уменьшаются.При движении вниз по группе в периодической таблице количество заполненных электронных оболочек увеличивается. В группе валентные электроны сохраняют одинаковый эффективный заряд ядра, но теперь орбитали удалены от ядра. Следовательно, ядро меньше притягивает внешние электроны, а атомные радиусы больше.
Рисунок 4: Предоставлено Джессикой Торнтон (UCD)Теперь мы можем использовать эту концепцию для объяснения различий в атомных радиусах катионов и анионов. Катион – это атом, потерявший один из своих внешних электронов.Катионы имеют меньший радиус, чем атом, из которого они образовались. С потерей электрона положительный ядерный заряд обесценивает отрицательный заряд, создаваемый электронами. Следовательно, положительное ядро притягивает электроны сильнее, а радиус меньше. Анион – это атом, который приобрел внешний электрон. Анионы имеют больший радиус, чем атом, из которого они образовались. Усиление электрона не изменяет заряд ядра, но добавление электрона вызывает уменьшение эффективного заряда ядра.Следовательно, электроны удерживаются более свободно, а радиус атома увеличивается.
Рисунок 5: Предоставлено Джессикой Торнтон (UCD)Энергия ионизации (потенциал ионизации)
Для выталкивания электрона из атома требуется достаточно энергии, чтобы преодолеть магнитное притяжение положительного заряда ядра. Следовательно, энергия ионизации (I.E. или I) – это энергия, необходимая для полного удаления электрона из газообразного атома или иона. Энергия ионизации всегда положительна.
Рисунок 6: Предоставлено Джессикой Торнтон (UCD)Энергия, необходимая для удаления одного валентного электрона, – это первая энергия ионизации, вторая энергия ионизации – это энергия, необходимая для удаления второго валентного электрона, и так далее.- \]
Энергия ионизации увеличивается относительно высокого эффективного заряда. Наивысшую энергию ионизации имеют благородные газы, потому что все они имеют высокий эффективный заряд из-за образования октетов и требуют большого количества энергии для разрушения этой стабильной конфигурации. Наибольшее количество энергии требуется для элементов в правом верхнем углу. Кроме того, элементы в левом углу имеют низкую энергию ионизации, потому что потеря электрона позволяет им иметь конфигурацию благородного газа.Следовательно, для удаления одного из валентных электронов требуется меньше энергии
| Элемент | 1-я | 2-я | 3-я | 4-я | 5-я | 6-я | 7-я |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4562 | |||||
| мг | 738 | 1451 | 7733 | ||||
| Al | 577 | 1817 | 2745 | 11580 | |||
| Si | 786 | 1577 | 3232 | 4356 | 16090 | ||
| п. | 1060 | 1903 | 2912 | 4957 | 6274 | 21270 | |
| S | 999.6 | 2251 | 3361 | 4564 | 7013 | 8496 | 27110 |
| Класс | 1256 | 2297 | 3822 | 5158 | 6542 | 9362 | 11020 |
| Ар | 1520 | 2666 | 3931 | 5771 | 7238 | 8781 | 12000 |
Это энергии ионизации для трех элементов периода.Обратите внимание, как Na после во втором I.E., Mg в третьем I.E., Al в четвертом I.E. и так далее – все они имеют огромное увеличение энергии по сравнению с исходным. Это происходит потому, что текущая конфигурация находилась в стабильном формировании октетов; поэтому для ионизации требуется гораздо большее количество энергии.
Энергия ионизации увеличивается слева направо в течение периода и увеличивается при движении вверх по группе. По мере того, как вы поднимаетесь на группу, энергия ионизации увеличивается, потому что меньше электронов защищает внешние электроны от притяжения ядра.Следовательно, требуется больше энергии, чтобы вывести ядро из строя и удалить электрон. Когда мы перемещаемся по таблице Менделеева слева направо, энергия ионизации увеличивается из-за увеличения эффективного заряда ядра. Это связано с тем, что чем больше эффективный заряд ядра, тем сильнее ядро удерживает электрон и тем больше энергии требуется для его высвобождения.
Рисунок 7: Предоставлено Джессикой Торнтон (UCD)Энергия ионизации – это лишь общее правило. Бывают случаи, когда эта тенденция не подтверждается.Обычно это можно объяснить их электронной конфигурацией. Например, магний имеет более высокую энергию ионизации, чем алюминий. Магний имеет электронную конфигурацию [Ne] 3s2. Магний обладает высокой энергией ионизации, потому что он имеет заполненную 3s-орбиталь, и ему требуется большее количество энергии, чтобы забрать электрон с заполненной орбитали.
Сродство к электрону
Сродство к электрону (E.A.) – это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому. Сродство к электрону можно дополнительно определить как изменение энтальпии в результате присоединения электрона к газообразному атому.- \]
Труднее найти тенденции, описывающие сродство к электрону. Как правило, элементы в правой части таблицы Менделеева имеют большое отрицательное сродство к электрону. Сродство к электрону станет менее отрицательным по мере продвижения от вершины к основанию периодической таблицы. Однако азот, кислород и фтор не следуют этой тенденции. Электронная конфигурация благородных газов будет близка к нулю, потому что они не будут легко получать электроны.
Рисунок 8: Предоставлено Джессикой Торнтон (UCD)
Электроотрицательность
Электроотрицательность – это измерение атома, который борется за электроны в связи.Чем выше электроотрицательность, тем выше его способность приобретать электроны в связи. Электроотрицательность будет важна, когда мы позже определим полярные и неполярные молекулы. Электроотрицательность связана с энергией ионизации и сродством к электрону. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, поскольку их ядра не оказывают сильного притяжения на электроны. Элементы с высокой энергией ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого положительным ядром на отрицательные электроны.Следовательно, электроотрицательность увеличивается снизу вверх и слева направо.
Рисунок 9: Предоставлено Джессией Торнтон (UCD)Металлический персонаж
Металлический символ используется для определения химических свойств металлических элементов. Обычно металлы теряют электроны с образованием катионов. Неметаллы стремятся получить электроны с образованием анионов. Они также обладают высоким окислительным потенциалом, поэтому легко окисляются и являются сильными восстановителями. Металлы также образуют основные оксиды; чем более щелочной является оксид, тем выше металлический характер.
Рис. 10: Предоставлено Джессикой Торнтон (UCD)По мере того, как вы перемещаетесь по таблице слева направо, металлический характер уменьшается, потому что элементы легко принимают электроны для заполнения своих оболочек. Следовательно, эти элементы принимают неметаллический характер образования анионов. По мере продвижения вверх по таблице металлический характер уменьшается из-за того, что ядро сильнее притягивает внешние электроны. Это большее притяжение затрудняет потерю электронов атомами и образование катионов.
Другие тенденции
Точки плавления: Тенденции изменения точек плавления и молекулярной массы бинарных углерод-галогеновых соединений и галогенидов водорода обусловлены межмолекулярными силами. Плавление разрушает расположение атомов в твердом теле, поэтому количество тепла, необходимое для плавления, зависит от силы притяжения между атомами. Эта сила притяжения увеличивается с увеличением количества электронов. Увеличение количества электронов увеличивает связь.
Пример: Точка плавления HF должна составлять приблизительно -145 ° C, исходя из точек плавления HCl, HBr и HI, но наблюдаемое значение составляет -83.6 ° С.
Показатели теплопроводности и электропроводности регулярно меняются в течение периода. Точки плавления могут постепенно увеличиваться или достигать пика внутри группы, а затем в обратном направлении.
Пример: элементы третьего периода Na, Mg и Al являются хорошими проводниками тепла и электричества, тогда как Si – только хороший проводник, а неметаллы P, S, Cl и Ar – плохие проводники.
Редокс-потенциал
Окислительный потенциал
Окисление – это реакция, которая приводит к потере электрона.- \]
Использование в знании периодических свойств элементов
- Предсказание большего или меньшего атомного размера и радиального распределения в нейтральных атомах и ионах
- Измерение и сравнение энергий ионизации
- Сравнение сродства к электрону и электроотрицательности
- Прогнозирование окислительно-восстановительного потенциала
- Сравнение металлического характера с другими элементами; его способность образовывать катионы
- Предсказание того, какая реакция может или не может произойти из-за тенденций
- Определение большего потенциала клеток (суммы окислительного и восстановительного потенциалов) между реакциями
- Завершение химических реакций согласно трендам
Сводка периодических тенденций
Периодическая таблица элементов классифицирует одинаковые элементы вместе.Дмитрий Менделеев, русский ученый, был первым, кто создал общепринятое расположение элементов в 1869 году. Менделеев считал, что, когда элементы расположены в порядке увеличения атомной массы, определенные наборы свойств периодически повторяются. Хотя большинство современных периодических таблиц организовано в восемнадцать групп (столбцов) элементов, в первоначальной периодической таблице Менделеева элементы были организованы в восемь групп и двенадцать периодов (строк).
Рисунок 11: Предоставлено Википедией для публикации этого изображения в общественном достоянииВ периодической таблице элементы с похожими свойствами находятся в одних и тех же группах (по вертикали).Слева направо атомный номер (z) элементов увеличивается от одного периода к следующему (по горизонтали). Группы пронумерованы вверху каждого столбца, а точки слева рядом с каждой строкой. Основными элементами группы являются группы 1, 2 и 13–18. Эти группы содержат элементы, наиболее богатые естественным образом, и являются наиболее важными для жизни. Элементы, заштрихованные в приведенной выше таблице светло-розовым цветом, известны как переходные металлы. Два ряда элементов, начинающихся с z = 58, иногда называют внутренними переходными металлами, и они были извлечены и помещены в нижнюю часть таблицы, потому что они сделали бы таблицу слишком широкой, если бы она оставалась непрерывной.14 элементов, следующих за лантаном (z = 57), называются лантаноидами, а следующие 14 элементов, следующие за актинием (z = 89), называются актинидами.
Элементы периодической таблицы можно разделить на две большие категории: металлы и неметаллы. Большинство металлов являются хорошими проводниками тепла и электричества, пластичны и пластичны, а их температура плавления составляет от умеренной до высокой. В общем, неметаллы не являются проводниками тепла и электричества, представляют собой нелегкие твердые вещества, а многие из них являются газами при комнатной температуре. Как показано в таблице выше, металлы и неметаллы в периодической таблице часто разделены ступенчатой диагональной линией, а несколько элементов рядом с этой линией часто называют металлоидами (Si, Ge, As, Sb, Te и At).Металлоиды – это элементы, которые выглядят как металлы и в некотором смысле ведут себя как металлы, но также обладают некоторыми неметаллическими свойствами. Группа в самом дальнем правом углу таблицы, заштрихованная оранжевым цветом, известна как благородные газы. Благородные газы рассматриваются как особая группа неметаллов.
Щелочные металлы / Щелочноземельные металлы
Щелочные металлы входят в группу 1 периодической таблицы и состоят из лития, натрия, рубидия, цезия и франция. Эти металлы обладают высокой реакционной способностью и образуют ионные соединения (когда неметалл и металл объединяются), а также многие другие соединения.Все щелочные металлы имеют заряд +1 и самые большие размеры атомов, чем любые другие элементы, в каждый из своих периодов.
Щелочноземельные металлы относятся к группе 2 и состоят из бериллия, магния, кальция, стронция, бария и радия. В отличие от щелочных металлов, земные металлы имеют меньший размер атома и не обладают такой реакционной способностью. Эти металлы также могут образовывать ионные и другие соединения и иметь заряд +2.
Переходные металлы
Переходные металлы варьируются от групп IIIB до XIIB в периодической таблице.Эти металлы образуют положительно заряженные ионы, очень твердые и имеют очень высокие температуры плавления и кипения. Переходные металлы также являются хорошими проводниками электричества и пластичны.
Лантаноиды и актиниды
Лантаноиды (показаны в строке ** на диаграмме выше) и актиниды (показаны в строке * на диаграмме выше) образуют блок из двух строк, которые помещены внизу периодической таблицы для проблем с пространством. Они также считаются переходными металлами. Лантаноиды составляют верхний ряд этого блока и представляют собой очень мягкие металлы с высокими температурами кипения и плавления.Актиниды образуют нижний ряд и являются радиоактивными. Они также образуют соединения с большинством неметаллов. Чтобы узнать, почему у этих элементов есть отдельный раздел, посетите страницу электронных конфигураций.
Металлоиды
Как упоминалось во введении, металлоиды расположены вдоль лестницы, отделяющей металлы от неметаллов в периодической таблице. Бор, кремний, германий, мышьяк, сурьма и теллур обладают металлическими и неметаллическими свойствами. Например, кремний имеет металлический блеск, но является хрупким и неэффективным проводником электричества, как неметалл.Поскольку металлоиды обладают сочетанием металлических и неметаллических характеристик, они являются промежуточными проводниками электричества или «полупроводниками».
Галогены
Галогены состоят из пяти неметаллических элементов: фторина, хлора, брома, йода и астата. Они расположены в 17-й группе периодической таблицы и имеют заряд -1. Термин «галоген» означает «солеобразователь», а соединения, содержащие один из галогенов, являются солями. Физические свойства галогенов значительно различаются, поскольку они могут существовать в виде твердых тел, жидкостей и газов при комнатной температуре.Однако в целом галогены очень реакционноспособны, особенно со щелочными и земельными металлами 1 и 2 групп, с которыми они образуют ионные соединения.
Благородные газы
Благородные газы состоят из группы 18 (иногда называемой группой O) периодической таблицы элементов. Благородные газы имеют очень низкие температуры кипения и плавления и являются газами при комнатной температуре. Они также очень инертны, так как у них уже есть полная валентная оболочка с 8 электронами. Следовательно, благородные газы имеют небольшую тенденцию терять или приобретать электроны.
Полезные связи из периодической таблицы
Периодическая таблица элементов полезна для определения зарядов простых одноатомных ионов. Элементы основной группы, отнесенные к группам 1, 2 и 13-18, образуют ионы, они теряют то же количество электронов, что и соответствующий номер группы, в которую они попадают. Например, атомы K (группа 1) теряют один электрон, чтобы стать K + , а атомы Mg (группа 2) теряют два электрона, чтобы сформировать Mg 2 + .Другие элементы основной группы, входящие в группу 13 и выше, образуют более одного возможного иона.
Элементы в группах 3-12 называются переходными элементами или переходными металлами. Подобно элементам основной группы, описанным выше, переходные металлы образуют положительные ионы, но из-за их способности образовывать более двух или более ионов разного заряда связь между номером группы и зарядом отсутствует.
Проблемы
1. Расположите эти элементы в соответствии с уменьшающимся размером атома: Na, C, Sr, Cu, Fr
2.Расположите эти элементы в соответствии с возрастающим отрицательным значением E. A .: Ba, F, Si, Ca, O
3. Расположите эти элементы в соответствии с возрастающим металлическим характером: Li, S, Ag, Cs, Ge
4. Какая реакция, по вашему мнению, будет иметь больший клеточный потенциал?
А) 2Na (тв) + Cl2 (г) → 2NaCl (тв) или 2Cs (тв) + Cl2 (г) → 2RbCl (тв)
B) 2Na (т.) + Cl2 (г) → 2NaCl (т) или Be (т) + Cl2 (г) → BeCl2 (т)
5. Какое уравнение вы ожидаете увидеть?
А) I2 (т.) + 2Br (водн.) → Br2 (л) + 2I (водн.)
B) Cl2 (г) + 2I (водн.) → I2 (т.) + 2Cl (водн.)
ответов
1.Fr, Sr, Cu, Na, C
2. Ba, Ca, Si, O, F
3. Li, S, Ge, Ag, Cs
4. A) Второе уравнение
B) Первое уравнение
5. A) Да
Б) №
Внешние ссылки
- История Периодической таблицы – Часть 1 из 2
- Группы Периодической таблицы
Периодические тенденции
Проблемы
* Выделите ответ: _____, чтобы просмотреть ответы.
1. Элемент, который является примером металлоида, представляет собой (а) S; (б) Zn; (c) Ge; d) Re; (e) ни один из этих
Ответ: (c) Ge
2. В периодической таблице вертикальные (верхние и нижние) столбцы называются (а) периодами; (б) переходы; (c) семьи / группы; (г) металлоиды; (e) ничего из этого.
Ответ: (c) семьи / группы
3. Почему благородные газы инертны (инертны)?
Ответ: Благородные газы инертны, потому что они уже имеют полную валентную электронную оболочку и имеют небольшую тенденцию к получению или потере электронов.
4. Как называются соединения, содержащие галоген?
Ответ: Соли
5. Лантаноиды и актиниды: (а) щелочноземельные металлы; (б) переходные металлы; (в) металлоиды; (d) щелочные металлы; (e) ни один из этих
Ответ: (б) переходные металлы
Список литературы
- Хлопок, F.A .; Уилкинсон, Г. (1988). Продвинутая неорганическая химия (5-е издание). Нью-Йорк: Вили. ISBN 0-471-84997 стр. 1385.
- Хатчинсон, Джон.«Журнал химического образования». Исследования развития концепции в химии (2007). Распечатать. Внешние ссылки
- Веселый, Уильям Л. (1991). Современная неорганическая химия (2-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-07-112651-1.
- Петруччи, Ральф Х. Общая химия. 9 изд. Нью-Джерси: Пирсон Прентис Холл, 2005.
Как устроена Периодическая таблица Менделеева?
В периодической таблице перечислены все известные элементы в порядке возрастания атомного номера, который представляет собой просто количество протонов в ядре.Если бы это было единственным соображением, диаграмма была бы просто линией, но это не так. Облако электронов окружает ядра каждого элемента, обычно по одному на каждый протон. Элементы объединяются с другими элементами и сами с собой, чтобы заполнить свои внешние электронные оболочки в соответствии с правилом октетов, которое указывает, что полная внешняя оболочка – это та, которая имеет восемь электронов. Хотя правило октетов не применяется так строго к более тяжелым элементам, как к более легким, оно все же обеспечивает основу для организации периодической таблицы.
TL; DR (слишком долго; не читал)
В периодической таблице элементы перечислены в порядке возрастания атомного номера. Форма диаграммы, состоящей из семи строк и восьми столбцов, основана на правиле октетов, которое указывает, что элементы комбинируются таким образом, чтобы получить стабильные внешние оболочки из восьми электронов.
Группы и периоды
Наиболее заметной особенностью периодической таблицы является то, что она организована в виде диаграммы с семью строками и восемью столбцами, хотя количество столбцов увеличивается к нижней части диаграммы.Химики называют каждую строку точкой, а каждый столбец – группой. Каждый элемент в периоде имеет одно и то же основное состояние, и элементы становятся менее металлическими при движении слева направо. Элементы в одной группе имеют разные основные состояния, но у них одинаковое количество электронов во внешних оболочках, что придает им схожие химические свойства.
Слева направо наблюдается тенденция к более высокой электроотрицательности, которая является мерой способности атома притягивать электроны.Например, натрий (Na) находится чуть ниже лития (Li) в первой группе, которая входит в состав щелочных металлов. Оба имеют по одному электрону на внешней оболочке, и оба обладают высокой реакционной способностью, стремясь отдать электрон для образования стабильного соединения. Фтор (F) и хлор (Cl) находятся в тех же периодах, что и Li и Na, соответственно, но они находятся в группе 7 на противоположной стороне диаграммы. Они входят в состав галогенидов. Они также очень реактивны, но являются акцепторами электронов.
Элементы группы 8, такие как гелий (He) и неон (Ne), имеют полные внешние оболочки и практически не реагируют.Они образуют особую группу, которую химики называют благородными газами.
Металлы и неметаллы
Тенденция к увеличению электроотрицательности означает, что элементы становятся все более неметаллическими по мере продвижения слева направо по периодической таблице. Металлы легко теряют свои валентные электроны, а неметаллы легко их приобретают. В результате металлы являются хорошими проводниками тепла и электричества, а неметаллы – изоляторами. Металлы являются пластичными и твердыми при комнатной температуре, тогда как неметаллы являются хрупкими и могут существовать в твердом, жидком или газообразном состоянии.
Большинство элементов являются металлами или металлоидами, которые по своим свойствам находятся где-то между металлами и неметаллами. Элементы, имеющие наиболее металлическую природу, расположены в нижней левой части диаграммы. Те, у кого меньше всего металлических качеств, находятся в верхнем правом углу.
Переходные элементы
Большая часть элементов не вписывается в аккуратную схему групп и периодов, которую задумал русский химик Дмитрий Иванович Менделеев (1834–1907), который первым разработал таблицу Менделеева.Эти элементы, известные как переходные элементы, занимают середину таблицы с периодов с 4 по 7 и между группами II и III. Поскольку они могут разделять электроны более чем на одну оболочку, они явно не являются донорами или акцепторами электронов. В эту группу входят такие распространенные металлы, как золото, серебро, железо и медь.
Кроме того, в нижней части периодической таблицы появляются две группы элементов. Их называют соответственно лантаноидами и актинидами. Они там, потому что им не хватает места на графике.Лантаноиды входят в группу 6 и относятся к лантану (La) и гафнию (Hf). Актиниды принадлежат к группе 7 и находятся между актинием (Ac) и резерфордием (Rf).
Радий – Информация об элементе, свойства и использование
Расшифровка:
Химия в своем элементе: радий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе самосветящаяся история элемента номер 88. Вот Брайан Клегг.
Брайан Клегг
В Radium есть что-то восхитительно викторианское. Дело не только в том, что этот радиоактивный элемент был обнаружен в конце викторианской эпохи в 1898 году. Есть еще что-то в его раннем использовании в качестве универсального восстанавливающего средства, которое имеет своеобразное ощущение того времени.Его считали источником энергии и яркости, его включали в зубные пасты и шарлатанские зелья – его даже втирали в кожу головы как средство для восстановления волос.
Но применение радия, которое принесло ему известность, заключалось в его использовании в светящейся в темноте краске. Жуткое синее свечение радия, часто используемое для обеспечения световых индикаторов на часах, переключателях самолетов и циферблатах приборов, считалось безвредным и практичным источником ночного освещения. И только когда несколько рабочих, которые красили светящиеся циферблаты, начали страдать от язв, анемии и рака вокруг рта, стало ясно, что что-то не так.Работницы регулярно доводили свои кисти до точки, облизывая их. Это оставило достаточно радиоактивного остатка во рту, чтобы вызвать повреждение клеток. В конце концов более 100 рабочих умрут от последствий.
Более известной жертвой радия стала его открывшая, дважды лауреат Нобелевской премии Мария Кюри, урожденная Мария Склодовская. Вместе со своим мужем Пьером Мария Кюри изучала уран, минерал из Северной Богемии, содержащий уран. Пичбленда была добыта недалеко от того места, где сейчас находится Яхимов, в Чешской Республике, и после того, как уран был извлечен для использования для окраски керамической глазури и тонирования фотографий, остаточный шлак был сброшен в близлежащий лес.Без урана настуран оказался радиоактивным – фактически, каким бы ни был другой радиоактивный материал, он был гораздо более радиоактивным, чем сам уран.
Мария Кюри написала сестре Бронии: «Излучение, которое я не могу объяснить, исходит от нового химического элемента. Элемент есть, и я должен его найти! Мы уверены!’ Проработав тонны уранового шлака, Кюри определили в оставшемся материале два новых элемента – полоний и радий.Наконец, в 1902 году они выделили радий в его чистой металлической форме. Радий был назван от латинского слова «луч» и оказался самым радиоактивным природным веществом из когда-либо обнаруженных.
Хотя Мария Кюри дожила до 1934 года, ее смерть от апластической анемии почти наверняка была вызвана воздействием радиоактивных материалов, особенно радия. По сей день ее записные книжки и бумаги необходимо хранить в ящиках с свинцовым покрытием и носить с собой защитную одежду, поскольку они остаются радиоактивными.
Радий образуется в естественных условиях при распаде урана, хотя и в очень небольших количествах.Потребовалось много тонн урана, чтобы произвести десятую долю грамма радия, который в конечном итоге извлекли Кюри. Он классифицируется в периодической таблице как щелочноземельный металл – самый тяжелый из ряда – наряду с более привычными металлами, такими как магний и кальций. С атомным номером 88 он имеет четыре природных изотопа с атомным весом 228, 226, 224 и 223, хотя есть еще 21 замечательный искусственный изотоп.
Позже радий сыграет главную роль в качестве источника альфа-частиц – ядер гелия, – которые Резерфорд использовал в 1909 году в лаборатории Кавендиша в Кембридже для стрельбы по тонкой золотой фольге.Радий распадается на радон, выбрасывая альфа-частицу из своего ядра. Неожиданно помощники Резерфорда Ханс Гейгер и Эрнест Марсден обнаружили, что очень немногие из альфа-частиц отскочили назад – Резерфорд сравнил это с «выстрелом 15-дюймовым снарядом по куску папиросной бумаги, после чего он вернулся и поразил вас». Это поведение использовалось для вывода о существовании компактного плотного ядра в атоме – радий оказался ключом к раскрытию структуры атома.
Основное практическое применение радия – медицина, производство газообразного радона из хлорида радия для использования в лучевой терапии рака.Этот процесс начался еще во времена Марии Кюри. Ранние исследователи обнаружили, что получили ожоги кожи при обращении с радиоактивными материалами, а когда Кюри работали с врачами, они обнаружили, что радиацию можно использовать для уменьшения или даже лечения опухолей. Это стало известно как терапия Кюри, и Сорбонна в Париже открыла лабораторию частично для Кюри, чтобы продолжить ее исследования, а частично для изучения медицинских применений излучения, которая впоследствии стала известна как Радиевый институт.
Если бы вы держали в руке кусок радия, он был бы теплым.Первоначально он был ярко-белым, но при взаимодействии с воздухом он становился черным с образованием нитрида радия. Он останется твердым – радий не плавится до температуры около 700 градусов по Цельсию. Он также будет трескать и плевать на поверхности вашей ладони, когда реагирует с водой на вашей коже с образованием гидроксида радия. Хотя держать радий я бы не рекомендовал. Радий постоянно распадается, производя альфа-частицы, используемые Резерфордом, бета-частицы, которые представляют собой быстрые электроны, и гамма-лучи, такие как рентгеновские лучи высокой энергии, которые будут проходить сквозь вашу плоть, разрушая ДНК и вызывая повреждение клеток.Изотопы радия различаются по периоду полураспада – времени, которое требуется половине молекул в образце для задержки – от 1602 лет для наиболее стабильного изотопа радия 226 до 11½ дней для радия 223.
Это элемент, который необходимо изменить. обращаться с осторожностью. Тем не менее, для любого, кто вырос на детской фантастике, полной лучевых пушек и в мире, где еще были рентгеновские аппараты для проверки размера вашей обуви, это вызывает ностальгическое чувство, которое когда-либо сделает его увлекательным.
Крис Смит
Интересно, будут ли подкастеры следующего века так же говорить о мобильных телефонах, микроволновых печах и МРТ-сканерах.Это был научный писатель из Бристоля Брайан Клегг с историей о радии. На следующей неделе к металлу, способному на ужасную жестокость по отношению к раку.
Кэтрин Хэкстон
В начале 1960-х Барнетт Розенберг проводил эксперименты на бактериях, измеряя влияние электрического тока на рост клеток. Бактерии E.coli были аномально длинными во время эксперимента, что не могло быть связано с электрическим током. Ряд соединений платины образовывался за счет реакции буфера и платинового электрода.Было обнаружено, что цисплатин ингибирует деление клеток, вызывая тем самым рост бактерий, и был протестирован на мышах на предмет противораковых свойств. В настоящее время цисплатин широко используется для лечения злокачественных новообразований эпителия с выдающимися результатами при лечении рака яичек.
Крис Смит
Итак, мы получили E.coli -переросток, виновных в открытии противораковых соединений на основе платины. И вы можете узнать, как все это произошло, с Кэтрин Хэкстон из Кильского университета на следующей неделе «Химия в ее стихии».Я Крис Смит, спасибо, что выслушали, и до свидания на этой неделе.
(промо)
(конец промо)
Периодические свойства элементов
В таблице Менделеева элементы упорядочены по периодическим свойствам, которые представляют собой повторяющиеся тенденции в физических и химических характеристиках. Эти тенденции можно предсказать, просто изучив периодическую таблицу, и их можно объяснить и понять, анализируя электронные конфигурации элементов.Элементы имеют тенденцию приобретать или терять валентные электроны для достижения стабильного формирования октетов. Стабильные октеты наблюдаются в инертных газах или благородных газах VIII Группы Периодической таблицы. Помимо этой деятельности, есть еще два важных направления. Во-первых, электроны добавляются по одному, перемещаясь слева направо через период. По мере того, как это происходит, электроны внешней оболочки испытывают все более сильное ядерное притяжение, поэтому электроны становятся ближе к ядру и более прочно связаны с ним.Во-вторых, двигаясь вниз по столбцу в периодической таблице, внешние электроны становятся менее тесно связанными с ядром. Это происходит потому, что количество заполненных основных энергетических уровней (которые защищают внешние электроны от притяжения к ядру) увеличивается вниз внутри каждой группы. Эти тенденции объясняют наблюдаемую периодичность элементных свойств атомного радиуса, энергии ионизации, сродства к электрону и электроотрицательности.
Атомный радиус
Атомный радиус элемента составляет половину расстояния между центрами двух атомов этого элемента, которые только касаются друг друга.Как правило, атомный радиус уменьшается в течение периода слева направо и увеличивается вниз для данной группы. Атомы с наибольшим атомным радиусом расположены в группе I и в нижней части групп.
Двигаясь слева направо через период, электроны по одному добавляются к внешней энергетической оболочке. Электроны внутри оболочки не могут защитить друг друга от притяжения протонов. Поскольку количество протонов также увеличивается, эффективный заряд ядра увеличивается с течением времени.Это вызывает уменьшение атомного радиуса.
При движении вниз по группе в периодической таблице количество электронов и заполненных электронных оболочек увеличивается, но количество валентных электронов остается прежним. Внешние электроны в группе подвергаются действию одного и того же эффективного ядерного заряда, но электроны находятся дальше от ядра по мере увеличения числа заполненных энергетических оболочек. Следовательно, атомные радиусы увеличиваются.
Энергия ионизации
Энергия ионизации или потенциал ионизации – это энергия, необходимая для полного удаления электрона из газообразного атома или иона.Чем ближе электрон к ядру и прочнее он связан, тем труднее его будет удалить и тем выше будет его энергия ионизации. Первая энергия ионизации – это энергия, необходимая для удаления одного электрона из родительского атома. Вторая энергия ионизации – это энергия, необходимая для удаления второго валентного электрона из одновалентного иона с образованием двухвалентного иона и так далее. Последовательные энергии ионизации увеличиваются. Вторая энергия ионизации всегда больше первой энергии ионизации.Энергия ионизации увеличивается при движении слева направо через период (уменьшение атомного радиуса). Энергия ионизации уменьшается при движении вниз по группе (увеличивая атомный радиус). Элементы группы I имеют низкую энергию ионизации, потому что потеря электрона формирует стабильный октет.
Сродство к электрону
Сродство к электрону отражает способность атома принимать электрон. Это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому. Атомы с более сильным эффективным зарядом ядра имеют большее сродство к электрону.Можно сделать некоторые обобщения относительно сродства к электрону определенных групп в периодической таблице. Элементы группы IIA, щелочноземельные элементы, имеют низкие значения сродства к электрону. Эти элементы относительно стабильны, поскольку они заполняют х подоболочек. Элементы группы VIIA, галогены, обладают высоким сродством к электрону, потому что добавление электрона к атому приводит к полностью заполненной оболочке. Элементы VIII группы, благородные газы, имеют сродство к электрону, близкое к нулю, поскольку каждый атом обладает стабильным октетом и с трудом принимает электрон.Элементы других групп имеют низкое сродство к электрону.
Через некоторое время галоген будет иметь самое высокое сродство к электрону, в то время как благородный газ будет иметь самое низкое сродство к электрону. Сродство к электрону уменьшается при движении вниз по группе, потому что новый электрон будет дальше от ядра большого атома.
Электроотрицательность
Электроотрицательность – это мера притяжения атома электронов в химической связи. Чем выше электроотрицательность атома, тем сильнее его притяжение для связывания электронов.Электроотрицательность связана с энергией ионизации. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, поскольку их ядра не оказывают сильного притяжения на электроны. Элементы с высокими энергиями ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого ядром на электроны. В группе электроотрицательность уменьшается с увеличением атомного номера в результате увеличения расстояния между валентным электроном и ядром (больший атомный радиус).Примером электроположительного (т.е. с низкой электроотрицательностью) элемента является цезий; Примером сильно электроотрицательного элемента является фтор.
Сводка свойств элементов периодической таблицы
Движение влево → вправо
- Уменьшение радиуса атома
- Увеличение энергии ионизации
- Сродство к электрону обычно увеличивается (, кроме Сродство к электрону благородных газов, близкое к нулю)
- Увеличивает электроотрицательность
Перемещение сверху → снизу
- Радиус атома увеличивается на
- Уменьшение энергии ионизации
- Сродство к электрону обычно уменьшается при движении вниз по группе
- Уменьшение электроотрицательности
Элементы Земли
Элементы [элемент]:
Гомогенное химическое вещество, состоящее из атомов одного типа, каждый из которых имеет одинаковое количество протонов в ядре.Каждый элемент обладает определенными свойствами, и атомы разных элементов объединяются, образуя молекулы, которые образуют химические и биологические взаимодействия и управляют ими.
Просмотреть исходный код
Адаптировано из “element.” Merriam-Webster.com. Merriam-Webster, n.d. Интернет. 11 сентября 2015 года. Строительные блоки всего
Что-то, что занимает пространство, имеет массу и обычно может существовать в виде твердого тела, жидкости или газа.
Просмотреть исходный код
. (без даты) Словарь студенческой науки American Heritage®, второе издание.(2014). Получено 7 декабря 2015 г. с http://www.thefreedictionary.com/matter в известной вселенной. На сегодняшний день мы идентифицировали 92 элемента, встречающихся в природе, и мы использовали технологии для синтеза еще 20 элементов. Эти элементы существуют в атмосфере, гидросфере, литосфере и / или биосфере. Вместе они образуют молекулы, составляющие живой и неживой материал, управляют химическими взаимодействиями и обеспечивают основу всех природных ресурсов на планете Земля.
Таблица Менделеева
Таблица, в которой перечислены все известные химические элементы на Земле, упорядоченные в соответствии с их свойствами.Его можно использовать для прогнозирования их реакции с другими элементами.
Просмотреть источник
По материалам «таблицы Менделеева». Merriam-Webster.com. Merriam-Webster, n.d. Интернет. 09 сентября 2015г. (Рисунок 8) организует элементы в группы и выявляет закономерности в их свойствах. В периодической таблице, изображенной на рисунке 8, элементы, известные как металлы, заштрихованы светло-зелено-серым цветом, а неметаллы – оранжевым; те, которые обладают свойствами как металлов, так и неметаллов, называются металлоидами [металлоидами]:
Химический элемент со свойствами между металлами и неметаллами.К ним относятся бор, кремний, германий, мышьяк, сурьма и теллур. Они могут соединяться с металлом с образованием металлического сплава и часто действуют как биологические токсины или питательные вещества, в зависимости от концентрации.
Просмотреть исходный код
Адаптировано из материала “Металлоид”. Википедия. Фонд Викимедиа, без даты. Интернет. 19 января 2016 г. и выделены темно-зеленым.
Наименьшая единица любого элемента называется атомом.
Наименьшая единица элемента, имеющая все характеристики этого элемента и состоящая из очень маленького и плотного центрального ядра, содержащего протоны и нейтроны, окруженного одной или несколькими оболочками вращающихся электронов.Просмотреть исходный код
Адаптировано из “Атом”. (n.d.) Словарь английского языка American Heritage®, пятое издание. (2011). Получено 18 сентября 2015 г. с сайта http://www.thefreedictionary.com/atom. Количество протонов, нейтронов и электронов, которые имеет каждый тип атома, – это то, что придает каждому элементу его уникальные свойства и определяет, как он будет химически взаимодействовать с другими элементами. Они также определяют место каждого элемента в периодической таблице. Первые 92 элемента, перечисленные в периодической таблице, присутствуют на Земле в разном количестве.Многие из этих элементов обладают свойствами, благодаря которым они способствуют поддержанию жизни, производству полезных материалов или обеспечению энергией. Не все 92 элемента необходимы для метаболизма живых организмов. Фактически, только 21 элемент важен для различных форм жизни на Земле (рис. 9).
Некоторые из этих основных элементов требуются в больших количествах и служат основными строительными блоками жизни. Эти элементы, называемые макроэлементами
Любое вещество, такое как углерод, водород или кислород, которое требуется в больших количествах для здорового роста и развития организма.Обычно они поступают с пищей, водой или воздухом.
Просмотреть исходный код
На основе «макроэлементов». (нет данных). Dictionary.com Полный. Получено 11 сентября 2015 г. с веб-сайта Dictionary.com: http://dictionary.reference.com/browse/macronutrient, включает углерод (C), водород (H + ) и кислород (O 2-), и элементы, необходимые в наибольшем количестве. Более 93% биомассы растений и животных состоит из этих трех элементов. Другие макроэлементы включают азот (N 3 – ), фосфор (P 3 – ), калий (K + ), серу (S 2 – ), кальций (Ca 2 ). + ), железо (Fe 2 + ) и магний (Mg 2 + ).Они необходимы для всех форм жизни, но в меньших количествах, чем C, H и O.
Микроэлементы [микронутриенты]:
Витамины и минералы, которые в незначительных количествах (<100 мг / день) необходимы для роста и здоровья организмов.
Просмотреть исходный код
На основе «микронутриентов». Merriam-Webster.com. Merriam-Webster, n.d. Интернет. 11 сентября 2015г. или следы питательных веществ
Основные пищевые факторы требуются организму лишь в небольших количествах; например, витамины, микроэлементы.Просмотреть исходный код
На основе «микроэлементов». Медицинский словарь Farlex Partner. 2012. Farlex 24 ноября 2015 г. http://medical-dictionary.thefreedictionary.com/trace+nutrient, также необходимы, но требуются только в очень небольших количествах. Обычно они служат сопутствующими факторами
Вещество, такое как ион металла или кофермент, которое должно быть связано с ферментом для функционирования фермента. Кофакторы работают, изменяя форму фермента или участвуя в ферментативной реакции.Просмотреть исходный код
Адаптировано из “cofactor”. Научный словарь American Heritage®. Компания Houghton Mifflin. 30 ноября 2015 г., или молекулы, участвующие в химических реакциях [химическая реакция]:
Процесс, который приводит к превращению одного набора химических веществ в другой.
Просмотреть источник
По материалам «химических реакций». (нет данных) Wikipedia.org. (2014). Получено 20 ноября 2015 г. с сайта http://encyclopedia.thefreedictionary.com/chemical+reactions. Среди микронутриентов медь (Cu 2 + ), цинк (Zn 2 + ), молибден (Mo), бор (B), натрий (Na + ), никель (Ni) и хлорид. (Классы – ).
В атмосферных условиях Земли многие элементы находятся в форме, обладающей электрическим зарядом, и называются ионами.
Электрически заряженные атомы, которые приобрели или потеряли электроны, придавая им положительный (катион) или отрицательный (анион) заряд.
. Ионы электрически заряжены, потому что у них нет равного количества протонов [протонов]:
Стабильная субатомная частица, имеющая положительный электрический заряд и являющаяся частью ядра атома. Его заряд противоположен заряду электрона, но равен по величине.Масса протона в 1836 раз больше массы электрона.
Просмотреть источник
Адаптировано из “Протон”. (без даты) Словарь студенческой науки American Heritage®, второе издание. (2014). Получено 7 декабря 2015 г. с http://www.thefreedictionary.com/proton and Electrons [электрон]:
Отрицательно заряженная субатомная частица, вращающаяся вокруг ядра атома.
. Если у атома такое же количество электронов, как и у протонов, отрицательно заряженные электроны нейтрализуют положительно заряженные протоны, и заряд атома будет нейтральным.Если у атома больше электронов, чем протонов, он будет иметь отрицательный общий итог и называется анионом.
Ион – это атом или молекула с чистым электрическим зарядом из-за неравного количества протонов (положительных частиц) и электронов (отрицательных частиц). Анионы имеют отрицательный заряд, потому что в них больше электронов, чем протонов.
Просмотреть исходный код
Адаптировано из “аниона”. Словарь английского языка American Heritage®, пятое издание. Авторские права © 2011 Издательская компания Houghton Mifflin Harcourt.. Катион
Ион – это атом или молекула с чистым электрическим зарядом из-за неравного количества протонов (положительных частиц) и электронов (отрицательных частиц). Катионы имеют положительный заряд, потому что в них больше протонов, чем электронов.
Просмотр источника
скопировано из «катиона». Википедия. Фонд Викимедиа. Интернет. 18 января 2016 г. протонов больше, чем электронов, что придает ему положительный заряд. Электрические заряды, которыми обладают ионы, позволяют элементу образовывать химические связи [химические связи]: притяжение между атомами, которое позволяет образовывать химические вещества, содержащие два или более атомов.Это могут быть «сильные связи», такие как ионные или ковалентные связи, или «слабые связи», такие как диполь-дипольное взаимодействие, водородная связь или сила дисперсии Лондона. Просмотр источника
Адаптировано из «химических связей». (нет данных) Wikipedia.org. (2014). Получено 20 ноября 2015 г. с сайта http://encyclopedia.thefreedictionary.com/chemical+bonds с другими элементами. Химически связанные элементы образуют соединения [соединение]:
Вещество, состоящее из атомов или ионов двух или более различных элементов в определенных пропорциях, которые нельзя разделить физическими средствами.Соединение обычно имеет свойства, отличные от свойств составляющих его элементов. Соединения могут быть молекулами, солями, интерметаллическими соединениями или комплексами.
См. Источник
http://www.thefreedictionary.com/compound, например вода (H 2 O – два атома водорода [H] в сочетании с одним атомом кислорода [O]), поваренная соль (NaCl) и диоксид углерода (CO 2 ). Эта тенденция соединяться вместе и образовывать более сложные молекулы привела к огромному разнообразию как живых, так и неживых форм материи, которые мы находим на Земле.
Пристальный взгляд
Посмотрите «Атомные приколы», короткий и шутливый фильм, объясняющий типы химических связей.
Группы элементов обладают некоторыми общими свойствами. Например, у металлов есть одно общее свойство: они хорошо проводят электричество, а неметаллы – плохие проводники. Неметаллы имеют тенденцию быть газообразными в атмосферных условиях Земли и, как правило, ионными и имеют тенденцию соединяться вместе, образуя молекулы [молекулы]: Комбинация двух или более атомов, связанных вместе, которые имеют другие качества, чем отдельные атомы.. В приведенном выше примере два элемента, натрий (Na + , катион металла) и хлорид (Cl –, неметаллический анион), будут связываться с образованием соли (NaCl, нейтрально заряженная молекула).
Все природные ресурсы, которые используют люди, состоят из тех же элементов, из которых состоит вся материя Вселенной. Большинство природных ресурсов, таких как деревья, вода, почва, ископаемое топливо и животные, состоят из многих типов элементов, соединенных вместе. Некоторые природные ресурсы, такие как железо, медь, серебро и золото, состоят из отдельных элементов, которые сами по себе встречаются в природе.
В следующем разделе вы узнаете, как некоторые из наиболее важных элементов для жизни на Земле становятся постоянно доступными благодаря естественным биогеохимическим циклам. Вы также узнаете, как человеческое развитие повлияло на баланс этих циклов и какое потенциальное влияние это окажет на природные системы
Вопросы для рассмотрения
Какие элементы составляют воздух, которым вы дышите? Какие элементы входят в вашу любимую еду? Вы бы предпочли жить без золота или без углерода?
Периодическая таблица | Безграничная химия
Периодическая таблица
Таблица Менделеева показывает все элементы и их физические свойства; он устроен на основе атомных номеров и электронных конфигураций.
Цели обучения
Определите общие периодические тенденции, которые можно вывести из периодической таблицы элементов
Основные выводы
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.
- Расположение таблицы Менделеева позволяет нам визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов.Таким образом, все элементы в определенной группе обладают схожими свойствами.
Ключевые термины
- атомный номер : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z .
- группа : Вертикальный столбец в периодической таблице, который обозначает количество электронов валентной оболочки в атоме элемента.
- период : горизонтальная строка в периодической таблице, которая обозначает общее количество электронных оболочек в атоме элемента.
Символы элементов
Периодическая таблица представляет собой сетку 18 X 7, расположенную над меньшим двойным рядом элементов. В периодической таблице перечислены только химические элементы, включая каждый изотоп каждого элемента в одной ячейке. В типичной периодической таблице каждый элемент указан по его символу элемента и атомному номеру. Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой или двумя первыми буквами своего английского названия, но есть некоторые исключения.Два заметных исключения включают серебро и ртуть. Символ серебра – «Ag» от латинского argentum, , что означает «серый» или «сияющий». Символ ртути – «Hg» от латинизированного греческого hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Таблица Менделеева : Таблица Менделеева представляет собой табличное отображение всех химических элементов.Атомы сгруппированы в порядке возрастания атомного номера.
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо. Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семьей).У некоторых групп есть особые названия, такие как галогены или благородные газы. Элементы, относящиеся к одному периоду или группе, имеют схожие свойства.
Определение химических свойств с использованием таблицы Менделеева
Химические свойства каждого элемента определяются его электронной конфигурацией и, в частности, его внешними валентными электронами. Расположение элемента в периодической таблице в значительной степени зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой находятся валентные электроны, определяет блок элемента.Кроме того, общее количество электронных оболочек атома определяет, к какому периоду он принадлежит. Из-за своей структуры периодическая таблица стала чрезвычайно полезным инструментом для оценки и прогнозирования тенденций изменения содержания элементов и химии.
Химия 3.1 Введение в периодическую таблицу – YouTube : Введение в периодическую таблицу, в которой металлы, неметаллы и металлоиды определяются по местоположению, а также сравниваются и сравниваются физические свойства металлов и неметаллов.
Молекулы
Молекулы – это электрически нейтральные соединения, состоящие из нескольких атомов, связанных друг с другом химическими связями.
Цели обучения
Распознавать общие свойства молекул
Основные выводы
Ключевые моменты
- Молекулы нейтральны и не несут заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как в случае кислорода (O 2 ), или из различных элементов, как в случае воды (H 2 O).
- Геометрия и состав молекулы определяют ее химические и физические свойства.
- Изомеры – это молекулы с одинаковыми атомами в разном геометрическом расположении.
Ключевые термины
- ковалентный : когда 2 или более неметаллических атома связаны вместе за счет общих электронов.
- изомер : молекулы с одинаковым числом атомов в разных геометрических формах.
- соединение : когда два или более разных атома удерживаются вместе ковалентной связью.Все соединения являются молекулами, но не все молекулы являются соединениями.
- молекула : два или более атома, которые удерживаются вместе химической ковалентной связью.
Атомы и молекулы
Атом определяется как основная единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, этот новый объект известен как молекула. Слово «молекула» – это расплывчатый термин, который в разговорной речи имеет разные значения в разных областях исследований.Например, термин «молекулы» используется в кинетической теории газов и относится к любой газовой частице независимо от ее состава.
Чаще всего термин «молекулы» относится к нескольким атомам; молекула может состоять из одного химического элемента, например кислорода (O 2 ), или из нескольких элементов, таких как вода (H 2 O). Молекулы нейтральны и не несут заряда; это свойство отличает их от многоатомных ионов, например нитрата (NO 3 – ).
молекула кофеина : Кофеин – сложная молекула, состоящая из множества атомов, связанных друг с другом определенным образом.
Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом. Самая маленькая молекула – двухатомный водород (H 2 ) с длиной связи 0,74 ангстрем. Макромолекулы – это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам.Некоторые макромолекулы можно наблюдать с помощью специализированных микроскопов.
Часто состав соединения также может быть обозначен эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную молекулу, о которой идет речь, поскольку она дает только соотношение ее элементов. Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов в молекуле.
Пример
- C 6 H 12 O 6 = молекулярная формула глюкозы
- CH 2 O = эмпирическая (упрощенное соотношение) формула для глюкозы
Изомеры
Изомеры – это молекулы с одними и теми же атомами в разном геометрическом расположении. Из-за такого разного расположения изомеры часто имеют очень разные химические и физические свойства. На рисунке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол является обычным бытовым спиртом.
структурные изомеры пропанола : Химическая формула пропанола (C 3 H 7 OH) описывает несколько различных молекул, которые различаются положением спирта (OH). Каждая молекула является структурным изомером другой.
Ионы
Ион – это атом или молекула, которые имеют чистый электрический заряд, потому что их общее количество электронов не равно количеству протонов.
Цели обучения
Сравните разные классы ионов
Основные выводы
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов.Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицательный и называется анионом.
- Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
- Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, отталкивающих друг друга.
Ключевые термины
- ион : атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- анион : отрицательно заряженные ионы, потому что у них больше электронов, чем протонов.
- катион : ионы, которые заряжены положительно, потому что у них больше протонов, чем электронов.
Атом – это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, окруженного облаком отрицательно заряженных электронов.Если в атоме одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет чистый электрический заряд.
Любой атом или молекула с чистым зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; Ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен количеству протонов минус количество электронов.
Ионы являются высокоактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Ионы в жидком или твердом состоянии образуются при взаимодействии солей со своими растворителями. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
Типы ионов
Есть специализированные типы ионов. Анионы имеют больше электронов, чем протонов, и поэтому имеют отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют чистый положительный заряд.Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно больше, чем исходная молекула или атом, потому что избыточные электроны отталкиваются друг от друга и увеличивают физический размер электронного облака. Катионы обычно меньше их родительского атома или молекулы из-за меньшего размера их электронных облаков.
Ионы водорода : показана взаимосвязь между молекулой, ее катионом и анионом.
Ион обозначается путем написания его отрицательного заряда в верхнем индексе сразу после химической структуры атома / молекулы. Обычно размер нетто записывается с величиной перед знаком; величина однозарядных молекул / атомов обычно не указывается. Одноатомные ионы иногда также представлены римскими цифрами, которые обозначают формальную степень окисления элемента, тогда как цифры с надстрочным индексом обозначают чистый заряд. Например, Fe 2+ можно обозначать как Fe (II).Эти представления можно рассматривать как эквивалентные для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Формирующие ионы
Ионы могут быть образованы в результате ионизации, которая представляет собой процесс потери или приобретения нейтральным атомом электронов. Обычно электроны либо добавляются, либо теряются на валентной оболочке атома; электроны внутренней оболочки более тесно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, согласно которому наиболее стабильные атомы и ионы имеют восемь электронов на своей внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут быть образованы, как правило, за счет приобретения или потери элементарных ионов, таких как H + , в нейтральных молекулах. Многоатомные ионы обычно очень нестабильны и реакционны.
Типичный пример иона – Na + . У натрия есть заряд +1, потому что у натрия одиннадцать электронов. Однако, согласно правилу октетов, натрий был бы более стабильным с 10 электронами (2 в самой внутренней оболочке, 8 в самой внешней оболочке). Следовательно, натрий имеет тенденцию терять электрон, чтобы стать более стабильным. С другой стороны, хлор имеет тенденцию приобретать электрон, чтобы стать Cl –. Хлор, естественно, имеет 17 электронов, но он был бы более стабильным с 18 электронами (2 в самой внутренней оболочке, 8 во второй оболочке и 8 в валентной оболочке).Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Periodic Properties: Part 3, Ionic Radius, Predicting Ionic Charges – YouTube : Продолжение обсуждения периодических свойств, включая ионный радиус и способы прогнозирования ионных зарядов.
границ | Стекло: обитель периодической таблицы
Введение
Стекло известно человечеству более 5000 лет и является одним из самых распространенных материалов в современной жизни.Несмотря на свою долгую историю, стекло остается одним из самых интересных объектов для изучения в области неорганического материаловедения. Благодаря работе исследователей со всего мира и разнообразию химических элементов, собранных в Периодической таблице, каждый год создаются новые составы стекла и методы обработки, создавая новые материалы для развития жизненно важных и устойчивых технологий. Согласно теоретическим расчетам, количество возможных составов стекол настолько велико, что для синтеза всех составов потребуется количество атомов, близкое к максимальному теоретическому содержанию атомов во всей Вселенной (Zanotto and Coutinho, 2004).Понимая важность стекольной науки и техники, Д. И. Менделеев сам активно занимался разработкой новых материалов на его основе, основные его результаты отражены в его книге 1864 года «Стекольное производство» (Менделеев, 1864).
В этой статье, посвященной недавней годовщине Периодической таблицы химических элементов, мы кратко описываем, как большой класс стекол может быть классифицирован по группам химических элементов Периодической таблицы, и даем взгляд на перспективные разработки в стекло, что делает его одним из самых перспективных материалов нашего времени.
Стеклянные семейства и их место в Периодической таблице
Как упоминалось выше, почти все элементы Периодической таблицы могут быть использованы для производства стекла, что делает его своеобразным «домом» для всех элементов. В зависимости от типа химических соединений, образующих стекла, они делятся на классы, каждый из которых имеет уникальную структуру и свойства, определяющие их применение.
Самый распространенный класс стекол – это оксидные стекла. Они образованы структурными единицами, которые представляют собой соединения различных элементов с кислородом.К этим элементам в первую очередь относятся Si, Ge, B, P, As, их оксиды легко получить в стеклообразном состоянии, и большинство стекол производится на их основе. Кроме того, оксиды Te, Ti, Se, Sb, Mo, W, Bi, Al, Ga, V и других элементов могут действовать как стеклообразующие агенты либо по отдельности, либо в смеси с другими оксидами. В зависимости от типа основного стеклообразующего оксида происходит название группы стекол – силикатные, фосфатные, теллуритные и др.
Особое место среди оксидных стекол занимает плавленый кварц или кварцевое стекло (SiO 2 ).Это наиболее тугоплавкое стекло, оно имеет широкое окно прозрачности в оптической области и аномально низкий коэффициент теплового расширения (КТР), равный 5,5 · 10 −7 / K −1 (LeLosq et al., 2019 ). Это определяет его широкий спектр применения – от УФ-ламп до оптических элементов. Благодаря развитию технологии кварцевого стекла и производству оптических волокон стало возможным глобальное внедрение широкополосного доступа в Интернет (Ballato and Dragic, 2016).
Силикатные стекла, в состав которых входят оксиды различных химических элементов от 1 до 17 групп, являются наиболее обширной группой стекол. Помимо Si и O, важнейшими элементами силикатных стекол являются щелочные (Li, Na, K) и щелочноземельные (Mg, Ca, Sr, Ba) металлы, а также элементы Al и B. Благодаря высокой прозрачности, Приемлемая прочность и относительно невысокая стоимость производства, изделия из силикатного стекла присутствуют во всех сферах жизнедеятельности человека: строительстве и транспорте, хранении изделий, станках и многом другом.Ионообменная технология, включающая замену мелких ионов металлов на более крупные в поверхностном слое силикатных стекол, позволяет значительно повысить прочность стекла, которое используется для создания гибких мобильных устройств (Mauro, Morten, 2016). На основе силикатных стекол и различных тонкопленочных слоев разработаны умные очки. Технология умного стекла позволяет изготавливать устройства на основе стекла для управления проходящим светом. Это может значительно снизить энергопотребление здания за счет улучшения внутренней среды (Rezaei et al., 2017). Введение в состав стекла различных химических элементов (в основном переходных, редкоземельных и благородных металлов) приводит к окрашиванию стекол. Для производства очков можно использовать даже элементы группы актинидов. Так, U 2 O 3 давно используется для производства посуды, украшений и оптических фильтров, поскольку ионы U придают стеклу ярко-зеленый цвет (Strahan, 2001). В настоящее время способность силикатных стекол содержать радиоактивные элементы (U, Pu) используется для захоронения радиоактивных отходов в технологии стеклования (Gin et al., 2013). При необходимости некоторые элементы можно даже перевести в радиоактивное состояние в очках, создав таким образом радиофармпрепараты. Так, стеклянные микросферы с изотопом Y 90 для лечения рака печени получают с использованием стекла Y 2 O 3 -Al 2 O 3 -SiO 2 (Ehrhardt and Day, 1987; Sigaev et al. др., 2012). Более того, используя силикатные стекла, содержащие оксиды Al, Li, Mg, Ca, Ti, Zr, P и другие элементы, стеклокерамика может быть получена с помощью процедуры объемной ядерно-ядерной кристаллизации.Стеклокерамика демонстрирует различные комбинации свойств [высокая прочность, нулевая пористость, точно регулируемый коэффициент теплового расширения (КТР), включая близкие к нулю значения, биосовместимость и т. Д.] И находит применение в различных областях от медицины до астрономии (Zanotto, 2010).
Промышленное производство некремнеземных стекол менее распространено. Между тем новые задачи в науке и технике приводят к разработке таких очков. Стекла на основе ТеО 2 имеют повышенный показатель преломления (> 2.0) и используются в сложных оптических устройствах видимого и ближнего ИК-диапазона. Стекла на основе GeO 2 активно исследуются для создания новых оптических и лазерных компонентов (Сигаев и др., 2011; Старобор и др., 2016). Боратные стекла (на основе B 2 O 3 ) с добавками различных оксидов используются в медицине для восстановления мягких тканей, в оптике и фотонике (Lorenzi et al., 2018; Feller, 2019). Фосфатные стекла (на основе P 2 O 5 ), содержащие оксиды редкоземельных элементов (Nd, Eu, Tb, Er, Yb), используются в промышленности для производства активных элементов мощных лазеров (Campbell и Suratwala). , 2000).Фосфатные и боратные стекла с добавками оксидов Zn, Sn, B, Al, Na, K широко используются для: герметизации материалов с различными значениями CTE, биомедицинских приложений и разработки твердых электролитов для батарей нового поколения (Muñoz et al. др., 2019).
Стекла, образованные элементами группы 16 (S, Se, Te) вместе с элементами группы 14 и 15 (Ge, Sn, P, As, Sb), относятся к классу халькогенидных стекол. Эти стекла обладают сверхвысокой прозрачностью в ИК-диапазоне (до 25 мкм), что определяет их использование в качестве устройств формирования ИК-изображений в тепловизорах нового поколения, оптических сенсорах для ИК-спектроскопии и активных элементах волоконных СО 2 лазеров (Hubert et al., 2011).
К классу галогенидных стекол относятся материалы на основе элементов 17 группы (прежде всего F, а также Cl, Br, I) в сочетании с металлами (Be, Zr, Hf, Ba, La, Al, Y). Наиболее изученным составом стекла является ZBLAN (в системе ZrF 4 -BaF 2 -LaF 3 -AlF 3 -NaF). Производство таких стекол осложняется их высокой склонностью к кристаллизации и чрезвычайно высокими требованиями к степени чистоты сырья. Однако исследования в этой области оправданы возможностью получения оптических волокон с минимальными оптическими потерями, которые могут обеспечить значительное (до 100 раз) увеличение скорости передачи данных по сравнению с существующими оптоволоконными кабелями и открыть путь для нового поколения кабелей ближнего действия. -IR волоконных лазеров (Wetenkamp et al., 1992; Clare et al., 2019). Стоит отметить, что исследователи установили возможность получения бездефектного волокна из стекла ZBLAN в условиях отсутствия гравитации и в настоящее время проводят эксперименты по получению такого волокна на Международной космической станции (Стародубов и др., 2014).
Металлические стекла – это общее название широкого класса аморфных материалов, состоящих из металлов или сплавов металлов и металлоидов, включая элементы 2-15 групп (наиболее распространены Zr, Ti, Cu, Ni, Be, Mg, Fe, Co и др.). Металлические стекла имеют высокую тенденцию к кристаллизации, которую можно преодолеть с помощью необычно высоких скоростей охлаждения расплава (от 10 5 до 10 12 ° C / с). Преимуществами металлических стекол перед металлами и металлическими сплавами являются высокие значения механической прочности, коррозионной стойкости, магнитных свойств и электрического сопротивления. В настоящее время возможно производство не только металлических стекол в виде тонких пластин, но и объемных изделий со сложной морфологией поверхности (Greer, 1995; Schroers, 2013).
Таким образом, почти все элементы Периодической таблицы в различных соотношениях и соединениях могут входить в состав стекла, изменяя его структуру и придавая материалу уникальные свойства. Обилие вариаций в составе и методах производства стекла открывает новые направления его использования в перспективных областях оптики, медицины, фотоники, энергетики и многих других.
Прямая лазерная запись на стекле и перераспределение элементов
Помимо изменения химического состава стекла, методы постобработки являются важными технологиями для создания материалов с заданными свойствами.Используя методы ионного обмена и поверхностных покрытий, можно создавать высокопрочные и энергоэффективные материалы с заданными оптическими свойствами. Сразу же возможность микро- и даже наноразмерного управления свойствами стекла открывает ранее невозможные пути для разработки новых материалов и устройств. В связи с интенсивным развитием фемтосекундной лазерной технологии появилось широкое поле исследований взаимодействия ультракоротких лазерных импульсов со стеклами. Благодаря многофотонному механизму энергия сфокусированных ультракоротких лазерных импульсов поглощается стеклом в зоне фокусировки.В этой области интенсивность лазера превышает значения 10 13 Вт / см 2 , что приводит к модификации структуры стекла. Нелинейный характер поглощения ультракоротких импульсов позволяет управлять пространственным положением модифицированных областей в объеме стекла, что открывает перспективы для их трехмерной (3D) модификации на микро- и наномасштабах за счет такового так называемая техника прямой лазерной записи (DLW) (Osellame et al., 2012; Sugioka and Cheng, 2014; Phillips et al., 2015).
В последние годы исследования DLW различных структур в стеклах выявили широкий спектр явлений, которые происходят, когда материал поглощает ультракороткие импульсы. К ним относятся локальные изменения показателя преломления и записи оптических волноводов (Phillips et al., 2015), формирование поверхностных и объемных двулучепреломляющих нанопериодических структур (нанорешеток) (Shimotsuma et al., 2003; Lotarev et al., 2019a), образование микро- и нанопузырьков (Bellouard, Hongler, 2011), локальная кристаллизация нелинейных фаз в стекле (Липатиев и др., 2018b, 2020; Лотарев и др., 2019б), осаждение металлических кластеров, наночастиц и полупроводниковых квантовых точек (Marquestaut et al., 2014; Шахгильдян и др., 2018; Ветчинников и др., 2018; Hu et al., 2019). Несмотря на физическую природу процессов взаимодействия лазерных импульсов со стеклом, они приводят к локальному изменению химического состава стекла за счет миграции ионов в разные участки зоны воздействия лазера. Согласно последним исследованиям, ионы модификатора стекла (Na, K, Mg, Ca, Sr, Ba, Zr) наиболее подвержены миграции.При наблюдении в плоскости, перпендикулярной лазерному лучу, такие ионы мигрируют к периферии зоны воздействия лазера, а стеклообразующие ионы имеют тенденцию концентрироваться в центре (Fernandez et al., 2018; Lotarev et al., 2018). Наиболее перспективным применением DLW в очках является многомерное оптическое хранилище данных с большой емкостью и практически неограниченным сроком службы. Этот метод основан на периодических наноструктурах (нанорешетках), записанных лазером в кварцевом стекле (Shimotsuma et al., 2003). Нанрешетки образованы периодическими нанопористыми областями, чередующимися с твердым стеклом.Они ориентированы перпендикулярно плоскости поляризации записывающего луча и демонстрируют двойное лучепреломление формы, которое можно использовать для кодирования данных (Zhang et al., 2014). Для увеличения скорости записи данных было предложено использовать в качестве носителя вместо кварцевого стекла нанопористое стекло SiO 2 (Федотов и др., 2018; Липатиев и др., 2018а). При этом двулучепреломляющие субмикронные полые полости формировались под действием сверхбыстрых лазерных импульсов. Вышеупомянутые многообещающие результаты послужили основой для запуска проектов прикладных исследований, направленных на создание технологии оптической памяти на основе стекла.Первый подобный проект был запущен в Университете Менделеева в России (Проект «Кварц») Лотарев (2017), следующий в лабораториях Microsoft (Проект «Силика») Project Silica (2017).
Таким образом, используя различные комбинации химических элементов для производства стекла и методы лазерной обработки, можно создавать новые материалы и устройства для широкого спектра применений. Прежде всего, это безопасное хранилище данных, а также элементы интегральных фотонных схем (волноводы, интерферометры, переключатели), оптические датчики, микрофлюидные устройства и многое другое.Процессы, происходящие при взаимодействии фемтосекундного лазерного излучения со стеклом, в большинстве случаев приводят к локальному изменению его химического состава и миграции химических элементов в определенные зоны, ограниченные лазерным пятном, что во многом определяет измененные свойства образующейся области. . В то же время возможность точной настройки состава стекла на этапе производства позволяет обеспечить наиболее эффективный поток процессов ЛСО.
Вечная и миниатюрная периодическая таблица
Чтобы символически обозначить возможность использования почти всех элементов Периодической таблицы в стекле, мы вписали цветное изображение в поляризованном свете Периодической таблицы в объем имеющегося в продаже кварцевого стекла типа КУ-1 (TechnoQuartz Ltd., Россия) методом DLW. Эта технология записи основана на свойствах двойного лучепреломления лазерно-индуцированных нанорешеток и напряжения, благодаря которым можно изменять длину волны света, проходящего через поляризатор и анализатор света (Spring et al., 2010; Sun et al., 2020 ).
В этой работе Периодическая таблица была записана в образце кварцевого стекла толщиной 10 мм на глубине 900 микрон от поверхности лазерным лучом, сфокусированным с помощью линзы Mitutoyo MPlan APO 5X (N.A. = 0,14). Мы использовали фемтосекундный лазер Pharos 6 Вт (Light Conversion Dev.) с центральной длиной волны 1030 нм. Чтобы контролировать цвет клеток через их двойное лучепреломление в Периодической таблице, меняли энергию лазерных импульсов, количество слоев и расстояние между ними. Скорость сканирования лазерного луча составляла 2 мм / с. Условия записи определенных групп элементов показаны в таблице 1. Следует отметить, что таблица 1 представляет фактический межслойный сдвиг, тогда как соответствующий сдвиг образца во время записи Периодической таблицы был равен этим значениям, деленным на 1.45 с учетом преломления, поскольку показатель преломления кварцевого стекла составляет 1,45 на длине волны 1030 нм. Названия элементов были написаны с использованием более жесткой фокусировки лазерного луча с помощью линзы Olympus LCPLNIR 20X (N.A. = 0,45) и с относительным поворотом плоскости поляризации лазерного луча на 45 °.
Таблица 1 . Условия записи DLW Периодической таблицы в образце кварцевого стекла.
Фотография образца стекла с написанной Таблицей представлена на рисунке 1а.Общий размер стола 3,6 × 2,4 мм. Чтобы увидеть Таблицу в цвете, необходимо наблюдать ее через микроскоп со скрещенными поляризаторами (Рисунок 1b), в то время как изображение Таблицы без скрещенных поляризаторов показано на Рисунке 1c. Размер каждой ячейки Таблицы составляет 200 × 200 мкм. Отжиг образца стекла с письменной таблицей при 900 ° C в течение 1 ч не приводит к заметной деградации изображения, тем не менее, его цвет немного изменился из-за релаксации лазерного напряжения. После многократных термоударов (быстрое охлаждение от 900 ° С до холодной воды) образец стекла с написанной Таблицей полностью сохраняет свою целостность.Благодаря высокой химической и радиационной стойкости кварцевого стекла написанное изображение также не подвергается деградации под воздействием влаги, кислот, щелочей и радиационного воздействия (в пределах устойчивости кварцевого стекла). Таким образом, с одной стороны, стекло можно производить, используя почти все элементы Периодической таблицы, а с другой, благодаря методу DLW, стекло становится вечным хранилищем Периодической таблицы.
Рис. 1. (a) Изображение образца кварцевого стекла в реальном размере с периодической таблицей, записанной лазером; (b, c) Изображение лазера с периодической таблицей, полученное с помощью оптического микроскопа в образце кварцевого стекла, полученное с использованием и без скрещенных поляризаторов, соответственно.Длина одной ячейки 200 мкм.
Обсуждение и заключение
Несмотря на долгую историю, сегодня стекло – важнейший класс материалов, востребованных в различных отраслях промышленности. Многообразие свойств и применений стекла связано с невообразимо большим количеством возможных составов – комбинаций различных химических элементов. Новые возможности для создания материалов на основе стекла с уникальными свойствами открывают методы лазерной модификации, позволяющие создавать в объеме стекла различные многофункциональные конструкции и объекты.
В честь 150-летия Периодической таблицы химических элементов мы показали возможность создания цветного изображения Периодической таблицы элементов в кварцевом стекле с использованием технологии прямой лазерной записи. Это изображение занимает площадь 3,6 × 2,4 мм, при этом размер каждой ячейки таблицы составляет 200 × 200 мкм. Отжиг образца стекла с письменной таблицей при 900 ° C в течение 1 ч не приводит к заметной деградации изображения. После многократных термоударов образца стекла Стол полностью сохраняет свою целостность.Благодаря высокой химической и радиационной стойкости кварцевого стекла написанное изображение также не подвергается деградации под воздействием влаги, кислот, щелочей и радиационного воздействия (в пределах устойчивости кварцевого стекла). Поэтому созданный имидж Таблицы можно считать вечным.
Таким образом, мы хотим показать, что, с одной стороны, стекло можно производить, используя почти все элементы Периодической таблицы, а с другой, что благодаря методу DLW стекло становится вечным хранилищем Периодической таблицы.Этими выводами мы хотим подчеркнуть важность развития исследований в области стеклообразных материалов, которые, благодаря разнообразию элементов Периодической таблицы Менделеева и использованию новых технологий, обеспечивают постоянно ускоряющееся развитие материаловедения. приборно-информационная база человечества.
Заявление о доступности данных
Наборы данных, созданные для этого исследования, доступны по запросу соответствующему автору.
Авторские взносы
GS, AL, SL и VS внесли свой вклад в концепцию и дизайн исследования.Экспериментальные работы проводились AL и SF (программирование, моделирование и лазерная запись) под руководством SL и VS. GS написал рукопись и подготовил изображения с участием AL, SL и VS в определенных разделах. Все авторы участвовали в анализе и обсуждении полученных результатов.
Финансирование
Работа поддержана грантом Менделеевского университета, проект № 2020-020.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Баллато Дж. И Драгич П. (2016). Стекло: носитель света – краткая история оптического волокна. Внутр. J. Appl. Glass Sci. 7, 413–422. DOI: 10.1111 / ijag.12239
CrossRef Полный текст | Google Scholar
Кэмпбелл, Дж. Х., и Суратвала, Т. И. (2000). Фосфатные стекла с примесью неодима для лазеров высокой энергии / большой пиковой мощности. J. Non Cryst. Твердые тела 263–264, 318–341. DOI: 10.1016 / S0022-3093 (99) 00645-6
CrossRef Полный текст | Google Scholar
Клэр, А.Г., Вахтель, П. Ф., Масгрейвс, Дж. Д. (2019). «Галогенидные стекла», в Springer Handbook of Glass , ред. J. D. Musgraves, J. Hu, L. Calvez (Springer International Publishing), 595–616. DOI: 10.1007 / 978-3-319-93728-1_17.
CrossRef Полный текст | Google Scholar
Федотов С.С., Охримчук А.Г., Липатьев А.С., Степко А.А., Пиянзина К.И., Шахгильдян Г.Ю. и др. (2018). 3-битная запись информации в нанопористом стекле с помощью одиночной субмикросекундной пачки фемтосекундных импульсов. Опт. Lett. 43: 851. DOI: 10.1364 / ol.43.000851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феллер, С. (2019). «Боратные стекла», в Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 505–524. DOI: 10.1007 / 978-3-319-93728-1_14
CrossRef Полный текст | Google Scholar
Фернандес, Т. Т., Сакакура, М., Итон, С. М., Сотилло, Б., Сигел, Дж., Солис, Дж. И др. (2018). Изготовленные на заказ фотонные устройства, использующие сверхбыструю миграцию ионов в очках, управляемую лазером. Progr. Матер. Sci. 94, 68–113. DOI: 10.1016 / j.pmatsci.2017.12.002
CrossRef Полный текст | Google Scholar
Gin, S., Abdelouas, A., Criscenti, L.J., Ebert, W. L., Ferrand, K., Geisler, T., et al. (2013). Международная инициатива по долгосрочному поведению высокоактивных ядерных отходов стекла. Mater. Сегодня 16, 243–248. DOI: 10.1016 / j.mattod.2013.06.008
CrossRef Полный текст | Google Scholar
Ху, Ю., Чжан, В., Е, Ю., Чжао, З., и Лю С. (2019). Выделение фемтосекундным лазером нанокристаллов перовскита CsPbBr3 в стеклах для преобразования солнечного спектра. ACS Appl. Nano Mater. 3, 850–857. DOI: 10.1021 / acsanm.9b02362
CrossRef Полный текст | Google Scholar
Хьюбер, М., Делезир, Г., Монье, Дж., Годарт, К., Ма, Х. Л., Чжан, X. Х. и др. (2011). Новаторский подход к разработке высокоэффективных халькогенидных стекол и стеклокерамики, прозрачных в инфракрасном диапазоне. Opticsexpress 19, 23513–23522.DOI: 10.1364 / OE.19.023513
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ЛеЛоск К., Чиккони М. Р., Гривз Г. Н. и Невилл Д. Р. (2019). «Силикатные стекла», в Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 441–503. DOI: 10.1007 / 978-3-319-93728-1_13
CrossRef Полный текст | Google Scholar
Липатьев А.С., Федотов С.С., Охримчук А.Г., Лотарев С.В., Васецкий А.М., Степко А.А. и др.(2018a). Многоуровневая запись данных в нанопористое стекло несколькими фемтосекундными лазерными импульсами. Заявл. Опт. 57, 978–982. DOI: 10.1364 / АО.57.000978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Липатьев А.С., Лотарев С.В., Смаев М.П., Липатева Т.О., Каратеев И.А., Пресняков М.Ю. и др. (2020). Пространственно-селективная кристаллизация стекла оптическим вихревым пучком. CrystEngComm 22, 430–434. DOI: 10.1039 / c9ce01869g
CrossRef Полный текст | Google Scholar
Липатьев, А.С., Моисеев И.А., Лотарев С.В., Липатева Т.О., Пресняков М.Ю., Федотов С.С. и др. (2018b). Рост треков монокристалла фресноита внутри стекла с использованием фемтосекундного лазерного луча с последующей термообработкой. Кристалл. Рост Des. 18, 7183–7190. DOI: 10.1021 / acs.cgd.8b01358
CrossRef Полный текст | Google Scholar
Лоренци Р., Голубев Н. В., Зяйтдинова М. З., Яр, ý, В., Бабин, В., Малашкевич, Г. Э. и др. (2018). Радио- и фотолюминесцентные свойства со-легированных Ce / Tb стекол хантитоподобного состава. Опт. Матер. 78, 247–252. DOI: 10.1016 / j.optmat.2018.02.016
CrossRef Полный текст | Google Scholar
Лотарев С., Федотов С., Липатьев А., Пресняков М., Казанский П., Сигаев В. (2018). Световая нанопериодическая модуляция распределения щелочных катионов внутри силикатного стекла. J. Non Cryst. Твердые тела 479, 49–54. DOI: 10.1016 / j.jnoncrysol.2017.10.008
CrossRef Полный текст | Google Scholar
Лотарев, С.В., Федотов, С.С., Курина, А.И., Липатьев, А.С., Сигаев, В.Н. (2019a). Сверхбыстрые лазерно-индуцированные нанорешетки в стеклах из германата натрия. Опт. Lett. 44, 1564–1567. DOI: 10.1364 / ol.44.001564
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лотарев С.В., Липатьев А.С., Липатева Т.О., Федотов С.С., Наумов А.С., Моисеев И.А. и др. (2019b). Сверхбыстрая лазерная остекловывание записанных лазером кристаллических треков в оксидных стеклах. J. Non Cryst.Твердые тела 516, 1–8. DOI: 10.1016 / j.jnoncrysol.2019.04.027
CrossRef Полный текст | Google Scholar
Маркисто, Н., Пети, Ю., Ройон, А., Мунаикс, П., Кардинал, Т., и Каниони, Л. (2014). Формирование трехмерных наночастиц серебра с использованием фемтосекундного лазерного излучения в фосфатных стеклах: аналогия с фотографией. Adv. Функц. Матер. 24, 5824–5832. DOI: 10.1002 / adfm.201401103
CrossRef Полный текст | Google Scholar
Мауро, Дж.К., и Мортен, М. С. (2014). Ультратонкие усиленные очки . Заявка на патент США № 13/961, 211.
.Google Scholar
Менделеев, Д. И. (1864). Производство стекла . Санкт-Петербург: Общественное благо.
Муньос Ф., Рочерулле Дж., Ахмед И. и Ху Л. (2019). «Фосфатные стекла», в Springer Handbook of Glass , ред. Дж. Д. Масгрейвс, Дж. Ху, Л. Кальвез. 553–594. DOI: 10.1007 / 978-3-319-93728-1_16
CrossRef Полный текст | Google Scholar
Оселлам, Р., Серулло, Г., и Рампони, Р., (ред.). (2012). «Фемтосекундная лазерная микрообработка», в Темы прикладной физики (Берлин; Гейдельберг: Springer). DOI: 10.1007 / 978-3-642-23366-1
CrossRef Полный текст | Google Scholar
Филлипс, К. К., Ганди, Х. Х., Мазур, Э., и Сундарам, С. К. (2015). Сверхбыстрая лазерная обработка материалов: обзор. Adv. Опт. Фотоника 7: 684. DOI: 10.1364 / aop.7.000684
CrossRef Полный текст | Google Scholar
Rezaei, S.Д., Шанниграхи, С., и Рамакришна, С. (2017). Обзор традиционных, передовых и интеллектуальных технологий и материалов остекления для улучшения внутренней среды. Solar Energy Mater. Солнечные элементы 159, 26–51. DOI: 10.1016 / j.solmat.2016.08.026
CrossRef Полный текст | Google Scholar
Шахгильдян Г.Ю., Липатьев А.С., Ветчинников М.П., Попова В.В., Лотарев С.В., Голубев Н.В. и др. (2018). Одностадийная микромодификация оптических свойств цинк-фосфатных стекол, легированных серебром, с помощью фемтосекундной прямой лазерной записи. J. Non Cryst. Твердые тела 481, 634–642. DOI: 10.1016 / j.jnoncrysol.2017.12.011
CrossRef Полный текст | Google Scholar
Шимоцума Ю., Казанский П. Г., Цю Дж. И Хирао К. (2003). Самоорганизованные нанорешетки в стекле при облучении ультракороткими световыми импульсами. Phys. Rev. Lett. 91: 247405. DOI: 10.1103 / Physrevlett.91.247405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сигаев В.Н., Атрощенко Г.Н., Савинков В.И., Саркисова П.Д., Бабаевб Г., Лингель К. и др. (2012). Структурная перестройка на обедненной иттрием поверхности иттрийалюмосиликатного стекла, обработанного HCl, для брахитерапии 90 Y-микросферой. Mater. Chem. Phys. 133, 24–28. DOI: 10.1016 / j.matchemphys.2011.12.079
CrossRef Полный текст | Google Scholar
Сигаев В. Н., Голубев Н. В., Игнатьева Е. С., Савинков В. И., Кампионе М., Лоренци Р. и др. (2011). Рост с помощью никеля и селективное легирование шпинелеподобных нанокристаллов оксида галлия в германо-силикатных стеклах для получения широкополосного инфракрасного излучения. Нанотехнологии 23: 15708. DOI: 10.1088 / 0957-4484 / 23/1/015708
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Старобор А. В., Железнов Д. С., Палашов О. В., Савинков В. И., Сигаев В. Н. (2016). Очки Борогерманата для изоляторов Фарадея при большой средней мощности. Опт. Commun. 358, 176–179. DOI: 10.1016 / j.optcom.2015.09.047
CrossRef Полный текст | Google Scholar
Стародубов Д., Мечери С., Миллер Д., Ulmer, C., Willems, P., Ganley, J., et al. (2014). Волокна ZBLAN: от испытаний в условиях невесомости до орбитального производства. Заявл. Инд. Оптика. DOI: 10.1364 / aio.2014.am4a.2
CrossRef Полный текст | Google Scholar
Страхан, Д. (2001). Уран в стекле, глазури и эмали: история, идентификация и обращение. Шпилька. Консерв. 46, 181–195. DOI: 10.1179 / sic.2001.46.3.181
CrossRef Полный текст | Google Scholar
Сугиока, К., Ченг, Ю.(2014). Сверхбыстрые лазеры – надежные инструменты для современной обработки материалов. Light Sci. Прил. 3: e149. DOI: 10.1038 / lsa.2014.30
CrossRef Полный текст | Google Scholar
Сан, К., Ли, Т., Бересна, М., и Брамбилла, Г. (2020). Контроль кумулятивного напряжения, индуцированного лазером, для эффективной обработки плавленого кварца. Sci. Отчет 10: 3819. DOI: 10.1038 / s41598-020-60828-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ветчинников, М.П., Липатьев А.С., Шахгильдян Г.Ю., Голубев Н.В., Игнатьева Е.С., Федотов С.С. и др. (2018). Прямое фемтосекундное лазерное образование квантовых точек CdS внутри силикатного стекла. Опт. Lett. 43, 2519–2522. DOI: 10.1364 / ol.43.002519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wetenkamp, L., West, G.F., and Többen, H. (1992). Оптические свойства стекол ZBLAN, легированных редкоземельными элементами. J. Non Cryst. Твердые тела 140, 35–40. DOI: 10.1016 / s0022-3093 (05) 80737-9
CrossRef Полный текст | Google Scholar
Занотто, Э. Д. (2010). Светлое будущее стеклокерамики. Am. Керамика Соц. Бык. 89, 19–27.
Google Scholar
Занотто, Э. Д., и Коутиньо, Ф. А. Б. (2004). Сколько некристаллических твердых тел можно сделать из всех элементов таблицы Менделеева? J. Non Cryst. Твердые тела 347, 285–288. DOI: 10.1016 / j.jnoncrysol.2004.07.081
CrossRef Полный текст | Google Scholar
Чжан, Дж., Гецявичюс, М., Бересна, М., Казанский, П. Г. (2014). Казалось бы, неограниченное пожизненное хранение данных в наноструктурированном стекле. Phys. Rev. Lett . 112: 033901. DOI: 10.1103 / PhysRevLett.112.033901
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.