Формула воздуха в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Газовый состав воздуха
От уровня моря до высоты около 11000 м (слой тропосферы) газовый состав воздуха практически не изменяется и выглядит следующим образом:
| Вещество | Формула | Объемная доля, % | Массовая доля, % |
|---|---|---|---|
|
Азот |
N2 |
78,08 |
75,5 |
|
Кислород |
O2 |
20,95 |
23,1 |
|
Аргон |
Ar |
0,93 |
1,29 |
|
Углекислый газ |
CO2 |
0,034 |
0,046 |
|
Неон |
Ne |
0,0018 |
0,0014 |
|
Гелий |
He |
0,000524 |
0,000073 |
|
Метан |
CH4 |
0,0002 |
0,000084 |
Криптон |
Kr |
0,0001 |
0,003 |
|
Водород |
H2 |
0,00005 |
0,00008 |
|
Ксенон |
Xe |
0,000008 |
0,00004 |
Воздух в тропосфере практически всегда содержит некоторое количество водяного пара. Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Влажность воздуха зависит от его температуры и высоты над уровнем моря.
Состав воздуха может незначительно меняться в зависимости от географического положения, времени года, времени суток. В крупных городах обычно повышенное содержание углекислого газа. В горах наблюдается более низкое содержание кислорода, из-за того, что кислород тяжелее азота, поэтому его плотность с высотой уменьшается быстрее.
В нижних слоях атмосферы могут содержаться во взвешенном состоянии некоторые количества мелких частиц пыли и золы, которые образуются в процессе горения различных видов топлива или в результате извержения вулканов. С присутствием в воздухе этих высокодисперсных частиц связана окраска солнечных восходов и закатов, обусловленная рассеянием на них солнечных лучей.
Примеры решения задач по теме «формула воздуха»
| Понравился сайт? Расскажи друзьям! | |||
Формула кислорода.
 Периодическая таблица Менделеева – кислород
Периодическая таблица Менделеева – кислородФормула кислорода. Периодическая таблица Менделеева — кислород
Химический элемент кислород находится во втором периоде VI основной группы устаревшей сокращенной версии таблицы Менделеева. По новым стандартам нумерации это 16-я группа. Соответствующее решение было принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — O2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы таблицы Менделеева, к которой относится кислород. Этот элемент отличается от связанных с ним халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всех отличительных черт можно найти, только узнав о структуре и свойствах атома.
Содержание
- 1 Халькогены — родственные кислороду элементы
- 2 Кислород — самый распространенный элемент
- 3 Строение атома кислорода
- 4 Свойства кислорода — химического элемента
- 5 Кислород — простое вещество
- 6 Физические свойства
- 7 Получение кислорода в лаборатории
- 8 Горение
- 9 Получение кислорода в промышленных масштабах
- 10 Химические расчеты по формуле и уравнениям реакций с участием молекул О2
- 11 Роль молекул О2 в природе и жизни человека
- 12 Кислород — идеальный окислитель
Халькогены — родственные кислороду элементы
Атомы с подобными свойствами образуют группу в периодической таблице.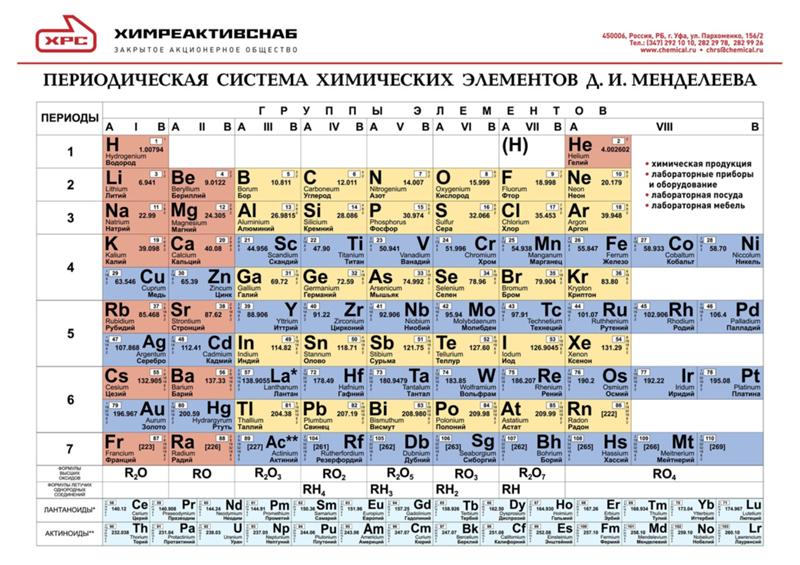 Кислород является прародителем семейства халькогенов, но отличается от них рядом свойств.
Кислород является прародителем семейства халькогенов, но отличается от них рядом свойств.
Атомная масса кислорода — предка группы — составляет 16 а.е.м. Халькогены при образовании соединений с водородом и металлами показывают обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода составляет –2.
Состав типичных водородных соединений халькогенов соответствует общей формуле: h3R. Когда эти вещества растворяются, образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является одновременно очень слабой кислотой и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в сочетании с кислородом и другими неметаллами с высокой электроотрицательностью (EO). Состав оксидов халькогенов отражает общие формулы: RO2, RO3. Соответствующие кислоты имеют следующий состав: h3RO3, h3RO4.
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Кислородная формула — O2. Аллотропной модификацией того же элемента является озон (O3). Обе модификации газовые. Сера и селен — твердые неметаллы. Теллур — неметаллическое вещество, проводник электрического тока, полоний — металл.
Первые три представителя проявляют неметаллические свойства. Кислородная формула — O2. Аллотропной модификацией того же элемента является озон (O3). Обе модификации газовые. Сера и селен — твердые неметаллы. Теллур — неметаллическое вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет около 47% (по весу). Кислород содержится как в свободной форме, так и во многих соединениях. Простое вещество, формула которого — О2, входит в состав атмосферы, составляя 21% воздуха (по объему). Молекулярный кислород растворен в воде, он находится среди частиц почвы.
Мы уже знаем, что существует другой тип существования того же химического элемента в виде простого вещества. Это озон, газ, образующий слой на высоте около 30 км от поверхности земли, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, а также в органические соединения.
Строение атома кислорода
Таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Основной заряд — +8.
- Общее количество электронов 8.
В природе есть три стабильных изотопа, которые имеют одинаковый порядковый номер в периодической таблице, одинаковый состав протонов и электронов, но разное количество нейтронов. Изотопы обозначены одним и тем же символом — О. Для сравнения приведем диаграмму, показывающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
В подслое 2p атома находятся два неспаренных электрона, что объясняет появление степеней окисления -2 и +2. Два парных электрона не могут разделиться, так что степень окисления повышается до +4, как сера и другие халькогены. Причина в отсутствии бесплатного подуровня. Следовательно, в соединениях химический элемент кислород не имеет валентности и степени окисления, равной номеру группы в сокращенной версии периодической системы (6). Его нормальная степень окисления -2.
Его нормальная степень окисления -2.
Только в соединениях с фтором кислород показывает необычную положительную степень окисления +2. Величина ЭО двух сильных неметаллов различна: ЭО (О) = 3,5; EO (F) = 4. Будучи более электроотрицательным химическим элементом, фтор сильнее удерживает свои электроны и притягивает валентные частицы к внешнему энергетическому уровню атома кислорода. Следовательно, в реакции с фтором кислород является восстановителем и отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе экспериментов выделил газ при разложении оксида ртути. Двумя годами ранее К. Шееле получил то же самое вещество в чистом виде. Всего через несколько лет французский химик А. Лавуазье установил, какой газ входит в состав воздуха, и изучил его свойства. Химическая формула кислорода — O2. Отражаем в регистре состава вещества электроны, участвующие в образовании неполярной ковалентной связи — O :: O. Каждую пару связывающих электронов заменяем признаком: O = O. Эта формула кислорода ясно показывает что атомы в молекуле связаны между двумя общими парами электронов.
Эта формула кислорода ясно показывает что атомы в молекуле связаны между двумя общими парами электронов.
Мы выполняем несложные вычисления и определяем, чему равен относительный молекулярный вес кислорода: Mr (O2) = Ar (O) x 2 = 16 x 2 = 32. Для сравнения: Mr (воздух) = 29. Химическая формула l кислорода отличается из формулы озона для атома кислорода. Следовательно, Mr (O3) = Ar (O) x 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при нормальной температуре и атмосферном давлении). Вещество немного тяжелее воздуха; растворим в воде, но в небольших количествах. Температура плавления кислорода отрицательная и составляет -218,3 ° С. Точка, в которой жидкий кислород снова превращается в газообразный, является его температурой кипения. Для молекул O2 эта физическая величина достигает -182,96 ° C. В жидком и твердом состоянии кислород приобретает синий цвет.
Получение кислорода в лаборатории
При нагревании оксигенатов, таких как перманганат калия, образуется бесцветный газ, который можно собрать в колбе или пробирке. Если к чистому кислороду добавить горящий факел, он горит сильнее, чем на воздухе. Два других лабораторных метода получения кислорода — это разложение перекиси водорода и хлората калия (бертолетовой соли). Рассмотрим схему устройства, которое используется для термического разложения.
Если к чистому кислороду добавить горящий факел, он горит сильнее, чем на воздухе. Два других лабораторных метода получения кислорода — это разложение перекиси водорода и хлората калия (бертолетовой соли). Рассмотрим схему устройства, которое используется для термического разложения.
Бертолетную соль насыпать в пробирку или круглодонную колбу, закрыть крышкой с газоотводной трубкой. Его противоположный конец следует направить (под воду) в перевернутую колбу. Горловину следует опустить в большой стакан или кристаллизатор, наполненный водой. Кислород выделяется при нагревании трубки с бертолетской солью. Пропустить колбу через газоотводную трубку, вытеснив из нее воду. Когда баллон наполняется газом, его закрывают под водой и переворачивают вверх дном. Кислород, полученный в этом лабораторном эксперименте, можно использовать для изучения химических свойств простого вещества.
Горение
Если сжигание веществ в кислороде проводится в лаборатории, необходимо знать и соблюдать правила пожарной безопасности. Водород мгновенно горит на воздухе и при смешивании с кислородом в соотношении 2: 1 является взрывоопасным. Горение веществ в чистом кислороде намного интенсивнее, чем на воздухе. Это явление объясняется составом воздуха. Кислород в атмосфере составляет чуть более 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются различные продукты, в основном оксиды металлов и неметаллов. Кроме того, горючие смеси O2 с горючими веществами могут быть токсичными.
Водород мгновенно горит на воздухе и при смешивании с кислородом в соотношении 2: 1 является взрывоопасным. Горение веществ в чистом кислороде намного интенсивнее, чем на воздухе. Это явление объясняется составом воздуха. Кислород в атмосфере составляет чуть более 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются различные продукты, в основном оксиды металлов и неметаллов. Кроме того, горючие смеси O2 с горючими веществами могут быть токсичными.
Горение обычной свечи (или спички) сопровождается образованием углекислого газа. Следующий эксперимент можно провести дома. Если вы сожжете вещество под стеклянной банкой или большим стаканом, горение прекратится, как только будет израсходован весь кислород. Азот не поддерживает дыхание и горение. Двуокись углерода, продукт окисления, больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие углекислого газа после зажигания свечи. Если продукты сгорания проходят через гидроксид кальция, раствор становится мутным. Между известковой водой и диоксидом углерода происходит химическая реакция с образованием нерастворимого карбоната кальция.
Между известковой водой и диоксидом углерода происходит химическая реакция с образованием нерастворимого карбоната кальция.
Получение кислорода в промышленных масштабах
Более дешевый процесс, в результате которого образуются безвоздушные молекулы O2, не связан с химическими реакциями. В промышленности, например, на металлургических заводах, воздух сжижается при низких температурах и высоких давлениях. Наиболее важные компоненты атмосферы, такие как азот и кислород, кипят при разных температурах. Воздушную смесь разделяют постепенным нагревом до нормальной температуры. Сначала высвобождаются молекулы азота, затем кислород. Метод разделения основан на различных физических свойствах простых веществ. Формула простого кислородного вещества такая же, как и до охлаждения и разжижения воздуха — O2.
В результате некоторых реакций электролиза также выделяется кислород, который собирается на соответствующем электроде. Промышленным и строительным компаниям нужен газ в больших объемах. Спрос на кислород постоянно растет, особенно в химической промышленности. Полученный газ хранится для промышленных и медицинских целей в стальных баллонах с маркировкой. Кислородные баллоны окрашены в синий или голубой цвет, чтобы отличать их от других сжиженных газов: азота, метана, аммиака.
Спрос на кислород постоянно растет, особенно в химической промышленности. Полученный газ хранится для промышленных и медицинских целей в стальных баллонах с маркировкой. Кислородные баллоны окрашены в синий или голубой цвет, чтобы отличать их от других сжиженных газов: азота, метана, аммиака.
Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Числовое значение молярной массы кислорода совпадает с другим значением: относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Вкратце формулу для кислорода и его молярную массу нужно записать так: M (O2) = 32 г / моль. В нормальных условиях один моль любого газа соответствует объему 22,4 литра. Это означает, что 1 моль O2 — это 22,4 литра вещества, 2 моль O2 — это 44,8 литра. Согласно уравнению реакции между кислородом и водородом видно, что 2 моля водорода и 1 моль кислорода взаимодействуют:
Если в реакцию вовлечен 1 моль водорода, объем кислорода составит 0,5 моль x 22,4 л / моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ более 3 миллиардов лет. Это главное вещество для дыхания и обмена веществ, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород на Земле постоянно потребляется, но его запасы пополняются за счет фотосинтеза. Русский ученый К. Тимирязев считал, что благодаря этому процессу на нашей планете все еще существует жизнь.
Роль кислорода в природе и народном хозяйстве велика:
- процессы гниения, брожения, ржавления протекают при участии кислорода, который действует как окислитель;
- всасывается при дыхании живыми организмами;
- используется для получения продуктов тонкого органического синтеза.
- участвует в реакциях фотосинтеза у растений;
- входит в состав органических молекул;
Сжиженный кислород в баллонах используется для резки и сварки металлов при высоких температурах.
Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, за исключением первых представителей семейства благородных газов. Многие вещества реагируют напрямую с атомами O, за исключением галогенов, золота и платины. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту и в промышленности. В металлургии взаимодействие минералов с кислородом называется обжигом. Предварительно измельченный минерал смешивается с воздухом, обогащенным кислородом.
Появление недорогого метода получения кислорода из воздуха путем разделения на компоненты при низких температурах стимулировало развитие многих областей промышленного производства. Химики считают молекулы O2 и атомы O идеальными окислителями. Это натуральные материалы, они постоянно обновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода часто приводят к синтезу другого природного и безопасного продукта: воды. O2 играет важную роль в обезвреживании токсичных промышленных отходов, в очистке воды от загрязнений. Помимо кислорода для дезинфекции используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. Озонирование воды разрушает загрязняющие вещества.
Поделиться:
- Предыдущая записьОбразованный человек — это… Качества образованного человека
- Следующая записьЖивотные в почве. Обитатели почвы и их приспособленность к среде
×
Рекомендуем посмотреть
Adblock
detector
FAQ Химия и физика воздуха
Что такое воздух? Воздух — это не что иное, как смесь различных газов. Воздух в атмосфере состоит из азота, кислорода, являющегося веществом, поддерживающим жизнь животных и человека, углекислого газа, водяного пара и небольшого количества других элементов (аргон, неон и др.). Выше в атмосфере воздух также содержит озон, гелий и водород. Люди могут ясно заметить присутствие воздуха только тогда, когда дует ветер.
Из чего состоит воздух?
The air we breathe consists mostly of the following gases:
Nitrogen (N 2 ) | 78% | ||||
Oxygen (O 2 ) | 20% | ||||
Благородные газы | 90 9025 1%0028Carbon dioxide (CO 2 ) 0,03% Water vapor (H 2 O) 0,97% |
Количество воды в воздухе сильно различается. Когда в воздухе присутствует большое количество воды, другие элементы присутствуют в меньшем количестве. Количество воды в воздухе может возрасти до 4%. Самый низкий процент воды в воздухе составляет 0,5%. Вода сжимает газы ближе друг к другу, так что она может занимать достаточно места.
Когда количество воды в воздухе очень мало, воздух называется «сухим». Вес 22,4 дм 3 сухого воздуха 28,96 грамм. Когда воздух содержит достаточное количество воды, его называют влажным. Влажный воздух легче (менее плотный), чем сухой воздух.
Помимо перечисленных выше элементов, в воздухе присутствуют и другие элементы. Однако процентное содержание этих элементов очень низкое. Аэрозоли могут находиться в воздухе. Это пылевые частицы, которые сдуваются с земной поверхности ветром, либо выбрасываются при вулканической деятельности. При горении в воздух также попадают частицы пепла и грязи.
Состав воздуха сильно зависит от высоты. На высоте более девяноста километров над земной поверхностью молекулы кислорода распадаются, и остаются только атомы кислорода. На высоте более ста километров над земной поверхностью разлагаются и молекулы азота. На этой высоте воздух не имеет того состава, который мы знаем. Там совсем другая атмосфера.
Что такое газы?
Все химические элементы могут находиться в нескольких различных состояниях (фазах). Одной из таких фаз является газообразная фаза. Помимо газообразного, элемент также может быть твердым или жидким. Вода называется льдом, когда она твердая, она влажная, когда она жидкая, а когда она газообразная, она существует просто как газ или пар.
Одной из таких фаз является газообразная фаза. Помимо газообразного, элемент также может быть твердым или жидким. Вода называется льдом, когда она твердая, она влажная, когда она жидкая, а когда она газообразная, она существует просто как газ или пар.
При повышении температуры молекулы вещества расходятся, в результате чего вещество становится газообразным и менее заметным. Это фазовое изменение делает воздух невидимым.
Когда температура падает, молекулы воздуха сближаются, и вещество в конце концов становится твердым. Температуры, при которых происходит каждое «фазовое изменение», различаются для каждого вещества.
Где на земле мы находим воздух?
Можно сказать, что воздух есть везде на земле, кроме воды. Воздух находится даже в поверхностном слое земли; в почве.
Воздух расположен не только на Земле, он также расположен вокруг Земли в воздушном слое, называемом атмосферой. Атмосферу можно разделить на отдельные слои в зависимости от температуры и высоты.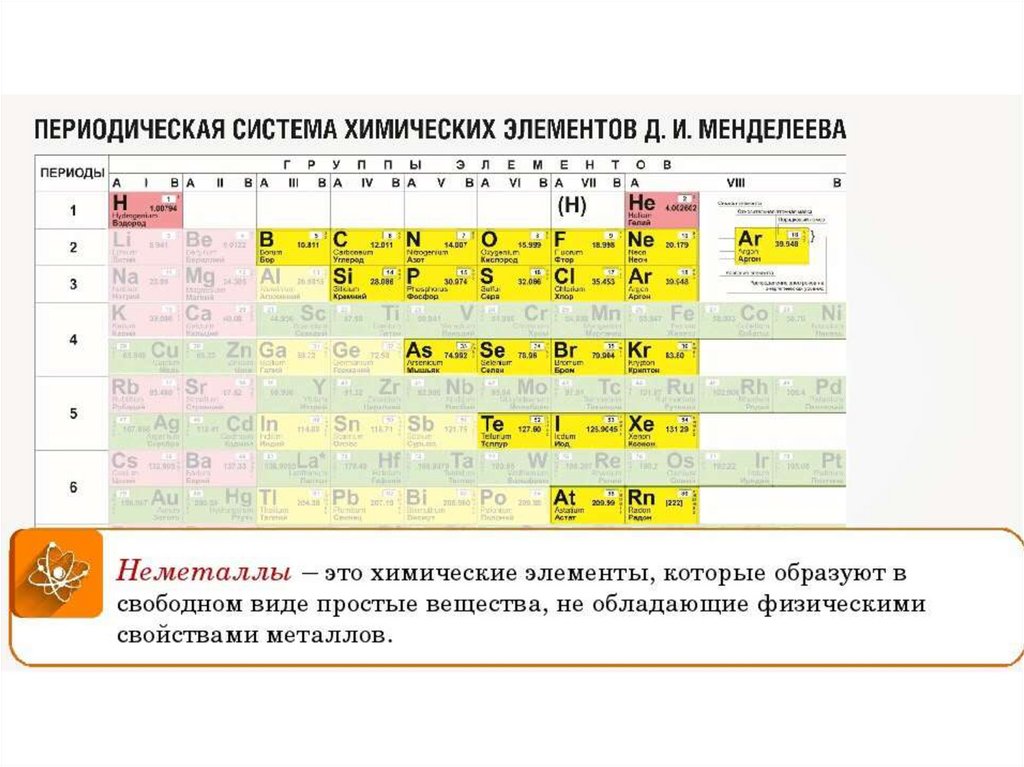 Эти линии не разделены четко прямыми границами; они постепенно перекрывают друг друга.
Эти линии не разделены четко прямыми границами; они постепенно перекрывают друг друга.
Первый слой воздуха, который расположен ближе всего к земле, называется тропосферой. Этот слой имеет высоту 11 километров. При движении вверх в тропосфере температура падает на шесть-семь градусов на километр. Следовательно, погода на Земле в основном определяется обстоятельствами внутри тропосферы.
Верхний слой тропосферы называется тропопаузой. Вблизи Антарктики слой тропопаузы находится в восьми-десяти километрах над землей. Однако на экваторе слой тропопаузы находится на высоте семнадцати-восемнадцати километров над землей.
Второй слой воздуха над тропосферой называется стратосферой. В нижней части этого слоя температуры перестают снижаться. Температура здесь около -55 градусов по Цельсию.
В верхних слоях стратосферы температура поднимается до нуля градусов по Цельсию на высоте сорока семи километров над землей.
Солнечное излучение в стратосфере создает озон (O 3 ) из кислорода (O 2 ) на высоте от двадцати до сорока километров над поверхностью земли. Эта реакция приводит к тому, что эту часть стратосферы называют «озоновой сферой». Верхняя часть стратосферы называется стратопаузой.
Эта реакция приводит к тому, что эту часть стратосферы называют «озоновой сферой». Верхняя часть стратосферы называется стратопаузой.
Третий слой воздуха называется мезосферой. Этот слой можно найти на высоте более пятидесяти двух километров над поверхностью земли. Верхняя часть мезосферы называется мезопаузой. В мезосфере температура снова снижается. Температура мезосферы около -90 градусов Цельсия.
Четвертый слой воздуха, термосфера, расположена на высоте девяноста километров над землей. Температура в этом слое сильно повышается, в результате чего самая высокая температура превышает тысячу градусов по Цельсию. Плотность воздуха в этом слое очень мала, поэтому силы между молекулами почти исчезают.
Самые легкие молекулы могут покинуть самый нижний слой термосферы, экзосферу. Экзосфера не имеет четкой границы, потому что растворяется в пространстве.
Самые нижние девяносто километров атмосферы часто называют полушарием, потому что состав воздуха довольно постоянный. Весь воздух над этим слоем называется гидросферой, потому что воздух в этой области имеет совсем другой состав.
Весь воздух над этим слоем называется гидросферой, потому что воздух в этой области имеет совсем другой состав.
Какие типы воздуха существуют?
Когда большое количество воздуха имеет одинаковую влажность и температуру, оно классифицируется как один отдельный тип воздуха. Воздушный тип должен охватывать горизонтальную зону в тысячу километров. Высота воздушного типа может варьироваться от ста метров до охвата всей тропосферы.
Воздушный тип образуется, когда воздушная масса циркулирует от трех до девяти дней в районе, полностью расположенном над сушей или над морем и где не дует ветер. В пределах этой области воздушная масса приобретает свои специфические свойства. Над сушей эти районы могут быть пустынями или саваннами.
Как только воздух покидает область, его специфические свойства постепенно исчезают и, в конце концов, полностью исчезают.
Типы воздуха, получившие свои специфические свойства над морем, гораздо более влажны, чем типы воздуха, получившие специфические свойства над сушей. Типы воздуха, формирующиеся над океанами, называются морскими типами воздуха. Типы воздуха, формирующиеся над землей, называются континентальными типами воздуха.
Типы воздуха, формирующиеся над океанами, называются морскими типами воздуха. Типы воздуха, формирующиеся над землей, называются континентальными типами воздуха.
Мы можем выделить четыре отдельных основных типа воздуха, которые можно разделить на морские и континентальные:
1. Экваториальный воздух. Температура составляет от 25 до 30 градусов по Цельсию, а содержание влаги высокое.
2. Тропический воздух. Морской тропический воздух имеет высокое содержание влаги и температуру около 25 градусов по Цельсию. Континентальный тропический воздух имеет низкую влажность и температуру более 50 градусов по Цельсию.
3. Полярный воздух. Морской полярный воздух всегда влажный, относительно горячий зимой и холодный летом. Континентальный полярный воздух очень сухой и холодный зимой. Температура может опускаться ниже -50 градусов по Цельсию. Летом этот тип воздуха теплый, но все же очень сухой.
4. Арктический воздух. Этот тип воздуха очень холодный. Зимой морской арктический воздух теплее континентального арктического воздуха.
Что такое ветер?
Ветер — это движение воздуха. Воздух движется вследствие различных видов давления воздуха на землю. Направление и сила ветра могут сильно различаться. Силу ветра часто называют сторонами света.
Сила ветра выражается числом, называемым числом Бофорта, по шкале Бофорта. Сила ветра всегда определяется примерно в десяти метрах над землей.
Description of wind speed according to the Beaufort scale
Number | Description | Wind speed | ||
0 | Безветренный | <1 | ||
1 | Слабый ветер | 1-3 | ||
2 | Little wind | 4-6 | ||
3 | Moderate wind | 7 -10 | ||
4 | Умеренный ветер | 11-16 | Rather strong wind | 17-21 |
6 | Strong wind | 22-27 | ||
7 | Буря | 28-33 | ||
8 | Штормовой ветер0021 | 34-40 | ||
9 | Storm | 41-47 | ||
10 | Heavy storm | 48-55 | ||
11 | Очень сильный шторм | 56-63 | 0007 | Ураган | >63 |
Проще говоря, ветер существует потому, что солнечное излучение нагревает землю. Тепло и горячий воздух поднимаются вверх, заставляя воздух в атмосфере двигаться. Это движение известно как ветер. При этом движении воздуха теплый воздух переносится от экватора к полюсам, а холодный – обратно к экватору. Этот эффект заставляет экватор охлаждаться, а полюса немного нагреваться, чтобы предотвратить экстремальные температуры. Помимо ветра, океаны также способствуют распространению тепла.
Тепло и горячий воздух поднимаются вверх, заставляя воздух в атмосфере двигаться. Это движение известно как ветер. При этом движении воздуха теплый воздух переносится от экватора к полюсам, а холодный – обратно к экватору. Этот эффект заставляет экватор охлаждаться, а полюса немного нагреваться, чтобы предотвратить экстремальные температуры. Помимо ветра, океаны также способствуют распространению тепла.
Воздух не движется напрямую от экватора к полюсам и обратно, как можно было бы ожидать. Вращательные движения земли влияют на направление ветра. Следовательно, ветер, дующий с экватора на Северный полюс, немного поворачивается на восток. Ветер, который дует от экватора к Южному полюсу, немного повернут на запад. Ветер всегда называют по направлению, откуда он дует. Ветер от экватора до Северного полюса называется западным ветром. Горячий воздух, который дует от экватора к полюсам, остывает на своем пути.
В 30 o северной и южной широты воздух опускается обратно на земную поверхность. Не весь воздух оттуда будет унесен обратно к экватору.
Не весь воздух оттуда будет унесен обратно к экватору.
Ветер дует по кругу, называемому ячейкой. На Земле мы можем различать три типа ячеек:
– Ячейка Хэдли – это ячейка между экватором и 30 o северной и южной широты. Ветер в этой ячейке, расположенной у поверхности земли, называется пассатом.
– Ячейка Феррелла расположена между 30 o и 60 o северной и южной широты. Ветер в этой камере зимой дует сильнее. На границе 30 o широты ветер стихает и дует в сторону полюсов. На 60 o широты воздух поднимается и ветер дует обратно к границе 30 o широты. Не весь ветер дует обратно, часть ветра из ячейки Феррелла поглощается ячейкой Полюса.
– Полюсная ячейка расположена на полюсах, до 60 o северной и южной широты. В 60 или 9009На 5 широте воздух поднимается, а над полюсами воздух падает. Ветры в полярной ячейке обычно холодные и сухие.
Это только впечатление от того, как дует ветер на земле.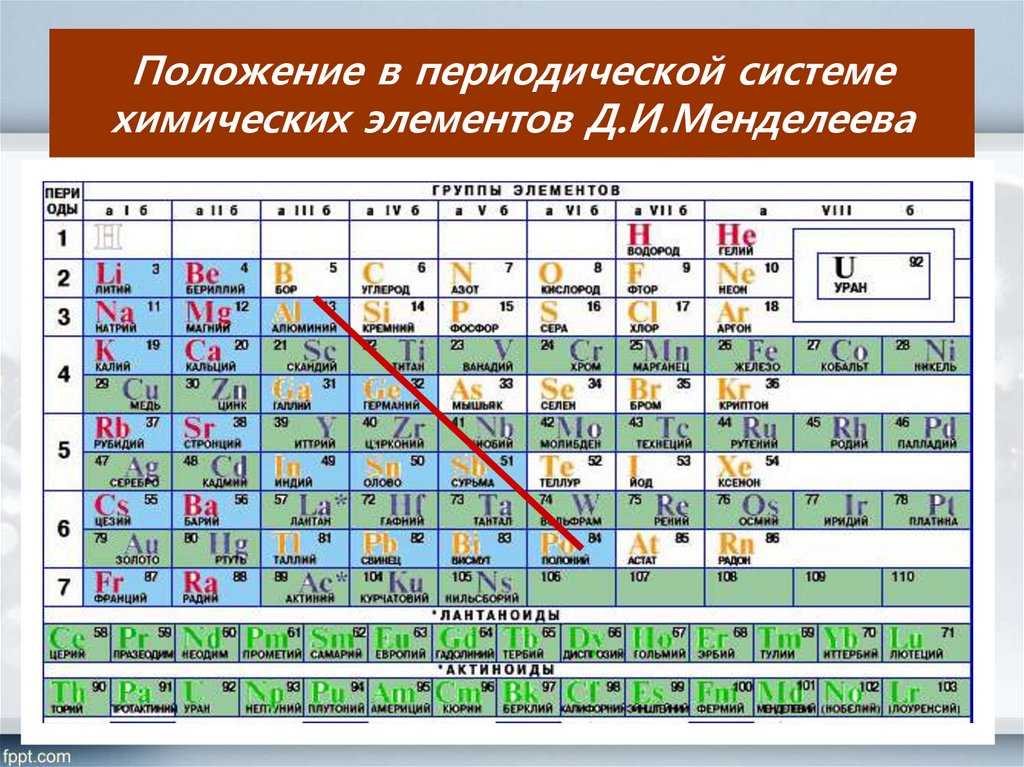 Земля состоит не только из воды, но и из суши. Земля влияет на направление ветра. Это приводит к тому, что ветер может дуть в разных направлениях в отдельных регионах.
Земля состоит не только из воды, но и из суши. Земля влияет на направление ветра. Это приводит к тому, что ветер может дуть в разных направлениях в отдельных регионах.
Что такое атмосферное давление?
Воздух воздействует на предметы определенной силой, называемой давлением воздуха. Весь воздух, находящийся в атмосфере, давит на землю за счет силы магнитного притяжения земли. Воздушное давление применяется к каждому объекту и форме жизни на земле, таким как столы, крыши и дома, а также к людям, животным и растениям. Вы не заметите этого давления воздуха, потому что внутри вашего тела есть сила, которая создает такое же сильное давление на воздух вокруг вас. Под столом давление равно давлению на стол, иначе он бы сразу рухнул.
Давление воздуха определяется как давление, которое оказывает общий вес столба воздуха на участок земли площадью один квадратный метр (1 м 2 ). Единицей давления является Паскаль (Па).
Самое высокое давление воздуха находится в нижней части атмосферы, прямо над землей. Выше в атмосфере атмосферное давление уменьшается. На земле вы испытываете давление большого количества частиц воздуха; выше в воздухе присутствует меньше частиц, оказывающих на вас давление.
Выше в атмосфере атмосферное давление уменьшается. На земле вы испытываете давление большого количества частиц воздуха; выше в воздухе присутствует меньше частиц, оказывающих на вас давление.
Среднее атмосферное давление на Земле составляет 1013 гПа. Это не точное число, поэтому оно может немного варьироваться. Люди вряд ли это заметят, потому что их тела приспосабливаются к новым атмосферным давлениям. Однако некоторые люди более чувствительны к изменениям атмосферного давления. У этих людей изменение атмосферного давления может вызвать мигрень.
Назад к FAQ air index
Если у вас есть другие вопросы, касающиеся воздуха и его обработки, пожалуйста, свяжитесь с нами!
Состав воздуха
7
N
14.01
8
O
16.00
18
AR
39.95
Air – это смеси газов. Три элемента составляют более 99,9% состава сухого воздуха: это азот, кислород и аргон.
Состав сухого воздуха – данные
Приведенные ниже цифры являются средними. В наше время процентное содержание углекислого газа в воздухе растет по мере сжигания ископаемого топлива. Метан также значительно вырос. В наше время процентное содержание углекислого газа в воздухе растет по мере сжигания ископаемого топлива. Метан также значительно вырос. | |
| Азот | 78,08% |
| Кислород | 20,95% |
| Аргон | 0,93% |
| Углекислый газ | 0,04% |
| Неон | 0,018% |
| Гелий | 0,00052% |
| Метан | 0,00018% |
| Криптон | 0,00011% |
| Водород | 0,000055% |
| Закись азота | 0,000032% |
| Окись углерода | 0,00002% |
| Ксенон | 0,0000087% |
Твердый аргон
Как был открыт состав воздуха
Доктор Дуг Стюарт
Является ли воздух элементом?
В 1640 году фламандский химик Ян Баптист ван Гельмонт сжег древесный уголь, чтобы получить ранее не идентифицированный газ двуокись углерода.
В 1674 году английский врач Джон Мэйоу установил, что воздух не является единым элементом, он состоит из различных веществ. Он сделал это, показав, что горючей является только часть воздуха. Большинство из них не так.
Азот, кислород и углекислый газ
В 1750-х годах шотландский химик Джозеф Блэк обнаружил, что в воздухе присутствует углекислый газ.
В 1772 году шотландский химик Дэниел Резерфорд, ученик Джозефа Блэка, сообщил об открытии «вредного воздуха», который мы сейчас называем азотом.
В 1774 году кислород был открыт английским химиком Джозефом Пристли, хотя двумя годами ранее в Швеции Карл Шееле открыл кислород, но не опубликовал свои результаты.
Это все?
В 1785 году сэр Генри Кавендиш был недоволен научными знаниями об окружающем нас воздухе, который, как считалось, полностью состоит из кислорода, азота и углекислого газа.
Он знал, что азот в воздухе может реагировать с кислородом с образованием азотистой кислоты. Он стремился выяснить, может ли ВЕСЬ воздух, который не был кислородом или углекислым газом, быть преобразован в азотистую кислоту. Если бы это было возможно, он бы доказал, что воздух полностью состоит из кислорода, углекислого газа и азота.
Он стремился выяснить, может ли ВЕСЬ воздух, который не был кислородом или углекислым газом, быть преобразован в азотистую кислоту. Если бы это было возможно, он бы доказал, что воздух полностью состоит из кислорода, углекислого газа и азота.
Кавендиш зажег воздух в банке электричеством для реакции кислорода и азота с образованием оксидов азота. Затем он добавил дополнительный кислород и снова зажег воздух, пока весь азот не прореагировал.
Оксиды азота кислые. Кавендиш использовал водный раствор гидроксида натрия для их удаления из аппарата. [Это также, конечно, удалило бы весь присутствующий углекислый газ.] Он удалил оставшийся кислород, используя полисульфиды калия.
Остался небольшой пузырь газа. Теперь мы знаем, что это был в основном аргон. Кавендиш писал, что этот пузырь «составлял не более ста двадцатых от массы флостигированного воздуха [азота]». (1)
По крайней мере, еще один газ присутствует в воздухе
Итак, Кавендиш узнал, что воздух состоит как минимум на 99,3 процента из азота/кислорода/углекислого газа и максимум на 0,7 процента из чего-то еще. Теперь мы знаем, что «что-то еще», аргон, очень инертно; это позволило Кавендишу найти его, но также помешало ему узнать о нем больше. (Гигантские достижения в области спектроскопии, достигнутые Густавом Кирхгофом и Робертом Бунзеном, отложатся на 85 лет вперед.)
Теперь мы знаем, что «что-то еще», аргон, очень инертно; это позволило Кавендишу найти его, но также помешало ему узнать о нем больше. (Гигантские достижения в области спектроскопии, достигнутые Густавом Кирхгофом и Робертом Бунзеном, отложатся на 85 лет вперед.)
Оглядываясь назад, мы можем сказать, что Кавендиш немного недооценил ту часть воздуха, которая не состоит из кислорода, азота или углекислого газа. Несмотря на это, он опередил свое время. После его эксперимента прошло более 100 лет, пока ученые снова не начали думать, что с воздухом что-то не совсем складывается.
Тайна
В 1892 году Джон Уильям Стратт (более известный как лорд Рэлей) объявил, что независимо от того, как он был приготовлен, кислород всегда в 15,882 раза плотнее водорода. Эта очень точная работа заняла десять лет.
Продолжая работать с большим вниманием к деталям, он обнаружил, что азот в воздухе всегда был плотнее примерно на 0,5 процента, чем азот, полученный из соединений азота. (2), (3) Как это объяснить?
(2), (3) Как это объяснить?
В 1893 Рэлей написал в Nature , объявив о проблеме всему миру. (Любой ученый, ответивший на этот вызов, на самом деле имел шанс открыть новый элемент. Никто этого не сделал!)
В апреле 1894 года Рэлей написал научную статью о проблеме азота. Как ни странно, чистый азот, не содержащий аргона, он рассматривал как «аномально легкий азот». Он хранил его восемь месяцев и повторно проверил, чтобы увидеть, увеличится ли его плотность. (4)
Статья Рэлея вызвала серьезный интерес Уильяма Рамзи, который уже знал об этой проблеме.
Рэйли и Рамзи провели дальнейшие эксперименты, поддерживая связь друг с другом по поводу их прогресса.
Аргон и благородные газы
В августе 1894 года Рамзи взял воздух и удалил его компоненты – кислород, углекислый газ и азот. Он удалил азот, прореагировав его с магнием.
После удаления всех известных газов из воздуха он обнаружил, что оставшийся газ занимает одну восьмидесятую первоначального объема. Его спектр не соответствовал ни одному известному газу.
Его спектр не соответствовал ни одному известному газу.
В 1895 году Рэлей и Рамзи написали совместный документ, в котором уведомили мир об их открытии. Новый газ ни с чем не реагировал, поэтому его назвали аргоном, от греческого «argos», что означает «неактивный» или «ленивый». (5)
В своем обращении к лауреату Нобелевской премии Рэйли сказал: «Аргон нельзя считать редким. Большой зал легко может вместить больший вес, чем может унести человек». (6)
Уильям Рамсей открыл или открыл большинство других благородных газов: гелий, неон, криптон и ксенон.
Он отвечал за добавление новой группы в периодическую таблицу. Радон был единственным благородным газом, который он не открыл.
Ссылки
- Энциклопедия Perthensis, или Универсальный словарь искусств, наук, литературы и т. д., 1816, том 1, стр. 231-232, Джон Браун.
- Джон Х. Вольфенден, Благородные газы и периодическая таблица: рассказывая все как есть, J.


