«В природе мы больше не найдем новых химических элементов». Член-корреспондент РАН Андрей Шевельков
О новых химических элементах, аномальных сверхпроводниках и рекордах МГУ рассказывает Андрей Владимирович Шевельков ― член-корреспондент РАН, заведующий кафедрой неорганической химии химического факультета МГУ им. М.В. Ломоносова.
― Где в периодической таблице Д.И. Менделеева проходит грань, отделяющая природные химические элементы от созданных искусственно? Правда ли, что природных химических элементов мы больше найти не сможем и таблицу впредь будут пополнять только искусственные?
― На второй вопрос ответить очень легко: да, это правда. А с первым дело обстоит сложнее: многие считают, что последний природный химический элемент периодической таблицы ― это уран, атомный номер которого 92. Уран радиоактивен, и различные его осколки могут оказаться довольно большими по массе, так что шанс встретить более тяжелый элемент в природе в каких-то следовых количествах, конечно, есть. Разумеется, этот факт не имеет никакого научного или прикладного значения, но для обсуждения вполне интересен.
Разумеется, этот факт не имеет никакого научного или прикладного значения, но для обсуждения вполне интересен.
― Максимальная глубина, на которую удалось пробурить Землю, на текущий момент составляет чуть более 12 км. Может, все-таки есть шансы найти новые природные химические элементы, если мы когда-нибудь проникнем под кору еще глубже?
― Я все же думаю, что открытие новых природных химических элементов невозможно. Каждый последующий элемент в таблице Д.И. Менделеева имеет бо́льшую массу, чем предыдущий, и проблема заключается в том, что с увеличением массы ядра атома уже не хватает ядерных сил, чтобы удержать вместе все его составляющие. Поэтому мы и наблюдаем естественный природный процесс ― радиоактивный распад ― у многих элементов. Чем больше масса, чем тем легче получить этот распад.
Чем дальше химический элемент расположен в таблице Менделеева, тем меньше время его жизни. И если такие радиоактивные элементы, как уран, имеют период полураспада миллиарды и более лет, то современные элементы конца периодической таблицы, например 118-й элемент оганесон, живут всего лишь микросекунды!
В 2016 г. новый, 118-й, химический элемент таблицы Менделеева получил название «оганесон» в честь признанного мирового лидера в области синтеза сверхтяжелых элементов академика Ю.Ц. Оганесяна, научного руководителя лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ. Таким образом, Юрий Цолакович Оганесян стал первым отечественным ученым (и вторым в мире), чьим именем при жизни был назван химический элемент. Фото: из архива «Научной России».
новый, 118-й, химический элемент таблицы Менделеева получил название «оганесон» в честь признанного мирового лидера в области синтеза сверхтяжелых элементов академика Ю.Ц. Оганесяна, научного руководителя лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ. Таким образом, Юрий Цолакович Оганесян стал первым отечественным ученым (и вторым в мире), чьим именем при жизни был назван химический элемент. Фото: из архива «Научной России».
― То есть дальше мы будем открывать новые искусственные элементы, время жизни которых будет все короче и короче?
― Да, я бы сказал, что тенденция примерно такова. Это не значит, однако, что каждый последующий элемент обязательно будет жить меньше, чем его предшественники, но, вероятно, мы уже не получим новые химические элементы, которые смогут жить дни, годы, десятилетия, века. И в целом корректнее говорить не о том, что мы будем открывать новые химические элементы, а о том, что их будут синтезировать специалисты ядерной физики.
Раньше химики и геологи открывали новые элементы в природе, а теперь их синтезируют физики в лабораториях.
― В одной из своих лекций вы говорили, что следующий новый химический элемент, вероятно, будет похож на щелочной металл франций с атомным номером 87. Расскажите, пожалуйста, об этом подробнее.
― Дело в том, что даже те сверхтяжелые элементы, которые синтезируются в последнее время, так или иначе вписываются в общие тенденции периодического закона, согласно которому элементы, находящиеся в одной группе, обладают схожими свойствами. Это не значит, что они должны быть похожи, как братья-близнецы, но некоторые общие закономерности будут существовать. Исходя из этого, мы можем предсказать конфигурацию следующего открытого элемента. Так вот, после оганесона, на котором сейчас заканчивается периодическая таблица, должен идти элемент № 119, повторяющий в какой-то степени, в том числе по конфигурации электронов, щелочные металлы.
― Столь короткое время жизни, как у последних элементов таблицы, не мешает проводить какие-то манипуляции с ними?
― В целом очень сложно говорить о химических свойствах элементов, время жизни которых составляет микросекунды. Скорее всего, с ними возможно проводить только сверхбыстрые физические эксперименты, позволяющие в той или иной степени оценить ожидаемые свойства.
Если говорить о практическом использовании ожидаемого 119-го элемента, то я не могу представить ни одного примера использования такого элемента, кроме выявления фундаментальных закономерностей природы в физике в первую очередь.
― Что это за закономерности?
― Например, поиск ответа на вопрос, как будут себя вести протоны и нейтроны при увеличении их количества. Что именно будет происходить? Как будет осуществляться распад? Какие энергии будут выделяться? Какие энергии потребуются для осуществления этого процесса? Это темы, которые пока кажутся очень далекими от практического применения. Но история науки знает массу примеров, когда то, что мы считали фундаментальным и глубинным, находит свое прикладное значение спустя десятки или даже сотню лет. Один великий ученый как-то сказал, что химия делится на две части: прикладная и пока еще не прикладная. Думаю, это справедливо и для физики.
Но история науки знает массу примеров, когда то, что мы считали фундаментальным и глубинным, находит свое прикладное значение спустя десятки или даже сотню лет. Один великий ученый как-то сказал, что химия делится на две части: прикладная и пока еще не прикладная. Думаю, это справедливо и для физики.
Последние шесть элементов седьмого периода таблицы Менделеева — 113, 114, 115, 116, 117, 118 — были синтезированы в Объединенном институте ядерных исследований в Дубне (ОИЯИ) на ускорительном комплексе У-400 в лаборатории ядерных реакций им. Г.Н. Флерова в сотрудничестве с физиками и химиками Национальных лабораторий США. Источник фото: Russia Beyond (общественное достояние, Legion Media, Getty Images).
― А что значит «не нужны»? Если вы имеете в виду прикладные, а не фундаментальные аспекты, то наверняка сверхтяжелые химические элементы, созданные искусственно, пока еще не нужны. Если же мы берем химические элементы, уже существующие в природе, то практически каждый из них находит хотя бы минимальное применение. Есть интересный пример на эту тему. Долгое время считалось, что редкоземельный элемент гольмий бесполезен и только мешает добыче соседних элементов. Оказалось, что это не так, и сегодня гольмий находит свое применение в различных магнитных сплавах и не только там. С прикладной точки зрения я не могу назвать ни один лишний элемент в таблице Менделеева. С фундаментальной точки зрения ― тем более: все элементы крайне важны, потому что они помогают прослеживать тенденции в изменениях свойств самих элементов и их соединений, начиная с фундаментальных свойств и заканчивая реакционной способностью соединений.
Если же мы берем химические элементы, уже существующие в природе, то практически каждый из них находит хотя бы минимальное применение. Есть интересный пример на эту тему. Долгое время считалось, что редкоземельный элемент гольмий бесполезен и только мешает добыче соседних элементов. Оказалось, что это не так, и сегодня гольмий находит свое применение в различных магнитных сплавах и не только там. С прикладной точки зрения я не могу назвать ни один лишний элемент в таблице Менделеева. С фундаментальной точки зрения ― тем более: все элементы крайне важны, потому что они помогают прослеживать тенденции в изменениях свойств самих элементов и их соединений, начиная с фундаментальных свойств и заканчивая реакционной способностью соединений.
― Какие химические элементы в будущем станут редкими? Все природные химические элементы ― исчерпаемые?
― Сложно прогнозировать, потому что это зависит от того, как будут развиваться наши технологии. Могу предположить, что довольно распространенный химический элемент под названием стронций в течение ближайших 50 лет может оказаться под угрозой исчезновения именно из-за того, что его активно используют при создании новых и модернизации старых технологий.
Вероятность исчезновения того или иного химического элемента зависит от двух факторов: первый ― как много этого элемента находится в природе, второй ― существует ли технология его переработки и извлечения (что-то вроде вторсырья).
Современная формулировка периодического закона Д.И. Менделеева: свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда ядра атомов химических элементов. Источник фото: фотобанк 123RF.
Разумеется, исчерпаемы все химические элементы, но вопрос в том, насколько быстро они могут быть израсходованы. Есть, например, такие широко распространенные элементы, как кремний или железо, исчерпать которые в ближайшие сотни и даже тысячи лет не представляется возможным.
― Давайте немного отвлечемся от таблицы Менделеева и поговорим о работе кафедры, которую вы возглавляете. В 1994 г. здесь был побит мировой рекорд высокотемпературной сверхпроводимости. Расскажите, пожалуйста, об этом подробнее.
― Сама по себе сверхпроводимость ― это в какой-то степени уникальное явление: понизив температуру вещества до определенного предела, мы можем создать проводник электричества, в котором ток не будет теряться совсем!
Передача тока без потерь ― заветная мечта ученых, создающих новые технологии.
Действительно, в 1993 г. на нашей кафедре впервые в мире был достигнут рекорд сверхпроводимости при температуре 130 К. Буквально через несколько недель этот рекорд был побит американскими и итальянскими учеными, достигшими рекорда 153 К, но эксперимент коллег в отличие от нашего проводился с применением большого давления — 30 ГПа. Если же говорить об эксперименте в условиях отсутствия такого давления, то наше достижение до сих пор никем не превзойдено. Наш эксперимент проводился на волне бума сверхпроводимости и поиска новых сверхпроводников в 1990-е гг. Но тематика сверхпроводников находит свое продолжение и в настоящее время ― не только в стенах наших лабораторий, но и на производствах, не связанных с МГУ.
Кристаллическая структура высокотемпературного сверхпроводника ― оксида иттрия-бария-меди, сохраняющего свои свойства даже при 77 К (то есть при температуре кипения жидкого азота). Вещества c подобной структурой считаются одними из наиболее перспективных сверхпроводников будущего. Источник фото: Википедия.
Источник фото: Википедия.
― Я слышала, что самая большая мечта ученых, занимающихся сверхпроводимостью, ― получить сверхпроводимость при комнатной температуре. Насколько далеко наука продвинулась в этом направлении?
― Для реализации этой мечты опять же нужно приложить очень большое давление. При гигантских давлениях, измеряемых в сотнях ГПа, можно перейти в сверхпроводимость при температурах, приближающихся к нулю градусов Цельсия. Применить на практике такое вещество пока невозможно, потому что столь гигантские давления можно создать только в рабочей сердцевине определенных приборов ― это невероятно сложный и дорогостоящий процесс.
Теоретически достичь сверхпроводимости при комнатной температуре возможно, но пока неизвестно, что нужно сделать, чтобы эта комнатная температура сочеталась с нормальным или слегка повышенным давлением. Исследования в этой области продолжаются, в том числе в лабораториях нашей кафедры. Пока сложно сказать, сколько лет потребуется для реализации заветной мечты многих ученых. Дело осложняется еще и тем, что все новые сверхпроводники не описываются классической фундаментальной теорией сверхпроводимости, выдвинутой в середине прошлого века и описывающей привычные нам сверхпроводники, работающие при низких температурах.
Пока сложно сказать, сколько лет потребуется для реализации заветной мечты многих ученых. Дело осложняется еще и тем, что все новые сверхпроводники не описываются классической фундаментальной теорией сверхпроводимости, выдвинутой в середине прошлого века и описывающей привычные нам сверхпроводники, работающие при низких температурах.
― Речь о так называемых аномальных сверхпроводниках? Это очень интересно!
― Именно так. Эти новые сверхпроводники аномальны с точки зрения современной физической теории. Они, видимо, работают в рамках иных физических явлений, нежели обычные сверхпроводники. Нам очень важно понять, каким образом возникают их особые свойства, в каком химическом соединении это происходит и как влияет на повышение температуры. Пока эти вопросы остаются без ответа. Нам интересно исследовать все сверхпроводники, температура перехода в сверхпроводящее состояние которых выше, чем температура кипения гелия, то есть выше -269° C.
Мы знаем некоторые закономерности работы аномальных сверхпроводников, но у нас нет полной предсказательной теории. Описать явление и понять, почему оно происходит, можно, но связать все эти знания в единую систему закономерностей, описанных теоретической физикой, пока не удается.
Описать явление и понять, почему оно происходит, можно, но связать все эти знания в единую систему закономерностей, описанных теоретической физикой, пока не удается.
― Надеюсь, что когда-нибудь все-таки удастся. Спасибо за интересный разговор!
― И вам спасибо!
Таблица Менделеева официально пополнилась четырьмя элементами
Наука 16887
Поделиться
Международным союзом теоретической и прикладной химии IUPAC верифицированы химические элементы с атомными номерами 113, 115, 117 и 118. Теперь они официально внесены в Периодическую систему химических элементов. До сих пор эти элементы носили не самые изящные «рабочие» названия унунтрий (Uut), унунпентий (Uup), унунсептий (Uus) и унуноктий (Uuo), однако в течение ближайших пяти месяцев первооткрыватели элементов смогут дать им новые, окончательные имена.
Теперь они официально внесены в Периодическую систему химических элементов. До сих пор эти элементы носили не самые изящные «рабочие» названия унунтрий (Uut), унунпентий (Uup), унунсептий (Uus) и унуноктий (Uuo), однако в течение ближайших пяти месяцев первооткрыватели элементов смогут дать им новые, окончательные имена.
Таким образом, на сегодняшний день верифицированы все элементы седьмого периода таблицы. В 2011 году в неё были добавлены 114-й и 116-й элементы, названные флеровием и ливерморием.
Первооткрывателями трёх из четырёх новых элементов – 115-го, 117-го и 118го – призваны российские учёные из Объединённого института ядерных исследований в Дубне, а также их американские коллеги из Ливерморской национальной лаборатории в Калифорнии и Окриджской национальной лаборатории в Теннеси. Право открытия 113-го элемента, по решению Международного союза теоретической и прикладной химии, признано за японскими учёными из Института естественных наук RIKEN.
Новые элементы, как и все, имеющие атомный номер 93 и более, получены искусственно: 115-й – в 2003 году, 113-й – в 2004-м, 118-й – в 2006-м и 117-й – в 2009-м.
113-й элемент, будучи первым в таблице Менделеева, полученным в Стране восходящего солнца, может получить название «японий». Также ранее звучало предложение назвать 117-й элемент «московием».
Первоначальный вариант таблицы, устанавливающей зависимость свойств элементов от их атомного веса, был разработан Дмитрием Менделеевым в 1869-1871 годах. На тот момент было известно лишь 63 химических элемента. Сегодня предполагается, что их существует по меньшей мере 126, и существование 118 из них признано доказанным.
Подписаться
Авторы:
- org/Person”>
Дмитрий Ерусалимский
Россия США
Что еще почитать
Что почитать:Ещё материалы
В регионах
В Рязани из трудового рабства спасли 25-летнюю девушку с грудным ребёнком
Фото 53710
РязаньАнастасия Батищева
Глава ЧВК «Вагнер» пожаловался на Ярославскую область
Фото 28573
ЯрославльСевастополь снова атаковали дроны утром 24 апреля
23648
Крымфото: МК в Крыму
В США представили снаряд, который поможет Украине бить по Крыму
16314
Крымфото: МК в Крыму
Подоляк заявил, что Украина может уничтожить Крым и Донбасс
13798
Крымcrimea.
 mk.ru
mk.ruВ мае в Крым приедут народные дипломаты из Германии
6653
Крымфото: МК в Крыму
В регионах:Ещё материалы
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Перейти к: домой | поиск |телефонная книга | баннерная навигация | навигация по сайту | основное содержание| Нижний колонтитул навигации
Периодическая таблица элементов: LANL
- Периодическая таблица Главная
| Символ | Элемент | Атомный номер | Символ | Элемент | Атомный номер | |
| Ас | Актиний | 89 | Мд | Менделевий | 101 | |
| Ал | Алюминий | 13 | рт. ст. ст. | Меркурий | 80 | |
| Ам | Америций | 95 | Пн | Молибден | 42 | |
| Сб | Сурьма | 51 | Нс | Нейлсборий | 107 | |
| Ар | Аргон | 18 | Нд | Неодим | 60 | |
| Как | Мышьяк | 33 | Не | Неон | 10 | |
| В | Астатин | 85 | Нп | Нептуний | 93 | |
| Ба | Барий | 56 | Нх | Нихоний | 113 | |
| Бк | Берклиум | 97 | Ni | Никель | 28 | |
| Бе | Бериллий | 4 | № | Ниобий | 41 | |
| Би | Висмут | 83 | Н | Азот | 7 | |
| Бх | Борий | 107 | № | Нобелий | 102 | |
| Б | Бор | 5 | Ог | Оганесон | 118 | |
| Бр | Бром | 35 | ОС | Осмий | 76 | |
| CD | Кадмий | 48 | О | Кислород | 8 | |
| Ca | Кальций | 20 | Пд | Палладий | 46 | |
См. | Калифорния | 98 | Р | Фосфор | 15 | |
| С | Углерод | 6 | Пт | Платина | 78 | |
| Се | Церий | 58 | Пу | Плутоний | 94 | |
| Cs | Цезий | 55 | По | Полоний | 84 | |
| Класс | Хлор | 17 | К | Калий | 19 | |
| Кр | Хром | 24 | Пр | Празеодим | 59 | |
| Ко | Кобальт | 27 | вечера | Прометий | 61 | |
| Сп | Коперниций | 112 | Па | Протактиний | 91 | |
| Медь | Медь | 29 | Ра | Радий | 88 | |
| См | Кюриум | 96 | Рн | Радон | 86 | |
| Дс | Дармштадтиум | 110 | Ре | Рений | 75 | |
| Дб | Дубниум | 105 | Рх | Родий | 45 | |
| Дай | Диспрозий | 66 | Рг | Рентгений | 111 | |
| Эс | Эйнштейний | 99 | руб | Рубидий | 37 | |
| Er | Эрбий | 68 | Ру | Рутений | 44 | |
| ЕС | Европий | 63 | РФ | Резерфордий | 104 | |
| ФМ | Фермиум | 100 | См | Самарий | 62 | |
| Фл | Флеровиум | 114 | Ск | Скандий | 21 | |
| Ф | Фтор | 9 | Сг | Сиборгиум | 106 | |
| Пт | Франций | 87 | Se | Селен | 34 | |
| Гд | Гадолиний | 64 | Си | Кремний | 14 | |
| Га | Галлий | 31 | Аг | Серебро | 47 | |
| Ге | Германий | 32 | На | Натрий | 11 | |
| Золото | Золото | 79 | Старший | Стронций | 38 | |
| Хф | Гафний | 72 | С | Сера | 16 | |
| Гс | Хассиум | 108 | Та | Тантал | 73 | |
| Он | Гелий | 2 | ТК | Технеций | 43 | |
| Хо | Гольмий | 67 | Те | Теллур | 52 | |
| Н | Водород | 1 | Ц | Теннесси | 117 | |
| В | Индий | 49 | Тб | Тербий | 65 | |
| я | Йод | 53 | Тл | Таллий | 81 | |
| Ир | Иридий | 77 | Т | Торий | 90 | |
| Фе | Железо | 26 | Тм | Тулий | 69 | |
| Кр | Криптон | 36 | Сн | Олово | 50 | |
| Ла | Лантан | 57 | Ти | Титан | 22 | |
| Лр | Лоуренсиум | 103 | Вт | Вольфрам | 74 | |
| Пб | Свинец | 82 | У | Уран | 92 | |
| Ли | Литий | 3 | В | Ванадий | 23 | |
| Уровень | Ливермориум | 116 | Хе | Ксенон | 54 | |
| Лу | Лютеций | 71 | Ыб | Иттербий | 70 | |
| мг | Магний | 12 | Д | Иттрий | 39 | |
| Мк | Московиум | 115 | Цин | Цинк | 30 | |
| Мн | Марганец | 25 | Зр | Цирконий | 40 | |
| Мт | Мейтнерий | 109 |
Периодическая таблица – введение в химию
ЛюменОбучение
Периодическая таблица
Периодическая таблица показывает все элементы и их физические свойства; он организован на основе атомных номеров и электронных конфигураций.
ЦЕЛИ ОБУЧЕНИЯ
Определить общие периодические тенденции, которые можно вывести из периодической таблицы элементов.
КЛЮЧЕВЫЕ ВЫВОДЫ
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.
- Расположение периодической таблицы заставляет нас визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов. Таким образом, все элементы в пределах определенной группы имеют схожие свойства.
Ключевые термины
- : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z.
- : Вертикальный столбец в периодической таблице, обозначающий количество электронов валентной оболочки в атоме элемента.
- : Горизонтальная строка в периодической таблице, обозначающая общее количество электронных оболочек в атоме элемента.

Символы элементов
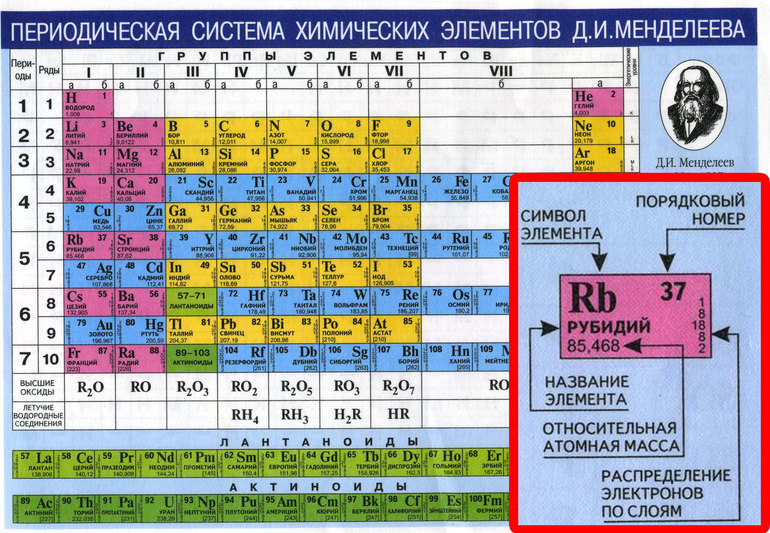
Периодическая таблица имеет структуру сетки 18 X 7, расположенную над меньшим двойным рядом элементов. В периодической таблице перечислены только химические элементы, и она включает каждый изотоп каждого элемента в пределах одной ячейки. В типичной периодической таблице каждый элемент указан по символу элемента и атомному номеру. Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой буквой или первыми двумя буквами их английского имени, но есть некоторые исключения. Два заметных исключения включают серебро и ртуть. Символ серебра — «Ag» от латинского 9.1044 argentum, , что означает «серый» или «блестящий». Символ ртути — «Hg» от латинизированного греческого hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо. Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семейством). Некоторые группы имеют определенные названия, такие как галогены или благородные газы. Элементы одного периода или группы имеют схожие свойства.
Определение химических свойств с помощью периодической таблицы
Химические свойства каждого элемента определяются электронной конфигурацией элемента, особенно его внешними валентными электронами. Положение элемента в периодической таблице во многом зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой лежат валентные электроны, определяет блок элемента. Кроме того, общее количество электронных оболочек атома определяет, к какому периоду он принадлежит. Из-за своей структуры таблица Менделеева стала чрезвычайно полезным инструментом для оценки и предсказания трендов в элементах и химическом составе.
Положение элемента в периодической таблице во многом зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой лежат валентные электроны, определяет блок элемента. Кроме того, общее количество электронных оболочек атома определяет, к какому периоду он принадлежит. Из-за своей структуры таблица Менделеева стала чрезвычайно полезным инструментом для оценки и предсказания трендов в элементах и химическом составе.
«Химия 3.1. Введение в периодическую таблицу» — YouTube: введение в периодическую таблицу, в которой металлы, неметаллы и металлоиды идентифицируются по местоположению, а также сравниваются и противопоставляются физические свойства металлов и неметаллов.
Молекулы
Молекулы представляют собой электрически нейтральные соединения, состоящие из множества атомов, связанных друг с другом химическими связями.
ЦЕЛИ ОБУЧЕНИЯ
Знать общие свойства молекул.
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Молекулы нейтральны и не несут никакого заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как кислород ([латекс]\текст{О}_2[/латекс]), или из разных элементов, как вода ([латекс]\текст{Н} _2\текст{О}[/латекс]).
- Геометрия и состав молекулы определяют ее химические и физические свойства.
- Изомеры — это молекулы с одними и теми же атомами в разном геометрическом расположении.
Ключевые термины
- : Когда 2 или более неметаллических атома связаны вместе общими электронами.
- : Молекулы с одинаковым числом атомов в различном геометрическом расположении.
- : Когда 2 или более различных атомов удерживаются вместе ковалентной связью. Все соединения являются молекулами, но не все молекулы являются соединениями.
- : 2 или более атомов, связанных вместе ковалентной химической связью.

Атомы и молекулы
Атом определяется как основная единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, эта новая сущность известна как молекула. Слово «молекула» является расплывчатым термином, и в разговорной речи оно имеет разные значения в разных областях исследования. Например, термин «молекулы» используется в кинетической теории газов по отношению к любой газовой частице независимо от ее состава. 9-[/латекс]).
Молекула кофеина: кофеин представляет собой сложную молекулу, состоящую из множества атомов, связанных друг с другом в определенном порядке. Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом. Самая маленькая молекула — двухатомный водород ([латекс]\текст{Н}_2[/латекс]) с длиной связи 0,74 ангстрема. Макромолекулы — это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам. Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Часто состав соединения можно также обозначить эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную рассматриваемую молекулу, поскольку она дает только отношение ее элементов. Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов, находящихся в молекуле.
ПРИМЕР
- [латекс]\text{C}_6\text{H}_12\text{O}_6[/latex] = молекулярная формула глюкозы
- [латекс]\текст{СН}_2\текст{О}[/латекс] = эмпирическая (упрощенная пропорция) формула для глюкозы
Изомеры
Изомеры — это молекулы с одинаковыми атомами в разном геометрическом расположении. Из-за такого различного расположения изомеры часто имеют очень разные химические и физические свойства. На картинке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — обычный бытовой спирт.
На картинке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — обычный бытовой спирт.
Ионы
Ион — это атом или молекула, обладающая суммарным электрическим зарядом, поскольку общее число электронов не равно числу протонов.
ЦЕЛИ ОБУЧЕНИЯ
Сравните различные классы ионов.
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов. Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицателен и называется анионом.
- Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются в изобилии на Земле.
 Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам.
Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам. - Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, которые отталкивают друг друга.
Ключевые термины
- : Атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- : Ионы, которые заряжены отрицательно, потому что у них больше электронов, чем протонов.
- : Ионы, которые заряжены положительно, потому что у них больше протонов, чем электронов.
Атом — это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, которое окружено облаком отрицательно заряженных электронов. Если атом имеет одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет суммарный электрический заряд.
Однако, если общее количество электронов не равно количеству протонов, атом имеет суммарный электрический заряд.
Любой атом или молекула с суммарным зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен количеству его протонов минус количество электронов.
Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются в изобилии на Земле. Ионы в жидком или твердом состоянии образуются при взаимодействии солей с их растворителями. Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам.
Типы ионов
Существуют специализированные типы ионов. Анионы имеют больше электронов, чем протонов, и поэтому имеют общий отрицательный заряд. {2+}[/латекс] может называться [латекс]\текст{Fe(II)}[/латекс]. Эти представления можно считать эквивалентными для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
{2+}[/латекс] может называться [латекс]\текст{Fe(II)}[/латекс]. Эти представления можно считать эквивалентными для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Формирующие ионы
Ионы могут образовываться в результате ионизации, которая представляет собой процесс потери или приобретения электронов нейтральным атомом. Как правило, электроны либо добавляются к валентной оболочке атома, либо теряются; электроны внутренней оболочки более прочно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, которое гласит, что самые стабильные атомы и ионы имеют восемь электронов в их самой внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут образовываться, как правило, за счет приобретения или потери элементарных ионов, таких как [латекс]\текст{Н}^+[/латекс], в нейтральных молекулах. Многоатомные ионы обычно очень нестабильны и реакционноспособны. 9-[/латекс]. У хлора, естественно, 17 электронов, но он был бы более стабильным с 18 электронами (2 на самой внутренней оболочке, 8 на второй оболочке и 8 на валентной оболочке). Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Многоатомные ионы обычно очень нестабильны и реакционноспособны. 9-[/латекс]. У хлора, естественно, 17 электронов, но он был бы более стабильным с 18 электронами (2 на самой внутренней оболочке, 8 на второй оболочке и 8 на валентной оболочке). Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
«Периодические свойства: часть 3, ионный радиус, прогнозирование ионных зарядов» — YouTube: продолжение обсуждения периодических свойств, включая ионный радиус и способы прогнозирования ионных зарядов.
ЛИЦЕНЗИИ И ОТНОШЕНИЯ
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, РАСПРОСТРАНЕННОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, КОНКРЕТНОЕ АВТОРСТВО
- Периодические тренды.
 Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Periodic_trends. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Periodic_trends. Лицензия : CC BY-SA: Attribution-ShareAlike - Периодическая таблица. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Periodic_table. Лицензия : CC BY-SA: Attribution-ShareAlike Группа
- . Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/group. Лицензия : CC BY-SA: Attribution-ShareAlike
- период. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/period. Лицензия : CC BY-SA: Attribution-ShareAlike
- атомный номер. Предоставлено : Викисловарь. Расположен по адресу : http://en.
 wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike - Периодическая%20таблица%20из%20%20элементов. Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Химия 3.1. Введение в периодическую таблицу» — YouTube. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Молекула. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Molecule. Лицензия : CC BY-SA: Attribution-ShareAlike
- молекулярная геометрия. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/молекулярное%20geometry.
 Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike - Периодическая%20таблица%20из%20%20элементов. Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
- «Химия 3.1. Введение в периодическую таблицу» — YouTube. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- молекула кофеина.png. Предоставлено : Википедия. Расположен по адресу : https://commons.wikimedia.org/wiki/File:Caffeine_Molecule.png. Лицензия : CC BY-SA: Attribution-ShareAlike
- пропанол.gif. Предоставлено : солнечная энергия зеленой планеты. Расположен по адресу : http://www.
 green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: Нет данных Авторские права
green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: Нет данных Авторские права - Ион. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Ion. Лицензия : CC BY-SA: Attribution-ShareAlike
- ион. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/ion. Лицензия : CC BY-SA: Attribution-ShareAlike
- цвиттерион. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/zwitterion. Лицензия : CC BY-SA: Attribution-ShareAlike
- электронное облако. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/electron_cloud. Лицензия : CC BY-SA: Attribution-ShareAlike
- Периодическая%20таблица%20из%20%20элементов.
 Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike - «Химия 3.1. Введение в периодическую таблицу» — YouTube. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- молекула кофеина.png. Предоставлено : Википедия. Расположен по адресу : https://commons.wikimedia.org/wiki/File:Caffeine_Molecule.png. Лицензия : CC BY-SA: Attribution-ShareAlike
- пропанол.gif. Предоставлено : солнечная энергия зеленой планеты. Расположен по адресу : http://www.green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: нет данных Авторское право
- ионов.


 mk.ru
mk.ru
 Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам.
Они отталкиваются от одинаковых электрических зарядов и притягиваются к противоположным зарядам. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Periodic_trends. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Periodic_trends. Лицензия : CC BY-SA: Attribution-ShareAlike  wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/atomic_number. Лицензия : CC BY-SA: Attribution-ShareAlike 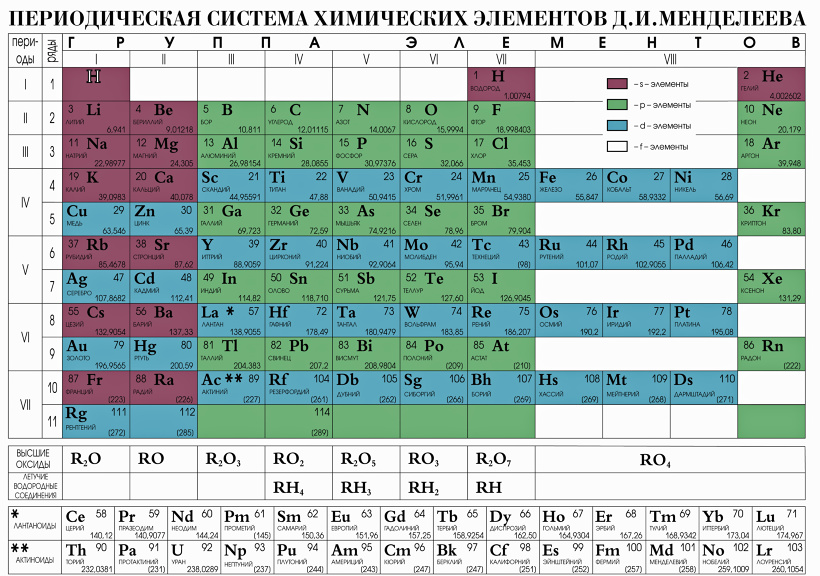 Лицензия : CC BY-SA: Attribution-ShareAlike
Лицензия : CC BY-SA: Attribution-ShareAlike  green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: Нет данных Авторские права
green-planet-solar-energy.com/этанол.html. Лицензия : Общественное достояние: Нет данных Авторские права  Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Wikimedia. Расположен по адресу : http://commons.wikimedia.org/wiki/File:Periodic_table_of_the_elements.jpg. Лицензия : CC BY-SA: Attribution-ShareAlike 