Химия всё что нужно знать для ОГЭ – Основные формулы для решения задач по химии
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов)Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023частиц (атомов, молекул, ионов) как 1 моль вещества.
Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Порядка тысячи. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества.
Обозначается как Mr. Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — h3SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(h3SO4)=1•2+32+16•4=98 г\моль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22. 4? Из закона Авогадро:
4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=m\Mr
n=V\22. 4 (л\моль)
4 (л\моль)
Масса веществаm (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (л\моль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
Задачи 35 из реального по химии-2020
Продолжаем разбор реальных заданий ЕГЭ по химии-2020.
Разбор задачи 34 на атомистику ЕГЭ 16 июля 2020
Разбор заданий на равновесие
Разбор варианта реального ЕГЭ по химии-2020
Решение некоторых интересных задач 35 (задачи на определение формулы вещества) из реального ЕГЭ по химии 14 июля 2020 года. Условия восстановлены по материалам в интернете, поэтому могут отличаться от оригинальных.
Условия восстановлены по материалам в интернете, поэтому могут отличаться от оригинальных.
Задачи примечательны тем, что для их решения необходимо хорошее понимание органической химии, а не знание схем или алгоритмов. Действительно, расчеты в разобранных задачах довольно примитивные. Основную сложность представляет интерпретация результатов расчетов, а именно определение структурной формулы вещества из описания свойств и из молекулярной формулы. Именно на этом этапе пригодится хорошее понимание органической химии, в том числе специфических тем, на которые обращают мало внимания при изучении курса органической химии (амины, аминокислоты и др.).
Хочу отметить, что приведенные задачи полностью соответствуют кодификатору и школьной программе, на мой взгляд. Это хорошие, нестандартные и нешаблонные задания.
Но из-за этой нестандартности и возникли у многих вопросы: ведь в официальных материалах, которые публикуются ФИПИ для подготовки абитуриентов, как правило, такими задачами «и не пахнет». Я говорю про демонстрационную версию ЕГЭ-2020, официальные сборники от авторов ФИПИ, банк задач на портале ФИПИ. Как правило, задания в них берутся из экзаменов прошлых лет.
Я говорю про демонстрационную версию ЕГЭ-2020, официальные сборники от авторов ФИПИ, банк задач на портале ФИПИ. Как правило, задания в них берутся из экзаменов прошлых лет.
Остановимся подробно на конкретных заданиях.
| 1. Вещество А содержит 9,3% углерода, 10,85% азота, 24,8% серы, 49,6% кислорода по массе. Известно, что вещество А получают восстановлением вещества В цинком в присутствии серной кислоты. На основании данных условия задания:
|
2. При полном сгорании образца органического вещества А массой 3,3 г было получено 2,64 г углекислого газа, 2,43 г бромоводорода, 90 мг воды и 112 мл (при н.у.) азота. Известно, вещество А может быть получено при бромировании вещества Б, не содержащего атомы углерода в sp3-гибридизации. При полном сгорании образца органического вещества А массой 3,3 г было получено 2,64 г углекислого газа, 2,43 г бромоводорода, 90 мг воды и 112 мл (при н.у.) азота. Известно, вещество А может быть получено при бромировании вещества Б, не содержащего атомы углерода в sp3-гибридизации.На основании данных условия задания: 1) проведите все необходимые вычисления (указывайте единицы измерения физический величин) и установите молекулярную формулу исходного органического вещества; 2) составьте структурную формулу этого вещества, которая отображает порядок связи атомов в его молекуле; 3) напишите уравнение реакции получения вещества А из вещества Б (используйте структурные формулы органических веществ). |
3. Вещество А содержит 54,13% углерода, 11,28% водорода, 24,06% кислорода и 10,53% азота по массе. Известно, что вещество А содержит один четвертичный атом углерода. На основании данных условия задачи: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции, протекающей при нагревании вещества А с гидроксидом бария (используйте структурные формулы органических веществ) |
| 4. При сжигании вещества А массой 13,24 г выделилось 10,56 г углекислого газа и 9,72 г бромоводорода. Известно, что вещество А содержит гидроксильную группу, и вещество А можно получить бромированием вещества В. На основании данных условия задачи: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции, протекающей при получении вещества А из вещества В (используйте структурные формулы органических веществ). |
| 5. При сжигании вещества А (или Б) массой 18 г выделилось 16,8 л углекислого газа и 9 г воды. Известно, что вещество А можно получить при взаимодействии вещества Б и оксида меди. Вещество А реагирует с аммиачным раствором оксида серебра в соотношении 1:4. На основании данных условия задачи: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции, протекающей при взаимодействии вещества А с аммиачным раствором оксида серебра (используйте структурные формулы органических веществ) |
6. При сжигании органического вещества А массой 1 г выделилось 1,12 л углекислого газа и 0,72 г воды.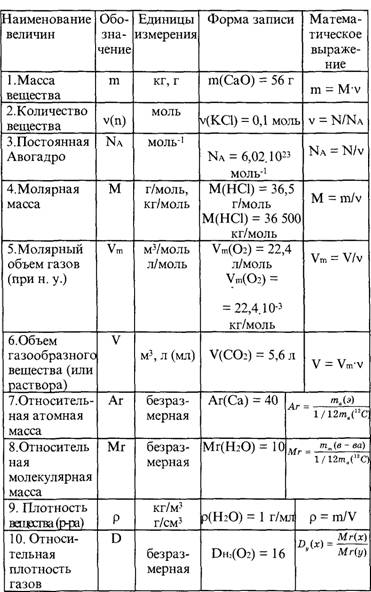 Известно, что вещество А образуется в реакции гидратации углеводорода Б. Углеводород Б может реагировать с аммиачным раствором оксида серебра в соотношении 1:2. Известно, что вещество А образуется в реакции гидратации углеводорода Б. Углеводород Б может реагировать с аммиачным раствором оксида серебра в соотношении 1:2.1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А; 2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции гидратации углеводорода Б с образованием вещества А (используйте структурные формулы органических веществ) |
| 7. На основании данных условия задачи:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции гидратации углеводорода Б с образованием вещества А (используйте структурные формулы органических веществ) |
Понравилось это:
Нравится Загрузка. ..
..
Формулы для решения задач, связанных с кислотами и основаниями
Кислотно-щелочные реакции и связанные с ними расчеты играют основную роль во многих химических, биологических и экологических системах. Определяете ли вы концентрацию ионов водорода [H + ]; концентрация ионов гидроксида, [OH ˗ ]; рН; или pOH, уравнение и калькулятор — важные инструменты, которые должны быть в вашем наборе инструментов. Ниже приведены некоторые удобные формулы для решения кислотно-основных задач.
Расчет концентрации ионов водорода или гидроксида
Следующее уравнение позволяет рассчитать концентрацию ионов водорода, [H + ], при 25°C, если известна концентрация ионов гидроксида, [OH – ]; вы также можете найти [OH – ], если знаете [H + ]. Просто разделите 1 × 10 – 14 на заданную концентрацию, и вы получите нужную концентрацию. Совет: Чтобы использовать экспоненциальное представление на вашем калькуляторе, используйте клавишу EE или EXP (за которой следует показатель степени), а не клавиши × 10^.
Расчет концентрации ионов водорода или гидроксида по pH или pOH
Знайте, как вычислять [H + ] или [OH – ], зная pH или pOH (или наоборот). Используйте следующие формулы:
Многие научные и графические калькуляторы различаются тем, как они обрабатывают ввод значений и логарифмирование, поэтому знайте правильный порядок нажатия клавиш для своего калькулятора. Обязательно просмотрите руководство к калькулятору или поищите его в Интернете.
Расчет pH при заданном значении pOH
Вычисление pH, когда вы знаете pOH (или наоборот), вероятно, является самым простым из вычислений кислотно-щелочного баланса. Вот формула:
рН + рОН = 14
Просто вычтите заданное значение из 14 (не забывая о значащих цифрах), чтобы получить нужное значение.
Выполнение расчетов титрования с соотношением кислот и оснований 1:1
Когда вам даны расчеты титрования, в которых кислота и основание реагируют в соотношении 1:1 в соответствии с сбалансированным уравнением, следующее уравнение предлагает быстрый и простой способ решить либо концентрацию одного из веществ, либо объем необходимо для завершения титрования:
М А В А = М В В В
Если кислота и основание не реагируют в соотношении 1:1, используйте стехиометрию (или размерный анализ), чтобы найти неизвестное количество. Между прочим, стехиометрия работает и для вопросов о соотношении 1:1; это просто занимает один или два шага. Помните : Следите за своими юнитами! Отмените то, от чего вам нужно избавиться, и убедитесь, что у вас все еще есть нужные единицы в вашем окончательном ответе.
Между прочим, стехиометрия работает и для вопросов о соотношении 1:1; это просто занимает один или два шага. Помните : Следите за своими юнитами! Отмените то, от чего вам нужно избавиться, и убедитесь, что у вас все еще есть нужные единицы в вашем окончательном ответе.
Об этой статье
Эта статья взята из книги:
- Химия: 1001 практические задачи для чайников (+ бесплатная онлайн-практика),
и химия на уровне колледжа за более чем 30 лет обучения.
Ричард Х. Лэнгли, доктор философии, работает на факультете Государственного университета Стивена Ф. Остина в Накогдочесе, штат Техас, где он преподает химию.
Хизер Хаттори преподавала химию как в средней школе, так и в колледже за более чем 30 лет обучения.
Ричард Х. Лэнгли, доктор философии, работает на факультете Государственного университета Стивена Ф. Остина в Накогдочесе, штат Техас, где он преподает химию.
Эту статью можно найти в категории:
- Химия,
2.7: Решение задач на уравнения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25449
Многие задачи по химии связаны с манипулированием уравнениями и требуют использования нескольких шагов преобразования. Такие задачи легко решить как числовые задачи, если вы понимаете, как к ним подходить. Четыре простых шага в решении проблем: ПРОЧИТАЙТЕ-ПЛАНИРУЙТЕ-РЕШИТЕ-ПРОВЕРЬТЕ.
Этапы решения задач по химии
- ПРОЧИТАЙТЕ вопрос: Прежде чем приступить к вычислениям и манипуляциям с уравнениями, внимательно прочитайте всю задачу, чтобы убедиться, что вы понимаете, о чем ее спрашивают.
- ПЛАН вашего подхода:
- Запишите всю предоставленную вам информацию. Нередки случаи, когда задачи дают больше фактов, чем требуется для решения — в этом есть доля реальности в задаче.
- Определите уравнения, которые необходимо использовать для решения задачи. Часто для получения желаемого ответа требуется манипулировать одним или несколькими уравнениями.
- РЕШИТЬ проблему
- Перед расчетом результатов подтвердите правильность единиц , необходимых для уравнений. Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений.

- Вставьте соответствующие параметры в уравнения и получите ответ. Не забывайте, что в большинстве ответов будут фигурировать единицы.
- Перед расчетом результатов подтвердите правильность единиц , необходимых для уравнений. Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений.
- ПРОВЕРЬТЕ ваш ответ: Подтвердите, что вы ответили на все, что требуется в задаче, и что ответ кажется разумным. Например, если вы вычисляете объем пробы и ваши расчетные результаты выражены в кубических километрах, вы, вероятно, допустили ошибку при преобразовании или расчете (если только вы не работаете в классе астрономии).
Пример \(\PageIndex{1}\)
| Пример \(\PageIndex{1}\) | Пример \(\PageIndex{2}\) | |
|---|---|---|
| Действия по устранению неполадок | Средний объем крови у взрослого мужчины составляет 4,7 л. Каков этот объем в миллилитрах? | Колибри может взмахнуть крыльями один раз за 18 мс. |

