Все формулы по физике. Молекулярная физика и термодинамика. 9-11 классы (Владимир Хребтов)
141 ₽
94 ₽
+ до 21 балла
Бонусная программа
Итоговая сумма бонусов может отличаться от указанной, если к заказу будут применены скидки.
Офлайн
Цена на сайте может отличаться от цены в магазинах сети. Внешний вид книги может отличаться от изображения на сайте.
В наличии в 99 магазинах. Смотреть на карте
Цена на сайте может отличаться от цены в магазинах сети. Внешний вид книги может отличаться от изображения на сайте.
В буклете знаний по тригонометрии в помощь школьникам 10-11 классов представлены основные формулы – понижения степени, приведения и произведения функций, функции суммы и разности углов, двойного и половинного аргументов, определения функций любого угла, с
Описание
Характеристики
В буклете знаний по тригонометрии в помощь школьникам 10-11 классов представлены основные формулы – понижения степени, приведения и произведения функций, функции суммы и разности углов, двойного и половинного аргументов, определения функций любого угла, с
Литера
На товар пока нет отзывов
Поделитесь своим мнением раньше всех
Как получить бонусы за отзыв о товаре
1
Сделайте заказ в интернет-магазине
2
Напишите развёрнутый отзыв от 300 символов только на то, что вы купили
3
Дождитесь, пока отзыв опубликуют.
Если он окажется среди первых десяти, вы получите 30 бонусов на Карту Любимого Покупателя. Можно писать неограниченное количество отзывов к разным покупкам – мы начислим бонусы за каждый, опубликованный в первой десятке.
Правила начисления бонусов
Если он окажется среди первых десяти, вы получите 30 бонусов на Карту Любимого Покупателя. Можно писать неограниченное количество отзывов к разным покупкам – мы начислим бонусы за каждый, опубликованный в первой десятке.
Книга «Все формулы по физике. Молекулярная физика и термодинамика. 9-11 классы» есть в наличии в интернет-магазине «Читай-город» по привлекательной цене.
Если вы находитесь в Москве, Санкт-Петербурге, Нижнем Новгороде, Казани, Екатеринбурге, Ростове-на-Дону или любом
другом регионе России, вы можете оформить заказ на книгу
Владимир Хребтов
«Все формулы по физике. Молекулярная физика и термодинамика. 9-11 классы» и выбрать удобный способ его получения: самовывоз, доставка курьером или отправка
почтой. Чтобы покупать книги вам было ещё приятнее, мы регулярно проводим акции и конкурсы.
Молекулярная физика и термодинамика. 9-11 классы» и выбрать удобный способ его получения: самовывоз, доставка курьером или отправка
почтой. Чтобы покупать книги вам было ещё приятнее, мы регулярно проводим акции и конкурсы.
Свойства, химическая структура и применение
Суммарные атомные массы всех атомов в молекуле составляют формулу молекулярного веса . Он рассчитывается в атомных единицах массы (а.е.м. или ед.). Мы также можем узнать, сколько граммов вещества содержится в одном моле соединения, взглянув на его формулу молекулярной массы . Следовательно, это сумма атомных весов всех атомов в данной молекуле данного химического соединения. Например, Формула молекулярной массы кислорода (O2) будет равна 32, потому что это сумма всех атомных масс, составляющих один атом кислорода. Формула молекулярного веса представляет собой представление атомов, присутствующих в конкретной молекуле, а также количество этих атомов. Количество атомов элемента, присутствующего в молекуле, обозначается атомным символом и нижним индексом, который появляется под ним. Например, О2 и С4 — это молекулы кислорода и углерода соответственно.
Например, О2 и С4 — это молекулы кислорода и углерода соответственно.
Что такое молекулярная масса?
Молекулы состоят из одного или нескольких атомов. Различные атомы, из которых состоит молекула, определяют массу молекулы. Молекулярная масса – это полная масса молекулы. Выражается в дальтонах. Он также известен как молярная масса, молекулярная масса и молекулярная масса. Дальтон — относительная масса изотопа углерода-12. Вес изотопа углерода-12 рассчитывается как вес атомной единицы массы и делится на 12. Чтобы узнать, сколько граммов содержится в одном моле вещества, необходимо знать его молекулярную массу или вес. Молекулярная масса Формула одного элемента представляет собой общую атомную массу всех атомов этого элемента, необходимых для образования стабильной молекулы. Например, молекулярная масса O2, равная сумме атомной массы одного атома кислорода, равна 32. Точно так же молекулярная масса железа, состоящего из одного атома, равна 56.
Как рассчитать молекулярную массу Формула веса?
Простое умножение количества атомов каждого типа, присутствующих в молекуле, на ее атомный вес и добавление весов других атомов даст молекулярный вес элемента. Молекулярная масса данной молекулы рассчитывается путем сложения атомных масс всех составляющих ее атомов. Молекулярная формула — это простой способ найти эту информацию. В результате определение и Формула молекулярной массы может быть получена из молекулярной формулы конкретной молекулы. Сумма всех атомов в данной молекуле, которую можно определить по ее молекулярной формуле, составляет формулу молекулярного веса .
Ниже приведены два примера расчета молекулярной массыПример 1. Расчет формулы молекулярной массы NaCl.
Решение: Молекулярный вес Na = 23·
Молекулярная масса Cl = 35
Количество молекул Na = 1
Количество молекул Ca = 1
Следовательно, общая молекулярная масса NaCl = 23(1) + 35(1) = 58
Пример 2: Рассчитайте формулу молекулярного веса C6H6.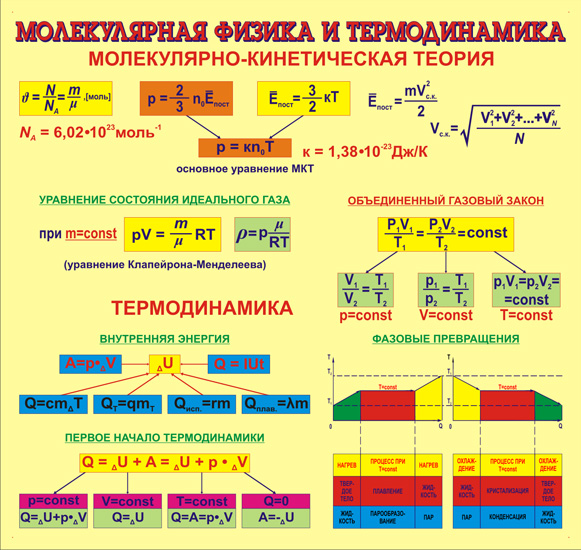
Решение: Из приведенной выше молекулярной формулы видно, что данное химическое соединение содержит 6 атомов углерода и 6 атомов водорода. Следовательно, атомные массы водорода и углерода равны 1,008 и 12,0107 соответственно.
Таким образом, молекулярная масса C6H6 составляет = 6*(атомный вес углерода) + 6*(атомный вес водорода)
= 6*(12,0107 AMU) + 6*(1,008 AMU)
= 72.0642 AMU + 6,048 а.е.м.
= 78,112 а.е.м.
Часто задаваемые вопросы (Часто задаваемые вопросы)
1. Что такое формула молекулярного веса?
Суммарный атомный вес атомов в конкретном химическом соединении определяется как Формула молекулярного веса.
2. Как рассчитать формулу молекулярного веса?
Атомные массы всех атомов, составляющих данную молекулу, складываются вместе для определения молекулярной массы молекулы. Молекулярная масса элемента может быть рассчитана путем сложения масс других атомов и умножения количества атомов каждого типа, присутствующих в молекуле, на ее атомную массу.
Определение молекулярной формулы в химии.
(существительное)
Формула, описывающая точное число и тип атомов в одной молекуле соединения.
Молекулярные формулы
- Например, для бутана молекулярная формула равна C4h20.
- Например, молекулярная формула фторида натрия представляет собой NaF.
- Молекулярные формулы являются более ограничивающими, чем химические названия и структурные формулы .
- Молекулярная формула для глюкозы: C6h22O6.
- Для преобразования между эмпирическими и молекулярными формулами эмпирическую формулу можно умножить на целое число, чтобы получить молекулярную формулу .
Связь формулы структуры
- Напомним, что молекулярная формула углеводорода (CnHm) дает информацию о количестве колец и/или двойных связей, которые должны присутствовать в его структуре формула .

- В приведенной ниже формуле тройная связь считается как две двойные связи.
- Этот молекулярный формула анализ может быть расширен за пределы углеводородов с помощью нескольких простых поправок.
- Все галогены, присутствующие в молекулярной формуле , должны быть заменены водородом.
- Каждый атом азота в формуле должен быть заменен фрагментом CH.
- Напомним, что молекулярная формула углеводорода (CnHm) дает информацию о количестве колец и/или двойных связей, которые должны присутствовать в его структуре формула .
Алкены и алкины
- Молекулярные формулы этих ненасыщенных углеводородов отражают множественное связывание функциональных групп:
- Как отмечалось ранее в разделе Анализ Молекулярных Формул , Молекулярная Формула углеводорода предоставляет информацию о возможных структурных типах, которые он может представлять.
- Например, рассмотрим соединения, имеющие формулу С5Н8.
- Формула пятиуглеродного алкана пентана C5h22, поэтому разница в содержании водорода составляет 4.

Эмпирические формулы
- Молекулярная формула соединения равна или кратна его эмпирической формуле .
- Что такое молекулярная формула декана?
- Шаг 1: Рассчитайте молекулярную массу эмпирического формула ( молекулярная
- Шаг 2: Разделите молекулярную массу молекулярной массы формулы на молекулярную массу эмпирической формулы , чтобы найти соотношение между ними.
- В этом видео показано, как перейти от молекулярной формулы соединения к соответствующей эмпирической формуле .
Анализ молекулярных формул
- Хотя структурные формулы необходимы для уникального описания органических соединений, интересно и поучительно оценить информацию, которая может быть получена только из молекулярной формулы .

- Рассмотрим углеводород с молекулярной структурой, состоящей из простой цепи из четырех атомов углерода, Ch4Ch3Ch3Ch4.
- Молекулярный формула равна C4h20 (максимальное число связанных атомов водорода по правилу 2n + 2).
- Из приведенного выше обсуждения и примеров должно быть ясно, что молекулярная формула углеводорода (CnHm) дает информацию о количестве колец и/или двойных связей, которые должны присутствовать в его структурной формуле .
- Все галогены, присутствующие в молекулярной
- Хотя структурные формулы необходимы для уникального описания органических соединений, интересно и поучительно оценить информацию, которая может быть получена только из молекулярной формулы .
Процентный состав соединений
- Атомный состав химических соединений может быть описан с использованием различных обозначений, включая молекулярные , эмпирические и структурные формулы .
- Процентный состав рассчитывается по молекулярной формуле путем деления массы одного элемента в одном моле соединения на массу одного моля всего соединения.

- Например, бутан имеет молекулярная формула C4h20.
- Однако этой информации недостаточно для определения
- Перевод между молекулярной формулой соединения и его процентным составом по массе
Многоатомные молекулы
- Наука о молекулах называется молекулярной химия или молекулярная физика, в зависимости от направленности.
- Молекулярная химия изучает законы взаимодействия между молекулами, приводящие к образованию и разрыву химических связей; молекулярная физика имеет дело с законами, управляющими их структурой и свойствами.
- Эмпирическая формула соединения представляет собой простейшее целочисленное отношение составляющих его химических элементов.
- Молекулярный формула характеризует различные молекулы, отражая точное количество атомов в их составе.

- Эмпирическая формула часто совпадает с молекулярной формулой , но не всегда; например, молекула ацетилена имеет молекулярную формулу C2h3, но простейшее целочисленное соотношение элементов – это CH.
Спектры высокого разрешения
- Разрабатывая масс-спектрометры, которые могут определять значения m/z с точностью до четырех знаков после запятой, можно различать различные
- Таким образом, масс-спектрометрия не только дает конкретное значение молекулярной массы, но также может установить молекулярную формулу неизвестного соединения.
- Поскольку данная номинальная масса может соответствовать нескольким молекулярным формулам , списки таких возможностей особенно полезны при оценке спектра неизвестного соединения.
- Разрабатывая масс-спектрометры, которые могут определять значения m/z с точностью до четырех знаков после запятой, можно различать различные
Молекулы
- Молекулярный Размер варьируется в зависимости от количества атомов, составляющих молекулу.

- Часто состав соединения можно также обозначить эмпирической формулой , которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов.
- Однако эта эмпирическая формула не всегда описывает конкретную рассматриваемую молекулу, поскольку дает только соотношение ее элементов.
- Полный элементный состав молекулы может быть точно представлен ее молекулярная формула , которая указывает точное количество атомов, находящихся в молекуле.
- Химическая формула для пропанола (C3H7OH) описывает несколько разных молекул, которые различаются положением спирта (ОН).
- Молекулярный Размер варьируется в зависимости от количества атомов, составляющих молекулу.
Наименование молекулярных соединений
- Молекулярные соединения названы с использованием систематического подхода префиксов для обозначения количества каждого элемента, присутствующего в соединении.
- Молекулярные соединения образуются, когда два или более элементов имеют общие электроны в ковалентной связи для соединения элементов.








