II. Молекулярная физика Основные формулы
• Основное уравнение кинетической теории газов
,
где р – давление газа, n – концентрация молекул (число молекул в единице объема), – средняя кинетическая энергия поступательного движения одной молекулы, угловые скобки обозначают осреднение по
большому ансамблю частиц, m0 – масса молекулы, – средняя квадратичная скорость движения молекул.
• Средняя кинетическая энергия поступательного движения одной молекулы
,
где k = 1,38·10-23 Дж/К – постоянная Больцмана, Т – абсолютная температура.
• Энергия теплового движения молекул (внутренняя энергия идеального газа):
,
где i – число степеней свободы молекулы, m – масса газа, М – молярная масса данного вещества, R = 8,31 Дж/(кг·К) – универсальная газовая постоянная,

• Числом степеней свободы называется число независимых координат полностью определяющих положение тела в пространстве. Любая молекула имеет 3 поступательных степени свободы (iпост=3). Молекулы, кроме одноатомных, имеют еще вращательные степени свободы (у двухатомных молекул iвр = 2, у многоатомных iвр = 3) и колебательные степени свободы, которые при невысоких (комнатных) температурах не учитываются.
• В соответствии с законом Больцмана о равномерном распределении энергии по степеням свободы, в среднем на каждую степень свободы молекулы приходится одинаковая энергия, равная .
• Средняя кинетическая энергия вращательного движения одной молекулы:
• Средняя суммарная кинетическая энергия одной молекулы:
,
где i – число степеней свободы молекулы
(i=iпост+ iвр).
• Средняя квадратичная скорость молекулы:
• Средняя арифметическая скорость (средняя скорость теплового движения)молекулы:
,
где m0 – масса одной молекулы, М – молярная масса вещества, причем ,
NA= 6,023·1023 1/моль – число Авогадро.
• Барометрическая формула характеризует изменение давления газа с высотой в поле сил тяжести:
или ,
где p – давление на высоте h над уровнем моря, p0 – давление на высоте h = 0, g
• Распределение Больцмана для концентрации частиц в силовом поле имеет вид:
,
где n – концентрация частиц, обладающих
потенциальной энергией Wп , n0 – концентрация
частиц в точках поля с Wп = 0.
Примеры решения задач
Задача
1.
Решение. Согласно закону Больцмана о равном распределении энергии по степеням свободы на каждую степень свободы приходится энергия равная , гдеk – постоянная Больцмана, Т – абсолютная температура.
Так как молекула кислорода двухатомная, у нее две вращательных степени свободы, поэтому средняя кинетическая энергия вращательного движения выразится формулой:
Подставим в полученную формулу значения
Кинетическая энергия всех N молекул, содержащихся в 4 г кислорода равна:
Число всех молекул газа можно вычислить по формуле:
,
где NA – число
Авогадро,
–
количество вещества,m – масса газа, М
– молярная
масса.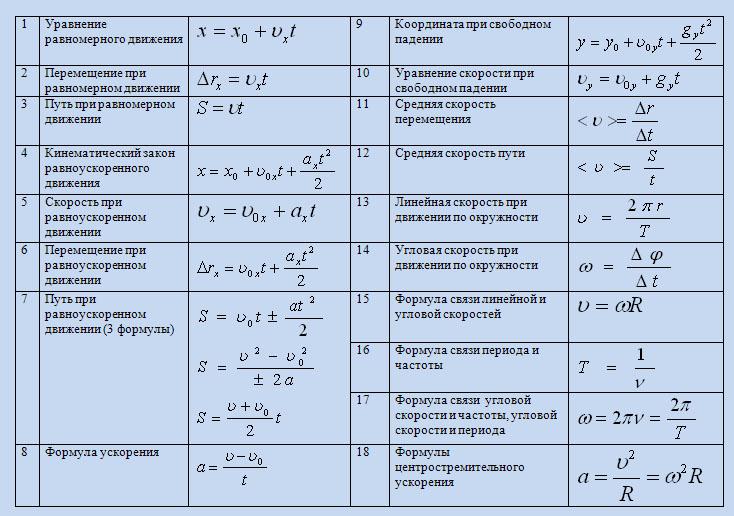 Учтя приведенные выражения,
получим:
Учтя приведенные выражения,
получим:
Подставляем числовые значения: N
Выведем размерность полученной величины:
Задача 2. В воздухе при нормальных условиях взвешены одинаковые частицы. Известно, что концентрация частиц уменьшается в два раза на высоте h = 20 м. Определить массу частицы.
Решение. Воспользуемся формулой распределения Больцмана:
,
где Wп = m0gh – потенциальная энергия частицы в поле сил тяжести.
Подставив это выражение в формулу распределения Больцмана, получим:
Логарифмируем обе части уравнения по основанию е, тогда:
, откуда
Подставив числовые значения в полученную формулу, найдем
Выведем размерность полученной величины:
Формулы по молекулярной физике и термодинамике
- формат doc
- размер 38.
 11 КБ
11 КБ - добавлен 17 июня 2009 г.
Молекулярно-кинетическая теория идеальных газов.
Основы термодинамики.
Реальные газы, жидкости и твёрдые тела
Смотрите также
- формат pdf
- размер 3.1 МБ
- добавлен 21 апреля 2010 г.
Издательство: Мир Год: 1977 Страниц: 279 В книге собраны основные формулы, единицы, константы, переводные множители и таблицы величин, которыми постоянно пользуются в своих работах астрономы, физики и геофизики. Справочник содержит необходимые сведения по общей физике, спектрам, теории излучения, данные о Солнце, Земле, Луне и других объектах Солнечной системы, о звездах, межзвездной среде, галактиках, космических лучах – справочный материал о Вс.
- формат pdf
- размер 17.01 МБ
- добавлен 03 февраля 2011 г.
2-е изд., перераб. и доп. – М.: Проспект, 2010. – 496 с. Словарь содержит более тысячи четырехсот терминов. Преобладающее большинство из них встречаются в различных разделах курса физики средней и высшей школы: в механике, молекулярной физике и термодинамике, электричестве и магнетизме, геометрической, волновой и квантовой оптике, атомной и ядерной физике, физике элементарных частиц. В словарь включены толкования нескольких десятков терминов из…
- формат doc
- размер 863 КБ
- добавлен 24 февраля 2010 г.
Файл содержит формулы из курса физики, которые будут полезны учащимся старших классов школ и младших курсов вузов.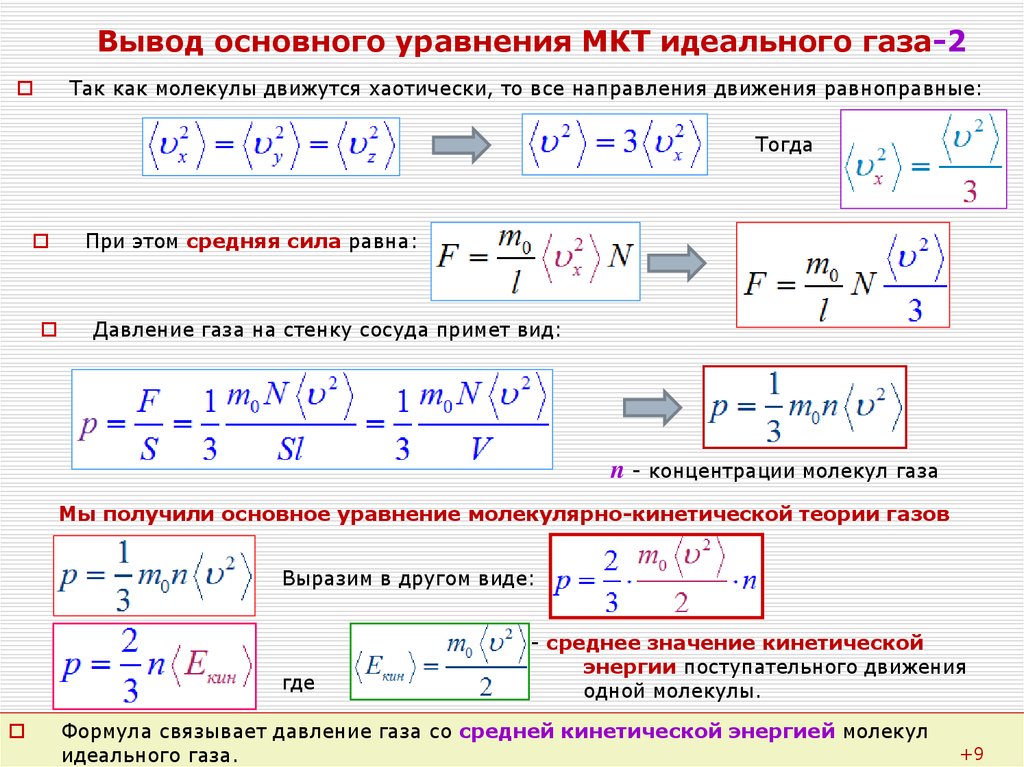 Все формулы изложены в компактном виде с небольшими комментариями. Файл также содержит полезные константы и прочую информацию.
Все формулы изложены в компактном виде с небольшими комментариями. Файл также содержит полезные константы и прочую информацию.
- формат jpg
- размер 5.71 МБ
- добавлен 30 сентября 2009 г.
1 таблица из 4. Профессионально составленные таблицы от компании ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы: – структура и содержание механики – структура и содержание кинемат…
- формат jpg
- размер 4.77 МБ
- добавлен 30 сентября 2009 г.
Профессионально составленные таблицы от ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений -…
Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений -…
- формат jpg
- размер 5.43 МБ
- добавлен 30 сентября 2009 г.
Профессионально составленные таблицы от ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений -. ..
..
Справочник
- формат jpg
- размер 1.11 МБ
- добавлен 10 марта 2011 г.
Профессионально составленные таблицы от ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п.rn
- формат jpg
- размер 3.5 МБ
- добавлен 30 сентября 2009 г.
Профессионально составленные таблицы от ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений -…
Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений -…
- формат jpg
- размер 5.16 МБ
- добавлен 30 сентября 2009 г.
Профессионально составленные таблицы от ИНФОПЛАСТ. Таблица представляет в сжатом виде описание основных физических понятий и законов. Содержит формулы и графики. Таблица состоит из четырех частей, посвященных механике, кинематике, динамике, статике, термодинамике, электродинамике, электроэнергетике, волновой и квантовой оптике и т. п. Основные разделы – структура и содержание механики – структура и содержание кинематики – графики движений – д…
Словарь
- формат doc
- размер 244.
 47 КБ
47 КБ - добавлен 12 мая 2009 г.
Краткая методичка для подготовки к экзамену и для шпор. 57 ст. формат DOC (Word) Содержание: Физические основы механики Пояснения к рабочей программе Основные формулы Примеры решения задач по механике Электричество и магнетизм Пояснения к рабочей программе Основные формулы Примеры решения задач по электричеству и магнетизму Колебания. Волны Пояснения к рабочей программе Основные формулы Примеры решения задач по колебаниям и волнам Оптика Пояснен…
Все формулы атомов и молекул Класс 9
- Количество молей атомов =
- Количество молей =
- Количество молей молекул =
- Количество молей молекул =
- 1 моль молекул = грам молекулярная масса
- 1 моль молекул = 6,023 × 1023 молекул
пр. Вычислите массу следующего:
- 0,5 моль O 2 газ
- 0,5 моль атомов О
- 3,011 × 10 23 атомов O
- 6,023 × 10 23 молекул O 2 .

(Дано: грамм атомной массы кислорода = 16 г, грамм молекулярной массы кислорода (O 2 ) = 32 г).
Решение:
- 0,5 моля газообразного O2
Количество молей =
Масса O 2 в граммах (м) = количество молей × M
= 0,5 × (32 г) = 16 г
- 0,5 моль атомов кислорода (O)
Количество молей =
Масса кислорода (O) в граммах (m) = количество молей × M
= 0,5 × (16 г) = 8 г.
- 3,011 × 1023 атомов кислорода (O)
Шаг I: Расчет нет. грамм атомов кислорода
Количество атомов в граммах =
Этап II: Расчет массы атомов кислорода (O)
Масса атомов кислорода (O) = атомная масса кислорода в граммах x количество атомов кислорода в граммах.
= 16 × 0,5 = 8г.
- 6,023 × 1023 молекул кислорода (O2) —
Шаг I: Расчет нет. молей кислорода.
молей кислорода.
Количество молей =
Этап II : Расчет массы молекул кислорода (O2).
Масса молекул кислорода (O2) = молекулярная масса кислорода в граммах x количество молей кислорода.
= 32 × 1 = 32 г
Часто задаваемые вопросы (FAQ)
Q1. Что такое атом и молекула класса 9?
Ответ. Атом – это мельчайшая частица вещества, участвующая в химической реакции.
Q2. Каков размер атома класса 9?
Ответ. Они крошечные, а их радиус измеряется в нанометрах. Атомный радиус измеряется в нанометрах. 1/109 м = 1 нм или 1 м = 10 9 нм.
Q3. Какие четыре типа атомов существуют?
Ответ. Итак… что отличает атомы друг от друга? Что ж, давайте посмотрим на водород, кислород, углерод и азот, четыре наиболее распространенных элемента в Солнечной системе.
Q4. Каков размер молекулы?
Ответ. Молекулы, обычно используемые в качестве строительных блоков органического синтеза, имеют величину от нескольких ангстрем (Å) до нескольких зини унций или около полумиллиона метров.
Q5. Какова форма атома?
Ответ. Атомы не имеют четко определенной внешней границы, поэтому положение атома обычно определяет его размер. Это измеряет расстояние, на котором электронное облако исходит от ядра. Это предполагает, что атом имеет сферическую форму, о которой слышно только у атомов в космосе или в свободном пространстве.
Q6. Из чего состоят атомы?
Ответ. Атомы состоят из двух фундаментальных частиц: электронов и кварков. Электроны занимают пространство вокруг ядра атома. Каждый электрон имеет 1 электрический заряд. Кварки производят протоны и нейтроны, которые, в свою очередь, образуют ядро атома.
В7. Кто открыл электрон?
Ответ. Дж.Дж. Томсон открыл электрон. Он был профессором физики Кембриджского университета в Великобритании. Он поместил катодные трубки в электрические и магнитные поля.
Q8. Какие пять примеров молекул?
Ответ. Вот примеры обычных молекул:
- H 2 O (вода)
- N 2 (азот)
- O 3 (озон)
- CaO (оксид кальция)
- C 6 H 12 O 6 (глюкоза, разновидность сахара)
- NaCl (поваренная соль)
Q9. Какой самый маленький атом?
Ответ. Самый маленький атом — гелий с радиусом 31 пм, а самый большой — цезий с радиусом 298 пм. Однако водород имеет более низкий атомный номер, чем гелий; расчетный радиус атома водорода примерно на 70% больше.
Также проверьте
- Химические формулы
- Вопросы по атомам и молекулам
- Атомная масса в граммах и Молекулярная масса в граммах
Формула и молекулярная масса | Химия на количественном языке: основы общих химических расчетов
Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry CalculationsAnalytical ChemistryBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry CalculationsAnalytical ChemistryBooksJournals Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Ориахи, Кристофер О,
«Формула и молекулярная масса»
,
Химия на количественном языке: Основы расчетов общей химии
(
Нью -Йорк,
2009;
онлайн EDN,
Oxford Academan
, 12 ноября. /doi.org/10.1093/oso/9780195367997.003.0008,
/doi.org/10.1093/oso/9780195367997.003.0008,
, по состоянию на 10 декабря 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry CalculationsAnalytical ChemistryBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford AcademicChemistry in Quantitative Language: Fundamentals of General Chemistry CalculationsAnalytical ChemistryBooksJournals Термин поиска на микросайте
Advanced Search
Abstract
Многие химики используют термины «масса формулы» и «молекулярная масса» как синонимы при работе с химическими соединениями известной формулы. Но между этими двумя терминами есть небольшая разница, как объясняется ниже. Формульная масса соединения представляет собой сумму атомных масс всех атомов в формульной единице соединения, независимо от того, является ли оно ионным или молекулярным (ковалентным). Масса формулы основана на соотношении различных элементов в формуле, в отличие от молекулярной массы, которая зависит от фактического количества атомов каждого типа (сравните раздел 6.2, «Эмпирическая формула»). Массы формул являются относительными, поскольку они получены из относительных атомных масс. Например, формула массы фосфорной кислоты h4PO4 равна 9.7,98 атомных единиц массы (а.е.м.), что получается при сложении атомных масс (взятых из периодической таблицы) элементов в одну формульную единицу (т. е. 3 Н + 1 Р + 4 О). (3 × ат. вес. H) + (1 × ат. вес. P) + (4 × ат. вес. O) = (3 × 1,00) + (1 × 30,97) + (4 × 16,00) = 97,97 Как только известна фактическая формула химического вещества, молекулярная масса может быть определена способом, аналогичным расчету массы формулы.
Но между этими двумя терминами есть небольшая разница, как объясняется ниже. Формульная масса соединения представляет собой сумму атомных масс всех атомов в формульной единице соединения, независимо от того, является ли оно ионным или молекулярным (ковалентным). Масса формулы основана на соотношении различных элементов в формуле, в отличие от молекулярной массы, которая зависит от фактического количества атомов каждого типа (сравните раздел 6.2, «Эмпирическая формула»). Массы формул являются относительными, поскольку они получены из относительных атомных масс. Например, формула массы фосфорной кислоты h4PO4 равна 9.7,98 атомных единиц массы (а.е.м.), что получается при сложении атомных масс (взятых из периодической таблицы) элементов в одну формульную единицу (т. е. 3 Н + 1 Р + 4 О). (3 × ат. вес. H) + (1 × ат. вес. P) + (4 × ат. вес. O) = (3 × 1,00) + (1 × 30,97) + (4 × 16,00) = 97,97 Как только известна фактическая формула химического вещества, молекулярная масса может быть определена способом, аналогичным расчету массы формулы. Молекулярная масса соединения представляет собой сумму атомных масс всех атомов в одной молекуле соединения. Этот термин применяется только к соединениям, существующим в виде молекул, таким как h3O, SO2 и глюкоза C6h22O6. Например, молекулярная масса этанола C2H5OH составляет: (2×C)+(6×H)+(1×O) (2×12,0)+(6×1,0)+(1×16,0) = 46. Когда ионные соединения, такие как NaCl, Zn(NO3)2 и Nh5Cl, находятся в кристаллическом состоянии или в форме раствора, они не содержат физически обособленных незаряженных молекулярных образований. Поэтому химики часто используют термин формула массы для обозначения общего состава таких веществ. Пример 4.1 Рассчитайте массу формулы (FM) NaOH, используя таблицу атомных масс (AM).
Молекулярная масса соединения представляет собой сумму атомных масс всех атомов в одной молекуле соединения. Этот термин применяется только к соединениям, существующим в виде молекул, таким как h3O, SO2 и глюкоза C6h22O6. Например, молекулярная масса этанола C2H5OH составляет: (2×C)+(6×H)+(1×O) (2×12,0)+(6×1,0)+(1×16,0) = 46. Когда ионные соединения, такие как NaCl, Zn(NO3)2 и Nh5Cl, находятся в кристаллическом состоянии или в форме раствора, они не содержат физически обособленных незаряженных молекулярных образований. Поэтому химики часто используют термин формула массы для обозначения общего состава таких веществ. Пример 4.1 Рассчитайте массу формулы (FM) NaOH, используя таблицу атомных масс (AM).
Ключевые слова: формула масса, молярная масса, молекулярная масса
Предмет
Аналитическая химия
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом.
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. - После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.


 11 КБ
11 КБ 47 КБ
47 КБ
 Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic. Не используйте личную учетную запись Oxford Academic.
Не используйте личную учетную запись Oxford Academic.