Открытие новых элементов
Немецкий учёный, академик Лотар Кольдиц так истолковывает особенности открытия Д.И. Менделеева, сопоставляя в высшей степени убедительные результаты его труда с работами других исследователей, искавших подобные закономерности:
«Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. <…>Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…»
Развивая в 1869—1871 годах идеи периодичности, Д.И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов.
В статье, датированной 29 ноября 1870 года предсказал существование, вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов — «экаалюминия», «экабора» и «экасилиция». Затем предсказал существование ещё восьми элементов, в том числе «двителлура» — полония, «экаиода» — астата , «экамарганца» — технеция , «двимарганца» — , «экацезия» — франция.
Элементы, предсказанные Менделеевым
- Галлий («экаалюминий»), открыт в 1875 г. П.Э. Лекок де Буободраном
- Скандий («экабор»), открыт в 1879 г. Л.Нильсоном
- Германий («экасилиций») открыт в 1886 г. К.Винклером
- Полоний («двителлур»), открыт Пьером и Марией Кюри в 1898 г.
- Радий («экабарий»), открыт Пьером и Марией Кюри в 1898 г.
- Протактиний, открыт О.
 Ганом и Л. Мейтнер в 1918 г.
Ганом и Л. Мейтнер в 1918 г. - Гафний, открыт Д. Хевеши и Д.Костером в 1923 г.
- Рений («двимарганец»), открыт В. Ноддак, И. Такке и О. Бергом в 1925 г.
- Технеций («экамарганец»), открыт Э. Сегре и К. Перье в 1937 г.
- Франций («экацезий»), открыт М. Перей в 1939 г.
Галлий. В 1875 г. французский ученый П. Лекок де Буабодран, исследуя цинковую обманку обнаружил в ней с помощью спектроскопического метода новый элемент и определил некоторые его свойства. Он назвал новый элемент галлием (Gallium) в честь своей родины – Франции (лат. Gallia).
Скандий. В 1879 г. шведский химик Л. Нильсон выделил 69 г. эрбиевой земли с примесью других редких земель. Разделив эту пробу, он получил окись иттербия и неизвестную землю, оказавшуюся новым элементом. Нильсон назвал его скандием в честь Скандинавского полуострова, на котором находится Швеция. Л.Нильсон пишет: «…не остается никакого сомнения, что в скандии открыт экабор<…> Так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование найденного простого тела, но и наперед дать его важнейшие свойства».
Германий .В 1886 г. немецкий химик К. Винклер в обнаруживает в серебряном минерале аргиродите новый элемент, который впоследствии назвал в честь своей родины германием. Новый элемент оказался предсказанным Менделеевым экасилицием.
Винклер пишет: «Вряд ли может существовать более ошеломляющее доказательство правильности учения о периодичности элементов, чем то, которое заключается в материализации до сих пор гипотетического «экасилиция». Это, поистине говоря, нечто больше, чем простое подтверждение смело выдвинутой теории; оно означает вдохновенное расширение химического кругозора, решительный шаг в области познания».
Л. де Буабодрана, Л.Нильсона и К.Винклера, открывших галлий, скандий и германий, предсказанных и описанных Менделевым, ученый считал укрепителями периодического закона.
Прекрасным подтверждением менделеевского закона явилась и открытая Рамзаем группа инертных газов, давшая возможность включить в систему «нулевую» группу — пограничную между щелочными металлами и металлоидами.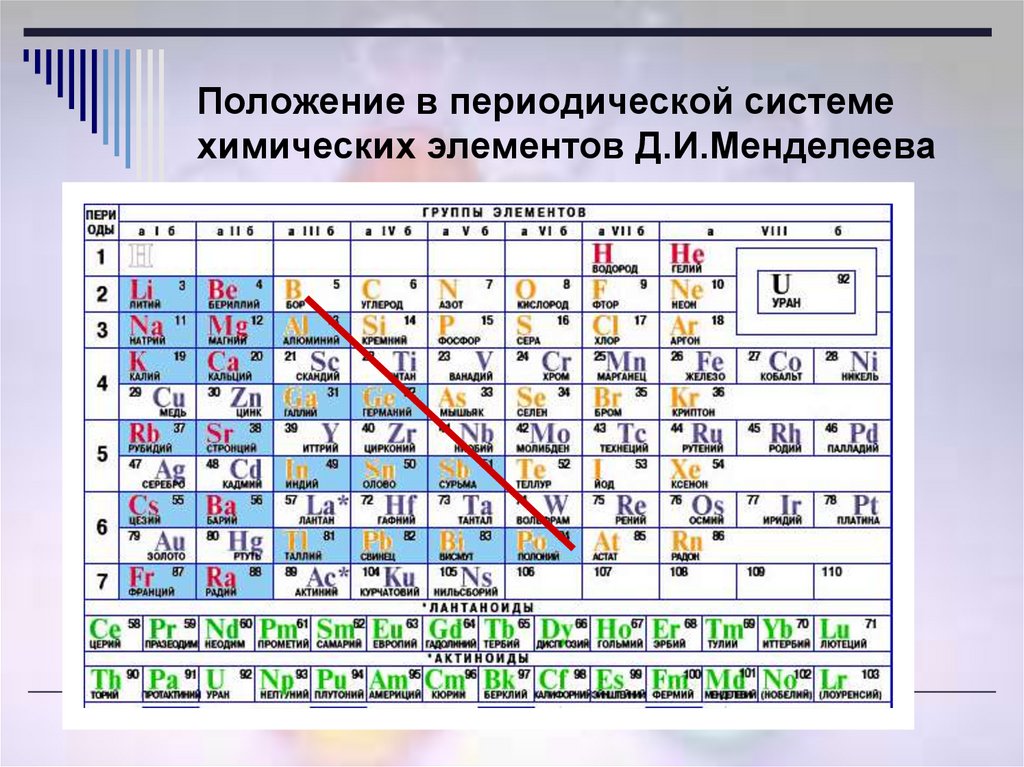
История открытия элементов
Названия элементов
Часто названия новые элементы получают по месту расположения лаборатории, где они были открыты, и по имени ученого, проводившего исследование.
Имя Д.И. Менделеева носит 101 элемент периодической системы, синтезированный в 1955 году в Беркли (США) – Менделевий (Md). Первым человеком, чье имя занесли в периодическую таблицу при жизни, стал химик Глен Сиборг. В честь него назван 106 элемент таблицы – сиборгий (Sg).
В 2016 году 118-й элемент получил название оганесон (Og) в честь российского ученого Юрия Цолаковича Оганесяна, внесшего вклад в исследования сверхтяжелых элементов.
Россия в периодической таблице
На настоящий момент 6 элементов периодической системы носят названия, связанные с Россией.
Рутений (Ru) – 44-й элемент, открыт в 1844 г. в Казани К. Клаусом, назван в честь России (лат. – Ruthenia).
– Ruthenia).
Менделевий (Md) – 101-й элемент, синтезирован в 1955 г. в Беркли (США), назван в честь Дмитрия Ивановича Менделеева.
Дубний (Db) – 105-й элемент, синтезирован в 1970 г. в Дубне и независимо в Беркли (США), назван в честь г. Дубны.
Флеровий (Fl) – 114- й элемент, открыт в 1998 г. в Дубне, назван в честь Лаборатории ядерных реакций им. Г. Н. Флёрова ОИЯИ.
Московий (Mc)– 115- й элемент, открыт в 2004 г. в Дубне, назван в честь Московской области, где находится ОИЯИ.
Оганессон (Og) – 118- й элемент, открыт в 2006 г., назван в честь российского ученого Ю.Ц. Оганесяна, руководителя лаборатории ядерных реакций им. Г.Н. Флерова ОИЯИ.
Школьники узнали секреты таблицы Менделеева на Всероссийском открытом уроке по химии
 Мероприятие, организованное Министерством просвещения РФ совместно с порталом «ПроеКТОриЯ», было посвящено Международному году Периодической таблицы химических элементов Д.И. Менделеева.
Мероприятие, организованное Министерством просвещения РФ совместно с порталом «ПроеКТОриЯ», было посвящено Международному году Периодической таблицы химических элементов Д.И. Менделеева.Во время урока ребята познакомились с человеком-легендой Юрием Оганесяном. В честь Юрия Цолаковича назван 118-ый химический элемент периодической таблицы — оганесон. Научный руководитель лаборатории ядерных реакций им. Г.Н. Флёрова Объединенного института ядерных исследований в Дубне объяснил зрителям, как получают новые элементы и отметил значимость открытия Менделеева: «Меня часто спрашивают: „Периодический закон на самом деле такой фундаментальный?“. Да! Природа создавала всё другим способом, мы это делаем в лаборатории тоже другим. Но если это атом, он должен быть сконструирован по вполне определенному закону. Именно по этому знаменитому Периодическому закону, которому сегодня исполняется 150 лет».
Специальным гостем урока стал Григорий Трубников, первый заместитель Министра науки и высшего образования РФ. Он рассказал школьникам, кто такой — современный учёный:
Он рассказал школьникам, кто такой — современный учёный:
«Это очень разносторонние люди: и в литературе, и в музыке, и в языках. Но самая главная черта, которая движет ученым — быть первым там, где никто никогда не был». И пригласил ребят в науку, потому что мы знаем об окружающем мире лишь 4% тайн природы.
Вице-президент Российского химического общества им. Д.И. Менделеева Юлия Горбунова рассказала школьникам, в чем уникальность таблицы Менделеева и как химия изменилась за 150 лет:
«Гениальность заключается в том, что Дмитрий Иванович не просто объединил их по сходству свойств, а ещё и предсказал появление новых элементов. И на сегодняшний день 118 элементов располагаются по той самой структуре, которую придумал Менделеев».
Спикеры уделили внимание и самой сложной биохимической лаборатории — человеку. 
«У нас появилось много хороших университетов не только в Москве и Санкт-Петербурге. Качественное образование вы можете получить далеко за их пределами — в Тюмени, Новосибирске, Красноярске, Томске», — добавил Степан Николаевич.
О новых материалах в современном протезировании рассказал научный сотрудник Центра композиционных материалов НИТУ «МИСиС» Фёдор Сенатов.
«Аддитивные технологии огромными шагами двигаются по всей России. Хорошие 3D-принтеры, способные напечатать костную ткань, есть во многих городах. Просто у каждого своя задача: можно печатать металлами, а можно — целыми клетками. Эти технологии есть, они активно развиваются, и это наше будущее», — ответил Фёдор.
Прямая трансляция урока была организована на портале «ПроеКТОриЯ» и в группах проекта в социальных сетях ВКонтакте и Одноклассники. К эфиру из Центра прототипирования высокой сложности «Кинетика» НИТУ «МИСиС» в режиме телемоста подключились ребята из Тобольска (родина Д.И.Менделеева), Чебоксар, Новокузнецка и Тюмени. Видеосвязь с точками подключения обеспечила компания «Ростелеком».
К эфиру из Центра прототипирования высокой сложности «Кинетика» НИТУ «МИСиС» в режиме телемоста подключились ребята из Тобольска (родина Д.И.Менделеева), Чебоксар, Новокузнецка и Тюмени. Видеосвязь с точками подключения обеспечила компания «Ростелеком».
В конце урока модератор, известный теле—, радиоведущий Антон Комолов предложил педагогам и школьникам стать соавторами следующих открытых уроков и записать видео для рубрик «Просто о сложном» и «Поставь вопросом в тупик». А также объявил старт опроса «Кто из известных людей увлекался химией?». Правильные ответы зрители смогут узнать в группах «ПроеКТОрии» в социальных сетях.
Следующий Всероссийский открытый урок состоится 21 февраля в 13:00 (мск) и будет посвящен градостроению и умным городам.
ICMM • What are minerals and metals?
Считается, что существует более 4000 различных полезных ископаемых, многие из которых содержат металлы.
Руды представляют собой твердые, природные неорганические вещества, которые залегают в земной коре. Они образовались без вмешательства человека и имеют определенный химический состав и кристаллическую структуру.
Они образовались без вмешательства человека и имеют определенный химический состав и кристаллическую структуру.
Металлы представляют собой простые вещества (например, золото, серебро и медь), которые имеют кристаллическую структуру в твердом состоянии и содержатся в рудах. Для них часто характерны такие свойства, как хорошая электропроводность и теплопроводность, внешний блеск и ковкость. Металлы, которые мы видим в нашей повседневной жизни, производятся путем переработки металлических руд. Для этого, в большинстве случаев, требуются химические вещества и особые технологии.
Распространенные группы металлов
Металлы обычно делят на группы по свойствам или назначению. Названия этих групп не являются точными или научными, однако отражают общее назначение или свойства металлов:
Благородные металлы включают в себя золото, серебро и платину. Около 90 процентов всего золота добывается на золотых приисках. Остальные 10 процентов добываются как побочный продукт при добыче других металлов, таких как медь и никель. Благородные металлы обращаются на мировых рынках и имеют различное назначение — от ювелирных изделий и электронных компонентов до каталитических конвертеров в автомобилях.
Благородные металлы обращаются на мировых рынках и имеют различное назначение — от ювелирных изделий и электронных компонентов до каталитических конвертеров в автомобилях.
Неблагородные металлы включают в себя менее дорогостоящие металлы, главным образом медь, свинец и цинк. В очищенном виде эти металлы обычно обращаются на мировых рынках в различных стандартных формах и размерах. Они представляют собой основные строительные материалы и используются повсюду в мире.
Черные металлы включают в себя металлы с высоким содержанием железа, которое входит во все виды стали. Железо на латыни имеет название ferrum, под которым этот металл известен нам из периодической таблицы Менделеева. К этой группе обычно относят такие металлы, как хром, кобальт, марганец и молибден, поскольку они преимущественно используются для улучшения свойств стали.
Цветные металлы включают в себя алюминий, медь, свинец, магний, никель, олово и цинк, и их основное назначение не связано с выплавкой стали. Обратите внимание, что некоторые из неблагородных металлов также относятся к этой группе, и поэтому выбор группы для классификации металлов зависит от контекста.
Обратите внимание, что некоторые из неблагородных металлов также относятся к этой группе, и поэтому выбор группы для классификации металлов зависит от контекста.
Редкоземельные металлы не настолько редко встречаются в земной коре, однако их добыча связана с определенными сложностями. К ним относятся скандий, иттрий, лантан и 14 элементов, следующих за лантаном в периодической таблице (лантанидов). Они повсеместно используются, хотя и в небольших объемах, в производстве стекла, керамики, глазури, магнитов, лазеров и телевизионных трубок, а также в переработке нефти.
Сплавы производятся путем смешивания двух или более металлов для получения нового уникального вещества, химические и физические свойства которого отличаются от свойств составляющих его компонентов. Свыше 90 процентов металлов на сегодняшний используются в сплавах.
Легирующие элементы обычно добавляются к чистым металлам для повышения их прочности или улучшения определенных свойств, таких как коррозионная стойкость, износостойкость и легкость в обработке. Растущие промышленные требования, такие как высокая тугоплавкость, повышенная прочность для использования в системах под давлением, усталостная прочность, легкий вес и упругость, а нередко их комбинации, лежат в основе разработки самых разнообразных сплавов.
Растущие промышленные требования, такие как высокая тугоплавкость, повышенная прочность для использования в системах под давлением, усталостная прочность, легкий вес и упругость, а нередко их комбинации, лежат в основе разработки самых разнообразных сплавов.
Наиболее распространенные сплавы в широком смысле относятся к сталям, В эти изначально прочные сплавы железа и углерода добавляются другие вещества, которые дополнительно усиливают их долговечность и другие характеристики. Например, в автомобиле встречается более 10 различных стальных сплавов: в кузове, зубчатых передачах, тягах, коленчатых валах и клапанах и так далее.
Эксперты прогнозируют, что спрос на более энергоэффективные системы, информационные технологии и космические исследования станет основным движущим фактором разработки новых сплавов в этом столетии.
что это за элемент и чем он интересен?
Эксперименты ученых из лаборатории Беркли с высокорадиоактивным элементом — эйнштейнием — выявляют его новые свойства. Рассказываем, что это за элемент, как его удалось воссоздать в Ок-Риджской национальной лаборатории, где его обнаружили впервые и на каком этапе изучение эйнштейния сейчас.
Рассказываем, что это за элемент, как его удалось воссоздать в Ок-Риджской национальной лаборатории, где его обнаружили впервые и на каком этапе изучение эйнштейния сейчас.
Как и где был обнаружен
эйнштейний?Эйнштейний (253Es) — радиоактивный элемент в периодической системе Менделеева. Этот трансурановый химический элемент с атомным номером 99, серебристый металл, обнаружен в 1952 году в Национальной лаборатории Лоуренса Беркли Министерства энергетики (лаборатория Беркли).
Открытие эйнштейния почти одновременно с фермием является результатом исследований продуктов взрыва термоядерного устройства, произведенного американцами в Тихом океане в ноябре 1952 г. (испытание «Майк»).
Иви (Айви) Майк Ivy Mike, испытание «Майк», испытание «М») это первое в мире испытание термоядерного взрывного устройства. Оно произведено США 1 ноября 1952 года на одном из моту атолла Эниветок. Из-за веса и габаритов, а также использования в качестве топлива для термоядерного синтеза жидкого дейтерия устройство не имело практической ценности в качестве оружия и предназначалось исключительно для экспериментальной проверки «двухступенчатой» конструкции, предложенной Уламом и Теллером. Эксперимент завершился успехом; оценочная мощность взрыва составила 10—12 мегатонн тротилового эквивалента.
Эксперимент завершился успехом; оценочная мощность взрыва составила 10—12 мегатонн тротилового эквивалента.
Было установлено, что в продуктах взрыва содержатся особенно тяжелые ядра урана и плутония, в том числе 224Pu и 246Pu. Образование таких ядер могло быть лишь результатом мгновенного захвата ядрами 238U нескольких нейтронов (от 6 до 17!). Это давало основание предположить, что одновременно с тяжелыми изотопами урана и плутония могли образоваться ядра элементов с атомным номером больше 98.
Действительно, при разделении продуктов взрыва обнаружилось присутствие нового тяжелого элемента, и после переработки большого количества коралловых отложений и грязи, привезенных с места взрыва, удалось выделить два изотопа (253 и 255) нового элемента. Ему было присвоено название «эйнштейний» в честь крупнейшего математика и физика XX в.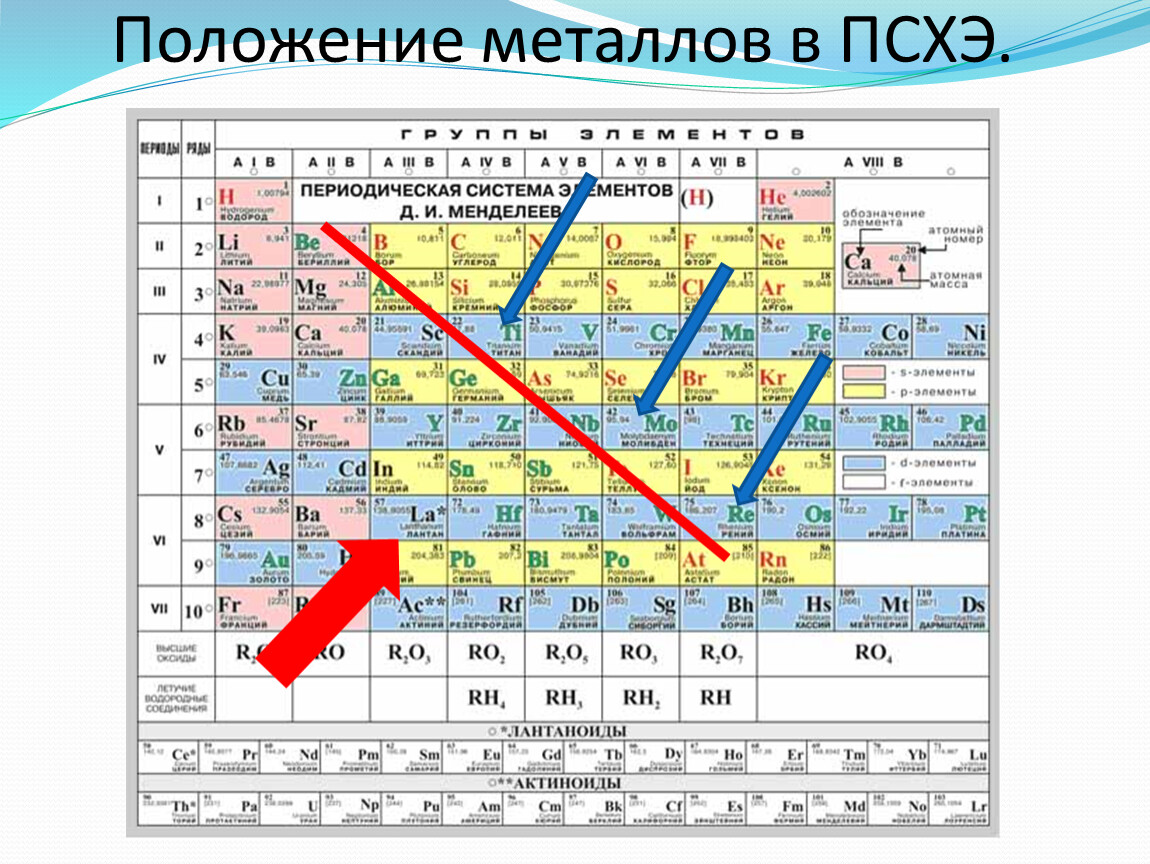 Альберта Эйнштейна. Позже элемент 99 был получен искусственно другими методами, главным образом путем продолжительного облучения плутония нейтронами высоких энергий. Этим методом за 2-3 года можно получить несколько граммов эйнштейния; при термоядерной реакции он образуется за несколько тысячных долей секунды. Наиболее устойчивый изотоп эйнштейний-254 обладает периодом полураспада около 270 дней.
Альберта Эйнштейна. Позже элемент 99 был получен искусственно другими методами, главным образом путем продолжительного облучения плутония нейтронами высоких энергий. Этим методом за 2-3 года можно получить несколько граммов эйнштейния; при термоядерной реакции он образуется за несколько тысячных долей секунды. Наиболее устойчивый изотоп эйнштейний-254 обладает периодом полураспада около 270 дней.
Почему он малоизучен и как используется?
Эйнштейний является радиоактивным металлом и принадлежит к семейству актиноидов. В соединениях он проявляет степени окисления +2 и +3. Примером может служить его иодид с химической формулой EsI3. В обычном водном растворе эйнштейний существует в наиболее устойчивой форме в виде ионов.
Также этот металл отличается кубической гранецентрированной решёткой, при этом параметр решётки около 0,575 наномеров, температура плавления — 860 °C. Характеризуется относительно высокой летучестью. Синтезированы и изучены многие твердые соединения эйнштейния, такие как Es₂O₃, EsCl₃, EsOCl, EsBr₂, EsBr₃, EsI₂ и EsI₃.
Всего известно 19 изотопов и 3 изомера с массовыми числами от 243 до 256. Самый долгоживущий из изотопов 252Es имеет период полураспада 471,7 суток.
Используется для получения менделевия при бомбардировке в циклотроне ядрами гелия.
Кварцевый флакон (диаметр 9 мм), содержащий ~ 300 мкг твердого 253Es. Возникающее освещение является результатом интенсивного излучения 253Es. Предоставлено: Haire, RG, Министерство энергетики США.Однако с чистым эйнштейнием ученые провели мало экспериментов. Дело в том, что его очень сложно воссоздать. Команда химиков из лаборатории Беркли преодолела эти препятствия, чтобы сообщить о первом исследовании, характеризующем некоторые из его свойств, открыв двери для лучшего понимания оставшихся трансурановых элементов ряда актинидов.
Как сейчас изучается элемент?
Исследование «Структурные и спектральные характеристики комплекса эйнштейний», опубликованное в журнале Nature, проводилось совместно женщиной-ученым из лаборатории Беркли Ребеккой Абергель и ученым из национальной лаборатории Лос-Аламоса Стошем Козимором. Также в работе приняли участие ученые из двух лабораторий — Калифорнийского университета в Беркли и Джорджтаунского университета. Всего в распоряжении ученых было около 250 нанограмм элемента, и этого количества вещества хватило, чтобы впервые измерить длину химической связи этого элемента — основное свойство, определяющее его взаимодействия с другими атомами и молекулами.
Также в работе приняли участие ученые из двух лабораторий — Калифорнийского университета в Беркли и Джорджтаунского университета. Всего в распоряжении ученых было около 250 нанограмм элемента, и этого количества вещества хватило, чтобы впервые измерить длину химической связи этого элемента — основное свойство, определяющее его взаимодействия с другими атомами и молекулами.
На сегодняшний день об эйнштейнии известно немного. Выяснив его химическое поведение, ученые могут применить это знание для разработки новых материалов или новых технологий. Причем не обязательно только с эйнштейнием, но и с остальными актинидами. Ученые отмечают, что тщательное изучение эйнштения в дальнейшем поможет открыть новую химию — как минимум, один новый элемент.
Как ученым удалось его воссоздать для изучения?
Абергель и ее команда использовали экспериментальные установки, недоступные несколько десятилетий назад, когда был впервые обнаружен эйнштейний, — Молекулярный литейный цех в лаборатории Беркли и Стэнфордский источник синхротронного излучения (SSRL) в Национальной ускорительной лаборатории SLAC, оба объекта Управления науки Министерства энергетики США — для проведения люминесцентной спектроскопии и эксперименты по рентгеновской абсорбционной спектроскопии.
Ученые отмечают, что получение образца в пригодном для использования виде было почти половиной успеха.
Материал изготовлен в реакторе изотопов с высоким потоком в Ок-Риджской национальной лаборатории. Это одно из немногих мест в мире, где создание эйнштейния возможно в принципе. В реакторе использовалась бомбардировка кюриевых мишеней нейтронами для запуска длинной цепи ядерных реакций. Первая проблема, с которой они столкнулись, заключалась в том, что образец был загрязнен значительным количеством калифорния, так как получение чистого эйнштейния в пригодном для использования количестве чрезвычайно сложно.
Ученые из лаборатории Беркли Дженнифер Вакер (слева направо), Летисия Арнедо-Санчес, Кори Картер, Кэтрин Шилд работают в химической лаборатории Ребекки Абергель. Предоставлено: Мэрилин Сарджент / Лаборатория Беркли.Поэтому им пришлось отказаться от своего первоначального плана по использованию рентгеновской кристаллографии, которая считается золотым стандартом для получения структурной информации о высокорадиоактивных молекулах, но требует чистого образца металла, и вместо этого придумали новый способ изготовления образцов и использования элементные методы исследования. Исследователи из Лос-Аламоса оказали критическую помощь на этом этапе, разработав держатель для образцов, который уникально подходит для решения проблем, присущих эйнштейнию.
Исследователи из Лос-Аламоса оказали критическую помощь на этом этапе, разработав держатель для образцов, который уникально подходит для решения проблем, присущих эйнштейнию.
Тогда еще одной проблемой стала борьба с радиоактивным распадом. Команда лаборатории Беркли провела свои эксперименты с эйнштейнием-254, одним из наиболее стабильных изотопов этого элемента. Его период полураспада составляет 276 дней, то есть время разложения половины материала. Хотя команда смогла провести многие эксперименты до пандемии коронавируса, у них были планы на последующие эксперименты, которые были прерваны из-за отключений, связанных с пандемией. К тому времени, когда им удалось вернуться в свою лабораторию прошлым летом, большая часть образца уже исчезла.
Что выяснили ученые?
Тем не менее, исследователи смогли измерить расстояние связи с эйнштейнием, а также обнаружили некоторое физико-химическое поведение, которое отличалось от того, что можно было бы ожидать от ряда актинидов.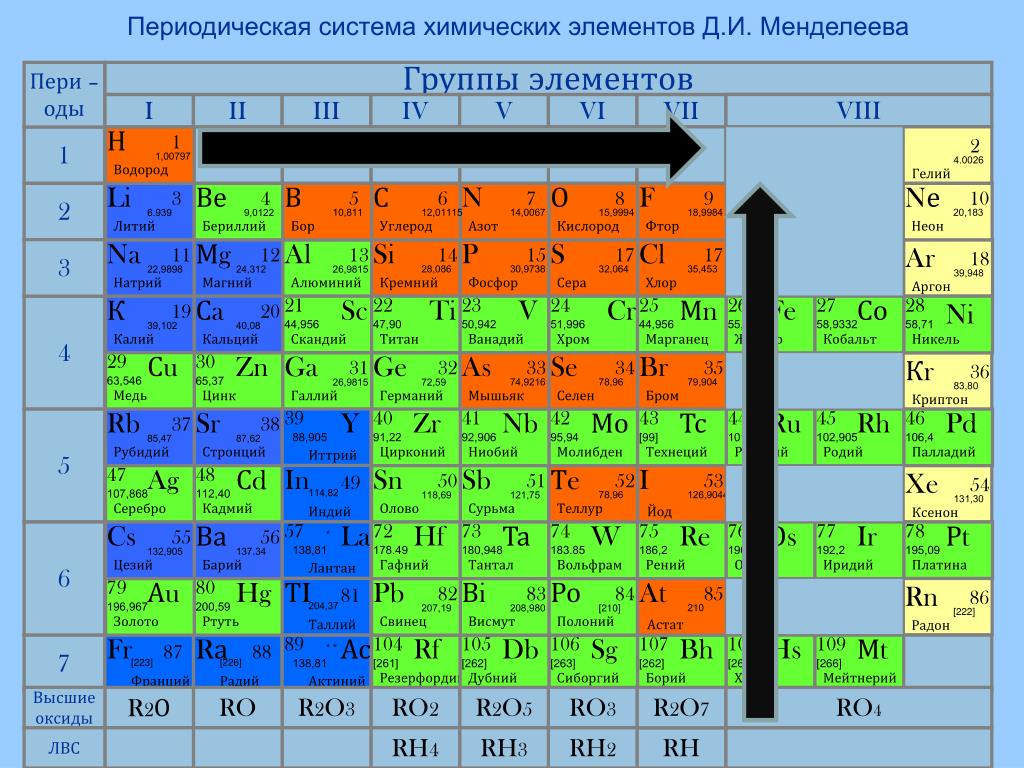 Речь идет об элементах в нижней строке периодической таблицы.
Речь идет об элементах в нижней строке периодической таблицы.
Получив картину расположения атомов в молекуле, включающей эйнштейний, ученые измерили длину химической связи и обнаружили некоторые интересные химические свойства. Особенности люминесценции и спин-орбитальной связи эйнштейния отличались от того, что можно было бы ожидать от элемента ряда актиноидов — нижней строки периодической таблицы.
Удивительно, но это исследование также дает возможность изучить то, что находится за пределами таблицы Менделеева, и, возможно, обнаружить новый элемент.
Читать далее
Посмотрите на изображение Марса из 8 триллионов пикселей
Ученые вывели замену для теории относительности. В чем суть «теории всего»?
Ученые нашли доказательство скрещивания современных людей с неандертальцами
Улучшенная версия таблицы Менделеева
Как легко определять свойства элементов и их соединений
Не так уж часто удается написать заметку о том, что не просто войдет в школьные учебники будущего, а станет одной из базовых картинок-иллюстраций. Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Химики из Сколковского института науки и технологий Артем Оганов и Захед Алахъяри придумали и рассчитали, как расположить химические элементы в порядке постепенного изменения их химических свойств. Такая последовательность удобнее, чем таблица Менделеева, для предсказания твердости, стабильности, намагниченности и других свойств элементов и их соединений. О том, как было сделано и что значит это отрытые, “Коту” рассказал профессор Сколтеха Артем Оганов.
Артем Оганов – кристаллограф-теоретик, создатель ряда новых материалов, а главное, методов, которые позволяют открывать новые материалы. Решил считавшуюся нерешаемой задачу предсказания кристаллической структуры вещества на основе его химического состава. Создал программу USPEX, способную предсказывать устойчивые химические соединения по набору исходных элементов. Один из самых цитируемых в мире ученых.
Я хорошо помню, как мне пришло в голову решение этой задачи. Мы с семьей садились в самолет. У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
У меня четверо детей, и все они расположились у меня на голове и прочих частях тела и к тому же продолжали непрерывно двигаться. Опытные родители знают, что сопротивляться этому бессмысленно, а беспокоиться неразумно. Поэтому мой мозг перестал метаться, анализируя внешние сигналы, и застыл, сфокусировавшись в одной точке. Точка эта оказалась на спинке впередистоящего кресла. Там-то и начал проступать основной график будущей работы. Я вдруг увидел, что элементы таблицы Менделеева не размазаны равномерно в пространстве своих свойств, а, как звезды в Галактике, расположены более-менее на плоскости.
Эта проблема волновала меня последние 15 лет. В 1984 году британский физик Дэвид Петтифор опубликовал работу, в которой ввел понятие менделеевских чисел, – с их помощью он сгруппировал элементы в порядке изменения их химических свойств. В таблице Менделеева свойства элементов меняются скачками. Так, после самого химически активного неметалла фтора идет инертный неон, а сразу за ним – активнейший металл натрий. Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Можно ли найти вариант, при котором рядом бы стояли похожие по свойствам элементы?
Петтифор предложил решение – выстроил элементы в некоторой последовательности, приписав им некие числа Менделеева. Но как приписал, не объяснил. И тем более не объяснил, какой у них физический смысл. Эти числа не расчет, а произвол, хотя и основанный на наблюдениях за свойствами бинарных соединений – веществ, состоящих из двух разных атомов. Скажем, если NaCl и KCl похожи, то и натрий с калием должны стоять рядом. Все это время ученые модифицировали и улучшали менделеевские числа, но что это такое, так никто и не объяснил.
У химических элементов есть разные характеристики, которые влияют на их свойства. Прежде всего размер атома (его радиус), валентность, поляризуемость*, электроотрицательность**. Но валентность – параметр непостоянный, у разных элементов могут быть разные валентности, а мы неоднократно открывали химические соединения, которые с точки зрения привычных представлений о валентности не могли бы существовать. Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
Но существуют. Поляризуемость очень сильно коррелирует с электроотрицательностью.
*Поляризуемость – способность атома или молекулы становиться электрически полярными во внешнем электромагнитном поле. Поляризуемость показывает, насколько легко может возникнуть заряженная частица (ион) или новая химическая связь.
**Электроотрицательность – способность атома оттягивать электроны других атомов в химических соединениях. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (F, O, N, Cl), низкая – у активных металлов (Li, Na, K).
Получается, что для определения фундаментальных свойств атомов можно использовать только атомный радиус и электроотрицательность. И если по оси Х – радиус, а по оси Y – электроотрицательность, мы получаем плоскость, на которой сильно вытянутым облаком располагаются элементы. Внутри этого облака, воспользовавшись несложным математическим приемом, можно провести линию, вдоль которой элементы встанут в порядке максимально плавного изменения свойств.
Так мы открыли физический и химический смысл менделеевских чисел: это наилучшее представление всех химических свойств атома одним числом. Но мы предложили не только объяснение, но и улучшенную версию чисел Менделеева, в которой нет места субъективности – только расчеты на основе фундаментальных характеристик атомов. Мы назвали это “Универсальной последовательностью элементов”, по-английски Universal Sequence Of Elements, сокращенно USE. И действительно, наша последовательность удобна в применении: она предсказывает свойства химических соединений лучше, чем петтифоровские менделеевские числа и их позднейшие модификации.
Если расположить элементы на осях, то на плоскости будут бинарные соединения – молекулы и кристаллы, состоящие из двух типов атомов. Мы обнаружили, что на этом поле – его можно назвать химическим пространством – возникают области соединений с близкими свойствами, например твердостью кристаллов, магнетизмом, энергией связи. Известно, например, что алмаз, состоящий только из углерода, – самый твердый из кристаллов.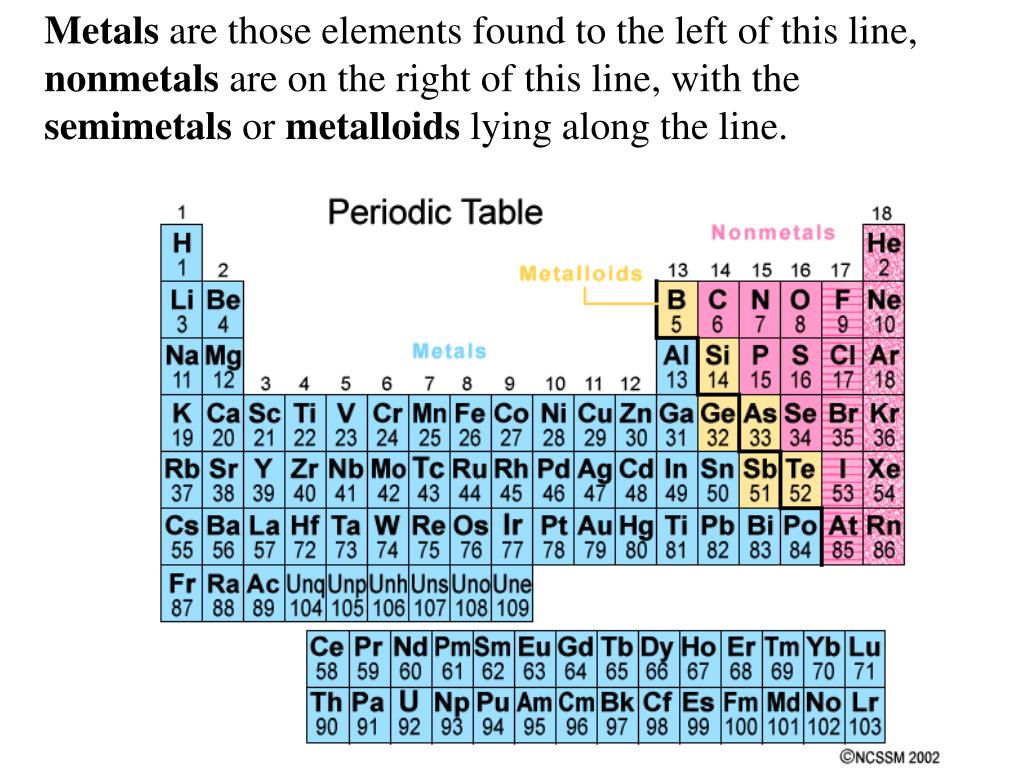 А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
А как искать другие твердые вещества? По соседству с алмазом в его химическом пространстве.
Улучшенные менделеевские числа помогут находить новые соединения с полезными свойствами и смогут прояснить некоторые вопросы, связанные с привычной таблицей Менделеева. Например, уже сейчас можно ставить точку в споре, где должен находиться водород: над литием или над фтором. Согласно менделеевским числам, водород ближе к галогенам, чем к щелочным металлам.
Ссылка: Zahed Allahyari and Artem R. Oganov, Nonempirical Definition of the Mendeleev Numbers: Organizing the Chemical Space: J. Phys. Chem. C 2020, 124, 43, 23867-23878.
Остатки гиперновой? Странная звезда Млечного Пути открыла тайну таблицы Менделеева
Странная древняя звезда содержит очень мало металлов в сравнении со своими ровесниками. Напомним, что в астрономии металлом считаются все элементы тяжелее гелия.
При этом возраст светила составляет около 13 миллиардов лет. То есть оно всего на миллиард лет моложе Вселенной. Получается, что у нее было предостаточно времени, чтобы синтезировать более тяжелые элементы в своих недрах.
То есть оно всего на миллиард лет моложе Вселенной. Получается, что у нее было предостаточно времени, чтобы синтезировать более тяжелые элементы в своих недрах.
Еще более удивительно, что древнее светило накопило в себе очень много таких тяжелых элементов, как цинк, уран, европий и, возможно, золото.
“Соотношение железа и водорода в этой звезде примерно в 3 000 раз ниже, чем у Солнца. И это свидетельство того, что она очень редкая: то, что мы называем чрезвычайно бедной металлом звездой, – объясняет Дэвид Юн (David Yong), один из авторов исследования. – То, что некоторых более тяжелых элементов в ней гораздо больше, чем ожидалось, делает её и вовсе настоящей иголкой в стоге сена”.
Результаты своих научных изысканий международная команда ученых опубликовала в журнале Nature.
Странная звезда относится ко второму поколению звезд Вселенной. Первое поколение состояло преимущественно из водорода и гелия.
Звезды первого поколения отживали свое, взрывались, превращаясь в сверхновые, рассеивали свою внешнюю оболочку в межзвездное пространство. Остатки ядра погибшей звезды уплотнялись в нейтронную звезду.
Нейтронные звезды затем сливались, производили тяжелые элементы и тоже выбрасывали их в космос. Так тяжелые элементы и достались второму поколению звезд.
Но накопленное странной звездой количество тяжелых элементов, по мнению ученых, невозможно объяснить слиянием нейтронных звезд. Их слияние не может дать столько тяжелых элементов.
Поэтому, исследуя странную звезду, астрономы допустили, что она родилась в результате звездного взрыва намного большей мощности, чем образование сверхновой. Она могла бы образоваться из светила крупнее Солнца в 25 раз.
“Мы обнаружили данные наблюдений, которые прямо указывают на существование другого типа гиперновой. При взрыве ядра быстро вращающейся массивной звезды с сильным магнитным полем появились одновременно все стабильные элементы периодической таблицы Менделеева”, – говорит Чиаки Кобаяси (Chiaki Kobayashi) из центра астрофизики ASTRO 3D Австралийского национального университета, один из авторов исследования.
Описанный механизм мог быть важным источником тяжелых химических элементов в ранней Вселенной, делают вывод ученые.
Впрочем, лишь дальнейшее изучение других звезд со странным составом поможет лучше понять, как появились тяжелые химические элементы в ранней Вселенной.
Ранее мы сообщали, как в столкновении нейтронных звёзд родился один из мощнейших магнитов Вселенной. А еще не так давно ученые описали другой странный объект: белого карлика размером с Луну, но тяжелее Солнца.
Больше новостей из мира науки вы найдёте в разделе “Наука” на медиаплатформе “Смотрим”.
Российские химики записали в кварцевом стекле миниатюрное цветное изображение Таблицы Менделеева
Ученые РХТУ имени Д.И. Менделеева создали микроизображение Таблицы Менделеева в кварцевом стекле, которое переживет пожар и другие внешние воздействия
Для этого использовали метод фемтосекундной лазерной записи, на основе которого разрабатывают технологии сверхплотного хранения данных в стекле. Размер созданной Таблицы 3,6х2,4 мм и она выдерживает температурное воздействие до 900°С.
Размер созданной Таблицы 3,6х2,4 мм и она выдерживает температурное воздействие до 900°С.
Работа опубликована в специальном номере журнала Frontiers in Chemistry, посвященном Таблице Менделеева и напоминает, что стекло может включать в себя почти все элементы Таблицы.
Люди используют стекла уже больше 5000 лет, и встретить их можно не только в привычной посуде, окнах и смартфонах, но и в стоматологии, ракетостроении, волоконно-оптической связи и других областях промышленности. Несмотря на такую распространённость, стекла до сих пор изучены не так хорошо, как кажется, и появляются всё новые их составы и методы обработки.
Почти 95 % всех стекол в мире силикатные: их делают из сырьевой смеси, главный компонент которой – это оксид кремния, или попросту песок, знакомый по пляжам и песочницам. Но кроме кремния в стеклах встречается почти вся Таблица Менделеева. Для придания стеклу нужных свойств (например, прочности, химической стойкости или цвета) в него включают оксиды натрия, алюминия, бора, кальция, хрома… Список можно продолжать, ведь из 118 элементов Таблицы Менделеева в стекле используют больше 80! К примеру, в составе красных стекол Кремлевских звезд есть кадмий и селен, а из стекла с оксидом урана раньше производили бокалы и столовую посуду.
В новой работе, опубликованной в журнале Frontiers in Chemistry, ученые записали в стекле миниатюрную Таблицу Менделеева. «В этой работе мы показали, насколько близки две, на первый взгляд никак не связанные между собой вещи – стекло и Таблица Менделеева», – комментирует ассистент кафедры стекла и ситаллов РХТУ им. Д.И. Менделеева и соавтор работы Георгий Шахгильдян. «Стекло – это своеобразный дом для Таблицы, потому что оно может вместить в себе, в своей структуре, почти все химические элементы».
Кроме разработки новых составов ученые могут изменять свойства стекол в какой-то маленькой, локальной области. Это делают с помощью фемтосекундных лазеров, которые испускают очень короткие световые импульсы (1 фемтосекунда – 10-15 секунд).
Из-за малой длительности импульса излучение обладает высокой интенсивностью, и поэтому локальная область облучаемой поверхности сильно разогревается и меняет свою структуру. В операциях на глазах врачи используют фемтосекундные лазеры, чтобы аккуратно разрезать и сшивать живые ткани. А с помощью лазерных «операций» на стеклах ученые могут создавать внутри них миниатюрные оптические элементы: волноводы, каналы, переключатели.
А с помощью лазерных «операций» на стеклах ученые могут создавать внутри них миниатюрные оптические элементы: волноводы, каналы, переключатели.
“Для многих стекол метод прямой лазерной записи приводит к ожидаемым результатам, но тут не обходится и без алхимических превращений” – рассказывает Владимир Сигаев, заведующий кафедрой стекла и ситаллов РХТУ и один из авторов работы, “в прозрачном стекле выделяются наночастицы золота или серебра, область стекла превращается в нелинейный кристалл или внезапно возникают зоны со строго повторяющейся периодической структурой (нанорешетки)”.
Миниатюрную таблицу Менделеева нарисовали именно с помощью нанорешеток: они обладают свойством двулучепреломления. То есть луч, проходящий через область с такой периодической структурой, разделяется на две компоненты, которые идут через материал разными путями и с разной скоростью, а затем воссоединяются на выходе из него, что приводит к появлению интерференционной окраски.
При этом цветом можно управлять, меняя интенсивность лазерного излучения и записывая несколько нанорешеточных слоев друг на другом. Ученые варьировали эти параметры от одной ячейки таблицы к другой, и в результате они стали цветными. Правда в обычном оптическом микроскопе эти цвета не видны, и все ячейки окрашены только в разные оттенки коричневого цвета, но если в микроскоп вставить скрещенные поляризаторы, тогда она становится цветной (это связано с тем, что прохождение света через нанорешетки также меняет поляризацию излучения). Шесть основных типов элементов (щелочные металлы, инертные газы и др.) выполнены в шести разных оттенках коричневого и голубого.
Ученые варьировали эти параметры от одной ячейки таблицы к другой, и в результате они стали цветными. Правда в обычном оптическом микроскопе эти цвета не видны, и все ячейки окрашены только в разные оттенки коричневого цвета, но если в микроскоп вставить скрещенные поляризаторы, тогда она становится цветной (это связано с тем, что прохождение света через нанорешетки также меняет поляризацию излучения). Шесть основных типов элементов (щелочные металлы, инертные газы и др.) выполнены в шести разных оттенках коричневого и голубого.
Общий размер Таблицы получился 3.6 на 2.4 мм, уместится на кончике ногтя, а каждая ячейка с химическим элементом вышла размером всего 200*200 микрон – не больше диаметра иглы шприца. Кроме того, Таблица устойчива перед температурой. Эксперименты показали, что нагрев до 900°С (температура бытового пожара) и резкое охлаждение стекла не влияет на изображение записанной Таблицы. Это делает созданное в РХТУ стекло с нанорешетками самым надежным хранилищем для Таблицы Менделеева.
“Ученые погружены в узкую научную тематику, читают статьи и обзоры в области своих исследований и редко выходят далеко за ее границы. А тема стекла – очень многогранна, это стык неорганической химии и физики. Поэтому мы решили опубликовать статью в журнале Frontiers in Chemistry и соединить там химические и физические явления, связанные со стеклом” – комментирует Шахгильдян. “Этот выпуск журнала посвящен 150-летию Таблицы Менделеева, многим химикам со всего мира будет интересно его содержание, они смогут открыть для себя возможности прямой лазерной записи в стекле и других прозрачных материалах”.
Кроме того, использованный учеными метод формирования нанорешеток в стекле подходит для записи данных. “Исследования нашей кафедры в области лазерной записи в стеклах привели к запуску в РХТУ первого в мире проекта по созданию технологии оптической памяти
на основе стекла” – рассказывает профессор Сигаев. “Эту идею подхватила компания Microsoft и тоже работает в данном направлении. Технология лазерной записи массивов данных в стекле пока имеет ряд ограничений, но в случае их преодоления нами или другими научными группами, будут созданы носители данных с неограниченным сроком службы”.
Технология лазерной записи массивов данных в стекле пока имеет ряд ограничений, но в случае их преодоления нами или другими научными группами, будут созданы носители данных с неограниченным сроком службы”.
Работа была выполнена при поддержке РХТУ имени Д.И. Менделеева, грант № 2020-20.
Статья:
Shakhgildyan, G., Lipatiev, A., Lotarev, S., Fedotov, S., & Sigaev, V. (2020). Glass: Home of the Periodic Table. Frontiers in Chemistry, 8, 384. DOI: 10.3389/fchem.2020.00384.
https://www.frontiersin.org/articles/10.3389/fchem.2020.00384/full#B44
Список металлов
Выделенные элементы считаются металлическими элементами.Большинство элементов периодической таблицы – металлы. Они сгруппированы в середине левой части таблицы Менделеева. Металлы состоят из щелочных металлов, щелочноземельных металлов, переходных металлов, лантаноидов и актинидов.
Вот список металлов, их расположение в периодической таблице, их свойства и использование.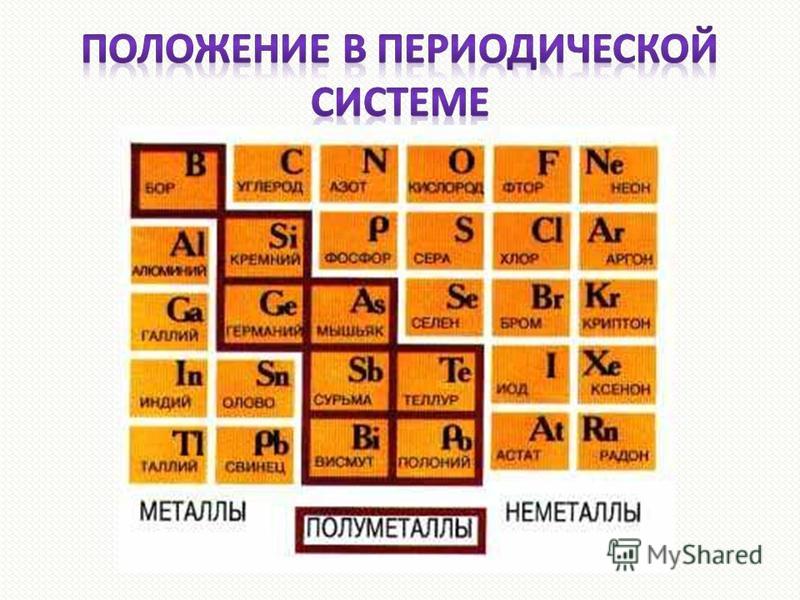
Свойства металлов
Металлы имеют несколько общих свойств, в том числе:
- Металлы твердые при комнатной температуре (за исключением ртути).
- Металлы блестящие, с металлическим блеском.
- Большинство металлов имеют высокую температуру плавления.
- Большинство из них являются хорошими проводниками тепла.
- Большинство из них являются хорошими электрическими проводниками.
- Имеют низкую энергию ионизации.
- Металлы обладают низкой электроотрицательностью.
- Они податливы – их можно растирать на листы.
- Они пластичные – их можно затягивать в проволоку.
- Металлы имеют высокие значения плотности (исключения: литий, калий и натрий).
- Большинство металлов подвержены коррозии на воздухе или в морской воде.
- Атомы металлов теряют электроны в реакциях. Другими словами, они образуют катионы.
* Bonus Fact * При определенных условиях водород может действовать как металлический элемент. Эти условия обычно встречаются в экстремальных условиях, таких как высокое давление или замерзшее твердое вещество.
Эти условия обычно встречаются в экстремальных условиях, таких как высокое давление или замерзшее твердое вещество.
Список металлов
Это список металлов в порядке возрастания атомного номера.
| НОМЕР | СИМВОЛ | ЭЛЕМЕНТ | |||
| 3 | Li | Литий | |||
| 4 | Be | Бериллий | |||
| 11 | Na | Натрий | 1253|||
| Mg | Магний | ||||
| 13 | Al | Алюминий | |||
| 19 | K | Калий | |||
| 20 | Ca | Кальций | |||
| 21 | Sc | Скандий | |||
| 22 | Ti | Титан | |||
| 23 | V | Ванадий | |||
| 24 | Cr | Хром | |||
| 25 | Mn | Марганец | |||
| 26 | Fe | Железо | |||
| 27 | 900 47 CoКобальт | ||||
| 28 | Ni | Никель | |||
| 29 | Cu | Медь | |||
| 30 | Zn | Цинк | |||
| 31 | Ga | Галлий | |||
| 37 | Rb | Рубидий | |||
| 38 | Sr | Стронций | |||
| 39 | Y | Иттрий | |||
| 40 | Zr | Цирконий | |||
| 41 | Nb | Ниобий | |||
| 42 | Mo | Молибден | |||
| 43 | Tc | Технеций | |||
| 44 | Ru | Рутений | |||
| 45 | Рутений | Rhdium | |||
| 46 | Pd | Палладий | |||
| 47 | Ag | Серебро | |||
| 48 | Cd | Кадмий | |||
| 49 | In | Индий | |||
| 50 | Sn | Олово | |||
| 55 | Cs | Цезий | |||
| 56 | Ba | Барий | |||
| 57 | La | Лантан | |||
| 58 | Ce | Церий | |||
| 59 | Pr | Празеодим | |||
| 60 | Nd | Неодим | |||
| 61 | Pm | Прометий | |||
| 62 | Sm | Самарий | |||
| 63 | Eu | Европий | |||
| 64 | Gdolinium | ||||
| 65 | Tb | Тербий | |||
| 66 | Dy | Диспрозий | |||
| 67 | Ho | Гольмий | |||
| 68 | Er | Эрбий | |||
| 69 | Tm | Тулий Y | |||
| 70 | Иттербий | ||||
| 71 | Lu | Лютеций | |||
| 72 | Hf | Гафний | |||
| 73 | Ta | Тантал | |||
| 74 | W | Вольфраммы | 75 | Re | Рений |
| 76 | Os | Осмий | |||
| 77 | Ir | Иридий | |||
| 78 | Pt | Платина | |||
| 79 | Au | Золото | |||
| 80 | Hg | Меркурий | |||
| 81 | Tl | Таллий | |||
| 82 | Pb | Свинец | |||
| 83 | Bi | Висмут | |||
| 84 | Po | Полоний | |||
| 87 | Fr | Франций | |||
| 88 | Ra | Радий | |||
| 89 | Ac | Актиний | |||
| 90 | Th | Торий | |||
| 91 | Па | Протактиний | 900|||
| 92 | U | Уран | |||
| 93 | Np | Нептуний | |||
| 94 | Pu | Плутоний | |||
| 95 | Am | Америций C | |||
| 96 | Кюрий | ||||
| 97 | Bk | Берклий | |||
| 98 | Cf | Калифорний | |||
| 99 | Es | Эйнштейний | |||
| 100 | Fm | Фермий | |||
| 101 | Md | Менделевий | 102№ | Нобелиум | |
| 103 | Lr | Лоуренсий | |||
| 104 | Rf | Резерфордий | |||
| 105 | Db | Дубний | |||
| 106 | Сегаборг | Сегаборг | |||
| 107 | Bh | Бориум | |||
| 108 | Hs | Калий | |||
| 109 | Mt | Мейтнерий | |||
| 110 | Ds | Дармштадций | |||
| Rg | Рентгений 900 48 | ||||
| 112 | Cn | Copernicium | |||
| 113 | Nh | Nihonium | |||
| 114 | Fl | Flerovium | |||
| 115 | Mc | Moscovium | |||
| 116 116 | Lv | Livermorium |
Расположение металлов в Периодической таблице
Более 75% элементов – металлы, поэтому они заполняют большую часть таблицы Менделеева.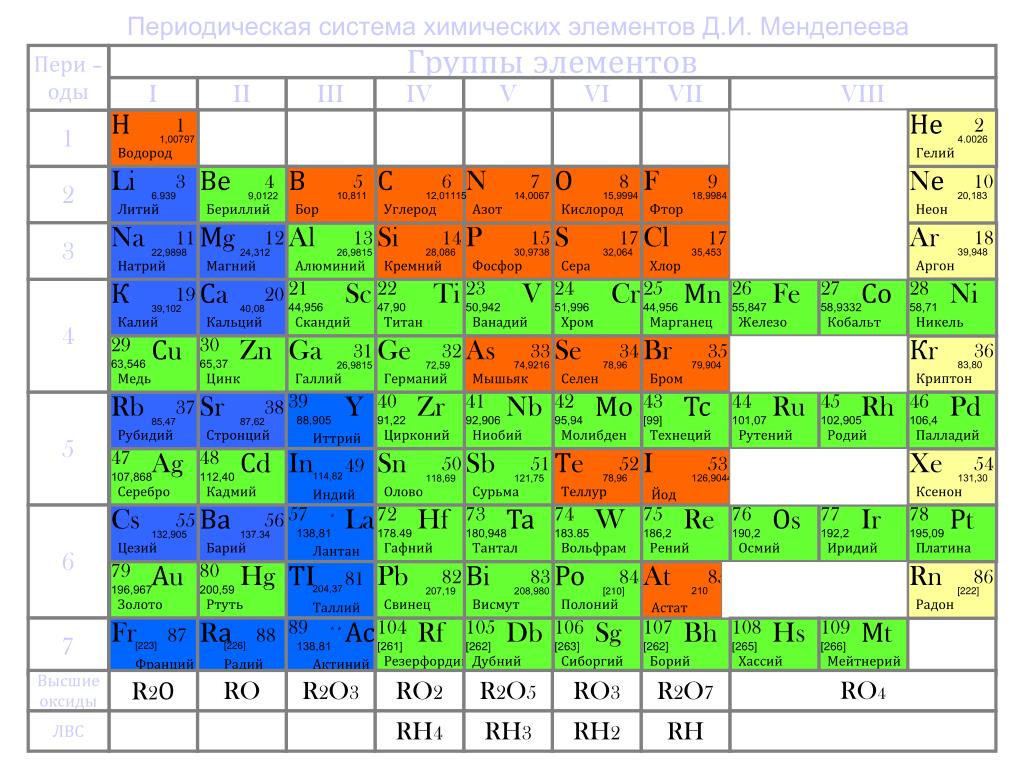 Металлы находятся в левой части таблицы. Два ряда элементов под основной частью таблицы (лантаноиды и актиниды) – это металлы.
Металлы находятся в левой части таблицы. Два ряда элементов под основной частью таблицы (лантаноиды и актиниды) – это металлы.
Использование металлов
Металлы находят применение во всех сферах жизни. Вот список их использования:
- Конструкционные компоненты
- Контейнеры
- Провода и электрические приборы
- Радиаторы
- Зеркала
- Монеты
- Ювелирные изделия
- Оружие
- Питание (железо, медь, кобальт, никель, цинк, молибден)
Каталожные номера
- Cox P.А. (1997). Элементы: их происхождение, изобилие и распространение . Издательство Оксфордского университета: Оксфорд. ISBN 978-0-19-855298-7.
- Эмсли, Дж. (2003). Строительные блоки природы: руководство по элементам от А до Я . Издательство Оксфордского университета. ISBN 978-0-19-850340-8.
- Strathern, P. (2000). Мечта Менделеева: В поисках стихий . Hamish Hamilton Ltd.
 ISBN 978-0-241-14065-9.
ISBN 978-0-241-14065-9. - улица, А .; Александр, В. (1998). Металлы на службе у человека (11-е изд.). Книги Пингвинов: Лондон. ISBN 978-0-14-025776-2.
Список металлов и неметаллов
Список металлов , составляющий периодическую таблицу, включает железо, свинец, золото, алюминий, платину, уран, цинк, литий, натрий, олово , серебро и т. д.
неметаллов т, составляющих периодическую таблицу Менделеева, включают водород, гелий, углерод, серу, азот, кислород, радон, неон, другие галогены, благородные газы и т. д.
Когда мы изучаем элементы, важно знать, какие элементы являются металлами, а какие – нет. Если вы пытаетесь научиться различать металлы и неметаллы, список и их использование – хороший способ разбить их и помочь запомнить разницу между ними. Хорошая новость в том, что большинство элементов – это металлы. Полезный способ подойти к изучению элементов – различать, металлические они или неметаллические. Металлы обладают некоторыми общими свойствами. Итак, знание того, что это за свойства, – хороший способ начать наше исследование.
Металлы обладают некоторыми общими свойствами. Итак, знание того, что это за свойства, – хороший способ начать наше исследование.
Как указано во введении, большинство элементов являются металлами или, по крайней мере, могут считаться таковыми. Знание того, какие из них есть, а какие нет, поможет нам правильно их сгруппировать. Прежде чем перейти к полному списку металлов, важно определить, что такое металл. Есть пять различных видов металлов:
Все металлические элементы помещены вместе в периодической таблице.
Нам нужно меньше запоминать – я никогда не запоминал периодическую таблицу элементов – я никогда не использовал ее, и я физик! Я могу это посмотреть.- Мичио Каку
Есть несколько свойств, которые делают большинство элементов металлами. Элемент должен обладать некоторыми из этих свойств, чтобы считаться металлом. Важно ознакомиться с этими различными свойствами. Не все свойства присущи всем металлам, но все элементы, которые обладают некоторыми из этих свойств, могут считаться металлами.
Не все свойства присущи всем металлам, но все элементы, которые обладают некоторыми из этих свойств, могут считаться металлами.
Большинство металлов имеют твердое состояние, когда они находятся при комнатной температуре. Фактически, единственным исключением из этого свойства является ртуть. Ртуть – единственный металл, который всегда находится в жидком состоянии независимо от температуры. Таким образом, он остается жидким даже при комнатной температуре. Как правило, температура плавления металлов высокая.
- Еще один способ распознать металл – это блестящий металл.
- Металлы также хорошо проводят тепло и электричество.Но имеют низкую энергию ионизации и низкую электроотрицательность. Еще одно важное свойство, которым обладают многие металлические элементы, – это их пластичность. Это означает, что металлы относительно легко разбить на листы.

- Кроме того, из большинства металлов можно производить проволоку. Это то, что мы называем пластичным.
- За исключением калия, лития и натрия, большинство металлов имеют высокую плотность.
- Одним из общих и, пожалуй, наиболее заметных свойств, присущих большинству металлических элементов, является то, что они подвержены коррозии при воздействии морской воды или воздуха.
- Наконец, большинство металлических элементов теряют электроны во время реакций.
Есть один неметаллический элемент, который иногда может действовать как металл. Это водород, который при воздействии чрезвычайно высоких или чрезвычайно низких температур может проявлять некоторые из этих общих свойств.
Полный список металловТеперь, когда мы установили свойства, которые превращают большинство элементов периодической таблицы в металлы, мы можем теперь представить полный список металлических элементов:
| Элемент | Символ | Номер в периодической таблице | |
| Литий | Li | 3 | |
| Бериллий | Be | 4 | |
| Натрий | Na | 11 | |
| Магний | Mg | 12 | |
| Алюминий | Al | 13 | |
| Калий | K | 19 | |
| Кальций | Ca | 20 | |
| Скандий | Sc | 21 | |
| Титан | Ti | 22 | |
| V | 23 | ||
| Хром | Cr | 24 | |
| Марганец | Mn | 25 | |
| Железо | Fe | 26 | |
| Кобальт | Co | 27 | |
| Никель | Ni | 28 | |
| Медь | Cu | 29 | |
| Цинк | Zn | 30 | |
| Галлий | Ha | 31 | |
| Рубидий | Rb | 37 | |
| Стронций | Sr | 38 | |
| Иттрий | Y | 39 | |
| Цирконий | Zr | 40 | |
| Ниобий | Ниобий | 41 | |
| Молибден | Мо | 42 | Технеций | Tc | 43 |
| Рутений | Ru | 44 | |
| Родий | Rh | 45 | |
| Палладий | Pd | 46 | |
| Серебро | 47 | ||
| Кадмий | Cd | 48 | |
| Индий | In | 49 | |
| Олово | Sn | 50 | |
| Цезий | Cs | 55 | |
| Барий | Ba | 56 | |
| Лантан | La | 57 | |
| Церий | Ce | 58 | |
| Празеодим | Pr | 59 | |
| Неодим | Nd 900 | 60 | |
| Прометий | PM | 61 90 048 | |
| Самарий | Sm | 62 | |
| Европий | Eu | 63 | |
| Гадолиний | Gd | 64 | |
| Тербий | Tb | 65 | |
| Dys | Dy | 66 | |
| Гольмий | Ho | 67 | |
| Эрбий | Er | 68 | |
| Тулий | Tm | 69 | |
| Иттербий | Yb | 70 | |
| Лютеций | Lu | 71 | |
| Гафний | Hf | 72 | |
| Тантал | Ta | 73 | |
| Вольфрам | W | 74 | |
| Рений Re | 75 | ||
| Осмий | Os 900 48 | 76 | |
| Иридий | Ir | 77 | |
| Платина | Pt | 78 | |
| Золото | Au | 79 | |
| Ртуть | Hg | 80 | |
| Таллий | Tl | 81 | |
| Свинец | PB | 82 | |
| Висмут | Bi | 83 | |
| Полоний | Po | 84 | |
| Франций | Fr | 87 | |
| Радий | Ra | 88 | |
| Актиний | Ac | 89 | |
| Торий | Th | 90 | |
| Протактиний | Па | 91 | |
| Уран | U | 92 | |
| Нептуний | 900 47 Np93 | ||
| Плутоний | Pu | 94 | |
| Америций | Am | 95 | |
| Кюрий | Cm | 96 | |
| Берклий | Bk | 97 | |
| Калифорний | Cf | 98 | |
| Эйнштейний | Es | 99 | |
| Фермий | Fm | 100 | |
| Менделевий | Md | 101 | |
| Нобелий № | 102 | ||
| Лоуренсий | Lr | 103 | |
| Резерфордий | Rf | 104 | |
| Дубний | Db | 105 | |
| Сиборгий | 106 | 900||
| Бориум | Bh | 107 90 048 | |
| Калий | Hs | 108 | |
| Мейтнерий | Mt | 109 | |
| Дармштадций | Ds | 110 | |
| Рентгений | Rg | 111 | 111 | Cn | 112 |
| Ununtrium | Uut | 113 | |
| Flevorium | Fl | 114 | |
| Livermorium | Lv | 116 |
Неметаллы можно определить просто по их свойствам, противоположным свойствам металлов. Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д.
Например, они не податливы, у них относительно низкая плотность, они тусклые, плохо проводят тепло и электричество и т. Д.
Вот полный список для неметаллов:
| Элемент | Символ элемента | Номер в периодической таблице |
| Водород | H | 1 |
| Гелий | He | 2 |
| Углерод | C | 6 |
| Азот | N | 7 |
| Кислород | O | 8 |
| Фтор | F | 9 |
| Неон | Ne | 10 |
| Фосфор | P | 15 |
| Сера 9004 8 | S | 16 |
| Хлор | Cl | 17 |
| Аргон | Ar | 18 |
| Селен | Se | 34 |
| Бром | Br | 35 |
| Криптон | Kr | 36 |
| Йод | I | 53 |
| Ксенон | Xe | 54 |
| Астатин | At | 85 |
| Радон 900 | Rn | 117 |
| Oganesson | Og | 118 |
Мы надеемся, что этот список металлов и неметаллов в периодической таблице поможет. Дайте нам знать в комментариях ниже, какой именно вы искали.
Дайте нам знать в комментариях ниже, какой именно вы искали.
Была ли эта статья полезной?
😊 ☹️ Приятно слышать! Хотите больше научных тенденций? Подпишитесь на нашу рассылку новостей науки! Нам очень жаль это слышать! Мы любим отзывы 🙂 и хотим, чтобы вы внесли свой вклад в то, как сделать Science Trends еще лучше.
Список металлов – Периодическая таблица
Список металлов – сплавов
Список металлов – открытие и история металлов Алфавитный список металлов * Элемент 113: Унунтриум, Элемент 114: Унунквадиум, Элемент 115: Унунпентиум и Элемент 116: Унунгексий, вероятно, будет основным металлом. Примеры элементов |
Список всех элементов, которые считаются металлами
Большинство элементов – металлы. В эту группу входят щелочные металлы, щелочноземельные металлы, переходные металлы, основные металлы, лантаноиды (редкоземельные элементы) и актиниды. Хотя лантаноиды и актиниды разделены в периодической таблице, на самом деле это особые типы переходных металлов.
Вот список всех элементов периодической таблицы, являющихся металлами.
Щелочные металлы
Щелочные металлы находятся в группе IA в крайней левой части таблицы Менделеева.Это высокореакционные элементы, отличающиеся степенью окисления +1 и, как правило, низкой плотностью по сравнению с другими металлами. Поскольку они обладают такой реакционной способностью, эти элементы находятся в соединениях. В природе свободен только водород как чистый элемент, то есть как двухатомный водород.
- Водород в металлическом состоянии (обычно считается неметаллом)
- Литий
- Натрий
- Калий
- Рубидий
- Цезий
- Франций
Щелочноземельные металлы
Щелочноземельные металлы находятся в группе IIA периодической таблицы, которая является вторым столбцом элементов.Все атомы щелочноземельных металлов имеют степень окисления +2. Как и щелочные металлы, эти элементы находятся в соединениях, а не в чистом виде. Щелочноземельные металлы обладают меньшей реакционной способностью, чем щелочные металлы. Металлы группы IIA твердые и блестящие, обычно ковкие и пластичные.
- Бериллий
- Магний
- Кальций
- Стронций
- Барий
- Радий
Основные металлы
Основные металлы обладают характеристиками, которые люди обычно ассоциируют с термином «металл».«Они проводят тепло и электричество, имеют металлический блеск и имеют тенденцию быть плотными, пластичными и пластичными. Однако некоторые из этих элементов обладают неметаллическими характеристиками. Например, один аллотроп олова ведет себя больше как неметалл. твердые, свинец и галлий являются примерами мягких элементов. Эти элементы, как правило, имеют более низкие температуры плавления и кипения, чем переходные металлы (за некоторыми исключениями).
Однако некоторые из этих элементов обладают неметаллическими характеристиками. Например, один аллотроп олова ведет себя больше как неметалл. твердые, свинец и галлий являются примерами мягких элементов. Эти элементы, как правило, имеют более низкие температуры плавления и кипения, чем переходные металлы (за некоторыми исключениями).
- Алюминий
- Галлий
- Индий
- Олово
- Таллий
- Свинец
- Висмут
- Нихоний: вероятно, основной металл
- Флеровий: вероятно, основной металл
- Московий: вероятно, основной металл
- Ливерморий: вероятно, основной металл
- Теннессин: относится к группе галогенов, но может вести себя больше как металлоид или металл
Переходные металлы
Переходные металлы характеризуются наличием частично заполненных электронных подоболочек d или f.Поскольку оболочка заполнена не полностью, эти элементы проявляют несколько степеней окисления и часто образуют окрашенные комплексы. Некоторые переходные металлы встречаются в чистом или самородном виде, включая золото, медь и серебро. Лантаноиды и актиниды встречаются только в природных соединениях.
Некоторые переходные металлы встречаются в чистом или самородном виде, включая золото, медь и серебро. Лантаноиды и актиниды встречаются только в природных соединениях.
- Скандий
- Титан
- Ванадий
- Хром
- Марганец
- Утюг
- Кобальт
- Никель
- Медь
- Цинк
- Иттрий
- Цирконий
- Ниобий
- Молибден
- Технеций
- Рутений
- Родий
- Палладий
- Серебро
- Кадмий
- Лантан
- Гафний
- Тантал
- Вольфрам
- Рений
- Осмий
- Иридий
- Платина
- Золото
- Меркурий
- Актиний
- Резерфордий
- Дубний
- Сиборгий
- Бориум
- Калий
- Мейтнерий
- Дармштадтиум
- Рентгений
- Копернициум
- Церий
- Празеодим
- Неодим
- Прометий
- Самарий
- Европий
- Гадолиний
- Тербий
- Диспрозий
- Гольмий
- Эрбий
- Тулий
- Иттербий
- Лютеций
- Торий
- Протактиний
- Уран
- Нептуний
- Плутоний
- Америций
- Кюрий
- Берклий
- Калифорний
- Эйнштейний
- Фермий
- Менделевий
- Нобелий
- Лоуренсий
Подробнее о металлах
В общем, металлы расположены в левой части таблицы Менделеева, и их металлический характер уменьшается при движении вверх и вправо.
В зависимости от условий элементы, принадлежащие к группе металлоидов, могут вести себя как металлы. Кроме того, металлами могут быть даже неметаллы. Например, в определенных ситуациях вы можете найти металлический кислород или металлический углерод.
Где металлы расположены в Периодической таблице (с изображениями)
Металлы расположены на левой стороне Периодической таблицы.
Это краткий и простой ответ на ваш вопрос «Где находятся металлы в Периодической таблице?»
Но подождите…
Есть еще много вещей, которые вам нужно знать о металлах Периодической таблицы, например;
Давайте сразу погрузимся в это.
Посмотрите, как эта Интерактивная периодическая таблица поможет вам.
- Вы можете легко найти каждую деталь об элементах из этой единой Интерактивной периодической таблицы.
- Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
- Вы также получите HD изображений Периодической таблицы (БЕСПЛАТНО).
Металлы – это элементы, которые имеют тенденцию отдавать или терять электроны с образованием положительных ионов.
Короче запомните;
- Металлы являются донорами электронов (металлы теряют / отдают электроны)
Элементы, проявляющие этот тип природы (характер потери электронов), известны как металлы.
Теперь в Периодической таблице эти металлы находятся на левой стороне.
Но эти металлы подразделяются на гораздо больше типов.
Позвольте мне рассказать вам несколько вещей о типах металлов в Периодической таблице .
Самые левые элементы Периодической таблицы (элементы группы 1) известны как щелочные металлы.
Но знаете ли вы;
Что такое щелочные металлы? А почему так называются щелочные металлы?
Простой ответ: Щелочные металлы образуют щелочной раствор (щелочной раствор) при взаимодействии с водой.
Вот почему они известны как щелочные металлы. (Подробное объяснение из здесь .)
Также посетите: Почему щелочные металлы так реактивны?
Щелочноземельные металлы находятся во 2-й группе Периодической таблицы.
Теперь я снова скажу вам простую причину, по которой эти элементы группы 2 известны как щелочноземельные металлы.
Видите, элементы группы 2 имеют почти те же свойства, что и элементы группы 1 (щелочные металлы).
Но разница в том, что они чаще всего встречаются в земной коре .
Таким образом, они известны как щелочноземельных металлов.
Элементы, относящиеся к группе 3–12, известны как переходные металлы (или переходные элементы).
Переходные металлы образуют мост между химически активными металлами элементов s-блока и менее активными элементами 13 и 14 групп.
Таким образом, эти металлы известны как «переходные металлы».
Также посетите: Сколько переходных металлов содержится в таблице Менделеева?
Две нижние строки Периодической таблицы называются внутренними переходными металлами.
Почему?
Как следует из названия, это только переходные металлы, но они находятся во внутренней части переходных металлов.
Следовательно, они называются внутренними переходными металлами (или внутренними переходными элементами).
Элементы первого ряда известны как лантаноиды, а элементы второго ряда известны как актиниды.
Также посетите:
1). Почему внутренние переходные металлы находятся внизу периодической таблицы?
2). Разница между переходными и внутренними переходными элементами.
Краткий ответ: я не знаю точно (смеется)
Позвольте мне объяснить вам, почему я не знаю этого ответа.
Общий вопрос, который задают все студенты, касается общего количества металлов в Периодической таблице.
Ну, точного ответа на этот вопрос нет.
Но из 118 известных элементов более 78% имеют металлический характер.
Из 118 элементов таблицы Менделеева примерно 94 элемента являются металлами (но это не точное число).
Причина?
Согласно Википедии, это число неточно, потому что границы между металлами, неметаллами и металлоидами слегка колеблются из-за отсутствия общепринятых определений.
(Это означает, что в металлургии исследователи могут определять металлы на основе плотности. В физике они могут определять металлы на основе физических свойств. А в химии химики занимаются химическими свойствами металлов.)
Также элементы, которые показаны серым цветом, все еще исследуются исследователями (элементы со 109 по 118 отмечены серым цветом).
Это синтетические элементы с очень коротким периодом полураспада.
По этой причине общее количество металлов до сих пор неизвестно.
Итак, если быть точным, если мы рассмотрим первые 108 элементов, то всего в Периодической таблице присутствует 84 металла .
Всего в Периодической таблице 17 редкоземельных металлов. Редкоземельные металлы включают все 15 лантаноидов, а также скандий (Sc) и иттрий (Y). Итого 15 + 2 = 17 редкоземельных металлов.
Вот полный список всех 17 редкоземельных металлов.
| Атомный номер | Символ | Название элемента | |
| 21 | Sc | Скандий | |
| 39 | Y | Иттрий | |
| 57 | Лантан | ||
| 58 | Ce | Церий | |
| 59 | Pr | Празеодим | |
| 60 | Nd | Неодим | |
| 61 | thium62 | Sm | Самарий |
| 63 | Eu | Европий | |
| 64 | Gd | Гадолиний | |
| 65 | Tb 48 | ||
| Tb | |||
| Тербий | 66 | 9301Диспрозий | |
| 67 | Ho | Гольмий | |
| 68 | Er | Эрбий | |
| 69 | Tm | Тулий | |
| 70 | Yb | Иттербий | |
| 71 | |||
| 71 |
А знаете, почему их называют редкими?
Почему так называются редкоземельные металлы? Ответ: Вы могли подумать, что редкость означает, что эти элементы доступны в очень меньшем количестве.
Но если вы так думаете, то ошибаетесь.
Редкоземельные металлы на самом деле не так уж редки, как следует из названия.
Даже они доступны в большем количестве, чем золото.
Но дело в том, что они равномерно распределены по Земле и очень трудно найти эти элементы в одном месте на Земле.
Таким образом, они редки в контексте доступных ресурсов.
Прежде всего,
Что такое тяжелые металлы?
Тяжелые металлы – это те металлы, которые обладают более высокой плотностью или большей атомной массой.
Что ж, определение тяжелых металлов может отличаться в металлургии, физике, а также в химии.
В металлургии исследователи определяют тяжелые металлы на основе плотности.
В физике они могут использовать атомные номера для определения тяжелых металлов.
В то время как в химии химики озабочены химическими свойствами тяжелых металлов для их определения.
Итак, исследования по определению и классификации тяжелых металлов все еще продолжаются.
Многие исследователи используют общие критерии, согласно которым, если металлы имеют плотность более 5 г / см³, то они, вероятно, будут известны как тяжелые металлы.
На основании этого критерия тяжелые металлы показаны в Периодической таблице.
Металлы с максимальными характеристиками тяжелых металлов:
- Ртуть (Hg)
- Свинец (Pb) и
- Висмут (Bi)
Эти тяжелые металлы отображаются в Периодической таблице красным цветом (см. Изображение выше)
Металлы, которые обладают меньшими характеристиками тяжелых металлов. металлы есть;
- Медь (Cu)
- Серебро (Ag)
- Кадмий (Cd)
- Олово (Sn)
- Таллий (Tl)
И эти элементы представлены оранжевым цветом в Периодической таблице.
Остальные элементы, показанные желтым цветом, обладают меньшими характеристиками тяжелых металлов.
Здесь я расскажу вам о самом химически активном металле в Периодической таблице.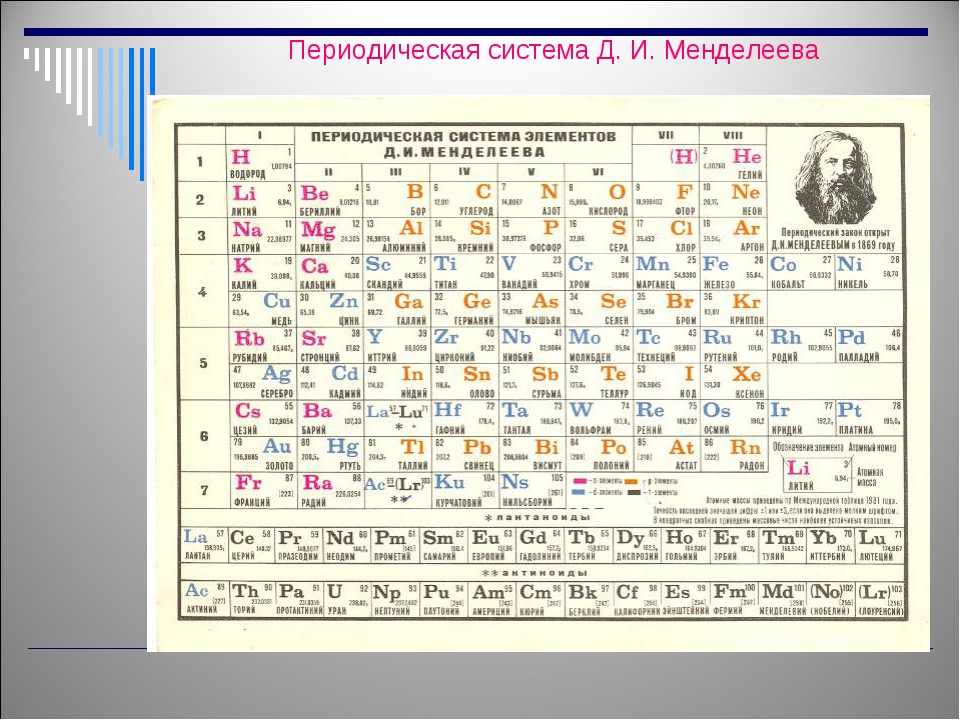 Но перед этим давайте обсудим, что такое реакционная способность в металлах?
Но перед этим давайте обсудим, что такое реакционная способность в металлах?
Реактивные металлы – это металлы, которые проявляют высокую тенденцию к потере электронов в химической реакции.
Например, при движении вниз по группе размер атома увеличивается.
Таким образом, сила притяжения между ядром и крайними электронами уменьшается.
Из-за этого электрон легко теряется во время химической реакции.
Следовательно, вниз по группе с увеличением размера атома реакционная способность металлов возрастает.
Самый реактивный металл в Периодической таблице.Металлы с высокой реакционной способностью расположены в левом нижнем углу Периодической таблицы. Это щелочные металлы группы 1.
В 1-й группе, когда мы движемся вниз сверху вниз, реакционная способность металлов увеличивается.
Таким образом, самый нижний элемент группы 1 (то есть франций) является наиболее химически активным металлом в Периодической таблице.
(Примечание : Франций – это элемент, изготовленный в лаборатории. Он доступен в очень меньшем количестве. И, следовательно, для любых практических целей цезий считается наиболее химически активным металлом в Периодической таблице. Цезий обладает высокой реакционной способностью, но это не так. предсказал, что франций будет иметь даже более высокую реакционную способность, чем цезий)
См. также: Реакционная способность щелочных металлов с водой (поясняется анимацией)
| Атомный номер | Символ | Имя элемент | ||
| 3 | Li | Литий | ||
| 4 | Be | Бериллий | ||
| 11 | Na | Натрий | ||
| 12 | Mg46 | 13 | Al | Алюминий |
| 19 | K | Калий | ||
| 20 | Ca | Кальций | ||
| 21 | Sc | Скандий | ||
| 22 | Ti | Титан | ||
| 23 | V | Ванадий | ||
| Хром | ||||
| 25 | Mn | Марганец | ||
| 26 | Fe | Железо | ||
| 27 | Co | Кобальт | ||
| 28 | Ni | 29 | Cu | Медь |
| 30 | Zn | Цинк | ||
| 31 | Ga | Галлий | ||
| 37 | Rb | Рубидий | 1 900r53Стронций | |
| 39 | Y | Иттрий | 9005 3||
| 40 | Zr | Цирконий | ||
| 41 | Nb | Ниобий | ||
| 42 | Mo | Молибден | ||
| 43 | Techne46 | Рутений | ||
| 45 | Rh | Родий | ||
| 46 | Pd | Палладий | ||
| 47 | Ag | Серебро | C | |
| 49 | In | Индий | ||
| 50 | Sn | Олово | ||
| 55 | Cs | Цезий | ||
| 56 | Ba | Барий | ||
| Лантан | ||||
| 58 | Ce | Церий | ||
| 59 | Pr | Празеодим | ||
| 60 | Nd | Неодим | ||
| 61 | Pm | Прометий | ||
| 62 | Самарий | Eu | Европий | |
| 64 | Gd | Гадолиний | ||
| 65 | Tb | Тербий | ||
| 66 | Dy | Dysprosium | Диспрозий | |
| 68 | Er | Эрбий | ||
| 69 | Tm | Тулий | ||
| 70 | Yb | Иттербий | ||
| 71 48 | Лютеций | L 72301 Hf | Гафний | |
| 73 | Ta | Тантал | ||
| 74 | W | Вольфрам | ||
| 75 | Re | Рений | ||
| 76 | Os | Осмий | ||
| Irrid | Осмий | |||
| Irrid | Iridium | |||
| 78 | Pt | Платина | ||
| 79 | Au | Золото | ||
| 80 | Hg | Ртуть | ||
| 81 | Tl48 | Таллий | Свинец | |
| 83 | Bi | Висмут | ||
| 84 | Po | Полоний | ||
| 87 | Fr | Франций | ||
| 88 | Радий | |||
| 89 | Ac | Актиний | ||
| 90 | 92 301 ThТорий | |||
| 91 | Па | Протактиний | ||
| 92 | U | Уран | ||
| 93 | Np | Путон | ||
| Плутон | ||||
| Плутон | Плутон | |||
| 95 | Am | Америций | ||
| 96 | Cm | Кюрий | ||
| 97 | Bk | Berkelium | ||
| 98 | Cf | |||
| Эйнштейний | ||||
| 100 | Fm | Фермий | ||
| 101 | Md | Менделевий | ||
| 102 | No | Нобелий | ||
| Лоурен | c||||
| 104 | Rf | Резерфорд ium | ||
| 105 | Db | Dubnium | ||
| 106 | Sg | Seaborgium | ||
| 107 | Bh | Bohrium | ||
| 108 | 109301 Hs | Mt | Meitnerium | |
| 110 | Ds | Darmstadtium | ||
| 111 | Rg | Roentgenium | ||
| 112 | Cn | 113 N | 113 Ni | Copernicium|
| 114 | Fl | Flerovium | ||
| 115 | Mc | Moscovium | ||
| 116 | Lv | Livermorium | ||
| 117 | Tsine1 Tsine | 1Ог | Оганессон | 9005 3
Знаете ли вы, что является основным свойством металла?
Они теряют электроны во время химической реакции.
А теперь подумайте, какими должны быть условия или свойства, которыми должен обладать элемент, чтобы электрон легко терялся.
Вот несколько свойств, необходимых для легкой потери электронов.
- Элемент должен иметь низкую энергию ионизации
- Элемент должен иметь меньшее количество электронов на внешней орбите
- Элемент должен иметь меньшую электроотрицательность
Если элементы обладают этими свойствами, они будут вести себя как металлы .
Теперь вы знаете, что элементы в левой части Периодической таблицы имеют меньше валентных электронов на своей внешней орбите.
Также атомные размеры этих элементов больше, что способствует потере электронов.
Поскольку они обладают большим атомным размером, валентные электроны легко удалить с внешней орбиты. Таким образом, у них низкая энергия ионизации.
Также эти элементы, расположенные слева, имеют меньшую электроотрицательность.
Позвольте мне кратко рассказать об электроотрицательности.
Электроотрицательность – это тенденция к притяжению электронной пары.
Я обсуждал это в подробной статье Периодической таблицы , что электроотрицательность зависит от размера атома.
Если размер атома меньше, то он имеет большую тенденцию притягивать электронную пару (означает меньший размер, больше электроотрицательность). А если размер атома больше, то он имеет меньшую тенденцию притягивать электронную пару (означает чем больше размер, тем меньше электроотрицательность.)
Теперь элементы в левой части Периодической таблицы имеют больший атомный размер. Так у них будет меньше электроотрицательности.
Следовательно, они более металлические по своей природе.
Надеюсь, теперь вы получили ответ «Почему металлы расположены в левой части таблицы Менделеева?»
Здесь я покажу вам физические и химические свойства металлов.
Продолжайте читать…
Физические свойства металла # 1 Звонкий Металлы издают звонкий звук, когда они сильно застревают. Это указывает на звонкую природу металлов.
Это указывает на звонкую природу металлов.
Например: Звонок.
# 2 Твердое состояние при комнатной температуреВсе металлы при комнатной температуре являются твердыми телами (кроме ртути)
Они имеют определенную форму и размер.
# 3 Блестящий (блестящий)Металлы блестящие.
Имеют гладкую блестящую поверхность.
# 4 КовкостьМеталлы могут быть преобразованы в тонкие листы, если приложить к ним достаточное давление.Это свойство металлов известно как пластичность.
# 5 ПластичностьМеталлы можно вытягивать в тонкую проволоку. (Например, кабельные провода, тонкие медные провода, используемые в электрической цепи, используемой в вашем ноутбуке или телефоне, который вы держите прямо сейчас, и т. Д.)
# 6 Проводимость Металлы являются хорошими проводниками тепла, а также электричества.
Это означает, что тепло и электричество могут легко проходить через металлы.
# 7 Высокая температура плавления и температура кипенияМеталлы имеют высокую температуру плавления, а также температуру кипения.
# 8 ТвердостьТвердость – это способность материала противостоять износу, истиранию, царапинам и сопротивляться изменениям формы.
Как правило, все металлы обладают этими свойствами (кроме ртути)
( Примечание: Натрий, калий и литий – мягкие металлы, которые можно разрезать кухонным ножом.)
# 9 ПлотностьМеталлы имеют высокая плотность. И из-за этого металлы имеют больший вес.
Химические свойства металла # 1 ВалентностьАтомы или металлы обычно имеют 1, 2 или 3 электрона на внешней орбите, и они теряют эти электроны во время химической реакции.
# 2 Коррозионная активностьНекоторые металлы легко корродируют при контакте с влажным воздухом или водой (например: Iron )
# 3 Потеря электронов Металлы имеют тенденцию терять электроны. Они отдают электроны во время химической реакции.
Они отдают электроны во время химической реакции.
Металлы менее электроотрицательны, поэтому они электроположительны по своей природе.
# 5 РеактивныйНекоторые металлы химически более активны.Они подвергаются химическим реакциям сами по себе или с другими элементами и выделяют энергию.
Например: Калий автоматически воспламеняется при контакте с водой.
# 6 Образует основные оксидыМеталлы реагируют с кислородом и образуют основные оксиды.
# 7 Хорошие восстановителиМеталлы являются восстановителями, потому что они отдают электроны во время химической реакции и окисляются.
Бонусный подарок для вас: Интерактивная периодическая таблицаПозвольте мне рассказать вам, как эта интерактивная периодическая таблица поможет вам в учебе.
1). Вы можете легко найти каждую деталь об элементах из этой единой Интерактивной периодической таблицы.
Вы можете легко найти каждую деталь об элементах из этой единой Интерактивной периодической таблицы.
2). Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
3). Вы также получите HD-изображения Периодической таблицы Менделеева (БЕСПЛАТНО).
Оформить заказ Интерактивная таблица Менделеева и загрузить изображение с высоким разрешением прямо сейчас ( Это БЕСПЛАТНО )
СводкаИтак, во всей статье мы обсуждали расположение металлов в таблице Менделеева.
Мы видели;
- Положение щелочных металлов,
- Положение щелочноземельных металлов,
- Положение переходных металлов,
- Положение внутренних переходных металлов,
- Положение редкоземельных металлов,
- Положение тяжелых металлов, а также химически активных металлов .

Затем мы обсудили полный список всех металлов Периодической таблицы.
Я назвал вам причину, по которой металлы расположены в левой части таблицы Менделеева.
И, наконец, мы обсудили физические и химические свойства металлов.
Я надеюсь, что эта статья «Где находятся металлы в Периодической таблице» помогла вам в решении ваших вопросов.
Сообщите мне в комментариях, какая часть статьи вам показалась интересной.Или, по крайней мере, прокомментируйте и дайте мне знать, помогла вам эта статья или нет.
Предлагаемые важные статьи для вас:
Типы металлов в Периодической таблице
Обновлено 13 декабря 2018 г.
Кевин Бек
Когда вы думаете о слове «металлы», вы, скорее всего, думаете о предметы повседневного обихода и их функции, например, химия или что-то еще, связанное с наукой. Например, большинство машин и многие конструкции изготавливаются из одного или нескольких металлов из-за их прочности и жесткости. Кроме того, некоторые металлы ценятся за их внешний вид, стоят немалых денег за единицу массы и буквально классифицируются как «драгоценные металлы»; золото и серебро, пожалуй, самые известные примеры.
Кроме того, некоторые металлы ценятся за их внешний вид, стоят немалых денег за единицу массы и буквально классифицируются как «драгоценные металлы»; золото и серебро, пожалуй, самые известные примеры.
Но металлы также представляют собой один из трех типов элементов в химии, два других – неметаллы и металлоиды. На самом деле металлы составляют большинство элементов в природе, хотя вы, вероятно, слышали лишь о небольшой их части. Прежде чем исследовать свойства металлов, полезно понять, что известно под термином «элемент» и как периодическая таблица используется для структурирования элементов в таблице.
Что такое элементы?
В повседневной жизни «элемент» – это составная часть целого. У этого слова есть похожее, но более строгое определение в химии: элемент – это что-то, состоящее из одного определенного типа атома. Его нельзя разделить на более простые компоненты с помощью обычных химических инструментов. По состоянию на 2018 год химики идентифицировали 92 встречающихся в природе элемента, а также 11 нестабильных элементов, которые были получены в лабораторных условиях. Данный элемент существует в виде твердого тела, жидкости или газа в своей природной форме.
Данный элемент существует в виде твердого тела, жидкости или газа в своей природной форме.
Атом, в свою очередь, представляет собой микроскопическое скопление протонов, нейтронов и электронов в некоторой комбинации. Водород, простейший атом, состоит только из протона и электрона; уран, самый массивный, содержит 92 протона, 92 электрона и 146 нейтронов в одном из своих изотопов. Атом обычно имеет одинаковое количество протонов, которые несут положительный заряд, и электронов, которые несут отрицательный заряд равной величины. Количество нейтронов, которые вместе с протонами составляют ядра (единичное ядро) атомов и не имеют электрического заряда, в некоторой степени приближается к количеству протонов, хотя по мере увеличения размеров элементов нейтронов, как правило, больше протонов, чем протонов. в большей степени.
Периодическая таблица элементов
Периодическая таблица является для химии тем же, чем индексированный список ингредиентов для поваренной книги. Любое химическое соединение, которое у вас есть или о котором вы можете подумать, большое или маленькое, можно свести к некоторой комбинации элементов периодической таблицы.
Любое химическое соединение, которое у вас есть или о котором вы можете подумать, большое или маленькое, можно свести к некоторой комбинации элементов периодической таблицы.
113 элементов расположены в этой таблице в порядке возрастания атомных номеров. Это число просто количество протонов, которые есть у элемента. Если это число изменится, изменится идентичность элемента.Это не относится к нейтронам или электронам; вариации элемента, которые содержат разное количество нейтронов, называются изотопами , этого элемента, тогда как элемент, который имеет больше или меньше электронов, чем протонов, называется ионом и несет положительный или отрицательный электрический заряд.
Периодическая таблица получила свое название, потому что включает в себя категории элементов, которые периодически и предсказуемо повторяются. Когда вы смотрите на периодическую таблицу (интерактивный пример см. В разделе Ресурсы), вы можете увидеть, что у нее есть некоторые любопытные пробелы в строках вверху, но они исчезают с элементами с более высокими номерами. Это связано с тем, что элементы не просто выстроены в массив на основе атомного номера; они были разделены на типы в зависимости от их различных атомных и химических свойств.
Это связано с тем, что элементы не просто выстроены в массив на основе атомного номера; они были разделены на типы в зависимости от их различных атомных и химических свойств.
Группы периодической таблицы
Строго говоря, элементы можно сгруппировать в металлов и неметаллов , но традиционно существует три группы элементов: металлы, неметаллы и металлоиды . Как следует из названия «металлоиды», эти элементы обладают как металлоподобными, так и неметаллическими свойствами.
Есть также три основных типа металлов: щелочные металлы, щелочноземельные металлы и переходные металлы. Переходные металлы включают ряд собственных подкатегорий, описанных ниже.
Элементов, строго классифицируемых как неметаллы, на удивление мало, всего семь из них (H, C, N, O, P, S и Se) усеивают периодическую таблицу. Эта классификация, однако, исключает неметаллы, которые получили свои собственные категории, включая пять галогенов (F, Cl, Br, I и At) и шесть благородных газов (He, Ne, Ar, Kr, Xe и Ra. ).
).
Характеристики металлов
Поскольку существует семь металлоидов и 18 неметаллов того или иного вида (семь неметаллов как таковых, шесть благородных газов и пять галогенов), 88 из 113 элементов в периодической таблице классифицируются как некоторые типы металлов. Хотя эти металлы явно различаются по своим свойствам, они обладают рядом общих характеристик.
Металлы твердые при комнатной температуре, за исключением ртути, жидкости, используемой в старых термометрах.У них есть блеск, что означает, что они отражают свет, свойство, которое часто придает им ценность (например, медь, серебро). Они податливы, что означает, что их можно физически формовать в тонкие листы без трещин. Обычно они твердые, хотя калий и натрий, которые служат биологически активными ионами в кровотоке человека, можно разрезать обычным ножом. Они пластичны, что является причудливым способом сказать, что из металлов можно делать проволоку; это свойство удобно, потому что большинство металлов являются хорошими проводниками электричества и тепла, что делает их очень важными для современных промышленных применений. Их проводимость является следствием наличия электронов, которые не связаны прочно с ядрами. Наконец, металлы обычно плотные (то есть имеют большую массу на единицу объема), и у них высокие температуры кипения и плавления. Вольфрам имеет чрезвычайно высокую температуру плавления, и не случайно этот элемент широко используется в нити накала ламп.
Их проводимость является следствием наличия электронов, которые не связаны прочно с ядрами. Наконец, металлы обычно плотные (то есть имеют большую массу на единицу объема), и у них высокие температуры кипения и плавления. Вольфрам имеет чрезвычайно высокую температуру плавления, и не случайно этот элемент широко используется в нити накала ламп.
Типы металлов
Три категории металлов – щелочные металлы, щелочноземельные металлы и переходные металлы.Расположение таблицы Менделеева полезно для того, чтобы держать их близко сгруппированными; Щелочные металлы – это шесть элементов непосредственно под водородом (H) в крайнем левом столбце таблицы, обозначенном IA. Щелочноземельные металлы являются шестью «ближайшими соседями» щелочных металлов в таблице, занимая всю колонку IIA.
Переходные металлы занимают столбцы с III по XII и строки с 3 по 6 периодической таблицы, всего 40 элементов. 14 лантаноидов (элементы с 58 по 71) и 14 актинидов (элементы с 90 по 103) считаются редкоземельными металлами.Наконец, в большинстве схем восемь элементов считаются металлами, не указанными иначе, в результате чего общее количество металлов составляет 6 (щелочные) + 6 (щелочноземельные) + 40 (переходные) +28 (редкоземельные) + 8 (неуказанные) = 88. .
Металлоиды и неметаллы
Эти семь элементов с металлоподобными и неметаллическими свойствами занимают части строк с 3 по 6 периодической таблицы и включают:
Они являются твердыми при комнатной температуре и полезны в область полупроводниковой технологии, и часто образуют сплавы , или комбинации металлов с другими металлическими элементами.
Периодическая таблица элементов: 2021 Refresher
Раскрытие информации: Ваша поддержка помогает поддерживать работу Commodity.com! Мы зарабатываем реферальный сбор за некоторых брокеров и услуг, перечисленных на этой странице. Узнать больше …Изучение и преподавание Периодической таблицы элементов является неотъемлемой частью естественнонаучного образования.
В дополнение к самой таблице мы предоставляем учебные ресурсы и ответы на часто задаваемые вопросы как для учителей, так и для студентов, чтобы помочь освоить этот краеугольный камень знаний STEM.
Нажмите, чтобы увеличить изображение.Общественное достояние изображение Периодической таблицы за 2012 г. через Викимедиа.
Понимание Периодической таблицы
Вот несколько ответов на общие вопросы о периодической таблице.
Почему она называется периодической таблицей?
Когда Дмитрий Менделеев составлял таблицу Менделеева, он сгруппировал элементы со схожими свойствами. Основываясь на количестве электронов, ученый может определить, в какую группу поместить элемент. Этот образец называется периодом (или строкой) в периодической таблице.
Как читать периодическую таблицу?
Ключ к пониманию таблицы Менделеева заключается в ее расположении. Таблица состоит из семи строк (называемых периодами) и 18 столбцов (называемых группами или семействами). Некоторые таблицы, такие как наша выше, также включают цвета, чтобы помочь идентифицировать группы, пересекающие строки и столбцы.
Цветные области нашей таблицы разбивают элементы на группы: щелочные металлы, щелочноземельные металлы, лантаноиды и актиниды, переходные и постпереходные металлы, металлоиды, неметаллы, галогены и благородные газы.Мы подробно рассмотрим каждую из этих групп в приведенных ниже вопросах.
Как интерпретировать поля элементов?
Расположен прямо над английским названием для каждого элемента , самые большие буквы представляют его химическое сокращение . Наибольшее число – это атомный номер элемента . Другая информация в коробке включает электронную конфигурацию элемента, электроотрицательность, степень окисления и его первую энергию ионизации, измеренную в килоджоулей на моль.
Что такое 118 элементов?
Элемент, проще говоря, фундаментальная единица материи, которую нелегко разбить . Он состоит из определенного количества протонов и переменных нейтронов и электронов. Вся материя состоит из этих 118 элементов, объединенных в различных соотношениях и находящихся в разных состояниях, как твердые тела.
В зависимости от того, где вы находитесь во вселенной, некоторые из них более распространены. Здесь, на Земле, такие элементы, как кислород (O) и водород (H), обычны, но технеций (Tc) и нихоний (Nh) встречаются редко.
Есть элемент 119?
На момент написания этой статьи ученые не выделили стабильный элемент 119. Большинство элементов были открыты естественным путем. Однако более тяжелые элементы необходимо синтезировать в ядерной лаборатории. Те, что больше, чем элемент 109, были сформированы и изолированы таким образом.
В настоящее время самый крупный из них – 118. Элементы с нечетными номерами представляют большую проблему для изоляции, поскольку их нуклоны не так стабильны.
Какие металлы самые редкие?
В периодической таблице есть семейство из восьми элементов, известных как драгоценные металлы, включая элементов, 44 – 47 , как серебро, и 76 – 79 , как золото.Эти металлы считаются очень редкими и очень ценными.
Из них двумя наиболее редкими металлами являются родий (Rh) и осмий (Os). Это означает, что они обычно не встречаются в естественных условиях на Земле или во Вселенной.
Почему в таблице Менделеева нет стали?
В периодическую таблицу входят только элементы, а сталь – это сплав , а не элемент. Сталь состоит из нескольких элементов. Его основная формула включает железо (Fe) со следовыми количествами углерода (C).
Различные типы стали добавляют другие элементы для улучшения свойств. Например, хром (Cr) может быть добавлен для увеличения твердости стали.
Что такое щелочные металлы?
Семейство щелочных металлов включает шесть элементов первого столбца периодической таблицы, от лития (Li) до франция (Fr). Все эти металлы содержат один валентный электрон, что означает, что они образуют катионы и легко реагируют с водой. Эти элементы образуют ионные связи, известные как соли.
Водород (H) может быть ошибочно отнесен к этому семейству, но он не содержит никаких признаков этого семейства.
Что такое щелочноземельные металлы?
Щелочноземельные металлы представляют собой второй столбец периодической таблицы. Его шесть элементов простираются от бериллия (Be) до радия (Ra). Эти металлы названы в честь образования основных растворов при попадании в воду. Они имеют тенденцию образовывать катионы с двумя положительными зарядами и связываются ионно.
Что такое лантаноиды и актиниды?
Лантаноиды и актиниды относятся к двум семействам, состоящим в основном из радиоактивных металлов в ответвлении периодической таблицы Менделеева.Обычно они отображаются в виде двух строк в отдельном разделе. В верхнем ряду находятся лантаноиды, элементы 57–70. В нижнем ряду содержатся актиниды, элементы 89–103.
Эти металлы обладают очень уникальными свойствами благодаря их f-орбитальному расположению и нестабильным ядрам. Например, уран (U) входит в эту группу.
Что такое переходные и постпереходные металлы?
Переходные металлы включают 34 металла в середине периодической таблицы.Эти металлы названы так, поскольку они могут принимать много разных зарядов из-за того, что их валентные электроны находятся на d-орбиталях. В результате эти металлы, как правило, имеют самые разные цвета и свойства.
Железо (Fe), платина (Pt), молибден (Mo), никель (Ni), палладий (Pd), цинк (Zn) и медь (Cu) являются переходными металлами.
Металлы после перехода – это те металлы, которые идут после переходных металлов, но до благородных газов в ряду.Их всего восемь, но они могут приобретать очень уникальные свойства, заряды и цвета.
Алюминий (Al), олово (Sn) и свинец (Pb) являются постпереходными металлами.
Что такое металлоиды и неметаллы?
Металлоиды – это те семь элементов, которые составляют ступенчатую линию в периодической таблице Менделеева, включая бор и кремний. Эти элементы обладают свойствами, схожими как с металлами, так и с неметаллами.
Металлоиды могут иметь как положительный, так и отрицательный заряд, в зависимости от окружающих элементов.Эти элементы особенно важны для электронного сообщества .
Неметаллы представляют собой справа вверху периодической таблицы. Эти элементы обычно представляют собой газы при комнатной температуре и склонны к образованию анионов. Неметаллы обладают наивысшей электроотрицательностью среди всех элементов, что означает, что они крадут электроны.
Что такое галогены?
Семейство галогенов – это основная группа из семи в периодической таблице, включая фтор вплоть до астата.Все они неметаллы, образующие однозарядный анион. Они представляют все три состояния материи.
Что такое благородные газы?
Благородные газы – это неметаллы , которые не вступают в реакцию с какими-либо элементами, если не наложены экстремальные условия. Это крайний правый столбец в периодической таблице. Обычно они не образуют соединений, так как имеют полный октет.
Почему трейдерам следует заботиться о таблице Менделеева?
Товарные трейдеры могут ссылаться на периодическую таблицу элементов, чтобы найти сокращения, используемые брокерами и средствами массовой информации для обозначения цветных металлов, таких как железо (Fe), и драгоценных металлов, таких как золото (Au).
Трейдеры могут также улучшить свое понимание рынка сырьевых товаров в целом, используя периодическую таблицу Менделеева, чтобы увидеть возможные связи между металлами и другими химическими веществами, которые могут повлиять на их ценообразование.
Учебные ресурсы по Периодической таблице
Мы собрали дополнительные ресурсы, чтобы помочь учителям и учащимся всех возрастов лучше понять периодическую таблицу Менделеева.
Краткие видеоролики о Периодической таблице
Планы и мероприятия уроков по работе с периодической таблицей
Регулируемые брокеры: где я могу торговать металлами?
Начните свое исследование с обзоров этих регулируемых брокеров, доступных в.


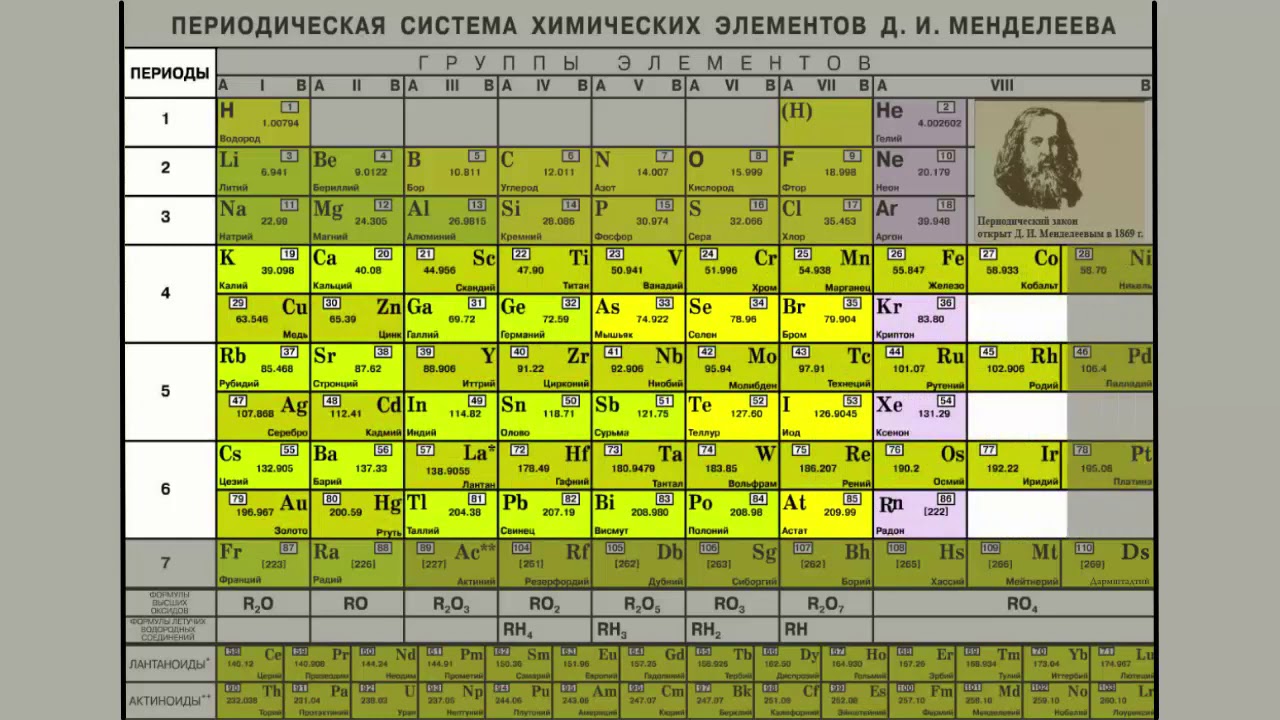 Примеры металлов: золото, алюминий, медь, железо, свинец, серебро, платина, уран и цинк. В Периодической таблице металлы разделены на группы, представленные в следующем списке:
Примеры металлов: золото, алюминий, медь, железо, свинец, серебро, платина, уран и цинк. В Периодической таблице металлы разделены на группы, представленные в следующем списке: Некоторые металлы были доступны и использовались некоторыми из старейших цивилизаций, включая древних египтян, древних греков и древних римлян. Вплоть до средневековья считалось, что металлов всего семь. Эти особые металлы называют «металлами древности». Древние «Металлы древности» вместе с приблизительными датами открытия: золото (6000 г. до н.э.), медь (9000 г. до н.э.), серебро (4000 г. до н.э.), свинец (6400 г. до н.э.), олово (3000 г. до н.э.), железо (1500 г. до н.э.) и ртуть (1500 г. до н.э.). Термин «металл» происходит от греческого слова «Metallon», означающего «раскапывать», например, в шахтах и ямах.Материалы, добытые на различных рудниках, Платон назвал металлеями.
Некоторые металлы были доступны и использовались некоторыми из старейших цивилизаций, включая древних египтян, древних греков и древних римлян. Вплоть до средневековья считалось, что металлов всего семь. Эти особые металлы называют «металлами древности». Древние «Металлы древности» вместе с приблизительными датами открытия: золото (6000 г. до н.э.), медь (9000 г. до н.э.), серебро (4000 г. до н.э.), свинец (6400 г. до н.э.), олово (3000 г. до н.э.), железо (1500 г. до н.э.) и ртуть (1500 г. до н.э.). Термин «металл» происходит от греческого слова «Metallon», означающего «раскапывать», например, в шахтах и ямах.Материалы, добытые на различных рудниках, Платон назвал металлеями.