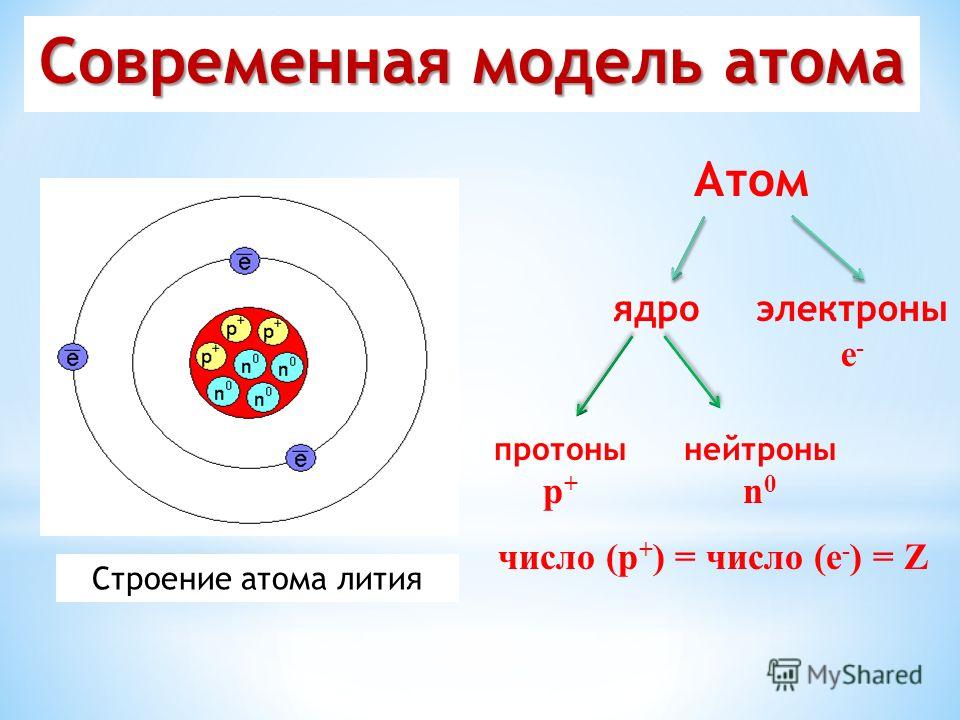
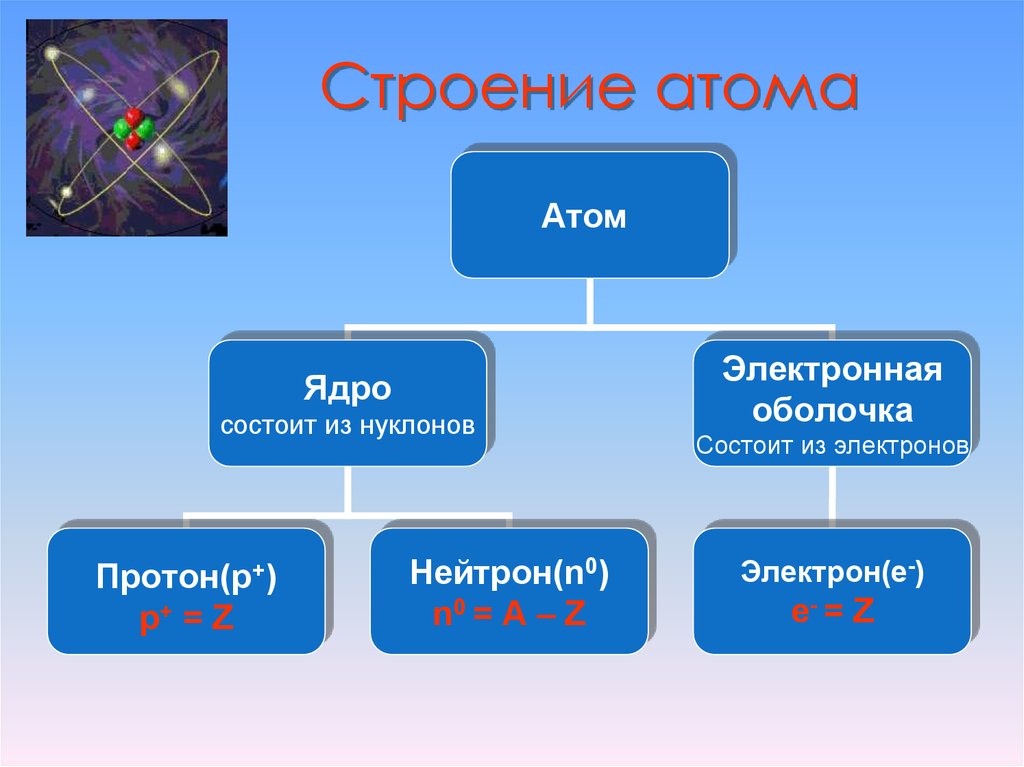
Строение атома
К содержанию
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие. В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Модель Томсона
Хотя слово атом в первоначальном значении — частица, которая не делится на меньшие части, согласно научным представлениям он состоит из более мелких частиц, которые называют субатомными частицами. Атом состоит из электронов, протонов, все атомы, кроме водорода-1, содержат также нейтроны. Не сразу ученые пришли к правильным представлениям о строении атома. Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон. По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью. Простейший атом — атом водорода — представляет собой положительно заряженный шар радиусом около 10 У более сложных атомов в положительно заряженном шаре находятся несколько электронов.
Однако модель Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
У более сложных атомов в положительно заряженном шаре находятся несколько электронов.
Однако модель Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является устойчивость.
Опыт Резерфорда
Масса электронов в несколько тысяч раз меньше массы атомов. Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906
 Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы.
Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на бо́льшие углы. Для этого он окружил фольгу сцинтилляционными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одно из двух тысяч) отклонилось на углы, большие 90º. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на бо́льшие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Электроны вследствие своей малой массы не могут заметно изменить траекторию α-частицы.
Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома. Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на бо́льшие углы. Для этого он окружил фольгу сцинтилляционными экранами и определил число вспышек на каждом экране. Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одно из двух тысяч) отклонилось на углы, большие 90º. Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на бо́льшие углы, он сам не верил в положительный результат. «Это почти столь же невероятно, — говорил Резерфорд, — как если бы вы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанес вам удар».
Другие заметки по физике
Полезная информация?
Строение атома – Всё для чайников
- Подробности
- Категория: Документальные учебные фильмы. Серия «Физика».
Документальные учебные фильмы. Серия «Физика».
Атом (от греческого atomos – неделимый) — одноядерная, неделимая химическим путем частица химического элемента, носитель свойства вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева.
Масса атома определяется массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A-Z). Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом.
Перед изучением свойств электрона и правил формирования электронных уровней, необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее “верных” представлениях, способных наиболее наглядно показать как располагаются электроны в атоме.

Электрон является квазичастицей проявляя корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускула) и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам – способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля.
Атомы, молекулы и ионы. Структура атома
Каждому атому нужна какая-то структура
Прежде чем мы сможем узнать обо всем, что связано с атомом, нам, вероятно, следует начать с самого основного вопроса: что такое атом?
Атом — это единица материи и основная единица элемента. Его нельзя разрушить никакими химическими процессами.
Помните нашего хорошего друга Джона Далтона? Он вообразил, что атом чрезвычайно мал и неделим. Это была хорошая отправная точка, но она не рассказывает всей истории. В 1850-х годах была завершена серия экспериментов, которые продемонстрировали, что атомы действительно обладают внутренней структурой и состоят из еще более мелких частиц, называемых 9.0009 субатомные частицы . Три самые основные субатомные частицы — это электронов , протонов и нейтронов .
Представляем вам еще одного известного ученого, Эрнеста Резерфорда. Он родился в Новой Зеландии и считается одним из величайших экспериментаторов всех времен. Если бы существовал Зал славы науки, он бы точно был в нем. У него был способ разобраться во всем. Он известен как отец ядерной физики и получил Нобелевскую премию по химии в 1908 за выдающуюся работу. 1
Эрнест Резерфорд 1871-1937. (Изображение отсюда.)
Так что именно сделал этот парень, чтобы выглядеть таким самодовольным на этой фотографии? И какое это имеет отношение к атому? Резерфорд был ученым, открывшим, что атомы имеют ядро (центр), содержащее протоны. Несколько лет спустя другие ученые обнаружили, что ядро также является домом для нейтрона и электрона.
Несколько лет спустя другие ученые обнаружили, что ядро также является домом для нейтрона и электрона.
Ядро невероятно маленькое. Мы имеем в виду очень маленькие. Он также очень плотный по сравнению с остальной частью атома. Взгляните на эти размеры: Атомы имеют диаметр около 10 -10 метров, в то время как диаметр ядра обычно составляет около 10 -15 метров. Если весь атом увеличить до размеров бейсбольного стадиона, ядро будет размером с арахис.
Давайте изучим и сосредоточимся на субатомных особенностях.
Субатомные частицы – электроны, протоны и нейтроны
Начнем с протона – милой положительно заряженной субатомной частицы. Эти ребята находятся внутри ядра. Как все эти положительно заряженные частицы сбиваются в маленькое пространство, если одноименные заряды отталкивают друг друга? Это Сила, юный джедай. Силы внутри ядра противодействуют этому протон-протонному отталкиванию и удерживают ядро вместе. Физики называют эти силы ядерным клеем.
Мы знаем, что ядро очень маленькое по сравнению с остальной частью атома, поэтому было бы удивительно услышать, что оно на самом деле содержит большую часть массы атома. Для всех практических целей масса всего атома в значительной степени равна массе ядра. Сумасшедший, да?
Атомы нейтральны по заряду. (Да, атомы могут быть также заряжены положительно или отрицательно, но мы рассмотрим это позже). Чтобы уравновесить положительно заряженные протоны, нам нужна отрицательно заряженная субатомная частица: электрон. Химическая реактивность, химическая связь, форма молекул и даже электричество зависят от того, где расположены электроны в атоме. До сих пор мы только упомянули, что электроны не находятся в ядре. Где находятся электроны в атоме?
В самых ранних моделях атома электроны беспорядочно вращались вокруг ядра. По мере того, как ученые проводили больше экспериментов и становились экспертами в области атомной энергетики, они поняли, что это представление, вероятно, было неверным. Сегодня ученые используют высокоматематическую модель, называемую квантово-механической моделью, для обнаружения электронов и лучшего представления структуры атома. А пока радуйтесь, что они это поняли, а вам не пришлось.
Сегодня ученые используют высокоматематическую модель, называемую квантово-механической моделью, для обнаружения электронов и лучшего представления структуры атома. А пока радуйтесь, что они это поняли, а вам не пришлось.
Эта сложная модель основана на квантовой теории, согласно которой материя также обладает свойствами, связанными с волнами. Другими словами, электроны — это частицы материи с определенной массой, но они также ведут себя так, как если бы они были волной. На самом деле все материи (включая вас, меня и Леди Гагу) обладают свойствами частиц и свойствами волн. Чем меньше кусок материи, тем больше он похож на волну и меньше на частицу. Вы и являетесь огромными кусками материи, поэтому наши волновые свойства практически отсутствуют. Просто помните, что квантовая теория и волны идут рука об руку.
Как это помогает нам определить местонахождение электрона? Согласно квантовой теории, невозможно знать точное положение и импульс электрона одновременно.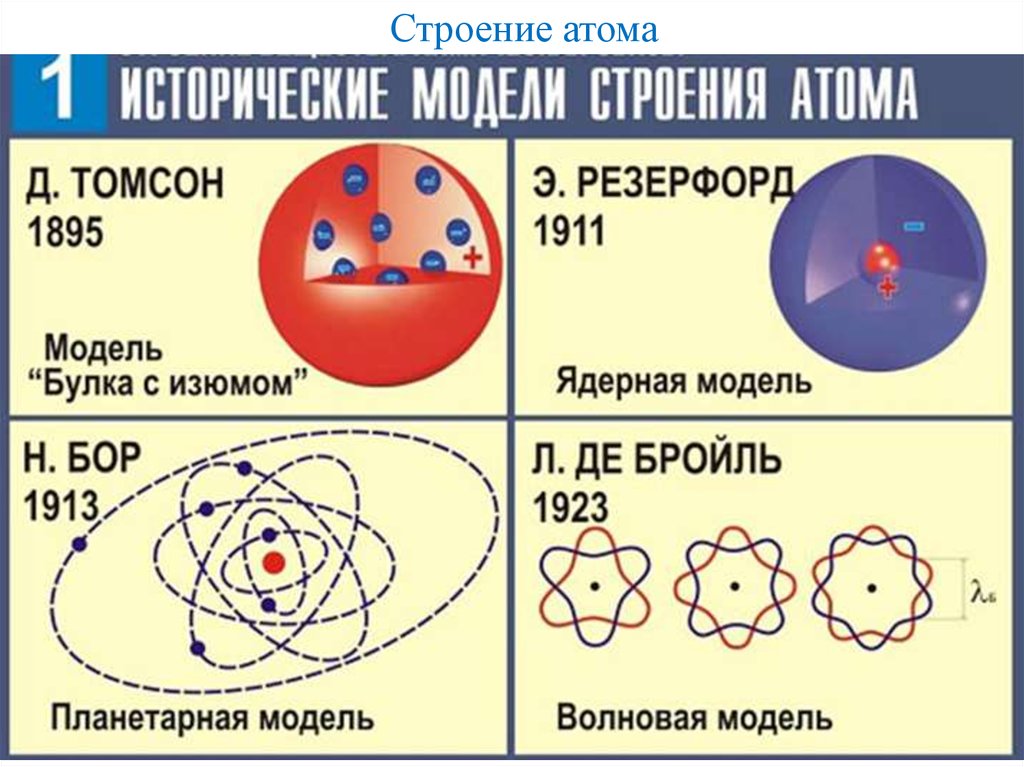 Это известно как принцип неопределенности . Другими словами, если вы знаете точное местоположение электрона, у вас нет информации о его импульсе (и вы помните, что электроны находятся в постоянном движении), или, если вы знаете его точный импульс, вы ничего не знаете о его местонахождении. В следующий раз, когда ваша мама спросит о вашем местоположении, попробуйте сказать ей, что сейчас вы едете в машине со скоростью ровно 40 миль в час, поэтому вы понятия не имеете, где вы находитесь. Это принцип неопределенности.
Это известно как принцип неопределенности . Другими словами, если вы знаете точное местоположение электрона, у вас нет информации о его импульсе (и вы помните, что электроны находятся в постоянном движении), или, если вы знаете его точный импульс, вы ничего не знаете о его местонахождении. В следующий раз, когда ваша мама спросит о вашем местоположении, попробуйте сказать ей, что сейчас вы едете в машине со скоростью ровно 40 миль в час, поэтому вы понятия не имеете, где вы находитесь. Это принцип неопределенности.
На данный момент мы все еще не уверены в местонахождении электрона. Вместо того чтобы зацикливаться на определении точного местоположения любого данного электрона в любой конкретный момент времени, ученые решили, что можно просто вычислить вероятность местоположения электрона в любой данный момент времени. Другими словами, они заменили уверенность вероятностью. Они знают, что электрон с большой долей вероятности находится где-то в рассчитанном объеме вокруг атома. Из всего этого вероятностного материала возникла идея орбиталей (или электронных облаков).
Из всего этого вероятностного материала возникла идея орбиталей (или электронных облаков).
Орбитали — это объемы пространства, в которых наиболее вероятно нахождение электрона. В следующих разделах вы узнаете все об орбиталях, включая их форму, энергию и все другие полезные вещи. А пока просто знайте, что электроны — это отрицательно заряженные субатомные частицы, расположенные вне ядра на орбиталях.
Орбитали бывают разных форм и размеров.
Нам осталось обсудить одну субатомную частицу: нейтрон. Нейтроны — ближайшие соседи протонов. Они также находятся в плотном и компактном ядре. Это электрически нейтральные частицы с массой немного большей, чем у протонов. Не все элементы одного и того же атома имеют одинаковое количество нейтронов, но мы немного забегаем вперед. Настройтесь на следующий раздел, чтобы узнать все о нейтронах и о том, как они связаны с элементом 9.0009 изотопов .
Закуска для мозгов
На этом веб-сайте вы найдете множество домашних экспериментов, которые вы можете провести, чтобы удовлетворить все свои любознательные потребности.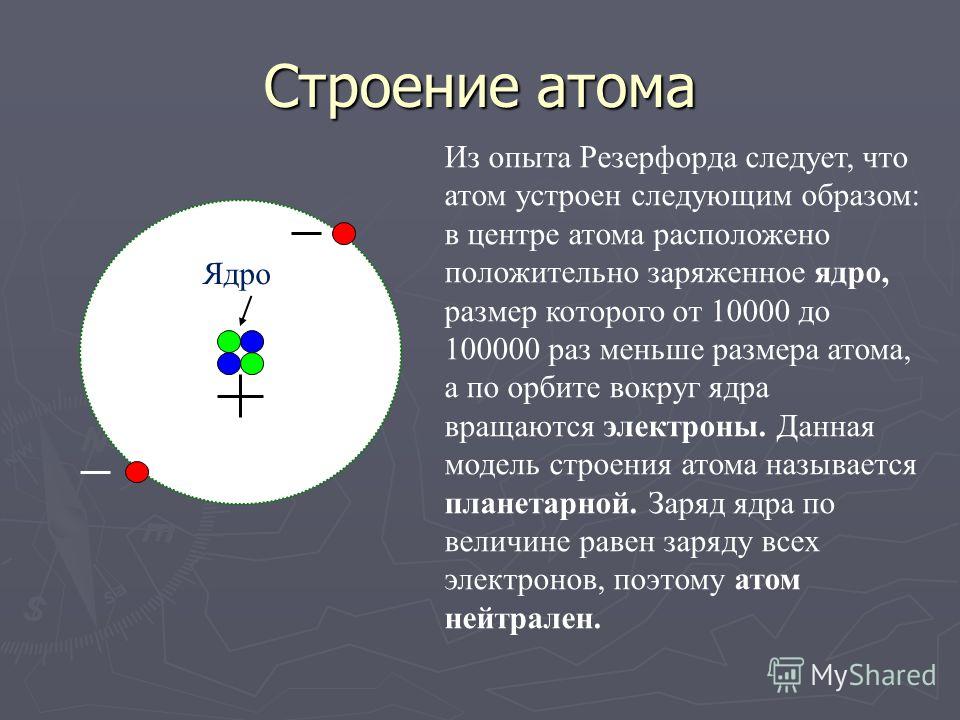
Видеоурок и практика атомной структуры
2 м
Воспроизвести видео:
Было ли это полезно ?
Итак, наконец, я хочу поговорить о трех принципах электронной конфигурации. Мы собираемся немного попрактиковаться с этим позже, но эти принципы, которые ты изучаешь, Джен, можешь просто запомнить их? Ладно, они тебе все равно понадобятся или уходи. Так что же они делают? Они описывают способ, которым электроны заполняют атомные орбитали. Помните, что или счета содержат два электрона. AFP о принципах также называют принципом построения основного здания в порядке. И с принципом наращивания происходит то, что он просто говорит: Эй, если у вас есть орбитали с разными энергиями, вы должны сначала заполнить самую низкую энергию. Хорошо, так что помните, что мы поговорим об этом позже. Но помните, что первая орбиталь — это ваша самая низкоэнергетическая орбиталь, а затем она поднимается до двух s, а затем доходит до двух p, и тогда вы получаете, что они начинают переходить в ds, efs и все такое.