Знаменитая таблица Менделеева
ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ
Автор: Сергей НЕЧАЕВ
30.12.2021
История науки знает множество открытий, однако немногие из них можно сопоставить с тем, что было сделано Дмитрием Ивановичем Менделеевым. В самом деле, хотя со времени открытия периодического закона химических элементов прошло немало лет, никто не может сказать, когда будет до конца понято все глубочайшее содержание знаменитой «таблицы Менделеева». Только вот вопрос: а кто же все-таки придумал ее первым?
Дмитрий Иванович Менделеев родился 27 января (8 февраля) 1834 года в Тобольске. В январе 1865 года он защитил докторскую диссертацию и был утвержден профессором кафедры технической химии Петербургского университета.
ОТКРЫТИЕ, СДЕЛАННОЕ «ВО СНЕ»
Принято считать, что свою периодическую таблицу Менделеев увидел во сне, и ему оставалось лишь записать ее и обосновать.
Дмитрий Иванович говорил своему другу философу И.И. Лапшину, посетившему его незадолго перед открытием: «Все в голове сложилось, а выразить таблицей не могу».
Получается, что Менделеев работал, как сумасшедший, три дня и три ночи не ложась спать. Доведя себя до крайней степени нервного истощения, он, как сейчас говорят, «отключился», и тут-то его и посетило «озарение».
Скорее всего, вся эта история с вещим сном лишь подтверждает тот факт, что люди, которые очень интенсивно работают над какой-либо проблемой, просто продолжают решать ее и во сне, только в этом случае к мыслительной деятельности подключается уже подсознание. Именно оно способно на такие величайшие научные «подвиги».
Конечно же, открытие Менделеева было совершено им не случайно, и уж точно не во сне. Всему этому предшествовала огромная работа, основанная на сочетании знаний физической стороны исследуемого явления, математической интуиции и философского осмысления. 17 февраля (1 марта) 1869 года Менделеев отправил в типографию рукопись, в которой был изложен его «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Уже через две недели он представил в Русское химическое общество статью «Соотношение свойств с атомным весом элементов».
В конечном итоге, Менделеев составил несколько вариантов периодической системы и на ее основе исправил атомные веса некоторых известных элементов.
С этого момента все другие проблемы отошли для него на задний план. В частности, он забросил работу над учебником «Основы химии» (труд этот будет закончен лишь в 1871 году). Распределение элементов в составленной им таблице каждый раз казалось ему несовершенным.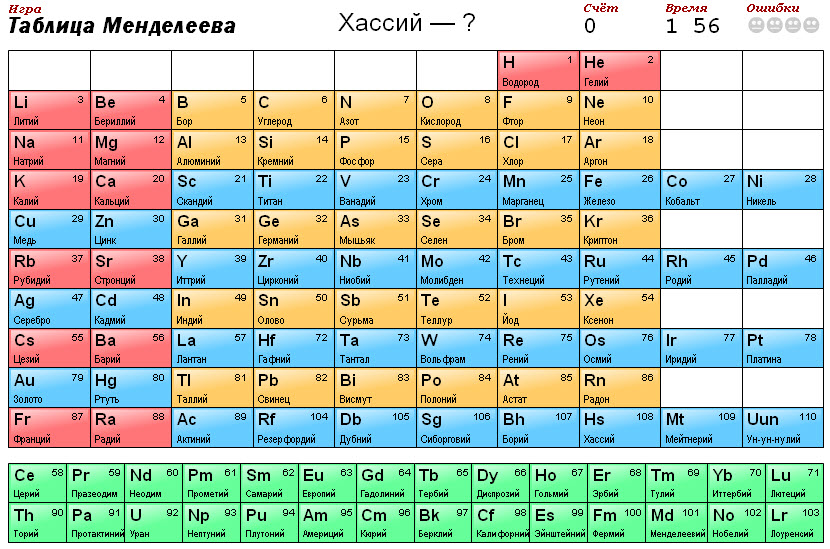
Закончилось все это тем, что Менделеев сумел предсказать существование нескольких до того неизвестных элементов. Более того, в одной из своих статей он подробно описал свойства трех из них: он назвал эти элементы «экабором», «экаалюминием» и «экакремнием» (или «экасилицием»). Чтобы было понятно: «эка» – на санскрите означает «первый», так что название, например, «экаалюминий» означает «первый аналог алюминия».
Так на свет появилась фундаментальная схема, которой до сих пор пользуются как школьники, так и ученые во всем мире.
ЮЛИУС ЛОТАР МЕЙЕР
И все же, справедливости ради, возвращаясь к знаменитой таблице Менделеева, необходимо отметить, что у нее был еще один «автор». Его звали Юлиус Лотар Мейер, и был он доктором медицины, занимавшимся вопросами теоретической и физической химии.
Этот человек родился 19 августа 1830 года в семье врача в маленьком городке Фарель, что в провинции Ольденбург.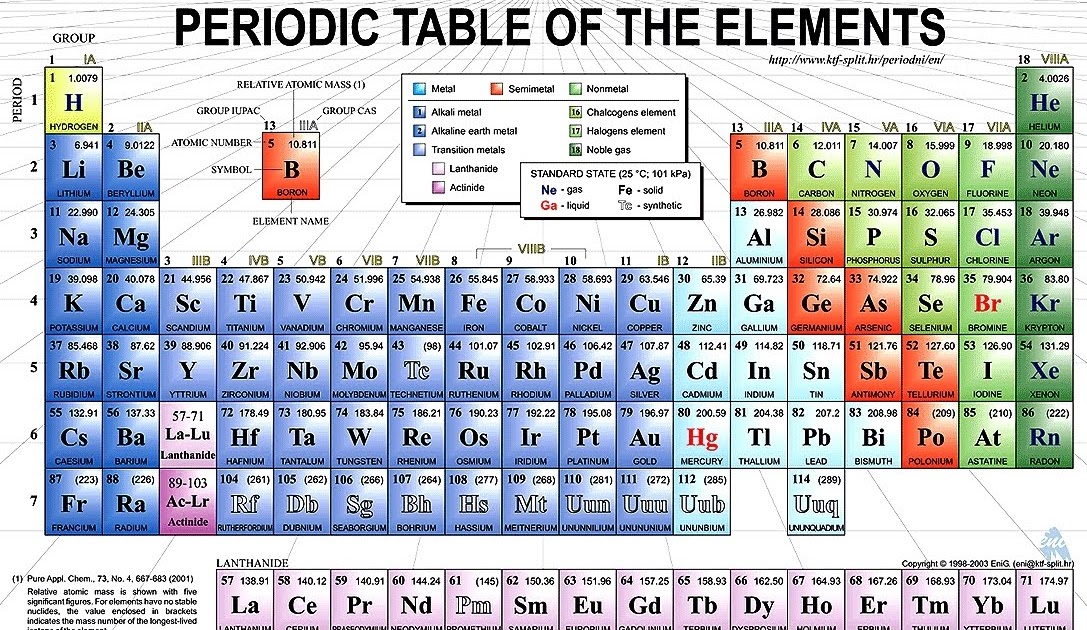 После школы по примеру своего отца Мейер стал изучать медицину и в 1854 году окончил Вюрцбургский университет, получив степень доктора медицины. Затем он изучал естественные науки в Гейдельбергском и Кёнигсбергском университетах, а также в университете Бреслау. В 1858 году он стал доктором наук. С 1866 года он работал профессором университета в Эбесвальде, в 1868–1876 гг. был профессор в университете Карлсруэ, а с 1876 года – в Тюбингенском университете. В 1888 году Мейер стал член-корреспондентом Берлинской академии наук.
После школы по примеру своего отца Мейер стал изучать медицину и в 1854 году окончил Вюрцбургский университет, получив степень доктора медицины. Затем он изучал естественные науки в Гейдельбергском и Кёнигсбергском университетах, а также в университете Бреслау. В 1858 году он стал доктором наук. С 1866 года он работал профессором университета в Эбесвальде, в 1868–1876 гг. был профессор в университете Карлсруэ, а с 1876 года – в Тюбингенском университете. В 1888 году Мейер стал член-корреспондентом Берлинской академии наук.
Работая в Гейдельберге, Мейер поддерживал научные контакты с химиками-органиками Августом Кекуле и Фридрихом Бейльштейном, и это привело Мейера к решению серьезно заняться химией.
В 1859 году Мейер защитил как диссертацию на право чтения лекций историко-критическую работу «Химические теории от Бертолле до Берцелиуса».
В 1860 году Мейер, как и Д.И. Менделеев, принял участие в Международном конгрессе химиков в Карлсруэ, на котором обсуждались определения основных понятий химии. На этом конгрессе, в частности, было решено четко разграничить понятия «атом», «молекула» и «эквивалент». В результате, была в основном решена проблема атомных масс, что открыло дорогу для систематизации химических элементов и создания периодического закона.
На этом конгрессе, в частности, было решено четко разграничить понятия «атом», «молекула» и «эквивалент». В результате, была в основном решена проблема атомных масс, что открыло дорогу для систематизации химических элементов и создания периодического закона.
В «Краткой истории химии» Айзека Азимова сказано: «Мейер опубликовал свою работу в 1870 году. А за год до этого русский химик Дмитрий Иванович Менделеев (1834–1907) установил порядок изменения длины периодов элементов и наглядно продемонстрировал значение своего открытия».
Это не совсем так. На самом деле, Менделеев не был первым человеком, который построил научную классификацию элементов. Юлиус Лотар Мейер на основании данных об атомных весах предложил таблицу, показывающую соотношение атомных весов для нескольких характерных групп элементов, намного раньше – в 1864 году.
В таблице Мейера было 28 элементов, размещенных в шесть столбцов согласно их валентностям.
Специалисты совершенно справедливо считают эту таблицу Мейера сокращенной, ибо в ней ученый отобразил только те 28 элементов, в свойствах которых он был уверен. Всего 28 элементов, а это – меньше половины известных в то время. Расположение остальных элементов оставалось неясным, и что делать с ними, Мейер не знал.
Более того, в 1864 году Мейер предложил располагать элементы по группам, но дальше этого предложения не пошел и понятие «группа элементов» не раскрыл.
ТАБЛИЦА МЕЙЕРА 1870 ГОДА
В 1870 году Мейер опубликовал еще одну работу, называвшуюся «Природа химических элементов как функция их атомного веса» и содержавшую новую таблицу, состоявшую уже из девяти вертикальных столбцов (сходные элементы располагались в горизонтальных рядах, а некоторые ячейки таблицы Мейер оставил незаполненными). В новой таблице отображалось уже 55 элементов, и она была понятна и удобна для отображения в книгах.
В новой таблице отображалось уже 55 элементов, и она была понятна и удобна для отображения в книгах.
В своей работе Мейер систематизировал элементы и изобразил их в виде кривой, где атомные объемы являются периодической функцией от значений атомных масс. Он так характеризовал эту зависимость: «Правильно определив различные атомные веса (из плотностей их соединений в газообразном состоянии или из теплоемкостей), можно в этой схеме расположить все известные до настоящего времени элементы».
ТАБЛИЦА МЕЙЕРА И ТАБЛИЦА МЕНДЕЛЕЕВА: ЗА КЕМ ПРИОРИТЕТ?
Как уже говорилось, Д.И. Менделеев составил и опубликовал свою знаменитую таблицу в феврале-марте 1869 года. Точнее, это был некий отдаленный прототип ныне всем известной периодической системы элементов. Он выстроил символы известных ему 63 элементов в прообраз периодической таблицы элементов вертикальной формы, а потом эту свою таблицу он корректировал и совершенствовал всю жизнь.
Мейер опубликовал свою редакцию периодической таблицы химических элементов в 1864 году, то есть на пять лет раньше Менделеева.
В 1870 году, то есть уже после опубликования Менделеевым периодического закона, появилась статья Мейера, в которой он рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс. По мнению ряда специалистов, таблица Мейера 1870 года была в некоторых отношениях совершеннее первых вариантов таблицы Менделеева. При этом сам Дмитрий Иванович в одной из своих статей заявил, что таблица Мейера представляла собой только простое сопоставление элементов, на что Мейер отвечал, что его таблица «в существенном идентична данной Менделеевым».
Дмитрий Иванович возмущенно писал: «Господин Мейер раньше меня не имел в виду периодического закона, а после меня ничего нового к нему не прибавил».
Более того, согласно Менделееву, Мейер не стал развивать свое открытие и даже не сделал попыток на его основе дать предсказания свойств еще не открытых элементов. Свое мнение по этому вопросу Дмитрий Иванович сформулировал так: «По праву творцом научной идеи должно того считать, кто понял не только философскую, но и практическую сторону дела, сумел так его поставить, что в новой истине все могли убедиться, и она стала всеобщим достоянием. Тогда только идея, как материя, не пропадет».
Тогда только идея, как материя, не пропадет».
Получается, что Мейер был все еще очень далек даже от понимания истинного смысла периодической системы. Менделеев же открывал элементы и предсказывал их свойства, опираясь на пустые клетки в созданной им таблице.
На самом деле, Мейер был очень осторожен в оглашении своих научных суждений. И поначалу он избегал публиковать свои прогнозы свойств еще неоткрытых элементов. И именно отсутствие у Мейера успешных научных прогнозов свойств еще неоткрытых элементов некоторые ученые расценили как намного меньшую научную достоверность его периодической таблицы по сравнению с таблицей Менделеева.
Тем не менее, Мейер уже через несколько месяцев после появления первых сообщений Менделеева об открытом им периодическом законе выступил с претензией на свой приоритет. И многие, особенно в Германии (это и понятно), до сих пор считают именно Мейера первооткрывателем периодической системы.
В свое время вокруг имен Мейера и Менделеева разгорелась весьма острая дискуссия, кто же из них первым сделал великое открытие. И до сих пор в зарубежных изданиях имена Менделеева и Мейера ставят рядом там, где речь идет о периодическом законе и периодической системе химических элементов, причем имя Мейера выдвигают на «полкорпуса вперед».
И до сих пор в зарубежных изданиях имена Менделеева и Мейера ставят рядом там, где речь идет о периодическом законе и периодической системе химических элементов, причем имя Мейера выдвигают на «полкорпуса вперед».
Кстати
Фигура Менделеева всегда была окружена всевозможными мифами. Один из самых распространенных – якобы Менделеев сделал научное обоснование стандарта русской водки в 40 градусов. Связано это с тем, что тема его докторской диссертации звучала так: «Рассуждение о соединении спирта с водою». Но к водке это не имело никакого отношения. Работа была посвящена очень узкой научной проблематике, связанной с теорией растворов.
А в 1882 году Лондонское королевское общество присудило золотые медали совместно Менделееву и Мейеру. Наградам сопутствовала формулировка: «За открытие периодических соотношений атомных весов».
ГЛАВНОЕ – ОТКРЫТИЕ ПЕРИОДИЧЕСКОЙ ЗАВИСИМОСТИ
Дмитрий Иванович Менделеев умер 20 января (2 февраля) 1907 года. Юлиус Лотар Мейер умер намного раньше – в апреле 1895 года.
Юлиус Лотар Мейер умер намного раньше – в апреле 1895 года.
Юлиус Лотар Мейер
Когда Менделеев придумывал свою таблицу, было известно лишь 63 химических элемента. В год смерти ученого был открыт «лютеций», получивший 71-й номер. Сотым элементом стал «фермий», впервые полученный в конце 1952 года. А в 1955 году американские ученые синтезировали элемент № 101, и ему было дано название «менделевий» (Md) – в честь Д.И. Менделеева.
Интересно отметить, что на сегодняшний день официально известно уже 118 химических элементов, из них 94 было обнаружено в природе, а остальные получены искусственно, и это уже исключительно ядерная физика.
Химические элементы делятся на металлы и неметаллы, причем к металлам относятся 85% из них. 99% земной коры по массе составляют лишь восемь химических элементов: кислород, калий, натрий, магний, кальций, железо, алюминий, кремний. Водород и гелий – элементы, преобладающие в космосе. В живых организмах наиболее распространенные элементы – это азот, водород, кислород, углерод.
В живых организмах наиболее распространенные элементы – это азот, водород, кислород, углерод.
Джон Ньюлендс
Как видим, наука шагнула очень далеко вперед. В свое время Менделеев так сформулировал текст предполагаемого им периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Современная формулировка такова: «Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины зарядов ядер их атомов».
Что же касается Мейера, то он в свое время опубликовал кривую изменения атомных объемов элементов. Она действительно отражала одно из свойств периодического закона, и этим Мейер существенно содействовал систематизации элементов. Но все дело в том, что сам Мейер не смог разглядеть общей закономерности природы – периодичности. Менделеев же совершенно правильно предположил, что свойствами элементов управляет периодический закон, и алгоритм этого периодического закона был реализован им в графической форме в виде его периодической таблицы элементов.
Менделеев же совершенно правильно предположил, что свойствами элементов управляет периодический закон, и алгоритм этого периодического закона был реализован им в графической форме в виде его периодической таблицы элементов.
А ВЕДЬ БЫЛ ЕЩЕ И ДЖОН НЬЮЛЕНДС
В данном контексте следует также упомянуть о британском химике Джоне Ньюлендсе (1837–1898). В 1864 году он тоже составил таблицу, в которой расположил все известные тогда элементы в порядке увеличения их атомных весов. Пронумеровав элементы (элементы, имевшие одинаковые веса, имели у него один и тот же номер), Ньюлендс сделал следующий вывод: «Разность в номерах наименьшего члена группы и следующего за ним равна семи; иначе говоря, восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке».
Через год Ньюлендс опубликовал новую таблицу, назвав ее «законом октав», который формулировался следующим образом: «Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
После 1866 года Джон Ньюлендс больше не предпринимал попыток дальнейшей разработки своей систематики, тем не менее, именно его в Великобритании считают тем, кто впервые высказал идею о периодичности изменения свойств элементов. В любом случае, в 1887 году, через пять лет после Менделеева и Мейера, Лондонское королевское общество вручило свою медаль и ему. Награде сопутствовала формулировка: «За открытие периодического закона химических элементов».
Дмитрий Иванович Менделеев на это отреагировал следующей оценкой работы Ньюлендса: «В этих трудах видны некоторые зародыши периодического закона».
ТАК КТО ЖЕ ВСЕ-ТАКИ?
И все же у знаменитого русского естествоиспытателя К.А. Тимирязева мы читаем: «Едва ли не самым выдающимся шагом вперед собственно химии явилась возможность естественной классификации элементов в периодическую систему (Ньюлендс, Лотар Мейер и особенно Менделеев), дозволяющих рассматривать все свойства как функции их атомного веса».
Ключевыми для нас тут являются слова: «особенно Менделеев»…
А вот мнение Лотара Кольдица, известного немецкого химика, издателя учебников по химии и профессора Берлинского университета: «Никто из ученых, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Ньюлендсу и Мейеру. Предсказание еще неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д.И. Менделеева».
Тем не менее, чтобы не путаться во взаимных претензиях, в большинстве химических сообществ западного мира периодическая таблица не носит имени первооткрывателя, а словосочетание «таблица Менделеева» существует только в России.
Фото предоставлены
сайтом Wikipedia.org
Автор: Сергей НЕЧАЕВ
Оказалось, что азот не является исключением из периодического закона Менделеева
Долгие годы азот считался «неудачником» в мире химиков. Элемент никак не хотел на практике проявлять свойств, предсказанных ему периодическим законом таблицы Менделеева. Ученые почти смирились с ненавистным словом «исключение», но в результате упорных и долгих исследований им удалось добиться от азота исполнения предначертанного ему пути.
Элемент никак не хотел на практике проявлять свойств, предсказанных ему периодическим законом таблицы Менделеева. Ученые почти смирились с ненавистным словом «исключение», но в результате упорных и долгих исследований им удалось добиться от азота исполнения предначертанного ему пути.
Елена Ли
Таблица химических элементов, носящая имя великого русского химика Дмитрия Ивановича Менделеева, не просто так называется периодической. В ней различные вещества расположены в порядке возрастания количества протонов в атомных ядрах. Число протонов равно числу электронов. От расположения электронов на внешних электронных оболочках зависят химические свойства — способность атомов одних веществ образовывать связи с атомами других.
Усложнение электронных оболочек напоминает формирование человеческих навыков. Сначала ребенок учится двигать ножками, вскоре начинает ползать, затем ходить и только потом — бегать. Ни один индивид на свете не получил медаль за марафонскую дистанцию, прежде чем впервые коснулся крохотными пятками пола. Конфигурация электронов идет от простого к сложному. Условно, электронная оболочка последующих элементов — это оболочка предыдущего плюс новый электрон. Вопрос лишь в том — куда он попадет.
Конфигурация электронов идет от простого к сложному. Условно, электронная оболочка последующих элементов — это оболочка предыдущего плюс новый электрон. Вопрос лишь в том — куда он попадет.
Как человек не может получить бесконечное число навыков за одну жизнь, так и элементы не могут иметь бесконечное число электронов на одной оболочке. В следующих «жизнях» или периодах таблицы Менделеева все начинается сначала: «ползать, ходить, бегать». Элементы с одинаковым расположением электронов на самых внешних оболочках находятся в гениальной таблице строго друг под другом. Эти столбцы называются группами, тогда как строки — периодами. Элементы в группе проявляют похожие химические свойства. Но в «семье», как говорится, не без азота.
Азот — самый легкий элемент в своей группе, и он даже под высоким давлением не формировал вещества, структурно схожие с теми, которые формировали при экстремальных условиях товарищи по группе: фосфор, мышьяк и сурьма. Выстраивание атомов элементов одной группы в похожие кристаллические решетки при повышенном давлении и температуре замечено в соседний группах, возглавляемых углеродом и кислородом. Азот же до недавнего времени считался в сообществе химических элементов чем-то вроде паршивой овцы.
Выстраивание атомов элементов одной группы в похожие кристаллические решетки при повышенном давлении и температуре замечено в соседний группах, возглавляемых углеродом и кислородом. Азот же до недавнего времени считался в сообществе химических элементов чем-то вроде паршивой овцы.
Из «белой вороны» в черную азот «перекрасили» исследователи из Баварского научно-исследовательского института экспериментальной геохимии и геофизики (BGI) и лаборатории кристаллографии в Университете Байройта. С помощью алмазной наковальни ученые выяснили, каких значений должны достичь температура и давление в веществе, чтобы атомы азота образовали структуру, характерную для черного фосфора и встречающуюся также у сурьмы и мышьяка. В этой многослойной структуре атомы расположены в зигзагообразном порядке. Свойства подобной структурной модификации элементов группы азота напоминают свойства графена — перспективного материала для множества применений в науке и технике.
В работе, опубликованной в 2020 году в Physical Review Letters, исследователи так и назвали наконец-то обнаруженную в эксперименте структурную модификацию — черный азот. С точки зрения применений, черный азот намного «чернее» фосфора — то есть интереснее для ученых. Свойства сжатого азота не одинаковы в различных геометрических направлениях, а ученые очень любят подобные анизотропные штучки.
С точки зрения применений, черный азот намного «чернее» фосфора — то есть интереснее для ученых. Свойства сжатого азота не одинаковы в различных геометрических направлениях, а ученые очень любят подобные анизотропные штучки.
К сожалению, в нормальных условиях черный азот долго не живет. Для существования ему необходимо давление, почти в 1,5 миллиона раз выше атмосферного, и температура выше 4000 градусов по Цельсию. Мощный удар двумя алмазами с противоположных сторон лишь на мгновение смог утащить азот «на темную сторону». Мига хватило, чтобы оправдать элемент перед химическим сообществом. Короткая рентгеновская вспышка просветила сжатый образец, и образование структуры подтвердилось.
Люди пока не могут выжать из таблицы Менделеева весь потенциал и вынудить элементы проявлять все предсказанные теоретически свойства. Однако это не означает, что в таблице куча исключений и парадоксов. По крайней мере, на один теперь точно меньше.
Периодические свойства элементов с примерами :: Учебники по химии
Периодические свойства элементов с примерами
1) Атомный радиус:
Атомный радиус элементов уменьшается при движении слева направо в периодической таблице. Причина в том, что; атомное число элементов увеличивается слева направо за один и тот же период, таким образом, увеличение числа протонов вызывает увеличение притяжения электронов протонами. Наоборот, в одной и той же группе по мере продвижения сверху вниз атомный радиус элементов увеличивается. Поскольку количество оболочек в одной и той же группе увеличивается сверху вниз, притяжение электронов к протонам уменьшается, а радиус атома увеличивается.
Причина в том, что; атомное число элементов увеличивается слева направо за один и тот же период, таким образом, увеличение числа протонов вызывает увеличение притяжения электронов протонами. Наоборот, в одной и той же группе по мере продвижения сверху вниз атомный радиус элементов увеличивается. Поскольку количество оболочек в одной и той же группе увеличивается сверху вниз, притяжение электронов к протонам уменьшается, а радиус атома увеличивается.
Пример: Найдите соотношение между атомными радиусами элементов 3 X, 11 Y и 5 Z.
Сначала найдем расположение элементов в периодической таблице.
3 x: 1S 2 2S 1 2. Период I A Group
11 Y: 1S 2 2S 2 2P 6 3S 1 3. ПЕРИОД А. А. А. А. 6 3S 1 3. ПЕРИОД И ПЕРИЧЕС И ПЕРИЧЕС И ПЕРИЯ И ПЛОВИЯ И.
5 Z:1s 2 2s 2 2p 1 2. период и группа III A.
период и группа III A.
I A III A
период X Z
период Y
атомный радиус увеличивается справа налево;
Y>X>Z
2) Энергия ионизации:
Энергия, необходимая для удаления электрона из атомов или ионов, называется энергией ионизации . Энергия, необходимая для удаления первого валентного электрона, называется энергией первой ионизации, энергия, необходимая для удаления второго валентного электрона, называется энергией второй ионизации и т. д. Следующие реакции показывают этот процесс;
x + IE 1 → x + + E-
x + + IE 2 → X +2 + E-955
x +2 + E-55
x + 2 + E-55
+ 2 + IE 955 + 2 . 3 →X +3 + e-
Увеличение силы притяжения ядра к электронам затрудняет удаление электронов с оболочек. Энергия второй ионизации больше энергии первой ионизации, энергия второй ионизации больше энергии третьей ионизации. Мы можем сказать это;
Энергия второй ионизации больше энергии первой ионизации, энергия второй ионизации больше энергии третьей ионизации. Мы можем сказать это;
IE 1
Когда электроны удаляются из атома, сила притяжения, приходящаяся на электрон, увеличивается, поэтому удаление электрона из атома становится более трудным. Атомы с электронной конфигурацией ns2np6 обладают свойством сферической симметрии, удаление электрона затруднено, а энергия ионизации высока. Более того, атомы, имеющие ns2np6ns1, имеют меньшую энергию ионизации, потому что удаление одного электрона из этих атомов делает их благородными газами и более стабильными. Таким образом, из них легко удалить электрон. Например;
10 Ne: 1s 2 2s 2 2p 6 and
11 Na: 1s 2 2s 2 2p 6 3s 1
IE Ne >IE Na
Зная последовательные энергии ионизации атома, можно найти число валентных электронов атомов. Изучите следующий пример;
Изучите следующий пример;
ИЭ 1 ИЭ 2 ИЭ 3 ИЭ 4 IE 5
176 347 1850 2520 3260
Увеличение второй и третьей энергии ионизации электронов больше, чем у других, поэтому валентные атомы имеют 2 больше, чем у других.
Пример:
NA (GAS) + IE 1 → NA + + E-
NA (GAS) + IE 2 → NA +2 + 2E-
559 → NA +2 + 2E-59559 → NA +2 + 2E-90009Na(твердый) + IE 3 →Na + + e-
Na+(твердый) + IE 4 →Na +2 + e-
Какое из следующих утверждений, относящихся к приведенным выше химическим уравнениям, неверно.
I. E 1 – первая энергия ионизации Na
II. E 3 >E 1
E 3 >E 1
III. E 2 – вторая энергия ионизации Na
IV. E 4 >E 1
В. E 2 =E 1 +E 4
Энергия первой ионизации – это энергия, необходимая для отрыва одного электрона от нейтрального атома в газообразном состоянии. Я верно.
E 3 есть сумма энергий E 1 и энергии сублимации. Таким образом, E 3 >E 1 II верно
Вторая энергия ионизации – это энергия, необходимая для отрыва одного электрона от +1 заряженного иона в газовом состоянии. Таким образом, III неверно.
E 4 – вторая энергия ионизации и E 1 — первая энергия ионизации. Таким образом; E 4 > E 1 IV IS TRUE
NA (GAS) + IE 1 → NA + + E-
NA + (тверд +2 + e-
——————————————
Na(газ) + (E 1 +E 4 )→Na
7 +2
7 +2
(газ)+2e-
Так; E 2 =E 1 +E 4 V верно
Изменения энергии ионизации в периодической таблице;
I A
Поскольку II A и V A обладают свойством сферической симметрии, они имеют большую энергию ионизации, чем III A и VI A. График приведенный ниже показывает связь между энергией ионизации и атомным номером.
График приведенный ниже показывает связь между энергией ионизации и атомным номером.
3) Сродство к электрону:
Если электрон присоединяется к нейтральному атому в газообразном состоянии, выделяется энергия. Мы называем эту энергию « сродство к электрону ». Следующее химическое уравнение показывает этот процесс.
X(газ) + e – → X – (газ) + E
Как правило, сродство к электрону увеличивается при движении слева направо по периоду. Наоборот, сродство к электрону уменьшается в группе сверху вниз.
4) Электроотрицательность:
В химической связи способность атомов притягивать электроны называется электроотрицательностью. Слева направо в периоде электроотрицательность увеличивается, а сверху вниз в группе электроотрицательность уменьшается. Поскольку благородные газы не образуют химических связей, нельзя говорить об их электроотрицательности.
5) Свойство металл-неметалл:
Способность отдавать электрон называется свойством металла, а способность получать электрон называется неметаллическим свойством элемента. При перемещении по периоду слева направо свойства металлов увеличиваются, а свойства неметаллов уменьшаются. В группе металлов сверху вниз свойства металла возрастают. В группах неметаллов сверху вниз неметаллические свойства атомов уменьшаются.
При перемещении по периоду слева направо свойства металлов увеличиваются, а свойства неметаллов уменьшаются. В группе металлов сверху вниз свойства металла возрастают. В группах неметаллов сверху вниз неметаллические свойства атомов уменьшаются.
Пример: Какое из следующих утверждений верно относительно данных элементов в таблице Менделеева ниже.
I. Свойство металла X больше, чем Y, Z и T.
II. Атомный радиус Z больше, чем X, Y и T.
III. Энергия ионизации T больше, чем IE X.
IV. Наиболее электроотрицательным элементом является Y.
Свойства металлов увеличиваются справа налево и сверху вниз. Таким образом, Y является наиболее металлическим элементом. Я ложный.
Атомные радиусы увеличиваются справа налево и сверху вниз. Таким образом, Y имеет большие атомные радиусы. II является ложным.
Энергия ионизации увеличивается слева направо за один и тот же период. Таким образом, IE T > IE X . III верно.
Таким образом, IE T > IE X . III верно.
Электроотрицательность увеличивается слева направо и снизу вверх. Z — самый электроотрицательный элемент.
Сводка периодических свойств представлена на рисунке ниже.
Периодическая Таблица Экзамены и Решения задач
© Copyright www.ChemistryTutorials.org, Воспроизведение в электронной и письменной форме категорически запрещено без письменного разрешения www.ChemistryTutorials.org. Политика конфиденциальности
Изучение физических и химических свойств
Мы знаем, что периодическая таблица состоит из периодов по горизонтали и групп по вертикали. Положение каждого элемента уникально и подходит в соответствии с его свойствами. Эти свойства регулярны и показывают периодичность. Мы используем периодическую таблицу, чтобы помочь нам распознать определенные тенденции физических и химических свойств элементов. Тенденции в периодической таблице обычно таковы: «радиус атома увеличивается» или «радиус атома уменьшается».
Все наши тренды описывают тренд в двух направлениях в периодической таблице: 1) по строке и 2) вверх и вниз по столбцу. В этой статье по химии мы собираемся изучить тенденции в периодической таблице, а также физические и химические свойства элементов и их вариации по группам и периодам.
Тенденции периодической таблицы
Закон Менделеева, согласно которому свойства элемента являются периодической функцией его атомного номера, составляет основу современной периодической таблицы. Эти характеристики связаны с электронной настройкой элементов. Аналогичная тенденция в атрибутах становится очевидной, если мы движемся во времени слева направо или вниз по группе. Периодические свойства — это имя, данное тренду этого свойства. Важные периодические характеристики включают размер атома, металлический или неметаллический состав, потенциал ионизации, сродство к электрону и электроотрицательность.
Периодический закон, который утверждает, что многие свойства химических элементов претерпевают циклические изменения, если они перечислены в порядке возрастания атомного номера, формирует основу для периодических тенденций. Элементы со сравнимыми качествами повторяются через определенные промежутки времени. После расположения элементов по возрастанию атомных номеров натрий, калий и цезий обладают многими общими физическими и химическими характеристиками лития, включая его сильную реакционную способность с водой.
Элементы со сравнимыми качествами повторяются через определенные промежутки времени. После расположения элементов по возрастанию атомных номеров натрий, калий и цезий обладают многими общими физическими и химическими характеристиками лития, включая его сильную реакционную способность с водой.
Также читайте про периодическую таблицу Менделеева здесь.
Periodic Table Trends in Physical Properties
The physical properties of elements include:
- Atomic Radius
- Covalent Radius
- Ionic Radius
- Ionization Energy
- Electron Gain Enthalpy
- Electronegativity
- Electron Affinity
- Valence Electrons
- Валентность
- Металлический характер
- Реакционная способность элементов
- Неметаллический характер
Атомный радиус
- Атомный радиус атома определяется как расстояние между центром его ядра и самой внешней оболочкой, содержащей валентный электрон.

- Прямое измерение радиуса атома невозможно.
- Как правило, атомный радиус атомов уменьшается слева направо по периоду.
- Исключение: радиус кислорода немного больше, чем радиус азота.
- Это связано с тем, что даже если атомный номер увеличивается, электроны добавляются к одному и тому же основному энергетическому уровню, т.е. экранирование электронов остается постоянным. При этом увеличивается количество протонов в ядре, т.е. увеличивается эффективный заряд ядра.
- Благодаря этому увеличивается притяжение между ядром и электронами, что приводит к сокращению атомного радиуса.
- Вместе с группой атомный радиус увеличивается сверху вниз по мере добавления электрона на следующий главный энергетический уровень.
Узнайте больше о положении водорода в периодической таблице здесь.
Ковалентный радиус
- Половина межъядерного расстояния между двумя одинаковыми атомами, связанными одинарной ковалентной связью.

- Образование ковалентных связей включает перекрытие атомных орбиталей и уменьшает ожидаемое межъядерное расстояние.
- Следовательно, ковалентный радиус всегда меньше фактического атомного радиуса.
- Ковалентный радиус увеличивается, когда мы движемся сверху вниз в группе таблицы Менделеева. Это связано с тем, что атомный радиус увеличивается в том же направлении.
- Ковалентный радиус уменьшается при перемещении по таблице Менделеева слева направо. Опять же, это потому, что атомный радиус уменьшается в том же направлении.
Узнайте больше об элементах D-блока здесь.
Ионный радиус
- Определяется как расстояние от центра ядра иона, до которого он оказывает свое влияние на электронное облако иона.
- Ионы образуются, когда атом теряет или приобретает электроны.
- Когда атом теряет электрон, он становится катионом, а когда принимает электрон, становится анионом.
- Ионный радиус увеличивается, когда мы движемся сверху вниз в группе периодической таблицы.
 Это связано с тем, что атомный радиус увеличивается в том же направлении.
Это связано с тем, что атомный радиус увеличивается в том же направлении. - Ионный радиус уменьшается при перемещении по таблице Менделеева слева направо. Опять же, это потому, что атомный радиус уменьшается в том же направлении.
Проверьте разработку периодической таблицы здесь.
Энергия ионизации
- Определяется как минимальное количество энергии, необходимое для удаления наиболее слабо связанного электрона с валентной оболочки изолированного нейтрального газообразного атома в его основном состоянии.
- Энергия ионизации зависит от экранирования или экранирования электронами.
- Электронное экранирование описывается как способность внутренних электронов атома экранировать положительно заряженное ядро от валентных электронов.
- Обычно увеличивается по периоду слева направо из-за увеличения эффективного заряда ядра.
- Энергия ионизации уменьшается вместе с движением группы вниз из-за увеличения размера атома.

- Элементы имеют несколько энергий ионизации: первая энергия ионизации, вторая энергия ионизации, третья энергия ионизации и т. д.
- Первая энергия ионизации — это энергия, необходимая для удаления первого электрона, вторая энергия ионизации — это энергия, необходимая для удаления второго электрона и так далее.
- Для любого элемента вторая энергия ионизации больше первой энергии ионизации, а третья энергия ионизации больше второй энергии ионизации. Это связано с тем, что с каждой последующей ионизацией ядерный заряд ядра увеличивается, что затрудняет удаление электронов.
Узнайте об элементах группы 16 здесь
Энтальпия прироста электронов
- Определяется как изменение энтальпии, сопровождающее процесс, когда дополнительный электрон добавляется к нейтральному газообразному атому для превращения его в анион.
- Энергия, высвобождаемая в процессе, называется сродством к электрону (EA).
- EA увеличивается по периоду слева направо, но EA группы 2, группы 0 и группы 15 равна нулю или положительна.

- EA уменьшается при движении вниз по группе, наиболее высока для хлора.
Кроме того, ознакомьтесь с информацией о различных атомных моделях здесь.
Электроотрицательность
- Определяется как относительная склонность элемента, присутствующего в ковалентно связанной молекуле, притягивать к себе общую пару электронов.
- Это неизмеримая величина.
- Электроотрицательность обычно уменьшается вниз по группе. По мере продвижения вниз в группе радиус атома увеличивается, а сила ядерного притяжения валентного электрона уменьшается, следовательно, электроотрицательность уменьшается.
- Электроотрицательность обычно увеличивается при движении слева направо по периоду. Это связано с тем, что в периоде элементы имеют меньше валентных электронов, когда мы движемся слева направо.
- Исключение: благородным газам присваивается нулевая электроотрицательность, поскольку они обладают полной валентной оболочкой и обычно не притягивают электроны.
 Лантаниды и актиноиды обладают более сложным химическим составом. Они тоже имеют нулевую электроотрицательность.
Лантаниды и актиноиды обладают более сложным химическим составом. Они тоже имеют нулевую электроотрицательность. - Переходные металлы показывают очень мало изменений в электроотрицательности. Следовательно, они имеют постоянную электроотрицательность.
Ознакомьтесь с более важными разделами химии здесь.
Сродство к электрону
- Сродство к электрону определяется как способность атома принимать электрон.
- Сродство к электрону обычно уменьшается вниз по группе по мере увеличения атомного радиуса, что приводит к большему расстоянию между отрицательно заряженным электроном и положительно заряженным ядром. Следовательно, сила притяжения относительно слабее.
- При движении слева направо по периоду атомы становятся меньше. Следовательно, силы притяжения становятся сильнее. Таким образом, электрон приближается к ядру, что приводит к увеличению сродства к электрону слева направо по периоду.
Валентный электрон
Количество валентных электронов увеличивается на один каждый раз, когда вы перемещаете следующий столбец (группу) вправо. Элементы группы 2 содержат два валентных электрона, в то время как элементы группы 1 имеют только один валентный электрон. Группы 13-17 имеют 3,4,5,6 и 7 валентных электронов соответственно. Все благородные газы (группа 18) имеют 8 валентных электронов, за исключением He, у которого их всего 2. электроны для этих элементов.
Элементы группы 2 содержат два валентных электрона, в то время как элементы группы 1 имеют только один валентный электрон. Группы 13-17 имеют 3,4,5,6 и 7 валентных электронов соответственно. Все благородные газы (группа 18) имеют 8 валентных электронов, за исключением He, у которого их всего 2. электроны для этих элементов.
Валентность
Со временем валентность таблицы Менделеева повышается, а затем постепенно снижается. Эта периодическая тенденция реже встречается у более тяжелых элементов (с атомным номером больше 20), в частности, у рядов лантанидов и актиноидов. Лучшее экранирование остовных электронов от остовного заряда ядра является результатом наличия большего количества остовных электронов.
В результате энергия ионизации элементов внутри группы ниже, а их видовая полярность выше. Поскольку основные электроны не влияют на поведение связи, валентность не меняется при движении вниз по группе. С другой стороны, остовные электроны влияют на несвязывающие взаимодействия.
Металлический характер
Легкость, с которой атом может потерять электрон, может быть использована для определения металлической природы элемента. По мере того, как притяжение между валентным электроном и ядром уменьшается, происходит большая потеря поверхностных электронов, увеличивая металлический характер и размер атома.
По мере роста атомного масштаба внешние оболочки становятся более рассредоточенными. По мере увеличения первичного квантового числа средняя электронная плотность удаляется от ядра. Электроны валентной оболочки могут быстро сбрасывать электроны из-за их более низкого сродства к ядру, что придает материалам с ними более металлический вид.
Реакционная способность элементов
Реакционная способность является мерой того, насколько легко элемент будет соединяться с другими элементами с образованием соединений. В то время как некоторые элементы пассивны и требуют затрат энергии, другие будут реагировать быстро и спонтанно.
Из-за способности как притягивать, так и удерживать электроны размер ядра определяет химическую активность элемента. В зависимости от размера ядра, количества электронов и количества оболочек существуют разные модели реактивности. В общем, металлы хотят получить электроны, а неметаллы предпочитают их терять.
В зависимости от размера ядра, количества электронов и количества оболочек существуют разные модели реактивности. В общем, металлы хотят получить электроны, а неметаллы предпочитают их терять.
Подробнее об элементах и соединениях читайте здесь.
Неметаллический характер элементов
Неметаллы сильно притягивают электроны внутри соединения и часто приобретают электроны во время химических процессов. Верхний правый угол периодической таблицы содержит наиболее реакционноспособные неметаллы. Фтор является наиболее реакционноспособным неметаллом, поэтому благородные газы составляют уникальный класс из-за их низкой реакционной способности. Как свободный элемент в природе не существует. Одним из самых опасных веществ, известных человеку, является газообразный фтор, который взрывоопасно реагирует со многими другими элементами и соединениями.
Обратите внимание, что различие между металлическими и неметаллическими символами неоднозначно. Вероятность того, что атом отдаст один или несколько электронов, уменьшается, а тенденция неметаллических элементов принимать электроны возрастает по мере продвижения по периодической таблице.
Периодическая таблица тенденций химических свойств
Электрическое расположение элементов во многом определяет их химические и физические свойства. Движение слева направо по периоду приводит к уменьшению атомного и ионного радиусов. В результате с течением времени энтальпия поглощения электронов имеет тенденцию к уменьшению, тогда как энтальпия ионизации обычно возрастает.
В период крайний левый элемент имеет самую низкую энтальпию ионизации, а крайний правый элемент имеет самую высокую энтальпию электронного поглощения. Две крайние точки имеют самую высокую химическую активность, а средняя — самую низкую. Щелочные металлы в крайнем левом углу чрезвычайно химически активны, потому что они могут потерять электрон, чтобы создать соответствующий катион.
Способность галогенов в крайнем правом положении приобретать дополнительный электрон, что приводит к образованию аниона, объясняет их химическую активность. Галогены являются хорошими окислителями, а щелочные металлы – хорошими восстановителями. Двигаясь по периоду слева направо, металлический характер элемента, который является самым высоким в крайнем левом углу, снижается, в то время как неметаллический характер увеличивается.
Двигаясь по периоду слева направо, металлический характер элемента, который является самым высоким в крайнем левом углу, снижается, в то время как неметаллический характер увеличивается.
Наиболее основными соединениями являются оксиды, которые легко образуются при взаимодействии крайних левых элементов периодической таблицы с кислородом. Самые кислотные элементы находятся в крайнем правом положении оксидов. Окисленные формы центральных компонентов нейтральны или амфотерны. В амфотерных оксидах можно увидеть как кислотные, так и основные свойства. Нейтральные оксиды не обладают ни кислотными, ни основными свойствами.
Подробнее об эмульсиях и суспензиях читайте здесь.
Аномальные свойства элементов второго периода- Элементы второго периода имеют только четыре орбитали (2s и 2p) в валентной оболочке и имеют максимальную ковалентность 4, тогда как другие элементы последующих периодов имеют больше орбиталей в своей валентной оболочке и показывают высшие валентности.
 Кроме того, они имеют небольшой атомный размер, высокую электроотрицательность и большое отношение заряда к радиусу.
Кроме того, они имеют небольшой атомный размер, высокую электроотрицательность и большое отношение заряда к радиусу. - Для этих элементов с увеличением атомного номера уменьшается атомный радиус элементов, увеличивается электроотрицательность и увеличивается энергия ионизации. Следовательно, они проявляют аномальные свойства.
- Поэтому их также называют мостовыми элементами.
- При перемещении по периодической таблице по диагонали элементы второго и третьего периодов обнаруживают определенное сходство. Сходство свойств, существующих между диагонально расположенными элементами, называется «диагональным отношением».
- Это отличается от сходства, которое мы видим в группе.
- Пример: Li-Mg, Be-Al, B-Si.
Итак, это все о тенденциях в периодической таблице. Попрактикуйтесь в том же в нашем бесплатном приложении Testbook. Скачать сейчас!
Часто задаваемые вопросы о тенденциях периодической таблицы В. 1 Каковы тенденции в современной периодической таблице?
1 Каковы тенденции в современной периодической таблице?
Ans.1 Современная периодическая таблица показывает тенденции в атомном радиусе, ковалентном радиусе, ионном радиусе, энергии ионизации, энтальпии электронного усиления, электроотрицательности, сродстве к электрону, валентности и химической активности.
Q.2 Какая тенденция идет вниз по группе в периодической таблице?
Ans.2 По мере продвижения вниз по группе атомный радиус увеличивается сверху вниз, ковалентный радиус увеличивается при движении сверху вниз, ионный радиус увеличивается при движении сверху вниз, Энергия ионизации уменьшается, EA или Электронная энтальпия усиления уменьшается, электроотрицательность уменьшается вниз по группе, и сродство к электрону также уменьшается.
Q.3 Что такое современная периодическая таблица?
Ответ 3 Современная периодическая таблица представляет собой расположение всех известных элементов таким образом, что элементы со схожими характеристиками сгруппированы.



 Это связано с тем, что атомный радиус увеличивается в том же направлении.
Это связано с тем, что атомный радиус увеличивается в том же направлении.

 Лантаниды и актиноиды обладают более сложным химическим составом. Они тоже имеют нулевую электроотрицательность.
Лантаниды и актиноиды обладают более сложным химическим составом. Они тоже имеют нулевую электроотрицательность.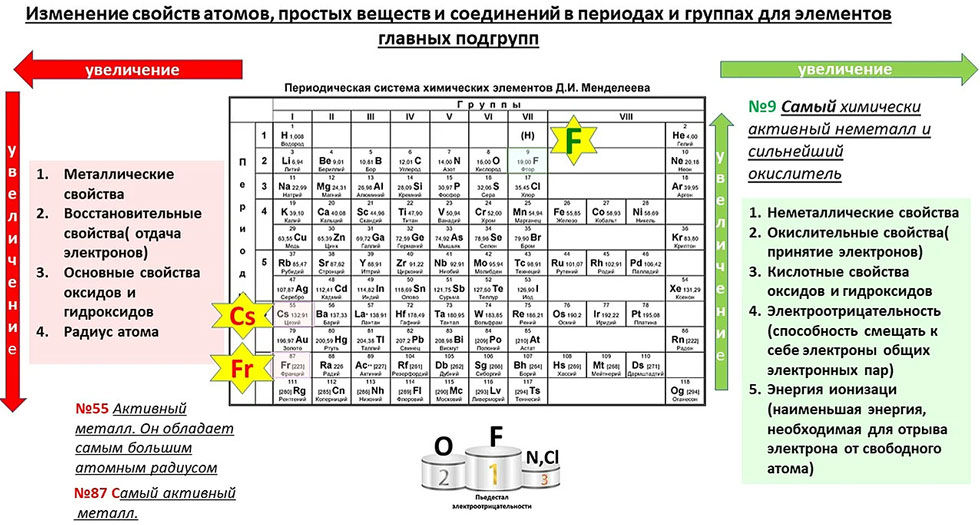 Кроме того, они имеют небольшой атомный размер, высокую электроотрицательность и большое отношение заряда к радиусу.
Кроме того, они имеют небольшой атомный размер, высокую электроотрицательность и большое отношение заряда к радиусу.