Второй закон термодинамики, формулировки, энтропия. Процессы: обратимые, необратимые
Физика->Термодинамика->второй закон термодинамики->
Тестирование онлайн
Второй закон термодинамики
Первый закон термодинамики – один из самых общих и фундаментальных законов природы. Неизвестно ни одного процесса, где он нарушался бы. Если какой-либо процесс запрещен первым законом, то можно быть уверенным, что этот процесс никогда не произойдет.
Но первый закон ничего не объясняет, в каком направлении происходят процессы. Например, при падении камня вся его кинетическая энергия исчезает при ударе о землю, но при этом увеличивается внутренняя энергия самого камня и окружающих его тел, так что закон сохранения энергии не нарушается. Но первому закону термодинамики не противоречил бы и обратный процесс, при котором к лежащему на земле камню перешло бы от окружающих предметов некоторое количество теплоты, в результате чего камень поднялся бы на некоторую высоту. Однако никто никогда не наблюдал таких самопроизвольно подскакивающих камней.
Однако никто никогда не наблюдал таких самопроизвольно подскакивающих камней.
Разбить яйца и сделать яичницу не сложно, воссоздать же сырые яйца из готовой яичницы — невозможно. Запах из открытого флакона духов наполняет комнату — однако обратно во флакон его не соберешь. И причина такой необратимости процессов, происходящих во Вселенной, кроется во втором начале термодинамики, который, при всей его кажущейся простоте, является одним из самых трудных и часто неверно понимаемых законов классической физики.
Опыт показывает, что разные виды энергии не равноценны в отношении способности превращаться в другие виды энергии.
Второе начало термодинамики имеет несколько формулировок. Формулировка Клаузиуса: невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой.
Формулировка Томсона: невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды.
Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды.
Формулировка Больцмана: Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему. Давайте посмотрим, как она работает, на примере воды. В жидком состоянии вода представляет собой довольно неупорядоченную структуру, поскольку молекулы свободно перемещаются друг относительно друга, и пространственная ориентация у них может быть произвольной. Другое дело лед — в нем молекулы воды упорядочены, будучи включенными в кристаллическую решетку. Формулировка второго начала термодинамики Больцмана, условно говоря, гласит, что лед, растаяв и превратившись в воду (процесс, сопровождающийся снижением степени упорядоченности и повышением энтропии) сам по себе никогда из воды не возродится. Энтропия не может уменьшаться в замкнутых системах — то есть, в системах, не получающих внешней энергетической подпитки. Или, холодильник не работает, если он не включен в розетку! Или, частицы, оказавшись в беспорядочном хаотичном состоянии не возвращаются в порядок самопроизвольно.
Или, холодильник не работает, если он не включен в розетку! Или, частицы, оказавшись в беспорядочном хаотичном состоянии не возвращаются в порядок самопроизвольно.
Обратимые и необратимые процессы
Газ находится в сосуде, закрытом поршнем. Выдвигаем поршень. Это необратимый процесс, потому что его нельзя вернуть в обратное состояние через те же промежуточные состояния системы!
Чтобы расширить газ обратимым образом, нужно выдвигать поршень бесконечно медленно. При этом давление газа будет во всем объеме одинаковым.
Необратимыми являются процессы, при которых механическая энергия переходит во внутреннюю при наличие трения. В отсутствие трения все механические процессы протекали бы обратимо.
Таким образом, равновесные обратимые процессы являются абстракцией из-за существующих трения и теплообмена.
Первый закон термодинамики характеризует процессы превращения энергии с количественной стороны, в нем содержится все необходимое для составления энергетического баланса любого процесса: равновесного или неравновесного, обратимого или необратимого. В наиболее общем виде этот закон может быть выражен так: “Любой реальный самопроизвольный процесс является необратимым”. Любые другие формулировки являются частными случаями этой. Первое определение второго закона термодинамики было дано в 1850 г. Рудольфом Клаузиусом: “Невозможен процесс, единственным конечным результатом которого была бы передача теплоты от менее нагретого тела к более нагретому”. В 1851 г. У. Томсон (лорд Кельвин) предложил другую формулировку этого закона (постулат Кельвина): “Невозможно осуществить круговой процесс, единственным результатом которого было бы превращение в работу теплоты отнятой у какоголибо теплового резервуара, без всяких изменений в других телах”. Постулат Кельвина можно представить в следующем виде (по В.
Такую машину называют вечным двигателем второго рода. В отличие от вечного двигателя первого рода, в котором работа производится из ничего, вечный двигатель второго рода производит работу A в точности равную количеству тепловой энергии Q1, заимствованной у источника тепла. Поэтому закон сохранения для вечного двигателя второго рода выполняется. Однако попытки построить такую машину всегда терпели неудачу. Объясняется это тем, что работа за цикл тепловой машины определяется площадью цикла и эта площадь отлична от нуля только в том случае, если процесс расширения рабочего вещества идет по кривой 1a2 (рис.  Покажем, что постулаты Клаузиуса и Кельвина эквивалентны, т. е. если не справедлив один из них, то не верен и другой. Предположим, что не выполняется постулат Клаузиуса. Рассмотрим тепловую машину, рабочее вещество которой за цикл потребляет от горячего источника количество тепла Q1 , отдает холодному источнику количество тепла Q2 и совершает над окружающей средой работу A= Q1– Q2 Так как, по предположению, постулат Клаузиуса не верен, то можно тепло Q2 вернуть горячему источнику без изменений в окружающей среде. В результате состояние холодного источника не изменилось; горячий же источник отдал рабочему веществу количество тепла Q1  С другой стороны, предположим, что не верен постулат Кельвина. Тогда с помощью вечного двигателя второго рода можно получить механическую работу A за счет теплоты Q1 взятой у какого-либо источника, например, холодного источника. Эту механическую работу можно путем трения полностью передать другому телу, например, горячему источнику. В результате теплота Q1, взятая у холодного источника, передана горячему источнику и никаких других изменений в окружающей среде не произошло. А это противоречит принципу Клаузиуса. Таким образом, постулаты Клаузиуса и Кельвина эквивалентны. | ||
Второй закон термодинамики | Определение, формула и энтропия
- Ключевые люди:
- Рудольф Клаузиус
- Похожие темы:
- энтропия законы термодинамики демон Максвелла Цикл Карно равновесие
Просмотреть весь связанный контент →
Популярные вопросы
Что такое второй закон термодинамики?
Второй закон термодинамики утверждает, что тепло не может перемещаться из резервуара с более низкой температурой в резервуар с более высокой температурой в циклическом процессе.
Когда был открыт второй закон термодинамики?
Шотландский физик Уильям Томсон, также известный как лорд Кельвин, и немецкий физик Рудольф Клаузиус разработали второй закон термодинамики в середине 19 века. Томсон и Клаузиус сформулировали закон немного по-разному, но вскоре оказалось, что эти две версии эквивалентны.
Каковы некоторые применения второго закона термодинамики?
Одним из ярких примеров второго закона термодинамики является модель теплового двигателя. Тепловые двигатели включают цикл повышения и понижения температуры, который приводит в движение поршень. Второй закон термодинамики определяет количество работы, которую может произвести изменение температуры в тепловом двигателе.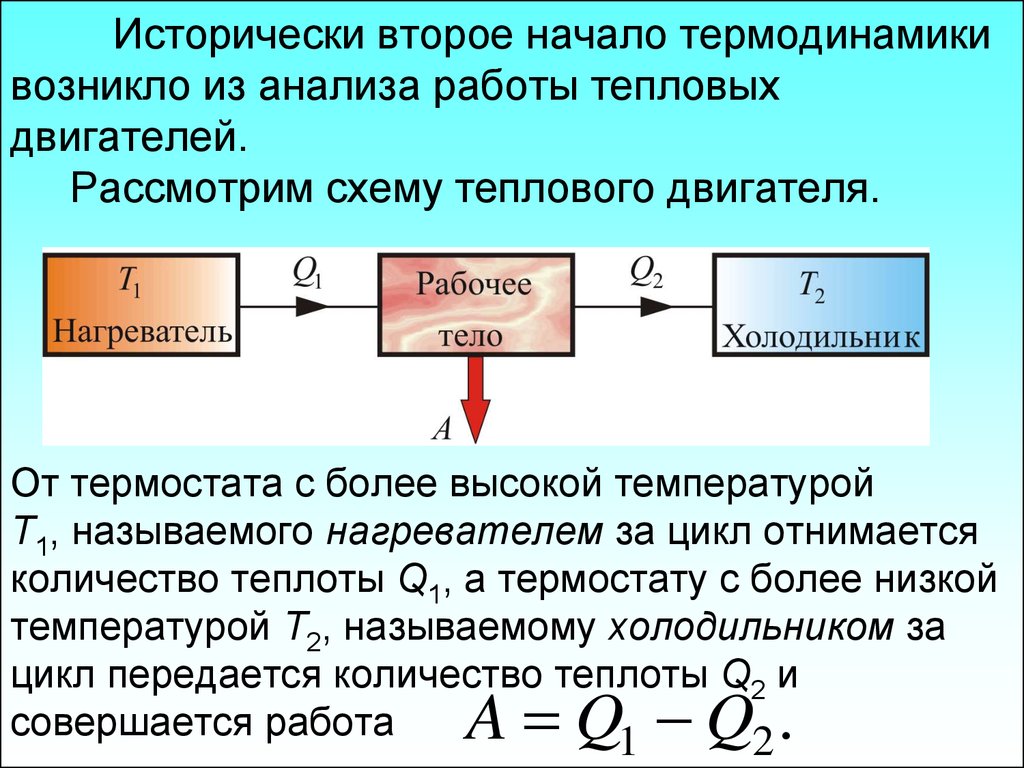 Закон часто применяется к различным типам двигателей.
Закон часто применяется к различным типам двигателей.
Какое отношение второй закон термодинамики имеет к биологии?
Второй закон термодинамики утверждает, что при передаче энергии часть энергии выделяется в виде тепла. Этот неэффективный перенос энергии играет роль во многих биологических системах. В пищевых цепях энергия уходит в виде тепла между трофическими уровнями, при этом потребители получают лишь небольшой процент энергии, хранящейся в их пище. На клеточном уровне энергия, необходимая для поддержания сложной структуры клетки, увеличивает энтропию внешней среды.
Второй закон термодинамики опровергает эволюцию?
Некоторые утверждают, что второй закон термодинамики опровергает эволюцию, потому что закон гласит, что энтропия всегда увеличивается, тогда как эволюция в сложные существа представляет собой уменьшение энтропии. Однако эволюционисты объясняют, что второй закон применим только к системам без внешних источников энергии.
второй закон термодинамики , формулировка, описывающая количество полезной работы, которая может быть выполнена в процессе обмена или передачи тепла.
Второй закон термодинамики можно точно сформулировать в следующих двух формах, первоначально сформулированных в XIX веке шотландским физиком Уильямом Томсоном (лордом Кельвином) и немецким физиком Рудольфом Клаузиусом соответственно:
More From Britannica
термодинамика: второй закон термодинамики
Циклическое превращение, единственным конечным результатом которого является преобразование тепла, извлеченного из источника, который на всем протяжении имеет одинаковую температуру, в работу, невозможно.
Циклическое превращение, единственным конечным результатом которого является передача тепла от тела с данной температурой к телу с более высокой температурой, невозможно.
Эти два утверждения на самом деле эквивалентны, потому что, если бы первое было возможно, то полученную работу можно было бы использовать, например, для производства электричества, которое затем можно было бы разряжать через электрический нагреватель, установленный в теле при более высокой температуре. Чистым эффектом был бы поток тепла от более низкой температуры к более высокой температуре, тем самым нарушая вторую (Клаузиуса) форму второго закона. И наоборот, если бы вторая форма была возможна, то тепло, переданное более высокой температуре, можно было бы использовать для запуска тепловой машины, которая преобразовывала бы часть тепла в работу. Конечным результатом будет преобразование тепла в работу при постоянной температуре — нарушение первой (Кельвина) формы второго закона.
Понятие энтропии было впервые введено в 1850 году Клаузиусом как точный математический способ проверки того, нарушается ли второй закон термодинамики конкретным процессом. Тест начинается с определения, что если количество теплоты Q поступает в тепловой резервуар при постоянной температуре T , то его энтропия S увеличивается на Δ S = Q / T . (На самом деле это уравнение дает термодинамическое определение температуры, которое, как можно показать, идентично обычному термометрическому.) Предположим теперь, что есть два резервуара тепла 9.0069 R 1 и R 2 при температурах T 1 и T 2 . Если количество теплоты Q перетекает из R 1 в R 2 , то чистое изменение энтропии для двух резервуаров равно 0 9 6 7 0 7 0 S 90 069 1 > Т 2 . Таким образом, наблюдение, что тепло никогда не перетекает самопроизвольно из более холодной области в более горячую (форма Клаузиуса второго закона термодинамики), эквивалентно требованию, чтобы чистое изменение энтропии было положительным для спонтанного потока тепла. Если T 1 = T 2 , то резервуары находятся в равновесии и Δ S = 0.
(На самом деле это уравнение дает термодинамическое определение температуры, которое, как можно показать, идентично обычному термометрическому.) Предположим теперь, что есть два резервуара тепла 9.0069 R 1 и R 2 при температурах T 1 и T 2 . Если количество теплоты Q перетекает из R 1 в R 2 , то чистое изменение энтропии для двух резервуаров равно 0 9 6 7 0 7 0 S 90 069 1 > Т 2 . Таким образом, наблюдение, что тепло никогда не перетекает самопроизвольно из более холодной области в более горячую (форма Клаузиуса второго закона термодинамики), эквивалентно требованию, чтобы чистое изменение энтропии было положительным для спонтанного потока тепла. Если T 1 = T 2 , то резервуары находятся в равновесии и Δ S = 0.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Условие Δ S ≥ 0 определяет максимально возможный КПД тепловых двигателей. Предположим, что некоторая система, способная совершать работу циклическим образом (тепловая машина), поглощает теплоту Q 1 из R 1 и отдает теплоту Q 2 в полный цикл. Поскольку в конце цикла система возвращается в исходное состояние, ее энергия не меняется. Тогда по закону сохранения энергии работа, совершаемая за один цикл, равна 9.0069 W = Q 1 − Q 2 , и чистое изменение энтропии для двух резервуаров возможно относительно Q 1 . Однако Q 2 не может быть равно нулю, потому что это сделало бы Δ S отрицательным и, таким образом, нарушило бы второй закон термодинамики. Наименьшее возможное значение Q 2 соответствует условию Δ S = 0, что дает фундаментальное уравнение, ограничивающее КПД всех тепловых двигателей, функцией которых является преобразование тепла в работу (например, генераторов электроэнергии). Фактическая эффективность определяется как доля Q 1 , которая преобразуется в работу ( Вт / Q 1 ).
Фактическая эффективность определяется как доля Q 1 , которая преобразуется в работу ( Вт / Q 1 ).
Максимальная эффективность для данного T 1 и T 2 Таким образом, процесс, для которого Δ S = 0 называется обратимым, потому что бесконечно малого изменения было бы достаточно, чтобы заставить тепловую машину работать в обратном направлении, как холодильник.
Например, свойства материалов ограничивают практическую верхнюю температуру для тепловых электростанций до T 1 ≅ 1200 K. Принимая T 2 за температуру окружающей среды (300 K), максимальный КПД 1 − 300/1200 = 0,75. Таким образом, не менее 25 процентов произведенной тепловой энергии должно отводиться в окружающую среду в виде сбросного тепла, чтобы не нарушался второй закон термодинамики. Из-за различных несовершенств, таких как трение и несовершенная теплоизоляция, реальный КПД электростанций редко превышает примерно 60 процентов. Однако из-за второго закона термодинамики никакая изобретательность или усовершенствование конструкции не могут повысить эффективность выше примерно 75 процентов.
Однако из-за второго закона термодинамики никакая изобретательность или усовершенствование конструкции не могут повысить эффективность выше примерно 75 процентов.
Пример тепловой машины иллюстрирует один из многих способов применения второго закона термодинамики. Один из способов обобщить пример — рассмотреть тепловую машину и ее резервуар с теплом как части изолированной (или замкнутой) системы, т. е. такой, которая не обменивается теплом и не взаимодействует с окружающей средой. Например, тепловой двигатель и резервуар могут быть заключены в жесткий контейнер с изолирующими стенками. В этом случае второй закон термодинамики (в представленной здесь упрощенной форме) говорит о том, что какой бы процесс ни происходил внутри сосуда, его энтропия должна возрастать или оставаться неизменной в пределе обратимого процесса. Точно так же, если Вселенная является изолированной системой, то ее энтропия тоже должна увеличиваться со временем. В самом деле, подразумевается, что Вселенная в конечном итоге должна претерпеть «тепловую смерть», поскольку ее энтропия постепенно увеличивается до максимального значения, и все части приходят в тепловое равновесие при одинаковой температуре. После этого никакие дальнейшие изменения, связанные с преобразованием теплоты в полезную работу, были бы невозможны. В общем случае состояние равновесия изолированной системы и есть состояние максимальной энтропии. (Это эквивалентно альтернативному определению термина энтропия как мера беспорядка системы, так что полностью случайная дисперсия элементов соответствует максимуму энтропии или минимуму информации. См. теория информации: энтропия.)
После этого никакие дальнейшие изменения, связанные с преобразованием теплоты в полезную работу, были бы невозможны. В общем случае состояние равновесия изолированной системы и есть состояние максимальной энтропии. (Это эквивалентно альтернативному определению термина энтропия как мера беспорядка системы, так что полностью случайная дисперсия элементов соответствует максимуму энтропии или минимуму информации. См. теория информации: энтропия.)
Так какая же связь между энтропией и вторым законом? Напомним, что тепло на молекулярном уровне представляет собой случайную кинетическую энергию движения молекул, а столкновения между молекулами обеспечивают микроскопический механизм переноса тепловой энергии из одного места в другое. Поскольку отдельные столкновения не изменяются при изменении направления времени на противоположное, тепло может течь так же хорошо в одном направлении, как и в другом. Таким образом, с точки зрения фундаментальных взаимодействий ничто не препятствует случайному событию, при котором несколько медленно движущихся (холодных) молекул собираются вместе в одном месте и образуют лед, а окружающая вода становится более горячей. Можно ожидать, что такие случайные события время от времени будут происходить в сосуде, содержащем всего несколько молекул воды. Однако одни и те же случайные события никогда не наблюдаются в полном стакане воды не потому, что они невозможны, а потому, что они крайне маловероятны. Это связано с тем, что даже в маленьком стакане воды содержится огромное количество взаимодействующих молекул (около 10 24 ), что делает крайне маловероятным, что в ходе своего беспорядочного теплового движения значительная часть холодных молекул соберется вместе в одном месте. Хотя такое спонтанное нарушение второго закона термодинамики не является невозможным, чрезвычайно терпеливому физику пришлось бы ждать, во много раз превышающее возраст Вселенной, чтобы увидеть, как это произойдет.
Можно ожидать, что такие случайные события время от времени будут происходить в сосуде, содержащем всего несколько молекул воды. Однако одни и те же случайные события никогда не наблюдаются в полном стакане воды не потому, что они невозможны, а потому, что они крайне маловероятны. Это связано с тем, что даже в маленьком стакане воды содержится огромное количество взаимодействующих молекул (около 10 24 ), что делает крайне маловероятным, что в ходе своего беспорядочного теплового движения значительная часть холодных молекул соберется вместе в одном месте. Хотя такое спонтанное нарушение второго закона термодинамики не является невозможным, чрезвычайно терпеливому физику пришлось бы ждать, во много раз превышающее возраст Вселенной, чтобы увидеть, как это произойдет.
Вышеизложенное демонстрирует важный момент: второй закон термодинамики носит статистический характер. На уровне отдельных молекул он не имеет смысла, тогда как закон становится существенно точным для описания большого числа взаимодействующих молекул. Напротив, первый закон термодинамики, выражающий закон сохранения энергии, остается в точности верным даже на молекулярном уровне.
Напротив, первый закон термодинамики, выражающий закон сохранения энергии, остается в точности верным даже на молекулярном уровне.
Пример таяния льда в стакане с горячей водой также демонстрирует другой смысл термина энтропия , как увеличение случайности и параллельная потеря информации. Первоначально общая тепловая энергия распределяется таким образом, что все медленно движущиеся (холодные) молекулы находятся во льду, а все быстродвижущиеся (горячие) молекулы находятся в воде (или водяном паре). После того, как лед растаял и система пришла в тепловое равновесие, тепловая энергия равномерно распределяется по всей системе. Статистический подход дает ценное понимание смысла второго начала термодинамики, но с точки зрения приложений микроскопическая структура материи становится неактуальной. Великая красота и сила классической термодинамики в том, что ее предсказания совершенно не зависят от микроскопической структуры материи.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Второй закон термодинамики | Encyclopedia.com
gale
просмотров обновлено 23 мая 2018
Второй закон термодинамики выражает фундаментальную и ограничивающую характеристику всех физических систем: в любой закрытой системе мера беспорядка или энтропия этой системы должны либо остаться прежними, либо увеличиться. Точно так же в любой изолированной системе количество доступной для работы энергии — свободной энергии — должно либо оставаться неизменным, либо уменьшаться. Процессы, в которых энтропия остается неизменной, обратимы; те, в которых энтропия возрастает, необратимы, т. е. нет реальной возможности восстановить начальное состояние системы. В основном из-за второго закона термодинамики все физические и биологические системы обречены на окончательное разрушение или смерть, даже сама Вселенная. Без постоянного вклада работы, энергии или материала (пищи) каждая система (не обязательно закрытая) движется к равновесию, которое характеризуется максимальной энтропией. Организация, порядок и жизнь требуют, чтобы рассматриваемая система находилась вдали от равновесия, а для этого требуется приток энергии извне — из окружающей ее среды.
Организация, порядок и жизнь требуют, чтобы рассматриваемая система находилась вдали от равновесия, а для этого требуется приток энергии извне — из окружающей ее среды.
Формулировки
Задолго до того, как второй закон был выражен в терминах изменения энтропии замкнутой системы, Сади Карно (1796–1832) сформулировал его в терминах теплоты и работы: Невозможно снова превратить теплоту в работу при заданная температура. Хотя работа может быть преобразована в теплоту при данной температуре, обратное не может быть осуществлено без других изменений. Тепло никогда не будет перемещаться вверх по температурному градиенту само по себе. Только с дополнительной работой теплота может быть передана от тела или системы при данной температуре к телу или системе, находящейся либо при той же температуре, либо при более высокой температуре. Конечно, тепло действительно может переходить от более горячей системы к более холодной без какой-либо работы. Таким образом, другая формулировка Второго закона состоит в том, что теплота не может перейти от данной системы к более горячей без совершения работы. Холодильник должен потреблять энергию, чтобы функционировать. Другими выражениями второго закона являются: невозможно построить совершенную тепловую машину (формулировка лорда Кельвина), и точно так же невозможно построить идеальный холодильник (формулировка Рудольфа Клаузиуса).
Холодильник должен потреблять энергию, чтобы функционировать. Другими выражениями второго закона являются: невозможно построить совершенную тепловую машину (формулировка лорда Кельвина), и точно так же невозможно построить идеальный холодильник (формулировка Рудольфа Клаузиуса).
Наиболее ясная и наиболее применимая формулировка второго закона термодинамики, однако, такова: во время любого процесса энтропия любой изолированной системы должна либо оставаться неизменной, либо возрастать. Но что такое энтропия? Иногда его определяют как меру неготовности энергии системы к работе. Изолированная система в идеальном равновесии имеет максимальную энтропию и, следовательно, не имеет энергии для работы. Однако в настоящее время более привычно определять энтропию, используя статистические механические основы термодинамики в терминах количества микросостояний, доступных системе при данной энергии. Любому заданному макроскопическому состоянию системы (заданному, например, ее температурой, давлением и объемом) соответствует множество различных возможных микроскопических состояний этой системы (расположение и скорости составляющих ее молекул). Чем больше число возможных микросостояний, соответствующих данному макросостоянию, тем больше энтропия системы и тем больше беспорядок в системе. Максимальная энтропия — и, следовательно, максимальный беспорядок — определяется ситуацией, в которой реальное макросостояние системы обладает максимальным числом доступных микросостояний для содержащейся в нем энергии. Это состояние равновесия. Таким образом, действительно важно не абсолютное значение энтропии для изолированной системы, а то, насколько далеко ее энтропия от максимума — насколько далеко система от равновесия. Как уже было сказано, это также указывает на то, сколько в нем имеется свободной энергии (для работы).
Чем больше число возможных микросостояний, соответствующих данному макросостоянию, тем больше энтропия системы и тем больше беспорядок в системе. Максимальная энтропия — и, следовательно, максимальный беспорядок — определяется ситуацией, в которой реальное макросостояние системы обладает максимальным числом доступных микросостояний для содержащейся в нем энергии. Это состояние равновесия. Таким образом, действительно важно не абсолютное значение энтропии для изолированной системы, а то, насколько далеко ее энтропия от максимума — насколько далеко система от равновесия. Как уже было сказано, это также указывает на то, сколько в нем имеется свободной энергии (для работы).
Определение энтропии и максимальной энтропии и, следовательно, применение второго закона термодинамики к гравитирующим системам, таким как скопление звезд, галактика или Вселенная, несколько сложнее, чем для не- гравитационные системы. Это связано с тем, что общая энтропия таких систем должна включать в себя гравитационную энтропию, а также термодинамическую энтропию, а состояние с самой низкой гравитационной энтропией системы реализуется, когда она совершенно однородна — без кластеризации или слипания. Однородная самогравитирующая система, очевидно, далека от равновесия. По мере того, как материя постепенно слипается и слипается, гравитационная энтропия увеличивается, высвобождая свободную энергию в виде тепла и излучения, которую теперь можно использовать для работы. В конце концов ядра некоторых из этих массовых концентраций становятся достаточно горячими для инициации нуклеосинтеза, и высвобождается еще больше свободной энергии. Максимальная гравитационная энтропия достигается, когда вся система становится единой черной дырой. Для этого вся свободная энергия системы должна быть исчерпана.
Однородная самогравитирующая система, очевидно, далека от равновесия. По мере того, как материя постепенно слипается и слипается, гравитационная энтропия увеличивается, высвобождая свободную энергию в виде тепла и излучения, которую теперь можно использовать для работы. В конце концов ядра некоторых из этих массовых концентраций становятся достаточно горячими для инициации нуклеосинтеза, и высвобождается еще больше свободной энергии. Максимальная гравитационная энтропия достигается, когда вся система становится единой черной дырой. Для этого вся свободная энергия системы должна быть исчерпана.
Каково было происхождение начального экстремального гравитационного неравновесия? Возможно, это была инфляционная фаза Вселенной почти сразу после Большого Взрыва, во время которой Вселенная невероятно быстро (экспоненциально) расширялась за очень короткое время; возможно, именно квантово-гравитационные эффекты еще раньше, в эпоху Планка, сделали начальное состояние нашей части Вселенной очень гладким. Как закончится вселенная, какой мы ее знаем? При энтропийной смерти или тепловой смерти. Это произойдет, когда либо Вселенная превратится в нечто вроде одиночной черной дыры, либо когда она расширится так сильно и так быстро, что гравитация перестанет быть эффективной в стягивании оставшихся концентраций реликтовой массы (частиц или черных дыр). В любом случае достигнуто состояние равновесия; энтропия вселенной максимальна, и невозможно найти никакой полезной энергии для работы или для питания.
Как закончится вселенная, какой мы ее знаем? При энтропийной смерти или тепловой смерти. Это произойдет, когда либо Вселенная превратится в нечто вроде одиночной черной дыры, либо когда она расширится так сильно и так быстро, что гравитация перестанет быть эффективной в стягивании оставшихся концентраций реликтовой массы (частиц или черных дыр). В любом случае достигнуто состояние равновесия; энтропия вселенной максимальна, и невозможно найти никакой полезной энергии для работы или для питания.
Иногда люди упоминают, что системы, порождающие или поддерживающие жизнь, не подчиняются второму закону термодинамики, потому что в порядке генерации они снижают энтропию. Но на самом деле они являются прекрасными примерами применения Второго закона. Системой, которую следует рассматривать в данном случае, является не только сам живой организм, не только рассматриваемое сообщество живых организмов, которые представляют собой , а не изолированные системы (они находятся в решающем и постоянном взаимодействии с окружающей их средой), а скорее вся совокупность.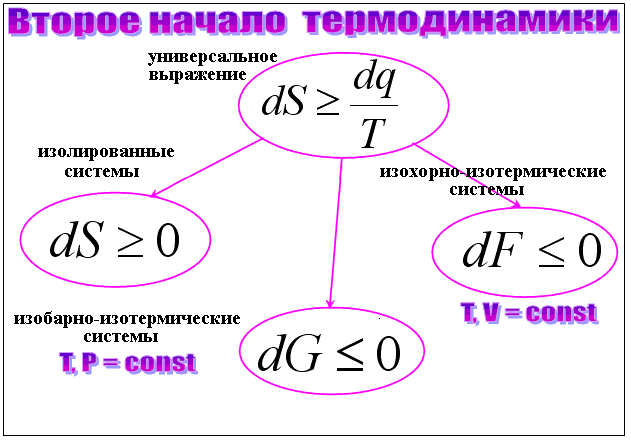 сама экологическая система как изолированная от того, что происходит вне ее. Да, энтропия каждого организма и сообщества живых организмов поддерживается относительно низкой, но только за счет увеличения энтропии их окружения. Энтропия всей изолированной экологической системы возрастает. Если изолировать организмы в ящике с определенным ограниченным количеством пищи и доступной энергии и без взаимодействия с внешним миром, организмы будут жить и размножаться в течение определенного периода времени. Но, в конце концов, доступная энергия будет исчерпана, а запасы еды (как пищи, с которой они начали, так и пищи, которую они впоследствии произвели) иссякнут, и все в ящике достигнет равновесия, которое является смертью.
сама экологическая система как изолированная от того, что происходит вне ее. Да, энтропия каждого организма и сообщества живых организмов поддерживается относительно низкой, но только за счет увеличения энтропии их окружения. Энтропия всей изолированной экологической системы возрастает. Если изолировать организмы в ящике с определенным ограниченным количеством пищи и доступной энергии и без взаимодействия с внешним миром, организмы будут жить и размножаться в течение определенного периода времени. Но, в конце концов, доступная энергия будет исчерпана, а запасы еды (как пищи, с которой они начали, так и пищи, которую они впоследствии произвели) иссякнут, и все в ящике достигнет равновесия, которое является смертью.
Значение для религии
Неизбежные ограничения, накладываемые на физическую и биологическую реальность Вторым законом термодинамики, ставят перед теологией и религией серьезный вызов. Если все конечно, преходяще и обречено на смерть и разрушение, то какой смысл и надежду могут правомерно утверждать теология и религия? Как понимать вечную судьбу, провозглашаемую религиями, и как преодолеть этот, казалось бы, непреодолимый предел? Это эсхатологические вопросы. Есть также вопросы, касающиеся природного зла. Предполагая, что Бог действует через все законы природы, включая Второй закон, для создания и поддержания мира, как можно представить Бога творцом мира, в котором смерть, болезни, страдания и эксплуатация ресурсов не только распространенный, но необходимый? Наконец, согласно религиозным взглядам, за вторым законом термодинамики не может быть последнего слова. «Новые небеса и новая земля», хотя и неразрывно связаны с этим миром, обещают быть лишенными преходящести, страданий, смерти и природного зла, сопровождающих человеческое существование.
Есть также вопросы, касающиеся природного зла. Предполагая, что Бог действует через все законы природы, включая Второй закон, для создания и поддержания мира, как можно представить Бога творцом мира, в котором смерть, болезни, страдания и эксплуатация ресурсов не только распространенный, но необходимый? Наконец, согласно религиозным взглядам, за вторым законом термодинамики не может быть последнего слова. «Новые небеса и новая земля», хотя и неразрывно связаны с этим миром, обещают быть лишенными преходящести, страданий, смерти и природного зла, сопровождающих человеческое существование.
См. также Теория большого взрыва; Смерть; Энтропия; Эсхатология
Библиография
Фейнман, Ричард П.; Лейтон, Роберт Б.; и пески, Мэтью. Фейнмановские лекции по физике, т. 1. чтение, масса.: Эддисон Уэсли, 1963.
Фраучи, Стивен. «энтропия в расширяющейся Вселенной». в энтропии, информации и эволюции: новые взгляды на физическую и биологическую эволюцию, ред.

 Однако оказывается, что далеко не всякое изменение, при котором соблюдается этот закон, может осуществиться на самом деле. Имеются дополнительные условия, которым должно подчиняться явление, чтобы оно могло наступить. Первый закон термодинамики не содержит никаких указаний о возможности протекания процесса в том или ином направлении. Тогда как опыт свидетельствует, что реальные процессы передачи энергии (например, с одного уровня давления или температуры на другой), будучи процессами неравновесными (необратимыми), имеют четко определенную направленность и сопровождаются необратимыми явлениями, т. е. такими изменениями, которые не могут быть устранены противоположными процессами такого же характера. Из опыта известно, что любая форма энергии (работа) – механическая, электромагнитная, световая, химическая и др. – при ее превращениях в конце концов полностью переходит в энергию теплового движения – во внутреннюю энергию тел. Однако обратный процесс полного преобразования теплоты в работу неосуществим: невозможно энергию хаотического движения молекул полностью преобразовать в энергию направленного макроскопического движения.
Однако оказывается, что далеко не всякое изменение, при котором соблюдается этот закон, может осуществиться на самом деле. Имеются дополнительные условия, которым должно подчиняться явление, чтобы оно могло наступить. Первый закон термодинамики не содержит никаких указаний о возможности протекания процесса в том или ином направлении. Тогда как опыт свидетельствует, что реальные процессы передачи энергии (например, с одного уровня давления или температуры на другой), будучи процессами неравновесными (необратимыми), имеют четко определенную направленность и сопровождаются необратимыми явлениями, т. е. такими изменениями, которые не могут быть устранены противоположными процессами такого же характера. Из опыта известно, что любая форма энергии (работа) – механическая, электромагнитная, световая, химическая и др. – при ее превращениях в конце концов полностью переходит в энергию теплового движения – во внутреннюю энергию тел. Однако обратный процесс полного преобразования теплоты в работу неосуществим: невозможно энергию хаотического движения молекул полностью преобразовать в энергию направленного макроскопического движения.


