Тунгстен или вольфрам? – Индикатор
Химия и науки о материалах
20:42, 12 октября 2019
Глава из книги «Наноэлементы»
Сегодня на XIV Всероссийском фестивале науки NAUKA 0+ состоялась презентация книги «Наноэлементы» популяризатора науки, члена правления Российского химического общества, а по совместительству– научного редактора нашего портала Алексея Паевского, изданной Фондом инфраструктурных и образовательных проектов группы Роснано. Публикуем главу этой книги, посвященной 20 самым используемым в нанотехнологиях химическим элементам.
Химический символ: W
Порядковый номер: 74
Год открытия: 1783
Стандартная атомная масса: 183,84(1)
Температура плавления: 3695 К
Температура кипения: 5828 К
_Плотность при стандартных условиях: 19,25 г/cм3 _
Скорость звука в вольфраме: 4620 м/с
Число стабильных изотопов: 4
Кристаллическая решетка: кубическая объемноцентрированная
…Иногда в любительских озвучках зарубежных детективных сериалов доводится слышать любопытные переводческие ляпы. Например, такой (полиция находит вроде бы украденное золото, но выясняется подмена): «Это не золото! Это покрашенный золотой краской металл тунгстен!». Недоумевающие зрители, плохо знающие английский, но хорошо учившие химию в школе, лихорадочно пытаются вспомнить тунгстен в таблице Менделеева – и не могут. В чем же тут дело?
Например, такой (полиция находит вроде бы украденное золото, но выясняется подмена): «Это не золото! Это покрашенный золотой краской металл тунгстен!». Недоумевающие зрители, плохо знающие английский, но хорошо учившие химию в школе, лихорадочно пытаются вспомнить тунгстен в таблице Менделеева – и не могут. В чем же тут дело?
Все дело в истории открытия элемента, который получил порядковый номер 74. Началось все, как это часто бывало в открытии химических элементов, с шведского рудника, на этот раз – близ городка Сетер, лен Даларна в центральной Швеции. Там в 1781 году был обнаружен новый минерал, который поступил на стол к великому химику Карлу Вильгельму Шееле. Шееле сумел выделить из него то, что потом назовут вольфрамовой кислотой (на самом деле – гидрат триоксида вольфрама, WO3·H2O, а не H2WO4). Минерал был тяжелый, а как назвать тяжелый камень? Правильно, «тяжелый камень», что по-шведски означает «тунг стен». Шееле вместе с коллегой Торном Олафом Бергманом предположили, что «тунгстеновая» кислота может содержать новый элемент.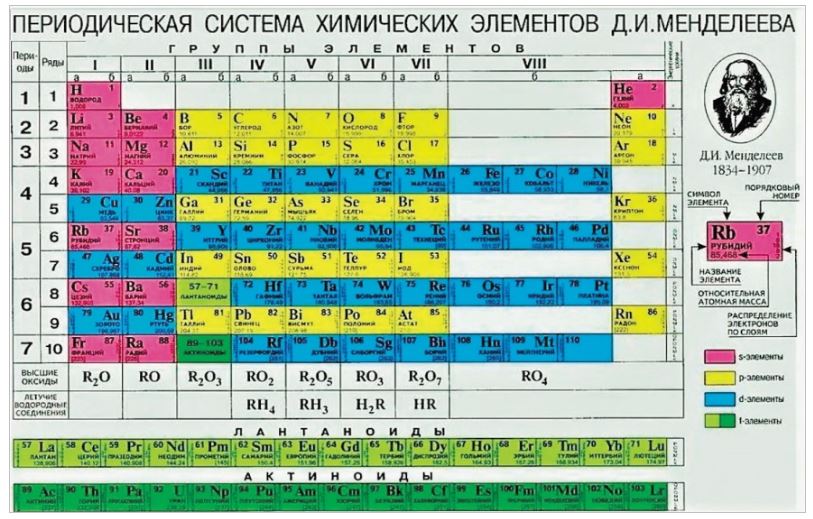 Но не выделили его. Зато это смогли сделать испанские братья Хосе и Фаусто Элюар (Фаусто, к слову, общался с Шееле лично), выделив его из минерала вольфрамита – и назвав соответственно. Название это, означающее «волк» и «пена», предположительно появилось из-за того, что вольфрамит вообще-то считался оловянной рудой, но олова из него выплавлялось намного меньше, чем из обычной руды. Как будто волк пожрал, превратив олово в пену шлаков.
Но не выделили его. Зато это смогли сделать испанские братья Хосе и Фаусто Элюар (Фаусто, к слову, общался с Шееле лично), выделив его из минерала вольфрамита – и назвав соответственно. Название это, означающее «волк» и «пена», предположительно появилось из-за того, что вольфрамит вообще-то считался оловянной рудой, но олова из него выплавлялось намного меньше, чем из обычной руды. Как будто волк пожрал, превратив олово в пену шлаков.
Так в разных языках у одного элемента закрепилось два названия. Но символ остался из языка братьев Элюар (как и приоритет открытия элемента). А в честь Шееле потом назвали минерал тунгстен. Теперь он называется шеелитом.
Вольфрам во многом – уникальный элемент. Во-первых, если не считать углерод, который не является металлом, вольфрам – самый тугоплавкий в чистом виде элемент. Это, с одной стороны, хорошо, а с другой – сильно осложняет жизнь металлургам, которые хотят получить сплавы вольфрама. Ведь при температуре 3422 градуса Цельсия, при которой начинает плавиться вольфрам, большинство металлов уже превращаются в пар. Поэтому чаще всего спекают порошки или делают прессованный и спеченный вольфрамовый порошок, который заливают расплавленным металлом. Впрочем, сейчас в силу входят более современные технологии – селективное лазерное плавление и селективное лазерное спекание, плазменные технологии и так далее.
Поэтому чаще всего спекают порошки или делают прессованный и спеченный вольфрамовый порошок, который заливают расплавленным металлом. Впрочем, сейчас в силу входят более современные технологии – селективное лазерное плавление и селективное лазерное спекание, плазменные технологии и так далее.
Такие усилия не напрасны: вольфрам способен заметно улучшать качество сплавов. Так, например, вольфрамсодержащие стали сохраняют твердость до температуры красного каления, вольфрам входит в состав магнитных сталей (наряду с кобальтом). Вольфрам, поскольку он очень тяжел (в 1,7 раз тяжелее свинца!), входит в состав тяжелых сплавов – это и сердечники бронебойных снарядов, и противовесы (например, в знаменитом авиалайнере Boeing-747 вольфрам заменил обедненный уран). Полет ракет (в том числе баллистических) стабилизируют вольфрамовые гироскопы, вращающиеся со скоростью 180 тысяч оборотов в минуту!
Интересно, что вольфрам используется и в уходящих технологиях, и в технологиях будущего. Вольфрам также хорошо известен всем, кто хоть раз имел дело с лампочкой накаливания – именно из него в ней сделана нить накаливания. Изотоп вольфрама-184 с очень низким сечением захвата тепловых нейтронов сплавляют с ураном-235 и используют в твердофазных ядерных ракетных двигателях.
Изотоп вольфрама-184 с очень низким сечением захвата тепловых нейтронов сплавляют с ураном-235 и используют в твердофазных ядерных ракетных двигателях.
Без карбида вольфрама сложно было бы представить себе целый ряд отраслей в их современном изводе: твердые победитовые сплавы (около 90% карбида вольфрама WC и 10% кобальта в качестве связующего звена) режут дерево и металл, бурят породу. Так что мебельная, металлообрабатывающая и нефтяная промышленность XXI века без вольфрама – никуда. Впрочем, осваивает вольфрам и ювелирная промышленность – поскольку вольфрам тяжелый, прочный и гипоаллергенный. Ну и для подделок золотых слитков, увы, тоже используют вольфрам – куда же без этого.
Впрочем, другие соединения вольфрама тоже находят себе применение, а некоторые из них, как и сам вольфрам, бьют химические рекорды. Самый известный рекордсмен, конечно, – это гексафторид вольфрама. Дело в том, что это вещество – самый тяжелый газ при нормальных условиях. Литр этого газа имеет массу почти 13 граммов! Он в 143 раза тяжелее самого легкого газа – водорода.
Дисульфид вольфрама – это высокотемпературная смазка, триоксид вольфрама применяют в качестве катализатора в процессах селективного каталитического восстановления (СКВ) на тепловых электростанциях. Этот процесс призван снизить выбросы в атмосферу оксидов азота, образующихся при сгорании угля. Дителлурид же вольфрама используется для других целей – он позволяет преобразовывать напрямую тепловую энергию в электрическую благодаря эффекту Зеебека.
А вот вольфраматы, точнее – их монокристаллы нашли себе применение в ядерной физике, физике элементарных частиц, ядерной энергетике и ядерной медицине. Дело в том, что кристаллы вольфраматов свинца, кадмия и кальция – это прекрасные сцинцилляторы для рентгеновского и других типов ионизирующего излучения. Когда сквозь кристалл пролетает высокоэнергетический квант света, возникает вспышка света.
Что же можно сказать о нанотехнологическом применении этого достаточно редкого и тяжелого элемента?
Наночастицы вольфрама проявляют высокую каталитическую активность и могут в перспективе служить заменой благородных металлов в химической промышленности.
Нитевидные кристаллы вольфрама (они же нановискеры, нанонити и нанопроволоки) получены в 2002 году. С тех пор их изучают и пытаются использовать в наноэлектронике, а также в качестве датчиков кислотности (pH – зонды) и газовых датчиков.
Наночастицы оксида вольфрама находит применение в биомедицине – и как антимикробный агент (интересно, что антибактериальная активность наночастиц увеличивается при освещении – и уже сейчас их используют для обеззараживания сточных вод), а кроме того – они служат контрастным агентом при компьютерной томографии. Последнее наряду с тем, что наночастицы эти обладают избирательной токсичностью к раковым клеткам, позволяет их использовать в тераностике рака – одновременной ранней его диагностике и лечении.
Наноструктурированный порошок карбида вольфрама находит применение как катализатор. Правда, его не так-то просто получить, поэтому химики все время ищут новые экзотические способы получения наночастиц такого прочного и тугоплавкого материала. Например – электрический взрыв. А наночастицы карбида вольфрама добавляют в твердые сплавы и увеличивают их прочность.
Например – электрический взрыв. А наночастицы карбида вольфрама добавляют в твердые сплавы и увеличивают их прочность.
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Теги #Книжный клуб #ОАО «Роснано»
свойства и применение. Вольфрам применение
ОПРЕДЕЛЕНИЕ
Вольфрам – семьдесят четвертый элемент Периодической таблицы. Обозначение – W от латинского «wolframium». Расположен в шестом периоде, VIB группе. Относится к металлам. Заряд ядра равен 74.
По распространенности в земной коре вольфрам уступает хрому, но превосходит молибден. Природные соединения вольфрама в большинстве случаев представляют собой вольфраматы – соли вольфрамовой кислоты H 2 WO 4 . Так, важнейшая вольфрамовая руда – вольфрамит – состоит из вольфраматов железа и марганца. Часто встречается также минерал шеелит CaWO 4 .
Вольфрам – тяжелый белый металл (рис. 1) плотностью 19,3 г/см 3 . Его температура плавления (около 3400 o С), выше, чем температура плавления всех других металлов. Вольфрам можно сваривать и вытягивать в тонкие нити.
Рис. 1. Вольфрам. Внешний вид.
Атомная и молекулярная масса вольфрама
ОПРЕДЕЛЕНИЕ
Относительной молекулярная масса вещества (M r) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (A r) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии вольфрам существует в виде одноатомных молекул W, значения его атомной и молекулярной масс совпадают. Они равны 183,84.
Изотопы вольфрама
Известно, что в природе вольфрам может находиться в виде пяти стабильных изотопов 180 W, 182 W, 183 W, 184 W и 186 W.Их массовые числа равны 180, 182, 183, 184 и 186 соответственно. Ядро атома изотопа вольфрама 180 W содержит семьдесят четыре протона и сто шесть нейтронов, а остальные отличаются от него только числом нейтронов.
Ядро атома изотопа вольфрама 180 W содержит семьдесят четыре протона и сто шесть нейтронов, а остальные отличаются от него только числом нейтронов.
Существуют искусственные нестабильные изотопы вольфрама с массовыми числами от 158-ми до 192-х, а также одиннадцать изомерных состояния ядер.
Ионы вольфрама
На внешнем энергетическом уровне атома вольфрама имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5р 6 5d 4 6s 2 .
В результате химического взаимодействия вольфрам отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
W o -2e → W 2+ ;
W o -3e → W 3+ ;
W o -4e → W 4+ ;
W o -5e → W 5+ ;
W o -6e → W 6+ .
Молекула и атом вольфрама
В свободном состоянии вольфрам существует в виде одноатомных молекул W. Приведем некоторые свойства, характеризующие атом и молекулу вольфрама:
Сплавы вольфрама
Большая часть добываемого вольфрама расходуется в металлургии для приготовления специальных сталей и сплавов. Быстрорежущая инструментальная сталь содержит до 20% вольфрама и обладает способностью самозакаливаться. Такая сталь не теряет своей твердости даже при нагревании докрасна.
Быстрорежущая инструментальная сталь содержит до 20% вольфрама и обладает способностью самозакаливаться. Такая сталь не теряет своей твердости даже при нагревании докрасна.
Кроме быстрорежущих широко применяются другие вольфрамовые и хромовольфрамовые стали. Например, сталь, содержащая от 1 до 6% вольфрама и до 2% хрома, применяется для изготовления пил, фрез, штампов.
Как самый тугоплавкий металл вольфрам входит в состав ряда жаропрочных сплавов. В частности, его сплавы с кобальтом и хромом – стеллиты – обладают высокими твердостью, износоустойчивостью, жаростойкостью. Сплавы вольфрама с медью сочетают в себе высокие электрическую проводимость, теплопроводность и износоустойчивость. Они применяются для изготовления рабочих частей рубильников, выключателей, электродов для точечной сварки.
Примеры решения задач
ПРИМЕР 1
Вольфрам (от латинского Wolframium) – химический элемент с относительной атомной массой 183,84. В периодической таблице Менделеева он обозначен символом W, принадлежит к шестой группе и имеет атомный номер 74.
Химически стоек к большинству кислот и царской водке, растворим в перекиси водорода и смеси плавиковой и азотной кислот. Он практически неразрушим и применяется везде, где надо работать с высокими температурами, выполнять сварку и вытягивать металлические нити.
Происхождение названия
Имя Wolframium произошло от известного с XVI века минерала вольфрамит, что в переводе с немецкого звучало как «волчий крем». При выплавке олова из его руд, содержавших вольфрам, между ними происходила реакция с усиленным пенообразованием, поэтично описанная так: «Олово пожирал, как волк пожирает овцу». В XVIII веке шведский химик Шеелер при обработке минерала тунгстена азотной кислотой обнаружил в продуктах реакции неизвестное серое вещество с серебристым отливом. Исходный минерал позже переименовали в шеелит, а новый элемент стал называться вольфрамом. До сих пор у американцев, англичан и французов существует его старинное шведское обозначение «тяжёлый камень».
Месторождения и способы получения
Этот элемент относится к группе очень редких металлов и в природе встречается в виде сложных кислородных соединений с железом, марганцем, кальцием, свинцом, медью и редкоземельными элементами. Эти минералы входят в состав гранитных пород, а концентрация чистого вещества не превышает 2%. Самые большие месторождения обнаружены в Казахстане, Китае, Канаде и США. Добычей занимаются также Боливия, Португалия, Россия, Узбекистан и Южная Корея.
При получении вольфрама сначала обогащают его руду и отделяют ценные компоненты от пустой породы. Метод обогащения – измельчение и флотация с последующей магнитной сепарацией и окислительным обжигом. Готовый концентрат спекают с содой, при этом получается растворимый вольфрамит натрия, или выщелачивают содовым раствором в автоклавах при высоких температурах под давлением, нейтрализуют и осаждают в виде вольфрамата кальция.
Из них уже выделяют очищенные от большинства примесей окиси вольфрама, которые потом при температурах около 700 °C восстанавливают водородом. Так получается наиболее чистый порошкообразный вольфрам. Для придания порошку сплошной волокнистой структуры его прессуют в токе водорода, постепенно увеличивая температуру почти до границ плавления, чтобы металл стал пластичным и ковким.
Так получается наиболее чистый порошкообразный вольфрам. Для придания порошку сплошной волокнистой структуры его прессуют в токе водорода, постепенно увеличивая температуру почти до границ плавления, чтобы металл стал пластичным и ковким.
Физические и химические свойства
Металл имеет объёмно-центрированную кубическую кристаллическую решётку, обладает парамагнитными свойствами и устойчивостью к вакууму. Температура плавления вольфрама составляет 3422 °C, кипения 5555 °C, его плотность равна 19,25 г/см³, твёрдость 488 кг/мм² по Бринеллю. В чистом виде он напоминает платину, а при температурах около 1600 °C вытягивается в тонкую нить. Проявляет высокую коррозионную стойкость, при нормальных условиях не изменяется в воде и на воздухе, а при нагревании до температуры красного каления (около 500 °C) образует шестивалентный оксид.
Вольфрам не взаимодействует с концентрированной соляной и разбавленной серной кислотой. Его поверхность слегка окисляется царской водкой и азотной кислотой.
Он растворяется в перекиси водорода, в смеси фтористоводородной и азотной кислот, в присутствии окислителей вступает в реакцию со щелочами, выделяя большое количество тепла. Легко соединяется с углеродом, образуя высокопрочный карбид, однако, при низких температурах металл быстро окисляется и становится ломким. Наиболее часто используются:
- триоксиды, называемые вольфрамовыми ангидридами;
- соли, образующие полимерные анионы;
- перекисные соединения;
- соединения с серой, галогенами и углеродом.
Области применения
Для металлургии вольфрам – основа тугоплавких материалов. На Всемирной Парижской выставке в 1900 году публике впервые была показана сталь с его добавками. Высокая температура плавления и пластичность сделали металл незаменимым в изготовлении нитей для ламп накаливания и других вакуумных трубок, покрытия транзисторов, используемых в жидкокристаллических дисплеях, а также электродов для аргонной сварки. Большая плотность вольфрама позволила ему стать основой деталей баллистических ракет, бронебойных пуль и снарядов в артиллерии.
Сплавы вольфрама, произведённые методом порошковой металлургии, отличаются твёрдостью и жаропрочностью, кислотостойкостью и устойчивостью к истиранию. Они обязательные компоненты лучших марок высоколегированных сталей, где буквы в названии обозначают состав:
Уникальные свойства позволяют изготавливать лучшие инструменты для хирургии, танковую броню и оболочки снарядов, пластины для бронежилетов, ответственные части авиационной и авиакосмической промышленности, контейнеры для радиоактивных отходов, ёмкости для выращивания кристаллов сапфиров. Карбид вольфрама – основа композитных материалов с гордым названием «победит», его используют для обработки металлов в машиностроении, горнодобывающей промышленности, для бурения скважин. В вакуумных печах нагревательные элементы термопары изготовлены из вольфрамовых сплавов.
Его соединения получили распространение как катализаторы и пигменты в различных производствах химической и лакокрасочной промышленности. Применение вольфрамовых солей дисульфидов в качестве высокотемпературной смазки связано с образованием аморфной плёнки серы, которая покрывает трущиеся металлические поверхности. Монокристаллы других вольфраматов используют для нужд ядерной физики, они детекторы радиоактивных излучений. Среди традиционных ювелирных украшений уверенно расширяют свою нишу изделия из карбида вольфрама. Их полированная поверхность прекрасно отражает свет и называется «серым зеркалом», которое невозможно поцарапать, изогнуть и сломать.
Монокристаллы других вольфраматов используют для нужд ядерной физики, они детекторы радиоактивных излучений. Среди традиционных ювелирных украшений уверенно расширяют свою нишу изделия из карбида вольфрама. Их полированная поверхность прекрасно отражает свет и называется «серым зеркалом», которое невозможно поцарапать, изогнуть и сломать.
Биологическая роль
Вольфрам не имеет большого биологического значения. У некоторых бактерий обнаружены ферменты, его содержащие. Поэтому появились гипотезы, что вольфрам участвовал в возникновении жизни на ранних этапах. Ювелирные украшения из него не вызывают аллергических реакций, а металлическая пыль вольфрама при вдыхании раздражает слизистые органов носоглотки и гортани человека.
Вольфрам выделяется среди металлов не только тугоплавкостью, но и массой. Плотность вольфрама при нормальных условиях составляет 19,25 г/см³, это примерно в 6 раз больше, чем у алюминия. По сравнению с медью вольфрам тяжелее ее в 2 раза. На первый взгляд, большая плотность может показаться недостатком, потому что сделанные из него изделия будут тяжелыми. Но даже эта особенность металла нашла свое применение в технике. Полезные свойства вольфрама, обусловленные высокой плотностью:
Но даже эта особенность металла нашла свое применение в технике. Полезные свойства вольфрама, обусловленные высокой плотностью:
- Возможность концентрировать большую массу в малом объеме.
- Защита от ионизирующего излучения (радиации).
Первое свойство объясняется внутренним строением металла. Ядро атома содержит 74 протона и 110 нейтронов, т. е. 184 частицы. В Периодической системе химических элементов, в которой атомы расположены по возрастанию атомной массы, вольфрам находится на 74 месте. По этой причине вещество, состоящее из тяжелых атомов, будет иметь большую массу. Способность защищать от радиации присуща всем материалам с высокой плотностью. Это обусловлено тем, что ионизирующее излучение, сталкиваясь с любым препятствием, передает ему часть своей энергии. Более плотные вещества имеют высокую концентрацию частиц в единице объема, поэтому ионизирующие лучи претерпевают больше столкновений и, соответственно, теряют больше энергии. Использование металла базируется на вышеуказанных свойствах.
Применение вольфрама
Высокая плотность — огромное преимущество вольфрама среди других металлов.
Вольфрам находит широкое применение в разных областях промышленности.
Использование, основанное на большой массе металла
Значительная плотность делает вольфрам ценным материалом для балансировки. Изготовленные из него балансировочные грузики уменьшают нагрузку, действующую на детали. Таким образом продлевается их эксплуатационный период. Области применения вольфрама:
- Аэрокосмическая сфера. Запчасти из тяжелого металла уравновешивают действующие моменты сил. Поэтому вольфрам используется для изготовления лопастей вертолетов, пропеллеров, рулей направления. По причине того, что материал не обладает магнитными свойствами, он применяется в производстве бортовых электронных систем авиации.
- Автомобильная промышленность. Вольфрам применяется там, где необходимо сосредоточить большую массу в малом объеме пространства, например, в автомобильных двигателях, установленных на тяжелых грузовиках, дорогих внедорожниках, машинах, работающих на дизельном топливе.

- Оптика. Вольфрамовые грузики сложной конфигурации выступают балансирами в микроскопах и других высокоточных оптических инструментах.
- Производство спортинвентаря. Вольфрам используется вместо свинца в спортивном оборудовании, потому что, в отличие от последнего, не наносит вреда здоровью и окружающей среде. Например, материал применяется в производстве клюшек для гольфа.
- В машиностроении. Из вольфрама делают вибромолоты, которыми забивают сваи. В середине каждого прибора находится вращающийся груз. Он преобразовывает энергию вибраций в силу для забивания. Благодаря наличию вольфрама имеется возможность применять вибромолоты для уплотненного грунта значительной толщины.
- Для изготовления высокоточных инструментов.
 В глубоком сверлении применяются прецизионные приборы, держатель которых не должен поддаваться вибрациям. Этому требованию соответствует вольфрам, имеющий к тому же и высокий модуль упругости. Антивибрационные держатели обеспечивают плавную работу, поэтому их используют в расточных и шлифовальных оправках, в стержнях инструментов. На основе вольфрама изготавливают рабочую часть инструмента, так как он обладает повышенной твердостью.
В глубоком сверлении применяются прецизионные приборы, держатель которых не должен поддаваться вибрациям. Этому требованию соответствует вольфрам, имеющий к тому же и высокий модуль упругости. Антивибрационные держатели обеспечивают плавную работу, поэтому их используют в расточных и шлифовальных оправках, в стержнях инструментов. На основе вольфрама изготавливают рабочую часть инструмента, так как он обладает повышенной твердостью.
Использование, основанное на способности защищать от радиации
Коллиматоры из вольфрама в хирургии.
- По этому критерию вольфрамовые сплавы опережают чугун, сталь, свинец и воду, поэтому из металла делают коллиматоры и защитные экраны, которые используются при радиотерапии. Сплавы из вольфрама не подвержены деформации и отличаются высокой надежностью. Применение многолепестковых коллиматоров дает возможность направить излучение на определенный участок пораженной ткани. Во время терапии в первую очередь делают рентгеновские снимки, чтобы локализовать расположение и определить характер опухоли.

- Разработаны специальные кольцевые коллиматоры из вольфрама для радиохирургии, облучение которых направлено на голову и шею. Прибор осуществляет высокоточную фокусировку гамма-излучения. Также вольфрам входит в состав пластин для компьютерных томографов, экранирующих элементов для детекторов и линейных ускорителей, дозиметрического оборудования и приборов неразрушающего контроля, емкостей для радиоактивных веществ. Вольфрам используется в устройствах для бурения. Из него делают экраны для защиты погружающихся инструментов от рентгеновского и гамма-излучении.

Классификация вольфрамовых сплавов
Такие критерии, как повышенная плотность и тугоплавкость вольфрама, дают возможность использовать его во многих отраслях. Однако современным технологиям иногда требуются дополнительные свойства материала, которыми чистый металл не обладает. Например, его электропроводность меньше, чем у меди, а изготовление детали сложной геометрической формы затруднительно из-за хрупкости материала. В таких ситуациях помогают примеси. При этом их количество часто не превышает 10%. После добавления меди, железа, никеля вольфрам, плотность которого остается очень высокой (не меньше 16,5 г/см³), лучше проводит электрический ток и становится пластичным, что дает возможность хорошо его обрабатывать.
ВНЖ, ВНМ, ВД
В зависимости от состава сплавы по-разному маркируются.
- ВНЖ – это сплавы вольфрама, которые содержат никель и железо,
- ВНМ – никель и медь,
- ВД – только медь.
В маркировке после заглавных букв следуют цифры, указывающие на процентное содержание.
Например, ВНМ 3–2 — это вольфрамовый сплав с добавлением 3% никеля и 2% меди, ВНМ 5–3 содержит в примеси 5% никеля и 3% железа, ВД-30 состоит на 30% из меди.
Одним из самых распространенных химических элементов является вольфрам. Он обозначается символом W и имеет атомный номер – 74. Вольфрам относится к группе металлов, имеющих высокую стойкость к изнашиванию и температуру плавления. В периодической системе Менделеева он находится в 6-й группе, обладает схожими свойствами с «соседями» – молибденом, хромом.
Открытие и история
Еще в XVI веке был известен такой минерал, как вольфрамит. Он был интересен тем, что при выплавке олова из руды его пена превращался в шлак и, конечно же, это мешало производству. С тех пор, вольфрамит стали называть “волчья пена” (с нем. Wolf Rahm). Название минерала перешло и на сам металл.
Шведский химик Шееле в 1781 году обрабатывал азотной кислотой металл шеелит. В процессе эксперимента у него получился жёлтый тяжёлый камень – оксид вольфрама (VI). Через два года братья Элюар (испанские химики) получили из саксонского минерала сам вольфрам в чистом виде.
Через два года братья Элюар (испанские химики) получили из саксонского минерала сам вольфрам в чистом виде.
Добывают этот элемент и его руды в Португалии, Боливии, Южной Корее, России, Узбекистане, а наибольшие запасы были найдены в Канаде, США, Казахстане и Китае. В год добывается всего 50 тонн этого элемента, поэтому он дорого стоит. Рассмотрим подробнее, что за металл вольфрам.
Свойства элемента
Как уже было сказано ранее, вольфрам – это один из самых тугоплавких металлов. Он имеет блестящий светло-серый цвет. Его температура плавления 3422°С, а кипения – 5555°C, плотность в чистом виде – 19,25 г/см 3 , а твердость 488 кг/мм². Это один из самых тяжелых металлов, обладающий высокой коррозионной стойкостью. Он практически не растворим в серной, соляной и плавиковой кислотах, но быстро вступает в реакцию с перекисью водорода. Что за металл вольфрам, если он не реагирует с расплавленными щелочами? Вступая в реакцию с гидроксидом натрия и кислородом, он образует два соединения – вольфрамат натрия и обычную воду Н 2 О. Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Интересно, что при повышении температуры вольфрам саморазогревается, тогда процесс происходит намного активнее.
Получение вольфрама
На вопрос о том, к какой группе металлов относится вольфрам, можно ответить, что он входит в категорию редких элементов, как рубидий и молибден. А это, в свою очередь, означает, что для него характерны небольшие масштабы производства. Кроме того, такой металл не получают восстановлением из сырья, сначала он перерабатывается на химические соединения. Как же происходит получение редкого металла?
- Из рудного материала выделяют необходимый элемент и концентрируют его в растворе или осадке.
- Следующим шагом, получают чистое химическое соединение путем очистки.
- Из полученного вещества выделяют чистый редкий металл – вольфрам.
Для обогащения руды используют гравитацию, флотацию, магнитную или электростатическую сепарацию. В результате получают концентрат, который содержит 55-65% ангидрида вольфрама WO 3 . Для получения порошка его восстанавливают при помощи водорода или углерода. Для некоторых изделий, на этом процесс получения элемента заканчивается. Так, вольфрамовый порошок используют для приготовления твердых сплавов.
Для некоторых изделий, на этом процесс получения элемента заканчивается. Так, вольфрамовый порошок используют для приготовления твердых сплавов.
Изготовление штабиков
Мы уже выяснили, что за металл вольфрам, а теперь узнаем, в каком сортаменте он изготавливается. Из порошкового соединения изготавливают компактные слитки – штабики. Для этого используют только порошок, который был восстановлен водородом. Их изготавливают путем прессования и спекания. Получаются довольно прочные, но хрупкие слитки. Иными словами, они плохо поддаются ковке. Для улучшения этого технологического свойства, штабики подвергают высокотемпературной обработке. Из этого изделия изготавливают другой сортамент.
Вольфрамовые прутки
Конечно же, это один из самых распространенных видов продукции из этого металла. Что за вольфрам используется для их изготовления? Это вышеописанные штабики, которые подвергаются ковке на ротационной ковочной машине. Важно отметить, что процесс происходит в нагретом состоянии (1450-1500°С). Полученные прутки применяют в самых различных отраслях промышленности. Например, для изготовления сварочных электродов. Кроме того, вольфрамовые прутки нашли широкое применение в нагревателях. Они работают в печах при температуре до 3000 °С в вакууме, инертном газе или водороде. Прутки также могут быть использованы как катоды электронных и газоразрядных приборов, радиоламп.
Полученные прутки применяют в самых различных отраслях промышленности. Например, для изготовления сварочных электродов. Кроме того, вольфрамовые прутки нашли широкое применение в нагревателях. Они работают в печах при температуре до 3000 °С в вакууме, инертном газе или водороде. Прутки также могут быть использованы как катоды электронных и газоразрядных приборов, радиоламп.
Интересно, что сами по себе электроды являются неплавящимися, и поэтому во время сварки, необходима подача присадочного материала (проволока, прут). При расплавлении со свариваемым материалом он создает сварочную ванну. Данные электроды, как правило, применяются для сварки цветных металлов.
Вольфрам и проволока
Вот еще один вид широко распространённой продукции. Вольфрамовая проволока изготавливается из кованых прутков, рассмотренных нами ранее. Волочение производится с постепенным снижением температуры от 1000°С до 400°С. Затем проводят очистку изделия путем отжига, электролитической полировкой или электролитическим травлением. Поскольку вольфрам – тугоплавкий металл, проволока используется в элементах сопротивления в нагревательных печах при температурах до 3000°С. Из нее изготавливают термоэлектрические преобразователи, а также спирали ламп накаливания, петлевые подогреватели и многое другое.
Поскольку вольфрам – тугоплавкий металл, проволока используется в элементах сопротивления в нагревательных печах при температурах до 3000°С. Из нее изготавливают термоэлектрические преобразователи, а также спирали ламп накаливания, петлевые подогреватели и многое другое.
Соединения вольфрама с углеродом
Карбиды вольфрама считаются очень важными с практической точки зрения. Они применяются для изготовления твердых сплавов. Соединения с углеродом имеют положительный коэффициент электросопротивления и хорошую проводимость металла. Карбиды вольфрама образуются двух видов: WC и W 2 C. Они различаются своим поведениям в кислотах, а также растворимостью в других соединениях с углеродом.
На основе вольфрамовых карбидов изготавливают два типа твердых сплавов: спеченные и литые. Последние получают из порошкообразного соединения и карбида с недостатком С (менее 3%) путем литья. Второй тип изготавливают из монокарбида вольфрама WC и цементирующего металла-связки, которым может выступать никель или кобальт. Спеченные сплавы получают только методом порошковой металлургии. Порошок цементирующего металла и карбид вольфрама смешивают, прессуют и спекают. Такие сплавы обладают высокой прочностью, твёрдостью износоустойчивостью.
Спеченные сплавы получают только методом порошковой металлургии. Порошок цементирующего металла и карбид вольфрама смешивают, прессуют и спекают. Такие сплавы обладают высокой прочностью, твёрдостью износоустойчивостью.
В современной металлургической промышленности их используют для обработки металлов резанием и для изготовления бурового инструмента. Одним из самых распространённых сплавов являются ВК6 и ВК8. Их применяют для изготовления фрез, резцов, сверл и другого режущего инструмента.
Область применения карбидов вольфрама достаточно объёмная. Так, их используют для изготовления:
- бронебойных припасов;
- деталей двигателей, самолетов, космических кораблей и ракет;
- оборудования в атомной промышленности;
- хирургических инструментов.
На Западе особенно широко применяются карбиды вольфрама в ювелирных изделиях, в особенности, для изготовления свадебных колец. Металл смотрится красиво, эстетично, его легко обрабатывать.
Это объясняется тем, что они невероятно износоустойчивы. Чтобы поцарапать такое изделие, придется приложить немало усилий. Даже через несколько лет, кольцо будет выглядеть как новое. Оно не потускнеет, не повредится рельефный узор, да и полированная часть не потеряет своего блеска.
Чтобы поцарапать такое изделие, придется приложить немало усилий. Даже через несколько лет, кольцо будет выглядеть как новое. Оно не потускнеет, не повредится рельефный узор, да и полированная часть не потеряет своего блеска.
Вольфрам и рений
Сплав этих двух элементов довольно широко применяется для изготовления высокотемпературных термопар. Вольфрам – какой металл? Как и рений, это жаропрочный металл, а легирование элементов снижает это свойство. Но что, если взять два практически одинаковых вещества? Тогда температура их плавления снижаться не будет.
Если использовать рений в качестве присадки, будет наблюдаться повышение жаропрочности и пластичности вольфрама. Данный сплав получают методом плавки в порошковой металлургии. Термопары, изготавливаемые из этих материалов, являются жаропрочными и могут измерять температуру больше 2000°С, но только в инертной среде. Конечно же, подобные изделия стоят дорого, ведь в один год добывается всего 40 тонн рения и только 51 тонна вольфрама.
Вольфрам – это химический элемент периодической системы Менделеева, который принадлежит к VI группе. В природе вольфрам встречается в виде смеси из пяти изотопов. В своем обычном виде и при обычных условиях он представляет собой твердый металл серебристо-серого цвета. Он также является самым тугоплавким из всех металлов.
Основные свойства вольфрама
Вольфрам – это металл, обладающий замечательными физическими и химическими свойствами. Практически во всех отраслях современного производства применяется вольфрам. Формула его обычно выражается в виде обозначения оксида металла – WO 3 . Вольфрам считается самым тугоплавким из металлов. Предполагается, что лишь сиборгий может быть еще более тугоплавок. Но точно пока этого утверждать нельзя, так как сиборгий имеет очень малое время существования.
Этот металл имеет особые физические и химические свойства. Вольфрам имеет плотность 19300 кг/м 3 , температура плавления его составляет 3410 °С. По этому параметру он занимает второе место после углерода – графита или алмаза. В природе вольфрам встречается в виде пяти стабильных изотопов. Их массовые числа находятся в интервале от 180 до 186. Вольфрам обладает 6-й валентностью, а в соединениях она может составлять 0, 2, 3, 4 и 5. Металл также имеет достаточно высокий уровень теплопроводности. Для вольфрама этот показатель составляет 163 Вт/(м*град). По этому свойству он превышает даже такие соединения, как сплавы алюминия. Масса вольфрама обусловлена его плотностью, которая равна 19кг/м 3 . Степень окисления вольфрама колеблется от +2 до +6. В высших степенях своего окисления металл имеет кислотные свойства, а в низших – основные.
В природе вольфрам встречается в виде пяти стабильных изотопов. Их массовые числа находятся в интервале от 180 до 186. Вольфрам обладает 6-й валентностью, а в соединениях она может составлять 0, 2, 3, 4 и 5. Металл также имеет достаточно высокий уровень теплопроводности. Для вольфрама этот показатель составляет 163 Вт/(м*град). По этому свойству он превышает даже такие соединения, как сплавы алюминия. Масса вольфрама обусловлена его плотностью, которая равна 19кг/м 3 . Степень окисления вольфрама колеблется от +2 до +6. В высших степенях своего окисления металл имеет кислотные свойства, а в низших – основные.
При этом сплавы низших соединений вольфрама считаются неустойчивыми. Самыми стойкими являются соединения со степенью +6. Они проявляют и наиболее характерные для металла химические свойства. Вольфрам имеет свойство легко образовывать комплексы. Но металлический вольфрам обычно является очень стойким. Он начинает взаимодействовать с кислородом лишь при температуре +400 °С. Кристаллическая решетка вольфрама относится к типу кубических объемноцентрированных.
Взаимодействие с другими химическими веществами
Если вольфрам смешать с сухим фтором, то можно получить соединение под названием “гексафторид”, который плавится уже при температуре 2,5 °С, а закипает при 19,5 °С. Похожее вещество получают при соединении вольфрама с хлором. Но для такой реакции необходима достаточно высокая температура – порядка 600 °С. Однако вещество легко противостоит разрушительному действию воды и практически не подвергается изменениям на холоде. Вольфрам – металл, который без кислорода не производит реакции растворения в щелочах. Однако он легко растворяется в смеси HNO 3 и HF. Самые главные из химических соединений вольфрама – это его трехокись WO 3 , Н 2 WO 4 – вольфрамовая кислота, а также ее производные – соли вольфраматы.
Можно рассмотреть некоторые химические свойства вольфрама с уравнениями реакций. Например, формула WO 3 + 3H 2 = W+3H 2 O. В ней металл вольфрам восстанавливается из оксида, проявляется его свойство взаимодействия с водородом. Это уравнение отражает процесс получения вольфрама из его триоксида. Следующей формулой обозначается такое свойство, как практическая нерастворимость вольфрама в кислотах: W + 2HNO3 + 6HF = WF6 + 2NO + 4h3O. Одним из наиболее примечательных веществ, содержащих вольфрам, считается карбонил. Из него получают плотные и ультратонкие покрытия из чистого вольфрама.
Это уравнение отражает процесс получения вольфрама из его триоксида. Следующей формулой обозначается такое свойство, как практическая нерастворимость вольфрама в кислотах: W + 2HNO3 + 6HF = WF6 + 2NO + 4h3O. Одним из наиболее примечательных веществ, содержащих вольфрам, считается карбонил. Из него получают плотные и ультратонкие покрытия из чистого вольфрама.
История открытия
Вольфрам – металл, получивший свое название из латинского языка. В переводе это слово означает «волчья пена». Такое необычное название появилось из-за поведения металла. Сопровождая добытую оловянную руду, вольфрам мешал выделению олова. Из-за него в процессе выплавки образовывались только шлаки. Об этом металле говорили, что он «поедает олово, как волк ест овцу». Для многих интересно, кто открыл химический элемент вольфрам?
Это научное открытие было сделано одновременно в двух местах разными учеными, независимо друг от друга. В 1781 году химик из Швеции Шееле получил так называемый «тяжелый камень», проводя опыты с азотной кислотой и шеелитом. В 1783 году братья-химики из Испании по фамилии Элюар также сообщил об открытии нового элемента. Точнее, ими был открыт оксид вольфрама, растворявшийся в аммиаке.
В 1783 году братья-химики из Испании по фамилии Элюар также сообщил об открытии нового элемента. Точнее, ими был открыт оксид вольфрама, растворявшийся в аммиаке.
Сплавы с другими металлами
В настоящее время различают однофазные и многофазные вольфрамовые сплавы. Они содержат один или несколько посторонних элементов. Самое известное соединение – это сплав вольфрама и молибдена. Добавление молибдена придает вольфраму прочность при его растяжении. Также к категории однофазных сплавов принадлежат соединения вольфрама с титаном, гафнием, цирконием. Самую большую пластичность вольфраму придает рений. Однако практически применять такой сплав – довольно трудоемкий процесс, так как рений очень тяжело добыть.
Так как вольфрам является одним из самых тугоплавких материалов, то получать вольфрамовые сплавы – непростая задача. Когда этот металл только начинает закипать, другие уже переходят в жидкость или состояние газа. Но современные ученые умеют получать сплавы при помощи процесса электролиза. Сплавы, содержащие вольфрам, никель и кобальт, используются для нанесения защитного слоя на непрочные материалы.
Сплавы, содержащие вольфрам, никель и кобальт, используются для нанесения защитного слоя на непрочные материалы.
В современной металлургической промышленности также получают сплавы, используя вольфрамовый порошок. Для его создания необходимы особенные условия, включая создание вакуумной обстановки. Из-за некоторых особенностей взаимодействия вольфрама с другими элементами металлурги предпочитают создавать сплавы не двухфазной характеристики, а с применением 3, 4 и более составляющих. Эти сплавы особенно прочны, но при четком соблюдении формул. При малейших отклонениях процентных составляющих сплав может получиться хрупким и непригодным к использованию.
Вольфрам – элемент, применяющийся в технике
Из этого металла изготавливают нити накаливания обыкновенных лампочек. А также трубки для рентгеновских аппаратов, составляющие вакуумных печей, которые должны использоваться при крайне высоких температурах. Сталь, в состав которой входит вольфрам, имеет очень высокий уровень прочности. Такие сплавы используются для изготовления инструментов в самых различных областях: для бурения скважин, в медицине, машиностроении.
Такие сплавы используются для изготовления инструментов в самых различных областях: для бурения скважин, в медицине, машиностроении.
Главное преимущество соединения стали и вольфрама – износоустойчивость, маловероятность повреждений. Самый известный в строительстве вольфрамовый сплав носит название «победит». Также этот элемент широко используется в химической промышленности. С его добавлением создают краски, пигменты. Особенно широкое применение в этой сфере получил оксид вольфрама 6. Его применяют для изготовления карбидов и галогенидов вольфрама. Другое название этого вещества – триоксид вольфрама. 6 используется как желтый пигмент в красках для керамики и изделий из стекла.
Что такое тяжелые сплавы?
Все сплавы на основе вольфрама, которые обладают высоким показателем плотности, называют тяжелыми. Их получают только при помощи методов порошковой металлургии. Вольфрам всегда является основой тяжелых сплавов, где его содержание может составлять до 98 %. Кроме этого металла, в тяжелые сплавы добавляется никель, медь и железо. Однако в них могут входить и хром, серебро, кобальт, молибден. Самую большую популярность получили сплавы ВМЖ (вольфрам – никель – железо) и ВНМ (вольфрам – никель – медь). Высокий уровень плотности таких сплавов позволяет им поглощать опасное гамма-излучение. Из них изготавливают маховики колес, электрические контакты, роторы для гироскопов.
Однако в них могут входить и хром, серебро, кобальт, молибден. Самую большую популярность получили сплавы ВМЖ (вольфрам – никель – железо) и ВНМ (вольфрам – никель – медь). Высокий уровень плотности таких сплавов позволяет им поглощать опасное гамма-излучение. Из них изготавливают маховики колес, электрические контакты, роторы для гироскопов.
Карбид вольфрама
Около половины всего вольфрама применяется для изготовления прочных металлов, особенно вольфрамового карбида, который имеет температуру плавления 2770 С. Карбид вольфрама представляет собой химическое соединение, в котором содержится равное количество атомов углерода и вольфрама. Этот сплав имеет особые химические свойства. Вольфрам придает ему такую прочность, что по этому показателю он превосходит сталь в два раза.
Карбид вольфрама широко используется в промышленности. Из него изготавливают режущие предметы, которые должны быть очень устойчивы к высоким температурам и истиранию. Также из этого элемента изготавливают:
- Детали самолетов, двигатели автомобилей.

- Детали для космических кораблей.
- Медицинские хирургические инструменты, которые применяются в сфере полостной хирургии. Такие инструменты дороже обычной медицинской стали, однако они более производительны.
- Ювелирные изделия, особенно обручальные кольца. Такая популярность вольфрама связана с его прочностью, которая для венчающихся символизирует прочность взаимоотношений, а также внешним видом. Характеристики вольфрама в отполированном виде таковы, что он в течение очень длительного времени сохраняет зеркальный, блестящий вид.
- Шарики для шариковых ручек класса люкс.
Победит – сплав вольфрама
Приблизительно во второй половине 1920-х годов во многих странах начали выпускаться сплавы для режущих инструментов, которые получали из карбидов вольфрама и металлического кобальта. В Германии такой сплав назывался видиа, в Штатах – карбола. В Советском Союзе такой сплав получил название «победит». Эти сплавы оказались прекрасными для обработки чугунной продукции. Победит является металлокерамическим сплавом с чрезвычайно высоким уровнем прочности. Он изготавливается в виде пластинок различных форм и размеров.
Победит является металлокерамическим сплавом с чрезвычайно высоким уровнем прочности. Он изготавливается в виде пластинок различных форм и размеров.
Процесс изготовления победита сводится к следующему: берется порошок карбида вольфрама, мелкий порошок никеля или кобальта, и все перемешивается и прессуется в специальных формах. Спрессованные таким образом пластины подвергаются дальнейшей температурной обработке. Это дает очень твердый сплав. Эти пластины используются не только для резки чугуна, но и для изготовления бурильных инструментов. Пластинки из победита напаиваются на бурильное оборудование при помощи меди.
Распространенность вольфрама в природе
Этот металл очень мало распространен в окружающей среде. После всех элементов он занимает 57-е место и содержится в виде кларка вольфрама. Также металл образует минералы – шеелит и вольфрамит. Вольфрам мигрирует в подземные воды либо в виде собственного иона, либо в виде всевозможных соединений. Но его наибольшая концентрация в подземных водах ничтожно мала. Она составляет сотые доли мг/л и практически не меняет их химические свойства. Вольфрам также может попадать в природные водоемы из стоков заводов и фабрик.
Она составляет сотые доли мг/л и практически не меняет их химические свойства. Вольфрам также может попадать в природные водоемы из стоков заводов и фабрик.
Влияние на человеческий организм
Вольфрам практически не поступает в организм с водой или пищей. Может существовать опасность вдыхания вольфрамовых частиц вместе с воздухом на производстве. Однако, несмотря на принадлежность к категории тяжелых металлов, вольфрам не токсичен. Отравления вольфрамом случаются лишь у тех, кто связан с вольфрамовым производством. При этом степень влияния металла на организм бывает разной. Например, вольфрамовый порошок, карбид вольфрама и такое вещество, как ангидрит вольфрамовой кислоты, могут вызывать поражение легких. Его главные симптомы – общее недомогание, лихорадка. Более сильные симптомы возникают при отравлении сплавами вольфрама. Это происходит при вдыхании пыли сплавов и приводит к бронхитам, пневмосклерозу.
Металлический вольфрам, попадая внутрь человеческого организма, не всасывается в кишечнике и постепенно выводится. Большую опасность могут представлять вольфрамовые соединения, относящиеся к растворимым. Они откладываются в селезенке, костях и коже. При длительном воздействии вольфрамовых соединений могут возникать такие симптомы, как ломкость ногтей, шелушение кожи, различного рода дерматиты.
Большую опасность могут представлять вольфрамовые соединения, относящиеся к растворимым. Они откладываются в селезенке, костях и коже. При длительном воздействии вольфрамовых соединений могут возникать такие симптомы, как ломкость ногтей, шелушение кожи, различного рода дерматиты.
Запасы вольфрама в различных странах
Самые большие ресурсы вольфрама находятся в России, Канаде и Китае. По прогнозам ученых, на отечественных территориях располагается около 943 тысяч тонн этого металла. Если верить этим оценкам, то подавляющая часть запасов расположена в Южной Сибири и на Дальнем Востоке. Очень незначительной является доля разведанных ресурсов – она составляет всего лишь порядка 7 %.
По количеству разведанных залежей вольфрама Россия уступает лишь Китаю. Большая их часть расположена в районах Кабардино-Балкарии и Бурятии. Но в этих месторождениях добывается не чистый вольфрам, а его руды, содержащие также молибден, золото, висмут, теллур, скандий и другие вещества. Две трети получаемых объемов вольфрама из разведанных источников заключены в труднообогатимых рудах, где главным вольфрамосодержащим минералом является шеелит. На долю легкообогатимых руд приходится всего лишь треть всей добычи. Характеристики вольфрама, добываемого на территории России, ниже, чем за рубежом. Руды содержат большой процент триоксида вольфрама. В России очень мало россыпных месторождений металла. Вольфрамовые пески также являются низкокачественными, с большим количеством оксидов.
Две трети получаемых объемов вольфрама из разведанных источников заключены в труднообогатимых рудах, где главным вольфрамосодержащим минералом является шеелит. На долю легкообогатимых руд приходится всего лишь треть всей добычи. Характеристики вольфрама, добываемого на территории России, ниже, чем за рубежом. Руды содержат большой процент триоксида вольфрама. В России очень мало россыпных месторождений металла. Вольфрамовые пески также являются низкокачественными, с большим количеством оксидов.
Вольфрам в экономике
Глобальное производство вольфрама начало свой рост примерно с 2009 года, когда стала восстанавливаться азиатская промышленность. Крупнейшим производителем вольфрама остается Китай. Например, в 2013 году на долю производства этой страны приходился 81 % от мирового предложения. Около 12 % спроса на вольфрам связано с производством осветительных приборов. По прогнозам экспертов, использование вольфрама в этой сфере будет сокращаться на фоне применения светодиодных и люминесцентных ламп как в бытовых условиях, так и на производстве.
Считается, что будет расти спрос на вольфрам в сфере производства электронной техники. Высокая износостойкость вольфрама и его способность выдерживать электричество делают этот металл наиболее подходящим для производства регуляторов напряжения. Однако по объему этот спрос пока остается довольно незначительным, и считается, что к 2018 году он вырастет лишь на 2 %. Однако согласно прогнозам ученых, в ближайшее время должен произойти рост спроса на цементированный карбид. Это связано с ростом автомобильного производства в США, Китае, Европе, а также увеличением горнодобывающей промышленности. Считается, что к 2018 году спрос на вольфрам увеличится на 3,6 %.
Все о Вольфрам (W)
обро пожаловать на страницу с описанием моего элемента. (вольфрам).
На этой странице я предоставлю исчерпывающие данные для Вольфрам (W). Я надеюсь, вам это пригодится.
Вольфрам (Обзор)
Имя Происхождение
Шведский: вольфрам (тяжелый камень): символ от немецкого названия вольфрам.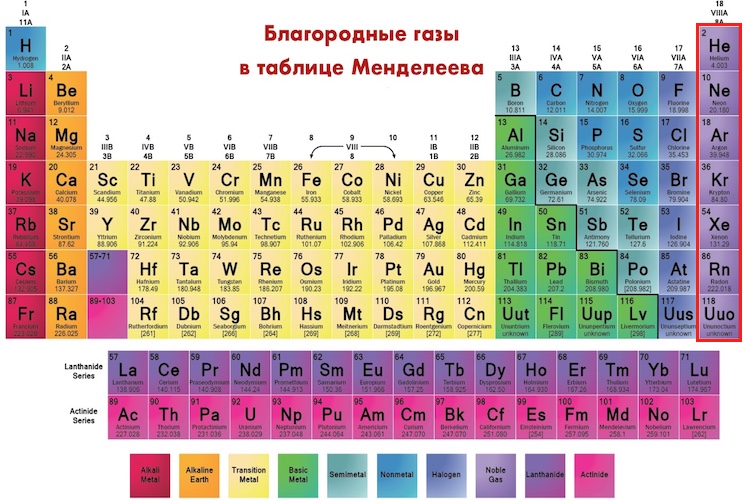
Символ
W
Описание
Твердый металл от серого стального до белого. Самая высокая температура плавления из всех металлов.
Открытие
Обнаружил:
Fausto and Juan José de Elhuyar
Год:
1783
Расположение:
Испания
Источники
Встречается в минералах шеелит (CaWO4) и вольфрамит [(Fe, Mn) WO4].
Использует
Изготавливается из нитей для электронных ламп и электрических ламп. Также как точки контакта в автомобилях. В сочетании с кальцием или магнием образует люминофор. Карбид вольфрама чрезвычайно твердый и используется для изготовления режущих инструментов и абразивов.
Состояние при 20 ° C
Твёрдое тело
Группа
Название группы:
Переходный металл
Группа в периодической таблице:
6
Период в таблице Менделеева:
6
Зарядовое число
74
Узнать больше о Зарядовое число.
Атомная масса
183,84
Узнать больше о Атомная масса.
Стабильный Изотопы
W180: .12% W182: 36.5% W183: 14.31% W184: 30.64% W186: 28.43%
Узнать больше о Стабильный Изотопы.
Радиоактивный Изотопы
W178-179, W181, W185, W187-188
Узнать больше о Радиоактивный Изотопы.
Период полураспада
Стабильный
Узнать больше о Период полураспада.
Атомная структура
Кристаллическая структура
Кубический: по центру тела
Узнать больше о Кристаллическая структура.
Электронная оболочка
2,8,18,32,12,2
Узнать больше о Электронная оболочка.
Электронная конфигурация
1s2 2s2 2p6 3s2 3p6 4 s2 3 d10 4 p6 5 s2 4 d10 5 p6 6 s2 5 d4 4 f14
Узнать больше о Электронная конфигурация.
Сокращенная конфигурация
[Xe] 4f14 5d4 6s2
Узнать больше о Сокращенная конфигурация.
Валентный электрон
2,3,4,5,6
Узнать больше о Валентный электрон.
Размер атома
Радиус атома
2.02 Å
Узнать больше о Радиус атома.
Ковалентный радиус
1.30 Å
Узнать больше о Ковалентный радиус.
Ионный радиус
.60 (+6) Å
Узнать больше о Ионный радиус.
Молярный объём
09.53 cm³/mol
Узнать больше о Молярный объём.
Химические свойства
Электроотрицательность
2,36
Узнать больше о Электроотрицательность.
Энергия сродства к электрону
78.6 kilojoules per mole
Узнать больше о Энергия сродства к электрону. -1
-1
Узнать больше о Тепловое расширение.
Тепловые свойства
Другие физические свойства, связанные с нагревом:
Температура плавления
3410°C ±20°C
Узнать больше о Температура плавления.
Точка кипения
5660°C
Узнать больше о Точка кипения.
Теплоёмкость
0.13 J/gK
Узнать больше о Теплоёмкость.
Удельная теплота плавления
35.40 kJ/mol
Узнать больше о Удельная теплота плавления.
Удельная теплота парообразования и конденсации
824.0 kJ/mol
Узнать больше о Удельная теплота парообразования и конденсации.
Хочу узнать больше подробности и данные о других элементах?.
видео
Вам сложно понять основы атомных элементов? Это видео проведет вас через:
- Что такое элемент
- Что такое вещество
- Как выглядят элементы
- Как небольшое количество атомов может соединяться и образовывать совершенно разные вещества
Цветная периодическая таблица
Нужна редактируемая таблица Менделеева для редактирования? Может быть, добавьте свой школьный логотип, рабочую команду или что-нибудь еще, чтобы ваша бумага выглядела круто?
Наряду с базовой информацией об элементе Вольфрам (W), он также содержит информацию с цветовой кодировкой о: состоянии (газ, жидкость или твердое вещество при комнатной температуре), деталях групп / серий и многом другом …
Периодическая таблица скачать.
Цитата
Если вам нужно включить факт или информацию в задание или эссе, вы также должны указать, где и как вы нашли эту информацию.
Это повышает доверие к вашей статье и иногда требуется в высших учебных заведениях.
Чтобы упростить себе жизнь (и цитирование), просто скопируйте и вставьте приведенную ниже информацию в свое задание или эссе:
Luz, Gelson. Все о Вольфрам (W). Материалы Блог. Gelson Luz.com. дд мммм. гггг. URL
Теперь замените дд, мм и гггг на день, месяц и год, когда вы просматриваете эту страницу. Также замените URL-адрес фактическим URL-адресом этой страницы. Этот формат цитирования основан на MLA
Не нашли то, что искали?
Введите что угодно и войдитеВольфрам, свойства атома, химические и физические свойства
Вольфрам, свойства атома, химические и физические свойства.
W 74 Вольфрам
183,84(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2
Вольфрам — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 74. Расположен в 6-й группе (по старой классификации — побочной подгруппе шестой группы), шестом периоде периодической системы.
И. Менделеева с атомным номером 74. Расположен в 6-й группе (по старой классификации — побочной подгруппе шестой группы), шестом периоде периодической системы.
Атом и молекула вольфрама. Формула вольфрама. Строение вольфрама
Изотопы и модификации вольфрама
Свойства вольфрама (таблица): температура, плотность, давление и пр.
Физические свойства вольфрама
Химические свойства вольфрама. Взаимодействие вольфрама. Реакции с вольфрамом
Получение вольфрама
Применение вольфрама
Таблица химических элементов Д.И. Менделеева
Атом и молекула вольфрама. Формула вольфрама. Строение вольфрама:
Вольфрам (лат. Wolframium, от нем. Wolf Rahm – «волчья пена») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением W и атомным номером 74. Расположен в 6-й группе (по старой классификации – побочной подгруппе шестой группы), шестом периоде периодической системы.
Вольфрам – металл. Относится к переходным металлам. Относится группе тяжёлых, редких, тугоплавких, цветных металлов.
Вольфрам — самый тугоплавкий из металлов.
Вольфрам обозначается символом W.
Как простое вещество вольфрам при нормальных условиях представляет собой твёрдый, блестящий, серебристо-серый металл.
Молекула вольфрама одноатомна.
Химическая формула вольфрама W.
Электронная конфигурация атома вольфрама 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2. Потенциал ионизации (первый электрон) атома вольфрама равен 758,76 кДж/моль (7,86403(10) эВ).
Потенциал ионизации (первый электрон) атома вольфрама равен 758,76 кДж/моль (7,86403(10) эВ).
Строение атома вольфрама. Атом вольфрама состоит из положительно заряженного ядра (+74), вокруг которого по шести оболочкам движутся 74 электрона. При этом 72 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку вольфрам расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлена s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома вольфрама на 5d-орбитали находятся четыре неспаренных электрона. На внешнем энергетическом уровне атома вольфрама – на s-орбитали находятся два спаренных электрона. В свою очередь ядро атома вольфрама состоит из 74 протонов и 110 нейтронов. Вольфрам относится к элементам d-семейства.
Вольфрам относится к элементам d-семейства.
Радиус атома вольфрама (вычисленный) составляет 193 пм.
Атомная масса атома вольфрама составляет 183,84(1) а. е. м.
При стандартных условиях вольфрам химически стоек.
Вольфрам, свойства атома, химические и физические свойства
Изотопы и модификации вольфрама:
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, редкий, тугоплавкий, цветной металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г. (назван), Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. (назван), Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой, – β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм, W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,76(1) кДж/моль (0,81626(8) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,55 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно [1] и [3] составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно [1] и [3] составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно [3] и [4] составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно [4] составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно [3] и [4] составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно [4] составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно [3] и [4] составляет 824 кДж/моль и 769 кДж/моль соответственно.
Физические свойства вольфрама:
Химические свойства вольфрама.
 Взаимодействие вольфрама. Реакции с вольфрамом:
Взаимодействие вольфрама. Реакции с вольфрамом:
Получение вольфрама:
Применение вольфрама:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Tungsten
- https://de.wikipedia.org/wiki/Wolfram
- https://ru.wikipedia.org/wiki/Вольфрам
- http://chemister.
 ru/Database/properties.php?dbid=1&id=284
ru/Database/properties.php?dbid=1&id=284 - https://chemicalstudy.ru/volfram-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
вольфрам атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле вольфрама вольфрам
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 536
Презентация по теме Вольфрам W химический элемент периодической таблицы Д
Презентация по теме Вольфрам(W)химический элемент периодической таблицы Д. И. Менделеева
И. Менделеева
Вольфрам История происхождения названия Нахождение в природе Месторождения Получение Физические свойства Химические свойства
Вольфрам • Вольфра м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium), твёрдый серый переходный металл. Главное применение — как основа тугоплавких материалов в металлургии. Крайне тугоплавок, при стандартных условиях химически стоек.
История и происхождение названия • Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или «Wolf Rahm» понемецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков ( «пожирает олово как волк овцу» ). • В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень» ). • В 1781 знаменитый шведский химик Шееле , обрабатывая азотной кислотой минерал шеелит, получил желтый «тяжелый камень» . В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
В 1783 испанские химики братья Элюар сообщили о получении из саксонского минерала вольфрамита жёлтой окиси нового металла, растворимой в аммиаке. При этом один из братьев, Фаусто, был в Швеции в 1781 и общался с Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете.
Нахождение в природе • Кларк вольфрама земной коры составляет (по Виноградову) 1, 3 г/т(0. 0013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0, 1, основных — 0, 7, средних — 1, 2, кислых — 1, 9. • Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO 3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца n. Fe. WO 4 * m. Mn. WO 4 — соответственно, ферберит и гюбнерит) и шеелит(вольфрамат кальция Ca. WO 4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1 -2 %.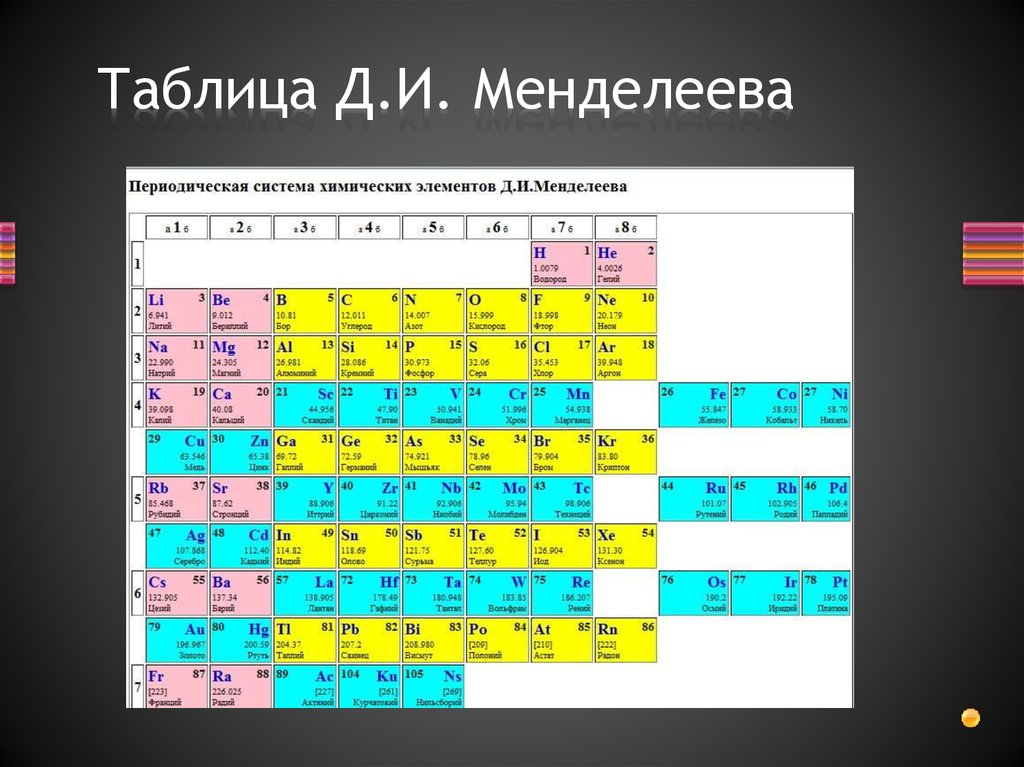
Месторождения • Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 18 -20 тысяч тонн в год, в том числе в Китае 10, России 3, 5; Казахстане 0, 7, Австрии 0, 5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания. Также есть месторождения вольфрама в Армении и других странах.
Получение • Процесс получения вольфрама проходит через подстадию выделения триоксида WO 3 из рудных концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C. Из-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200— 1300 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Физические свойства • Вольфрам — светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё более тугоплавок, но пока что об этом твёрдо утверждать нельзя — время существования сиборгия очень мало). • Некоторые физические свойства приведены в таблице (см. выше). Другие физические свойства вольфрама: • твердость по Бринеллю 488 кг/мм². • удельное электрическое сопротивление при 20 °C 55× 10− 9 Ом·м, при 2700 °C — 904× 10− 9 Ом·м. • скорость звука в отожжённом вольфраме 4290 м/с. • Вольфрам является одним из наиболее тяжелых, твердых и самым тугоплавким металлом. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Химические свойства • Валентность от 2 до 6. Наиболее устойчив 6 -валентный вольфрам.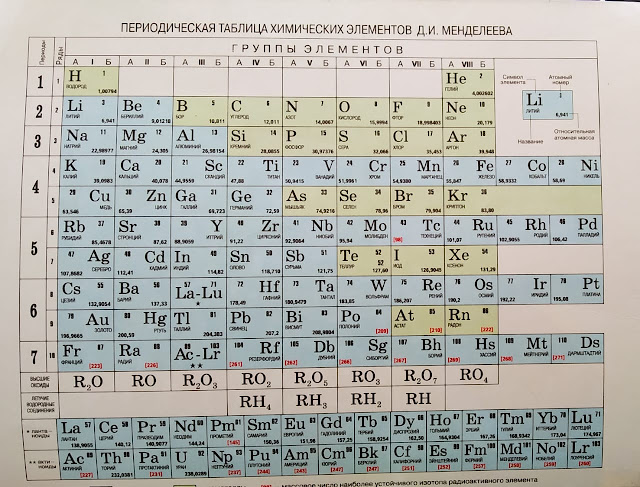 3 – и 2 -валентные соединения вольфрама неустойчивы и практического значения не имеют. • Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
3 – и 2 -валентные соединения вольфрама неустойчивы и практического значения не имеют. • Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама VI; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me 2 WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
10 фактов о вольфраме — W или атомный номер 74
Перейти к содержанию
Search for:
Главная » Факты
Автор Тимохин Александр На чтение 4 мин. Просмотров 25 Опубликовано
Просмотров 25 Опубликовано
Вольфрам (атомный номер 74, символ элемента W) — это металл от серо-стального до серебристо-белого цвета, знакомый многим как металл, используемый в нити накаливания ламп накаливания. Символ элемента W происходит от старого названия элемента — вольфрам. Вот 10 интересных фактов о вольфраме:
- Вольфрам — это элемент номер 74 с атомным номером 74 и атомный вес 183,84. Это один из переходных металлов с валентностью 2, 3, 4, 5 или 6. В соединениях наиболее распространенной степенью окисления является VI. Распространены две кристаллические формы. Объемно-центрированная кубическая структура более устойчива, но с этой формой может сосуществовать другая метастабильная кубическая структура.
- Существование вольфрама подозревалось в 1781 году, когда Карл Вильгельм Шееле и Т.О. Бергман сделал ранее неизвестную вольфрамовую кислоту из материала, который теперь называется шеелитом.
 В 1783 году испанские братья Хуан Хосе и Фаусто Д’Элхуяр выделили вольфрам из вольфрамитовой руды, и им приписывают открытие этого элемента.
В 1783 году испанские братья Хуан Хосе и Фаусто Д’Элхуяр выделили вольфрам из вольфрамитовой руды, и им приписывают открытие этого элемента. - Название элемента вольфрам произошло от названия руды, вольфрамита, которое происходит от немецкого волчий баран , что означает «волчья пена». Он получил такое название, потому что европейские оловянные заводы заметили, что присутствие вольфрамита в оловянной руде снижает выход олова, по-видимому, поедая олово, как волк пожирает овец. Что многие люди не знают, так это то, что братья Делхуяр фактически предложили название вольфрам для элемента, поскольку в то время w не использовалось в испанском языке. В большинстве европейских стран этот элемент был известен как вольфрам, но на английском языке он был назван вольфрамом (от шведского tungsten , что означает «тяжелый камень», имея в виду тяжесть шеелитовой руды). В 2005 году Международный союз теоретической и прикладной химии полностью отказался от названия вольфрам, чтобы периодическая таблица Менделеева была одинаковой во всех странах.
 Вероятно, это одно из самых спорных изменений названия, внесенных в периодическую таблицу Менделеева.
Вероятно, это одно из самых спорных изменений названия, внесенных в периодическую таблицу Менделеева. - Вольфрам имеет самую высокую температуру плавления среди металлов (6191,6 ° F или 3422 ° C), самое низкое давление пара и самая высокая прочность на разрыв. Его плотность сопоставима с плотностью золота и урана и в 1,7 раза выше, чем у свинца. Хотя чистый элемент может быть вытянут, экструдирован, разрезан, кован и пряден, любые примеси делают вольфрам хрупким и трудным для обработки.
- Элемент является проводящим и устойчивым к коррозии, хотя металлические образцы будут иметь характерный желтоватый оттенок на воздухе. Также возможен радужный оксидный слой. Это четвертый по твердости элемент после углерода, бора и хрома. Вольфрам легко поддается воздействию кислот, но устойчив к щелочам и кислороду.
- Вольфрам — один из пяти тугоплавких металлов. Другие металлы — ниобий, молибден, тантал и рений. Эти элементы сгруппированы рядом друг с другом в периодической таблице.
 Тугоплавкие металлы — это те металлы, которые обладают чрезвычайно высокой устойчивостью к нагреванию и износу..
Тугоплавкие металлы — это те металлы, которые обладают чрезвычайно высокой устойчивостью к нагреванию и износу.. - Считается, что вольфрам обладает низкой токсичностью и играет биологическую роль в организмах. Это делает его самым тяжелым элементом, используемым в биохимических реакциях. Некоторые бактерии используют вольфрам в качестве фермента, восстанавливающего карбоновые кислоты до альдегидов. У животных вольфрам мешает метаболизму меди и молибдена, поэтому он считается слегка токсичным.
- Природный вольфрам состоит из пяти стабильных изотопов. Эти изотопы действительно подвергаются радиоактивному распаду, но период полураспада настолько велик (четыре квинтиллиона лет), что они стабильны для всех практических целей. Также было обнаружено не менее 30 искусственных нестабильных изотопов.
- Вольфрам имеет множество применений. Он используется для накала в электрических лампах, в телевизионных и электронных лампах, в металлических испарителях, для электрических контактов, в качестве мишени для рентгеновских лучей, для нагревательных элементов и во многих высокотемпературных приложениях.
 Вольфрам — распространенный элемент в сплавах, включая инструментальные стали. Его твердость и высокая плотность также делают его отличным металлом для создания проникающих снарядов. Металлический вольфрам используется для уплотнений стекло-металл. Соединения элемента используются для люминесцентного освещения, дубления, смазок и красок. Соединения вольфрама находят применение в качестве катализаторов.
Вольфрам — распространенный элемент в сплавах, включая инструментальные стали. Его твердость и высокая плотность также делают его отличным металлом для создания проникающих снарядов. Металлический вольфрам используется для уплотнений стекло-металл. Соединения элемента используются для люминесцентного освещения, дубления, смазок и красок. Соединения вольфрама находят применение в качестве катализаторов. - Источники вольфрама включают минералы вольфрамит, шеелит, ферберит и хюбнерти. Считается, что около 75% мировых запасов этого элемента находится в Китае, хотя другие месторождения руды известны в США, Южной Корее, России, Боливии и Португалии. Этот элемент получают путем восстановления оксида вольфрама из руды водородом или углеродом. Получить чистый элемент сложно из-за его высокой температуры плавления.
Алфавитный список по наименованию химических элементов таблицы Менделеева
- Главная
- Периодическая таблица
- Элементы по наименованию
Элементы периодической таблицы отсортированы по наименованию в алфавитном списке.

Щелкните на имени любого элемента, чтобы узнать о дополнительных химических свойствах, данных об окружающей среде или влиянии на здоровье.
Этот список содержит 118 химических элементов.
| Химические элементы the periodic chart sorted by: | Name chemical element | Symbol | Atomic number | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| – Name alphabetically | Actinium | Ac | 89 | ||||||||
| – Атомный номер | Алюминий | Al | 13 | ||||||||
| – Символ 0014 | Americium | Am | 95 | ||||||||
| – Atomic Mass | Antimony | Sb | 51 | ||||||||
| – Electronegativity | Argon | Ar | 18 | ||||||||
| – Плотность | Мышьяк | As | 33 | ||||||||
| – Melting point | Astatine | At | 85 | ||||||||
| – Boiling point | Barium | Ba | 56 | ||||||||
| – Радиус Вандерваальса | Berkelium | Bk | 97 | ||||||||
| – Год открытия | Beryllium | Be | 4 | ||||||||
| – Inventor surname | Bismuth | Bi | 83 | ||||||||
| – Elements in earthcrust | Bohrium | Bh | 107 | ||||||||
| – Элементы в организме человека | Бор | 0013 B5 | |||||||||
| – Covalent Radius | Bromine | Br | 35 | ||||||||
| – Ionization energy | Cadmium | Cd | 48 | ||||||||
Для студентов и преподавателей химии: таблица справа представлена в алфавитном порядке. Первым химическим элементом является актиний, а последним – цирконий. Обратите внимание, что элементы не показывают своего естественного отношения друг к другу, как в периодической системе. Там вы можете найти металлы, полупроводники, неметаллы, инертный благородный газ (ы), галогены, лантаноиды, актиноиды (редкоземельные элементы) и переходные металлы. | Кальций | CA | 20 | ||||||||
| Калифорния | CF | 9 | CF | 9 | CF | 119CF | 119CF | 119CF | 9.0021 Carbon | C | 6 |
| Cerium | Ce | 58 | |||||||||
| Cesium | Cs | 55 | |||||||||
| Chlorine | CL | 17 | |||||||||
| Хром | CR | 24 | |||||||||
COBALT| 0014 | Co | 27 | | ||||||||
| Copernicium | Cn | 112 | |||||||||
| Copper | Cu | 29 | |||||||||
| Curium | См | 96 | |||||||||
| Дармштадтиум | Ds 50025 20091 | 10038 | |||||||||
| Dubnium | Db | 105 | |||||||||
| Dysprosium | Dy | 66 | |||||||||
| Einsteinium | Es | 99 | |||||||||
| Erbium | Er | 68 | |||||||||
| Европий | Eu | ||||||||||
| 238 9 | |||||||||||
| Fermium | Fm | 100 | |||||||||
| Flerovium | Fl | 114 | |||||||||
| Fluorine | F | 9 | |||||||||
| Francium | Фр | 87 | |||||||||
| Гадолиний | Gd 2 5 9990 9 00215 | 0038||||||||||
| Gallium | Ga | 31 | |||||||||
| Germanium | Ge | 32 | |||||||||
| Gold | Au | 79 | |||||||||
| Гафний | Hf | 72 | |||||||||
| Хафний | 10025108 | ||||||||||
| Helium | He | 2 | |||||||||
| Holmium | Ho | 67 | |||||||||
| Hydrogen | H | Иод0021 I | 53 | ||||||||
| Iridium | Ir | 77 | |||||||||
| Iron | Fe | 26 | |||||||||
| Krypton | KR | 36 | |||||||||
| Lanthanum | LA | 57 | |||||||||
| Законодательство | |||||||||||
| 0014 | Lr | 103 | |||||||||
| Lead | Pb | 82 | |||||||||
| Lithium | Li | 3 | |||||||||
| Livermorium | Lv | 116 | |||||||||
| Лютеций | Лу | 5 | 8 71 | ||||||||
| Magnesium | Mg | 12 | |||||||||
| Manganese | Mn | 25 | |||||||||
| Meitnerium | Mt | 109 | |||||||||
| Менделевий | Md | 101 | |||||||||
| Ртуть | Hg 0025 | 80 | |||||||||
| Molybdenum | Mo | 42 | |||||||||
| Moscovium | Mc | 115 | |||||||||
| Neodymium | Nd | 60 | |||||||||
| Неон | Ne | 10 | |||||||||
Нептуний0025| Np | 93 | | |||||||||
| Nickel | Ni | 28 | |||||||||
| Nihonium | Nh | 113 | |||||||||
| Niobium | Nb | 41 | |||||||||
| Азот | N | 7 | |||||||||
| No | 102 | ||||||||||
| Oganesson | Og | 118 | |||||||||
| Osmium | Os | 76 | |||||||||
| Кислород | O | 8 | |||||||||
| Палладий | Pd | 5 4 | 50025 | ||||||||
| Phosphorus | P | 15 | |||||||||
| Platinum | Pt | 78 | |||||||||
| Plutonium | Pu | 94 | |||||||||
| Полоний | Po | 84 | |||||||||
| Калий | 9 | 0013 K | 19 | ||||||||
| Praseodymium | Pr | 59 | |||||||||
| Promethium | Pm | 61 | |||||||||
| Protactinium | Pa | 91 | |||||||||
| Радий | Ra | 88 | |||||||||
| Rn | 86 | ||||||||||
| Rhenium | Re | 75 | |||||||||
| Rhodium | Rh | 45 | |||||||||
| Roentgenium | Рг | 111 | |||||||||
| Рубидий | Рб 7 | 5 32 5 | 32 5 30038|||||||||
| Ruthenium | Ru | 44 | |||||||||
| Rutherfordium | Rf | 104 | |||||||||
| Samarium | Sm | 62 | |||||||||
| Скандий | Sc | 21 | |||||||||
| Сиборгий | Sg | 106 | |||||||||
| Selenium | Se | 34 | |||||||||
| Silicon | Si | 14 | |||||||||
| Silver | Ag | 47 | |||||||||
| Натрий | Na | 11 | |||||||||
| 14 | Sr | 38 | |||||||||
| Sulfur | S | 16 | |||||||||
| Tantalum | Ta | 73 | |||||||||
| Technetium | Tc | 43 | |||||||||
| Теллур | Te | 9 | Tennessine | Ts | 117 | ||||||
| Terbium | Tb | 65 | |||||||||
| Thallium | Tl | 81 | |||||||||
| Торий | Th | 90 | |||||||||
| Тулий | Tm| 40021 69 | | |||||||||
| Tin | Sn | 50 | |||||||||
| Titanium | Ti | 22 | |||||||||
| Tungsten | W | 74 | |||||||||
| Уран | У | 92 | |||||||||
| 1512 Ванадий 0013 V | 23 | ||||||||||
| Xenon | Xe | 54 | |||||||||
| Ytterbium | Yb | 70 | |||||||||
| Yttrium | Y | 39 | |||||||||
| ZINC | ZN | 30 | |||||||||
| 0014 | Zr | 40 |
Щелкните здесь: для схематического обзора периодической таблицы элементов в виде диаграммы
Вам нужно знать массу молекул? Попробуйте наш калькулятор молекулярного веса!
Пожалуйста, сообщайте о любой случайной ошибке в приведенной выше статистике по химическим элементам.
Список элементов в алфавитном порядке
Периодическая таблица: Список элементов в алфавитном порядке| « НАЗАД | ПЕРИОДИЧЕСКАЯ ТАБЛИЦА | HOME » |
| Elements in alphabetical order [ click on Element for info page ]
|
| « BACK | ПЕРИОДИЧЕСКАЯ ТАБЛИЦА | ГЛАВНАЯ » |
. |
Вольфрам (W) – Периодическая таблица (информация об элементе и многое другое)
от Admin
Это СУПЕР простое руководство по вольфрамовому элементу.
Фактически, таблица, упомянутая ниже, представляет собой идеальное информационное поле (которое дает вам все подробности об элементе вольфрама в периодической таблице).
Давайте погрузимся прямо в это!
Информация о вольвательством (W)| Внешний вид В вольважении | 3 Серый белый вид. Вольфрам в Периодической таблице | Группа: 6 , Период: 6 , Блок: d |
| Category of Tungsten element | Transition metals | |
| Atomic number of Tungsten, or Protons in Tungsten | 74 | |
| Neutrons in Tungsten | 110 | |
| Электроны в вольфраме | 74 | |
| Символ вольфрама | Вт | |
| Атомная масса of Tungsten | 183. 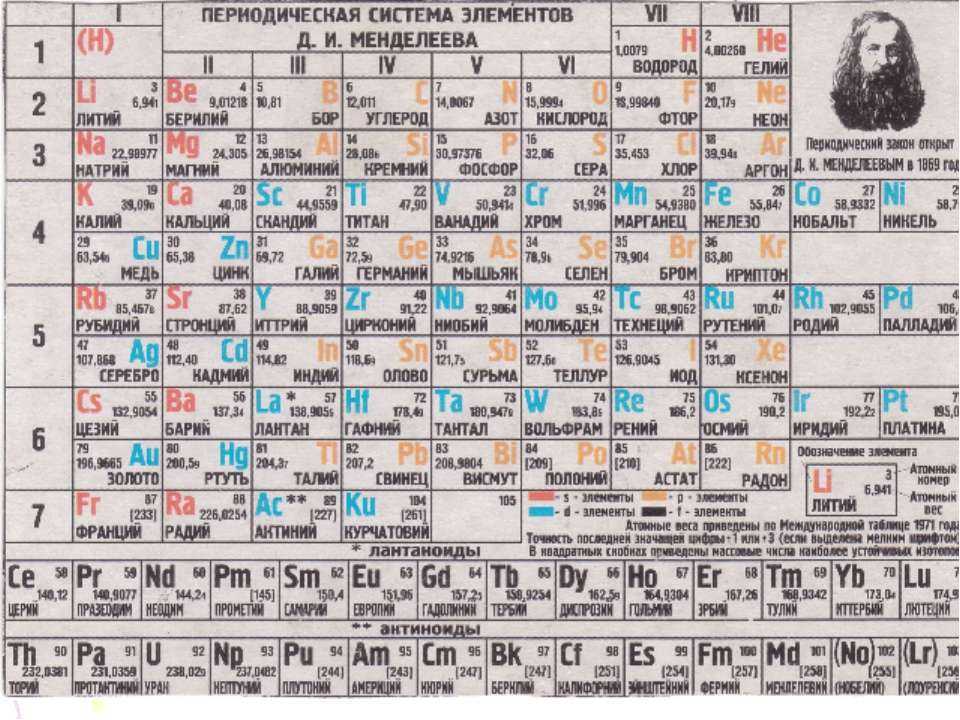 84 u 84 u | |
| Electrons arrangement in Tungsten or Bohr model of Tungsten | 2, 8, 18, 32, 12, 2 | |
| Electronic configuration of Tungsten | [Xe] 4f 14 5d 4 6s 2 | |
| Atomic radius of Tungsten | 210 picometers (van der Waals radius) | |
| 1st Ionization energy of Tungsten | 7.98 eV | |
| Electronegativity of Tungsten | 2.36 (Pauling scale) | |
| Crystal structure of Tungsten | BCC (Body centered cubic | |
| Температура плавления вольфрама | 3695 K или 3422 °C или 6192 °F | |
| Температура кипения вольфрама | 6203 K or 5930 °C or 10706 °F | |
| Density of Tungsten | 19.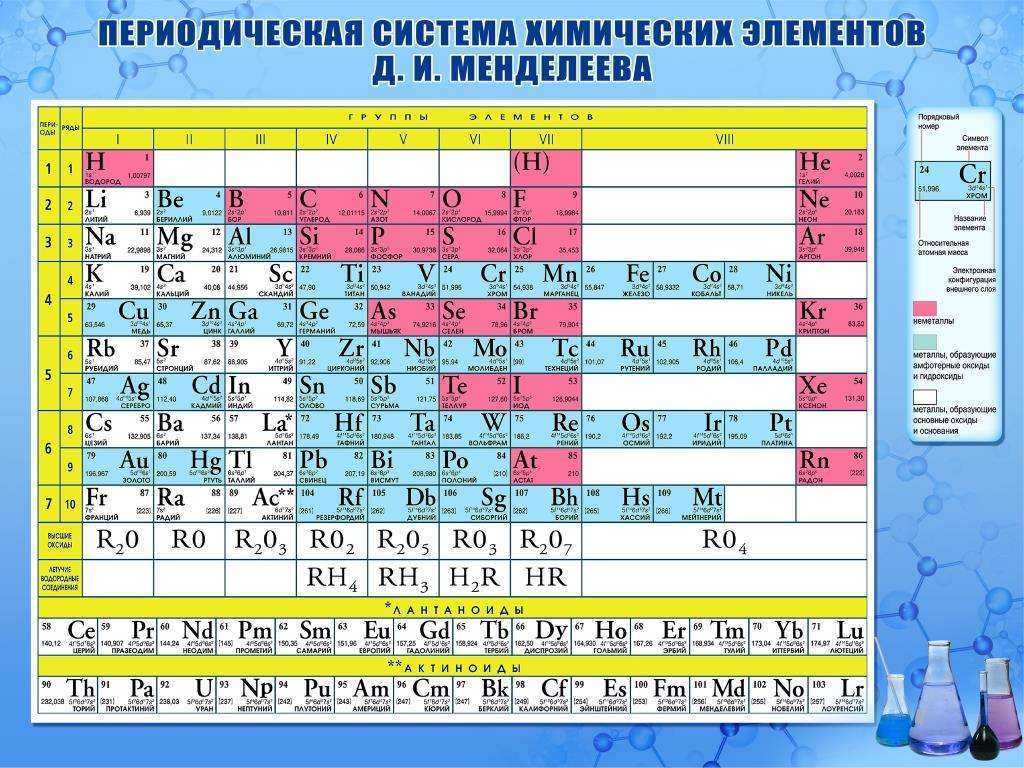 25 g/cm 3 25 g/cm 3 | |
| Main isotopes of Tungsten | 182 W (26.5%) , 184 Вт (30,6%), 186 Вт (28,4%) | |
| Кто открыл Вольфрам и когда? | Фаусто Эльхуяр и Хуан Хосе Эльхуяр (в 1783 г.) | |
| Номер CAS | 7440-33-7 |
Посмотрите, как эта интерактивная периодическая таблица поможет вам
- Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной периодической таблицы.
- Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
- Вы также получите HD-изображений Периодической таблицы (БЕСПЛАТНО).
Посещение ➢ Таблица Менделеева
Вольфрам в периодической таблице Вольфрамовый элемент находится в группе 6 и периоде 6 900. Вольфрам является элементом d-блока и принадлежит к группе переходных металлов .
Вольфрам является элементом d-блока и принадлежит к группе переходных металлов .
Нажмите на указанные выше элементы (в периодической таблице), чтобы просмотреть информацию о них, или посетите Interactive Periodic Table (который показывает названия, символ, атомную массу, электронную конфигурацию, расположение электронов и т. д. всех элементов )
Нажмите на элементы выше (в периодической таблице), чтобы увидеть их информацию
←Перейти к: Элемент тантала (Ta) – периодическая таблица
→Перейти к: элемент рений (Re) – периодическая таблица
Позвольте задать вам вопрос.
Сколько оболочек у атома вольфрама?
Сейчас 6. Верно?
Вы уже видели боровскую модель атома вольфрама в приведенной выше таблице.
Из модели Бора можно найти, что количество орбит или оболочек в вольфраме равно 6. Следовательно, поскольку у вольфрама 6 орбит, он находится в периоде 6 Периодической таблицы.
Следовательно, поскольку у вольфрама 6 орбит, он находится в периоде 6 Периодической таблицы.
Прежде чем узнать эту причину, прежде всего я хочу задать вам простой вопрос.
Как определить положение элементов по блокам?
Простой ответ: Элементы, которые будут лежать в блоках s, p, d или f, будут полностью зависеть от подоболочки, в которую войдет последний электрон.
Например; электронная конфигурация вольфрама [Xe] 4f 14 5d 4 6s 2 .
Итак, последний электрон вольфрама попадает на d-подоболочку или d-орбиталь.
Следовательно, вольфрам является элементом d-блока.
Является ли вольфрам переходным металлом? Почему?Да , Вольфрам является переходным металлом, поскольку в основном состоянии имеет не полностью заполненную d-орбиталь.
Позвольте мне объяснить точное значение этого.
Согласно определению переходных металлов;
Элемент обязательно должен иметь неполные d-орбитали либо в их основном состоянии (М), либо в наиболее распространенных степенях окисления (М 1+ , М 2+ и т. д.), тогда только они называются переходными металлами.
Основное состояние вольфрама означает его нормальное состояние, в котором он не приобрел и не потерял ни одного электрона/электронов.
Итак, основное состояние вольфрама W .
Электронная конфигурация вольфрама в основном состоянии [Xe] 4f 14 5d 4 6s 2 .
В этом состоянии, если мы видим электронную конфигурацию вольфрама, то он обладает неполными d-орбиталями.
Потому что на d-орбиталях (здесь 5d-орбитали) всего четыре электрона.
Чтобы иметь полные d-орбитали, в ней должно быть 10 электронов.
Но в электронной конфигурации вольфрама в основном состоянии видно, что у него только 4 электрона на d-орбиталях.
Таким образом, вольфрам имеет неполные d-орбитали.
И, следовательно, поскольку вольфрам имеет неполные d-орбитали, он считается переходным металлом.
5 фактов о вольфрамеНиже приведены интересные факты о вольфрамовом элементе.
- Раньше в европейских странах этот элемент назывался «вольфрам», но позже ИЮПАК назвал его «вольфрамом».
- Название «вольфрам» произошло от шведского слова «tung sten», что означает «тяжелый камень».
- Из всех металлов периодической таблицы вольфрам имеет самую высокую температуру плавления (т.е. 3695 К или 3422 °С).
- Вольфрам является 4-м -м -м самым твердым элементом в периодической таблице элементов, за ним следуют углерод (алмаз), бор и хром.
- Содержание вольфрама в земной коре составляет примерно 1,25 частей на миллион по весу.
Ниже приведены физические и химические свойства вольфрама.
Физические свойства вольфрама указаны ниже.
- Вольфрам – прочный металл с серо-белым блеском.
- Вольфрам в виде порошка имеет серый цвет.
- Атомная масса вольфрама 183,84 ед., плотность 19,25 г/см 3 .
- Температура плавления и температура кипения вольфрама составляют 3422 °C и 5930 °C соответственно.
- Существует много изотопов вольфрама, но из этих изотопов основными изотопами являются 182 Вт (26,5%), 184 Вт (30,6%) и 186 Вт (28,4%).
- Кристаллическая структура вольфрама – ОЦК (объемно-центрированная кубическая).
Химические свойства вольфрама указаны ниже.
- При комнатной температуре вольфрам не вступает в реакцию с водой, кислотами и основаниями.
- Вольфрам не вступает в реакцию с кислородом при комнатной температуре.
 Но при более высокой температуре он реагирует с кислородом с образованием оксида.
Но при более высокой температуре он реагирует с кислородом с образованием оксида. - Когда вольфрам присутствует в его соединениях, он в основном находится в степени окисления +6.
- Вольфрам имеет неполные d-орбитали, поэтому он классифицируется как переходный металл в периодической таблице.
Использование вольфрама указано ниже.
- Поскольку вольфрам имеет очень высокую температуру плавления, он используется в качестве материала накаливания в электрических лампах.
- Около 18% вольфрама используется в быстрорежущих сталях, которые используются для резки металла на более высокой скорости.
- Вольфрам также используется в качестве легирующего элемента, а также в высокотемпературных применениях, таких как сварка.
- Карбид вольфрама — это материал, который используется для изготовления сверл, а также других режущих инструментов.
Позвольте мне рассказать вам, как эта Интерактивная таблица Менделеева поможет вам в учебе.
1). Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной периодической таблицы.
(Для интерактивной периодической таблицы просмотрите ее на ноутбуке/настольном компьютере для лучшего восприятия. Если вы используете мобильное устройство, используйте «режим сайта рабочего стола», чтобы просмотреть интерактивную периодическую таблицу)
2). Вы получите подробную информацию о таблице Менделеева, которая превратит новичка в профессионала.
3). Вы также получите HD-изображения Периодической таблицы (БЕСПЛАТНО).
Оформить заказ интерактивной таблицы Менделеева и загрузить ее изображение в высоком разрешении прямо сейчас ( Это БЕСПЛАТНО )
Посетите интерактивную таблицу Менделеева
Получить информацию + Изображение периодической таблицы в высоком разрешении
Ссылки: 900 90014
Химические данные: Wikipedia, Chemspider
Вольфрамовый элемент: изображение Alchemist-hp (talk) (www.
 pse-mendelejew.de), через Wikimedia Commons
pse-mendelejew.de), через Wikimedia CommonsПериодическая таблица элементов
Периодическая таблица элементов с их атомным числа.
Рекламные ссылки
Для полной таблицы со всеми элементами – повернуть экран!
| Группа | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||
| 1 H | 2 He | |||||||||||||||||||||||||||||||||||
| 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F 0025| 10 | Ne | |||||||||||||||||||||||||||||
| 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||||||||||||||||||||||
| 102 K 0025 | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||||||||||||||||||||
| 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 MO | 43 TC | 44 RU | 45 RH | 46 PD | 47 AG | 48 CD | 1 49999 | 48 CD | 1 49 33 3 | | 4 3 3 | | | 51 Sb | 52 Te | 53 I | 54 Xe | ||||||||||||||
| 55 Cs | 56 Ba | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | |||||
| 87 Fr | 88 Ra | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | |||||||||||
| Atomic Number | Chemical Element Name | Символ | ||
|---|---|---|---|---|
| 1 | Водород | H | ||
| 2 | Гелий | HE | ||
| 0021 3 | Lithium | Li | ||
| 4 | Beryllium | Be | ||
| 5 | Boron | B | ||
| 6 | Carbon | C | ||
| 7 | Nitrogen | N | ||
| 8 | кислород | O | ||
| Флуорин | F | |||
| 10 | 1 NEON | |||
| 10 | 11119 | |||
| 10 | 11119 | |||
| 10 | 111111110025 | Ne | ||
| 11 | Sodium | Na | ||
| 12 | Magnesium | Mg | ||
| 13 | Aluminum | Al | ||
| 14 | Silicon | Si | ||
| 15 | Фосфор | P | ||
| 16 | Сера | S | ||
| 17 | 0021 Cl||||
| 18 | Argon | Ar | ||
| 19 | Potassium | K | ||
| 20 | Calcium | Ca | ||
| 21 | Scandium | Sc | ||
| 22 | Титан | Ti | ||
| 23 | Ванадий | V | ||
| 24 | 15||||
| 25 | Manganese | Mn | ||
| 26 | Iron | Fe | ||
| 27 | Cobalt | Co | ||
| 28 | Nickel | Ni | ||
| 29 | медь | CU | ||
| 30 | ZINC | ZN | ||
| 31 | Gallium | GA | ||
| Gallium | GA | |||
| Gallium | GA | |||
| Gallium | 0021 32Germanium | Ge | ||
| 33 | Arsenic | As | ||
| 34 | Selenium | Se | ||
| 35 | Bromine | Br | ||
| 36 | Krypton | Kr | ||
| 37 | Рубидий | Rb | ||
| 38 | Стронций | 3 Sr8Yttrium | Y | |
| 40 | Zirconium | Zr | ||
| 41 | Niobium | Nb | ||
| 42 | Molybdenum | Mo | ||
| 43 | Technetium | Tc | ||
| 44 | Рутений | Ru | ||
| 45 | Родий | Rh | 8Palladium | Pd |
| 47 | Silver | Ag | ||
| 48 | Cadmium | Cd | ||
| 49 | Indium | In | ||
| 50 | Tin | Sn | ||
| 51 | Отвания | SB | ||
| 52 | Tellurium | TE | ||
| 53 | IODIN0025 | I | ||
| 54 | Xenon | Xe | ||
| 55 | Cesium | Cs | ||
| 56 | Barium | Ba | ||
| 57 | Lanthanum | La | ||
| 58 | Церий | Ce | ||
| 59 | Празеодим | Pr | ||
| 5 Неодий0021 Nd | ||||
| 61 | Promethium | Pm | ||
| 62 | Samarium | Sm | ||
| 63 | Europium | Eu | ||
| 64 | Gadolinium | Gd | ||
| 65 | Тербий | Tb | ||
| 66 | Диспрозий | Dy | ||
| 67 | 0021 Ho | |||
| 68 | Erbium | Er | ||
| 69 | Thulium | Tm | ||
| 70 | Ytterbium | Yb | ||
| 71 | Lutetium | Lu | ||
| 72 | Гафний | Hf | ||
| 73 | Тантал | Та | ||
| 74 5 | Вольфрам 900025 | |||
| 75 | Rhenium | Re | ||
| 76 | Osmium | Os | ||
| 77 | Iridium | Ir | ||
| 78 | Platinum | Pt | ||
| 79 | Золото | Au | ||
| 80 | Ртуть | Hg | ||
| 81 | Таллий | 002082 | Lead | Pb |
| 83 | Bismuth | Bi | ||
| 84 | Polonium | Po | ||
| 85 | Astatine | At | ||
| 86 | Radon | RN | ||
| 87 | FRANCIUM | FR | ||
| 88 | Radium | RA | ||
| 89 89 | Actinium | Ac | ||
| 90 | Thorium | Th | ||
| 91 | Protactinium | Pa | ||
| 92 | Uranium | U | ||
| 93 | Neptunium | Np | ||
| 94 | Плутоний | Pu | ||
| 95 | Америций | Am 6 | Curium | Cm |
| 97 | Berkelium | Bk | ||
| 98 | Californium | Cf | ||
| 99 | Einsteinium | Es | ||
| 100 | Fermium | Fm | ||
| 101 | Менделевий | Md | ||
| 102 | Нобелий | № | ||
| Lawrencium | Lr | |||
| 104 | Rutherfordium | Rf | ||
| 105 | Dubnium | Db | ||
| 106 | Seaborgium | Sg | ||
| 107 | Bohrium | Bh | ||
| 108 | Хассиум | Hs | ||
| 109 | Мейтнерий | Mt | ||
| Darmstadtium | Ds | |||
| 111 | Roentgenium | Rg | ||
| 112 | Ununbium | Uub | ||
| 113 | Ununtrium | Uut | ||
| 114 | Ununquadium | Uuq | ||
| 115 | Унунпентиум | Uup | ||
| 116 | Унунгексий | 1 Уух0025 | ||
| 117 | Ununseptium | Uus | ||
| 118 | Ununoctium | Uuo |
Sponsored Links
Related Topics
Related Documents
Engineering ToolBox – SketchUp Extension – Online 3D modeling!
Добавляйте стандартные и настраиваемые параметрические компоненты, такие как балки с полками, пиломатериалы, трубопроводы, лестницы и т. д., в свою модель Sketchup с помощью Engineering ToolBox — расширения SketchUp, которое можно использовать с потрясающими, увлекательными и бесплатными программами SketchUp Make и SketchUp Pro. .Добавьте расширение Engineering ToolBox в свой SketchUp из хранилища расширений SketchUp Pro Sketchup!
д., в свою модель Sketchup с помощью Engineering ToolBox — расширения SketchUp, которое можно использовать с потрясающими, увлекательными и бесплатными программами SketchUp Make и SketchUp Pro. .Добавьте расширение Engineering ToolBox в свой SketchUp из хранилища расширений SketchUp Pro Sketchup!
Перевести
О Engineering ToolBox!
Мы не собираем информацию от наших пользователей. В нашем архиве сохраняются только электронные письма и ответы. Файлы cookie используются только в браузере для улучшения взаимодействия с пользователем.
Некоторые из наших калькуляторов и приложений позволяют сохранять данные приложения на локальном компьютере. Эти приложения будут — из-за ограничений браузера — отправлять данные между вашим браузером и нашим сервером. Мы не сохраняем эти данные.
Google использует файлы cookie для показа нашей рекламы и обработки статистики посетителей. Пожалуйста, прочитайте Конфиденциальность и условия Google для получения дополнительной информации о том, как вы можете контролировать показ рекламы и собираемую информацию.
AddThis использует файлы cookie для обработки ссылок на социальные сети. Пожалуйста, прочитайте AddThis Privacy для получения дополнительной информации.
Реклама в ToolBox
Если вы хотите продвигать свои товары или услуги в Engineering ToolBox – используйте Google Adwords. Вы можете настроить таргетинг на Engineering ToolBox с помощью управляемых мест размещения AdWords.
Цитирование
Эту страницу можно цитировать как
- Engineering ToolBox, (2014). Периодическая таблица элементов . [онлайн] Доступно по адресу: https://www.engineeringtoolbox.com/periodic-table-elements-atomic-numbers-d_1891.html [День доступа, мес. год].
Изменить дату доступа.
. .
закрыть
Периодическая таблица элементов | Ящик для инструментов
Перейти к основному содержанию- & #31616;& #21270;& #23383;
- Deutsch
- español
- français
- & #x0939;& #x093f;& #x0928;& #x094d;& #x0926;ी
- итальянский
- 日& #x672c;& #x8a9e;
- & #54620;& #44397;& #50612;
- Нидерланды
- Португалия
- & #x0420;& #x043e;& #x0441;& #x0441;& #x0438;& #x0438;
- svensk
- Английский
| Символ | Элемент | Атомный номер | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ac | Actinium | 89 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Al | Aluminum | 13 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Am | Americium | 95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sb | Antimony | 51 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ar | Аргон | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AS | Арсеник | 33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AT | ASTATIN0025 | Barium | 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bk | Berkelium | 97 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Be | Beryllium | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bi | Bismuth | 83 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bh | Bohrium | 107 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| B | Boron | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BR | Бром | 35 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | CADMIUM | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 0025 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ca | Calcium | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cf | Californium | 98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C | Carbon | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ce | Cerium | 58 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Цезий | 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CL | Хлор | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CR | Хром | 24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 24 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO | 0021 Cobalt | 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cn | Copernicium | 112 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cu | Copper | 29 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cm | Curium | 96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ds | Darmstadtium | 110 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DB | Dubnium | 105 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DY | Dysprosium | 66 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ES | EINSTEININ0021 99 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Er | Erbium | 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eu | Europium | 63 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fm | Fermium | 100 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fl | Flerovium | 114 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| F | Fluorine | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fr | Francium | 87 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gd | Gadolinium | 64 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ga | Gallium | 31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ge | Germanium | 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Au | Gold | 79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hf | Hafnium | 72 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hs | Hassium | 108 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| He | Helium | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ho | Holmium | 67 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H | Hydrogen | 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| In | Indium | 49 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| I | Iodine | 53 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ir | Iridium | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fe | Iron | 26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kr | Krypton | 36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La | Lanthanum | 57 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lr | Lawrencium | 103 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pb | Lead | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Lithium | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lv | Livermorium | 116 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lu | Lutetium | 71 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mg | Magnesium | 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MN | Манганец | 25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MT | MEITNERIUM | 109 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MD | MendELELVIUM | MD | 111111111111111 гг. 0025 0025 | 101 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hg | Mercury | 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mo | Molybdenum | 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mc | Moscovium | 115 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nd | Neodymium | 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ne | Neon | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Np | Neptunium | 93 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ni | Nickel | 28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nh | Nihonium | 113 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nb | Niobium | 41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N | Nitrogen | 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No | Nobelium | 102 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Og | Oganesson | 118 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| OS | OSMIUM | 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| O | кислород | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. 0025 0025 | 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P | Phosphorus | 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pt | Platinum | 78 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pu | Plutonium | 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Po | Polonium | 84 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Калий | 19 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PR | Praseodymium | 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PM | PROMETHIUM | 70021 | PROMETHIUM | 70025 | .0038||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pa | Protactinium | 91 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ra | Radium | 88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rn | Radon | 86 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Re | Rhenium | 75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rh | Rhodium | 45 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RG | ROENTGENIUM | 111 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RB | Rubidium | 37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RU | 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RU | 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RU | 37 | . 0021 Ruthenium 0021 Ruthenium | 44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rf | Rutherfordium | 104 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sm | Samarium | 62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sc | Scandium | 21 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sg | Seaborgium | 106 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SE | Selenium | 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI | Кремний | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AG | СВЕРИ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AG | СВЕТ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AG | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AG | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AG | 0021 47 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Sodium | 11 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sr | Strontium | 38 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S | Sulfur | 16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ta | Tantalum | 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tc | Technetium | 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Te | Tellurium | 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tn | Tennessine | 117 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tb | Terbium | 65 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tl | Thallium | 81 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Th | Thorium | 90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tm | Thulium | 69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sn | Tin | 50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ti | Titanium | 22 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| W | Tungsten | 74 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| U | Uranium 9Металл, свойства, факты, соединения, использованиеЧто такое вольфрам? Вольфрам является химическим элементом или прочным серебристым переходным металлом группы 6 (VIB) периодической таблицы с символом W и атомным номером 74. Свойства вольфрама и молибдена очень похожи, но химический состав этих двух металлов немного отличается. Он имеет самую высокую температуру плавления среди всех металлов и второе место после углерода среди всех элементов таблицы Менделеева. Вольфрам помещается в d-блок современной периодической таблицы вместе с членами группы хрома и молибдена. Открытие вольфрамаМинерал вольфрам (шведский тяжелый камень CaWO 4 ) был изучен в 1751 году Кронштедтом. В 1981 году Карл Вильгельм Шееле открыл новый оксид этого минерала. Два года спустя испанские химики Хосе и Фаусто Эльхуяр (два брата) выделили тот же оксид из минерала, известного как вольфрамит. Они выделили металлический вольфрам реакцией восстановления углерода из древесного угля. Символ вольфрама происходит от имени Вольфрам. Свойства вольфрамаАтомный номер вольфрама 74 и электронная конфигурация [Xe] 4f 14 5d 4 6s 2 . Это последний металл в третьем переходном ряду, в котором все d-электроны участвуют в металлической связи. Металл очень твердый, тугоплавкий и относительно нереакционноспособный благодаря защитному оксидному слою. Он образует типичную металлическую объемно-центрированную кубическую кристаллическую решетку, такую как молибден. Металлы Cr, Mo и W входят в группу VI периодической таблицы. Обычная степень окисления или состояние вольфрама +6 (VI).
Где встречается вольфрам Вольфрам встречается в природе в основном в виде вольфрамита, Fe(Mn)WO 4 и шеелит или вольфрамат кальция, CaWO 4 . Основные запасные места металла в Китае, США, Южной Корее, Боливии, Португалии, России. Изотопы вольфрамаМеталлический вольфрам имеет четыре природных изотопа ( 182 Вт, 183 Вт, 184 Вт и 186 Вт) и один радиоактивный изотоп (50649 Вт). Радиоактивный изотоп металла имеет очень долгую жизнь. Все пять изотопов радиоактивно распадаются с образованием гафния в результате ядерной реакции. Наблюдаются еще 30 радиоактивных изотопов металла. Они могут быть получены различными типами ядерных реакций. Производство вольфрамового порошка из вольфрамита
Химические соединенияХимический состав вольфрама близок к молибдену. Наиболее распространенная и стабильная степень окисления металла +6, но также стабильны состояния +5 и +4. Сильные восстановительные свойства металла не выполняются до состояний +3 и +2. Оксиды, фториды и оксокислоты образуются в различных степенях окисления. ОксидыЖелтый WO 3 является конечным продуктом нагревания других соединений вольфрама на воздухе. Он нерастворим в кислотах. ВО 3 , 2H 2 O образуется в сильнокислых средах. Ее называют вольфрамовой кислотой, но это не гидратированная кислота. Некоторые низшие оксиды, такие как WO 2 , были получены восстановлением триоксида водородом. ГалогенидыГексагалогениды металла получают прямым соединением. Бесцветный фторид, такой как WF 6 , более стабилен. Он достаточно реакционноспособен и легко реагирует с кислородом и влагой с образованием оксогалогенидов и HF. ВБр 6 нестабилен и разлагается при осторожной обработке червями. Оксогалогениды металла бывают двух типов
Также известны петагалогениды металлического вольфрама. Желтый галогенид, такой как WF 5 образуется путем восстановления WF 6 при температуре от 500 до 800 °C. Тетрафторид металла образуется восстановлением гексафторида бензолом или другими углеводородами. Это нелетучее красно-коричневое химическое соединение. Кластеры галогенидовНижняя степень окисления вольфрама нестабильна и сильно восстанавливается по своей природе. Металл образует только WCl 3 и WBr 3 в степени окисления +3. Вольфрам (II) совершенно нестабилен. Комплексный галогенид W (II) относится к типу W 6 X 12 (где X = хлор, бром, йод). Он образует кластерные соединения, такие как (W 6 X 8 ) +4 X 4 – . Нулевая степень окисления наблюдается в карбонильных комплексах типа W(CO) 6 . Аналитические реакции При добавлении соляной кислоты к вольфрамату осаждается гидратированная вольфрамовая кислота. Вольфраматы осаждают в виде бензидиновольфрамата из разбавленной 0,1N серной кислоты. Осадок прокаливают до WO 3 и взвешивают. При шкале рН от 7 до 8 вольфраматы могут быть осаждены как BaWO 4 . Для чего используется вольфрам?
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 В глубоком сверлении применяются прецизионные приборы, держатель которых не должен поддаваться вибрациям. Этому требованию соответствует вольфрам, имеющий к тому же и высокий модуль упругости. Антивибрационные держатели обеспечивают плавную работу, поэтому их используют в расточных и шлифовальных оправках, в стержнях инструментов. На основе вольфрама изготавливают рабочую часть инструмента, так как он обладает повышенной твердостью.
В глубоком сверлении применяются прецизионные приборы, держатель которых не должен поддаваться вибрациям. Этому требованию соответствует вольфрам, имеющий к тому же и высокий модуль упругости. Антивибрационные держатели обеспечивают плавную работу, поэтому их используют в расточных и шлифовальных оправках, в стержнях инструментов. На основе вольфрама изготавливают рабочую часть инструмента, так как он обладает повышенной твердостью.

 Например, ВНМ 3–2 — это вольфрамовый сплав с добавлением 3% никеля и 2% меди, ВНМ 5–3 содержит в примеси 5% никеля и 3% железа, ВД-30 состоит на 30% из меди.
Например, ВНМ 3–2 — это вольфрамовый сплав с добавлением 3% никеля и 2% меди, ВНМ 5–3 содержит в примеси 5% никеля и 3% железа, ВД-30 состоит на 30% из меди.
 Никель
Никель Самарий
Самарий Америций
Америций ru/Database/properties.php?dbid=1&id=284
ru/Database/properties.php?dbid=1&id=284 В 1783 году испанские братья Хуан Хосе и Фаусто Д’Элхуяр выделили вольфрам из вольфрамитовой руды, и им приписывают открытие этого элемента.
В 1783 году испанские братья Хуан Хосе и Фаусто Д’Элхуяр выделили вольфрам из вольфрамитовой руды, и им приписывают открытие этого элемента. Вероятно, это одно из самых спорных изменений названия, внесенных в периодическую таблицу Менделеева.
Вероятно, это одно из самых спорных изменений названия, внесенных в периодическую таблицу Менделеева. Тугоплавкие металлы — это те металлы, которые обладают чрезвычайно высокой устойчивостью к нагреванию и износу..
Тугоплавкие металлы — это те металлы, которые обладают чрезвычайно высокой устойчивостью к нагреванию и износу.. Вольфрам — распространенный элемент в сплавах, включая инструментальные стали. Его твердость и высокая плотность также делают его отличным металлом для создания проникающих снарядов. Металлический вольфрам используется для уплотнений стекло-металл. Соединения элемента используются для люминесцентного освещения, дубления, смазок и красок. Соединения вольфрама находят применение в качестве катализаторов.
Вольфрам — распространенный элемент в сплавах, включая инструментальные стали. Его твердость и высокая плотность также делают его отличным металлом для создания проникающих снарядов. Металлический вольфрам используется для уплотнений стекло-металл. Соединения элемента используются для люминесцентного освещения, дубления, смазок и красок. Соединения вольфрама находят применение в качестве катализаторов.
 0020
0020
 0025
0025 0025
0025 :: Радиохимическое общество © ::.
:: Радиохимическое общество © ::. Но при более высокой температуре он реагирует с кислородом с образованием оксида.
Но при более высокой температуре он реагирует с кислородом с образованием оксида.