Таблица менделеева – Электронный учебник K-tree
Электронный учебник
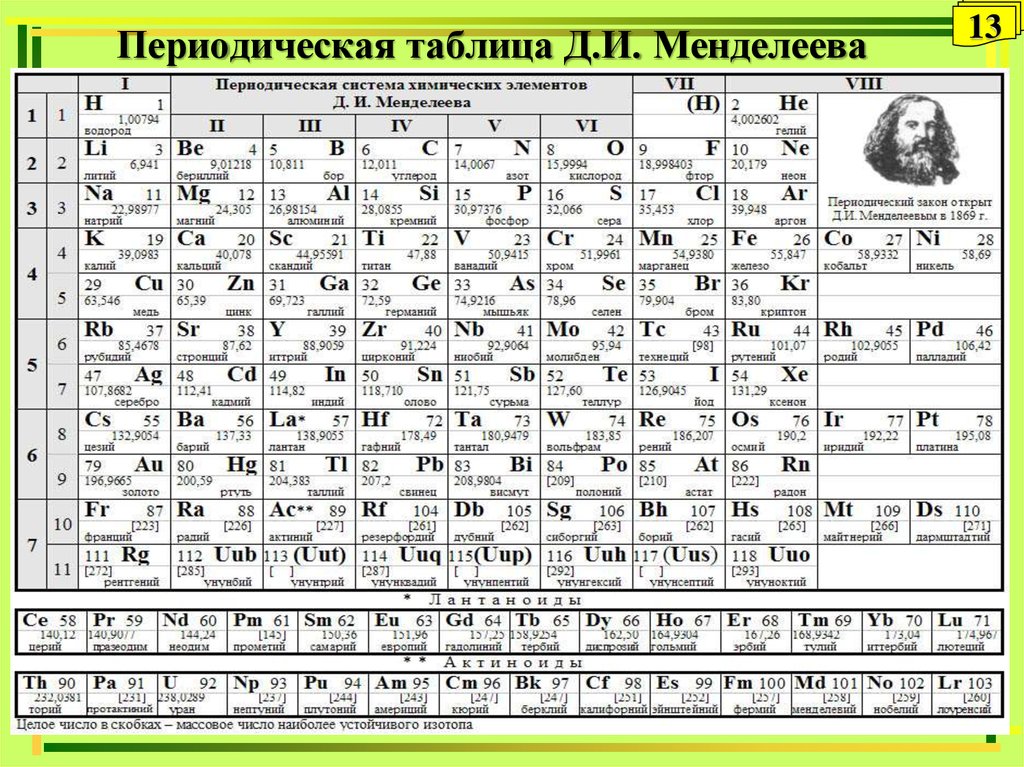
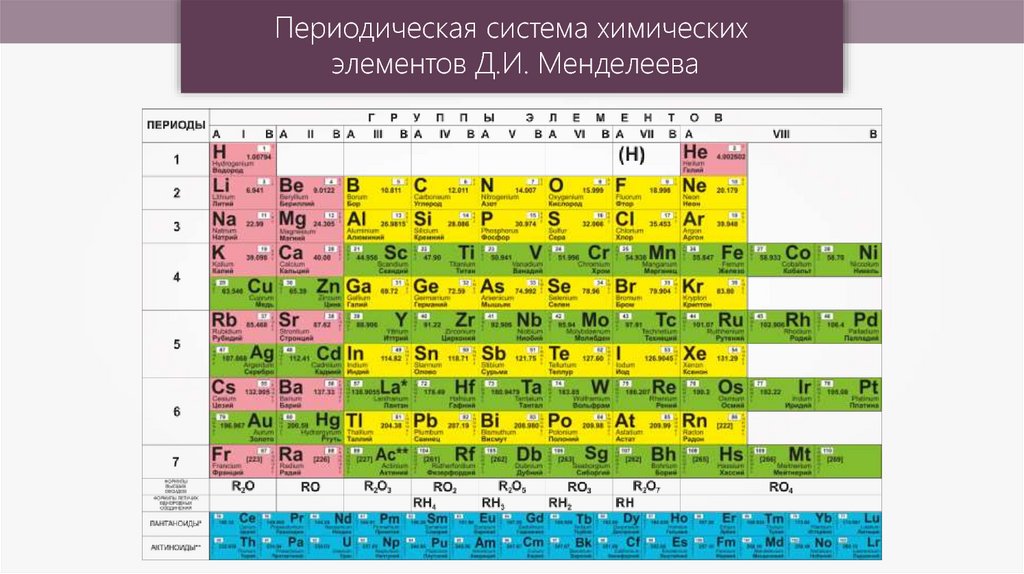
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.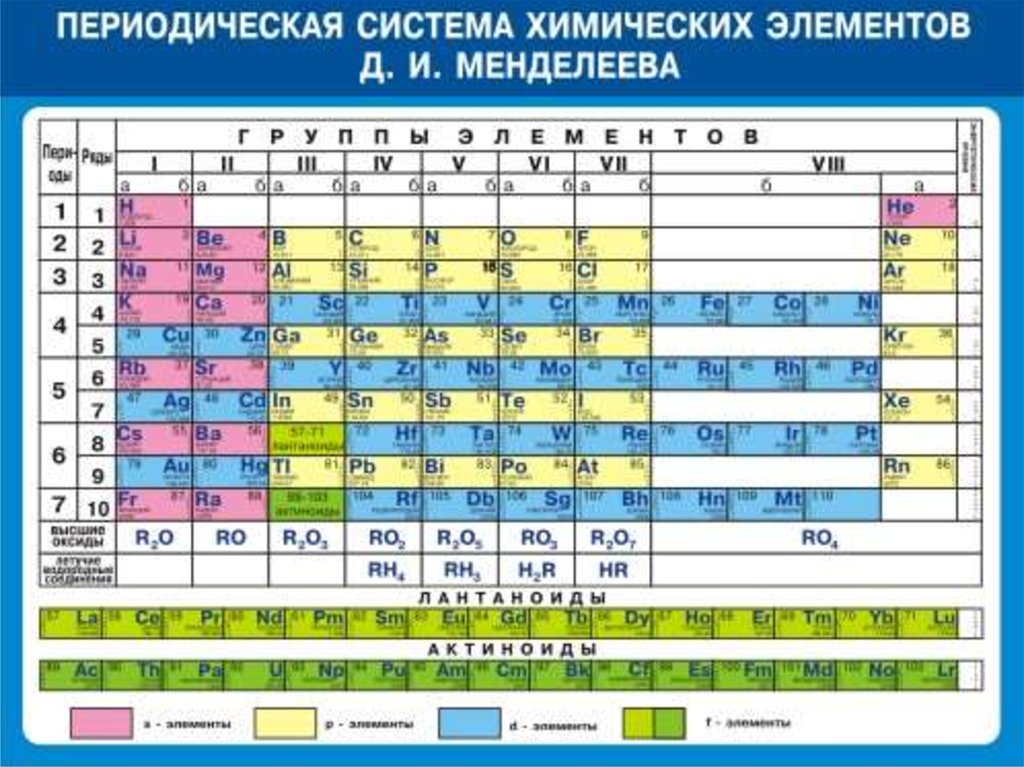
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Ксенон
| Ксенон | |
|---|---|
| Атомный номер | 54 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Свойства атома | |
|
Атомная масса (молярная масса) |
131,29 а. |
| Радиус атома | ? (108) пм |
|
Энергия ионизации (первый электрон) |
1 170,0 (12,13) кДж/моль (эВ) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p6 |
| Химические свойства | |
| Ковалентный радиус | 140[1]пм |
| Радиус иона | 190 пм |
|
Электроотрицательность (по Полингу) |
2,6 |
| Электродный потенциал | 0 |
| Степени окисления | 0, +1, +2, +4, +6, +8 |
| Термодинамические свойства простого вещества | |
| Плотность | 3,52 (при −109 °C) г/см³ |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Теплопроводность | 0,0057 Вт/(м·K) |
| Температура плавления | 161,3 K |
| Теплота плавления | 2,27 кДж/моль |
| Температура кипения | 166,1 K |
| Теплота испарения | 12,65 кДж/моль |
| Молярный объём | 42,9 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки | 6,200 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| Xe | 54 |
| 131,29 | |
| [Kr]4d105s25p6 | |
| Ксенон | |
Ксенон — элемент главной подгруппы восьмой группы, пятого периода периодической системы химических элементов, с атомным номером 54. Обозначается символом Xe (Xenon). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха. Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Обозначается символом Xe (Xenon). Простое вещество ксенон (CAS-номер: 7440-63-3) — инертный одноатомный газ без цвета, вкуса и запаха. Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
Происхождение названия
ξένος — чужой.
Распространённость
Ксенон относительно редок в атмосфере Солнца, на Земле, в составе астероидов и комет. Концентрация ксенона в атмосфере Марса аналогична земной: 0.08 миллионной доли, хотя содержание
Земная кора
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.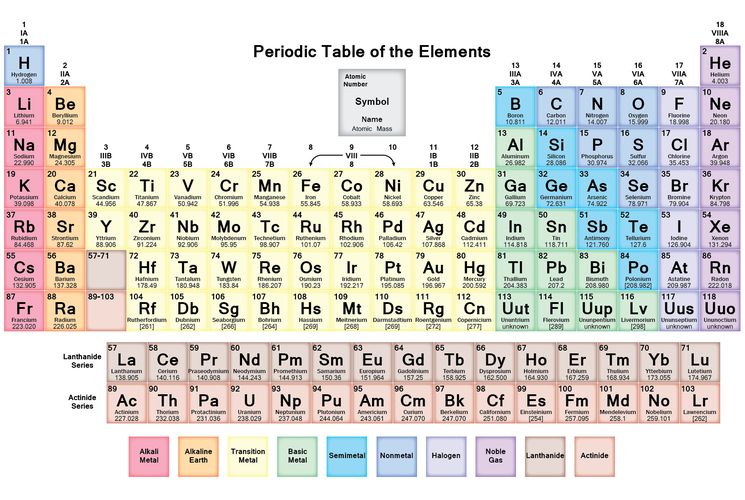
Определение
Качественно ксенон обнаруживают с помощью эмиссионной спектроскопии (характеристические линии 467,13 нм и 462,43 нм). Количественно его определяют масс-спектрометрически, хроматографически, а также методами абсорбционного анализа.
Физические свойства
Температура плавления −112 °C,температура кипения −108 °C,свечение в разряде фиолетовым цветом.
Химические свойства
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона.
Изотопы ксенона
Получение
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.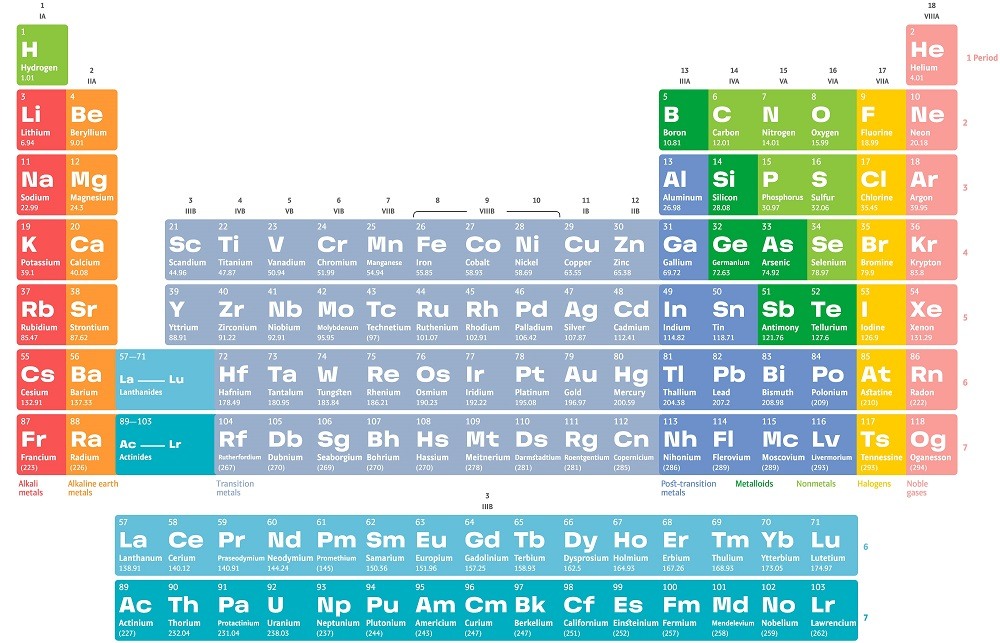
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон. Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Применение
Ксеноновая лампа-вспышка
Ксеноновая лампа
Прототип ионного двигателя на ксеноне.
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
-
Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).

- Радиоактивные изотопы (127Xe, 133Xe, 137Xe, и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
-
С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — как инертный газ — не вызывает химических последствий). Первые диссертации о технике ксенонового наркоза в России — 1993 г., в качестве лечебного наркоза эффективно применяется для снятия острых абстинентных состояний (Абстинентный синдром) и лечения наркомании, а также психических и соматических расстройств.

- Жидкий ксенон иногда используется как рабочая среда лазеров
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а так же в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния называемого гиперполяризацией.
- Ксенон используется в конструкции ячейки Голея.
Биологическая роль
Ксенон не играет никакой биологической роли.
Физиологическое действие
Газ ксенон безвреден, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80 %) вызывает асфиксию.
Фториды ксенона ядовиты, ПДК в воздухе 0,05 мг/м³.
Ксенон | Определение, свойства, атомная масса, соединения и факты
ксенон
Смотреть все медиа
- Ключевые люди:
- Сэр Уильям Рамзи
- Похожие темы:
- химический элемент благородный газ воздух ксенон-129
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
ксенон (Xe) , химический элемент, тяжелый и чрезвычайно редкий газ группы 18 (благородные газы) периодической таблицы. Это был первый благородный газ, образующий настоящие химические соединения. Ксенон более чем в 4,5 раза тяжелее воздуха, он бесцветен, не имеет запаха и вкуса. Твердый ксенон принадлежит к гранецентрированной кубической кристаллической системе, что означает, что его молекулы, состоящие из одиночных атомов, ведут себя как сферы, максимально плотно упакованные вместе. Название ксенон происходит от греческого слова 9.0027 ксенос , «чужой» или «чужой».
Это был первый благородный газ, образующий настоящие химические соединения. Ксенон более чем в 4,5 раза тяжелее воздуха, он бесцветен, не имеет запаха и вкуса. Твердый ксенон принадлежит к гранецентрированной кубической кристаллической системе, что означает, что его молекулы, состоящие из одиночных атомов, ведут себя как сферы, максимально плотно упакованные вместе. Название ксенон происходит от греческого слова 9.0027 ксенос , «чужой» или «чужой».
| atomic number | 54 |
|---|---|
| atomic weight | 131.29 |
| melting point | −111.9 °C (−169.4 °F) |
| boiling point | −108,0 °C (−162,4 °F) |
| плотность (1 атм, 0 °C [32 °F]) | 5,887 г/литр (0,078 унции/галлон) |
| степени окисления | 0, +2, +4, +6, +8 |
электрон конфиг. | (KR) 4 D 10 5 S 2 5 P 6 |
В НАСТОЯЩИХ ИСПОЛНИТЕЛЬНЫХ ИСПОЛНИТЕЛЬНЫХ ИСПОЛЬЗОВАНИЯХ В НАСТОЯЩИХ НАЗНАЧЕНИЯМ
x. до уровня около 0,0000086 процента, или около 1 части на 10 миллионов по объему сухого воздуха. Как и некоторые другие благородные газы, ксенон присутствует в метеоритах. Ксенон производится в небольших масштабах путем фракционной перегонки жидкого воздуха. Это наименее летучий (температура кипения -108,0 ° C [-162,4 ° F]) благородный газ, получаемый из воздуха. Британские химики сэр Уильям Рамзи и Моррис В. Трэверс выделили этот элемент в 189 г.8 повторной фракционной перегонкой благородного газа криптона, который они обнаружили шестью неделями ранее.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Элемент ксенон используется в лампах, которые производят очень короткие и интенсивные вспышки света, таких как стробоскопы и фонари для высокоскоростной фотографии. Когда электрический заряд проходит через газ при низком давлении, он испускает вспышку голубовато-белого света; при более высоких давлениях излучается белый свет, напоминающий дневной свет. Ксеноновые лампы-вспышки используются для активации рубиновых лазеров.
Когда электрический заряд проходит через газ при низком давлении, он испускает вспышку голубовато-белого света; при более высоких давлениях излучается белый свет, напоминающий дневной свет. Ксеноновые лампы-вспышки используются для активации рубиновых лазеров.
Ксенон природный представляет собой смесь девяти стабильных изотопов в следующих процентных соотношениях: ксенон-124 (0,096), ксенон-126 (0,090), ксенон-128 (1,92), ксенон-129 (26,44), ксенон-130 (4,08) , ксенон-131 (21,18), ксенон-132 (26,89), ксенон-134 (10,44) и ксенон-136 (8,87). Массовые числа известных изотопов ксенона колеблются от 118 до 144. Ксенон, обнаруженный в некоторых каменных метеоритах, показывает большую долю ксенона-129, который считается продуктом радиоактивного распада йода-129, период полураспада которого составляет 17 000 000 лет. годы. Измерение ксенона-129Содержание метеоритов проливает свет на историю Солнечной системы. Известно более десятка радиоактивных изотопов ксенона, образующихся при делении урана и других ядерных реакциях. Например, ксенон-135 (период полураспада 9,2 часа) производится при делении урана в ядерных реакторах, где он создает проблемы, поскольку поглощает нейтроны, вызывающие деление. Ксенон-129 имеет особое значение, поскольку этот изотоп можно наблюдать с помощью спектроскопии ядерного магнитного резонанса, что делает его полезным для структурной характеристики соединений ксенона. Изотопы ксенона, образующиеся в наибольшем количестве при делении ядер, – это ксенон-131, -132, -134 и -136, которые являются стабильными, и ксенон-133, который является радиоактивным с периодом полураспада 5,27 дня.
Например, ксенон-135 (период полураспада 9,2 часа) производится при делении урана в ядерных реакторах, где он создает проблемы, поскольку поглощает нейтроны, вызывающие деление. Ксенон-129 имеет особое значение, поскольку этот изотоп можно наблюдать с помощью спектроскопии ядерного магнитного резонанса, что делает его полезным для структурной характеристики соединений ксенона. Изотопы ксенона, образующиеся в наибольшем количестве при делении ядер, – это ксенон-131, -132, -134 и -136, которые являются стабильными, и ксенон-133, который является радиоактивным с периодом полураспада 5,27 дня.
Соединения
Инертные газы считались химически инертными до 1962 года, когда британский химик Нил Бартлетт получил первое соединение благородных газов, желто-оранжевое твердое вещество, которое лучше всего можно составить в виде смеси [XeF + ][ PtF 6 – ], [XeF + ][ Pt 2 F 11 – ] и PtF 5 . Ксенон имеет самый обширный химический состав в группе 18 и проявляет степени окисления + 1 / 2 , +2, +4, +6 и +8 в соединениях, которые он образует. С момента открытия реакционной способности благородных газов были синтезированы и структурно охарактеризованы соединения ксенона, включая галогениды, оксиды, оксофториды, оксосоли и многочисленные ковалентные производные с рядом соединений, ковалентно связанных с другими многоатомными лигандами. Как можно было бы предсказать по положению ксенона в периодической таблице, соединения ксенона являются более слабыми окислителями, чем соединения криптона. Следовательно, большая часть известной в настоящее время химии ксенона включает его фториды и оксофториды в их реакции с сильными акцепторами кислоты Льюиса и донорами фторид-ионов с образованием различных фтор- и оксофторкатионов и анионов соответственно. В настоящее время известны примеры ксенона, ковалентно связанного с фтором, кислородом, азотом и углеродом.
Ксенон имеет самый обширный химический состав в группе 18 и проявляет степени окисления + 1 / 2 , +2, +4, +6 и +8 в соединениях, которые он образует. С момента открытия реакционной способности благородных газов были синтезированы и структурно охарактеризованы соединения ксенона, включая галогениды, оксиды, оксофториды, оксосоли и многочисленные ковалентные производные с рядом соединений, ковалентно связанных с другими многоатомными лигандами. Как можно было бы предсказать по положению ксенона в периодической таблице, соединения ксенона являются более слабыми окислителями, чем соединения криптона. Следовательно, большая часть известной в настоящее время химии ксенона включает его фториды и оксофториды в их реакции с сильными акцепторами кислоты Льюиса и донорами фторид-ионов с образованием различных фтор- и оксофторкатионов и анионов соответственно. В настоящее время известны примеры ксенона, ковалентно связанного с фтором, кислородом, азотом и углеродом.
Известны три фторида ксенона: XeF 2 (самый простой в приготовлении), XeF 4 и XeF 6 . Это стабильные бесцветные кристаллические вещества, которые можно сублимировать в вакууме при 25 ° C (77 ° F). Как и KrF 2 , XeF 2 представляет собой линейную симметричную молекулу. Тетрафторид ксенона (XeF 4 ) представляет собой квадратную плоскую молекулу, а XeF 6 в газовой фазе представляет собой искаженную октаэдрическую молекулу, возникающую из-за наличия «лишней» пары несвязывающих электронов в валентной оболочке ксенона. Высшие галогениды, такие как XeCl 2 , XeClF, XeBr 2 и XeCl 4 термодинамически нестабильны и были обнаружены только в небольших количествах. Нестабильные и короткоживущие моногалогениды XeF, XeCl, XeBr и XeI были получены в газовой фазе и имеют большое значение в качестве светоизлучающих частиц в газовых лазерах.
Это стабильные бесцветные кристаллические вещества, которые можно сублимировать в вакууме при 25 ° C (77 ° F). Как и KrF 2 , XeF 2 представляет собой линейную симметричную молекулу. Тетрафторид ксенона (XeF 4 ) представляет собой квадратную плоскую молекулу, а XeF 6 в газовой фазе представляет собой искаженную октаэдрическую молекулу, возникающую из-за наличия «лишней» пары несвязывающих электронов в валентной оболочке ксенона. Высшие галогениды, такие как XeCl 2 , XeClF, XeBr 2 и XeCl 4 термодинамически нестабильны и были обнаружены только в небольших количествах. Нестабильные и короткоживущие моногалогениды XeF, XeCl, XeBr и XeI были получены в газовой фазе и имеют большое значение в качестве светоизлучающих частиц в газовых лазерах.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Известны два оксида ксенона: триоксид ксенона (XeO 3 ) и четырехокись ксенона (XeO 4 ), и оба являются нестабильными, взрывоопасными твердыми веществами, с которыми необходимо обращаться с величайшей осторожностью. The oxide fluorides XeO 3 F 2 , XeO 2 F 4 , XeOF 4 , XeO 2 F 2 , and XeOF 2 are known and, with the exception of XeOF 4 , все они термодинамически нестабильны.
The oxide fluorides XeO 3 F 2 , XeO 2 F 4 , XeOF 4 , XeO 2 F 2 , and XeOF 2 are known and, with the exception of XeOF 4 , все они термодинамически нестабильны.
Дифторид ксенона ведет себя как простой донор ионов фтора по отношению ко многим пентафторидам металлов с образованием комплексных солей, содержащих XeF + и Xe 2 F 3 + [F(XeF) 2 ] + катионы по аналогии с KrF 2 ( соединения см. kryton). Смеси газообразных ксенона и фтора самопроизвольно реагируют с жидким пентафторидом сурьмы в темноте с образованием растворов XeF + Sb 2 F 11 − , в которых в качестве промежуточного продукта образуется Xe 2 + который впоследствии окисляется фтором до XeF + катион. Ярко-изумрудно-зеленый, парамагнитный катион диксенона, Xe 2 + , является единственным примером ксенона в фракционной степени окисления, + 1 / 2 .
Тетрафторид ксенона является гораздо более слабым донором фторид-ионов, чем XeF 2 , и образует стабильные комплексные соли только с самыми сильными акцепторами фторид-ионов с образованием таких соединений, как [XeF 3 + ][SbF 6 − ] и [XeF 3 + ][Sb 2 F 11 − ]. Также было показано, что тетрафторид ксенона ведет себя как слабый акцептор фторид-иона по отношению к фторид-иону с образованием солей пятиугольного плоского аниона XeF 5 – . Дифторид оксида ксенона также является акцептором ионов фтора, образуя единственный другой анион, содержащий ксенон в степени окисления +4, анион XeOF 3 – в Cs + XeOF 3 – .
Гексафторид ксенона является как сильным донором фторид-ионов, так и сильным акцептором фторид-ионов. Примеры солей, содержащих XeF 9Катионы 0111 5 + многочисленны, с противоанионами, такими как PtF 6 – и AuF 6 – . Также известны примеры солей, содержащих мостиковый фторидный катион Xe 2 F 11 + . Гексафторид ксенона ведет себя как акцептор ионов фтора, реагируя с фторидами щелочных металлов с образованием солей, содержащих анионы XeF 7 – и XeF 8 2- . Было показано, что несколько солей нещелочных металлов содержат анионы XeF 7 – и XEF 8 2– и включают [NF 4 + ] [XEF 7 – ] и [№ + 11111111111111111111111111111111111111111111111111111111111111111111111111111111111111129н. 2− ].
Также известны примеры солей, содержащих мостиковый фторидный катион Xe 2 F 11 + . Гексафторид ксенона ведет себя как акцептор ионов фтора, реагируя с фторидами щелочных металлов с образованием солей, содержащих анионы XeF 7 – и XeF 8 2- . Было показано, что несколько солей нещелочных металлов содержат анионы XeF 7 – и XEF 8 2– и включают [NF 4 + ] [XEF 7 – ] и [№ + 11111111111111111111111111111111111111111111111111111111111111111111111111111111111111129н. 2− ].
Оксофториды ксенона +6, XeOF 4 и XeO 2 F 2 , проявляют аналогичные свойства донора и акцептора фторид-ионов. Соли как катионов XeOF 3 + , так и XeO 2 F + , а также соль фторид-мостикового катиона Xe 2 O 4 F 3 + , известны. К ним относятся [XEOF 3 + ] [SBF 6 – ] и [XE 2 O 4 F 3 + ] [ASF 1 70112 . + ]. Известно несколько комплексов фторидов щелочных металлов с XeOF 4 , таких как 3KF∙XeOF 4 и CsF∙3XeOF 4 . Структурные исследования показывают, что комплексы CsF и N(CH 3 ) 4 F лучше всего формулировать как [Cs + ] [XEOF 5 – ], [N (CH 3 ) 4 + ] [XEOF 5 – ] и [CS + 808080]. 4 ) 3 F − ]. В этих соединениях XeOF 4 ведет себя как акцептор фтора. Единственными комплексами XeO 2 F 2 с сильным донором фторид-иона являются соли [Cs + ][XeO 2 F 3 − ] и [NO 907 + 20080 ][XeO 2 F 3 ∙XeO 2 F 2 − ].
К ним относятся [XEOF 3 + ] [SBF 6 – ] и [XE 2 O 4 F 3 + ] [ASF 1 70112 . + ]. Известно несколько комплексов фторидов щелочных металлов с XeOF 4 , таких как 3KF∙XeOF 4 и CsF∙3XeOF 4 . Структурные исследования показывают, что комплексы CsF и N(CH 3 ) 4 F лучше всего формулировать как [Cs + ] [XEOF 5 – ], [N (CH 3 ) 4 + ] [XEOF 5 – ] и [CS + 808080]. 4 ) 3 F − ]. В этих соединениях XeOF 4 ведет себя как акцептор фтора. Единственными комплексами XeO 2 F 2 с сильным донором фторид-иона являются соли [Cs + ][XeO 2 F 3 − ] и [NO 907 + 20080 ][XeO 2 F 3 ∙XeO 2 F 2 − ].
При гидролизе XeF 6 в сильнощелочном растворе часть ксенона теряется в виде газа (восстанавливается до степени окисления 0), но большая часть осаждается в виде перксената (XeO 6 4− ) соль, в которой ксенон находится в степени окисления +8. Соли кинетически очень стабильны и постепенно теряют воду при нагревании; например, Na 4 XeO 6 ∙6H 2 O становится безводным при 100 °C (212 °F) и разлагается при 360 °C (680 °F).
Ксенаты щелочных металлов состава MHXeO 4 ∙1,5H 2 O, где М – натрий, калий, рубидий или цезий, а ксенон находится в степени окисления +6. Ксенаты представляют собой нестабильные взрывчатые вещества. Фтороксенаты щелочных металлов [K + ][XeO 3 F − ], [Rb + ][XeO 3 F − ], [Cs + ][ ][0111 3 F − ] (разлагается при температуре выше 200 °C [392 °F]) и хлороксенат [Cs + ][XeO 3 Cl − ] (разлагается при температуре выше 150 °C [302 °F]) были приготовлены выпариванием водных растворов XeO 3 и соответствующих фторидов и хлоридов щелочных металлов. Фтороксенаты щелочных металлов являются наиболее стабильными известными твердыми кислородными соединениями ксенона (+6). Однако CsXeO 3 Br нестабилен даже при комнатной температуре.
Фтороксенаты щелочных металлов являются наиболее стабильными известными твердыми кислородными соединениями ксенона (+6). Однако CsXeO 3 Br нестабилен даже при комнатной температуре.
Ряд многоатомных лигандов с высокой эффективной групповой электроотрицательностью образует соединения с ксеноном. Наибольшее разнообразие групп многоатомных лигандов, связанных с ксеноном, встречается у ксенона в его степени окисления +2, и групп, связанных через кислород, больше всего. Как моно-, так и дизамещенные производные, имеющие составы FXeL и XeL 2 известны, например, где L = OTeF 5 и OSeF 5 .
Высокоэлектроотрицательная группа OTeF 5 − точно имитирует способность F − стабилизировать степени окисления ксенона со стабильными производными OTeF 5 − , также существующими для окисления +4 и +6 состояния ксенона. Также известны катионы, содержащие группу (OTeF 5 ) + .
Несколько групп лигандов образуют соединения, содержащие связи ксенон-азот. Среди первых соединений, связанных ксенон-азот, которые должны были быть получены, были FXe[N(SO 2 F) 2 ] и Xe[N(SO 2 F) 2 ] 2 . Подобно XeF 2 и KrF 2 , FXe[N(SO 2 F) 2 ] является донором фторид-иона по отношению к AsF 5 , образуя [XeN(SO 2 2 F) + ][AsF 6 − ]. Как и KrF + , катион XeF + ведет себя как акцептор электронной пары по отношению к азотистым основаниям Льюиса, но поскольку XeF + не является таким сильным окислителем, как KrF + , диапазон лигандов, которые могут быть согласованы с XeF + , более обширен. К ним относятся HCN и (CH 3 ) 3 CCN, которые взаимодействуют с XeF + с образованием катионов HCNXeF + и (CH 3 ) 3 CCNXeF + + 9 соответственно.
Известен ряд соединений, содержащих связи Xe-C. Эти соединения представляют собой соли катионов, содержащих ксенон (+2), координированных с углеродом, и включают такие катионы, как (C 6 F 5 )Xe + и ( m -CF 3 C 6 H 4 )Xe + . Также известен пример ксенона (+4), связанного с углеродом. Катион (C 6 F 5 )XeF 2 + получен в виде соли BF 4 − .
Эта статья была недавно отредактирована и обновлена Адамом Августином.
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Вернуться к списку элементов
| Ксенон | используется в сверхъярких лампах для наблюдения за морскими глубинами. |
| Атомный номер: | 54 | Атомный радиус: | 216 часов (Ван-дер-Ваальс) |
| Атомарный символ: | Хе | Температура плавления: | -111,75 °С |
| Атомный вес: | 131,3 | Точка кипения: | -108,099 °С |
| Электронная конфигурация: | [Kr]5s 2 4d 10 5p 6 | Степени окисления: | 0 , +1, +2, +4, +6, +8(редко больше 0; слабокислотный оксид) |
История
От греческого слова ксенон , незнакомец.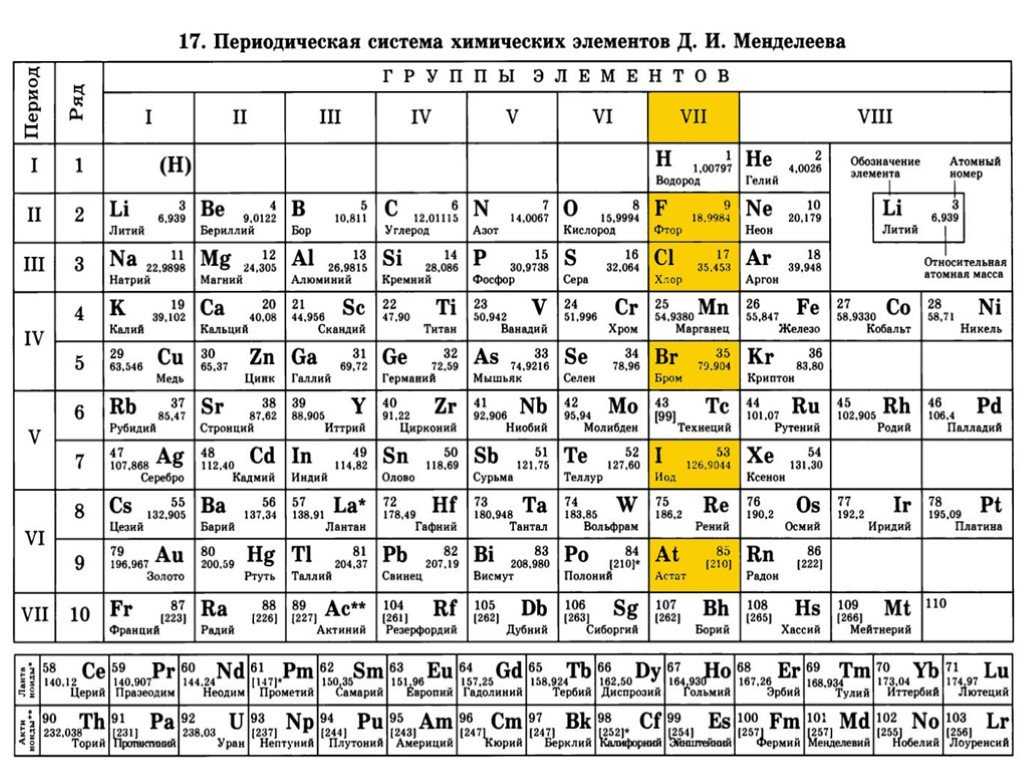 Обнаружен в 189 г.8 Рамзи и Трэверс в остатках, оставшихся после испарения жидкого воздуха. Ксенон входит в состав так называемых благородных или «инертных» газов. Он присутствует в атмосфере примерно в количестве одной двадцатимиллионной части. Ксенон присутствует в марсианской атмосфере в количестве 0,08 промилле. этот элемент содержится в газах, выделяющихся из некоторых минеральных источников, и в коммерческих целях его получают путем извлечения из жидкого воздуха.
Обнаружен в 189 г.8 Рамзи и Трэверс в остатках, оставшихся после испарения жидкого воздуха. Ксенон входит в состав так называемых благородных или «инертных» газов. Он присутствует в атмосфере примерно в количестве одной двадцатимиллионной части. Ксенон присутствует в марсианской атмосфере в количестве 0,08 промилле. этот элемент содержится в газах, выделяющихся из некоторых минеральных источников, и в коммерческих целях его получают путем извлечения из жидкого воздуха.
Изотопы
Природный ксенон состоит из девяти стабильных изотопов. В дополнение к ним были охарактеризованы 20 нестабильных изотопов. До 1962, обычно предполагалось, что ксенон и другие инертные газы не способны образовывать соединения. В последние несколько лет накапливаются доказательства того, что ксенон, как и другие элементы с нулевой валентностью, действительно образует соединения. Среди «соединений» ксенона, о которых в настоящее время сообщается, перксенат натрия, дейтерат ксенона, гидрат ксенона, дифторид, тетрафторид и гексафторид.