Ядерная теория – Справочник химика 21
Эмоциональные утверждения (Э). Пункт основан на эмоциях и отражает определенное предубеждение (в пользу или против ядерной теории). Заметьте, что для таких пунктов можно найти и научные доказательства, и научные опровержения. [c.364]Наиболее бурно развивалось учение о строении вещества, в особенности о строении атомов и молекул. Первым крупным достижением в этой области была ядерная теория атома, предложенная Резерфордом (1911), которая вскоре получила развитие в первой количественной теории атома водорода, разработанной Бором (1913). [c.18]
Последующее развитие наших знаний о строении атома подтвердило основные представления ядерной теории атома. [c.27]
В начале курса мы ознакомились с ядерной теорией строения атома, рассмотрели структуру)электронных оболочек, окружающих ядро, и их роль в химических процессах.
Ядерная теория строения атома. Ряд фактов указывает на то, что атом не является неделимой частицей. На это указывают простейшие опыты электризации тел трением. Металл, теряя при нагревании отрицательно заряженные частицы —электроны, сам заряжается положительно. Далее, известны явления самопроизвольного распада атомов некоторых элементов с образованием более мелких электрически заряженных частиц. Это—явление радиоактивности, которое более подробно рассматривается ниже.
Ядерная теория строения атома. Электроны выделяются из [c.39]
Резерфорд в 1911 г. предложил так называемую ядерную теорию строения атома. Согласно этой теории в центре атома находится положительно заряженное ядро, вокруг которого вращаются электроны. В целом атом электронейтрален, так как суммарный заряд электронов численно равен положительному заряду ядра. Масса электронов ничтожно мала, следовательно, практически вся масса атома сконцентрирована в его ядре. Размер ядра по сравнению с размером атома чрезвычайно мал. Объем, занимаемый атомными ядрами, составляет примерно только 10 от общего объема атомов. Отсюда следует, что плотность атомных ядер очень велика. Если бы удалось собрать 1 сж атомных ядер, то их масса была бы около 116 млн. т (116 Тг)
Какие опыты привели к ядерной теории строения атома
Теория Бора.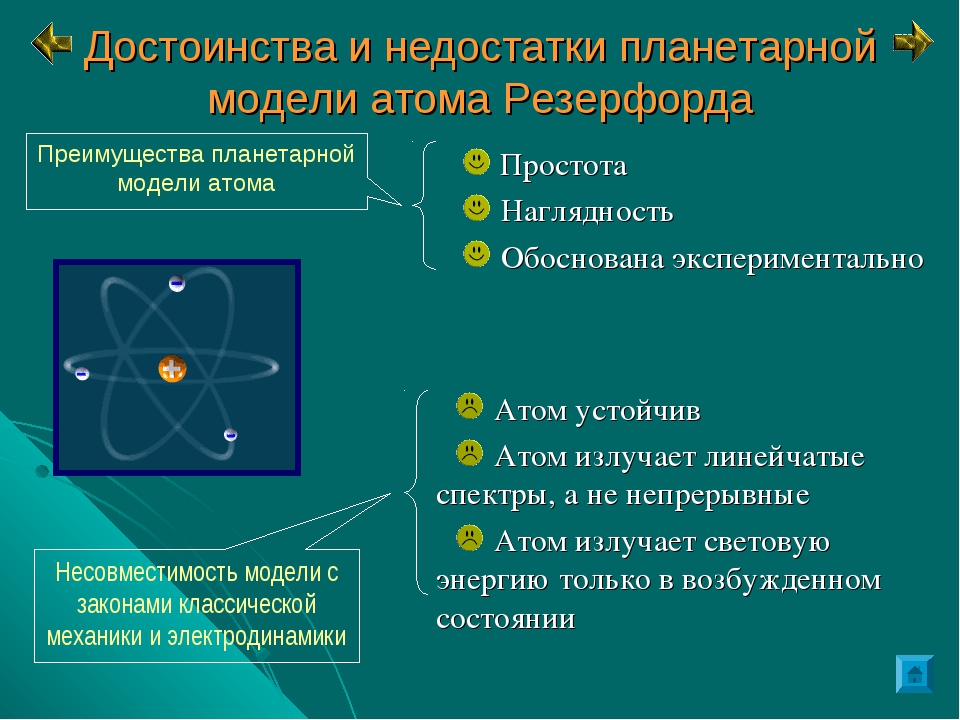 Предложенная Э. Резерфордом ядерная теория строения атома получила широкое распространение. Однако [c.44]
Предложенная Э. Резерфордом ядерная теория строения атома получила широкое распространение. Однако [c.44]
Так как атомы электронейтральны, то, следовательно, в них должны содержаться и какие-то частицы, заряженные положительно. В изучении внутреннего строения атомов очень важное значение имели опыты по рассеянию а-частиц при прохождении их в газе и через металлическую фольгу (а-частицы заряжены положительно). В камере Вильсона наблюдаются прямолинейные пути а-частиц в газе. Следовательно, а-частица проходит сквозь атомы. Однако она, хотя и редко, но резко отклоняется от прямолинейного пути, что указывает на столкновение ее с положительно заряженной частицей. Эти наблюдения привели к выводу, что атом состоит из положительно заряженного ядра весьма малого объема ( 10″ см), в котором сосредоточена почти вся масса атома, и электронов, находящихся на значительном расстоянии от ядра. На основании обобщения экспериментальных данных, Резерфорд в 1911 г. предложил планетарную модель атома, согласно которой атом в целом нейтрален, а положительно заряженное ядро его окружено электронами, причем число их равно заряду ядра (порядковому номеру элемента).
Наиболее бурно развивалось учение о строении вещества, в особенности о строении атомов и молекул. Изучение явления радиоактивности с несомненностью показало, что атомы не являются простейшими частицами, а построены из еще более простых частиц. Отсюда получило начало систематическое изучение строения атомов. Первым крупным достижением в этой области была ядерная теория атома, предложенная Резерфордом (1911) на основе результатов экспериментальных исследований, проведенных им и его школой. Эта теория вскоре получила развитие в первой количественной теории атома водорода, разработанной Бором (1913), выводы которой получили блестящее подтверждение в экспериментальных данных о спектрах водорода в различных условиях.
 22]
22] Эта атака началась примерно 70 лет тому назад, когда ученые столкнулись с явлением радиоактивного распада, рассматривая последний как внутриатомный процесс. Более действенными атаками следует считать те, которые опирались на ядерную теорию Резерфорда и новую константу, открытую Мозели — порядковый номер элемента к этому времени (1911—1914 гг.) окончательно сформировались понятия об изотопах и изобарах. Периодическая система Менделеева оказала неоценимую услугу в раскры-
Ядерная теория стала плодотворно развиваться после того, как советскими учеными Д. Д. Иваненко и Е. И. Гапоном в 1932 г. и независимо от них немецким ученым Гейзенбергом была предложена протонно-нейтронная модель строения ядра. Эта модель опиралась на две основные количественные характеристики ядер порядковый номер — 1 и массовое число — А. [c.148]
Основное положение ядерной теории можно сформулировать так ядра всех атомов, кроме легкого атома водорода, состоят из протонов и нейтронов (оба вида частиц объединяют общим названием нуклоны).
Более детального развития теории строения атома Бор достиг, исходя из модели Резерфорда. Основываясь на опытах по рассеянию а-частиц тонкими металлическими пленками, Резерфорд, как известно, предложил так называемую ядерную теорию атомов, которая предполагает, что атом состоит из тяжелого положительно заряженного ядра (размеры которого малы по сравнению с размерами всего атома) и вращающихся вокруг него электронов. Заряд ядра равен Ее, где е—заряд электрона, а Е — зарядовое число элемента, равное его порядковому номеру в периодической
Однако уже в 1911 г. известный английский ученый Эрнест Резерфорд обосновал динамическую или ядерную теорию строения атома. а-Частицы вызывают вспьинку при ударе об экран, покрытый слоем сульфида цинка, что делает возможным их подсчет. Резерфорд, наб-, людая прохождение а-частиц через тонкую /0 металлическую пластинку, обнаружил, что
а-Частицы вызывают вспьинку при ударе об экран, покрытый слоем сульфида цинка, что делает возможным их подсчет. Резерфорд, наб-, людая прохождение а-частиц через тонкую /0 металлическую пластинку, обнаружил, что
Я хорошо полшю, как ко мне… пришел Мозли, чтобы обсудить вместе со ашою план следующей работы. Он наметил четыре или пять возможных направлений исследования, которые он считал интересными, и среди них было одно, которое сразу привлекло и меня. А именно, он хотел непосредственно доказать, зависят ли свойства элемента от его атомного веса, как это предполагалось в периодическом законе Менделеева, или же они определяются его порядковым числом или атомным номером, как представлялось вероятным согласно ядерной теории . [c.58]
Уже в 1911 г. Резерфорд предложил ядерную теорию атома. В 1916 г. были опубликованы знаменитые статьи Косселя [3] и Льюиса [4]. По представлениям этих авторов, электроны в атомах образуют концентрические оболочки первая из них содержит два электрона дублет), вторая и третья — по восьми.

Так возникло определение Панета, которое полностью вытекало из электронно-ядерной теории. G точки зрения атомной модели Резерфорда—Бора,— писал Панет,— такое теоретическое определение будет гласить следующее элемент есть вещество, все атомы которого имеют одинаковый ядерный заряд i. [c.198]
основные сведения, из каких частиц состоит, описание структуры
Сегодня даже дети дошкольного возраста знают, что все вокруг состоит из молекул и атомов. А вот что это такое и из чего они, в свою очередь, состоят — знает далеко не каждый взрослый. В этой статье просто и доступно, поделимся современными знаниями о мельчайших частицах.
Что такое атом — история открытия
Итак, все окружающие нас объекты и мы сами состоим из крошечных частиц, которые называются атомами. В их состав входят еще меньшие частицы: протоны, нейтроны и электроны. Современное строение атома наука открыла сравнительно недавно, до этого его долго считали неделимой частицей.
Мысль о том, что все вокруг состоит из мельчайших, невидимых глазу частиц возникла в Древней Греции и Древней Индии еще до нашей эры. Древнегреческий философ Демокрит был материалистом. Именно он первым ввел в обиход понятие атома (с греческого — atomos — неделимый). Демокрит считал, что невидимые частицы вечны, их бесчисленное множество, они постоянно двигаются, обладают весом, размером и формой.
Последующее развитие теория атомизма получила в Средние века и Новое время в работах французского физика Пьера Гассенди (1592—1655 гг.) и английского ученого Роберта Бойля (1627-1691 гг.).
Развитием атомистической теории и превращением ее в атомно-молекулярное учение занимались также Ломоносов, Лавуазье, Дальтон.
Долгое время атом считали элементарной, т.е. неделимой частицей. Но в 1897 году Джозеф Дж. Томсон открыл первую субатомную частицу — электрон. Это открытие имело огромное значение. Ученый впервые предложил определенную структуру строения, считавшейся ранее неделимой частицы, которая получила название «пудинг с изюмом».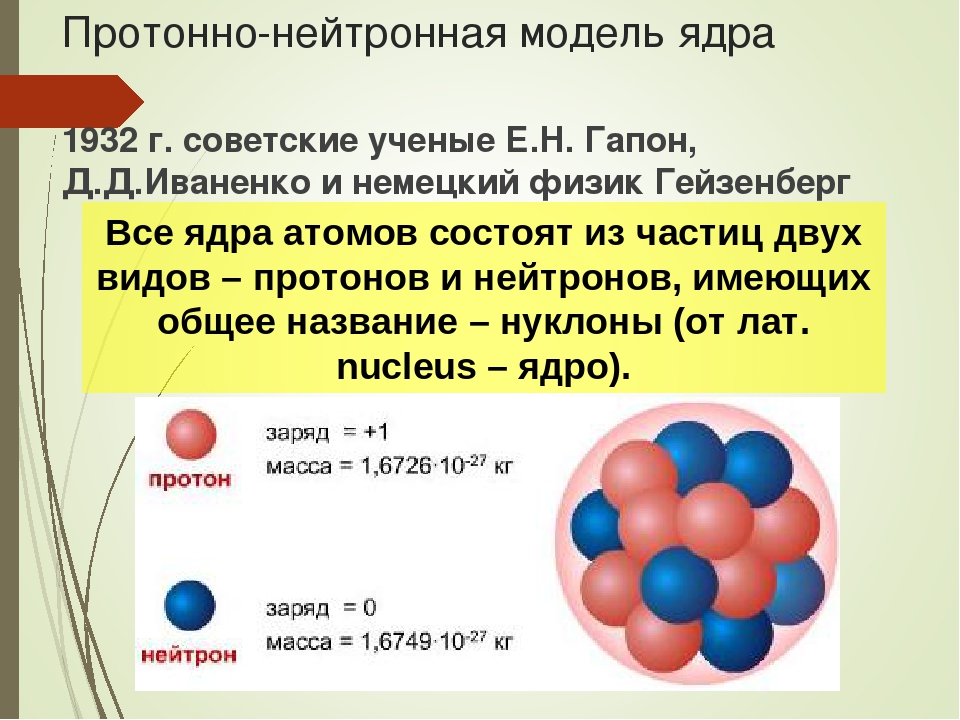 Согласно этой модели атом — это положительно заряженная сфера, внутри которой находятся отрицательно заряженные электроны.
Согласно этой модели атом — это положительно заряженная сфера, внутри которой находятся отрицательно заряженные электроны.
Но теорию Томсона опроверг Эрнест Резерфорд. В 1917 году британским физиком было совершено открытие протона — положительно заряженной элементарной частицы. Открыв протон, Резерфорд предположил и наличие нейтронов — нейтрально заряженных частиц в атоме. Позже их существование экспериментально подтвердил Джеймс Чэдвик. Основываясь на своем открытии, Резерфорд предложил свое описание атомной модели: положительно заряженное ядро и окружающие его электроны.
В 1913 году датчанин Нильс Бор предложил свой вариант строения атома, получивший название «планетарной модели». Согласно теории Бора, электроны находятся на определенном расстоянии от атомного ядра и вращаются по специальным орбитам (по аналогии с планетами, вращающимися вокруг Солнца).
В начале XX века планетарную модель заменила волновая модель, принятая научным сообществом во всем мире.
Современные представления о строении атома были бы невозможны без открытия элементарных частиц и явления радиоактивности. Огромный вклад в науку, помимо вышеназванных ученых, внесли Эрвин Шредингер, Макс Планк, Вольфганг Паули.
Огромный вклад в науку, помимо вышеназванных ученых, внесли Эрвин Шредингер, Макс Планк, Вольфганг Паули.
Атомная структура — современные знания
Источник: infourok.ruНа чем базируется, из скольки главных частиц состоит
Основу современных представлений теории атомизма составляют следующие положения:
- Атом состоит из ядра и окружающей его электронной оболочки.
- Электронная оболочка представляет собой движущиеся вокруг ядра электроны.
- Ядро всегда положительно заряжено — оно состоит из протонов, обозначающихся символом — p и нейтронов — n. Заряд ядра всегда равен сумме протонов в нем.
- Атом электронейтрален, так как число отрицательных частиц — электронов (е–) равняется числу положительных частиц — протонов (p+).
- Его электронейтральность может нарушаться, при условии, что он отдает или присоединяет электроны, при этом он становится положительно или отрицательно заряженным ионом соответственно.

- Электроны располагаются вокруг ядра в трехмерном пространстве. Они находятся в специальных областях, которые называют орбиталями. Каждая из этих областей характеризуется формой, размером и ориентацией внутри атома, каждой из орбиталей присваивается буквенно-цифровое обозначение.
Свойства, масса и размер
Большую часть атома составляет полупустое пространство, заполненное электронами. Ядро — это самая тяжелая (99,97% от массы атома) и одновременно самая маленькая его часть. В ядре как раз и сосредоточена практически вся масса атома. Ее измеряют в а.е.м. — атомных единицах массы. Атомная единица массы равна массе 1/12 части атома углерода, свободно покоящегося и находящегося в основном состоянии. В химии используют «моль» для измерения атомной массы. {-12}\). А радиус ядра в 10 000 раз меньше радиуса атома.
{-12}\). А радиус ядра в 10 000 раз меньше радиуса атома.
Электронно-графическая формула
Источник: en.ppt-online.orgПериодическая система и строение атома, какая взаимосвязь
В таблице Менделеева указывается относительная атомная масса химических элементов.
Количество протонов в ядре соответствует порядковому номеру химического элемента в известной таблице Менделеева. Заряд ядра — это главная характеристика атома, которая влияет на распределение вещества в таблице Менделеева.
Количество нейтронов в таблице не указывается, их можно рассчитать, вычтя из массы атома порядковый номер химического вещества (число его протонов).
Почему ядро не распадается
Науке известно 4 основных вида взаимодействия между телами и частицами:
- слабое;
- сильное;
- электромагнитное;
- гравитационное.
Внутри атома, в его ядре, между протонами и нейтронами существует сильное взаимодействие, которое не позволяет ядру с легкостью распадаться.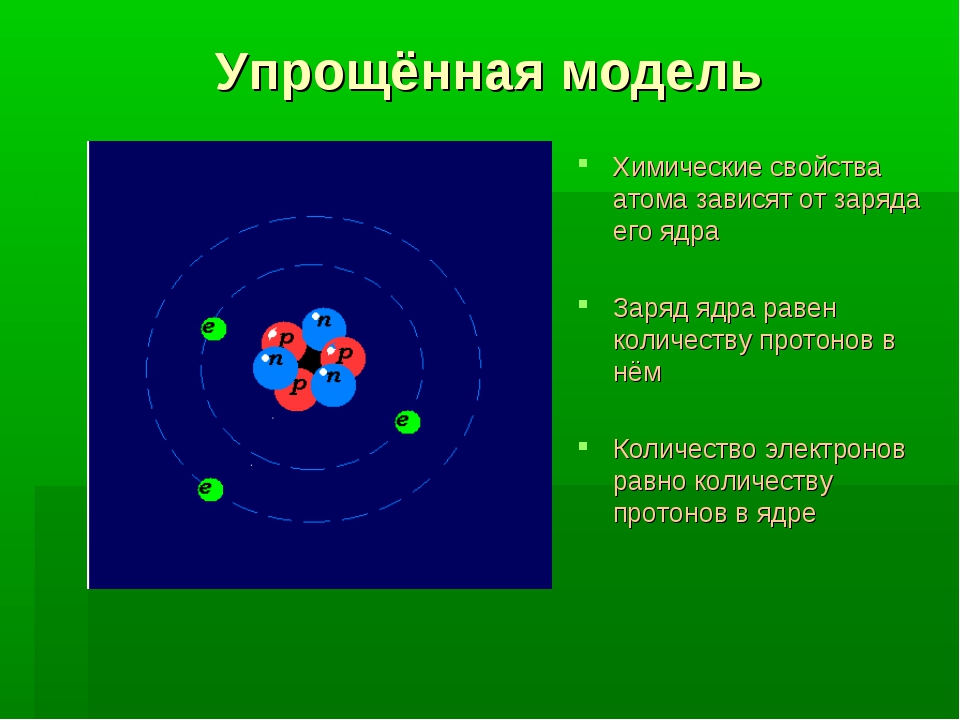 В середине XX века человечество обнаружило, что при расщеплении ядер происходит высвобождение огромной энергии, что послужило толчком для развития атомной промышленности и ядерного оружия.
В середине XX века человечество обнаружило, что при расщеплении ядер происходит высвобождение огромной энергии, что послужило толчком для развития атомной промышленности и ядерного оружия.
Атомистическая теория — не самая сложная тема, которая есть в физике и химии. Если столкнулись с заданиями посложнее и не понимаете, с чего начать, ищите помощи у специалистов Феникс.Хелп!
ТОПОЛОГИЧЕСКАЯ ТЕОРИЯ СТРОЕНИЯ АТОМОВ: zonasingularn — LiveJournal
Приложение к роману “Рай под колпаком”(c) Виталий Забирко
Ядерная физика как наука началась с того момента, когда Резерфорд нарисовал на доске мелом планетарную модель атома. Как в последующем бурном развитии ядерной физики, так и на настоящий момент планетарная модель является основополагающим постулатом, на котором зиждется современная концепция строения микромира. Все результаты научных экспериментов втискивались в прокрустово ложе планетарной модели, в результате чего было выведено заключение, что физические законы микромира имеют мало общего с законами общей физики. Отсюда многочисленные правила, запреты и ограничения, регламентирующие физические законы микромира. Вместе с тем в общепризнанной теории строения атомов имеются некоторые аспекты, которые до сих пор не поддаются объяснению.
Отсюда многочисленные правила, запреты и ограничения, регламентирующие физические законы микромира. Вместе с тем в общепризнанной теории строения атомов имеются некоторые аспекты, которые до сих пор не поддаются объяснению.
Например:
— как при синтезе ядер элементов, так и при их распаде происходит выделение энергии, что находится в противоречии с законами молекулярной химии (если при синтезе молекулы выделяется энергия, то при ее разложении происходит обратный процесс — энергия поглощается, и наоборот). Поскольку при синтезе (а также распаде) ядра соблюдается закон сохранения энергии, то такой процесс возможен лишь при условии, если вокруг ядра существует некий барьер (материальный, пространственный, энергетический), на преодоление которого требуется энергия, вне зависимости от того, с какой стороны это барьер преодолевается;
— ядро атома имеет положительный заряд, а электрон — отрицательный, и, исходя из элементарной логики; их столкновение (взаимодействие) должно быть неизбежным. Тем не менее такое взаимодействие электрона с ядром (так называемый электронный захват) происходит исключительно редко. Подобный феномен возможен опять-таки лишь в том случае, если вокруг ядра существует некий барьер, препятствующий взаимодействию протона и электрона;
Тем не менее такое взаимодействие электрона с ядром (так называемый электронный захват) происходит исключительно редко. Подобный феномен возможен опять-таки лишь в том случае, если вокруг ядра существует некий барьер, препятствующий взаимодействию протона и электрона;
— не существует объяснения, почему протоны внутри ядра плотно сжаты, в то время как одноименный заряд должен их расталкивать;
— до сих пор не существует теории, почему одни изотопы стабильны, а другие нет. Известны так называемые магические числа нуклонов, при которых ядро атома является стабильным, но структура ядра атома до сих пор неясна;
— до сих пор не существует объяснения, почему периодическая система элементов периодична. Согласно планетарной модели атома и логике ее построения, электронные слои должны нарастать вокруг ядра в некой прогрессии — за s-подуровнем должен идти p-подуровень, затем d-подуровень, f-подуровень и так далее (то есть 2, 6, 10, 14 и так далее электронов в последующем слое). На самом же деле наблюдается странная картина — последовательное наращивание электронных слоев вокруг ядра вдруг обрывается, и с началом нового периода построение электронных слоев начинается с s-подуровня. При этом электроны внутренних электронных слоев настолько плотно упакованы, что их невозможно извлечь из атома никакими способами, кроме разрушения ядра. Создается впечатление, что ядро атома вместе с электронными слоями предыдущих периодов представляет собой единое целое. То есть атом, допустим, лития (второй период, первая группа), представляет собой следующее образование: ядро с массой 7 и одним положительным зарядом, вокруг которого вращается один электрон; атом натрия (третий период, первая группа), в свою очередь, состоит из ядра с массой 23 и одним положительным зарядом с одним электроном и так далее. Только таким образом можно объяснить появление s-орбитали вокруг ядра в начале периода, само построение атомов в периоды, схожесть их химических свойств по группам;
На самом же деле наблюдается странная картина — последовательное наращивание электронных слоев вокруг ядра вдруг обрывается, и с началом нового периода построение электронных слоев начинается с s-подуровня. При этом электроны внутренних электронных слоев настолько плотно упакованы, что их невозможно извлечь из атома никакими способами, кроме разрушения ядра. Создается впечатление, что ядро атома вместе с электронными слоями предыдущих периодов представляет собой единое целое. То есть атом, допустим, лития (второй период, первая группа), представляет собой следующее образование: ядро с массой 7 и одним положительным зарядом, вокруг которого вращается один электрон; атом натрия (третий период, первая группа), в свою очередь, состоит из ядра с массой 23 и одним положительным зарядом с одним электроном и так далее. Только таким образом можно объяснить появление s-орбитали вокруг ядра в начале периода, само построение атомов в периоды, схожесть их химических свойств по группам;
— согласно принципу Паули, в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел.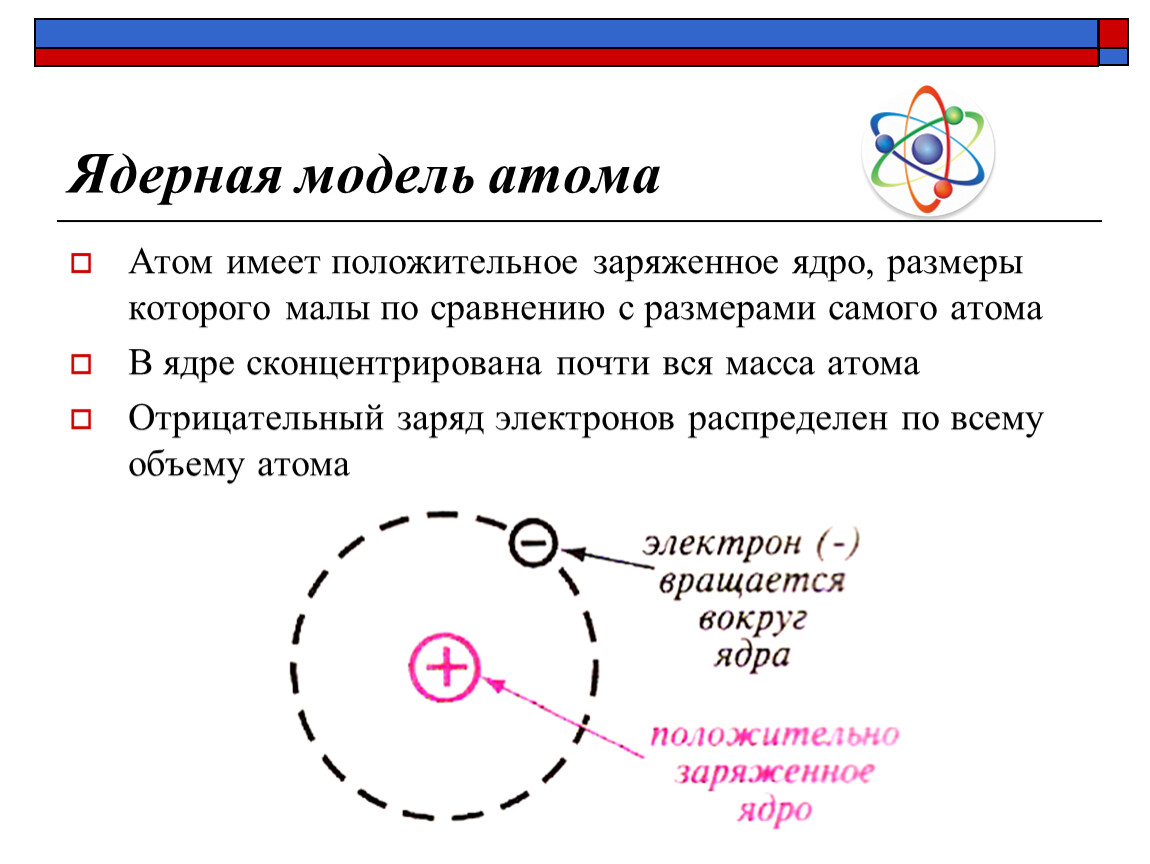 Однако из графических построений электронных структур атомов видно, что электронные облака различных подуровней не только пересекаются, но и имеют общие зоны, что противоречит принципу Паули. Принцип Паули никто не опровергал, графическое построение электронных облаков лежит в основе молекулярного взаимодействия элементов, но в то же время одно взаимоисключает другое.
Однако из графических построений электронных структур атомов видно, что электронные облака различных подуровней не только пересекаются, но и имеют общие зоны, что противоречит принципу Паули. Принцип Паули никто не опровергал, графическое построение электронных облаков лежит в основе молекулярного взаимодействия элементов, но в то же время одно взаимоисключает другое.
Подобных противоречий в планетарной теории строения атома великое множество, поэтому не стоит приводить их все — иначе из-за деревьев не будет видно леса. Однако, прежде чем приступить к изложению топологической теории строения атомов, позволим небольшое отступление, для чего перенесемся из микрокосмоса в макрокосмос.
На протяжении столетий основополагающей теорией в построении макрокосмоса являлась геоцентрическая система Клавдия Птолемея со сферическим (двумерным) небом, по которому вокруг Земли вращались Солнце и планеты, причем Солнце двигалось с равномерной скоростью, а планеты то ускорялись, то замедлялись в своем движении. Гелиоцентрическая система Николая Коперника позволила увидеть макрокосмос в истинном виде… но при этом отнюдь не похоронила геоцентрическую систему, как думает большинство людей, получивших общее образование. Ею до сих пор пользуются астрономы при определении положения планет, а также навигаторы морских судов. Объясняется это тем, что, приняв свое местонахождение (то есть свои координаты на Земле) за исходную точку отсчета и экстраполировав трехмерный космос на плоскость, проводить расчеты гораздо проще, чем делать то же самое, исходя из истинного положения планет и их движения в трехмерном пространстве. Другое дело — навигация в открытом космосе. Здесь уже расчеты проводятся на основе гелиоцентрической системы и с учетом истинного движения космических тел в пространстве.
Гелиоцентрическая система Николая Коперника позволила увидеть макрокосмос в истинном виде… но при этом отнюдь не похоронила геоцентрическую систему, как думает большинство людей, получивших общее образование. Ею до сих пор пользуются астрономы при определении положения планет, а также навигаторы морских судов. Объясняется это тем, что, приняв свое местонахождение (то есть свои координаты на Земле) за исходную точку отсчета и экстраполировав трехмерный космос на плоскость, проводить расчеты гораздо проще, чем делать то же самое, исходя из истинного положения планет и их движения в трехмерном пространстве. Другое дело — навигация в открытом космосе. Здесь уже расчеты проводятся на основе гелиоцентрической системы и с учетом истинного движения космических тел в пространстве.
Экстраполяция трехмерного мира на плоскость (в двухмерный мир) широко используется человеком — это и картография, и всевозможные чертежи архитектурных строений, и многое другое. Исходя из всего этого, зададимся вопросом: а не пытаемся ли мы экстраполировать свои воззрения об окружающем нас пространстве на микромир? Не уподобляемся ли мы при этом древним, представлявшим Землю плоской, звездное небо неподвижной сферой, а весь окружающий мир геоцентрическим?
Известно, что плотность частиц в ядре атома чрезвычайно высока. А что, если представить, будто с увеличением плотности вещества происходит ломка привычного нам трехмерного пространства, и элементарные частицы, чтобы разместиться в микромире, переходят в многомерное пространство? Тогда тот самый барьер, который приходится преодолевать элементарным частицам при синтезе или распаде ядра атома, можно считать барьером между трехмерным пространством и многомерным.
А что, если представить, будто с увеличением плотности вещества происходит ломка привычного нам трехмерного пространства, и элементарные частицы, чтобы разместиться в микромире, переходят в многомерное пространство? Тогда тот самый барьер, который приходится преодолевать элементарным частицам при синтезе или распаде ядра атома, можно считать барьером между трехмерным пространством и многомерным.
Однако, прежде чем рассмотреть строение атома в четырехмерном пространстве, обратимся к азам топологии.
На рис. 1 представлены квадрат, куб и четырехмерный куб. Это своего рода элементарные ячейки двумерного (квадрат), трехмерного (куб) и четырехмерного (четырехмерный куб) пространств; стороны которых являются координатами этих пространств, Назреем эти координаты следующим образом: АВ — долгота, АС — широта, АЛ — высота и, скажем, АЕ — глубина. Все эти координаты пространственные (то есть измеряются как расстояние), и угол между ними составляет 90°. Обратим внимание, что в квадрате имеются две пары параллельных сторон (АС иВF,АВи СЕ), в кубе — три пары параллельных плоскостей (АСFВи DGHI, АСGD и ВFН1, АDIВ и СGHF), а в четырехмерном кубе — четыре пары параллельных пространств (АСFBDGHI и EJKLNMOP, АСFBEJKL и DGHINMOP, ACGDEJMN и BFHILKOP, ADIBENPL и CGHFJMOK).
Но, прежде чем приступить к рассмотрению теории топологического строения атомов, следует абстрагироваться от мнения, навязанного нам писателями-фантастами, что параллельные пространства существуют независимо друг от друга и никоим образом не пересекаются и не взаимодействуют. На самом деле все не так — как невозможно вычислить объем без определения площади поверхности, так и многомерные пространства тесно связаны с трехмерными пространственными координатами и проявляются в трехмерном мире в виде проекций. Древний человек, глядя на небо, представлял трехмерную Вселенную в виде плоской сферы — аналогично этому в трехмерный мир проецируются многомерные миры, а также параллельные трехмерные пространства с их вещественностью (массой и энергией), но, естественно, в искаженном проекцией виде. Уяснив это, можно приступить и к рассмотрению топологической теории строения атома.
Проведем мысленный эксперимент. Допустим, в трехмерном пространстве существует образование, представленное на рис. 2.
2.
Протоны, находящиеся в центрах плоскостей ACFB и DGHL, соединены между собой двумя нейтронами трехмерном пространстве, а электроны вращаются вокруг протонов строго в плоскостях, в которых расположены протоны. Поскольку речь идет о мысленном допущении, то вопрос о правомерности такого образования пока не стоит. Вопрос чисто фантастический: в каком виде увидит это образование обитатель двумерного мира плоскости AÇFB? Так как понятие третьей координаты, то естьвысоты, для него нереально и проекция этой координаты в его двумерный мир равна нулю, он получит следующую картинку, представленную на рис. 3.
То есть ядро атома, состоящее из двух протонов и двух нейтронов, и вращающиеся вокруг ядра по одной орбите два электрона. При этом электроны странным образом не сталкиваются между собой и… и не «падают» на ядро. Поразмыслив над такой необычной ситуацией и не догадываясь, что это лишь совмещенная проекция из параллельного двумерного пространства, наблюдатель из двумерного мира отнесет такое поведение электронов, скажем, на счет их противоположных спинов, или, упрощенно, собственного вращения электронов вокруг своей оси.
А теперь представим несколько иную картину, пользуясь рис. 2. Представим, что плоскости двумерных параллельных пространств ACFB и DGHI являются объемными трехмерными параллельными пространствами ACFBDGHI и EJKLNMOP (рис. 1, четырехмерный куб), в которых вокруг протонов вращаются электроны, а ось, по которой соединяются протоны и нейтроны, — координата четвертого измерения (глубина). Тогда проекция этого образования в наш трехмерный мир и будет той самой планетарной моделью, которую нарисовал Резерфорд.
Для упрощения понимания теории лучше пользоваться рис. 2, экстраполируя двумерные пространства в трехмерные, а трехмерное — в четырехмерное, но учитывая при этом, что если в трехмерном кубе — шесть попарно параллельных сторон, то в четырехмерном кубе — восемь попарно параллельных пространств.
Следует сделать еще одно допущение: элементарные частицы в протоне находятся в многомерном пространстве, за счет чего сам протон — в четырехмерном, поэтому электрон не «падает» на него из-за межпространственного барьера, и это расстояние между электроном и протоном в настоящее время называется радиусом электронной орбитали. Таким образом, атом водорода можно представить как своеобразный диполь (протон в четырехмерном пространстве — электрон в трехмерном), существование которого подтверждается тем, что молекула водорода состоит из двух атомов.
Таким образом, атом водорода можно представить как своеобразный диполь (протон в четырехмерном пространстве — электрон в трехмерном), существование которого подтверждается тем, что молекула водорода состоит из двух атомов.
Приняв все вышесказанное за основу, можно теперь рассмотреть, каким образом устроены атомы различных элементов и почему наступает периодичность в их свойствах.
На рис. 2 показано схематическое строение гелия (два протона). Ось, по которой связаны нейтроны и протоны в ядре (глубина четырехмерного пространства), меньше радиуса орбитали электрона (которую лучше представить как электростатическое поле, ближе которого другой электрон приблизиться не может), поэтому образование следующего элемента — лития (с тремя протонами) осуществляется как бы над ядром гелия. Третий протон через нейтроны подсоединяется к ядру на более высоком уровне в четвертом измерении. При этом, пользуясь привычной терминологией, электроны первого периода, находящиеся в трехмерных параллельных пространствах, оказываются внутри четырехмерного пространства, почему и становятся недоступными. Бериллий (с четырьмя протонами) строится по принципу гелия, но далее Оказывается, что расстояние пространственной связи протонов с нейтронами в четвертом измерении для элементов второго периода больше радиуса электростатического поля электрона, что позволяет на этом уровне подсоединиться восьми диполям. То есть образовать вокруг пространственной решетки из протонов и нейтронов в четвертом измерении четырехмерный куб с восьмью попарно параллельными трехмерными пространствами, в которых находятся электроны (какую именно пространственную решетку создают в четвертом измерении протоны и нейтроны, оставим решать последователям топологической теории — сейчас важно уяснить саму идею топологического строения атомов). Объясним лишь, чем отличается s-подуровень от p-подуровней, хотя по схематическому изображению четырехмерного куба (рис. 1) все попарно параллельные трехмерные пространства вроде бы должны быть равнозначными. На самом деле это не так. Одно из этих пространств (безразлично какое, но? допустим, ACFBDGHI) является НАШИМ трехмерным пространством, в которое проецируется параллельное ему пространствоEJKLNMOP, и электроны этих пространств образуют так называемый s-подуровень.
Бериллий (с четырьмя протонами) строится по принципу гелия, но далее Оказывается, что расстояние пространственной связи протонов с нейтронами в четвертом измерении для элементов второго периода больше радиуса электростатического поля электрона, что позволяет на этом уровне подсоединиться восьми диполям. То есть образовать вокруг пространственной решетки из протонов и нейтронов в четвертом измерении четырехмерный куб с восьмью попарно параллельными трехмерными пространствами, в которых находятся электроны (какую именно пространственную решетку создают в четвертом измерении протоны и нейтроны, оставим решать последователям топологической теории — сейчас важно уяснить саму идею топологического строения атомов). Объясним лишь, чем отличается s-подуровень от p-подуровней, хотя по схематическому изображению четырехмерного куба (рис. 1) все попарно параллельные трехмерные пространства вроде бы должны быть равнозначными. На самом деле это не так. Одно из этих пространств (безразлично какое, но? допустим, ACFBDGHI) является НАШИМ трехмерным пространством, в которое проецируется параллельное ему пространствоEJKLNMOP, и электроны этих пространств образуют так называемый s-подуровень. Остальные попарно параллельные пространства проецируются в наш трехмерный мир с одинаковыми искажениями, и электроны в них образуют так называемые p-подуровни.
Остальные попарно параллельные пространства проецируются в наш трехмерный мир с одинаковыми искажениями, и электроны в них образуют так называемые p-подуровни.
Ядро атома в четвертом измерении представляет собой нечто похожее на кристаллическую решетку, узлами в которой служат нейтроны и протоны. Но поскольку проекция координаты четвертого измерения (глубина) в трехмерный мир равна нулю, радиус ядра атома увеличивается весьма незначительно, в то время как проекции параллельных трехмерных пространств с электронами в наш реальный трехмерный мир проецируются с небольшими искажениями, что и объясняется видимым увеличением радиуса их орбиталей. При этом электроны предыдущих периодов представляют собой как бы слои параллельных трехмерных пространств в четырехмерном пространстве, выше которых идет надстройка протонно-нейтронной решетки, С увеличением объема атома (в четырехмерном пространстве понятие ядра неуместно) появляется возможность увеличен ния поверхности электронных слоев над протонно-нейтронной решеткой, вследствие чего образуются слои так называемых электронных d-подуровней и f-подуровней, которые, естественно, начинают свое построение как s-подуровни.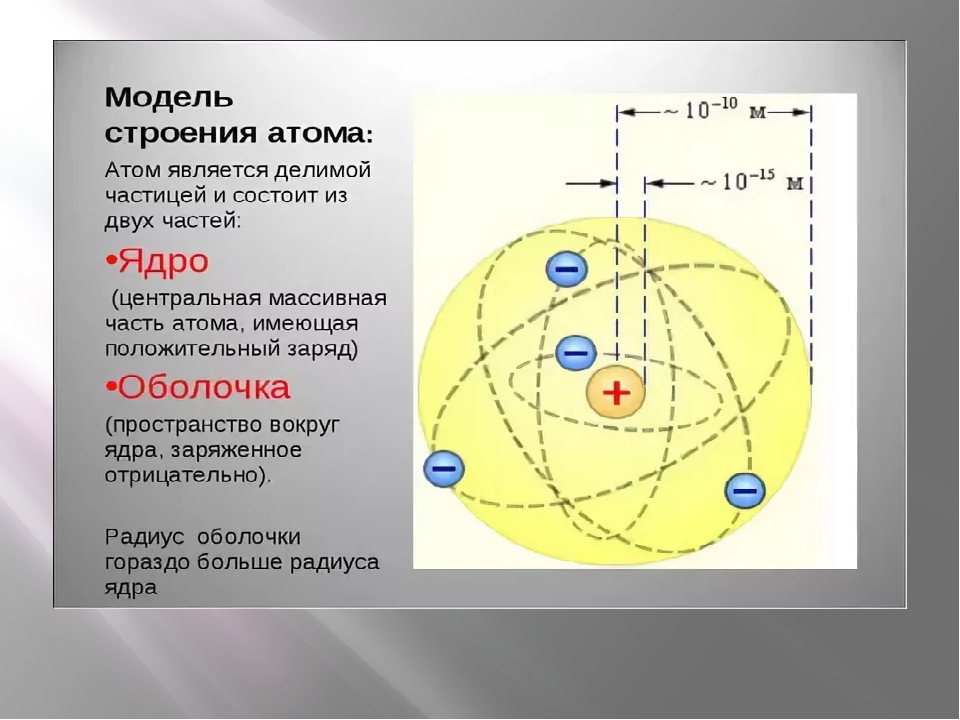
Таковы, в принципе, основные положения топологической теории строения атомов. Достоинство этой теории в том, что она не отвергает ни одного экспериментально полученного результата ядерной физики, но в то же время позволяет объяснить ранее необъяснимые факты:
В частности:
— периодичность системы элементов;
— детальная разработка построения протонно-нейтронной решетки атома позволит понять, почему существуют стабильные и нестабильные изотопы;
— диполь трехмерного электрона и четырехмерного протона в протонно-нейтронной решетке, несомненно? объяснит явление магнетизма;
— подобное строение атома объясняет пространственные углы молекулярных связей, в то время как гибридизация электронных облаков ничем не подтверждается и ее теория явно надуманна, поскольку вытекает именно из существования угловых молекулярных связей, а не наоборот;
— по планетарной теории, исходя из логики ее построения, распад ядра атома должен протекать с полным разрушением ядра на элементарные частицы (что противоречит экспериментальным данным), а разрушение атома но топологической теории, поскольку здесь происходит дробление протонно-нейтронной решетки, — на другие элементы (что как раз и подтверждается экспериментальными данными).
Вполне возможно, что представление о многомерности пространства позволит наконец разработать теорию поля, а также объяснить двойственность квантово-волновой механики;
И, пожалуй, самое главное — топологическая теория полностью согласуется с существующей, поскольку проекция четырехмерной модели атома в трехмерный мир соответствует принятой ныне планетарной модели атома и не противоречит ей в той же степени, в которой гелиоцентрическая система макрокосмоса не противоречит геоцентрической.
Нильс Бор думал не только о строении атома — о строении мира
Свои первые труды по квантовой механике будущий лауреат Нобелевской премии Лев Ландау опубликовал, ещё будучи сотрудником Ленинградского университета, однако особое влияние на его формирование как советского учёного произвело участие в деятельности Копенгагенского института теоретической физики, который возглавлял выдающийся датский физик-теоретик Нильс Бор.
Он родился седьмого октября 1885 года. Если мать Эллен была душой и сердцем семьи, то отец Христиан, профессор физиологии Копенгагенского университета, — её интеллектуальным средоточием. Его коллеги и друзья составляли цвет датской науки начала девятнадцатого века. Родительское воспитание дало плоды: в школе Нильс стал лучшим учеником по физике и математике. Затем с лёгкостью поступил в престижный вуз и удивлял преподавателей способностью глубоко и самостоятельно мыслить. Там, где другие сокурсники находили только одно решение задачи, Нильс отыскивал несколько вариантов.
Если мать Эллен была душой и сердцем семьи, то отец Христиан, профессор физиологии Копенгагенского университета, — её интеллектуальным средоточием. Его коллеги и друзья составляли цвет датской науки начала девятнадцатого века. Родительское воспитание дало плоды: в школе Нильс стал лучшим учеником по физике и математике. Затем с лёгкостью поступил в престижный вуз и удивлял преподавателей способностью глубоко и самостоятельно мыслить. Там, где другие сокурсники находили только одно решение задачи, Нильс отыскивал несколько вариантов.
Ещё студентом Нильс участвовал в конкурсе по теме «Использование вибрации струи для определения поверхностного натяжения жидкостей». В результате серьёзной работы получил золотую медаль Датского королевского общества. После окончания университета успешно защитил диссертацию, посвящённую физическим свойствам металлов, и получил степень магистра. Чтобы расширить свои знания, отправился осенью 1911 года на стажировку в Кембридж — научный центр Англии, к знаменитому профессору Джозефу Джону Томсону, который считался ревностным приверженцем классической физики.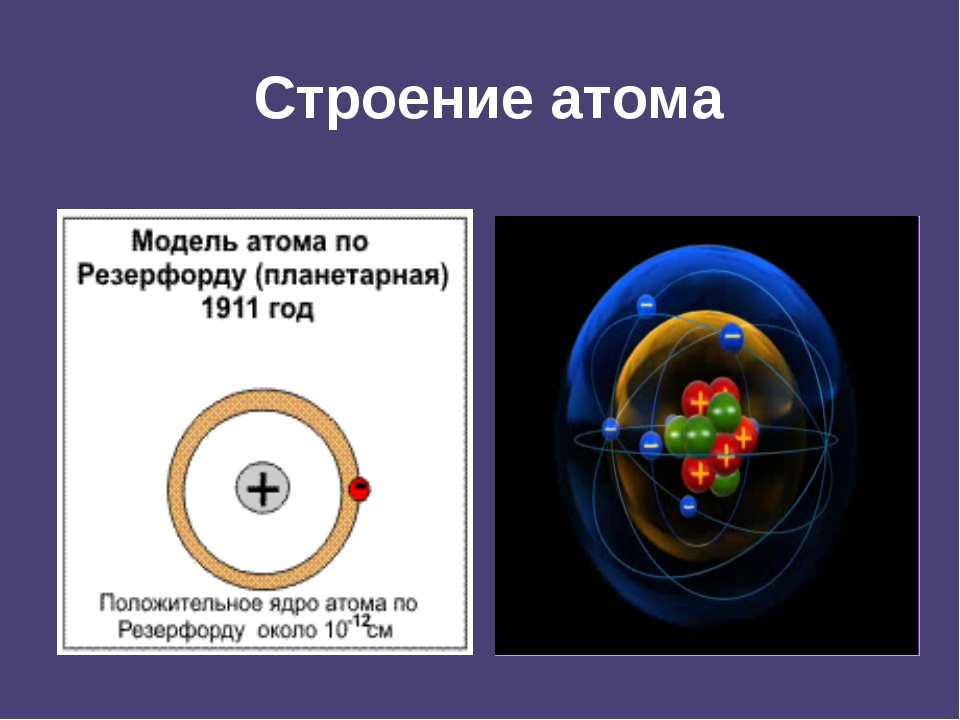
При первой встрече с ним двадцатишестилетний Бор вместо своей диссертации положил на стол учёного его же статью с отмеченными в тексте ошибками, на которые указал автору со словами: «Не правда ли, сэр Джозеф, как важно, что ошибки обнаружены!» Через несколько лет лауреат Нобелевской премии Пётр Капица услышал другую версию случившегося. По ней молодой датчанин, нетвёрдый в английском, просто сказал: «Сэр Джозеф, вот тут вы написали глупость!»
На ежегодном застолье учёных Кавендишской лаборатории, ставшей научной меккой для физиков-исследователей разных стран, в том числе СССР, Бор встретился с её руководителем, выдающимся английским теоретиком в области физики Эрнестом Резерфордом и решил работать с ним. Но этот ответственный поступок необходимо было согласовать с Томсоном, который не мог до конца понять образ мыслей Бора, но и не хотел, видимо, ему мешать, поэтому без колебаний дал своё согласие.
Переехав в Манчестер, Бор занялся в лаборатории Резерфорда созданием новой теории квантовой модели атома, которая основывалась тогда на двух постулатах, противоречивших законам классической физики.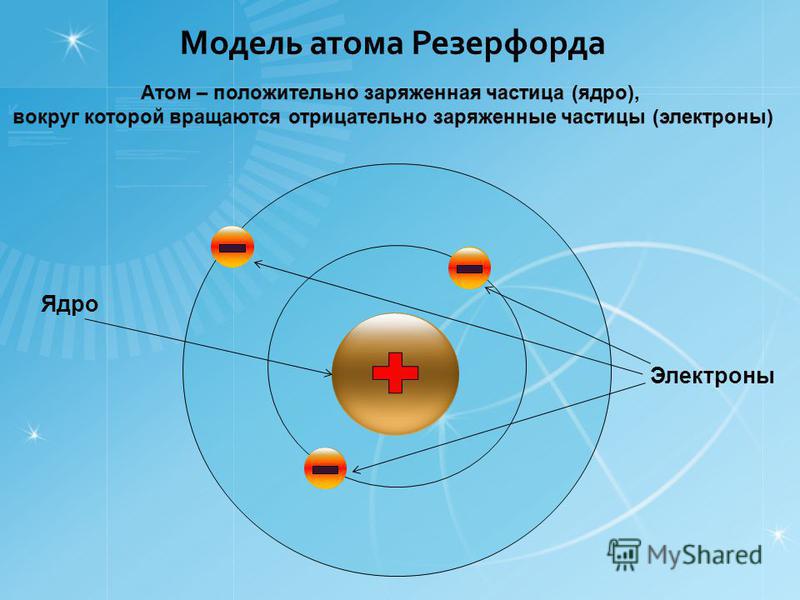 Бору удалось устранить эти противоречия, в результате появилась квантовая теория планетарного атома. За эти исследования, а также за заслуги в изучении атомного излучения Бор был удостоен в 1922 году Нобелевской премии.
Бору удалось устранить эти противоречия, в результате появилась квантовая теория планетарного атома. За эти исследования, а также за заслуги в изучении атомного излучения Бор был удостоен в 1922 году Нобелевской премии.
Фото: pixabay.com
Ставший учёным с мировым именем, он много сделал для развития науки в Дании. Благодаря ему Копенгаген превратился в центр теоретической физики, в котором был создан институт, сыгравший большую роль для широкого общения деятелей науки из разных стран. Сам Бор, будучи административным и научным руководителем института, сумел создать в нём свой стиль работы, построенный на уважении, дружбе, полной свободе слова и мысли. Его всегда окружали молодые учёные-исследователи, среди которых был швейцарец Вольфганг Паули. Он поступил к Бору ассистентом и внёс важные дополнения к его теории планетарного атома, что открыло новое направление в физике, названное квантовой механикой.
Первые десятилетия ХХ века были временем бурных открытий в области атомной физики, для развития которой много сделал и Бор. В 1938 году на Всемирном конгрессе антропологии и этнографии он выступил с докладом, направленным против расовой теории нацистов. Немецкая делегация покинула тогда зал, а учёный был внесён в список непримиримых противников третьего рейха. Его пребывание в оккупированной фашистами Дании стало опасным: в начале сентября 1943 года Бора вывезли в люке самолёта в Англию, а оттуда вскоре он перебрался в США, где велась работа над созданием атомной бомбы. То, что она стала угрозой человечеству, подтвердили американские бомбардировки японских городов Хиросимы и Нагасаки в августе 1945 года. Сразу же после этого жестокого акта Бор опубликовал в английской газете «Таймс» статью, в которой популярно объяснил, что сделать мир безопасным от оружия массового уничтожения могут только честный диалог и желание решать все вопросы, связанные с его производством и применением, при равноправном сотрудничестве учёных и правительств всех стран. По его мнению, самый большой фактор риска при использовании ядерной энергии — это человек.
По его мнению, самый большой фактор риска при использовании ядерной энергии — это человек.
Вернувшись в Копенгаген, Нильс Бор был избран президентом Датской академии наук, ему была присуждена престижная международная премия «Атом для мира», в его честь правительство страны учредило золотую медаль, на одной стороне которой был изображён профиль учёного, а на другой — модель атома с надписью вокруг неё: «Противоположности суть дополнения». Физик-теоретик и общественный деятель, член более двадцати иностранных академий наук, в том числе АН СССР, Нильс Бор дважды приезжал в нашу страну, побывал в Москве, Ленинграде, Дубне, познакомился с научно-исследовательскими институтами, читал лекции перед учёными и студентами. В 1963 году исполнилось полвека его теории атома, а за год до этой даты великого учёного не стало.
Основные сведения по теории строения атома
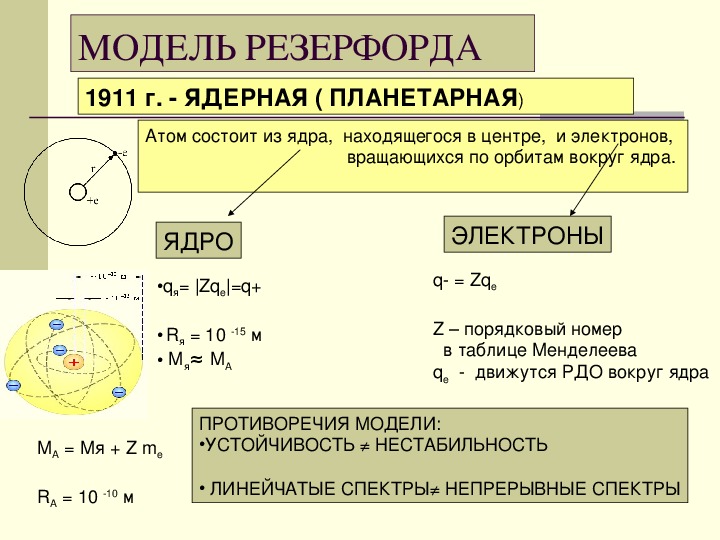
В 1897 г. Дж. Томсон открыл электрон; в 1909 г. Р. Малликен определил его заряд, который равен 1,6·10-19 Кл. В 1910 г. Э. Резерфорд провел опыты по бомбардировке металлической фольги a-частицами, в результате опытов было установлено, что некоторые a-частицы рассеиваются фольгой. Отсюда Э. Резерфорд предложил ядерную планетарную модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором сосредоточена основная часть массы атома, и электронов, вращающихся вокруг ядра по орбитам, подобно планетам солнечной системы. Однако Э. Резерфорд не смог объяснить устойчивость атома и наличие линейчатых спектров атомов; как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Малликен определил его заряд, который равен 1,6·10-19 Кл. В 1910 г. Э. Резерфорд провел опыты по бомбардировке металлической фольги a-частицами, в результате опытов было установлено, что некоторые a-частицы рассеиваются фольгой. Отсюда Э. Резерфорд предложил ядерную планетарную модель атома, согласно которой атом состоит из положительно заряженного ядра, в котором сосредоточена основная часть массы атома, и электронов, вращающихся вокруг ядра по орбитам, подобно планетам солнечной системы. Однако Э. Резерфорд не смог объяснить устойчивость атома и наличие линейчатых спектров атомов; как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
В 1913г. датский ученый Н. Бор, используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода.
Основные положения своей теории Н. Бор сформулировал в виде постулатов (утверждений, принимаемых без доказательств):
Бор сформулировал в виде постулатов (утверждений, принимаемых без доказательств):
Электрон в атоме находится на определенных стационарных орбитах и при этом не излучает и не поглощает энергии.
Каждая орбита имеет номер n (1, 2, 3, 4, …), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты (боровский радиус r0) был 5,29 ·10-13 м, радиус других орбит вычислялся по формуле:
rn =5,29·10-13 · n 2
Энергия электрона (эВ) зависела от значения главного квантового числа п:
Еп= — 13,6(1/n2)
Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (рис. 1). Такое состояние называется основным. При переходе электрона на более высокие орбиты атом становится возбужденным. Такое состояние атома неустойчиво.
Рис.1 Схема энергетических состояний атома водорода
II постулат.

При переходе электрона с одного стационарного состояния (энергетического уровня) на другой происходит излучение или поглощение энергии в виде кванта, энергия которого равна разности энергий в конечном и начальном состояниях.
Ek— EH = hn ,
где h — постоянная Планка; h = 6,626 · 10-34 Дж·с, n- частота волны
Экспериментально квантование энергии атомов обнаруживается в их спектрах поглощения и испускания. Атомные спектры имеют линейчатый характер (рис. 2) .
Рис. 2 Линии видимого спектра атомного водорода (серия Бальмера).
Возникновение линий в спектре обусловлено тем, что при возбуждении атомов (нагревании газа, электроразряде и пр.) электроны, принимая соответствующие порции энергии, переходят в состояние с более высокими энергетическими уровнями. В таком возбужденном состоянии атомы находятся лишь ничтожные доли секунды. Переход электронов в состояния с более низкими энергетическими уровнями сопровождается выделением кванта энергии. Это отвечает появлению в спектре отдельных линий, соответствующих излучению определенной частоты колебаний (длины волны). Поскольку газообразный атомный водород содержит множество атомов в разных степенях возбуждения, спектр состоит из большого числа линий.
Это отвечает появлению в спектре отдельных линий, соответствующих излучению определенной частоты колебаний (длины волны). Поскольку газообразный атомный водород содержит множество атомов в разных степенях возбуждения, спектр состоит из большого числа линий.
Видимый спектр водорода (рис. 2) возникает при переходе возбужденных электронов в состояние с главным квантовым числом n=2 (серия Бальмера).
Теория Бора была усовершенствована его учеником А. Зоммерфельдом. Он предположил что электроны могут вращаться в атоме не только по круговым, но и по эллиптическим орбитам.
Схема строения атома, с примерами
Схема строения атома
Всем известно, что атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся его масса. Внутри ядра находятся протоны и нейтроны, а вокруг него по орбитам движутся отрицательно заряженные электроны (рис. 1).
Рис. 1. Схематическое изображение строения атома неона.
Впервые модель строения атома была предложена в 1903 году Дж. Дж. Томсоном. Согласно его предположениям, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда.
Дж. Томсоном. Согласно его предположениям, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда.
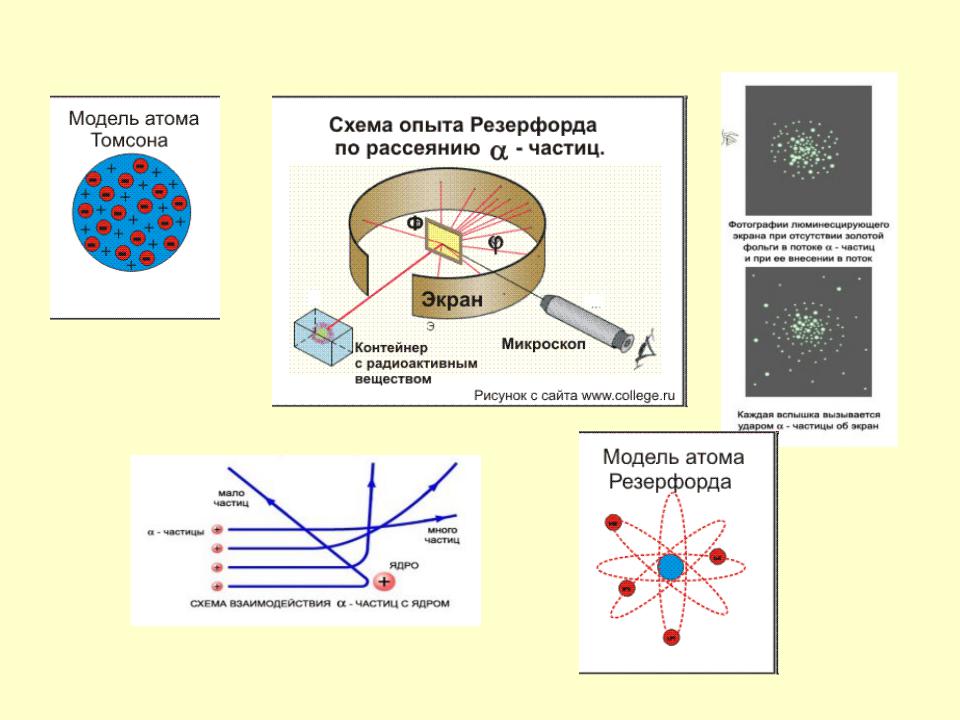
Гипотеза Томсона была проверена и уточнена Э. Резерфордом, который провел серию опытов по рассеянию α-частиц тонкими металлическими пластинками и сообщил. На основании своего исследования он заключил что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре. Вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома – величина порядка 10-8 см, а диаметр ядра – порядка 10-13 – 10-12 см. Такая модель строения атома получила название ядерной.
Однако, несмотря на большой прорыв в изучении строения атома теория Э. Резерфорда не могла дать ответ на два вопроса: устойчивость атома и приводила к неправильным выводам о характере атомных спектров.
Существенный вклад в развитие представлений о строении атома в 1913 году сделал Нильс Бор, предложивший квантовую теорию, объединяющую ядерную модель атома с квантовой теорией света. Он показал, что способность нагретого тела к лучеиспусканию можно описать количественно предположив, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно, т.е. отдельными порциями – квантами.
Основные положения теории Бора о схеме строения атома
Основные положения своей теории Бор изложил в виде постулатов:
- Электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным круговым орбитам (стационарным).
- Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии.
- Излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состояниях.

Однако и теория Н. Бора страдала противоречивостью, например не могла ответить на вопрос: где находится электрон в процессе перехода с одной орбиты на другую.
Эта задача была решена только после развития нового ответвления теоретической физики – квантовой (волновой) механики (учения Луи де Бройля и Шредингера).
Примеры решения задач
лучшие приложения «МЭШ» по физике / Новости города / Сайт Москвы
К 135-летию со дня рождения Нильса Бора, одного из создателей современной физики, лауреата Нобелевской премии и основоположника первой квантовой теории атома, «Московская электронная школа» («МЭШ») представила подборку приложений по физике из своей библиотеки.
В приложении «Ученые-физики и их эксперименты» можно будет вспомнить самые значимые открытия в области физики и их авторов. Например, того, кто доказал существование в атомах положительно заряженного ядра и отрицательно заряженных электронов вокруг него или кто открыл закон плавания тел, ставший основой гидростатики.
Датский физик Нильс Бор внес весомый вклад в развитие теории атомного ядра и ядерных реакций. Именно он в 1913 году предложил модель строения атома, в которой электроны могут двигаться только по определенным орбитам, не излучая энергию, а ее излучение или поглощение происходит лишь в момент перехода с одной орбиты на другую. Повторить тему строения атома и атомного ядра поможет одноименное интерактивное приложение.
На рубеже XIX–XX веков ученые вплотную приблизились к разгадке радиоактивных превращений. Тогда и был найден ответ на вопрос, почему атомы радиоактивного вещества подвержены спонтанным видоизменениям. Этому посвящено приложение «Радиоактивные превращения».
Сергей Собянин: «Московская электронная школа» уже стала неотъемлемой частью учебного процесса Как пользоваться библиотекой «МЭШ»
Библиотека «МЭШ» — сервис проекта «Московская электронная школа», разработанный городским Департаментом образования и науки совместно с Департаментом информационных технологий Москвы. В библиотеке собрано более 49 тысяч сценариев уроков и свыше 4,7 тысячи видеоуроков, около 1600 электронных учебных пособий, 348 учебников, свыше 124 тысяч образовательных интерактивных приложений, семь уникальных виртуальных лабораторий по физике и математике, 245 произведений художественной литературы, а также огромное количество тестовых заданий, соответствующих содержанию ОГЭ и ЕГЭ, и многое другое.
В библиотеке собрано более 49 тысяч сценариев уроков и свыше 4,7 тысячи видеоуроков, около 1600 электронных учебных пособий, 348 учебников, свыше 124 тысяч образовательных интерактивных приложений, семь уникальных виртуальных лабораторий по физике и математике, 245 произведений художественной литературы, а также огромное количество тестовых заданий, соответствующих содержанию ОГЭ и ЕГЭ, и многое другое.
4.3: Ядерный атом – Chemistry LibreTexts
Цели обучения
- Объясните наблюдения, которые привели к открытию Томсоном электрона.
- Опишите модель атома “сливового пудинга” Томсона и доказательства этого.
- Нарисуйте схему атома “сливового пудинга” Томсона и объясните, почему у нее такое название.
- Опишите эксперимент Резерфорда с золотой фольгой и объясните, как этот эксперимент изменил модель «сливового пудинга».
- Нарисуйте схему модели атома Резерфорда и обозначьте ядро и электронное облако.
Атомная теория Далтона подтвердила множество различных химических экспериментов, которые ученые проводили для ее проверки. Фактически, в течение почти 100 лет казалось, что теория атома Далтона была всей правдой. Однако в 1897 году ученый по имени Дж. Дж. Томсон провел исследование, которое показало, что теория атома Далтона – это еще не все. Он предположил, что маленькие отрицательно заряженные частицы, составляющие катодный луч, на самом деле были частями атомов.Он назвал эти части «корпускулами», хотя сегодня мы знаем их как электронов . Благодаря его умным экспериментам и тщательным рассуждениям Дж. Дж. Томсону приписывают открытие электрона.
Фактически, в течение почти 100 лет казалось, что теория атома Далтона была всей правдой. Однако в 1897 году ученый по имени Дж. Дж. Томсон провел исследование, которое показало, что теория атома Далтона – это еще не все. Он предположил, что маленькие отрицательно заряженные частицы, составляющие катодный луч, на самом деле были частями атомов.Он назвал эти части «корпускулами», хотя сегодня мы знаем их как электронов . Благодаря его умным экспериментам и тщательным рассуждениям Дж. Дж. Томсону приписывают открытие электрона.
Электроны и сливы
Электрон был открыт Дж.Дж. Томсон в 1897 году. Было также известно о существовании протонов и нейтральном заряде атомов. Поскольку нетронутый атом не имел суммарного заряда, а электрон и протон имели противоположные заряды, следующим шагом после открытия субатомных частиц было выяснение того, как эти частицы расположены в атоме. Это была трудная задача из-за невероятно малых размеров атома. Поэтому ученые решили разработать модель того, как, по их мнению, мог выглядеть атом. Цель каждой модели атома состояла в том, чтобы точно представить все экспериментальные данные об атомах самым простым из возможных способов.
Это была трудная задача из-за невероятно малых размеров атома. Поэтому ученые решили разработать модель того, как, по их мнению, мог выглядеть атом. Цель каждой модели атома состояла в том, чтобы точно представить все экспериментальные данные об атомах самым простым из возможных способов.
После открытия электрона Дж. Дж. Томсон разработал то, что стало известно как модель « сливовый пудинг » в 1904 году. Сливовый пудинг – английский десерт, похожий на черничный маффин. В модели атома из сливового пудинга Томсона электроны были заключены в однородную сферу с положительным зарядом, как черника, застрявшая в булочке. Положительное вещество считалось желеобразным или похожим на густой суп. Электроны были несколько подвижными. По мере того, как они приближались к внешней части атома, положительный заряд в этой области был больше, чем у соседних отрицательных зарядов, и электрон оттягивался больше к центральной части атома.
Рисунок \ (\ PageIndex {2} \): Модель «сливового пудинга».
Однако эта модель атома вскоре уступила место новой модели, разработанной новозеландцем Эрнестом Резерфордом (1871-1937) примерно пятью годами позже. При жизни Томсон получил множество наград, в том числе Нобелевскую премию по физике в 1906 году и рыцарское звание в 1908 году.
Атомы и золото
В 1911 году Резерфорд и его коллеги Ханс Гейгер и Эрнест Марсден инициировали серию новаторских экспериментов, которые полностью изменили принятую модель атома.Они бомбардировали очень тонкие листы золотой фольги быстро движущимися альфа-частицами . Альфа-частицы, тип естественных радиоактивных частиц, представляют собой положительно заряженные частицы с массой, примерно в четыре раза превышающей массу атома водорода.
Рисунок \ (\ PageIndex {3} \): (A) Экспериментальная установка для эксперимента Резерфорда с золотой фольгой: радиоактивный элемент, испускавший альфа-частицы, был направлен на тонкий лист золотой фольги, окруженный экраном, который позволял обнаруживать отклоненные частицы. (B) Согласно модели сливового пудинга (вверху), все альфа-частицы должны были пройти через золотую фольгу с небольшим отклонением или без него. Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу).
(B) Согласно модели сливового пудинга (вверху), все альфа-частицы должны были пройти через золотую фольгу с небольшим отклонением или без него. Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу). Согласно принятой модели атома, в которой масса и заряд атома равномерно распределены по всему атому, ученые ожидали, что все альфа-частицы пройдут через золотую фольгу с небольшим отклонением или вообще без отклонения.Удивительно, хотя большая часть альфа-частиц действительно не отклонялась, очень небольшой процент (примерно 1 из 8000 частиц) отскакивал от золотой фольги под очень большими углами. Некоторых даже перенаправили обратно к источнику. Никакие предварительные знания не подготовили их к этому открытию. В известной цитате Резерфорд воскликнул, что это было «как если бы вы выстрелили 15-дюймовым [артиллерийским] снарядом по куску ткани, а он вернулся и попал в вас».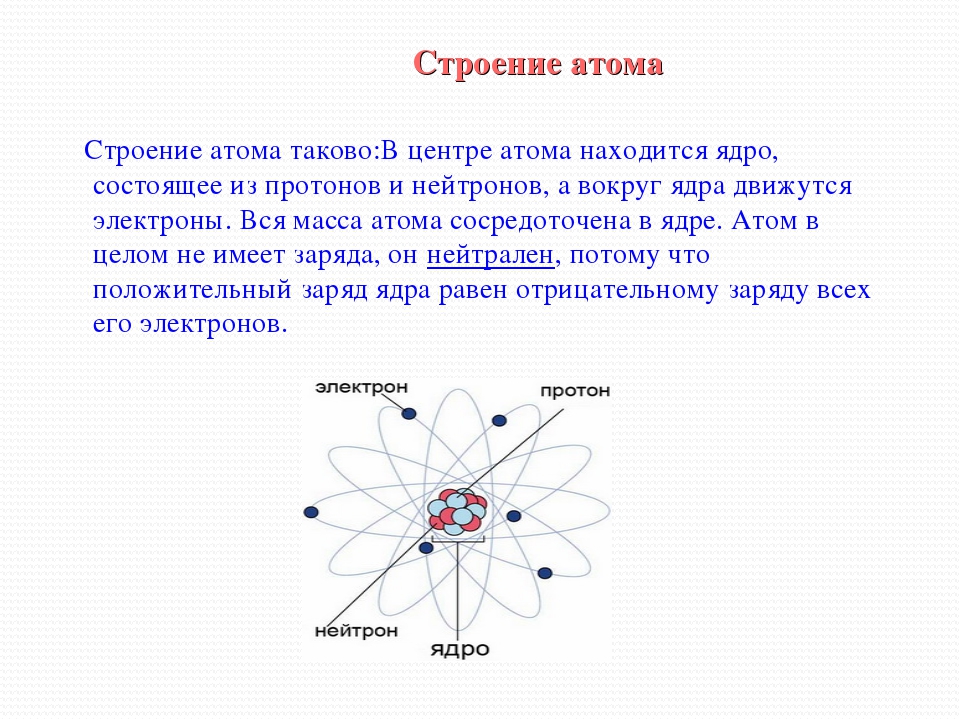
Резерфорду нужно было предложить совершенно новую модель атома, чтобы объяснить свои результаты.Поскольку подавляющее большинство альфа-частиц прошло через золото, он рассудил, что большая часть атома представляет собой пустое пространство. Напротив, сильно отклоненные частицы должны были испытать чрезвычайно мощную силу внутри атома. Он пришел к выводу, что весь положительный заряд и большая часть массы атома должны быть сосредоточены в очень маленьком пространстве внутри атома, которое он назвал ядром. Ядро – крошечное плотное центральное ядро атома, состоящее из протонов и нейтронов.
Атомная модель Резерфорда стала известна как ядерная модель . В ядерном атоме протоны и нейтроны, составляющие почти всю массу атома, расположены в ядре в центре атома. Электроны распределены вокруг ядра и занимают большую часть объема атома. Стоит подчеркнуть, насколько маленькое ядро по сравнению с остальной частью атома. Если бы мы могли взорвать атом до размеров большого профессионального футбольного стадиона, ядро было бы размером с шарик.
Модель Резерфорда оказалась важным шагом на пути к полному пониманию атома. Однако он не полностью рассматривал природу электронов и то, как они занимают огромное пространство вокруг ядра. Только несколько лет спустя было достигнуто полное понимание электрона. Это оказалось ключом к пониманию химических свойств элементов.
Атомное ядро
Ядро (во множественном числе, ядра) – это положительно заряженная область в центре атома.Он состоит из плотно упакованных субатомных частиц двух типов. Частицы – это протоны с положительным электрическим зарядом и нейтроны с нейтральным электрическим зарядом. Вне ядра атом – это в основном пустое пространство, в котором вращаются отрицательные частицы, называемые электронами. На рисунке ниже показаны эти части атома.
Рисунок \ (\ PageIndex {4} \): ядерный атом. Ядро атома очень маленькое. Его радиус составляет всего около 1/100 000 от общего радиуса атома.Электроны практически не имеют массы, но протоны и нейтроны имеют большую массу для своего размера. В результате ядро имеет практически всю массу атома. Учитывая его большую массу и крошечные размеры, ядро очень плотное. Если бы объект размером с пенни имел ту же плотность, что и ядро атома, его масса была бы больше 30 миллионов тонн!
В результате ядро имеет практически всю массу атома. Учитывая его большую массу и крошечные размеры, ядро очень плотное. Если бы объект размером с пенни имел ту же плотность, что и ядро атома, его масса была бы больше 30 миллионов тонн!
Держим все вместе
Частицы с противоположными электрическими зарядами притягиваются друг к другу. Это объясняет, почему отрицательные электроны вращаются вокруг положительного ядра.Частицы с одинаковым электрическим зарядом отталкиваются друг от друга. Это означает, что положительные протоны в ядре отталкиваются друг от друга. Так почему же ядро не разлетается? Еще более сильная сила – сильная ядерная сила – удерживает протоны и нейтроны вместе в ядре.
Сводка
- Атомы – это основные строительные блоки всей материи.
- Современная атомная теория устанавливает представления об атомах и о том, как они составляют материю.
- Бомбардировка золотой фольги альфа-частицами показала, что некоторые частицы отклоняются.

- Ядерная модель атома состоит из небольшой и плотной положительно заряженной внутренней части, окруженной облаком электронов.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
3.4: Эксперимент Резерфорда – Ядерная модель атома
Цели обучения
- Опишите модель атома “сливового пудинга” Томсона и доказательства этого.
- Опишите эксперимент Резерфорда с золотой фольгой и объясните, как этот эксперимент изменил модель «сливового пудинга».
Электрон был открыт Дж. Дж. Дж. Томсоном в 1897 году. Было также известно о существовании протонов и нейтральном заряде атомов.Поскольку нетронутый атом не имел суммарного заряда, а электрон и протон имели противоположные заряды, следующим шагом после открытия субатомных частиц было выяснение того, как эти частицы расположены в атоме. Это сложная задача из-за невероятно малых размеров атома. Поэтому ученые решили разработать модель того, как, по их мнению, мог выглядеть атом. Цель каждой модели атома состояла в том, чтобы точно представить все экспериментальные данные об атомах самым простым из возможных способов.
Это сложная задача из-за невероятно малых размеров атома. Поэтому ученые решили разработать модель того, как, по их мнению, мог выглядеть атом. Цель каждой модели атома состояла в том, чтобы точно представить все экспериментальные данные об атомах самым простым из возможных способов.
После открытия электрона Дж. Дж. Томсон разработал так называемый «сливовый пудинг » (рис. \ (\ PageIndex {1} \) ) в 1904 году. Сливовый пудинг – это английский десерт, похожий на черничный маффин. В модели атома из сливового пудинга Томсона электроны были заключены в однородную сферу с положительным зарядом, как черника, застрявшая в булочке. Положительное вещество считалось желеобразным или густым супом. Электроны были несколько подвижными.По мере того, как они приближались к внешней части атома, положительный заряд в этой области был больше, чем у соседних отрицательных зарядов, и электрон оттягивался больше к центральной части атома.
Рисунок \ (\ PageIndex {1} \) Модель «сливового пудинга».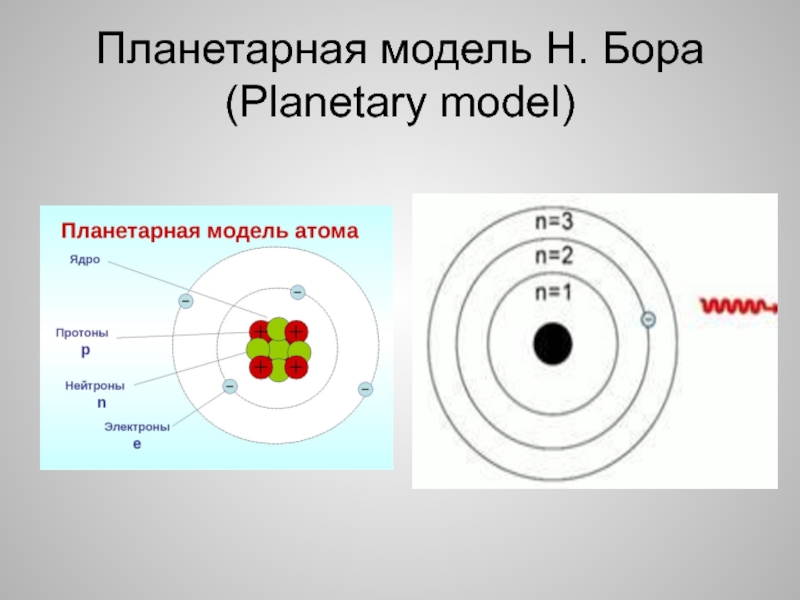
Однако эта модель атома вскоре уступила место новой модели, разработанной новозеландцем Эрнестом Резерфордом (1871-1937) примерно пятью годами позже. Томсон все же получил много наград при жизни, в том числе был удостоен Нобелевской премии по физике в 1906 году и рыцарского звания в 1908 году.
Атомы и золото
В 1911 году Резерфорд и его коллеги Ханс Гейгер и Эрнест Марсден инициировали серию новаторских экспериментов, которые полностью изменили принятую модель атома. Они засыпали очень тонкие листы золотой фольги быстро движущимися альфа-частицами.
Рисунок \ (\ PageIndex {2} \) (a) Экспериментальная установка для эксперимента Резерфорда с золотой фольгой: радиоактивный элемент, испускавший альфа-частицы, был направлен на тонкий лист золотой фольги, окруженный экраном, который позволял обнаруживать отклоненных частиц.(b) Согласно модели сливового пудинга (вверху) все альфа-частицы должны были пройти через золотую фольгу с небольшим отклонением или без него. Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу).
Резерфорд обнаружил, что небольшой процент альфа-частиц отклоняется на большие углы, что можно объяснить атомом с очень маленьким плотным положительно заряженным ядром в центре (внизу).
Согласно принятой модели атома, в которой масса и заряд атома равномерно распределены по всему атому, ученые ожидали, что все альфа-частицы пройдут через золотую фольгу с небольшим отклонением или вообще без отклонения.Удивительно, но, как показано на рисунке \ (\ PageIndex {2} \) ( в то время как большинство альфа-частиц действительно не отклонялись, очень небольшой процент (примерно 1 из 8000 частиц) отражался от золотой фольги. под очень большими углами. Некоторых даже перенаправили обратно к источнику. Никакая предварительная информация не подготовила их к этому открытию. В известной цитате Резерфорд воскликнул, что это было «как если бы вы выпустили 15-дюймовый [артиллерийский] снаряд по кусок ткани, и он вернулся и ударил вас.«
Резерфорду нужно было предложить совершенно новую модель атома, чтобы объяснить свои результаты. Поскольку подавляющее большинство альфа-частиц прошло через золото, он рассудил, что большая часть атома представляет собой пустое пространство. Напротив, сильно отклоненные частицы должны были испытать чрезвычайно мощную силу внутри атома. Он пришел к выводу, что весь положительный заряд и большая часть массы атома должны быть сосредоточены в очень маленьком пространстве внутри атома, которое он назвал ядром.Ядро – крошечное плотное центральное ядро атома, состоящее из протонов и нейтронов.
Поскольку подавляющее большинство альфа-частиц прошло через золото, он рассудил, что большая часть атома представляет собой пустое пространство. Напротив, сильно отклоненные частицы должны были испытать чрезвычайно мощную силу внутри атома. Он пришел к выводу, что весь положительный заряд и большая часть массы атома должны быть сосредоточены в очень маленьком пространстве внутри атома, которое он назвал ядром.Ядро – крошечное плотное центральное ядро атома, состоящее из протонов и нейтронов.
Атомная модель Резерфорда стала известна как ядерная модель . В ядерном атоме протоны и нейтроны, составляющие почти всю массу атома, расположены в ядре в центре атома. Электроны распределены вокруг ядра и занимают большую часть объема атома. Стоит подчеркнуть, насколько маленькое ядро по сравнению с остальной частью атома.Если бы мы могли взорвать атом до размеров большого профессионального футбольного стадиона, ядро было бы размером с шарик.
Модель Резерфорда оказалась важным шагом на пути к полному пониманию атома.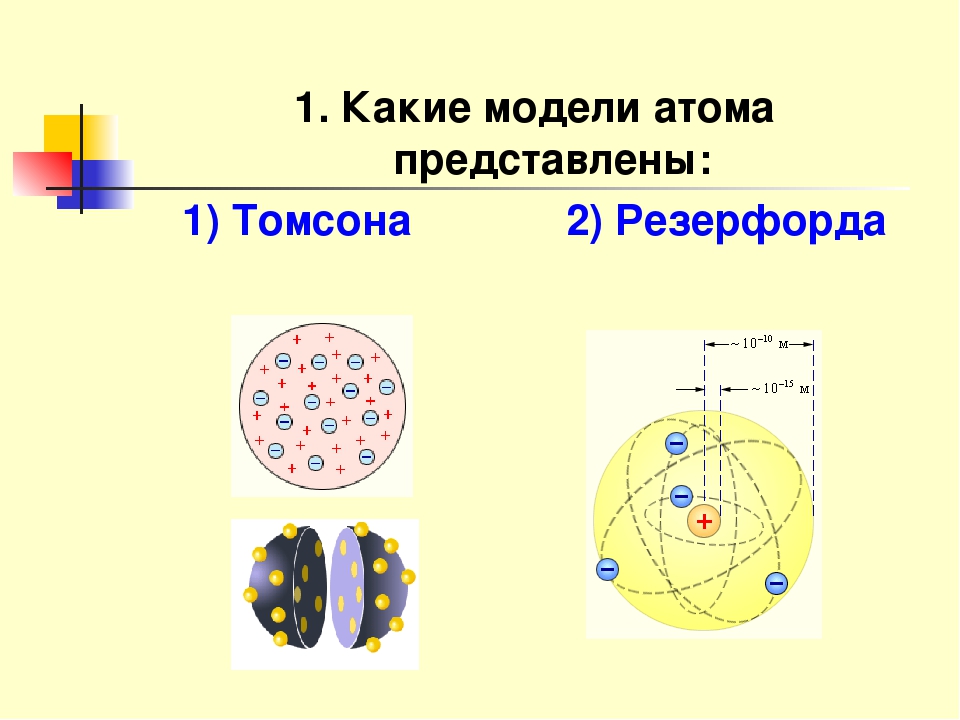 Однако он не полностью рассматривал природу электронов и то, как они занимали огромное пространство вокруг ядра. За это и другие открытия Резерфорд был удостоен Нобелевской премии по химии в 1908 году. К сожалению, Резерфорд предпочел бы получить Нобелевскую премию по физике, потому что считал физику выше химии.По его мнению, «Вся наука – это либо физика, либо коллекционирование марок».
Однако он не полностью рассматривал природу электронов и то, как они занимали огромное пространство вокруг ядра. За это и другие открытия Резерфорд был удостоен Нобелевской премии по химии в 1908 году. К сожалению, Резерфорд предпочел бы получить Нобелевскую премию по физике, потому что считал физику выше химии.По его мнению, «Вся наука – это либо физика, либо коллекционирование марок».
Сводка
- Модель сливового пудинга – это ранняя попытка показать, как выглядит атом.
- Бомбардировка золотой фольги альфа-частицами показала, что некоторые частицы отклоняются.
- Ядерная модель атома состоит из небольшой и плотной положительно заряженной внутренней части, окруженной облаком электронов.
Авторы и авторство
Экспериментальных свидетельств строения атома
Экспериментальных свидетельств строения атомаГеоргий Сивулка
23 марта 2017 г.
Представлено как курсовая работа для Ph341, Стэнфордский университет, зима 2017 г.
Введение
| Фиг.1: Трехмерный вид аппарат, подобный окончательному цилиндрическому устройству Гейгера и Марсдена. итерация, наглядно демонстрирующая рассеяние альфа-частиц золотой фольгой. (Источник: Викимедиа Commons) |
Эксперимент с золотой фольгой Резерфорда предложил
первое экспериментальное свидетельство, которое привело к открытию ядра
атом как небольшое, плотное и положительно заряженное атомное ядро.Также
известное как эксперименты Гейгера-Марсдена, открытие фактически включало
серия экспериментов Ганса Гейгера и Эрнеста Марсдена
под руководством Эрнеста Резерфорда. С помощью экспериментального метода Гейгера и Марсдена
доказательств, Резерфорд вывел модель атома, открыв атомную
ядро. Его «Модель Резерфорда», описывающая крошечный положительно заряженный
атомный центр, окруженный вращающимися электронами, был ключевым научным
открытие, раскрывающее структуру атомов, составляющих все
материя во Вселенной.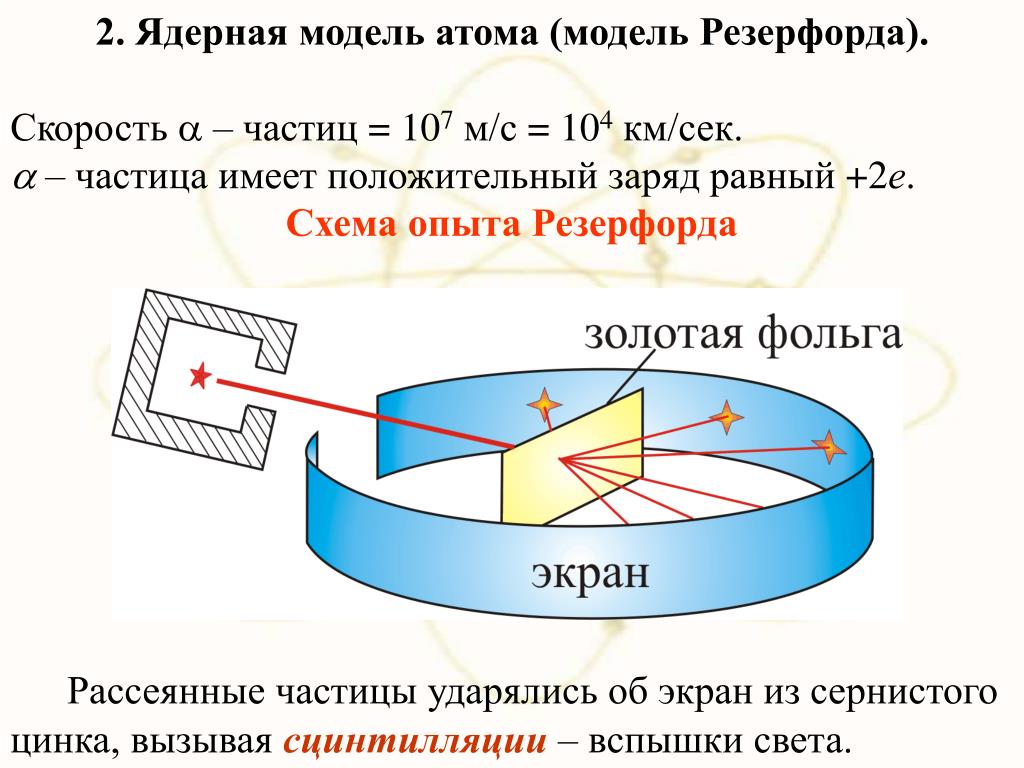
Экспериментальные доказательства открытия включал рассеяние пучка частиц после прохождения тонкой засорение золотой фольгой. Частицы, использованные для эксперимента – альфа частицы – положительные, плотные, могут испускаться радиоактивными источник. Эрнест Резерфорд открыл альфа-частицу как положительный радиоактивное излучение в 1899 году, и вывели его зарядовые и массовые свойства в 1913 году, анализируя заряд, который он вызвал в воздухе вокруг себя.[1] Как эти альфа-частицы имеют значительный положительный заряд, любой значительные потенциальные помехи должны быть вызваны большим концентрация электростатической силы где-то в структуре атом. [2]
Предыдущая модель Atom
Рис. 2: Сравнение J.J.
Атомная модель “сливового пудинга” Томпсона и модель Резерфорда
модель и ее ядро.Альфа-частицы и их рассеяние
или его отсутствие изображены дорожками черного
стрелки. (Источник:
Викимедиа
Commons) (Источник:
Викимедиа
Commons) |
Рассеяние пучка альфа-частиц должно иметь было невозможно согласно принятой в то время модели атома. Эта модель, изложенная лордом Кельвином и расширенная Дж. Дж. Томпсоном. после открытия электрона, считал, что атомы состоят из сферы положительного электрического заряда, отмеченной наличием отрицательно заряженные электроны.[3] Описание атомной модели, подобной “сливовый пудинг” предполагалось, что электроны распределены во всем этом поле положительного заряда, как сливы, распределенные в Десерт. Однако в этой модели сливового пудинга отсутствовали какие-либо значительная концентрация электромагнитной силы, которая может ощутимо влияют на любые альфа-частицы, проходящие через атомы. Таким образом, альфа частицы не должны проявлять признаков рассеяния при прохождении через тонкие иметь значение.[4] (см. Рис. 2)
Эксперименты Гейгера-Марсдена
Проверяя эту общепринятую теорию, Ганс Гейгер и Эрнест
Марсден обнаружил, что атомы действительно рассеивают альфа-частицы,
экспериментальный результат полностью противоречит модели атома Томпсона. В 1908 г. была опубликована первая статья серии экспериментов.
описание аппарата, используемого для определения этого рассеяния, и
рассеяние на малые углы.Гейгер построил двухметровую
стеклянная трубка, закрытая с одного конца радиевым источником альфа-частиц
а на другом конце – фосфоресцентный экран, излучающий свет, когда
попадание частицей. (см. рис. 3) Альфа-частицы перемещались по длине
трубки, через щель посередине и попадая в детектор экрана,
производя мерцания света, которые отмечали их точку падения.
Гейгер отмечал, что «в хорошем вакууме вряд ли и сцинтилляции были
наблюдается вне геометрического изображения щели, а когда
щель покрыта сусальным золотом, область наблюдаемых мерцаний
был намного шире, и “разницу в распределении можно было отметить с помощью
невооруженным глазом.”[5]
В 1908 г. была опубликована первая статья серии экспериментов.
описание аппарата, используемого для определения этого рассеяния, и
рассеяние на малые углы.Гейгер построил двухметровую
стеклянная трубка, закрытая с одного конца радиевым источником альфа-частиц
а на другом конце – фосфоресцентный экран, излучающий свет, когда
попадание частицей. (см. рис. 3) Альфа-частицы перемещались по длине
трубки, через щель посередине и попадая в детектор экрана,
производя мерцания света, которые отмечали их точку падения.
Гейгер отмечал, что «в хорошем вакууме вряд ли и сцинтилляции были
наблюдается вне геометрического изображения щели, а когда
щель покрыта сусальным золотом, область наблюдаемых мерцаний
был намного шире, и “разницу в распределении можно было отметить с помощью
невооруженным глазом.”[5]
Рис. 3: Схема оригинала
двухметровая труба, которую Гейгер построил и использовал для
сначала обнаруживают рассеяние альфа-частиц атомными
ядро. В точке, обозначенной R, находится частица радона.
источник излучения, а Z – экран детектора. (Источник:
Викимедиа
Commons) В точке, обозначенной R, находится частица радона.
источник излучения, а Z – экран детектора. (Источник:
Викимедиа
Commons) |
По запросу Резерфорда, Гейгер и Марсден
продолжил испытания на рассеяние под большими углами и под разными
параметры эксперимента, сбор данных, которые позволили Резерфорду
далее его собственные выводы о природе ядра.К 1909 г.
Гейгер и Марсден показали отражение альфа-частиц под углами
больше чем на 90 градусов, если наклонить источник альфа-частиц к
отражатель из фольги, который теоретически будет отражать падающий
частицы на экране обнаружения. Разделение источника частиц и
экран детектора свинцовым барьером для уменьшения паразитного излучения, они
отметил, что 1 из каждых 8000 альфа-частиц действительно отражается от
тупые углы, необходимые для отражения металлического листа на
экран с другой стороны.[6] Более того, в 1910 году Гейгер улучшил
дизайн его первого эксперимента с вакуумной лампой, что упростило измерение
расстояние отклонения, варьируйте типы и толщину фольги, а также отрегулируйте
скорость потока альфа-частиц с преградами из слюды и алюминия. Здесь он обнаружил, что и более толстая фольга, и фольга из элементов
увеличенный атомный вес привел к увеличению наиболее вероятного
угол рассеяния. Кроме того, он подтвердил, что вероятность
угол отражения более 90 градусов был «исчезающе малым» и
отметил, что увеличение скорости частиц уменьшилось наиболее вероятно
угол рассеяния.[7]
Здесь он обнаружил, что и более толстая фольга, и фольга из элементов
увеличенный атомный вес привел к увеличению наиболее вероятного
угол рассеяния. Кроме того, он подтвердил, что вероятность
угол отражения более 90 градусов был «исчезающе малым» и
отметил, что увеличение скорости частиц уменьшилось наиболее вероятно
угол рассеяния.[7]
Атом Резерфорда
Опираясь на это экспериментальное свидетельство, Резерфорд
изложил свою модель структуры атома, рассуждая о том, что атомы
четко рассеянные падающие альфа-частицы, структура содержала
гораздо большая электростатическая сила, чем предполагалось ранее; как большой угол
рассеяние было редким явлением, источник электростатического заряда был
содержится только в части общего объема атома.Как он
завершает это рассуждение «простейшим объяснением» в своей книге 1911 г.
бумаги, “атом содержит центральный заряд, распределенный через очень
малый объем “и” большие одиночные прогибы обусловлены центральным
заряда в целом ». Фактически, он математически смоделировал рассеяние
предсказанные этой моделью с этим маленьким центральным “ядром”
точечный заряд. Позже Гейгер и Марсден экспериментально подтвердили каждый из
отношения, предсказанные в математической модели Резерфорда с
методы и устройства рассеяния, которые улучшили свои предыдущие
работа, подтверждающая атомную структуру Резерфорда.[4, 8, 9] (см. Рис.
1)
Фактически, он математически смоделировал рассеяние
предсказанные этой моделью с этим маленьким центральным “ядром”
точечный заряд. Позже Гейгер и Марсден экспериментально подтвердили каждый из
отношения, предсказанные в математической модели Резерфорда с
методы и устройства рассеяния, которые улучшили свои предыдущие
работа, подтверждающая атомную структуру Резерфорда.[4, 8, 9] (см. Рис.
1)
С экспериментально проанализированным характером прогиба альфа-лучей тонкой золотой фольгой, правда обрисовывая структуру атом встает на место. Хотя позже немного поправил Quantum Механика эффектов, понимание строения атома сегодня почти полностью следует выводам Резерфорда о Эксперименты Гейгера и Марсдена. Это знаменательное открытие принципиально развивает все области науки, навсегда изменяя человечество понимание окружающего мира.
© Георгий Сивулка. Автор дает разрешение копировать, распространять и отображать эту работу в неизменном виде, с ссылка на автора, только в некоммерческих целях. Все остальные права, в том числе коммерческие, принадлежат автору.
Список литературы
[1] Э. Резерфорд, “Урановая радиация и Производимая им электрическая проводимость, Philos. Mag. 47 , 109 (1899).
[2] E.Резерфорд, “Структура атома”, Филос. Mag. 27 , 488 (1914).
[3] Дж. Дж. Томсон, “О структуре атома: Исследование устойчивости и периодов колебаний ряда Корпускулы, расположенные через равные промежутки времени по окружности Круг; с применением результатов к теории атомного Структура, Philos. Mag. 7 , 237 (1904)
[4] Э. Резерфорд, “Рассеяние α и β-частицы в веществе и строение атома // Philos.Mag. 21 , 669 (1911).
[5] Х. Гейгер, “О рассеянии α Частицы по материи, Proc. R. Soc. A 81 , 174 (1908).
[6] Х. Гейгер и Э. Марсден, «О диффузном Отражение α-частиц, Proc. R. Soc. A 82 , 495 (1909).
[7] Х. Гейгер, “Рассеяние α Частицы по материи, Proc. R. Soc. A 83 , 492 (1910).
[8] E.Резерфорд, “Происхождение α и β” Лучи радиоактивных веществ, Philos. Mag. 24 , 453 (1912).
[9] Х. Гейгер и Э. Марсден, “Законы отклонения. α-частиц под большими углами, Philos. Mag. 25 , 604 (1913).
История открытия ядра | Разделы | Американский институт физики
Резерфорд в Манчестере, 1907–1919 гг.
Эрнест Резерфорд открыл ядро атома в 1911 году.Мы читаем об этом в учебниках и в популярных произведениях. Но что означает это заявление? Географическое открытие обычно означает, что человек видит место впервые. Но может ли открытие быть таким же для царства, скрытого от глаз? В этом смысле нельзя увидеть атом. Это намекает на то, что, возможно, история открытия ядра была более сложной. История, развернувшаяся в лаборатории Резерфорда в Манчестерском университете, вращалась вокруг реальных людей. Это было связано с разочарованиями и победами.Это было связано с тяжелым трудом, недоумением и вдохновением.
Когда Резерфорд стал профессором Манчестера в 1907 году, он нашел современные лаборатории как для преподавания, так и для исследований. По настоянию его предшественника Артура Шустера было собрано более 40 000 фунтов стерлингов для финансирования программы по физике. Для сравнения: щедрая зарплата Резерфорда составляла 1600 фунтов стерлингов в год. Кредит: Из книги: Физические лаборатории Манчестерского университета: отчет о 25-летней работе Манчестерского университета, Манчестер: в University Press, 1906.AIP Эмилио Сегре Визуальные архивы, Коллекция хрупких книг.Резерфорд прибыл в Манчестер летом 1907 года, за несколько месяцев до начала семестра в университете. Его назвали профессором физики Лэнгуорти, преемником Артура Шустера (1851–1934), который вышел на пенсию в возрасте 56 лет, чтобы нанять Резерфорда. Шустер построил современный физический корпус, нанял Ханса Гейгера, доктора философии. (1882–1945) благодаря своим экспериментальным способностям и обеспечил новую должность в математической физике, чтобы завершить полную физическую программу.Резерфорд вошел в центр мира физики. Исследователи приходили к нему десятками.
Прослушать голосовой фрагмент
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Я нашел квартиру Резерфорда очень занятой, усердно работающей. Но очень грязное место. А именно, Манчестер очень туманный, туманный и дымный. И, конечно, везде дым, везде дым. Теперь в лаборатории Резерфорда использовали электроскоп.Вы должны сами построить его из ящиков с какао, сусального золота и изоляции серы. А электроскоп заряжаешь сургучом, которым натираешь брюки. Так что это была очень примитивная техника. Но, конечно же, микроскоп для чтения электроскопа. Теперь микроскоп был закреплен, и тогда нельзя было его трогать. И, конечно, вы не должны были его чистить. Так проходили годы без чистки аппаратов. Но не считая недостатков, это была прекрасная лаборатория, хорошие комнаты, и там работало много людей – способных людей…. Я очень хорошо помню Мозли, с которым мы были в очень дружеских отношениях. О его творчестве я расскажу позже. И Чарльз Дарвин был там. Он читал лекции по теоретической физике. И Рассел, который позже приехал в Оксфорд. Итальянец Росси проделал спектроскопическую работу. Он показал, что ионий и натрий имеют одинаковый спектр. А потом был Гейгер. Он был помощником. А также помощник по имени Маковер, который умер с тех пор. Гейгер и Маковер вместе издали книгу. А также парень Робинсон, который работал над бета-лучами.Грей, новозеландский мужчина. Марсден, приехавший из Австралии. Фаяны, приехавшие из Германии. И Болтвуд был там какое-то время. Он приехал из Йеля. Резерфорд пригласил его в надежде, что Болтвуд, великий химик, очистит ионий, но он потерпел неудачу, как и многие другие.
Резерфорд прибыл, имея в виду множество исследовательских вопросов. Он не закончил разгадывать загадки распадающихся семейств тория, радия и т. Д., Но он передал большую часть этой работы Болтвуду, Хану и Содди. Болтвуд и Хан оба работали с Резерфордом в Манчестере, Болтвуд в 1909–1910 годах и Хан в 1907–1908 годах.Резерфорд постепенно обращал свое внимание гораздо больше на сами лучи α (альфа), β (бета) и γ (гамма) и на то, что они могут раскрыть об атоме. То есть он оставил радиохимию другим и обратился к физике.
Резерфорд всегда собирал вокруг себя группу талантливых молодых исследователей. На этой групповой фотографии 1910 года – Эрнест Марсден и Ханс Гейгер. Спереди и в центре – профессора Шустер и Резерфорд, а в центре сзади – Уильям Кей, талантливый и услужливый управляющий лабораторией.Предоставлено: Дж. Б. Биркс, изд., Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), напротив стр. 38.В раннюю команду Резерфорда в Манчестере входили Гейгер и Уильям Кей (1879–1961), младший лаборант с 1894 года. Резерфорд повысил Кея до стюарда лаборатории в 1908 году, чтобы управлять лабораторным оборудованием и помогать ему в его исследованиях. В 1957 году Кей вспомнил свою молодость с Резерфордом в интервью. Язык необычный, но описание максимально приближено к подходу Резерфорда.Спрашивал Сэмюэл Девонс (1914–2006), который был одним из последних учеников Резерфорда в 1930-х годах.
Ганс Гейгер был главным партнером Резерфорда в исследованиях альфа-лучей с 1907 по 1913 год. Вместе они разработали несколько способов обнаружения альфа-лучей. Они доказали, что альфа-лучи – это дважды ионизированные ядра гелия.Ок. 1908. Предоставлено: AIP Эмилио Сегре Visual Archives, Physics Today Collection.[Девонс] «Когда вы были здесь [в Манчестере], в то время … Резерфорд действительно делал какие-нибудь аппараты сам?»
[Кей] «Нет, нет, нет, нет. Мы привыкли, я настраивал почти весь его аппарат. Знаете, когда он делал свою работу, знаете, чаще всего он мне рассказывал, и мы проводили грубый эксперимент, повторно … »
[Д.] «Он набросал то, что хотел?»
[K.] «Ну, он скажет вам, что он хочет, грубо, понимаете, но он позволил вам сделать то, что вы хотите, понимаете, он сказал вам, что он собирался сделать, Понимаете, это было очень хорошо. Он дает вам ……… он многому вас научил, и вы знали, что делать, а чего не делать. А затем мы проводили грубый эксперимент и получали одну или две кривые, которые вы видите, а затем сразу же переключали их на кого-то другого, чтобы он проделал настоящую работу, и вот как он делал свое…….. напал на эти мелочи, понимаете.
[D.] «Он сам попробовал их первым?»
[K.] «Он сам проводил грубый эксперимент над мелочами, понимаете, а затем передавал его кому-нибудь …» (цитируется по Hughes, стр. 104)
Резерфорд и Ханс Гейгер тесно работали в 1907 и 1908 годах над обнаружением и измерением α частиц. Если бы они использовали α частиц для зондирования атома, им нужно было сначала узнать больше об этих частицах и их поведении. Резерфорд попытался подсчитать α частиц, но безуспешно.
Год спустя в Манчестере ему и Гейгеру удалось двумя методами наблюдать α частиц.Первый метод заключался в сцинтилляции, возбуждаемой α частицами на тонком слое сульфида цинка. Они наблюдали их через микроскоп и подсчитывали сцинтилляции при разных углах рассеяния. Они также разработали «электрометр», который мог продемонстрировать прохождение отдельной частицы α большой аудитории. Инструмент, который превратился в «счетчик Гейгера», имел частично откачанный металлический цилиндр с проволокой в центре. Они приложили напряжение между цилиндром и проводом, достаточно высокое, чтобы образовалась искра.Они пропускали α частиц через тонкое слюдяное окно, где эти частицы сталкивались с газами, образуя ионы газа. Затем они столкнулись с другими молекулами и образовали больше ионов и так далее. Каждая частица α производила каскад ионов, которые частично разряжали цилиндр и указывали на прохождение частицы α . Гейгер и Резерфорд опубликовали несколько статей в 1908 и 1909 годах об этих методах и их использовании.
Резерфорд написал Генри Бамстеду (1870–1920), американскому физику, 11 июля 1908 г .:
Гейгер – хороший человек и работал как раб.Я никогда не смог бы найти время для тяжелой работы, пока мы не наладили бы дела в хорошем стиле. Наконец-то все прошло хорошо, но черт рассыпается. Наша трубка работала как шарм, и мы могли легко получить дальность хода до 50 мм. для каждой частицы. … Гейгер – демон, который подсчитывает мерцания, и может считать с интервалами в течение всей ночи, не нарушая своего хладнокровия. Я чертовски энергично удалился через две минуты. (Цит. У Евы, с. 180.)
Хотя Резерфорд еще в 1906 году подозревал, что α частиц были атомами гелия, лишенными электронов, он потребовал строгих доказательств.Одного эксперимента было недостаточно. Одного детектора было недостаточно. Он хотел больше доказательств. Для этого Резерфорд хотел «больших напряжений» и больших электромагнитов, чтобы отклонить α частиц, но этот метод еще не созрел. Стюард лаборатории Уильям Кей вспомнил в цитируемом интервью устной истории, что Резерфорд в 1908 году настаивал на необходимости сильных электрических и магнитных полей для более точного измерения заряда и массы частиц α и β :
И вот кем он был все время.Это то, что он получил в Кембридже [после 1919 года], чего у нас здесь не было, понимаете, потому что у нас не было денег. (Хьюз, «Уильям Кей», 2008 г., стр. 109–110.)
Кей сказал, что Резерфорду нужен большой магнит с водяным охлаждением, но он «уронил его, как горячий пирог», когда узнал его стоимость. Так что ему требовалась новая линия атаки. Новая линия была очень простой, химическая процедура смешивалась с физикой. Для этой работы Резерфорд нанял Томаса Ройдса (1884–1955), который получил диплом с отличием по физике в 1906 году.Они собрали α частиц в герметичную стеклянную трубку, сжали их и пропустили электрическую искру. Они изучили излучаемый свет с помощью спектроскопа и обнаружили, что он идентичен спектру гелия. Через несколько месяцев Резерфорд был удостоен Нобелевской премии по химии «за исследования распада элементов и химии радиоактивных веществ». (Нобелевская цитата) Резерфорд и Ройдс установили идентичность и основные свойства α частиц.Затем Резерфорд обратил свое внимание на их использование для исследования атома.
Осенью 1908 года началась важная серия исследований. Гейгер пропускал лучи из α частиц через золотую и другие металлические фольги, используя новые методы обнаружения, чтобы измерить, насколько эти лучи рассеиваются атомами в фольге. Гейгер подумал, что Эрнест Марсден (1889–1970), 19-летний студент с отличием по физике, был готов помочь в этих экспериментах, и предложил это Резерфорду.Поскольку Резерфорд часто подталкивал студентов третьего курса к исследованиям, говоря, что это лучший способ изучить физику, он с готовностью согласился.
Этот набросок из статьи Гейгера и Марсдена 1909 года показывает коническую стеклянную трубку, полную «излучения радия» (радона), закрытую в точке B тонкой пластиной из слюды. Это был их источник альфа ( α ) частиц. S представляет собой экран из сульфида цинка, который мерцает при ударе частицей α . P представлял собой свинцовый экран, который блокировал перемещение любых частиц α непосредственно на экран из сульфида цинка.RR представлял собой фольгу (или фольгу) из различных металлов (включая золото), которая «диффузно отражала» падающие α частиц. Гейгер и Марсден наблюдали образовавшиеся сцинтилляции с помощью микроскопа M. Авторы и права: Х. Гейгер и Э. Марсден, «О диффузном отражении α -частиц», Proceedings of the Royal Society , 1909, 82: 495–500.Гейгер и Марсден начали с малоугловой дисперсии и попробовали фольгу разной толщины, пытаясь найти математические соотношения между дисперсией и толщиной фольги или числом пройденных атомов.Позже Марсден вспоминал, что Резерфорд сказал ему во время этих экспериментов: «Посмотри, сможешь ли ты получить какой-нибудь эффект от прямого отражения альфа-частиц от металлической поверхности». (Сообщено Марсденом в Birks, 1962, стр. 8). Марсден сомневался, что Резерфорд ожидал обратного рассеяния α частиц, но, как писал Марсден,
… это была одна из тех «догадок», что, возможно, может наблюдаться какой-то эффект, и что в любом случае соседнюю территорию с землей Тома Тиддлера можно будет исследовать с помощью разведки.Резерфорд всегда был готов встретить неожиданное и использовать его там, где это было выгодно, но он также знал, когда остановиться на таких экскурсиях. (Биркс, 1962, с. 8)
Это был игривый подход Резерфорда в действии. Его ученики и другие люди опробовали его идеи, многие из которых зашли в тупик. Однако эта идея искать обратное рассеяние α частиц окупилась. Резерфорд писал:
Эксперимент, направляемый дисциплинированным воображением отдельного человека или, что еще лучше, группы людей с различным мировоззрением, может дать результаты, которые далеко превосходят только воображение величайшего философа.(Цит. По Eve, 1939, Frontmatter)
Спустя некоторое время, в 1908 или 1909 году, Марсден сообщил о своих результатах Резерфорду. Резерфорд вспоминал об этом несколько иначе:
Я помню … позже Гейгер пришел ко мне в большом волнении и сказал: «Мы смогли получить некоторые из α -частиц, летящих назад …» Это было самое невероятное событие, которое когда-либо происходило. меня в моей жизни. Это было почти невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас.( Резерфорд , 1938, стр. 68)
Человеческая память подвержена ошибкам. Говорил ли Марсден или Гейгер Резерфорду, эффект был одинаковым. Резерфорд сказал, что они должны подготовить публикацию об этом исследовании, которое они представили в мае 1909 года. Более того, это заставило Резерфорда задуматься о том, что в конечном итоге, почти два года спустя, он опубликовал как теорию атома.
Чем занимался Резерфорд остаток 1909 года и весь 1910 год? Во-первых, его близкий друг Болтвуд был в Манчестере в течение учебного года, работая с Резерфордом над продуктами радиоактивного распада радия.Он также рассматривал более ранние идеи об атомной структуре и говорил о них. Что наиболее важно, он систематически исследовал явление рассеяния α частиц и тестировал каждую деталь. Резерфорд не сразу придумал свою смелую идею – ядерный атом, но пришел к ней постепенно, рассматривая проблему со всех сторон.
Осенью 1910 года он привез Марсдена обратно в Манчестер, чтобы завершить тщательную экспериментальную проверку своих идей с помощью Гейгера. Они повторно установили уровни выбросов и диапазоны α частиц радиоактивными источниками, а также повторно изучили свой статистический анализ.Резерфорд попытался согласовать результаты рассеяния с различными моделями атомов, особенно с моделью Дж. Дж. Томсона, в котором положительное электричество считалось распределенным равномерно по всей сфере атома.
Страница ранних, недатированных (1910 или 1911) черновых заметок Резерфорда. Первые несколько строк гласят: «Теория строения атома. Предположим, что атом состоит из + заряда ne в центре & – заряда, поскольку электрон распределен по сфере радиуса r». Затем он обобщил идеи о вычислении силы отклонения заряженной частицы, проходящей близко к этому заряженному центру.Предоставлено: Дж. Б. Биркс, изд., Резерфорд в Манчестере, (Лондон: Heywood & Co., 1962), стр. 70.В какой-то момент зимой 1910–1911 годов Резерфорд разработал основную идею атома с «заряженным центром». Как отметили Гейгер и Марсден в своей статье 1909 года:
Если принять во внимание высокую скорость и массу α -частицы, кажется удивительным, что некоторые из α -частиц, как показывает эксперимент, могут быть повернуты в пределах слоя 6 x 10 -5. см.золота на угол 90 ° и даже больше. Чтобы произвести аналогичный эффект с помощью магнитного поля, потребуется огромное поле в 109 абсолютных единиц. (Биркс, с. 179)
Резерфорд в своей статье в мае 1911 года пришел к выводу, что такое замечательное отклонение пути массивной заряженной частицы может быть достигнуто только в том случае, если большая часть массы, скажем, атома золота и большая часть его заряда будут сосредоточены в очень маленьком центральном элементе. тело. Примечание: на тот момент в 1911 году Резерфорд не называл это ядром.«
Послушайте, как Чедвик расскажет о первом публичном заявлении Резерфорда
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Первое публичное заявление о ядерной теории Резерфорда было сделано на собрании Манчестерского литературно-философского общества, и он пригласил нас, молодых людей, пойти на собрание. Он сказал, что хочет сказать несколько интересных вещей и подумал, что мы хотели бы их услышать.В то время мы не знали, о чем это было. Старшие люди в лаборатории знали, конечно, Гейгер и Марсден знали, потому что они уже проводили эксперименты. Фактически, Резерфорд никогда не упоминал об этом публично, если только они не сделали того, что было достаточным для того, чтобы иметь решающее значение. И, конечно же, Дарвин знал об этом намного раньше. Но это должно было быть в начале 1911 года, и мы пошли на собрание, и он рассказал нам. И тогда он упомянул, что были некоторые экспериментальные доказательства, полученные Гейгером и Марсденом.Насколько я помню, он не сказал больше о результатах, кроме того, что они были решающими. И, как я уже говорил, он никогда бы не сделал публичного заявления такого рода, если бы у него не было веских доказательств. И это одна из характеристик, которая пронизывает все работы Резерфорда, особенно все его работы до конца манчестерского периода. Если вы посмотрите на некоторые из его работ в первые дни – я называю МакГилла первые дни – он был вполне убежден, что альфа-частицы были атомами гелия, но он никогда не говорил этого в этих словах.Он всегда говорил, что это либо атомы гелия, либо молекулы водорода, или, возможно, он мог сказать что-то еще в этом роде. Для него было весьма характерно то, что он никогда не сказал бы, что что-то было так, если бы у него не было экспериментальных доказательств этого, которые действительно его удовлетворили.
Фактически, Резерфорд был чрезвычайно осторожен, делая выводы об этом центральном заряде: «Простой расчет показывает, что атом должен быть местом сильного электрического поля, чтобы вызвать такое большое отклонение при одном столкновении.»(Биркс, стр. 183). Он быстро и примерно пришел к выводу, что несколько количественных соотношений должны быть верными, если эта основная теория верна. Во-первых, количество рассеянных под заданным углом α частиц должно быть пропорционально толщине фольги. Во-вторых, это число должно быть пропорционально квадрату заряда ядра. Наконец, она должна быть обратно пропорциональна четвертой степени скорости частицы α . Эти три идеи составили экспериментальную программу Гейгера и Марсдена на следующий год.
Послушайте, как Чедвик говорит об интересе Резерфорда к исследованиям
Для прослушивания этого аудиоклипа необходимо установить Flash Player.
Резерфорд тогда почти полностью интересовался исследованиями. Он очень мало преподавал в Макгилле. Он был профессором-исследователем. Я предполагаю, что он читал какие-то лекции, но их было бы очень мало. И его интерес, естественно, был в исследовательской сфере. Он действительно читал несколько лекций, но элементарных лекций – такого рода вещи, которые вы ожидаете от человека, должны знать до того, как он приедет в университет.Это были лекции для инженеров. Они были хулиганами, и Резерфорд мог держать их под контролем. Возможно, в отделе был только один человек, который мог бы это сделать, и ему (Резерфорду?) Они понравились, потому что он смог показать им очень интересные эксперименты, которые можно проводить на начальных курсах.
Мне часто говорили, что Резерфорд был плохим лектором. Никогда не слышал такой ерунды. Совершенно верно, что иногда он бывал немного скучным, немного запутанным, но это было только в очень редких случаях.Были и другие случаи, когда он действительно был наиболее возбуждающим. Он восхищался огромным энтузиазмом.
Резерфорд допускал возможность отрицательного заряженного центра. Сегодня это звучит странно, так что же сделало это разумным? Во-первых, она не сильно отличалась от модели Томсона. Во-вторых, поскольку Резерфорд знал, что α частиц несут двойной заряд +, он подумал, что это может действовать так же, как Солнце на комету, движущуюся рядом с ним.Он будет направлять частицу α назад и назад к ее источнику. Он также рассмотрел почти забытую модель, предложенную японским физиком Хантаро Нагаока (1865–1950) – модель Сатурна. Нагаока и Резерфорд контактировали в 1910 и 1911 годах, и Резерфорд упомянул модель Нагаоки о «центральной притягивающей массе, окруженной кольцами вращающихся электронов» (Биркс, стр. 203). Конечным результатом этой критической статьи Резерфорда, однако, стало заявление Резерфорда о том, что независимо от того, был ли атом диском или сферой, и действительно, был ли центральный заряд положительным или отрицательным, не повлияло на расчеты.Резерфорд всегда старался не требовать большего, чем его результаты могли подтвердить.
В теперь известной работе Резерфорда от мая 1911 года о рассеянии альфа-частиц золотой фольгой он включил этот набросок гиперболического пути частицы. Авторы и права: Э. Резерфорд, «Рассеяние α и β частиц веществом и структура вещества», Philosophical Magazine , 1911, 21: 669–688.Резерфорд действительно видел возможные проверки природы центрального заряда. По его словам, поглощение β частиц должно отличаться с отрицательным центром и положительным.Положительный центр объясняет большую скорость, которую α частиц достигают во время излучения радиоактивных элементов. Но это были только намеки.
Эта схема представляет собой усовершенствованные эксперименты 1912–1913 годов, проведенные Гейгером и Марсденом. R был источником альфа-частиц, E – золотой фольгой, а M – микроскопом, вращающимся вокруг вертикальной оси с центром на золотой фольге. Альфа-частицы от источника проходили через диафрагму D, рассеивались фольгой и наблюдались в виде сцинтилляций на экране S.Гейгер и Марсден наблюдали углы рассеяния частиц, вращая сборку экрана микроскопа. Авторы и права: Х. Гейгер и Э. Марсден, «Законы отклонения частиц α на большие углы», Philosophical Magazine , 1913, 25: 604–623.Гейгер и Марсден действительно систематически работали над проверяемыми выводами гипотезы о центральном заряде Резерфорда. Первая крупная публикация их результатов была на немецком языке в журнале Proceedings Венской академии наук ( Sitzungberichte der Wiener Akademie der Wissenschaften) в 1912 году.За этой 30-страничной версией в 1913 г. последовала версия на английском языке в Philosophical Magazine: «Законы отклонения частиц α под большими углами». Английская версия является наиболее известной. Небольшие различия между ними привели одного историка к предположению, что Резерфорд принял решение в пользу положительно заряженного центра к августу 1912 года (Trenn, 1974). Другие члены команды Резерфорда, особенно Чарльз Гальтон Дарвин (1887–1962), Х.Г.Дж. Мозли (1887–1915) и Нильс Бор (1885–1962) сыграли важную роль в окончательном создании ядерного атома Резерфорда.
Молодой Генри Дж. Дж. Мозли, в лаборатории Баллиола-Тринити, Оксфорд, ок. 1910. Позже в том же году Мозли начал исследования в манчестерской лаборатории Резерфорда. Его блестящая карьера была прервана в боях Первой мировой войны. Авторы: Оксфордский университет, Музей истории науки, любезно предоставлено AIP Emilio Segrè Visual Archives, Physics Today, Collection.«Великая война» полностью нарушила работу манчестерского департамента Резерфорда. Бор вернулся в Данию. Марсден принял профессуру в Новой Зеландии.Мозли погиб в битве при Галлиполи. Джеймс Чедвик (1891–1974), который работал с Гейгером в Техническом университете Берлина, когда разразилась война, провел несколько лет в лагере для военнопленных Рухлебен. Другие студенты тоже ушли на войну, и Резерфорд посвятил много энергии мобилизации науки для военных действий и, в частности, противолодочным методам.
Нильс Бор впервые работал с Резерфордом в зданиив Манчестере в 1912 году. На этой фотографии показаны молодые Нильс и Маргрет Бор, ок.1914 г., когда Бор сменил Чарльза Гальтона Дарвина на посту читателя по математической физике в Манчестере. Предоставлено: AIP Emilio Segre Visual Archives, Margrethe Bohr Collection.
На этом отвлеченном фоне Резерфорд и его лаборант Уильям Кей в 1917 году начали исследовать прохождение α частиц через водород, азот и другие газы. Когда закончилась Великая война, Эрнест Марсден ненадолго помог с утомительными сцинтилляционными наблюдениями, которые дали ключ к разгадке природы ядра.Резерфорд сообщил о предварительных результатах этих обширных экспериментов в 1919 году. Резерфорд поместил источник радия C (висмут-214) в герметичный латунный контейнер, приспособленный так, чтобы положение источника могло быть изменено и чтобы можно было вводить различные газы или по желанию создавался вакуум. Частицы α пересекли внутреннюю часть контейнера, прошли через щель, покрытую серебряной пластиной или другим материалом, и попали на экран из сульфида цинка, где в затемненном помещении наблюдали сцинтилляцию.Когда газообразный водород был введен в контейнер и были приняты меры для поглощения α частиц до того, как они попадут на экран, сцинтилляции все еще наблюдались. Резерфорд утверждал, что, проходя через газообразный водород, частицы α иногда сталкивались с ядрами водорода. Как писал Резерфорд, это произвело «быстрые атомы водорода», которые в основном проецировались вперед в направлении первоначального движения частиц α .
Во время этих экспериментов Резерфорд имел в виду несколько тонких вопросов, в основном связанных с природой ядра.Он попросил своего коллегу Дарвина проанализировать эти столкновения на основе “ простой теории ” упругих столкновений между точечными ядрами, отталкиваемыми по закону обратных квадратов, при этом α частиц несут заряд, в 2 раза превышающий заряд электрона (и противоположного знака). ) и ядра водорода 1 раз. Дарвин обнаружил, что все α частиц, приближающихся в пределах 2,4х10 -13 см, будут производить «быстрый атом водорода». Однако эта простая теория предсказывала гораздо меньше ускоренных атомов водорода, чем наблюдалось в экспериментах.
Резерфорд отверг объяснения этой дисперсии, основанные на различных зарядах частиц или других законах, чем законы обратных квадратов. Скорее, он пришел к выводу, что для расстояний порядка диаметра электрона «структура ядра гелия больше не может рассматриваться как точка…». Он утверждал, что ядро гелия ( α частица) имеет сложную структуру из четырех ядер водорода плюс двух отрицательно заряженных электронов. (Мы бы сказали, что он состоит из двух протонов.Резерфорд пришел к выводу, что деформация сложных ядер во время столкновений была более вероятным объяснением, поскольку изменение сил между ядрами сложным образом меняется при близком сближении.
Принимая во внимание сильные силы, возникающие при таких столкновениях, неудивительно, если бы ядро гелия распалось. Никаких доказательств такого распада … не наблюдалось, что указывает на то, что ядро гелия должно быть очень стабильной структурой.
Мы должны помнить, что Резерфорд не мог напрямую наблюдать структуру ядра, поэтому его выводы были предварительными.Тем не менее он открыто рассматривал возможности сложного ядра, способного к деформации и даже к возможному распаду. Эти мысли сформировали этот напряженный период экспериментальных исследований.
Модель атома водорода Бора – University Physics Volume 3
Цели обучения
К концу этого раздела вы сможете:
- Объясните разницу между спектром поглощения и спектром испускания излучения, испускаемого атомами
- Опишите эксперимент Резерфорда с золотой фольгой и открытие атомного ядра
- Объясните атомную структуру водорода
- Опишите постулаты ранней квантовой теории атома водорода
- Обобщите, как квантовая модель атома водорода Бора объясняет спектр излучения атомарного водорода
Исторически модель атома водорода Бора – это самая первая модель атомной структуры, которая правильно объяснила спектры излучения атомарного водорода.Эта модель занимает особое место в истории физики, потому что она представила раннюю квантовую теорию, которая привела к новому развитию научной мысли и позже привела к развитию квантовой механики. Чтобы понять специфику модели Бора, мы должны сначала рассмотреть открытия девятнадцатого века, которые побудили ее сформулировать.
Когда мы используем призму для анализа белого света, исходящего от Солнца, наблюдаются несколько темных линий в солнечном спектре ((Рисунок)). Линии поглощения Солнца называются линиями фраунгофера в честь Джозефа фон Фраунгофера, который точно измерил их длины волн.В 1854–1861 годах Густав Кирхгоф и Роберт Бунзен обнаружили, что для различных химических элементов линейчатый спектр излучения элемента точно соответствует его линейчатому спектру поглощения. Разница между спектром поглощения и спектром излучения поясняется на (Рисунок). Спектр поглощения наблюдается при прохождении света через газ. Этот спектр выглядит как черные линии, которые появляются только на определенных длинах волн на фоне непрерывного спектра белого света ((Рисунок)).Отсутствующие длины волн говорят нам, какие длины волн излучения поглощаются газом. Спектр излучения наблюдается, когда свет излучается газом. Этот спектр виден в виде разноцветных линий на черном фоне (см. (Рисунок) и (Рисунок)). Положение эмиссионных линий говорит нам, какие длины волн излучения испускает газ. Каждый химический элемент имеет свой характерный спектр излучения. Для каждого элемента положение его эмиссионных линий точно такое же, как и положение его линий поглощения.Это означает, что атомы определенного элемента поглощают излучение только на определенных длинах волн, а излучение, не имеющее этих длин волн, вообще не поглощается элементом. Это также означает, что излучение, испускаемое атомами каждого элемента, имеет точно такие же длины волн, что и поглощаемое ими излучение.
В спектре солнечного излучения в видимом диапазоне от 380 до 710 нм линии фраунгофера наблюдаются как вертикальные черные линии в определенных спектральных положениях в непрерывном спектре.Высокочувствительные современные приборы наблюдают тысячи таких линий.
Наблюдение линейчатых спектров: а – установка для наблюдения линий поглощения; (б) установка для наблюдения эмиссионных линий. (а) Белый свет проходит через холодный газ, содержащийся в стеклянной колбе. Призма используется для разделения длин волн прошедшего света. В спектре прошедшего света отсутствуют некоторые длины волн, которые видны как черные линии поглощения в непрерывном спектре на экране просмотра.(б) Газ содержится в стеклянной газоразрядной трубке с электродами на концах. При большой разнице потенциалов между электродами газ светится, и свет, излучаемый газом, проходит через призму, разделяющую его длины волн. В спектре излучаемого света присутствуют только волны определенной длины, которые видны на экране в виде красочных линий излучения.
Спектр излучения атомарного водорода: Спектральное положение линий излучения характерно для атомов водорода.(кредит: «Мериканто» / Wikimedia Commons)
Спектр излучения атомарного железа: Спектральное положение линий излучения характерно для атомов железа.
Спектры излучения элементов имеют сложную структуру; они становятся еще более сложными для элементов с более высокими атомными номерами. Простейший спектр, показанный на (Рисунок), принадлежит атому водорода. Человеческому глазу видно всего четыре линии. Если читать справа налево на (Рисунок), это следующие линии: красные (656 нм), называемые H-линией; голубой (486 нм), синий (434 нм) и фиолетовый (410 нм).Линии с длинами волн короче 400 нм появляются в ультрафиолетовой части спектра ((Рисунок), крайний слева) и невидимы для человеческого глаза. У водорода в ряду невидимых спектральных линий бесконечно много.
Эмпирическая формула для описания положений (длин волн) линий излучения водорода в этой серии была открыта в 1885 году Иоганном Бальмером. Она известна как формула Бальмера:
.Постоянная называется постоянной Ридберга для водорода.На (Рисунок) положительное целое число n принимает значения для четырех видимых линий в этой серии. Серия эмиссионных линий, заданная формулой Бальмера, называется серией Бальмера для водорода. Другие линии излучения водорода, открытые в двадцатом веке, описываются формулой Ридберга, которая суммирует все экспериментальные данные:
Когда серия спектральных линий называется серией Лаймана. Когда ряд называется рядом Бальмера, и в этом случае формула Ридберга совпадает с формулой Бальмера.Когда сериал называется серией Пашена. Когда сериал называется серией Брэкетта. Когда серия называется серией Pfund. Когда у нас есть серия Хамфриса. Как вы можете догадаться, таких спектральных полос в спектре водорода бесконечно много, потому что это может быть любое положительное целое число.
Формула Ридберга для водорода дает точное положение спектральных линий, наблюдаемых в лаборатории; однако в начале двадцатого века никто не мог объяснить, почему это так хорошо работает.Формула Ридберга оставалась необъясненной до тех пор, пока в 1913 году не была предложена первая успешная модель атома водорода.
Проверьте свое понимание Каковы ограничения серии Lyman? Вы видите эти спектральные линии?
121,5 нм и 91,1 нм; нет, эти спектральные полосы находятся в ультрафиолете
Ключ к разгадке тайны атомных спектров – понимание атомной структуры. Ученым давно известно, что материя состоит из атомов. Согласно науке девятнадцатого века, атомы – это наименьшие неделимые количества материи.Это научное убеждение было разрушено серией новаторских экспериментов, доказавших существование субатомных частиц, таких как электроны, протоны и нейтроны.
Электрон был открыт и идентифицирован как наименьшее количество электрического заряда Дж. Дж. Дж. Томсон в 1897 году в своих экспериментах с катодными лучами, также известными как эксперименты с β-лучами: β -луч – это пучок электронов. В 1904 году Томсон предложил первую модель атомной структуры, известную как модель «сливового пудинга», в которой атом состоит из неизвестной положительно заряженной материи с внедренными в нее отрицательными электронами, как сливы в пудинге.Приблизительно в 1900 году Э. Резерфорд и независимо Пол Ульрих Виллард классифицировали все известное в то время излучение как -лучей, β -лучей и γ -лучей ( γ -лучей представляет собой пучок с высокой энергией. фотоны). В 1907 году Резерфорд и Томас Ройдс использовали методы спектроскопии, чтобы показать, что положительно заряженные частицы -излучения (называемые -частицами) на самом деле являются дважды ионизированными атомами гелия. В 1909 году Резерфорд, Эрнест Марсден и Ханс Гейгер использовали α-частицы в своем знаменитом эксперименте по рассеянию, опровергающему модель Томсона (см. «Линейный импульс и столкновения»).
В эксперименте с золотой фольгой Резерфорда (также известном как эксперимент Гейгера – Марсдена) -частицы падали на тонкую золотую фольгу и рассеивались атомами золота внутри фольги (см. Типы столкновений). Уходящие частицы регистрировались сцинтилляционным экраном, окружающим золотую мишень (подробное описание экспериментальной установки см. В разделе «Линейный импульс и столкновения»). Когда рассеянная частица попала на экран, в этом месте наблюдалась крошечная вспышка света (мерцание).Подсчитав мерцания, наблюдаемые под разными углами по отношению к направлению падающего луча, ученые могли определить, какая часть падающих частиц была рассеяна, а какая часть вообще не отклонилась. Если бы модель сливового пудинга была верной, не было бы рассеянных обратно частиц. Однако результаты эксперимента Резерфорда показали, что, хотя значительная часть α-частиц вышла из фольги и не рассеялась совсем, как если бы фольга не мешала им, значительная часть β-частиц была рассеяна обратно к источнику.Такой результат был возможен только тогда, когда большая часть массы и весь положительный заряд атома золота были сосредоточены в крошечном пространстве внутри атома.
В 1911 году Резерфорд предложил ядерную модель атома. В модели Резерфорда атом содержит положительно заряженное ядро незначительного размера, почти как точка, но включает почти всю массу атома. Атом также содержал отрицательные электроны, которые находились внутри атома, но относительно далеко от ядра.Десять лет спустя Резерфорд придумал название протон для ядра водорода и название нейтрон для гипотетической электрически нейтральной частицы, которая будет опосредовать связывание положительных протонов в ядре (нейтрон был открыт в 1932 году Джеймсом Чедвиком). . Резерфорду приписывают открытие атомного ядра; однако модель атомной структуры Резерфорда не объясняет формулу Ридберга для эмиссионных линий водорода.
Модель атома водорода Бора, предложенная Нильсом Бором в 1913 году, была первой квантовой моделью, которая правильно объяснила спектр излучения водорода.Модель Бора сочетает классическую механику движения планет с квантовой концепцией фотонов. Как только Резерфорд установил существование атомного ядра, интуиция Бора о том, что отрицательный электрон в атоме водорода должен вращаться вокруг положительного ядра, стала логическим следствием закона электростатического притяжения обратных квадратов. Напомним, что закон Кулона, описывающий притяжение между двумя противоположными зарядами, имеет форму, аналогичную универсальному закону тяготения Ньютона, в том смысле, что и гравитационная сила, и электростатическая сила уменьшаются, как где r – расстояние между телами.Так же, как Земля вращается вокруг Солнца, отрицательный электрон в атоме водорода может вращаться вокруг положительного ядра. Однако ускоряющий заряд излучает свою энергию. Классически, если бы электрон двигался вокруг ядра планетарным образом, он подвергался бы центростремительному ускорению и, таким образом, излучал бы энергию, которая заставляла бы его двигаться по спирали в ядро. Такой планетарный атом водорода не был бы стабильным, что противоречит тому, что мы знаем об обычных атомах водорода, которые не распадаются.Более того, классическое движение электрона не может объяснить дискретный спектр излучения водорода.
Чтобы обойти эти две трудности, Бор предложил следующие три постулата модели Бора:
- Отрицательный электрон движется вокруг положительного ядра (протона) по круговой орбите. Все электронные орбиты сосредоточены в ядре. Не все классически возможные орбиты доступны электрону, связанному с ядром.
- Разрешенные электронные орбиты удовлетворяют первому условию квантования : На n -й орбите угловой момент электрона может принимать только дискретные значения:
Этот постулат гласит, что угловой момент электрона квантован.Обозначаемое соответственно радиусом n -й орбиты и скоростью электрона на ней, первое условие квантования может быть явно выражено как - Электрону разрешено переходить с одной орбиты, где его энергия, на другую орбиту, где его энергия равна. Когда атом поглощает фотон, электрон совершает переход на орбиту с более высокой энергией. Когда атом испускает фотон, электрон переходит на орбиту с более низкой энергией. Электронные переходы с одновременным поглощением или испусканием фотона происходят мгновенно .Разрешенные электронные переходы удовлетворяют условию второго квантования :
где – энергия излучаемого или поглощенного фотона с частотой f . Второе условие квантования гласит, что изменение энергии электрона в атоме водорода квантуется.
Эти три постулата ранней квантовой теории атома водорода позволяют нам вывести не только формулу Ридберга, но также значение постоянной Ридберга и другие важные свойства атома водорода, такие как его уровни энергии, его энергия ионизации, и размеры электронных орбит.Обратите внимание, что в модели Бора, наряду с двумя постулатами неклассического квантования, мы также имеем классическое описание электрона как частицы, на которую действует кулоновская сила, и ее движение должно подчиняться законам движения Ньютона. Атом водорода, как изолированная система, должен подчиняться законам сохранения энергии и количества движения, известным нам из классической физики. Имея в виду эту теоретическую основу, мы готовы продолжить наш анализ.
Электронные орбиты
Чтобы получить размер n -й орбиты электрона и скорость электрона на ней, мы обратимся к механике Ньютона.Как заряженная частица, электрон испытывает электростатическое притяжение к положительно заряженному ядру в центре его круговой орбиты. Это электростатическое притяжение представляет собой центростремительную силу, которая заставляет электрон двигаться по кругу вокруг ядра. Следовательно, величина центростремительной силы отождествляется с величиной электростатической силы:
Здесь обозначено значение элементарного заряда. Отрицательный электрон и положительный протон имеют одинаковое значение заряда. Когда (рисунок) комбинируется с первым условием квантования, данным (рисунок), мы можем решить для скорости и радиуса
.Обратите внимание, что эти результаты говорят нам, что скорость электрона, а также радиус его орбиты зависят только от индекса n , который нумерует орбиту, потому что все другие величины в предыдущих уравнениях являются фундаментальными константами.Мы видим из (Рисунок), что размер орбиты увеличивается как квадрат n . Это означает, что вторая орбита в четыре раза больше первой орбиты, а третья орбита в девять раз больше первой и так далее. Мы также видим из (Рисунок), что скорость электрона на орбите уменьшается с увеличением размера орбиты. Скорость электрона наибольшая на первой боровской орбите, которая является ближайшей к ядру орбитой. Радиус первой боровской орбиты называется боровским радиусом водорода и обозначается как Его значение, полученное путем установки в (Рисунок):
Мы можем подставить в (Рисунок), чтобы выразить радиус n -й орбиты через
Этот результат означает, что орбиты электронов в атоме водорода квантованы , потому что радиус орбиты принимает только определенные значения, указанные в (Рисунок), и никакие другие значения не допускаются.
Энергии электронов
Полная энергия электрона на орбите n является суммой его кинетической энергии и его электростатической потенциальной энергии. Используя (рисунок), мы находим, что
Напомним, что электростатическая потенциальная энергия взаимодействия между двумя зарядами, которые разделены расстоянием: Здесь – заряд ядра в атоме водорода (заряд протона), – заряд электрона и – радиус орбиты n -й.Теперь мы используем (рисунок), чтобы найти потенциальную энергию электрона:
Полная энергия электрона складывается из (Рисунок) и (Рисунок):
Обратите внимание, что энергия зависит только от индекса n , потому что остальные символы на (Рисунок) являются физическими константами. Значение постоянного множителя на (рисунок) составляет
.Энергию электрона на n -й орбите удобно выразить через эту энергию, как
Теперь мы видим, что энергии электронов в атоме водорода равны квантованным , потому что они могут иметь только дискретные значения, заданные (рисунок), и никакие другие значения энергии не допускаются.Этот набор разрешенных энергий электронов называется энергетическим спектром водорода ((Рисунок)). Индекс n , который перечисляет уровни энергии в модели Бора, называется квантовым числом энергии. Мы отождествляем энергию электрона внутри атома водорода с энергией атома водорода. Обратите внимание, что наименьшее значение энергии получается для атома водорода, поэтому он не может иметь меньшую энергию. Это наименьшее значение энергии электрона в атоме водорода называется энергией основного состояния атома водорода, и его значение составляет
.Атом водорода может иметь другие энергии, превышающие основное состояние.Эти более высокие энергетические состояния известны как возбужденные энергетические состояния атома водорода.
Существует только одно основное состояние, но существует бесконечно много возбужденных состояний, потому что существует бесконечно много значений n на (рисунок). Мы говорим, что электрон находится в «первом возбужденном состоянии», когда его энергия (когда), во втором возбужденном состоянии, когда его энергия (когда), и, в общем, в n -м возбужденном состоянии, когда его энергия не является наивысшим возбужденным состоянием; однако существует предел последовательности возбужденных состояний.Если мы продолжим увеличивать n на (Рисунок), мы обнаружим, что предел равен. В этом пределе электрон больше не связан с ядром, а становится свободным электроном. Электрон остается связанным в атоме водорода, пока его энергия отрицательна. Электрон, который вращается вокруг ядра по первой боровской орбите, ближайшей к ядру, находится в основном состоянии, где его энергия имеет наименьшее значение. В основном состоянии электрон наиболее прочно связан с ядром, и его энергия определяется выражением (рисунок).Если мы хотим удалить этот электрон из атома, мы должны снабдить его достаточной энергией, чтобы, по крайней мере, уравновесить его энергию основного состояния
Энергия, необходимая для удаления электрона из атома, называется энергией ионизации. Энергия ионизации, необходимая для удаления электрона с первой боровской орбиты, называется пределом ионизации атома водорода. Предел ионизации на (рис.), Который мы получаем в модели Бора, согласуется с экспериментальным значением.
Энергетический спектр атома водорода.Уровни энергии (горизонтальные линии) представляют связанные состояния электрона в атоме. Есть только одно основное состояние и бесконечное количество квантованных возбужденных состояний. Состояния пронумерованы квантовыми числами. Вертикальные линии показывают разрешенные переходы электронов между состояниями. Стрелками вниз показаны переходы с излучением фотона с длиной волны в указанной спектральной полосе.Спектральные линии излучения водорода
Чтобы получить длины волн испускаемого излучения, когда электрон совершает переход с орбиты n на орбиту м , мы используем второе из условий квантования Бора и (рисунок) для энергий.Излучение энергии из атома может происходить только тогда, когда электрон переходит из возбужденного состояния в состояние с более низкой энергией. В ходе такого перехода излучаемый фотон уносит разность энергий между состояниями, участвующими в переходе. Переход не может идти в обратном направлении, потому что энергия фотона не может быть отрицательной, а это значит, что для излучения мы должны иметь и, следовательно, третий постулат Бора дает
Теперь выразим энергию фотона через длину волны и разделим обе части (рисунок) на. Результат:
.Значение константы в этом уравнении равно
.Это значение в точности равно константе Ридберга в эвристической формуле Ридберга (рисунок).Фактически (рисунок) идентичен формуле Ридберга, потому что для данного м мы имеем. Таким образом, квантовая модель атома водорода Бора позволяет нам вывести экспериментальную константу Ридберга из первых принципов и выразить ее с точки зрения фундаментальных констант. Переходы между разрешенными электронными орбитами показаны на (Рисунок).
Мы можем повторить те же шаги, которые привели к (Рисунок), чтобы получить длину волны поглощенного излучения; это снова дает (рисунок), но на этот раз для положений линий поглощения в спектре поглощения водорода.Единственное отличие состоит в том, что для поглощения квантовое число m является индексом орбиты, занятой электроном до перехода (орбита с более низкой энергией), а квантовое число n является индексом орбиты, на которую электрон совершает переход (орбита с более высокой энергией). Разница между энергиями электронов на этих двух орбитах и есть энергия поглощенного фотона.
Размер и энергия ионизации атома водорода в возбужденном состоянии Если атом водорода в основном состоянии поглощает атом 93.Фотон с длиной волны 7 нм, соответствующий линии перехода в серии Лаймана, как это влияет на энергию и размер атома? Сколько энергии нужно для ионизации атома, когда он находится в этом возбужденном состоянии? Дайте свои ответы в абсолютных единицах и относительно основного состояния.
Стратегия Перед поглощением атом находится в основном состоянии. Это означает, что переход электрона происходит с орбиты на некоторую более высокую n -ю орбиту. Сначала мы должны определить длину поглощенной волны. Затем мы можем использовать (рисунок), чтобы найти энергию возбужденного состояния и его энергию ионизации, и использовать (рисунок), чтобы найти радиус атома в возбужденном состоянии.Для оценки n воспользуемся (рисунок).
РешениеЗамените и в (рисунок) и решите для. Не следует ожидать получения точного целочисленного ответа из-за ошибок округления, но ваш ответ будет близок к целому числу, и вы можете оценить n , взяв целую часть вашего ответ:
Радиус орбиты
Таким образом, после поглощения фотона с длиной волны 93,7 нм размер атома водорода в возбужденном состоянии в 36 раз больше, чем до поглощения, когда атом находился в основном состоянии.Энергия пятого возбужденного состояния ():
После поглощения фотона с длиной волны 93,7 нм энергия атома водорода больше, чем до поглощения. Ионизация атома, когда он находится в пятом возбужденном состоянии (), требует в 36 раз меньше энергии, чем требуется, когда атом находится в основном состоянии:
Значение Таким же образом мы можем анализировать любую спектральную линию в спектре водорода. Таким образом, экспериментальные измерения спектральных линий дают нам информацию об атомной структуре атома водорода.
Проверьте свое понимание Когда электрон в атоме водорода находится в первом возбужденном состоянии, какое предсказание дает модель Бора относительно его орбитальной скорости и кинетической энергии? Какова величина его орбитального углового момента?
Модель атома водорода Бора также правильно предсказывает спектры некоторых водородоподобных ионов. Водородоподобные ионы – это атомы элементов с атомным номером Z больше единицы (для водорода), но с удаленными всеми электронами, кроме одного.Например, электрически нейтральный атом гелия имеет атомный номер. Это означает, что у него есть два электрона, вращающихся вокруг ядра с зарядом, равным. Когда один из вращающихся электронов удаляется от атома гелия (мы говорим, когда атом гелия однократно ионизируется), остается водородоподобная атомная структура, в которой оставшийся электрон вращается вокруг ядра с зарядом. Этот тип ситуации описывается моделью Бора. Предполагая, что заряд ядра не равен, но мы можем повторить все шаги, начиная с (рисунок), чтобы получить результаты для водородоподобного иона:
где – боровская орбита водорода, а
где – предел ионизации атома водорода.Эти уравнения являются хорошими приближениями, если атомный номер Z не слишком велик.
Модель Бора важна, потому что это была первая модель, постулирующая квантование электронных орбит в атомах. Таким образом, он представляет собой раннюю квантовую теорию, положившую начало развитию современной квантовой теории. Он ввел понятие квантового числа для описания атомных состояний. Ограничение ранней квантовой теории состоит в том, что она не может описывать атомы, в которых число электронов, вращающихся вокруг ядра, больше единицы.Модель водорода Бора является полуклассической моделью, потому что она сочетает в себе классическую концепцию электронных орбит с новой концепцией квантования. Замечательный успех этой модели побудил многих физиков искать объяснение, почему такая модель вообще должна работать, и искать понимание физики, лежащей в основе постулатов ранней квантовой теории. Эти поиски привели к появлению совершенно новой концепции «материальных волн».
Сводка
- Положения линий поглощения и излучения в спектре атомарного водорода задаются экспериментальной формулой Ридберга.Классическая физика не может объяснить спектр атомарного водорода.
- Модель водорода Бора была первой моделью атомной структуры, правильно объяснившей спектры излучения атомарного водорода. Ему предшествовала ядерная модель атома Резерфорда. В модели Резерфорда атом состоит из положительно заряженного точечного ядра, которое содержит почти всю массу атома, и отрицательных электронов, расположенных далеко от ядра. Модель атома водорода
- Бора основана на трех постулатах: (1) электрон движется вокруг ядра по круговой орбите, (2) угловой момент электрона на орбите квантуется, и (3) изменение энергии электрона поскольку он совершает квантовый скачок с одной орбиты на другую, всегда сопровождается испусканием или поглощением фотона.Модель Бора является полуклассической, потому что она сочетает в себе классическую концепцию электронной орбиты (постулат 1) с новой концепцией квантования (постулаты 2 и 3).
- Модель атома водорода Бора объясняет спектры излучения и поглощения атомарного водорода и водородоподобных ионов с низкими атомными номерами. Это была первая модель, которая ввела понятие квантового числа для описания состояний атома и постулирует квантование электронных орбит в атоме. Модель Бора – важный шаг в развитии квантовой механики, которая имеет дело с многоэлектронными атомами.
Концептуальные вопросы
Объясните, почему образцы ярких эмиссионных спектральных линий имеют идентичное спектральное положение с образцом темных спектральных линий поглощения для данного газообразного элемента.
Перекрываются ли различные спектральные линии атома водорода?
Серия Бальмера для водорода была открыта до серии Лаймана или Пашена. Почему?
Когда анализируется спектр поглощения водорода при комнатной температуре, обнаруживаются линии поглощения для серии Лаймана, но не обнаруживаются для серии Бальмера.Что это говорит нам об энергетическом состоянии большинства атомов водорода при комнатной температуре?
Они в основном состоянии.
Водород составляет около 75% массы вещества на поверхности большинства звезд. Однако линии поглощения водорода наиболее сильны (с наибольшей интенсивностью) в спектрах звезд с температурой поверхности около 9000 К. Они слабее в солнечном спектре и практически отсутствуют в очень горячих (температурах выше 25000 К) или, скорее, холодные (температуры ниже 3500 К) звезды.Подумайте, почему температура поверхности влияет на наблюдаемые нами линии поглощения водорода.
Обсудите сходства и различия между моделью атома водорода Томсона и моделью атома водорода Бора.
Обсудите нефизичность модели Томсона. Подтвердите свой аргумент экспериментальными данными.
Если в атоме водорода электрон перемещается на орбиту с большим радиусом, энергия атома водорода увеличивается или уменьшается?
Как сохраняется энергия, когда атом переходит из более высокого в более низкое энергетическое состояние?
Предположим, что электрон в атоме водорода совершает переход с орбиты ( n + 1 ) на орбиту n .Длина волны испускаемого фотона больше для больших значений n или для меньших значений n ?
Обсудите, почему допустимая энергия атома водорода отрицательна.
Может ли атом водорода поглотить фотон, энергия которого превышает 13,6 эВ?
Да, превышение 13,6 эВ станет кинетической энергией свободного электрона.
Почему сквозь стекло видно, а сквозь дерево нет?
Имеют ли гравитационные силы значительное влияние на уровни энергии атома?
Покажите, что постоянная Планка имеет размерность углового момента.
Проблемы
Вычислите длину волны первой линии в серии Лаймана и покажите, что эта линия лежит в ультрафиолетовой части спектра.
Вычислите длину волны пятой линии в серии Лаймана и покажите, что эта линия лежит в ультрафиолетовой части спектра.
а. 0,661 эВ; б. –10,2 эВ; c. 1,511 эВ
Определите длину волны третьей линии Бальмера (переход от к).
Какова частота поглощаемого фотона, когда атом водорода переходит из основного состояния в состояние?
Когда атом водорода находится в основном состоянии, каковы самые короткие и самые длинные волны фотонов, которые он может поглотить без ионизации?
Когда атом водорода находится в третьем возбужденном состоянии, каковы самые короткие и самые длинные волны фотонов, которые он может излучать?
Какая самая длинная длина волны может быть у света, чтобы он мог ионизировать атом водорода в его основном состоянии?
Для электрона в атоме водорода в состоянии вычислите: (а) угловой момент; (б) кинетическая энергия; (c) потенциальная энергия; и (d) полная энергия.
а. ч / б. 3,4 эВ; c. – 6,8 эВ; d. – 3,4 эВ
Найдите энергию ионизации атома водорода в четвертом энергетическом состоянии.
Было измерено, что для удаления электрона из атома водорода требуется 0,850 эВ. В каком состоянии находился атом до ионизации?
Каков радиус атома водорода, когда электрон находится в первом возбужденном состоянии?
Найдите самую короткую длину волны из серии Бальмера.В какой части спектра лежит эта линия?
Покажите, что вся серия Пашена лежит в инфракрасной части спектра.
Пересекаются ли серии Бальмера и серии Лаймана? Почему? Почему нет? (Подсказка: рассчитайте самую короткую линию Бальмера и самую длинную линию Лаймана.)
(а) Какая линия из серии Бальмера является первой в УФ части спектра? б) Сколько бальмеровских линий лежит в видимой части спектра? (c) Сколько линий Бальмера лежит в УФ?
Эмиссионная линия атомарного водорода соответствует переходу между состояниями и Найти
Атомная теория – обзор
2 Интеллектуальная одиссея
Общее философское развитие Оствальда можно разделить на четыре перекрывающихся, но достаточно разных периода.Во время первого из них, которое длилось примерно до 1890 года, он был ярым, хотя и все более осторожным, защитником многого, что было основополагающим для механического мировоззрения. Оствальд не всегда был противником атомной теории в химии или кинетических и молекулярных теорий в целом. Напротив, он с энтузиазмом поддерживал такие взгляды в работах до начала 1880-х годов и оставался их квалифицированным сторонником, пока почти десять лет спустя не начал серьезно писать об энергетике (см. [Görs, 1999; Deltete, 2007a]).Это ясно видно в его развитии – поначалу довольно наивном, но позже более осмотрительном – атомных и кинетических теорий в различных эссе и учебниках. И это также очевидно в его защите и вкладе в теорию Аррениуса и Ван’т Гоффа, оба из которых разработали частичные взгляды на вещества в растворе. За некоторыми исключениями, Оствальд больше не предлагал реалистичных интерпретаций таких теорий примерно после 1885 года, но отстаивал их эвристическую ценность до конца десятилетия.
В то же время, однако, Оствальд также начал ценить больше, чем он имел прежде, эвристические преимущества феноменологической термодинамики – ее большой успех в ясном и кратком получении старых результатов и в предсказании новых без осложнений и неопределенностей, связанных с молекулярные и механические обходные пути [1887a; 1887b; 1891; 1892]. Первоначально это было очевидно для него в областях физической химии, в которые он сам уже внес важный вклад, но вскоре он осознал силу термодинамических рассуждений и в других областях.Он думал, что ключом к этой силе является внимание, уделяемое термодинамике энергии и ее преобразованиям. Оствальд постепенно пришел к выводу, что, хотя теории, основанные на микромеханических гипотезах, не достигли большого прогресса в решении многих проблем, немеханистические подходы, основанные на энергии, оказались чрезвычайно успешными. Эти успехи побудили его более внимательно изучить различные формы энергии для себя (см. Deltete 1995b и 2007a).
Второй период, который частично перекрывает первый, простирается с конца 1880-х годов до начала нового века.Он отмечен отказом Оствальда от атомизма и механизма – в любой их форме – и его усилиями по обеспечению всеобъемлющей энергетической альтернативы. В первые годы этого периода Оствальд начал сомневаться даже в эвристической ценности молекулярных и механических теорий. Он поставил под сомнение сложность их математического развития и их опору на, как он это видел, произвольные и неоправданные гипотезы. Он все чаще считал многие такие теории безответственными спекулятивными и ненаучными.Фактически, после середины 1890-х годов отношение Оствальда даже к устоявшимся механическим теориям было настолько враждебным, что он иногда отрицал, что они когда-либо вообще имели какую-либо ценность. Несколько общих работ тех лет представляют собой не более чем радикальное осуждение механического мировоззрения (например, [1895b]).
Взгляды Оствальда на энергетику в этот период развивались в два довольно разных этапа. В работах с 1887 по 1890 год он был озабочен прежде всего установлением важности энергии наряду с материей как центральной для прогрессивной естествознания [1887a; 1887b; Дельтете, 2007а].Там он настаивал на важности энергетических соображений не только для химии, но и для других наук. Акцент в этих работах постепенно смещается от химической энергии и ее преобразований к созданию общей теории энергии. Он все чаще видел в любом успехе исследований, в которых использовалось количество энергии, основание полагать, что теория энергии может объединить естественные науки. Первые попытки Оствальда построить такую теорию были предварительными и неполными (например, [1889]), но он стал смелее, когда обрел уверенность в своем подходе и его очевидных результатах.
В 1891 году Оствальд начал утверждать сначала приоритет, а затем и абсолютное превосходство энергии – концептуально, методологически и онтологически. Хотя он утверждал реальность и субстанциальность энергии еще в 1887 году, его амбиции в отношении нее росли по мере развития его мысли, и к середине десятилетия он был готов однозначно утверждать, что энергия была единственной реальностью. В те же годы Оствальд предпринимал самые настойчивые попытки построить последовательную и последовательную науку об энергетике.На эти усилия повлияло множество факторов: дискуссии с коллегами и студентами; продолжение размышлений о концептуальной структуре термодинамики; изучение более ранних энергетических сочинений, особенно Георга Хельма; поощрение Хельма, Больцмана и других выражать свои мысли об энергии в систематической форме; и решающее знакомство с термодинамическими работами Уилларда Гиббса (см. [Deltete, 1995a; 1995b]). В серии работ, опубликованных между 1891 и 1895 годами, Оствальд стремился показать, как основные результаты механики, термодинамики и химии могут быть получены из первых энергетических принципов [1891; 1892; 1893a; 1893b; 1895а].Его первые заявления об успехе, как правило, были предварительными и тщательно сформулированными, но заявления конца 1890-х годов становились все более решительными. К концу десятилетия он был убежден, что, хотя отдельные проблемы все еще остаются, основная теоретическая основа для их решения была прочно установлена. Но к тому времени такие остаточные проблемы также интересовали Оствальда меньше, чем другой амбициозный проект, который привлек его внимание.
Далее я сосредоточусь на этих двух периодах в развитии Оствальда, в течение которых его усилия в области энергетики имели основу в физической науке.Третий период, который длился примерно с рубежа веков до начала Первой мировой войны, был центром более широкого философского проекта. Эти годы – большинство из них после того, как он оставил свою кафедру в Лейпциге, – характеризовались его попыткой показать, что науки о жизни и разуме, такие как биология и психология, также были охвачены энергетикой. Однако в то же время изменился характер, а не только содержание его сочинений. Оствальд интересовался философскими вопросами (например, научной методологией) еще со студенческих лет, но с конца 1890-х годов такие вопросы стали доминировать в его мыслях.Он все больше полагался на общие философские аргументы в защиту энергетики, а глобальные ссылки на «Monismus» и «Weltanschauung» заменили подробные обсуждения химического сродства и форм энергии (например, [1902; 1908]). Большинство свидетелей считали, что первое десятилетие этого столетия ознаменовало упадок энергетики как серьезного научного предложения и ее продолжение только как довольно расплывчатое философское движение (например, [Arrhenius, 1923; Nernst, 1932]).
Здесь не будет предпринято никаких попыток обсудить работы четвертого периода (который включает развитие его новой теории цветов), завершающих интеллектуальную одиссею Оствальда, за исключением того, что мы скажем, что непосредственно перед началом Первой мировой войны и до конца В своей жизни Оствальд пытался сформулировать глобальные социальные и политические теории, основанные на принципах энергетики (e.грамм. [1911; 1912; Deltete, 2008а]). В его усилиях есть чем восхищаться (Оствальд был интернационалистом, антивоенным и сторонником окружающей среды), но они имеют в лучшем случае лишь смутную связь с энергетической теорией, которую он предложил двумя десятилетиями ранее.
атом: Развитие атомной теории
Атомная теория, согласно которой материя состоит из крошечных неделимых частиц, находящихся в постоянном движении, была предложена в 5-м веке. До н.э. греческими философами Левкиппом и Демокритом и был принят римлянином Лукрецием.Однако Аристотель не принял эту теорию, и многие столетия ее игнорировали. Интерес к теории атома возродился в 18 в. следующие работы о природе и поведении газов (см. законы газа).
Современная атомная теория начинается с работы Джона Дальтона, опубликованной в 1808 году. Он утверждал, что все атомы элемента имеют точно одинаковый размер и вес (см. Атомный вес) и в этих двух отношениях не похожи на атомы любого другого элемента. другой элемент. Он заявил, что атомы элементов химически объединяются в простых числовых соотношениях с образованием соединений.Лучшим доказательством его теории был экспериментально подтвержденный закон простых кратных пропорций, который дает соотношение между весами двух элементов, которые вместе образуют разные соединения.
Доказательства теории Дальтона также пришли из закона электролиза Майкла Фарадея. Важным развитием стала периодическая таблица, разработанная одновременно Дмитрием Менделеевым и Дж. Л. Мейером, в которой атомы различных элементов располагались в порядке возрастания атомного веса таким образом, чтобы элементы с аналогичными химическими свойствами распадались на группы.К концу 19 в. было общепризнанным, что материя состоит из атомов, которые объединяются в молекулы.
В 1911 году Эрнест Резерфорд разработал первое последовательное объяснение структуры атома. Используя альфа-частицы, испускаемые радиоактивными атомами, он показал, что атом состоит из центрального положительно заряженного ядра, ядра и отрицательно заряженных частиц, называемых электронами, которые вращаются вокруг ядра. Однако было одно серьезное препятствие для принятия ядерного атома.Согласно классической теории, когда электроны вращаются вокруг ядра, они непрерывно ускоряются (см. Ускорение), и все ускоренные заряды излучают электромагнитную энергию. Таким образом, они должны потерять свою энергию и спиралью проникнуть в ядро.
Эту трудность решил Нильс Бор (1913), применив квантовую теорию, развитую Максом Планком и Альбертом Эйнштейном, к проблеме атомной структуры. Бор предположил, что электроны могут вращаться вокруг ядра, не излучая энергии, только на орбитах, для которых их орбитальный угловой момент является целым кратным постоянной Планка h , деленной на 2π.Дискретные спектральные линии (см. Спектр), испускаемые каждым элементом, образовывались электронами, падающими с разрешенных орбит с более высокой энергией на орбиты с более низкой энергией, причем частота излучаемого фотона света пропорциональна разнице энергий между орбитами.
Примерно в то же время эксперименты Х. Дж. Мозли по рентгеновским спектрам (см. Рентгеновские лучи) показали, что каждое ядро характеризуется атомным номером, равным количеству единичных положительных зарядов, связанных с ним. Путем перестановки периодической таблицы в соответствии с атомным номером, а не атомным весом, было получено более систематическое расположение.Развитие квантовой механики в течение 1920-х годов привело к удовлетворительному объяснению всех явлений, связанных с ролью электронов в атомах и всеми аспектами связанных с ними спектров. С открытием нейтрона в 1932 году современная картина атома была завершена.
Теперь, когда многие проблемы индивидуальной атомной структуры и поведения решены, внимание было обращено как на меньшие, так и на большие масштабы. В меньшем масштабе атомное ядро изучается с целью определения деталей его структуры и разработки источников энергии из ядерного деления и синтеза (см. Ядерная энергия), поскольку атом вовсе не неделим, как думали древние философы. , но может претерпеть ряд возможных изменений.



