Решение задач по химии на строение атома и периодический закон
Важно знать! Как научиться решать задачи по химии.
Задача 3-1. Определите состав атома фтора
Решение.
Атом состоит из ядра и электронов. Судя по обозначению
массовое число ядра , число протонов в ядре , число нейтронов . Атом электронейтрален, поэтому число отрицательно заряженных электронов равно числу положительно заряженных протонов: .
Ответ: 9 протонов, 10 нейтронов, 9 электронов.
Задача 3-2. Определите состав атомов и . Укажите сходство и отличие этих атомов.
Решение.
Состав атомов определим так же, как и в предыдущей задаче. Для сравнения атомов составим таблицу:
| Атом | ||
|---|---|---|
| Массовое число A | 35 | 37 |
| 17 | 17 | |
| Число нейтронов N | 18 | 20 |
| Заряд атома | 0 | 0 |
| Заряд ядра | +17 | +17 |
| Число электронов | 17 | 17 |
Из таблицы видно, что атомы двух изотопов хлора отличаются только массовым числом и числом нейтронов.
Задача 3-7. Напишите электронную конфигурацию иона магния. Назовите один отрицательный ион, который имеет такую же конфигурацию.
Решение.
Электронная конфигурация атома магния: . Ион магния образуется при удалении двух валентных электронов с внешнего подуровня и имеет электронную конфигурацию: . В этой конфигурации полностью заселены два энергетических уровня — первый и второй.
Ответ: . Ион
Задача 3-8. Определите значения квантовых чисел, характеризующих валентный электрон в атоме натрия.
Решение.
Натрий — первый элемент 3-го периода — имеет электронную конфигурацию с одним валентным электроном на орбитали . Эта орбиталь находится на третьем энергетическом уровне, поэтому главное квантовое число . Для любой s-орбитали побочное квантовое число , магнитное квантовое число . Спин электрона , проекция спина может принимать любое из двух значений:
Эта орбиталь находится на третьем энергетическом уровне, поэтому главное квантовое число . Для любой s-орбитали побочное квантовое число , магнитное квантовое число . Спин электрона , проекция спина может принимать любое из двух значений:
Ответ:
[Сборник задач и упражнений по химии: Школьный курс / В.В. Еремин, Н.Е. Кузьменко]
Поделитесь с друзьями:
Что это – изотопы в химии? Определение, строение
Ещё древние философы высказывали предположение, что материя строится из атомов. Однако о том, что сами «кирпичики» мироздания состоят из мельчайших частиц, учёные начали догадываться лишь на стыке XIX и XX веков. Опыты, доказывающие это, произвели в науке в своё время настоящую революцию. Именно количественное соотношение составных частей отличает один химический элемент от другого. Каждому из них отведено своё место в Периодической системе Менделеева согласно порядковому номеру. Но существуют разновидности атомов, занимающие в таблице одни и те же клетки, несмотря на различие в массе и свойствах. Почему это так и о том, что такое изотопы в химии, будет рассказано далее.
Почему это так и о том, что такое изотопы в химии, будет рассказано далее.
Атом и его частицы
Исследуя структуру материи посредством бомбардировки альфа-частицами, Э. Резерфорд доказал в 1910 году, что основное пространство атома заполнено пустотой. И только в центре находится ядро. Вокруг него по орбиталям двигаются отрицательные электроны, составляя оболочку этой системы. Так была создана планетарная модель «кирпичиков» материи.
Что такое изотопы? Вспомните из курса химии, что ядро тоже имеет сложное строение. Оно состоит из положительных протонов и не имеющих заряда нейтронов. Количество первых определяет качественные характеристики химического элемента. Именно число протонов отличает вещества друг от друга, наделяя их ядра определённым зарядом. И по этому признаку им присваивается порядковый номер в таблице Менделеева. Но количество нейтронов у одного и того же химического элемента дифференцирует их на изотопы. Определение в химии данному понятию поэтому можно дать следующее.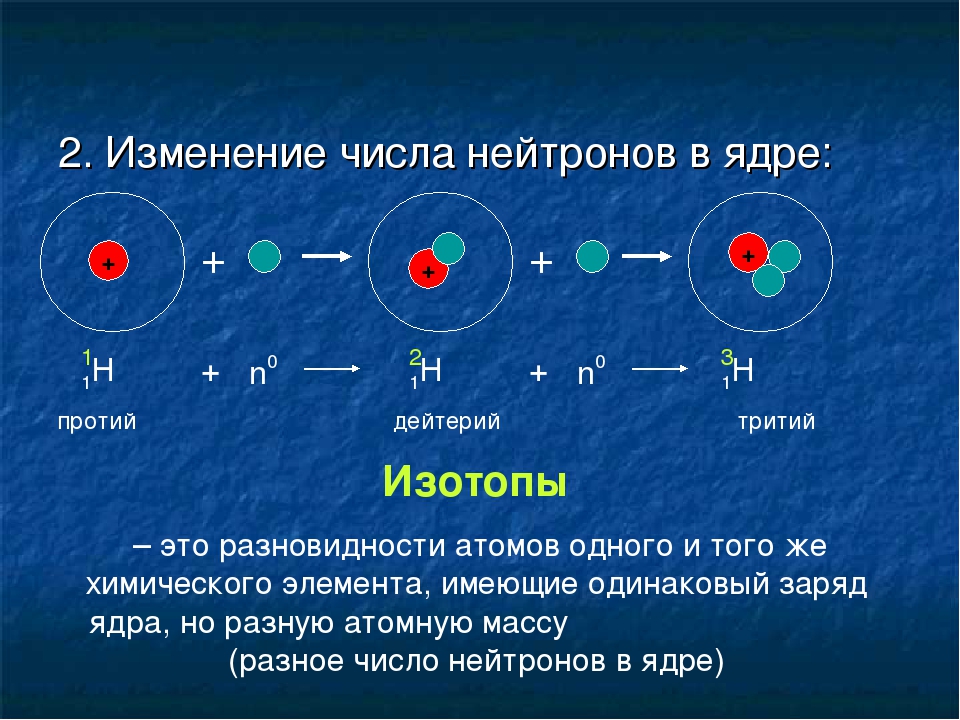 Это разновидности атомов, отличающиеся по составу ядра, обладающие одинаковым зарядом и порядковым номеров, но имеющие разные массовые числа, ввиду различий в количестве нейтронов.
Это разновидности атомов, отличающиеся по составу ядра, обладающие одинаковым зарядом и порядковым номеров, но имеющие разные массовые числа, ввиду различий в количестве нейтронов.
Обозначения
Изучая химию в 9 классе и изотопы, школьники узнают о принятых условных обозначениях. Буквой Z отмечается заряд ядра. Это цифра совпадает с количеством протонов и поэтому является их показателем. Сумма этих элементов с нейтронами, отмечаемыми значком N, составляет А – массовое число. Семейство изотопов одного вещества, как правило, обозначается значком того химического элемента, которых в таблице Менделеева наделяется порядковым номером, совпадающим с числом протонов в нём. Левый верхний индекс, добавляемый к указанному значку соответствует массовому числу. К примеру, 238U. Заряд элемента (в данном случае урана, отмеченного порядковым номером 92) обозначается похожим индексом снизу.
Зная эти данные, легко можно подсчитать количество нейтронов у данного изотопа. Оно равно массовому числу за вычетом порядкового номера: 238 – 92 = 146. Количество нейтронов могло бы быть меньше, от этого данный химический элемент не перестал бы оставаться ураном. Следует заметить, что чаще всего у других, более простых, веществ число протонов и нейтронов приблизительно совпадает. Подобные сведения помогают понять, что такое изотоп в химии.
Оно равно массовому числу за вычетом порядкового номера: 238 – 92 = 146. Количество нейтронов могло бы быть меньше, от этого данный химический элемент не перестал бы оставаться ураном. Следует заметить, что чаще всего у других, более простых, веществ число протонов и нейтронов приблизительно совпадает. Подобные сведения помогают понять, что такое изотоп в химии.
Нуклоны
Индивидуальностью определённый элемент наделяет именно число протонов, а количество нейтронов на неё никаким образом не влияет. Но атомная масса составляется из этих двух указанных элементов, имеющих общее наименование «нуклоны», представляя собой их сумму. Однако этот показатель не зависит от числа электронов, формирующих отрицательно заряженную оболочку атома. Почему? Стоит только сравнить.
Доля массы протона в атоме велика и составляет приблизительно 1 а. е. м. или 1,672 621 898(21)·10-27кг. Нейтрон близок к показателям этой частицы (1,674 927 471(21)·10-27кг). А вот масса электрона в тысячи раз меньше, считается ничтожной и не учитывается. Вот почему, зная верхний индекс элемента в химии, состав ядра изотопов узнать несложно.
Вот почему, зная верхний индекс элемента в химии, состав ядра изотопов узнать несложно.
Изотопы водорода
Изотопы некоторых элементов настолько известны и распространены в природе, что получили собственные наименования. Ярким и наиболее простым примером тому может служить водород. В естественных условиях он содержится в своей самой распространённой разновидности протия. Этот элемент имеет массовое число 1, а ядро его состоит из одного протона.
Так что такое изотопы водорода в химии? Как известно, атомы этого вещества имеют первый номер в таблице Менделеева и соответственно наделены в природе зарядовым числом 1. Но количество нейтронов в ядре атома у них различно. Дейтерий, являясь тяжёлым водородом, помимо протона имеет в составе ядра ещё одну частицу, то есть нейтрон. В результате это вещество проявляет собственные физические свойства, в отличие от протия, обладая собственным весом, температурой плавления и кипения.
Тритий
Сложнее всех устроен тритий. Это сверхтяжёлый водород. В соответствии с определением изотопов в химии, он имеет зарядовое число 1, но массовое число 3. Его часто называют тритоном, потому что помимо одного протона, он имеет в составе ядра два нейтрона, то есть состоит из трёх элементов. Наименование этого элемента, открытого в 1934 году Резерфордом, Олифантом и Хартеком, было предложено ещё до его выявления.
Это неустойчивое вещество, проявляющее радиоактивные свойства. Ядро его обладает способностью расщепляться с выделение бета-частицы и электронного антинейтрино. Энергия распада данного вещества не очень велика и составляет 18,59 кэВ. Поэтому подобная радиация не является для человека слишком опасной. От неё способна защитить обыкновенная одежда и хирургические перчатки. А получаемый с пищей этот радиоактивный элемент быстро выводится из организма.
Изотопы урана
Гораздо опаснее оказываются различные типы урана, которых на сегодняшний день науке известно 26. Поэтому, рассказывая о том, что такое изотопы в химии, невозможно не упомянуть об этом элементе. Несмотря на разнообразие видов урана, в природе его изотопов встречается всего три. К ним относятся 234U, 235U, 238U. Первый из них, обладая подходящими свойствами, активно применяется как топливо в ядерных реакторах. А последний – для производства плутония-239, который сам, в свою очередь, незаменим как ценнейшее топливо.
Несмотря на разнообразие видов урана, в природе его изотопов встречается всего три. К ним относятся 234U, 235U, 238U. Первый из них, обладая подходящими свойствами, активно применяется как топливо в ядерных реакторах. А последний – для производства плутония-239, который сам, в свою очередь, незаменим как ценнейшее топливо.
Каждый из радиоактивных элементов характеризуется собственным периодом полураспада. Это отрезок времени, в течение которого вещество расщепляется в отношении ½. То есть в результате этого процесса количество сохранившейся части вещества вдвое уменьшается. Этот отрезок времени для урана огромен. К примеру, для изотопа-234 он исчисляется в 270 тысячелетий, а для двух других указанных разновидностей он гораздо значительнее. Рекордный период полураспада – у урана-238, продолжающийся миллиарды лет.
Нуклиды
Не каждый из видов атома, характеризующихся собственным и строго определённым числом протонов и электронов, настолько стабилен, чтобы существовать хоть сколько-нибудь продолжительный период, достаточный для его изучения. Те из них, которые обладают относительной устойчивостью, называются нуклидами. Стабильные образования такого рода радиоактивному распаду не подвергаются. Нестабильные называются радионуклидами и тоже, в свою очередь, делятся на короткоживущие и долгожители. Как известно из уроков химии 11 класса о строении атомов изотопов, наибольшим числом радионуклидов обладают осмий и платина. По одному стабильному имеют кобальт и золото, а наибольшее количество устойчивых нуклидов у олова.
Те из них, которые обладают относительной устойчивостью, называются нуклидами. Стабильные образования такого рода радиоактивному распаду не подвергаются. Нестабильные называются радионуклидами и тоже, в свою очередь, делятся на короткоживущие и долгожители. Как известно из уроков химии 11 класса о строении атомов изотопов, наибольшим числом радионуклидов обладают осмий и платина. По одному стабильному имеют кобальт и золото, а наибольшее количество устойчивых нуклидов у олова.
Вычисление порядкового номера изотопа
Теперь постараемся обобщить сведения, описанные ранее. Поняв, что такое изотопы в химии, пришло время выяснить, как можно использовать полученные знания. Рассмотрим это на конкретном примере. Допустим, известно, что некоторый химический элемент обладает массовым числом 181. При этом оболочка атома данного вещества содержит в себе 73 электрона. Как можно, воспользовавшись таблицей Менделеева, узнать название данного элемента, а также число протонов и нейтронов в составе его ядра?
Приступим к решению задачи. Определить наименование вещества можно, зная его порядковый номер, который соответствует количеству протонов. Так как число положительных и отрицательных зарядов в атоме равны, то оно составляет 73. Значит, это тантал. При том, общее количество нуклонов в сумме составляет 181, а значит, протонов у данного элемента 181 – 73 = 108. Достаточно просто.
Определить наименование вещества можно, зная его порядковый номер, который соответствует количеству протонов. Так как число положительных и отрицательных зарядов в атоме равны, то оно составляет 73. Значит, это тантал. При том, общее количество нуклонов в сумме составляет 181, а значит, протонов у данного элемента 181 – 73 = 108. Достаточно просто.
Изотопы галлия
Элемент галлий в периодической системе имеет порядковый номер 71. В природе у этого вещества есть два изотопа – 69Ga и 71Ga. Как определить процентное соотношение разновидностей галлия?
Решение задач на изотопы по химии почти всегда связано с информаций, которую можно получить из таблицы Менделеева. В этот раз следует поступить аналогичным образом. Определим из указанного источника среднюю атомную массу. Она равна 69,72. Обозначив за x и y количественное соотношение первого и второго изотопа, примем сумму их равной 1. А значит, в виде уравнения это запишется: x + y = 1. Отсюда следует, что 69x + 71y = 69,72. Выразив y через x и подставив первое уравнение во второе, получаем, что x = 0,64, а y = 0,36. Это значит, что 69Ga содержится в природе 64 %, а процентное соотношение 71Ga составляет 34 %.
Выразив y через x и подставив первое уравнение во второе, получаем, что x = 0,64, а y = 0,36. Это значит, что 69Ga содержится в природе 64 %, а процентное соотношение 71Ga составляет 34 %.
Превращения изотопов
Радиоактивное расщепление изотопов с трансформацией их в другие элементы разделяется на три основных типа. Первым из них является альфа-распад. Он происходит с испусканием частицы, представляющей собой ядро атома гелия. То есть это образование, состоящие из совокупности пар нейтронов и протонов. Поскольку количество последних определяет зарядовое число и номер атома вещества в периодической системе, то в результате этого процесса происходит качественное превращение одного элемента в другой, а в таблице он сдвигается влево на две клетки. При этом массовое число элемента уменьшается на 4 единицы. Это мы знаем из разделов химии о строении атомов изотопов.
При потере ядром атома бета-частицы, по сути представляющей собой электрон, меняется его состав.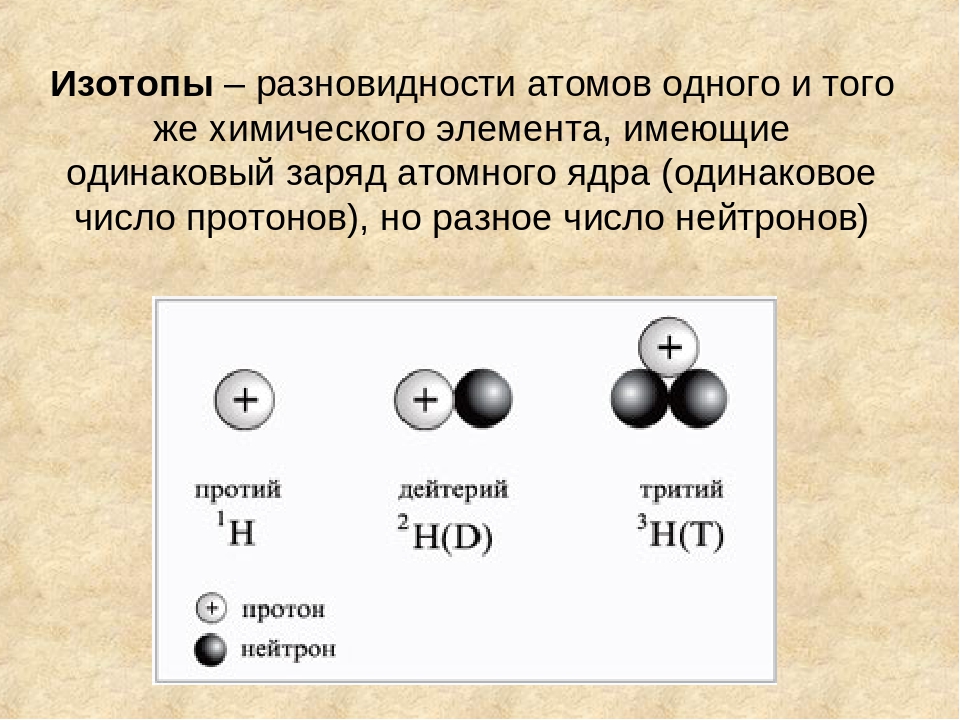 Один из нейтронов трансформируется в протон. Это значит, что качественные характеристики вещества вновь меняются, а элемент сдвигается в таблице на одну клетку вправо, практически не теряя при этом в массе. Обычно подобное превращение сопряжено с электромагнитным гамма-излучением.
Один из нейтронов трансформируется в протон. Это значит, что качественные характеристики вещества вновь меняются, а элемент сдвигается в таблице на одну клетку вправо, практически не теряя при этом в массе. Обычно подобное превращение сопряжено с электромагнитным гамма-излучением.
Превращение изотопа радия
Вышеизложенные сведения и знания из химии 11 класса об изотопах снова помогают решать практические задачи. К примеру, следующие: 226Ra при распаде превращается в химический элемент IV группы, обладающий массовым числом 206. Сколько альфа- и бета-частиц при этом он должен потерять?
Учитывая изменения в массе и группу дочернего элемента, воспользовавшись таблицей Менделеева, легко определить, что образовавшимся при расщеплении изотопом будет свинец с зарядом 82 и массовым числом 206. А учитывая зарядовое число этого элемента и исходного радия, следует предположить, что ядро его потеряло пять альфа-частиц и четыре бета-частицы.
Использование радиоактивных изотопов
Всем прекрасно известно, какой вред живым организмам может нанести радиоактивное излучение. Однако свойства радиоактивных изотопов бывают для человека полезны. Они с успехом применяются во многих отраслях промышленности. С их помощью возможно обнаружить утечку в инженерных и строительных сооружениях, подземных трубопроводах и нефтепроводах, накопительных баках, теплообменниках на электростанциях.
Однако свойства радиоактивных изотопов бывают для человека полезны. Они с успехом применяются во многих отраслях промышленности. С их помощью возможно обнаружить утечку в инженерных и строительных сооружениях, подземных трубопроводах и нефтепроводах, накопительных баках, теплообменниках на электростанциях.
Указанные свойства активно используются также в научных экспериментах. К примеру, муха цеце является переносчиком многих серьёзных заболеваний для человека, скота и домашних животных. В целях предотвращения подобного самцов этих насекомых стерилизуют посредством слабого радиоактивного излучения. Изотопы также бывают незаменимы при изучении механизмов некоторых химических реакций, ведь атомами данных элементов можно метить воду и другие вещества.
При биологических исследованиях часто также используются меченые изотопы. К примеру, именно таким образом было установлено, как фосфор влияет на почву, рост и развитие культурных растений. С успехом свойства изотопов применяются и в медицине, что позволило лечить раковые опухоли и другие тяжёлые заболевания, определять возраст биологических организмов.
Радиоактивные изотопы, использование в химии
Определение при помощи радиоактивного изотопа калия К . Описанный выше радиометрический метод определения калия пригоден для анализа сравнительно больших количеств исследуемого вещества Если анализу подлежит очень малая навеска или маленький объем разбавленного раствора, то здесь оказываются пригодными способы, основанные на использовании искусственного радиоактивного изотопа К . Описан радиометрический метод определения калия в виде хлороплатината с применением К в качестве индикатора [1532] Метод изотопного разбавления — осаждение калия в виде перхлората в присутствии того же индикатора [2667] —применен для анализа почвы [686]. На некоторые другие работы о применении К в аналитической химии мы только сошлемся (541, 1612]Однако все элементы периодической системы с 2>83 (т. е. после висмута) радиоактивны, не имеют стабильных изотопов.
 Большое практическое значение имеют и многие искусственно получаемые радиоактивные изотопы. Поэтому в наши дни важнейшей характеристикой химического элемента являются не только химические свойства, определяемые строением электронной оболочки атома, но и свойства атомного ядра, прежде всего его стабильность. Современная химия решает задачи, связанные с выделением и очисткой отдельных изотопов, как стабильных, так и радиоактивных, их практическим использованием, например при работе АЭС. От строения и устойчивости атомного ядра изотопов того или иного химического элемента зависит его распространенность, влияющая на распределение элемента в земной коре и на земном шаре, сочетание элементов друг с другом в минералах и месторождениях.
Большое практическое значение имеют и многие искусственно получаемые радиоактивные изотопы. Поэтому в наши дни важнейшей характеристикой химического элемента являются не только химические свойства, определяемые строением электронной оболочки атома, но и свойства атомного ядра, прежде всего его стабильность. Современная химия решает задачи, связанные с выделением и очисткой отдельных изотопов, как стабильных, так и радиоактивных, их практическим использованием, например при работе АЭС. От строения и устойчивости атомного ядра изотопов того или иного химического элемента зависит его распространенность, влияющая на распределение элемента в земной коре и на земном шаре, сочетание элементов друг с другом в минералах и месторождениях. Кроме использования в качестве меченых атомов, радиоактивные изотопы в настоящее время все шире применяются и как источник излучений в технике для просвечивания металлических изделий (гамма-дефектоскопия), в контрольно-измерительной аппаратуре, в химии — для возбуждения некоторых реакций без повышения температуры, в частности процессов полимеризации, для борьбы со статическим электричеством в промышленности (радиоактивные ионизаторы), в медицине — для лечения злокачественных опухолей, для стерилизации различных препаратов и пр.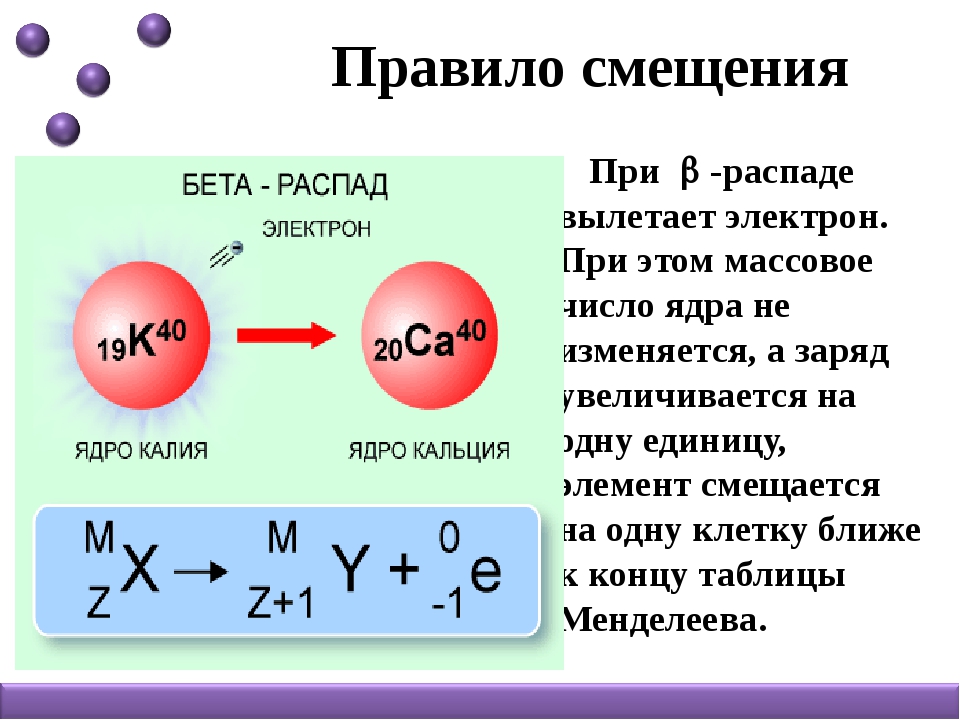
Использование радиоактивных изотопов в различных областях химии стало настолько широким, что нет никакой возможности даже перечислить их все. Радиоактивные, меченые атомы нашли большое применение как в промышленности, так и в научных исследованиях начиная от определения механизма химических реакций и кончая наблюдением за земляными червями во время действия на них различных раздражителей. [c.421]
Замечательным примером применения радиоактивных индикаторов в аналитической химии является радиоактивационный анализ. Он основан на образовании в анализируемом материале радиоактивных изотопов или продуктов их превращений определяемых элементов под действием ядерных частиц. Его целесообразно использовать для определения малых примесей, когда обычные аналитические методы непригодны из-за ограниченной чувствительности. В табл. 19.10 приведена чувствительность активационного анализа при использовании для облучения анализируемого вещества медленных нейтронов ядерного реактора.
Теперь ядерная химия превратилась в обширную и важную отрасль науки. Удалось получить лабораторными методами примерно 1000 радиоактивных нуклидов (изотопов), тогда как природных открыто только 272 устойчивых нуклида и 55 неустойчивых (радиоактивных). Использование радиоактивных изотопов в качестве меченых атомов стало ценным методом научных исследований, в частности в медицине. Управляемое высвобождение ядерной энергии дало новый важный источник энергии. [c.607]
Другое важное применение связано с введением метки С. Установление механизмов реакций в органической химии или биохимии, которое ранее основывалось исключительно на использовании радиоактивного изотопа С, можно теперь выполнить с помощью спектроскопии ЯМР С. Как и прежде, проведение синтеза меченого соединения неизбежно, но удается избавиться от часто трудной и не всегда однозначной деградации выделенных продуктов реакции для определения положения метки, поскольку, используя резонанс С, легко определить положение изучаемого атома углерода.
В последние годы интерес к аналитической химии кобальта сильно возрос. Это обусловлено разнообразными новыми применениями кобальта и его соединений. Общеизвестно использование кобальта в качестве легирующего компонента специальных сплавов с высокой твердостью и термостойкостью. Многие соединения кобальта обладают высокой каталитической активностью и служат катализаторами синтеза различных химических соединений. Радиоактивные изотопы кобальта широко применяются в медицине. Ряд сложных органических соединений кобальта влияет на обмен вешеств у растений и животных и т. п. Все ъто привело к необходимости разработать новые методы качественного обнаружения и количественного определения кобальта как основного компонента и примеси в технических и биологических материалах весьма разнообразного состава. Особое внимание в работах последних лет обращено на развитие методов определения следов кобальта. Для этого в настоящее время используются главным образом спектрофотометрические, кинетические и электрохимические методы анализа.
Некоторые из применяемых в настоящее время методов определения концентрации стабильных изотопов могут быть осуществлены с использованием аппаратуры и приборов, имеющихся во многих химических лабораториях, а методики проведения изотопных анализов, как правило, по сложности мало отличаются от обычных приемов, используемых в аналитической химии. Относительное содержание изотопов данного элемента в смеси мол ет быть определено по отношению масс этих изотопов, в связи с чем наиболее общим методом изотопного анализа следует считать масс-спектроскопический метод. Способ превращения анализируемого вещества в образец для анализа зависит от его природы и от особенности изотопа. Часто методы превращения, используемые при работе с радиоактивными изотопами, могут быть использованы такл е в случае стабильных изотопов, и наоборот.
Настоящая книга посвящена в основном новым приложениям физических методов к координационной химии. Речь идет о тех методах, предвозвестниками которых были проводившиеся Вернером в конце XIX в. определения электропроводностей растворов комплексных солей и начатое Н. Бьеррумом изучение равновесий комплексов в водных растворах, которые, однако, не применялись исследователями в области координационной химии достаточно широко до 40-х годов. Естественно поэтому, что книга начинается главой об исследованиях термодинамики комплексо-образования в растворах, являющейся прямым продолжением ранних работ Н. Бьеррума, проводимых в значительной части его сыном Я. Бьеррумом за этой главой следует глава о кинетике комилексообразования. Оба эти раздела за последние годы очень сильно расширились в результате применения новых физико-химических методик, и особенно использования радиоактивных изотопов. [c.9]
Радиоактивные изотопы и излучения находят применение в химической промышленности не только как средство воздействия на ту или иную реакцию, но и для контроля и автоматизации промышленных процессов. Уже применяются приборы, действие которых основано на использовании изотопов или излучения для контроля толщины, плотности, концентрации, расхода, уровня, давления и других параметров технологических процессов в химической промышленности. Основными видами установок излучений в радиационной химии являются у- и рентгеновские установки, линейные ускорители и электростатические генераторы Ван-Граафа. [c.272]
Уже применяются приборы, действие которых основано на использовании изотопов или излучения для контроля толщины, плотности, концентрации, расхода, уровня, давления и других параметров технологических процессов в химической промышленности. Основными видами установок излучений в радиационной химии являются у- и рентгеновские установки, линейные ускорители и электростатические генераторы Ван-Граафа. [c.272]
Книга посвящена рассмотрению мер безопасности работы в химических лабораториях с вредными, ядовитыми, огнеопасными и взрывоопасными веществами. Предполагается, что читателю известны основы неорганической, аналитической, органической и физической химии. Книга иллюстрирована рядом практических примеров из работы химических лабораторий. Большое место отводится мерам безопасности применения в химических лабораториях современных методов исследования (радиоактивные изотопы и источники излучений, высокое давление, высокий вакуум, работа с жидкими газами и газами, находящимися в баллонах, использование электронных приборов и т.
 д.). Хотя книга является пособием для студентов химических факультетов, в ней много полезного найдут работающие в заводских химических и сельских агрохимических лабораториях. [c.2]
д.). Хотя книга является пособием для студентов химических факультетов, в ней много полезного найдут работающие в заводских химических и сельских агрохимических лабораториях. [c.2] В заключение необходимо отметить, что методы получения производных для газохроматографического анализа разработаны достаточно подробно и широко используются на практике. Однако эти методы рассчитаны, как правило, на использование в последующем газохроматографическом определении только двух типов детекторов пламенно-ионизационного (ПИД) и электронно-захватного (ЭЗД). Более широкие возможности для селективного определения отдельных классов органических соединений открываются при использовании и предварительных реакций, связанных с введением в молекулу анализируемых соединений атомов серы, фосфора, азота и других элементов, для определения которых разработаны и успешно используются в хроматографической практике селективные детекторы пламенно-фотометри-ческий, термоионный, электрохимические (кулонометрический, полярографический и др. ). В данном случае мы можем и должны говорить о развитии аналитической химии меченых нерадиоактивных атомов. Отметим, что в ряде случаев может быть полезным использование для тех же целей и методов введения в молекулы анализируемых соединений групп, содержащих радиоактивные изотопы, например и [154]. Особенно перспективно, по нашему мнению, использование комбинированных реагентов и детекторов для решения задачи идентификации компонентов сложных смесей, что является наиболее важной стороной использования метода предварительных реакций. Вторым перспективным направлением является применение предварительных реакций с целью концентрирования примесей. [c.49]
). В данном случае мы можем и должны говорить о развитии аналитической химии меченых нерадиоактивных атомов. Отметим, что в ряде случаев может быть полезным использование для тех же целей и методов введения в молекулы анализируемых соединений групп, содержащих радиоактивные изотопы, например и [154]. Особенно перспективно, по нашему мнению, использование комбинированных реагентов и детекторов для решения задачи идентификации компонентов сложных смесей, что является наиболее важной стороной использования метода предварительных реакций. Вторым перспективным направлением является применение предварительных реакций с целью концентрирования примесей. [c.49]
Основными элементами, входящими в состав органической молекулы, являются углерод, водород и кислород. Многие органические соединения содержат также азот, серу, фосфор. Известные радиоактивные изотопы кислорода и азота обладают слишком малыми периодами полураспада и потому применение их в исследованиях методом радиоактивных индикаторов ограничено. Также и единственный радиоактивный изотоп водорода тритий из-за особых технических трудностей работы с ним не нашел пока достаточно широкого применения. Естественно, что значительная часть работ в области органической химии была выполнена с применением стабильных изотопов дейтерия ( Н), тяжелого кислорода ( 0) и тяжелого азота Тем не менее использование радиоактив- [c.232]
Также и единственный радиоактивный изотоп водорода тритий из-за особых технических трудностей работы с ним не нашел пока достаточно широкого применения. Естественно, что значительная часть работ в области органической химии была выполнена с применением стабильных изотопов дейтерия ( Н), тяжелого кислорода ( 0) и тяжелого азота Тем не менее использование радиоактив- [c.232]
Ядерная медицина, базирующаяся на использовании радиоактивных изотопов в форме радиофармацевтических препаратов (РФП), источников излучения закрытого типа, а также на внешнем облучении, позволяет проводить многие исследования, диагностические и терапевтические процедуры лучше, проще и быстрее, чем любые другие традиционные методы. В некоторых случаях методам ядерной медицины вообще нет альтернативы. Эффективность этих методов основана на достижениях таких фундаментальных наук, как ядерная физика, химия, биология, а также результатах развития техники ускорителей и новых диагностических систем (сцинтиляционные камеры, однолучевые и позитрон-эмиссионные томографы, низкоэнергетические детекторы типа многопроволочных камер и т. д.). В настоящее время для научно-исследовательских, диагностических и терапевтических целей применяют около 200 различных радиоактивных изотопов, период полураспада которых составляет от нескольких минут до нескольких лет. Эти изотопы имеют преимущественно искусственное происхождение за счёт образования в реакциях взаимодействия заряженных частиц или нейтронов с веществом мишени. Радиоактивные изотопы получают в ядерных реакторах (реакторные изотопы), на ускорителях (циклотронные изотопы) и с помощью генераторов короткоживущих изотопов (генераторные изотопы). Некоторые изотопы, в основном изотопы долгоживущих и трансурановых элементов, могут быть получены при переработке отработавшего ядерного топлива. [c.548]
д.). В настоящее время для научно-исследовательских, диагностических и терапевтических целей применяют около 200 различных радиоактивных изотопов, период полураспада которых составляет от нескольких минут до нескольких лет. Эти изотопы имеют преимущественно искусственное происхождение за счёт образования в реакциях взаимодействия заряженных частиц или нейтронов с веществом мишени. Радиоактивные изотопы получают в ядерных реакторах (реакторные изотопы), на ускорителях (циклотронные изотопы) и с помощью генераторов короткоживущих изотопов (генераторные изотопы). Некоторые изотопы, в основном изотопы долгоживущих и трансурановых элементов, могут быть получены при переработке отработавшего ядерного топлива. [c.548]
Химия протекающих при этом экстракционных процессов остается, естественно, той же, что и при использовании экстракции в иных целях, однако некоторая специфика должна быть принята во внимание. Радиоактивное излучение обладает способностью вызывать побочные химические реакции — радиолиз воды, органического растворителя и т. д., что в свою очередь может изменить форму существования элемента в растворе, в частности валентное состояние. Экстракция радиоактивных элементов нередко требует также иного технического оформления процесса, предусматривающего защиту от излучения и тем более исключение прямого контакта с растворами. В ряде случаев следует учитывать также заметную адсорбцию радиоактивных изотопов без носителей на стенках используемой аппаратуры. [c.321]
д., что в свою очередь может изменить форму существования элемента в растворе, в частности валентное состояние. Экстракция радиоактивных элементов нередко требует также иного технического оформления процесса, предусматривающего защиту от излучения и тем более исключение прямого контакта с растворами. В ряде случаев следует учитывать также заметную адсорбцию радиоактивных изотопов без носителей на стенках используемой аппаратуры. [c.321]
При некоторых типах ядерных реакций (например, при облучении ядер элементов частицами высоких энергий и процессах деления тяжелых ядер) могут образоваться очень сложные смеси радиоактивны изотопов ряда элементов. Далее требуется их разделение и выделение в чистом виде как для изучения происходящих при этом процессов, так и для изучения свойств самих радиоактивных изотопов или использования их в качестве радиоактивных индикаторов. Приемы аналитической химии, используемые с учетом специфических условий (обычно приходится иметь дело с микроколичествами образующихся радиоактивных элементов), позволяют в ряде случаев проводить такие разделения с применением изотопных носителей или без них. Однако некоторые группы очень близких по свойствам элементов (редкоземельных, трансурановых и др.) обычными химическими методами разделяются весьма трудно. За последнее время эти задачи были успешно решены с помощью ионообменной хроматографии. Кроме того, оказалось, что часто ионообменными методами можно быстрее, проще и чище выделять и другие элементы, для которых обычно используются химические методы выделения. Поэтому в настоящее время разрабатываются хроматографические методы выделения многих элементов периодической системы. Преимущество этих методов состоит также в том, что в них отсутствуют явления соосаждений, захватов и т. д., причем чистые препараты можно получать в одном цикле. [c.384]
Однако некоторые группы очень близких по свойствам элементов (редкоземельных, трансурановых и др.) обычными химическими методами разделяются весьма трудно. За последнее время эти задачи были успешно решены с помощью ионообменной хроматографии. Кроме того, оказалось, что часто ионообменными методами можно быстрее, проще и чище выделять и другие элементы, для которых обычно используются химические методы выделения. Поэтому в настоящее время разрабатываются хроматографические методы выделения многих элементов периодической системы. Преимущество этих методов состоит также в том, что в них отсутствуют явления соосаждений, захватов и т. д., причем чистые препараты можно получать в одном цикле. [c.384]
Синтезированы и применяются содержащие серу аминокислоты, например СНз—3 5—СНа—СНг—СН (ЫНг)—СООН (метионин). Но особенно часто и широко в органической химии и биохимии применяются разнообразные вещества с радиоактивным изотопом углерода С. Исходным веществом для синтеза в этих случаях часто является СОг (из Ва СОз). Очень многие синтезы проводят с использованием реакции Гриньяра получение кислот, сложных эфиров, кетонов, алкоголей и др. Таким образом, приобретают большое значение такие синтезы, которые, казалось бы, никогда не было смысла применять в практике. Так, например, описан путь получения толуола по схеме [c.399]
Очень многие синтезы проводят с использованием реакции Гриньяра получение кислот, сложных эфиров, кетонов, алкоголей и др. Таким образом, приобретают большое значение такие синтезы, которые, казалось бы, никогда не было смысла применять в практике. Так, например, описан путь получения толуола по схеме [c.399]
Снижение стоимости очистки сточных вод может быть достигнуто только при одновременном решении двух проблем. Первая из них, которой должны заниматься и которой занимаются специалисты по радиационной химии, это — интенсификация радиационной очистки, т. е. изыскание условий, при которых радиационные процессы будут протекать с большими выходами. Вторая проблема — снижение стоимости источников излучения. Представляется необходимым изыскание путей производства дешевых радиоактивных изотопов °Со и Сз. Относительно Сз в гл. VI уже упоминалось, что, по мнению американских ученых, его производство могло бы быть существенно усовершенствовано, во много раз увеличено и, очевидно, удешевлено, если он будет использоваться в большом масштабе. В настоящее время это производство значительно ниже возможностей ядерной промышленности. Что касается Со, то, по мнению некоторых ученых, при эксплуатации энергетических реакторов имеется возможность использовать часть нейтронов для активации кобальта без существенного снижения мощности реактора. Для этой цели, вероятно, можно было бы использовать нейтроны утечки и нейтроны из запаса реактивности. Тогда стоимость Со существенно снизится. Но этот вопрос, конечно, не может быть здесь обсужден сколько-нибудь подробно, он требует специального рассмотрения. Требуется также разработка и проверка в производственных условиях ускорителей, дающих мощный поток электронов с достаточной высокой энергией, стабильных и надежных в работе. И, далее, необходимы исследования возможностей, предоставляемых для радиационной очистки реакторными петлями и СПД. Весьма перспективным представляется использование реакторов атомных электростанций — не только для получе- [c.137]
В настоящее время это производство значительно ниже возможностей ядерной промышленности. Что касается Со, то, по мнению некоторых ученых, при эксплуатации энергетических реакторов имеется возможность использовать часть нейтронов для активации кобальта без существенного снижения мощности реактора. Для этой цели, вероятно, можно было бы использовать нейтроны утечки и нейтроны из запаса реактивности. Тогда стоимость Со существенно снизится. Но этот вопрос, конечно, не может быть здесь обсужден сколько-нибудь подробно, он требует специального рассмотрения. Требуется также разработка и проверка в производственных условиях ускорителей, дающих мощный поток электронов с достаточной высокой энергией, стабильных и надежных в работе. И, далее, необходимы исследования возможностей, предоставляемых для радиационной очистки реакторными петлями и СПД. Весьма перспективным представляется использование реакторов атомных электростанций — не только для получе- [c.137]
Метод радиоактивных индикаторов прочно вошел в практику химических исследований. Поэтому во многих университетах и институтах введены лекционные курсы и практические занятия по методу радиоактивных индикаторов в химии, цель которых заключается в подготовке химиков широкого профиля (не являющихся специалистами— радиохимиками) к сознательному и грамотному использованию радиоактивных изотопов при решении различных химических задач. [c.11]
Поэтому во многих университетах и институтах введены лекционные курсы и практические занятия по методу радиоактивных индикаторов в химии, цель которых заключается в подготовке химиков широкого профиля (не являющихся специалистами— радиохимиками) к сознательному и грамотному использованию радиоактивных изотопов при решении различных химических задач. [c.11]
Знание закономерностей, определяющих поведение индикаторных количеств веществ, позволяет свести к минимуму возможность неконтролируемых потерь радиоактивного индикатора или предотвратить его загрязнение посторонними примесями. Кроме того, обнаруженные закономерности могут широко использоваться в целом ряде областей прикладной химии при получении сверхчистых веществ, полупроводников, ферритов и т. п. Наконец, использование особенностей поведения веществ в ультрамалых концентрациях лежит в основе важнейших методов концентрирования и разделения радиоактивных изотопов. [c.142]
Использование радиоактивных изотопов в аналитической химии позволило создать принципиально новые методы качественного и количественного анализа, проверить и существенно улучшить многие классические методы, сократить время выполнения анализа. [c.201]
[c.201]
Широко применяют также вещества, меченные стабильными изотопами— дейтерием Н, тяжелым кислородом Ю и тяжелым азотом однако далее речь будет идти только об использовании в органической химии радиоактивных изотопов. [c.296]
В книге освещается широкий круг вопросов, связанных с применением радиоактивных изотопов в химий теоретические основы изотопных методов исследования, получение и выделение изотопов различных элементов, методы получения меченых роединений. Основное внимание уделяется использованию радиоактивных изотопов в наиболее важных областях химии — аналитической, неорганической, физической, органической. [c.2]
Книга может служить полезным руководством для лиц, занимающихС Я исследованиями с использованием радиоактивных изотопов в химии и смежных с ней областях. Кроме того, она может быть рекомендована как учебное пособие для студентов химических вузов. [c.2]
С другой стороны, тесные контакты коллоидной химии со смежными дисциплинами способствовали обогащению ее экспериментальной базы. Наряду с такими классическими методами эксперимента, родившимися именно в коллоидной химии, как определение поверхностного натяжения и двухмерного давления, ультрамикроскопия, центрифугирование, диализ и ультрафильтрацня, наблюдение разнообразных электрокинетичеоких явлений в дисперсных системах, дисперсионный анализ и порометрия, многочисленные прецизионные адсорбционные методы, изучение рассеяния света (опалесценции) и т. п., в разных разделах коллоидной химии нашли эффективное применение всевозможные спектральные методы ЯМР, ЭПР, УФ- и ИК-спектроскопия, гашение люминесценции, многократно нарушенное полное внутреннее отражение, эллипсометрия (с широким использованием лазерной техники), малоугловое рассеяние рентгеновских лучей и другие рентгеновские методы, радиоактивные изотопы, все виды электронной микроскопии. Большие перспективы открывает привлечение современных физических методов исследования поверхностей с использованием медленных электронов, масс-спектроскопии вторичных ионов и т.
Наряду с такими классическими методами эксперимента, родившимися именно в коллоидной химии, как определение поверхностного натяжения и двухмерного давления, ультрамикроскопия, центрифугирование, диализ и ультрафильтрацня, наблюдение разнообразных электрокинетичеоких явлений в дисперсных системах, дисперсионный анализ и порометрия, многочисленные прецизионные адсорбционные методы, изучение рассеяния света (опалесценции) и т. п., в разных разделах коллоидной химии нашли эффективное применение всевозможные спектральные методы ЯМР, ЭПР, УФ- и ИК-спектроскопия, гашение люминесценции, многократно нарушенное полное внутреннее отражение, эллипсометрия (с широким использованием лазерной техники), малоугловое рассеяние рентгеновских лучей и другие рентгеновские методы, радиоактивные изотопы, все виды электронной микроскопии. Большие перспективы открывает привлечение современных физических методов исследования поверхностей с использованием медленных электронов, масс-спектроскопии вторичных ионов и т.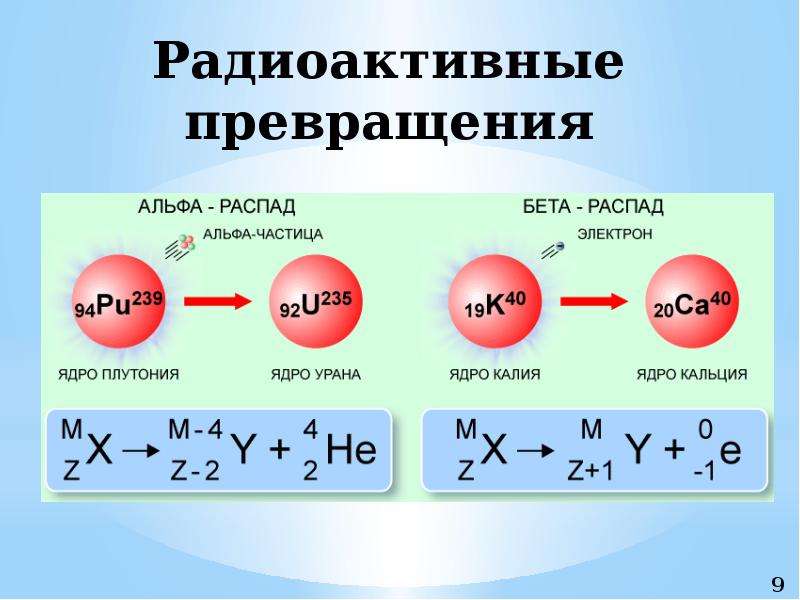 п. [c.9]
п. [c.9]
Еще более сильное действие на молекулы оказывают ядерные излучения (у-излучение, протоны, нейтроны и др.) и рентгеновское излучение. Раздел химии, занимающийся вопросами химического действия этих излучений, называется радиационной химией. В отличие от нее радиохимией называют химию радиоактивных элементов, в частности химию меченых атомов . Радиационная химия развивается в связи с развитием ядернсй физико-химии и ядерной энергетики. Атомные реакторы, ускорители частиц, радиоактивные изотопы дают разнообразные очень мощные потоки частиц, которыми все больше начинают пользоваться для осуществления химических реакций. Эти излучения рвут связи, выбивают отдельные атомы, порождают радикалы и ионы, а затем идут перегруппировки связей и возникают новые. Например, вместо двухстадийного обычного химического получения фенола из бензола можно получать это важнейшее вещество из бензола и воды в одностадийном процессе с использованием ядерных излучений. При этом из воды получаются радикалы ОН и Н и бензол далее реагирует по схеме [c. 57]
57]
Следует отметить, что в подавл 5ющем большинстве случаев при использовании радиоактивных веществ в химии и химической промышленности применяются препараты такой активности, излучение которых не может не только превысить,, но даже сколь-нибудь приблизиться к предельно допустимой норме. Однако применение радиоактивных изотопов при химических исследованиях часто-сопряжено с другой опасностью. Поскольку эти вещества применяются в так называемом открытом виде, т. е. химику приходится манипулировать с жидкими, сыпучим или даже газообразными радиоактивными препаратами, возникает опасность при неосторожной работе попадани радиоактивных веществ внутрь организма. В этом случае вредное действие радиоактивных изотопов резко повышается, поскольку многие из изотопов обладают способностью концентрироваться в определенных органах челове-ческого тела и выводятся из организма очень медленно. [c.127]
В 50—60-е годы развитие фундаментальных исследований в химии комплексонов и комплексонатов способствовало дальнейшему расширению области применения обсуждаемых хелантов. В основном это относится к использованию комплексонов в качестве умягчителей воды и средств удаления накипи и солеот-ложений в энергетическом оборудовании, применению комплексонатов микроэлементов в сельском хозяйстве Появление и совершенствование ядерной техники стимулировало разработку методик использования комплексонов для выведения из организма человека радиоактивных изотопов [c.10]
В основном это относится к использованию комплексонов в качестве умягчителей воды и средств удаления накипи и солеот-ложений в энергетическом оборудовании, применению комплексонатов микроэлементов в сельском хозяйстве Появление и совершенствование ядерной техники стимулировало разработку методик использования комплексонов для выведения из организма человека радиоактивных изотопов [c.10]
Известную проблему, особенно в биоаналитической химии, составляет определение выхода, т. е. определение процентного количества соединения после его выделения из, скажем, биологической матрицы. Выход часто определяется с помошью метода внутреннего стандарта, основное требование к которому состоит в том, чтобы он по своим свойствам был максимально близок к определяемому соединению. Очень часто эту проблему решить довольно трудно, что, естественно, влияет на достоверность результатов. Почти идеальными внутренними стандартами являются изотопно-меченные аналоги соединения, использование которых привело к исключительно важной роли масс-спектрометрического обнаружения в количественном газохроматографическом анализе.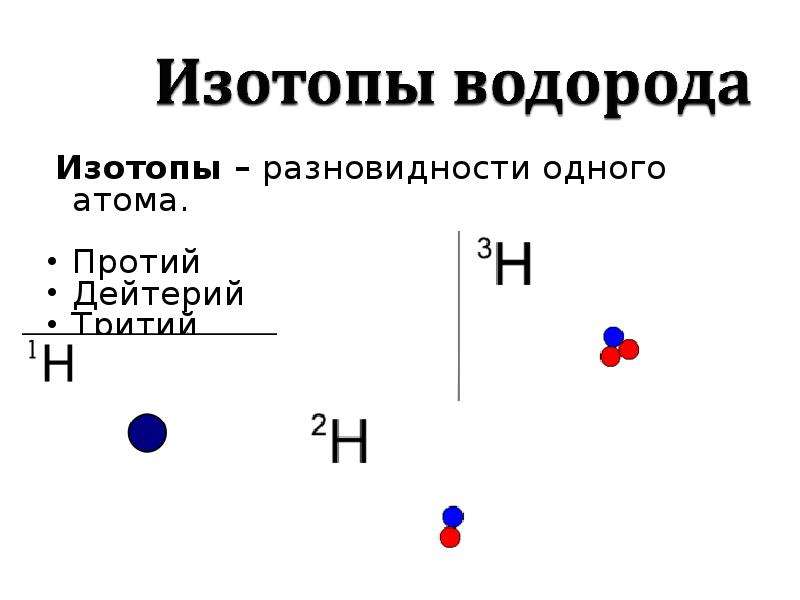 В этом случае для введения метки применяются стабильные изотопы (чаще всего дейтерированные аналоги), и вследствие высокой разрешающей способности такой системы обнаружения отношение меченого внутреннего стандарта и немеченого анализируемого образца можно определить точно. Химическое различие, обусловленное изотопным замещением, обычно пренебрежимо мало и не влияет на результаты выделения и обработки пробы. Хотя в капиллярной ГХ может наблюдаться небольшое различие во временах удерживания изомеров, меченных Н и н, влияние изотопного замещения на удерживание обычно не проявляется ввиду очень незначительного различия в способности к образованию водородных связей с неподвижной фазой. Как и при применении стандартов, меченных радиоактивными изотопами, определение меченого и немеченого соединений основывается целиком на специфическом методе одновременного обнаружения обеих форм. [c.174]
В этом случае для введения метки применяются стабильные изотопы (чаще всего дейтерированные аналоги), и вследствие высокой разрешающей способности такой системы обнаружения отношение меченого внутреннего стандарта и немеченого анализируемого образца можно определить точно. Химическое различие, обусловленное изотопным замещением, обычно пренебрежимо мало и не влияет на результаты выделения и обработки пробы. Хотя в капиллярной ГХ может наблюдаться небольшое различие во временах удерживания изомеров, меченных Н и н, влияние изотопного замещения на удерживание обычно не проявляется ввиду очень незначительного различия в способности к образованию водородных связей с неподвижной фазой. Как и при применении стандартов, меченных радиоактивными изотопами, определение меченого и немеченого соединений основывается целиком на специфическом методе одновременного обнаружения обеих форм. [c.174]
Среди различных проблем мирного использования атомнрй энергии важное место занимают работы по изысканию путей и методов приме1чения радиоактивных изотопов и ядерных излучений в различных процессах переработки нефтяных углеводородов.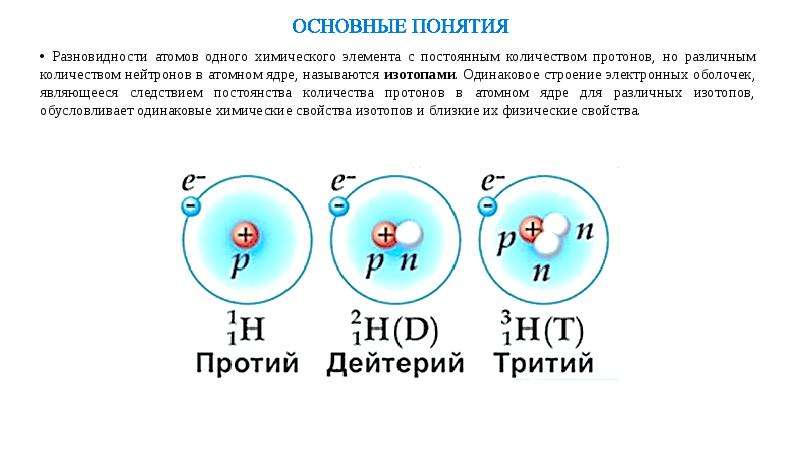 В послевоенные годы в связи с появлением мощных источников ионизирующего излучения начала бурно развиваться новая отрасль науки — радиационная химия как одно из направлений общей проблемы использования атомной энергии в мирных целях. [c.269]
В послевоенные годы в связи с появлением мощных источников ионизирующего излучения начала бурно развиваться новая отрасль науки — радиационная химия как одно из направлений общей проблемы использования атомной энергии в мирных целях. [c.269]
Основные научные работы относятся к аналитической и физической химии. Разработал колориметрический метод определения водородного показателя с использованием кислотно-основных индикаторов, Указал на важность контроля этого показателя в промышленности, бактериологии и аналитической химии. Изучал процессы образования и кристаллизации осадков с помощью радиоактивных изотопов. Одним из первых в США выполнил фундаментальные исспе-дования в области полярографического анализа. Изучал кинетику и механизм эмульсионной полимеризации, разработал низкотемпературный способ производства синтетического каучука. После 1955 сконцентрировал свое рнимание на изучении кислотно-основного равновесия и разработке методов титрования в неводных средах Автор переведенных на многие языки книг, в частности таких, как Кон-дуктометрическое титрование (1923. русский перевод 1935), Потенциометрическое титрование (1927), Объемный анализ (т. 1 — 2, 1929, русский перевод 1930, 1932), Учебник количественного неорганического анализа (1936), [c.249]
русский перевод 1935), Потенциометрическое титрование (1927), Объемный анализ (т. 1 — 2, 1929, русский перевод 1930, 1932), Учебник количественного неорганического анализа (1936), [c.249]
Ценные результаты в области радиационной химии водных растворов получены при использовании радиоактивиых и стабильных изотопов. Выше уже отмечалось (см. стр. 100), что введение радиоактивного изотопа церия в виде иона Се + в раствор сернокислого окисного церия позволило экспериментально доказать участие радикалов ОН в обратном окислении Се +, возникающего при радиолитическом ваастанавлении Се +. Позже в результате применения радиоактивного Сг + была установлена аналогичная роль радикалов ОН в радиолитических превращениях ионов Сг + [156]. [c.119]
Недавние исследования Мелвина Кэлвина (род. в 1911 г.) с использованием радиоактивных изотопов представили процесс фотосинтеза в новом освещении оказалось, что для него имеет значение также реакция фосфо-рилирования Так же как альдольная конденсация формальдегида была привлечена для объяснения процесса фотосинтеза в растениях, эта реалия послужила для решения путем синтезов in vitro некоторых про блем, относящихся к химии простых сахаров. [c.370]
[c.370]
Однако многие элементы (Т1, V, А1, Мд и др.) не имеют доступных радиоизотопов, пригодных в качестве индикаторов. Для определения состава экстрагирующихся внутрикомплексных соединений, образуемых такими элементами, можно использовать неизо-топные индикаторы, т. е. радиоактивные изотопы других элементов. Области применения неизотопных индикаторов в аналитической химии рассмотрены Коренманом и Шеяновой [429, 430]. В наиболее простом варианте использование этих индикаторов аналогично их применению в экстракционном радиометрическом титровании (стр. 208). [c.144]
Адсорбционные явления находят чрезвычайно широкое применение в препаративной химии искусственных радиоактивных элементов. Методы, основанные на использовании вторичной обменной адсорбции, позволяют выделять без носителя большое число радиоактивных изотопов, получаемых с помощью различных реакций. Так, например, отделение изотопа хрома, получаемого по реакции У Цй,2п) Сг от вещества мишени и радиоактивных загрязнений (изотопы титана и скандия) осуществляется с помощью адсорбции на гидроокиси железа. Аналогичным образом осуществляется выделение радиоактивного изотопа марганца, получаемого по реакции Сг52( , 2п)Мп [20]. [c.127]
Аналогичным образом осуществляется выделение радиоактивного изотопа марганца, получаемого по реакции Сг52( , 2п)Мп [20]. [c.127]
Радиоактивные индикаторы могут быть использованы для решения различных задач, связанных с изучением электрохимических процессов. Во многих случаях, когда речь идет об определении малых количеств веществ, выделяющихся при электролизе, о контроле перемещения ионов в электрическом поле и т. д., применение радиоактивных индикаторов дает возможность упростить решение поставленной задачи и ускорить получение нужной информации. Принципы использования радиоактивных индикаторов в электрохимических процессах имеют много общего с нринципами использования меченых атомов в других областях физической химии. Поэтому ограничимся рассмотрением только одного примера нсполь-зовання радиоактивных индикаторов в электрохимии, а именно, применением радиоактивных изотопов для определения чисел переноса. [c.288]
Одна из важнейших особенностей органических соединений состоит в том, что в состав их молекул обычно входит несколько атомов одного и того же элемента, которые могут по-разному вести себя в различных химических процессах. Использование радиоактивных изотопов позволяет проследить за поведением отдельных атомов органических веществ при химических реакциях, если для исследования взяты вещества, в молекулах которых радиоактивные атомы занимают строго определенное положение. Например, за поведением карбоксильного углерода, входящего в состав молекулы пропионовой кислоты, можно проследить, используя пропио-новую кислоту, содержащую радиоактивные атомы только в карбоксильной группе С2Н5 СООН. Другая группа задач, решаемых в органической химии с помощью радиоактивных индикаторов (определение количеств органических веществ, скоростей расходования или накопления какого-либо продукта и т. д.), не нуждается в использовании соединений, содержащих радиоактивную метку в строго определенном положении. В этом случае возможно применение веществ, состоящих из равномерно меченых молекул или молекул, радиоактивную метку в которых несет любой атом данного элемента. [c.295]
Использование радиоактивных изотопов позволяет проследить за поведением отдельных атомов органических веществ при химических реакциях, если для исследования взяты вещества, в молекулах которых радиоактивные атомы занимают строго определенное положение. Например, за поведением карбоксильного углерода, входящего в состав молекулы пропионовой кислоты, можно проследить, используя пропио-новую кислоту, содержащую радиоактивные атомы только в карбоксильной группе С2Н5 СООН. Другая группа задач, решаемых в органической химии с помощью радиоактивных индикаторов (определение количеств органических веществ, скоростей расходования или накопления какого-либо продукта и т. д.), не нуждается в использовании соединений, содержащих радиоактивную метку в строго определенном положении. В этом случае возможно применение веществ, состоящих из равномерно меченых молекул или молекул, радиоактивную метку в которых несет любой атом данного элемента. [c.295]
И, наконец, говоря о применении рутения, нельзя не упомянуть об использовании его радиоактивных изотопов в научных исследованиях, особенно при решении спорных вопросов химии самого рутения. Здесь элемент № 44 в конечном счете борется сам с собой и для себя. Ведь путь к окончательному решению проблемы очистки ядерного горючего от радиорутения и разработка способов его эффективного извлечения из руд проходит через углубленное познание свойств и особенностей этого сложного и необычного элемента. [c.253]
Здесь элемент № 44 в конечном счете борется сам с собой и для себя. Ведь путь к окончательному решению проблемы очистки ядерного горючего от радиорутения и разработка способов его эффективного извлечения из руд проходит через углубленное познание свойств и особенностей этого сложного и необычного элемента. [c.253]
Использование адсорбции на угле в препаративной химии радиоактивных изотопов. [c.470]
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Как вы работаете?
Вам нужно написать сообщение в WhatsApp . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Whatsapp или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Урок №1.
 Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные веществаУрок №1. Атом. Химический элемент. Изотопы. Простые и сложные вещества
Повторите основные
положения темы «Основные понятия химии» и решите предложенные задачи. Используйте материалы уроков химии 8 класса №№6-17.
Видео YouTube
Основные положения
1. Вещество (простое и сложное) – это любая совокупность атомов и молекул, находящаяся в определённом агрегатном состоянии.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называется химическими реакциями.
2. Структурные единицы вещества:
· Атом – наименьшая элекронейтральная частица химического элемента и простого
вещества, обладающая всеми его химическими свойствами и далее физически и
химически неделимая.
· Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая химически.
3. Химический элемент – это вид атомов с определённым зарядом ядра.
4. Состав атома:
Частица | Как определить? | Заряд | Масса | ||
Кл | условные единицы | г | а.е.м. | ||
Электрон | По порядковому Номеру (N) | -1. | -1 | 9.10 ∙ 10-28 | 0.00055 |
Протон | По порядковому номеру (N) | 1.6 ∙ 10 -19 | +1 | 1.67 ∙ 10-24 | 1.00728 |
Нейтрон | Ar – N | 0 | 0 | 1.67 ∙ 10-24 | 1.00866 |
5. Состав атомного ядра:
· В состав ядра входят элементарные частицы (нуклоны) –
протоны (11p) и нейтроны (10n).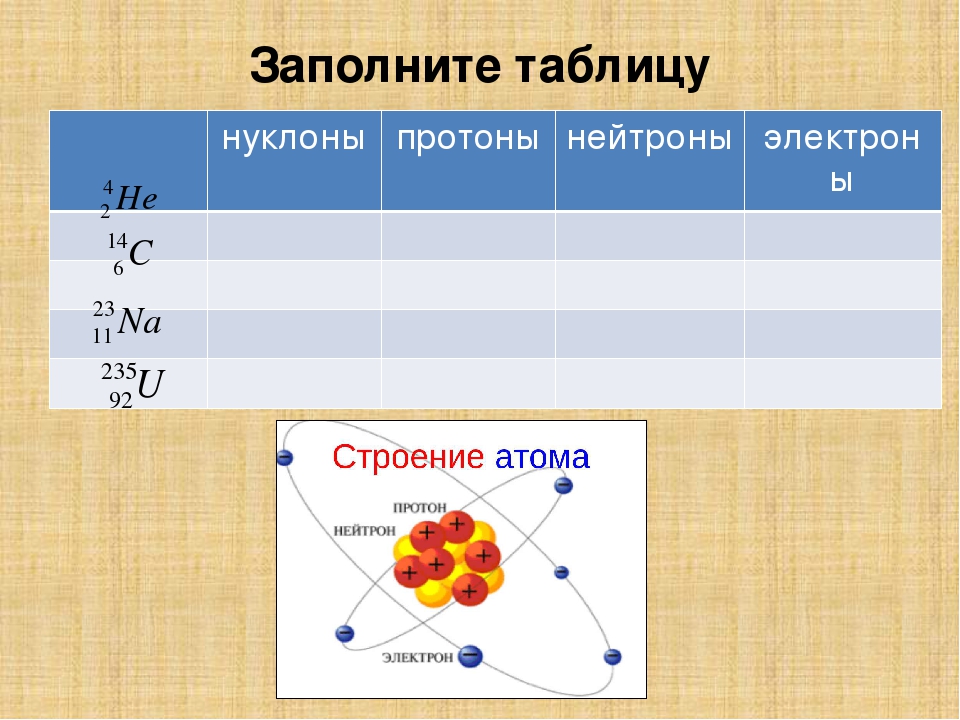
· Т.к. практически вся масса атома сосредоточена в ядре и mp ≈ mn ≈ 1 а.е.м, то округлённое значение Ar химического элемента равно общему числу нуклонов в ядре.
(А – массовое число, округлённое значение Аr; N – число нейтронов в ядре; Z – заряд ядра, равный числу протонов)
6. Общее число электронов в электронной оболочке атома Nē равно числу протонов в ядре и порядковому номеру химического элемента
7. Изотопы – разновидность атомов одного и того же химического элемента, отличающиеся друг от друга только своей массой.
· Обозначение изотопов: слева от символа элемента указывают массовое число (вверху) и порядковый номер элемента (внизу)
· Почему у изотопов разная масса?
Задание: Определите атомный состав изотопов хлора: 3517Cl и 3717Cl?
·
Изотопы имеют
разную массу из-за различного числа нейтронов в их ядрах.
8. В природе химические элементы существуют в виде смесей изотопов.
Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Например:
ωат (3517Cl) = 0,754
ωат (3717Cl) = 0,246
9. В таблице Менделеева приведены средние значения относительных атомных масс химических элементов с учётом их изотопного состава. Поэтому Ar , указанные в таблице являются дробными.
Arср = ωат.(1) ∙ Ar(1) +
… + ωат.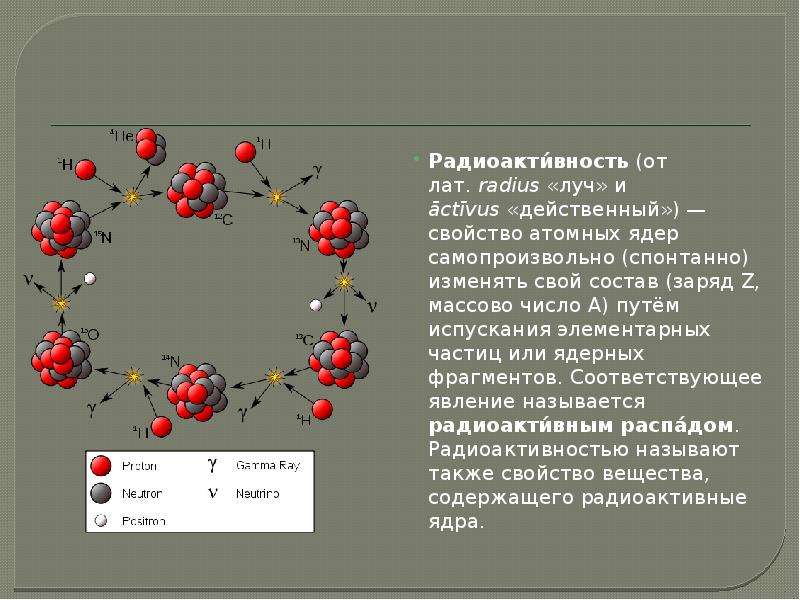 (n) ∙ Ar(n)
(n) ∙ Ar(n)
Например:
Arср (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
10. Задача для решения:
№1. Определите относительную атомную массу бора, если известно, что молярная доля изотопа 10В составляет – 19,6 %, а изотопа 11В – 80,4 %.
11. Массы атомов и молекул очень малы. В настоящее время в физике и химии принята единая система измерения.
1 а.е.м. = m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-27 кг = 1,66057 ∙ 10-24 г.
Абсолютные массы некоторых атомов:
m(C) = 1,99268 ∙ 10-23 г
m(H) = 1,67375 ∙ 10-24 г
m(O) = 2,656812 ∙ 10-23 г
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С.
Мr – показывает, во сколько раз данная молекула тяжелее 1/12 части атома 12С.
12. Связь между абсолютной и относительной массами атома или молекулы:
m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг |
m(молекулы) = Mr∙ 1,66 ∙ 10 -27 кг |
13. Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют единицу измерения – моль.
· Моль (ν) – единица количества вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов содержится в 12 г изотопа 12C
·
Масса 1
атома 12C равна 12 а. е.м., поэтому число атомов в 12 г изотопа 12C равно:
е.м., поэтому число атомов в 12 г изотопа 12C равно:
NA = 12 г / 12 ∙ 1,66057 ∙ 10-24 г = 6,0221 ∙ 1023
· Физическая величина NA называется постоянной Авогадро (число Авогадро) и имеет размерность [NA] = моль-1.
14. Основные формулы:
M = Mr = ρ ∙ Vm (ρ – плотность; Vm – объём при н.у.)
Задачи для самостоятельного решения
№1. Вычислите число атомов азота в 100г карбоната аммония, содержащего 10% неазотистых примесей.
№2. При нормальных
условиях 12 л
газовой смеси, состоящей из аммиака и углекислого газа, имеют массу 18 г. Сколько литров каждого
из газов содержит смесь?
Сколько литров каждого
из газов содержит смесь?
№3. При действии избытка соляной кислоты на 8,24 г смеси оксида марганца (IV) с неизвестным оксидом МО2, который не реагирует с соляной кислотой, получено 1,344 л газа при н.у. Входе другого опыта установлено, что мольное отношение оксида марганца (IV) к неизвестному оксиду равно 3:1. Установите формулу неизвестного оксида и вычислите его массовую долю в смеси.
сайт химиков > справочник по химии > Нуклиды. Изотопы.
Большинство элементов, содержащихся в природе, состоит из нескольких видов атомов, отличающихся значениями относительной атомной массы.Пример. Хлор в природе встречается как смесь двух видов атомов, один из которых 18, а другой 20 нейтронов в ядре.
Каждый вид атомов независимо от принадлежности к конкретному элементу однозначно описывается числом нуклидов (суммой протонов и нейтронов). Поэтому число видов атомов превышает число элементов.
Каждый вид атомов (вид ядер) называется нуклидом.
Нуклид – это вид атомов и ядер, отвечающий определенным числам протонов и нейтронов.
Изотопные нуклиды (изотопы) – это нуклиды принадлежащие одному химическому элементу имеющие одинаковое число протонов, но различающиеся по числу нейтронов.
Изотопы элемента – это нуклиды, обладающие равным зарядом ядра (одинаковым числом протонов).
Пример. Ядра двух природных изотопов хлора содержат по 17 протонов, по 18 и 20 нейтронов, т. е. 35 и 37 нуклонов соответственно.
Вследствие того, что именно числом протонов в ядре определяется число электронов в оболочке атома и химические свойства элемента, следует, что атомы всех изотопов одного и того же элемента имеют одинаковое электронное строение, а сами изотопы – близкие химические свойства, из – за чего их не удается разделить химическими методами.
В литературе еще встречается смешивание понятий нуклид и изотоп, хотя в 1950 г. было принято международное соглашение, по которому к изотопам следует относить различные виды атомов (точнее, ядер) только одного элемента (Z = const), а различные не только по числу нейтронов, но и также по числу протонов и электронов ядра и атомы следует называть нуклидами. Например, атом углерода с 12 нуклонами в ядре, атом кобальта с 59 нуклонами и атом урана с 235 нуклонами – это нуклиды, т. е. конкретные виды атомов различных элементов, а три разных атома углерода с 12, 13 и 14 нуклонами в их ядрах – это изотопы (изотопные нуклиды) элемента углерод. Таким образом, нуклид – это более широкое понятие, чем изотоп, так как каждый изотоп есть нуклид, но только нуклиды одного элемента являются изотопами.
Например, атом углерода с 12 нуклонами в ядре, атом кобальта с 59 нуклонами и атом урана с 235 нуклонами – это нуклиды, т. е. конкретные виды атомов различных элементов, а три разных атома углерода с 12, 13 и 14 нуклонами в их ядрах – это изотопы (изотопные нуклиды) элемента углерод. Таким образом, нуклид – это более широкое понятие, чем изотоп, так как каждый изотоп есть нуклид, но только нуклиды одного элемента являются изотопами.
В природе встречаются элементы, имеющие только один изотоп. Такие элементы называются изотопно-чистыми. В Периодическая система химических элементов насчитывается 21 изотопно-чистый элемент (ниже они перечислены по возрастанию порядкового номера):
| бериллий  фтор натрий алюминий фосфор скандий марганец | Be F Na Al P Sc Mn | кобальт мышьяк иттрий ниобий родий йод цезий | Co As Y Nb Rh I Cs | празеодим тербий гольмий тулий золото висмут торий | Pr Tb Ho Tm Au Bi Th |
Остальные природные элементы представляют собой смесь двух или более изотопов, атомы которых различаются по числу нуклонов. Такие элементы называются изотопно-смешанными, их в Периодической системе большинство. Значения относительных атомных масс таких элементов отвечают природной смеси изотопов и являются усредненными по содержанию изотопов, поэтому значения Аr многих элементов сильно отклоняются от целочисленных значений, и часто, начинающие изучать химию, воспринимают их как ошибку Периодической системы (!). Наипример, обычное и закономерное увеличение атомной массы с увеличением порядкового номера, “нарушается” у таких элементов как теллур и йод: 127.652Te 126.904553I. Даже углерод, который принят за точку отсчета относительных атомных масс других элементов, является изотопно-смешанным элементом (два изотопа с Аr = 12 b Аr = 13), и мерой определения относительной атомной массы служит один из природных изотопов углерода, а именно углерод-12.
Такие элементы называются изотопно-смешанными, их в Периодической системе большинство. Значения относительных атомных масс таких элементов отвечают природной смеси изотопов и являются усредненными по содержанию изотопов, поэтому значения Аr многих элементов сильно отклоняются от целочисленных значений, и часто, начинающие изучать химию, воспринимают их как ошибку Периодической системы (!). Наипример, обычное и закономерное увеличение атомной массы с увеличением порядкового номера, “нарушается” у таких элементов как теллур и йод: 127.652Te 126.904553I. Даже углерод, который принят за точку отсчета относительных атомных масс других элементов, является изотопно-смешанным элементом (два изотопа с Аr = 12 b Аr = 13), и мерой определения относительной атомной массы служит один из природных изотопов углерода, а именно углерод-12.
Наибольшее число изотопов (десять) имеет элемент олово Sn. В первом приближении считается, что соотношение изотопов элемента в любых природных объектах, и оно не изменяется в химических реакциях.
Пример: Изотопно-смешанный элемент хлор всегда отвечает природному содержанию двух изотопов: 75,77% с Аr = 35 (34,9688 точно) и 24,23 % с Аr = 37 (36,9658).
На основе прецизионных экспериментальных определений установлено, что некоторые изотопно-смешанные элементы в образцах различного происхождения проявляют отклонения (хотя и незначительные) по изотопному составу, впервые это было обнаружено у серы в пределах ±0,003%.
Для нуклидов точные значения относительных атомных масс всегда близки к целочисленным значениям, поэтому массы нуклидов можно сравнивать по этим значениям Аr, называемым массовыми числами.
Каждый нуклон имеет массовое число, равное 1 ( точные значения Аrp = 1,0073 а.е.м., для нейтрона Аrn = 1,0087 а.е.м.). Так как масса атома сосредоточена в его ядре, то фактически за единицу атомной массы принята масса одного нуклона, или 1/12 часть массы атома изотопа углерод-12.
Для обозначения конкретного нуклида применяется специальная символика. Слева от символа химического элемента верхним индексом указывается массовое число, а нижним индексом – заряд ядра (порядковый номер элемента).
Пример:
| 126С | 168O | 3517Cl | 5927Co | 23592U |
Массовое число = Число нуклонов в ядре
Порядковый номер = Число протонов в ядре или число электронов в оболочке атома
Разность между массовым числом и порядковым номером = Число нейтронов в ядре
По происхождению нуклиды (виды атомов и ядер) делятся на природные и искусственные в зависимости от того, выделены они из природных объектов или синтезированы в лаборатории.
По устойчивости т.е. способности самопроизвольно видоизменяться, нуклиды делятся на стабильные и радиоактивные.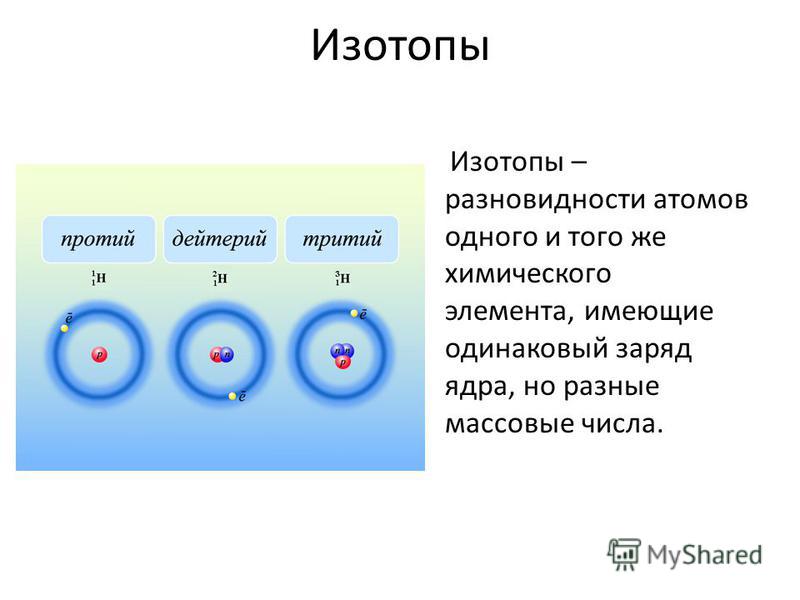
Большинство нуклидов, встречающихся в природе, стабильны. Или не радиоактивны; они могут сохраняться в неизмененном виде неограниченно долго. В природе имеются и радиоактивные нуклиды с ограниченным временем жизни, однако почти у всех природных нуклидов оно достаточно большое и не вызывает колебаний природного изотопного состава. Так, среди трех природных изотопов калия ( 39К, 40К, 41К) изотоп 40К радиоактивен; половина атомов изотопа 40К распадается за 1,28·109 лет; это время называется периодом полураспада.
период полураспада – это время, по прошествии которого количество радиоактивного вещества уменьшится в 2 раза по сравнению с первоначальным количеством этого вещества на момент начала отсчета времени
Формула для расчета количества радиоактивного вещества (ν½, моль), с известным временем полураспада (T½), которое остается с течением времени (t):
Например, изотоп элемента 106 с массовым числом 263 имеет период полураспада 0,9 с, а изотоп 60Co – 5,272 лет.
Радиоактивные нуклиды спонтанно распадаются, превращаясь в другие виды ядер, при распаде кроме других видов ядер, возникают и другие частицы α-частицы – это ядра атомов гелия 42H (ядерная реакция – альфа-распад) и β-частицы – это электроны 0-1e (ядерная реакция – бета-распад).
Радиоактивность. Ядерные реакции.
Изотопы — все статьи и новости
Изотопы — разновидности атомов одного химического элемента, сходные по свойствам (структура электронных оболочек), но отличающиеся массой ядер. Также изотопы называются нуклидами элементов, так как в их ядрах одинаковое число протонов и разное — нейтронов.
В периодической системе химических элементов изотопы занимают одну и ту же позицию. Для обозначения изотопов одного элемента приписывают индекс вверху, указывающий на количество нейтронов и протонов, и внизу, сообщающий о зарядовом числе (порядковый номер в системе). У изотопов водорода (Н) есть собственные названия — дейтерий и тритий. У других элементов зафиксировано большее число изотопов: у железа (Fe) — 4, у ртути (Hg) — 7, у олова (Sn) — 10, что считается максимумом.
У изотопов водорода (Н) есть собственные названия — дейтерий и тритий. У других элементов зафиксировано большее число изотопов: у железа (Fe) — 4, у ртути (Hg) — 7, у олова (Sn) — 10, что считается максимумом.
Разделение изотопов одного элемента достаточно сложный и трудоёмкий процесс. Один из наиболее распространенных методов — физико-химический. Он строится на описании различий таких свойств, как скорость реакций или испарения.
Изотопы можно разделить на стабильные и нестабильные. Первые характеризуются устойчивостью, они способны оставаться неизменными. Ко второй группе относятся те изотопы, которые самостоятельно распадаются с течением времени.
Изотопы широко применяются в практической жизни. Например, достаточно популярно радиоизотопное исследование почек. В кровь пациента вводят вещество, содержащее атомы йода. Попадая в ткани почек, вещество изнутри подсвечивает проблемные участки, видимые на специальном приборе, и даёт полное представление о работе органа.
Активное изучение изотопов началось в 1900-х годах одновременно с новыми исследованиями атомов. Наличие изотопов опытным путём подтвердили Френсис Астон и Джозеф Томсон. Особый вклад внесли французские физики, лауреаты Нобелевской премии Фредерик и Ирэн Жолио-Кюри. В 1934 году им впервые удалось искусственным получить радиоактивные изотопы азота (N), кремния (Si) и фосфора (P).
Наличие изотопов опытным путём подтвердили Френсис Астон и Джозеф Томсон. Особый вклад внесли французские физики, лауреаты Нобелевской премии Фредерик и Ирэн Жолио-Кюри. В 1934 году им впервые удалось искусственным получить радиоактивные изотопы азота (N), кремния (Si) и фосфора (P).
Источник картинки: http://qps.ru/Bx8h4
2.3: Изотопное содержание и атомный вес
цели обучения
- Определить атомный вес
- Рассчитать атомный вес по процентному содержанию
- Манипулируйте уравнением атомного веса для вычисления различных неизвестных переменных
- Различать атомный вес, атомный номер и массовое число
Атомный вес
Атомный вес – это масса атома, обычно выражаемая в атомных единицах массы (а.е.м.).Для изотопа это масса ядра, то есть масса протонов и нейтронов, поскольку масса электронов считается незначительной. В своем естественном состоянии только 21 элемент существует в виде отдельных изотопов, то есть образец имеет ядра только одного изотопа, и они называются мононуклидными элементами.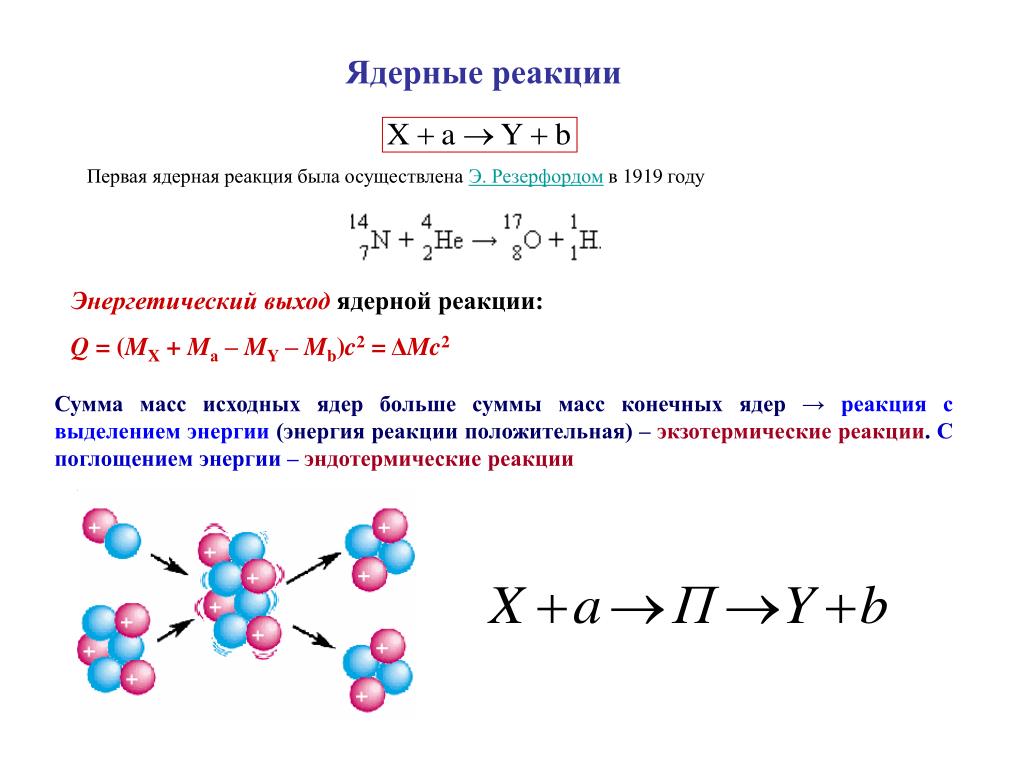 Большинство элементов существуют в виде смеси ядер из нескольких изотопов, и они обозначены как полинуклидные элементы. Атомный вес моноклидного элемента – это масса этого нуклида.
Большинство элементов существуют в виде смеси ядер из нескольких изотопов, и они обозначены как полинуклидные элементы. Атомный вес моноклидного элемента – это масса этого нуклида.
Для полинуклидного элемента атомный вес – это средний вес, основанный на долевом содержании каждого изотопа, и это значение, указанное в периодической таблице. Медь имеет два изотопа: 63 Cu (69,15%, масса = 62,9300 а.е.м.) и 65 Cu (30,85%, масса = 64,928 а.е.м.), поэтому соответствующие мольные доли составляют 0,6915 и 0,3085, что дает средний атомный вес 63,55 а.е.м., хотя нет ни одного атома с массой 63,55 а.е.м.
| \ [\ underbrace {0.{65} Cu} = \ underbrace {63,55 \, amu} _ {\ text {средняя масса}} \\ примечание: \; 0,6915 + 0,3085 = 1 \] |
Рисунок \ (\ PageIndex {1} \): Природные образцы меди содержат два изотопа, а его атомный вес с точностью до четырех значащих цифр составляет 63,55 а. е.м., хотя нет ни одного атома меди с массой 63,55 а.е.м. .
е.м., хотя нет ни одного атома меди с массой 63,55 а.е.м. .
Упражнение \ (\ PageIndex {1} \)
Атомный вес хлора ______________, атомный номер хлора-35 ________________.
- 35, 17
- 17, 35
- 35,4527; 17
- 35,4527; 35
- Ответ
C) атомный вес представляет собой среднее значение массы всех изотопов атомов хлора и находится под символом в периодической таблице. Атомный номер – это количество протонов во всех атомах хлора, он находится в верхней части символа в периодической таблице.
Мононуклидные элементы
Есть 21 элемент из природных образцов, которые имеют только одно ядро и, таким образом, классифицируются как мононуклидные.Девятнадцать из них стабильны, а два радиоактивны (Bi и Th). Термин моноизотопный относится к наличию только одного стабильного ядра, из которых 26, девятнадцать из которых являются мононуклидными, но семь из моноизотопных элементов также имеют радиоактивные изотопы и поэтому являются не мононуклидными, а полинуклидными.
Для мононуклидного элемента атомный вес – это вес его изотопа. Натрий – стабильный мононуклидный элемент, состоящий всего из одного изотопа, 23 Na.
Рисунок \ (\ PageIndex {1} \): Натрий имеет только один изотоп, и обратите внимание, неопределенность этого значения выражается (2) в 22.{230} Th \)).
Полинуклидные элементы
Подавляющее большинство элементов являются полинуклидными, то есть образец содержит смесь ядер из разных изотопов. Для некоторых образцов доля каждого изотопа постоянна, в то время как для других itf варьируется между образцами. Итак, есть два типа полинуклидных элементов: с инвариантным изотопным распределением и с переменным изотопным распределением.
Постоянные изотопные распределения
Например, медь имеет два стабильных изотопа и составляет примерно 69% 63 Cu и 31% 65 Cu по количеству (не по массе). Это соотношение является постоянным от образца к образцу и поэтому является неизменным. Атомный вес меди основан на этом изотропном распределении и составляет 63,546 а.е.м., хотя нет ни одного атома меди, который весит 63,546 а.е.м. (69% из них весят 63 а.е.м., а 31% – 65).
Это соотношение является постоянным от образца к образцу и поэтому является неизменным. Атомный вес меди основан на этом изотропном распределении и составляет 63,546 а.е.м., хотя нет ни одного атома меди, который весит 63,546 а.е.м. (69% из них весят 63 а.е.м., а 31% – 65).
Рисунок \ (\ PageIndex {3} \): Медь имеет два стабильных изотопа, как показано на круговой диаграмме. Адаптировано из Технического отчета IUPAC 2018 – IPTEI for Education Community, (cc.4.0), стр. 1901.
Свинец содержит 4 стабильных изотопа, как показано на рисунке. Свинец – довольно крупный элемент и имеет много радиоизотопов, на самом деле в нем 29 изотопов с периодом полураспада менее одного часа, семь изотопов с периодом полураспада от часа до года и два с периодом полураспада более года ( 202 Pb = 5,25 x10 4 лет & 210 Pb = 22,3 года), но они незначительны для тысячной позиции (обратите внимание, что четыре мольных доли добавляют к единице).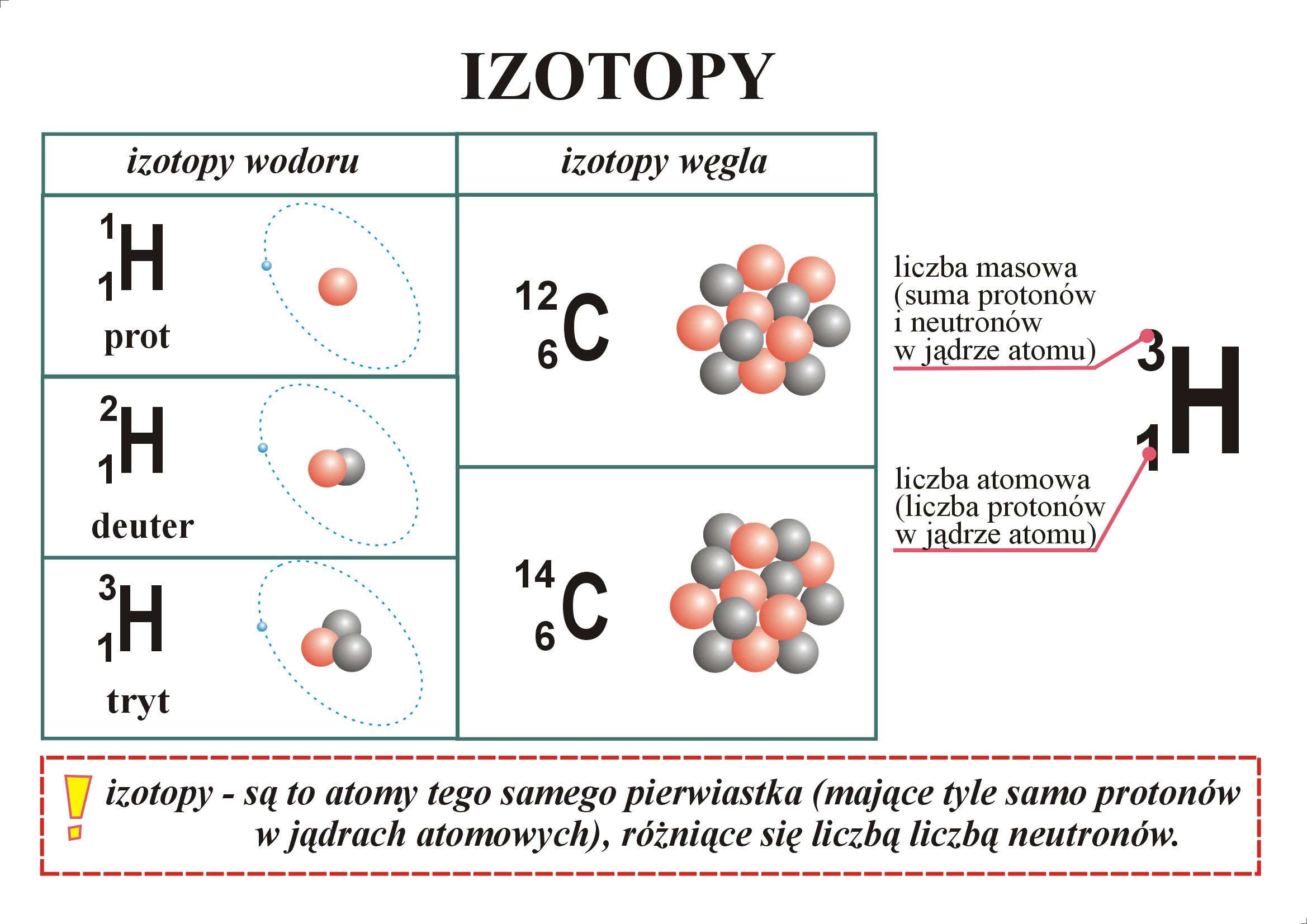
Рисунок \ (\ PageIndex {4} \): У свинца 4 стабильных изотопа.Адаптировано из Технического отчета IUPAC за 2018 г. – IPTEI для образовательного сообщества, (cc. 4.0), стр. 2007.
Переменные изотопные распределения
До недавнего времени считалось, что изотопный состав элемента постоянен, но теперь стало понятно, что он может варьироваться в зависимости от образца. На сегодняшний день определены следующие 13 элементов, которые имеют ряд изотопных распределений; водород, литий, бор, углерод, азот, кислород, магний, кремний, сера, хлор, аргон, бром и таллий.В 2009 году Комиссия ИЮПАК по изотопному содержанию и атомным весам ввела обозначение интервалов для атомных весов, которые выражали естественную изменчивость изотопного состава элементов.
Водород состоит из двух изотопов: протия ( 1 H, один протон) и дейтерия ( 2 H, протона и нейтрона). {3} H \) (тритий), который встречается очень редко и имеет настолько малую мольную долю, что она ничтожна по сравнению с протием и дейтерием.
Рисунок \ (\ PageIndex {5} \): Изотопное распределение водорода может варьироваться от образца к образцу, поэтому ИЮПАК ввел обозначение интервалов. Адаптировано из Технического отчета IUPAC 2018 – IPTEI for Education Community, (cc. 4.0), p 1839.
Эти различия могут фактически проявиться в атомном весе водорода в речной воде, где, например, вода в горах будет иметь более высокую долю более тяжелого изотопа, и это имеет смысл, поскольку более тяжелый изотоп будет конденсироваться в дождь легче, чем легче, а вода на более низких высотах будет иметь больше легкого изотопа.Это можно увидеть на рисунке 2.3.6.
Рисунок \ (\ PageIndex {6} \): на этой карте показана дисперсия изотопного распределения водорода в различных образцах воды на территории США. {209} _ {83} Bi \)) радиоактивны.{3} H \) (тритий).Измерение изотопного содержания
Масс-спектрометр – это прибор, который позволяет нам измерять массу атомов или, точнее, отношение массы к заряду. На рисунке 2.3.8 вы можете увидеть газообразный хлор, поступающий в масс-спектрометр. Хлор имеет несколько изотопов и подвергается ударам потоком ионизирующих электронов, которые разрывают связь Cl 2 и отрывают электроны от атомов хлора, вызывая одноатомные ионы. Затем они ускоряются вниз по камере, пока не достигнут магнитного поля, которое отклоняет частицы.Угол отклонения зависит как от массы частицы, так и от напряженности магнитного поля, при этом более легкие частицы отклоняются сильнее при постоянной напряженности магнитного поля ( более легкие ионы 35 Cl + отклоняются сильнее, чем более тяжелые 37 Cl + ion .) В конце камеры находится выходное отверстие с детектором, и по мере увеличения напряженности магнитного поля изменяется угол отклонения, который разделяет частицы. Обратите внимание на масс-спектр на рисунке 2.3.8 (b) дает относительное содержание каждого изотопа, с пиком, нормированным на изотоп с наибольшим содержанием. Таким образом, если это соотношение составляет 3: 1, это означает, что на каждую частицу 37 Cl приходится 3 частицы 35 Cl, и относительное содержание будет 0,75 для 35 Cl и 0,25 для 37 Cl.
Рисунок \ (\ PageIndex {8} \): Определение относительных атомных масс с помощью масс-спектрометра. Изображение использовано с разрешением (CC BY-SA-NC; анонимно по запросу).Ниже видео с YouTube, описывающее масс-спектрометр
. Видео \ (\ PageIndex {1} \): 2:43 YouTube загружено Evagating о том, как работает масс-спектрометр.Вот гистограмма, показывающая относительное содержание 4 изотопов стронция
Рисунок \ (\ PageIndex {9} \): гистограмма, показывающая относительное процентное содержание изотопов для четырех изотопов стронция.Масс-спектр стронция имеет четыре различных пика, различающихся по интенсивности. Четыре пика указывают на то, что существует четыре изотопа стронция.{88} Sr \) – изотоп, который встречается в самых больших количествах.
Упражнение \ (\ PageIndex {2} \)
Азот имеет два изотопа, первый изотоп имеет массу 14,004 а.е.м., а второй изотоп имеет массу 15000 а.е.м., какой изотоп имеет наибольшее естественное изобилие? Совет, вам нужно посмотреть на таблицу Менделеева.- 14 N
- 15 №
- Есть равные суммы.
- Недостаточно информации.
- ничего из вышеперечисленного
- Ответ
А) Средний атомный вес 14.007 а.е.м., что намного ближе к 14, чем к 15, поэтому 14 является наиболее распространенным изотопом. В следующем разделе вы будете использовать данные такого рода для расчета фракционной численности.
Расчет изотопного содержания
Для элементов с более чем одним изотопом существует множество проблем, которые необходимо решить. {n} X_im_i = m_ {ave} \]
Обратите внимание, что уравнение для двух изотопов имеет 5 неизвестных, и вы можете получить m ave из периодической таблицы, поэтому вам нужно указать три другие переменные для решения уравнения (одно уравнение может быть решено только для одного неизвестного ).{n} X_i = 1 \]
В следующей задаче смотрим
, вам не только нужно уметь вычислять среднюю атомную массу, но также необходимо использовать среднюю массу в периодической таблице, чтобы работать в обратном направлении и вычислять проценты
Пример \ (\ PageIndex {1} \): расчет средней атомной массы
Какова средняя атомная масса Неона, учитывая, что он имеет 3 изотопа со следующими процентными содержаниями;
20 Ne = 19,992 а.е.м. (90,51%), 21 Ne = 20.993 а.е.м. (0,27%), 22 Ne = 21,991 а.е.м.
Что мы знаем: , так как вы знаете, что это за элемент, вы можете решить это, не выполняя никаких математических вычислений, используя периодическую таблицу, но вам нужно уметь делать математику, потому что это может быть неизвестно, и что это единственный способ вычислить правильные значащие цифры.
Поскольку Ne-20 имеет наибольшее процентное содержание, он должен иметь наибольшее влияние на ваше среднее значение. Таким образом, мы ожидаем, что средняя атомная масса будет ближе к массе Ne-20 (около 19.992 а.е.м.). Нажмите на следующий видеоурок, чтобы узнать, правильно ли мы оценили.
Видео \ (\ PageIndex {2} \): 4:53 мин. YouTube решает вышеуказанную проблему.Ответ Согласно правильному количеству значащих цифр, мы получили 20,18 а.е.м. как средний атомный вес, хотя средний атомный вес из периодической таблицы составляет 20,179 а.е.м. Однако это по-прежнему хорошая проверка, чтобы убедиться, что вы на правильном пути.
Проверьте себя: Ранее мы предсказывали, что наш ответ должен быть ближе к массе Ne-20 (19.992 а.е.м.) вместо Ne-21 или Ne-22, потому что он имеет наибольшее естественное изобилие и, таким образом, больше влияет на среднее значение. Мы видим, что математика соответствует нашей логике!
Пример \ (\ PageIndex {1} \): расчет изотопной массы
Хлор имеет два изотопа, 75,53% – это 35 Cl с изотопной массой 34,969 а.е.м., какова масса другого изотопа?
Что мы знаем : В данном случае у вас есть средняя атомная масса (из периодической таблицы).Вы пытаетесь найти массу отдельного изотопа. Вы также знаете, что отдельные изотопы должны составлять до 100%.
Ответ: Правильный ответ – 36,9 а.е.м.
После просмотра следующих двух YouTube вам следует выполнить следующие рабочие листы, которые были разработаны как классные задания для подготовительного курса, и поэтому дать больше пошаговых инструкций, чем мы используем. Вы захотите обойти многие «шаги» в раздаточных материалах, поскольку они были разработаны для подготовительного класса по химии 1300, который потратил больше времени на этот материал.Также обратите внимание, что раздаточные материалы размещены в виде файлов PDF, и вы можете использовать систему аннотаций hypothes.is, чтобы комментировать их, и если вы пометите их тегом f19c1402c2 , они появятся в оглавлении этой главы.
Таблицы содержания изотопов :
Рабочий лист изотопного состава
Ключ к Таблице содержания изотопов
Авторы и авторство
Роберт Э.Белфорд (Арканзасский университет Литл-Рока; факультет химии). За широту, глубину и достоверность этой работы отвечает Роберт Э. Белфорд, [email protected]. Вам следует связаться с ним, если у вас возникнут какие-либо вопросы. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
- Аноним
- Рония Каттум и Ноябрь Палмер (Украина, Литл-Рок)
- Елена Лисицына (интерактивные модули H5P)
Какой пример практической проблемы с изотопами?
Изотопы – это атомы одного и того же элемента, имеющие разные массовые числа.Массовое число изотопа – это сумма протонов и нейтронов в его ядре. Каждый элемент имеет свой уникальный атомный номер, который представляет собой количество протонов в его атомных ядрах, поэтому количество протонов во всех изотопах данного элемента одинаково. Однако количество нейтронов может варьироваться, и это является причиной разных массовых чисел для разных изотопов одного и того же элемента.
Существуют специальные символы, которые представляют массовое число, атомный номер и количество нейтронов: X представляет символ элемента, Z представляет атомный номер (количество протонов), A представляет массовое число, а N представляет нейтроны.
Есть несколько уравнений, связанных с изотопами:
1) A = Z + N
2) N = A – Z
3) Z = A – N
Изотопы названы по их массовым числам. Например, углерод имеет три встречающихся в природе изотопа; углерод-12, углерод-13 и углерод-14. Число после дефиса – массовое число. Имея эту информацию, мы можем определить количество протонов (атомный номер) и количество нейтронов.
Практическая задача
Изотоп имеет массовое число A = 11.Число нейтронов N = 6. Определите атомный номер и назовите изотоп.
Ответ: Z = A – N = 11 – 6 = 5
Используя периодическую таблицу, мы видим, что элемент с атомным номером 5 является бором. изотоп – бор-11.Изотоп элемента состоит из 5 протонов и 5 нейтронов. Определите его атомный номер Z и массовое число A. Назовите изотоп.
.
Ответ: Z = 5 (потому что он имеет 5 протонов), N = 5, A = Z + N = 5 + 5 = 10
Используя периодическую таблицу, мы видим, что элемент с атомным номером 5 является бором.Название этого изотопа – бор-10Определите массовое число, атомный номер (число протонов) и число нейтронов для углерода-12, углерода-13 и углерода-14.
Ответ
3a) углерод-12
Ответ: A = 12, Z = 6 (из периодической таблицы), N =?
N = A – Z = 12 – 6 = 6
Атом изотопа углерода-12 имеет массовое число 12, атомный номер 6 и 6 нейтронов.
3b) углерод-13
Ответ: A = 13, Z = 6 (из периодической таблицы), N =?
N = A – Z = 13-6 = 7
Атом изотопа углерода-13 имеет массовое число 13, атомный номер 6 и 7 нейтронов.
3c) углерод-14
Ответ: A = 14, Z = 6 (из периодической таблицы), N =?
N = A – Z = 14 – 6 = 8
Атом изотопа углерода-14 имеет массовое число 14, атомный номер 6 и 8 нейтронов.
Изотопы часто записываются в ядерной или изотопной нотации. На следующей диаграмме показан способ записи изотопа в ядерной нотации.
На следующей схеме показано, как записать изотопы углерода, используя ядерную нотацию.1 “H” #
Ответ: массовое число, A = 1, атомный номер, Z = 1, число нейтронов, N = 1 – 1 = 0. Название этого изотопа – водород-1.
Изотопы – Химический колледж
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса – изображению, ссылке, тексту и т. д. – относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; а также Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Часто задаваемые вопросы | Комиссия по изотопному содержанию и атомному весу
1. Зачем нам нужно столько цифр в атомных весах?
2.Являются ли атомные веса постоянными в природе?
3. Почему у некоторых элементов нет стандартного атомного веса?
4. Атомный вес или атомная масса?
5. Почему нет единиц для атомного веса?
6. Какое изменение атомной массы было самым большим?
7. Каковы текущие значения атомной массы?
1. Зачем нам нужно столько цифр в атомных весах?
Точные значения атомных весов занимают важное место в науке.Нобелевская премия по химии 1914 года была присуждена Теодору У. Ричардсу за «его работу по точному определению атомного веса многих элементов», и это признало необходимость точного атомного веса элементов.
В начало
2. Являются ли атомные веса постоянными в природе?
Да, но только для тех элементов, стандартный атомный вес которых определяется только одним изотопом (таких элементов девятнадцать).
Для всех элементов с более чем одним изотопом их атомный вес зависит от относительных количеств изотопов, которые могут значительно различаться по природе.
В начало
3. Почему у некоторых элементов нет стандартного атомного веса?
Многие элементы не имеют стабильных изотопов и не имеют характерного земного изотопного состава. Для этих элементов не существует стандартного атомного веса.
Вернуться к началу
4. Атомный вес или атомная масса?
Название атомная масса относится к массе одного атома .
Напротив, название атомная масса относится к средневзвешенной массе всех атомов элемента с учетом количества каждого изотопа.Кроме того, атомный вес определяется как отношение средних масс всех изотопов к атомной единице массы (1/12 массы атома углерода-12).
Вернуться к началу
5. Почему нет единиц для атомного веса ?
Поскольку атомная масса определяется как отношение двух связанных с массой величин – это отношение средней атомной массы элемента к 1/12 массы атома углерода-12.
Пока обе эти массы измеряются в одной шкале, результирующее соотношение не зависит от используемой единицы массы.
В начало
6. Какое изменение атомной массы было самым большим?
Начиная с 1951 года CIAAW рекомендует атомные веса с соответствующей неопределенностью. С тех пор только один раз рекомендуемое значение атомного веса было вынесено за пределы неопределенности предыдущей рекомендации.
Это произошло в 2007 году, когда стандартный атомный вес цинка был изменен с 65,409 ± 0,004 до 65,38 ± 0,02.
Исторически самое большое изменение значения атомной массы CIAAW произошло в 1909 году, когда атомный вес недавно открытого ксенона был изменен на 130.7 из 128.0.
В начало
7. Каковы текущие значения атомного веса?
Текущие значения стандартных атомных весов и изотопных составов элементов были приняты CIAAW в 2020 году.
Последний отчет по стандартным атомным весам был опубликован в Pure Appl. Chem. 88 265-291 (2016),
изменения содержания иттербия в 2015 г. были объявлены ИЮПАК в документе Chem. Intl. 37 (5-6) , 26 (2015),
изменения 2017 г. были объявлены ИЮПАК в пресс-релизе (июнь 2018 г.),
поправки 2019 г. были объявлены ИЮПАК в пресс-релизе (декабрь 2019 г.), и
изменения 2020 г. были объявлены IUPAC в пресс-релизе (май 2021 г.).
Изотопные составы элементов опубликованы в Pure Appl. Chem. 88 293-306 (2016).
Редакции 2015 г. для иттербия и редакции 2017 г. для аргона, иридия и тантала не были официально опубликованы, но доступны на веб-сайте CIAAW.
В начало
Симпсоны , Лиза получает пятерку (FOX, 1998)
Эдна Крабаппель: Кто мне скажет атомный вес болониума?
Охотники за привидениями II (Columbia Pictures, 1989)
Доктор.Раймонд Стэнц: Думаете, есть связь между этим персонажем Виго и … слизью?
Д-р Эгон Шпенглер: Атомный вес кобальта равен 58,9?
вопросов по стехиометрии | Shmoop
Вопросы по стехиометрии
1. Медь имеет два стабильных изотопа: 63 29 Cu (атомная масса = 62,93 а.е.м .; 69,09% естественного содержания) и 65 29 Cu (атомная масса = 64,9278 а.е.м .; 30,91% естественное изобилие). Рассчитайте среднюю атомную массу меди.
2. Сколько атомов серы содержится в 25,1 г S?
3. Рассчитайте молекулярную массу (в а.е.м.) кофеина (C 8 H 10 N 4 O 2 ).
4. Сколько атомов водорода содержится в 43,8 г мочевины [(NH 2 ) 2 CO]?
5. Фосфорная кислота – H 3 PO 4 . Рассчитайте массовый процентный состав H, P и O в этом соединении.
6. Уравновесите следующее уравнение с наименьшими целочисленными коэффициентами:
Al + O 2 → Al 2 O 3
7.Рассмотрим реакцию: C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O. Если 968 г C 6 H 12 O 6 , какова масса произведенного CO 2 ?
8. Рассмотрим следующую реакцию: 2 Li + 2 H 2 O → 2 LiOH + H 2 . Сколько граммов Li необходимо для производства 7,79 г H 2 ?
9. Рассмотрим следующее уравнение: 2 NH 3 + CO 2 → (NH 2 ) 2 CO + H 2 O.Если 849,2 г NH 3 обработать 1223 г CO 2 , сколько (NH 2 ) 2 CO образуется?
10. Рассмотрим следующую реакцию: C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O. Сколько граммов кислорода необходимо для получения 550 граммов CO 2 ?
Возможные ответы
1. Медь имеет два стабильных изотопа 63 29 Cu (атомная масса = 62.93 а.е.м .; 69,09% естественного содержания) и 65 29 Cu (атомная масса = 64,9278 а.е.м .; 30,91% естественного содержания). Рассчитайте среднюю атомную массу меди.
Каждый изотоп вносит вклад в среднюю атомную массу, основанную на его относительной распространенности. Умножение массы изотопа на его относительное содержание даст вклад в среднюю атомную массу этого изотопа.
(0,6909) (62,93 а.е.м.) + (0,3091) (64,9278 а.е.м.) = 63,55 а.е.м.
2.Сколько атомов серы в 25,1 г S?
Нам нужно два преобразования: сначала из граммов в моль, а затем из молей в число частиц (атомов).
Коэффициент преобразования:
Число Авогадро также является ключевым:
1 моль = 6,023 × 10 23 частиц (атомов)
Для решения нам необходимо:
грамма S → моль S → количество атомов S
3. Рассчитайте молекулярную массу (в а.е.м.) кофеина (C 8 H 10 N 4 O 2 ).
Чтобы вычислить молекулярную массу, нам нужно просуммировать все атомные массы в молекуле. Для каждого элемента мы умножаем атомную массу элемента на количество атомов этого элемента в молекуле. Мы можем найти атомные массы в периодической таблице.
В кофеине восемь атомов C, десять атомов H, четыре атома N и два атома O, поэтому молекулярная масса определяется как:
8 (12,01 а.е.м.) + 10 (1,008 а.е.м.) + 4 (14,01 а.е.м.) + 2 (16,00 а.е.м.) = 194,20 а.е.м.
4.Сколько атомов водорода содержится в 43,8 г мочевины [(NH 2 ) 2 CO]?
Сначала нам нужно рассчитать молярную массу мочевины: 60,06 г
грамма мочевины → моль мочевины → моль H → атомы H
5. Фосфорная кислота – H 3 PO 4 . Рассчитайте массовый процентный состав H, P и O в этом соединении.
Предположим, у вас есть 1 моль H 3 PO 4 .Массовый процент каждого элемента определяется как объединенная молярная масса атомов элемента в 1 моль H 3 PO 4 , деленная на молярную массу H 3 PO 4 , затем умноженную на 100 процентов.
Молярная масса H 3 PO 4 составляет 97,99 г. Это означает, что массовый процент каждого из элементов равен:
6. Уравновесите следующее уравнение с наименьшими целочисленными коэффициентами:
Al + O 2 → Al 2 O 3
| Элемент | До | После |
| Al | 1 | 2 |
| O | 2 | 3 |
Al +3 O 2 → 2 Al 2 O 3
| Элемент | До | После |
| Al | 1 | 4 |
| O | 6 | 6 |
4 Al +3 O 2 → 2 Al 2 O 3
| Элемент | До | После |
| Al | 4 | 4 |
| O | 6 | 6 |
7.Рассмотрим реакцию: C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O. Если 968 г C 6 H 12 O 6 , какова масса произведенного CO 2 ?
Убедитесь, что уравнение сбалансировано: выполнено.
8. Рассмотрим следующую реакцию: 2 Li + 2 H 2 O → 2 LiOH + H 2 . Сколько граммов Li необходимо для производства 7.79 г H 2 ?
граммов H 2 → молей H 2 → молей Li → граммов Li
9. Рассмотрим следующее уравнение: 2 NH 3 + CO 2 → (NH 2 ) 2 CO + H 2 О. Если 849,2 г NH 3 обработать 1223 г CO 2 , сколько (NH 2 ) 2 образуется CO?
Один из реагентов является ограничивающим, но мы не знаем, какой именно.Нам нужно провести два расчета. Расчет, который дает наименьшее количество продукта, является правильным ответом.
10. Рассмотрим следующую реакцию: C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O. Сколько граммов кислорода необходимы для производства 550 граммов CO 2 ?
Клавиша набора задач 3 – Чтение – Набор задач 03 – Atom Chem 105 2.23 – 2.26 1. (a) Заполните набор задач
03 – Атом
Chem 105
2.23 – 2.26
1. (a) Заполните недостающую информацию об атомах восьми нуклидов в следующих двух таблицах.
Число протонов
(атомный номер)
(b) Заполните недостающую информацию в следующих таблицах одноатомных ионов.
2. (a) В предложениях 1–3 дайте определение изотопу. Атомы одного и того же элемента, которые имеют одинаковое количество протонов
в своих ядрах, но разное количество нейтронов.
(b) 2.20 Объясните присущую избыточность символу нуклида X
𝑍
𝐴. И Z, и X описывают элемент
периодической таблицы Менделеева, поэтому необходим только один.
(c) Напишите символ самого распространенного изотопа натрия. Сколько нейтронов в нем?
Атомный вес натрия 22,9898 г / моль. Это число представляет собой средневзвешенное значение
молярных массразличных изотопов. Поскольку оно очень близко к 23, большинство атомов должно быть изотопа
с массой 23 г / моль.Символ этого изотопа – Na
11
23. В нем 12 нейтронов.
3. Гелиевый шарик, который вы получили на свой день рождения, почти полностью спустился, но внутри все еще остается очень небольшое количество 4He
общей массой 160 а.е.м. Сколько протонов и
электронов присутствует в воздушном шаре (при условии, что там только 4He)?
160 𝑎𝑚𝑢 × 1,66053892 × 10−24 г
1 𝑎𝑚𝑢 × 1 𝑚𝑜𝑙 He
4𝑔 × 6.022 × 1023 𝑎𝑡𝑜𝑚𝑠
1 𝑚𝑜𝑙 𝐻𝑒 × 2 𝑝𝑟𝑜𝑡𝑜𝑛𝑠
1 𝑎𝑡𝑜𝑚 𝐻𝑒 = 80 𝑝𝑟𝑜𝑡𝑜𝑛𝑠.Этот атом
имеет равное количество протонов и электронов, поэтому также будет 80 электронов.
Или другой метод: 160 𝑎𝑚𝑢
𝑥 = 4 𝑎𝑚𝑢
1 𝐻𝑒 𝑎𝑡𝑜𝑚 x = 40 атомов He. Поскольку 2 протона на He, присутствует 80 протонов и
80 электронов.
4. (a) Сколько нейтронов содержится в 10 г фтора-19, единственного стабильного изотопа фтора?
10𝑔 𝐹
9
19 × 1 моль
19 𝑔 𝐹 × 6.022 × 1023 𝑎𝑡𝑜𝑚𝑠
1 𝑚𝑜𝑙 × 10 𝑛𝑒𝑢𝑡𝑟𝑜𝑛𝑠
1 𝑎𝑡𝑜𝑚 𝐹
9
19 = 3 × 1024 𝑛𝑒𝑢𝑡𝑟𝑜𝑛𝑠
) Вычислите количество нейтронов, найденных в 2.13 мг неделящегося изотопа урана
с массовым числом 238.
Число протонов
(атомный номер)
Число протонов
(атомный номер)
Число протонов
( Атомный номер)
Учебное пособие по относительной атомной массе
Ключевые концепции
- Относительная атомная масса элемента также известна как относительный атомный вес элемента или атомный вес элемента.
- Относительная атомная масса часто обозначается сокращенно как r.a.m.
- Относительная атомная масса элемента (его атомный вес) указана в Периодической таблице.
- Относительная атомная масса элемента – это средневзвешенная масса изотопов в природном элементе относительно массы атома изотопа углерода-12, которая принята равной точно 12.
- Атомная единица массы (u) определяется как эквивалент массы 1 / 12 массы одного атома углерода-12.
1 u = 1,66 × 10 -27 кг
- Мы можем оценить относительную атомную массу (атомный вес) элемента E с встречающимися в природе изотопами a E, b E, c E и т. Д. И с соответствующими содержаниями A %. , B %, C % и т. Д.,
относительная атомная масса (r.am.) = ( А
100× a ) + ( B
100× б ) + ( С
100× в ) + и т. Д. - Учитывая относительную атомную массу (т.утра) элемента и предполагаемую массу каждого из его изотопов, мы можем затем оценить относительное содержание каждого изотопа:
let x = процентное содержание изотопа-а
и 100 – x = процентное содержание изотопа-b
тогда, пусть r.a.m = относительная атомная масса элемента:п.м. = ( x
100× масса изотопа-а) + ( 100 – x
100× масса изотопа-б) и решите для x
- Обратите внимание, что мы можем измерить массу каждого изотопа и его содержание с помощью масс-спектроскопии.
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Обилие изотопов природного происхождения
Большинство элементов встречаются в природе в виде смеси различных изотопов.
Элемент углерод, например, существует в природе как смесь различных изотопов: стабильных 1 атомов углерода-12 и углерода-13.
Если вы возьмете образец атомов углерода, например сажу из дымохода или кусок угля, вы обнаружите, что большинство атомов углерода являются изотопом углерода-12, и только некоторые из них будут изотопом углерода-13. изотоп.
Мы называем это количество каждого изотопа, содержащегося в природном элементе, его изобилием, или, если быть более точным, его изотопным изотопом.
Содержание изотопа углерода-12 в естественном массовом углероде составляет 98,90%, в то время как содержание изотопа углерода-13 в природе составляет 1,10%.
Это означает, что если вы возьмете кусок угля из природы, 98,90% углерода в угле будут атомами изотопа углерода-12, в то время как только 1,10% будут атомами изотопа углерода-13.
В таблице ниже приведены содержания изотопов для некоторых элементов на Земле:
| Элемент | Изотоп | Изобилие (%) | Элемент | Изотоп | Изобилие (%) |
|---|---|---|---|---|---|
| водород | 1 H | 99,99 | натрия | 23 Na | 100.00 |
| 2 H | 0,01 | магний | 24 мг | 78,90 | |
| гелий | 3 He | 0,0001 | 25 мг | 10,00 | |
| 4 He | 99.9999 | 26 мг | 11.10 | ||
| литий | 6 Li | 7,42 | алюминий | 27 Al | 100,00 |
| 7 Li | 92,58 | кремний | 28 Si | 92,23 | |
| бериллий | 9 Be | 100.00 | 29 Si | 4,67 | |
| бор | 10 B | 19.80 | 30 Si | 3,10 | |
| 11 В | 80,20 | фосфор | 31 п. | 100 | |
| углерод | 12 С | 98.90 | сера | 32 S | 95,02 |
| 13 К | 1,10 | 33 S | 0,75 | ||
| азот | 14 N | 99,63 | 34 S | 4,21 | |
| 15 N | 0.37 | 36 S | 0,02 | ||
| кислород | 16 O | 99,76 | хлор | 35 Класс | 75,77 |
| 17 O | 0,038 | 37 Класс | 24.23 | ||
| 18 O | 0,20 | аргон | 36 Ар | 0,34 | |
| фтор | 19 ф. | 100,00 | 38 Ар | 0,063 | |
| неон | 20 Ne | 90.60 | 40 Ар | 99,60 | |
| 21 Ne | 0,26 | ||||
| 22 Ne | 9,20 |
Вы можете найти более полный список изотопных содержаний внизу этой страницы.
Оценка изотопной массы
Относительная атомная масса атома углерода-12 определяется как 12,00
Относительная атомная масса атома углерода-13 оказалась в 1,08333 раза больше массы атома углерода-12, то есть 1,083 × 12 = 13,00.
Мы можем оценить массу любого изотопа элемента, его изотопную массу, используя его массовое число (A).
Массовое число (A) изотопа говорит нам, сколько протонов и нейтронов находится в ядре атома этого изотопа.
Нуклон – это термин, используемый для описания как протонов, так и нейтронов.
Итак, массовое число (A) сообщает нам количество нуклонов в ядре атома изотопа элемента.
Например:
- ядро атома изотопа углерода-12 содержит 12 нуклонов
- ядро атома изотопа углерода-13 содержит 13 нуклонов
Масса протона почти такая же, как масса нейтрона.
Масса протона составляет около 1 u (1 атомная единица массы), поэтому масса нейтрона также около 1 u.
Масса электрона настолько мала по сравнению с массой протона или нейтрона, что ею можно пренебречь при оценке массы изотопа элемента. 2
Мы можем оценить массу атома изотопа элемента, сложив массы его нуклонов: 3
изотопическая масса = количество нуклонов × масса нуклонаизотопная масса = количество нуклонов × 1 и
Например:
- изотопная масса атома углерода-12: 12
нуклонов× 1 ед. /нуклонов= 12 ед. - изотопная масса атома углерода-13: 13
нуклонов× 1 ед. /нуклонов= 13 ед.
Изотопные массы могут быть измерены с помощью масс-спектроскопии.Вы найдете обсуждение расчета относительной атомной массы (атомного веса) с использованием этих измеренных изотопных масс в учебном пособии по масс-спектроскопии.
Расчет относительной атомной массы (атомного веса) элемента
Относительная атомная масса элемента – это средневзвешенная масса изотопов в природном элементе относительно массы атома изотопа углерода-12, которая принята равной точно 12.
Что такое «средневзвешенное значение»?
Сначала давайте посмотрим, какой будет «средний вес» углерода:
масса изотопа углерода-12 12 и
Масса изотопа углерода-13 13 и
Итак, мы можем рассчитать среднюю массу (средний вес) углерода как:
| средний вес = | 12 + 13 2 | = 12.5 u |
Если мы посмотрим на атомный вес углерода в Периодической таблице, то обнаружим, что это 12,01 НЕ 12,5.
Это связано с тем, что большинство атомов углерода, встречающихся в природе, являются атомами изотопа углерода-12, в то время как очень немногие из атомов относятся к изотопу углерода-13.
Нам необходимо учитывать это при вычислении нашего «среднего», и когда мы это делаем, мы называем результат «средневзвешенным».
Нам нужно знать количество каждого изотопа, то есть нам нужно знать, какая часть массы (веса) природного углерода в объеме приходится на каждый из изотопов (углерод-12 и углерод-13).
Из таблицы в разделе выше мы находим, что изотопное содержание углерода-12 составляет 98,90%, а изотопное содержание углерода-13 составляет 1,10%.
Это означает, что если бы у меня было 100 атомов углерода в объеме (например, в угле или сажи), то:
- 98,90% из 100 атомов углерода составляют атомы углерода-12 с массой 12 ед.
То есть 98,90 атомов углерода имеют массу 12 u - 1,10% из 100 атомов углерода составляют атомы углерода-13 с массой 13 ед.
То есть 1.10 атомов углерода имеют массу 13 ед.
Итак, общая масса 100 встречающихся в природе атомов углерода равна:
| общая масса из 100 атомов | = | Масса всех атомов углерода-12 | + | Масса всех атомов углерода-13 |
| = | 98.90 × 12 | + | 1,10 × 13 | |
| = | 1186,8 | + | 14,3 | |
| = | 1201,1 |
Итак, масса 100 встречающихся в природе атомов углерода равна 1201.1 ты
Следовательно, «средневзвешенная масса» 1 атома углерода равна 1201,1 ÷ 100 = 12,011 ед.
Это значение атомной массы углерода согласуется со значением в Периодической таблице.
Обратите внимание, что это НЕ означает, что масса 1 атома углерода равна 12,011 ед.
Это ДЕЙСТВИТЕЛЬНО означает, что если мы возьмем образец встречающегося в природе углерода, мы обнаружим, что средняя масса атома углерода будет 12,011 ед.
Давайте рассмотрим, как мы вычисляли «средневзвешенную» массу объемных атомов углерода:
- содержание первого изотопа, умноженное на массу этого изотопа, заданную массовым числом
- содержание второго изотопа, умноженное на массу этого изотопа, заданную массовым числом
- сложите эти два значения вместе и разделите на 100
В общем, чтобы рассчитать «средневзвешенную» массу элемента, который встречается в природе в виде двух разных изотопов, изотопа 1 и изотопа 2, тогда:
| «средневзвешенная» масса элемента | = | (изотопное содержание 1 × массовый изотоп 1) + (изотопное содержание 2 × массовый изотоп 2) 100 |
Если мы оценим массу каждого изотопа, используя его массовое число (A), то мы можем переписать выражение как:
| «средневзвешенная» масса элемента | = | (изотоп содержания 1 × A (изотоп 1) ) + (изотоп содержания 2 × A (изотоп 2) ) 100 |
Или, другими словами:
| «средневзвешенная» масса элемента | = ( | % -ный изотоп 1 100 | × A (изотоп 1) ) | + ( | % изотопа 2 100 | × A (изотоп 2) ) |
Расчет изотопного содержания по атомному весу
Периодическая таблица дает нам средневзвешенное значение массы элемента, называемое атомным весом элемента (или относительной атомной массой).
Если мы знаем массу каждого изотопа, составляющего этот природный элемент (оцениваемую его массовым числом), то мы можем вычислить распространенность каждого изотопа в природе.
Выше мы написали общее математическое выражение (математическое уравнение) для расчета «средневзвешенной» массы, также известной как относительная атомная масса или атомный вес, элемента, которая была:
| «средневзвешенная» масса элемента | = | (изотоп содержания 1 × A (изотоп 1) ) + (изотоп содержания 2 × A (изотоп 2) ) 100 |
Допустим, я хотел найти содержание (%) каждого изотопа азота.
Азот содержит два природных стабильных изотопа: азот-14 и азот-15.
Итак, подставив их в математическое уравнение выше, я получу:
| «средневзвешенная» масса азота | = | (содержание азота-14 × A (азот-14) ) + (содержание азота-15 × A (азот-15) ) 100 |
Я могу найти атомный вес (относительную атомную массу или «средневзвешенную» массу) азота в Периодической таблице:
атомный вес азота 14.01
Я могу оценить массу атома каждого изотопа, используя его массовое число (A):
Масса атома азота-14 = его массовое число = 14 ед.
Масса атома азота-15 = его массовое число = 15 ед.
Я могу подставить эти значения в математическое уравнение выше:
| 14.01 | = | (содержание азота-14 × 14) + (содержание азота-15 × 15) 100 |
Я могу умножить обе части математического уравнения на 100:
| 100 × 14.01 | = | (содержание азота-14 × 14) + (содержание азота-15 × 15) |
| 1401 | = | (содержание азота-14 × 14) + (содержание азота-15 × 15) |
Но как я могу решить это уравнение, когда есть 2 неизвестных, содержание азота-14 неизвестно, а содержание азота-15 неизвестно.
Уловка состоит в том, чтобы помнить, что мы говорим о процентах изобилия! Что обозначает:
% содержание азота-14 +% содержание азота-15 = 100
Или, по-другому:
9000 2% содержание азота-14 = 100% содержание азота-15Итак, если я позволю процентному содержанию азота-14 быть равным x , тогда:
% содержание азота-14 = x
% содержание азота-15 = 100 – x
Если я подставлю их в математическое уравнение выше, у меня будет только одно неизвестное значение, x :
| 1401 | = | (содержание азота-14 × 14) | + | (содержание азота-15 × 15) |
| 1401 | = | ( х × 14) | + | ([100 – x ] × 15) |
Чтобы решить для x , сначала сниму скобки:
| 1401 | = | ( х × 14) | + | ([100 – x ] × 15) |
| 1401 | = | 14 х | + | (15 × 100) – 15 x |
| 1401 | = | 14 х | + | 1500-15 x |
Далее собираю похожие термины, начиная с x :
| 1401 | = | 14 х | + | 1500-15 x |
| 1401 | = | 14 x -15 x | + | 1500 |
| 1401 | = | – х | + | 1500 |
Затем вычтем 1500 из обеих частей уравнения:
| 1401 – 1500 | = | – х | + | |
| -99 | = | – х |
Обратите внимание, что содержание изотопа должно быть положительным числом (а не отрицательным числом), поэтому я делю обе части уравнения на -1, чтобы найти значение x :
| | = | | ||
| 99 | = | х |
Затем замените это значение на x обратно в выражения, которые мы написали для содержания каждого изотопа:
9000 2% содержание азота-14 = x = 99% 9000 2% содержание азота-15 = 100 – x = 100 – 99 = 1%В целом, если элемент встречается в природе в 2 изотопных формах, изотопе 1 и изотопе 2, то мы можем оценить процентное содержание каждого изотопа, используя массовое число (A) каждого изотопа, поскольку процентное содержание изотопа 2 равно 100. -% содержание изотопа 1:
| 100 × атомная масса элемента | = | (изотоп 1 × A (изотоп 1) ) + ([100 – изотоп 1] × A (изотоп 2) ) |
пусть изотоп 1 = x
| 100 × атомная масса элемента | = | ( x × A (изотоп 1) ) + ([100 – x ] × A (изотоп 2) ) |
| 100 × атомная масса элемента | = | x A (изотоп 1) + 100A (изотоп 2) – A (изотоп 2) x |
| (100 × атомный вес элемента) – (100 × A (изотоп 2) ) | = | x A (изотоп 1) – x A (изотоп 2) |
| 100 × (атомная масса элемента – A (изотоп 2) ) | = | x (A (изотоп 1) – A (изотоп 2) ) |
| 100 × (атомная масса элемента – A (изотоп 2) ) (A (изотоп 1) – A (изотоп 2) ) | = | х |
Итак,
- % изотопа 1 = x
- % изотопа 2 = 100 – x
Рабочий пример 1: Расчет атомного веса элемента
Вопрос: Серебро природного происхождения – 51.84% серебра-107 и 48,16% серебра-109.Рассчитайте атомный вес серебра.
Решение:
(на основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
Рассчитайте «средневзвешенную» массу (относительную атомную массу или атомный вес) серебра.
- Какие данные (информацию) вы указали в вопросе?
Извлеките данные из вопроса:
название изотопа массовое число (А) Изотопное содержание(%) серебро-107 107 51.84 серебро-109 109 48,16 - Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
(a) массу изотопа можно оценить, используя его массовое число (A), выраженное в атомных единицах массы, u
(б)
«средневзвешенная»
масса серебра= ( % содержание серебра-107
100× А (серебристый-107) ) + ( % обилие серебра-109
100× А (серебристый-109) ) - Подставляем значения и решаем:
«средневзвешенная»
масса серебра= ( 51.84
100× 107) + ( 48,16
100× 109) = 55,469 + 52,494 = 107,96 - Правдоподобен ли ваш ответ?
Сделайте приблизительный расчет:
Поскольку около половины (& приблизительно; 50%) атомов серебра составляют серебро-107, а другая половина (& приблизительно; 50%) – серебро-109, средневзвешенная масса серебра будет находиться примерно посередине между массой серебро-107 (107) и серебро-109 (109):
атомный вес & ок. ½ × (107 + 109) = 108
Поскольку наше расчетное значение 107.96 близко к 108, мы достаточно уверены, что наш ответ правильный.
Вы также можете посмотреть атомный вес серебра в периодической таблице и узнать, что он равен 107,9.
Поскольку наше вычисленное значение 107,96 примерно такое же, как значение в периодической таблице, мы достаточно уверены, что наш ответ правдоподобен. - Изложите свое решение задачи «атомный вес серебра»:
атомный вес серебра 107.96 u
Рабочий пример 2: Расчет изотопного содержания элемента
Вопрос: Медь состоит из двух изотопов: меди-63 и меди-65.
Его атомный вес (относительная атомная масса) равен 63,62 ед.Найдите процентное содержание каждого изотопа.
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что вас просят сделать?
(a) Рассчитайте процентное содержание меди-63
(b) Рассчитайте процентное содержание меди-65
- Какие данные (информацию) вы указали в вопросе?
Извлеките данные из вопроса:
название изотопа массовое число (А) приблизительная масса изотопа (u) медь-63 63 63 медь-65 65 65 атомный вес меди = 63.62 u
- Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить?
(а)
«средневзвешенная»
масса меди= ( % содержание меди-63
100× А (медь-63) ) + ( % содержание меди-65
100× А (медь-65) ) (б) пусть% содержания меди-63 = x
и% содержания меди-65 = 100 – x - Подставьте значения в уравнение и решите:
(а)
63.62 = ( x
100× 63) + ( 100 – x
100× 65) 63,62 = 63 x
100+ (65 × 100) – 65 x
10063.62 = 63 x
100+ 6500-65 x
10063,62 = 63 x + 6500-65 x
100100 × 63.62 = 100 ×63 x + 6500-65 x
1006362 = 63 x + 6500-65 x 6362 = -2 x + 6500 6362-6500 = -2 х -138 = -2 х -138
-2= -2 x
-269 = х (b)% содержание меди-63 = x = 69%
% содержание меди-65 = 100 – x = 100 – 69 = 31% - Правдоподобен ли ваш ответ?
Атомный вес меди равен 63.62.
Поскольку этот вес ближе к массе изотопов меди-63, чем к массе изотопов меди-65, мы знаем, что медь-63 должна быть более распространенной (более 50%).
Наше рассчитанное значение содержания меди-63 составляет 69%, что превышает 50%, поэтому мы достаточно уверены, что наш ответ правдоподобен.
Обратите внимание, что процентное содержание обоих изотопов должно составлять в сумме 100%.
69% + 31% = 100%
Итак, мы достаточно уверены, что наши расчетные значения содержания каждого изотопа правдоподобны. - Изложите свое решение проблемы «содержание каждого изотопа меди»:
содержание меди-63 = 69%
содержание меди-65 = 31%
Сноски
1. Стабильный изотоп – это изотоп, который не подвергается радиоактивному распаду (ядерному распаду).
Нестабильный изотоп – это изотоп, который действительно подвергается радиоактивному распаду, и поэтому количество встречающегося в природе нестабильного изотопа со временем будет уменьшаться….
Изотопное содержание может меняться со временем, если радиоактивный изотоп распадается с образованием стабильного изотопа другого элемента, то изотопное содержание этого стабильного изотопа со временем будет увеличиваться.
Искусственные ядерные реакции также изменят изотопное содержание.
В учебнике по датированию углерода-14 обсуждается изменение содержания изотопов.
2. Масса протона = 1,673 × 10 -27 кг = 1,01 ед.
Масса нейтрона = 1.675 × 10 -27 кг = 1,01 ед.
Масса электрона = 9,109 × 10 -31 кг = 0,000549 ед.
3. Фактически, мы оцениваем массу ядра, а не атома (поскольку мы игнорируем массу электронов, которые вносят очень небольшой вклад в массу атома).
Когда мы измеряем массу ядра, мы обнаруживаем, что наблюдаемая масса меньше суммы масс всех нуклонов.
Это называется дефектом массы.
Данные по изотопному содержанию
| Элемент | Изотоп | Изобилие (%) |
|---|---|---|
| водород | 1 H | 99.99 |
| 2 H | 0,01 | |
| гелий | 3 He | 0,0001 |
| 4 He | 99.9999 | |
| литий | 6 Li | 7,42 |
| 7 Li | 92.58 | |
| бериллий | 9 Be | 100,00 |
| бор | 10 B | 19.80 |
| 11 В | 80,20 | |
| углерод | 12 С | 98.90 |
| 13 К | 1,10 | |
| азот | 14 N | 99,63 |
| 15 N | 0,37 | |
| кислород | 16 O | 99,76 |
| 17 O | 0.038 | |
| 18 O | 0,20 | |
| фтор | 19 ф. | 100,00 |
| неон | 20 Ne | 90,60 |
| 21 Ne | 0.26 | |
| 22 Ne | 9,20 | |
| натрий | 23 Na | 100 |
| магний | 24 мг | 78,90 |
| 25 мг | 10.00 | |
| 26 мг | 11,10 | |
| алюминий | 27 Al | 100 |
| кремний | 28 Si | 92,23 |
| 29 Si | 4,67 | |
| 30 Si | 3.10 | |
| фосфор | 31 п. | 100 |
| сера | 32 S | 95,02 |
| 33 S | 0,75 | |
| 34 S | 4,21 | |
| 36 S | 0.02 | |
| хлор | 35 Класс | 75,77 |
| 37 Класс | 24,23 | |
| аргон | 36 Ар | 0,34 |
| 38 Ар | 0,063 | |
| 40 Ар | 99.60 | |
| калий | 39 К | 93,20 |
| 40 К | 0,012 | |
| 41 К | 6,73 | |
| кальций | 40 Ca | 96,95 |
| 42 Ca | 0.65 | |
| 43 Ca | 0,14 | |
| 44 Ca | 2,086 | |
| 46 Ca | 0,004 | |
| 48 Ca | 0,19 | |
| скандий | 45 SC | 100 |
| титан | 46 Ti | 8.00 |
| 47 Ti | 7,30 | |
| 48 Ti | 73,80 | |
| 49 Ti | 5,50 | |
| 50 Ti | 5,40 | |
| ванадий | 50 В | 0,25 |
| 51 В | 99.75 | |
| хром | 50 Кр | 4,35 |
| 52 Кр | 83,79 | |
| 53 Cr | 9,50 | |
| 54 Кр | 2,36 | |
| марганец | 55 Мн | 100 |
| утюг | 54 Fe | 5.80 |
| 56 Fe | 91,72 | |
| 57 Fe | 2,20 | |
| 58 Fe | 0,28 | |
| кобальт | 59 Co | 100 |
| никель | 58 Ni | 68.27 |
| 60 Ni | 26,10 | |
| 61 Ni | 1,13 | |
| 62 Ni | 3,59 | |
| 64 Ni | 0,91 | |
| медь | 63 Cu | 69,17 |
| 65 Cu | 30.83 | |
| цинк | 64 Zn | 48,60 |
| 66 Zn | 27,90 | |
| 67 Zn | 4,10 | |
| 68 Zn | 18,80 | |
| 70 Zn | 0.60 | |
| галлий | 69 Ga | 60.10 |
| 71 Ga | 39,90 | |
| германий | 70 Ge | 20,50 |
| 72 Ge | 27,40 | |
| 73 Ge | 7,80 | |
| 74 Ge | 36,50 | |
| 76 Ge | 7.80 | |
| мышьяк | 75 Как | 100 |
| селен | 74 SE | 0,90 |
| 76 SE | 9,00 | |
| 77 SE | 7.60 | |
| 78 SE | 23.50 | |
| 80 SE | 49,60 | |
| 82 SE | 9,40 | |
| бром | 79 руб. | 50,69 |
| 81 Br | 49,31 | |
| криптон | 78 Kr | 0.35 |
| 80 Kr | 2,25 | |
| 82 Kr | 11,60 | |
| 83 Kr | 11,50 | |
| 84 Kr | 57,00 | |
| 86 кр. | 17,30 | |
| рубидий | 85 руб | 72.17 |
| 87 руб. | 27,84 | |
| стронций | 84 Sr | 0,56 |
| 86 Sr | 9,86 | |
| 87 Sr | 7,00 | |
| 88 Sr | 82,58 | |
| иттрий | 89 Y | 100 |
| цирконий | 90 Zr | 51.45 |
| 91 Zr | 11,27 | |
| 92 Zr | 17,17 | |
| 94 Zr | 17,33 | |
| 96 Zr | 2,78 | |
| ниобий | 93 Nb | 100 |
| молибден | 92 Пн | 14.84 |
| 94 Пн | 9,25 | |
| 95 Пн | 15,92 | |
| 96 Пн | 16,68 | |
| 97 Пн | 9,55 | |
| 98 Пн | 24,13 | |
| 100 Пн | 9.63 | |
| рутений | 96 Ру | 5,52 |
| 98 Ру | 1.88 | |
| 99 Ру | 12,70 | |
| 100 Ру | 12,60 | |
| 101 Ру | 17,00 | |
| 102 Ру | 31.60 | |
| 104 Ру | 18,70 | |
| родий | 103 Rh | 100 |
| палладий | 102 Pd | 1.02 |
| 104 Pd | 11,14 | |
| 105 Pd | 22.33 | |
| 106 Pd | 27,33 | |
| 108 Pd | 24,46 | |
| 110 Pd | 11,72 | |
| серебро | 107 Ag | 51,84 |
| 109 Ag | 48,16 | |
| кадмий | 106 КД | 1.25 |
| 108 КД | 0,89 | |
| 110 КД | 12,49 | |
| 111 КД | 12,80 | |
| 112 КД | 24,13 | |
| 113 КД | 12,22 | |
| 114 КД | 28.73 | |
| 116 КД | 7,49 | |
| индий | 113 дюйм | 4,30 |
| 115 дюйм | 95,70 | |
| банка | 112 Sn | 0,97 |
| 114 Sn | 0.65 | |
| 115 Sn | 0,36 | |
| 116 Sn | 14,70 | |
| 117 Sn | 7,70 | |
| 118 Sn | 24,30 | |
| 119 Sn | 8,60 | |
| 120 Sn | 32.40 | |
| 122 Sn | 4,60 | |
| 124 Sn | 5.60 | |
| сурьма | 121 Сб | 57,30 |
| 123 Сб. | 42,70 | |
| теллур | 120 Te | 0.096 |
| 122 Te | 2,60 | |
| 123 Te | 0,91 | |
| 124 Te | 4,82 | |
| 125 Te | 7,14 | |
| 126 Te | 18,95 | |
| 128 Te | 31.69 | |
| 130 Te | 33,80 | |
| йод | 127 I | 100 |
| ксенон | 124 Xe | 0,10 |
| 126 Xe | 0,09 | |
| 128 Xe | 1.91 | |
| 129 Xe | 26,40 | |
| 130 Xe | 4,10 | |
| 131 Xe | 21,20 | |
| 132 Xe | 26,90 | |
| 134 Xe | 10,40 | |
| 136 Xe | 8.90 | |
| цезий | 133 CS | 100 |
| барий | 130 Ba | 0,11 |
| 132 Ba | 0,10 | |
| 134 Ba | 2,42 | |
| 135 Ba | 6.59 | |
| 136 Ba | 7,85 | |
| 137 Ba | 11,23 | |
| 138 Ba | 71,70 | |
| лантан | 138 La | 0,09 |
| 139 Ла | 99,91 | |
| церий | 136 CE | 0.19 |
| 138 CE | 0,25 | |
| 140 CE | 88,48 | |
| 142 CE | 11,08 | |
| празеодим | 141 пр. | 100 |
| неодим | 142 Nd | 27.13 |
| 143 Nd | 12,18 | |
| 144 Nd | 23,80 | |
| 145 Nd | 8,30 | |
| 146 Nd | 17,19 | |
| 148 Nd | 5,76 | |
| 150 Nd | 5.64 | |
| самарий | 144 см | 3,10 |
| 147 см | 15,00 | |
| 148 см | 11,30 | |
| 149 См | 13,80 | |
| 150 см | 7,40 | |
| 152 Sm | 26.70 | |
| 154 см | 22,70 | |
| европий | 151 Eu | 47,80 |
| 153 Eu | 52,20 | |
| гадолиний | 152 Gd | 0,20 |
| 154 Gd | 2.18 | |
| 155 Gd | 14,80 | |
| 156 Gd | 20,47 | |
| 157 Gd | 15,65 | |
| 158 Gd | 24,84 | |
| 160 Gd | 21,86 | |
| тербий | 159 Тб | 100 |
| диспрозий | 156 Dy | 0.06 |
| 158 Dy | 0,10 | |
| 160 Dy | 2,34 | |
| 161 Dy | 18,90 | |
| 162 Dy | 25,50 | |
| 163 Dy | 24,90 | |
| 164 Dy | 28.20 | |
| гольмий | 165 Ho | 100 |
| эрбий | 162 Er | 0,14 |
| 164 Er | 1,61 | |
| 166 Er | 33,60 | |
| 167 Er | 22.95 | |
| 168 Er | 26,80 | |
| 170 Er | 14,90 | |
| тулий | 169 тм | 100 |
| иттербий | 168 Yb | 0,13 |
| 170 Yb | 3.05 | |
| 171 Yb | 14,30 | |
| 172 Yb | 21,90 | |
| 173 Yb | 16,12 | |
| 174 Yb | 31,80 | |
| 176 Yb | 12,70 | |
| лютеций | 175 Лю | 97.40 |
| 176 Лю | 2,60 | |
| гафний | 174 Hf | 0,16 |
| 176 Hf | 5,20 | |
| 177 Hf | 18,60 | |
| 178 Hf | 27,10 | |
| 179 Hf | 13.74 | |
| 180 Hf | 35,20 | |
| тантал | 180 Ta | 0,012 |
| 181 Ta | 99,99 | |
| вольфрам | 180 Вт | 0,013 |
| 182 Вт | 26.30 | |
| 183 Вт | 14,30 | |
| 184 Вт | 30,67 | |
| 186 Вт | 28,60 | |
| рений | 185 Re | 37,40 |
| 187 Re | 62,60 | |
| осмий | 184 Ос | 0.02 |
| 186 Ос | 1,58 | |
| 187 Ос | 1,60 | |
| 188 Ос | 13,30 | |
| 189 Ос | 16,10 | |
| 190 Ос | 26,40 | |
| 192 Ос | 41.00 | |
| иридий | 191 Ir | 37,30 |
| 193 Ir | 62,70 | |
| платина | 190 Pt | 0,01 |
| 192 Pt | 0,79 | |
| 194 Pt | 32.90 | |
| 195 Pt | 33,80 | |
| 196 Pt | 25,30 | |
| 198 Pt | 7,20 | |
| золото | 197 Au | 100 |
| ртуть | 196 рт. Ст. | 0.15 |
| 198 Hg | 10,10 | |
| 199 Hg | 17,00 | |
| 200 рт. Ст. | 23,10 | |
| 201 Hg | 13,20 | |
| 202 Hg | 29,65 | |
| 204 рт. Ст. | 6.80 | |
| таллий | 203 Tl | 29,52 |
| 205 Tl | 70,48 | |
| свинец | 204 Пб | 1,40 |
| 206 Pb | 24,10 | |
| 207 Pb | 22. |

 6 ∙ 10 -19
6 ∙ 10 -19