Задачи по ОХТ (онлайн) решения часть 2 –
Задача И-40 Монохлорирование бензола проводится при следующих условиях: F0 (C6H6) = 250 кмоль/ч, F0(Cl2) = 400 кмоль/ч, F(C6H5Cl) = 85 кмоль/ч. Рассчитать материальный баланс процесса и на его основе составить таблицу материального баланса.
C6H6 + Cl2 = C6H5Cl2 + HCl
Скачать решение задачи И-40 (цена 100р)
Задача И-41 Составить материальный баланс процесса малеинового ангидрида гетерогенно-каталитическом окислением бензола, протекающего при 700 К в соответствии со следующей схемой последовательно-параллельных реакций:
Определить селективность процесса в целевой продукт по бензолу, если выход целевого продукта х, процесс протекает при мольном потоке бензола, равном FA0=160кмоль/ч, начальном молярном соотношении O2:C6H6=21, до степени превращения бензола XА=93,5.
Скачать решение задачи И-41 (цена 100р)
Задача И-43 Производительность трубчатого четырехпоточного реактора 10 тонн пентена в час. Пентан поступает на пиролиз в смеси с водяным паром в мольном соотношении 5:1. Определить массовую скорость парогазовой смеси в трубах, если диаметр трубы змеевика 143 мм, а выход пентена 68 % в расчете на исходный пентан.
Скачать решение задачи И-43 (цена 100р)
Задача И-44 Рассчитать материальный и тепловой баланс трубчатой печи для конверсии природного газа. Состав природного газа, % объемные: CH4-97,8; C2H6-0,5; C3H8-0,2; C4H10-0,1; N2-1,4
-отношение пар-газ в исходной смеси 2,5;
-степень конверсии газа по углероду -67%;
Расчет ведем на 100 природного газа (при нормальных условиях).
Скачать решение задачи И-44 (цена 100р)
Задача И-45 Степень конверсии этилена в процессе его прямого окисления равна 45%; объем этилена, израсходованного в процессе, составляет 1800 м3. Определить селективность по этиленоксиду, если масса этиленоксида равна 690 кг.
Определить селективность по этиленоксиду, если масса этиленоксида равна 690 кг.
Скачать решение задачи И-45 (цена 100р)
Задача И-46 Определить массу 64 м3 кислорода при температуре 165 С и давлении 0,25 МПа.
Скачать решение задачи И-46 (цена 100р)
Задача И-47 Вычислите константы равновесия Kp и Kc газовой реакции
CO + Cl2 = COCl2
состав газовой смеси при равновесии был следующим (% по объему):
CO=2,4; Cl2 = 12,6; COCl2 = 85;
а общее давление смеси при 20 C составляло 1,033 Па. вычислите G.
Скачать решение задачи И-47 (цена 100р)
Задача И-48 Составить материальный баланс производства 3,8 тонн криолита, если процесс описывается следующим суммарным уравнением:
2Al(OH)3 + 12HF + 3Na2CO3 = 2Na3AlF6 + 3CO2 + 9H2O или
2Al(OH)3 + 12HF = 2Н3AlF6 + 6h3O
2Н3AlF6 + 3Na2CO3 = 2Na3AlF6 + 3CO2 + 3H2O
Плавиковая кислота применяется в виде 17% раствора фтористого водорода в воде. Соду берут с 8% недостачи от стехиометрического соотношения для обеспечения необходимой остаточной кислотности.
Соду берут с 8% недостачи от стехиометрического соотношения для обеспечения необходимой остаточной кислотности.
Скачать решение задачи И-48 (цена 100р)
Задача И-49 Вычислите начальные концентрации веществ в обратимой реакции
2CO + O2 = 2CO2
и константу равновесия, если равновесные концентрации составляют
[CO]=0,44моль/л, [O2]=0,12моль/л, [CO2]=0,18моль/л,
Скачать решение задачи И-49 (цена 100р)
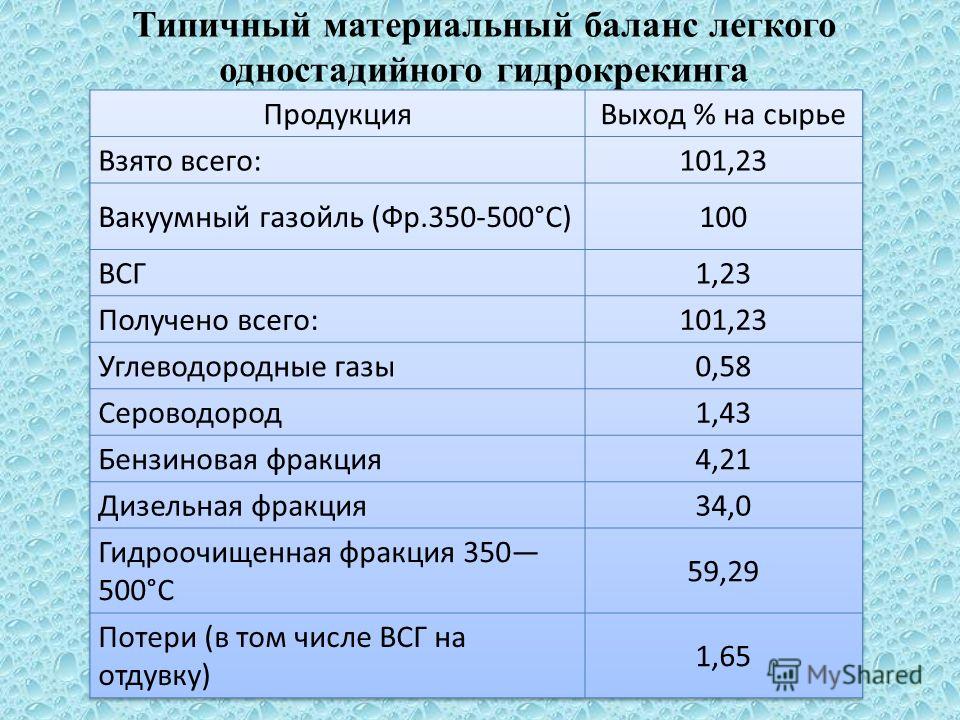
Задача И-50-1 Составить материальный баланс процесса гидродеалкилирования 1900кг толуола в бензол, протекающего в паровой фазе при температуре 1000К и давлении 5 МПа по следующей схеме последовательно-параллельных реакций:
если процесс идет при 6-кратном мольном избытке водорода до степени превращения толуола 81%, с селективностью в целевой продукт по толуолу 95%.
Скачать решение задачи И-50-1 (цена 100р)
Задача И-50 Составить материальный баланс процесса гидродеалкилирования 1500кг толуола в бензол, протекающего в паровой фазе при температуре 100К и давлении 5 МПа по следующей схеме последовательно-параллельных реакций:
если процесс идет при 5,2-кратном мольном избытке водорода до степени превращения толуола 80,7%, с селективностью в целевой продукт по толуолу 95%.
Скачать решение задачи И-50 (цена 100р)
Задача И-51 Рассчитать материальный баланс следующего процесса:
Основная реакция CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Побочная реакция 2C2H5OH = C2H5OC2H5 + H2O
Вариант 6
Производительность реактора П = 7600 т/год
число дней работы реактора в году, n = 300
Технологический выход продукта ,f = 900%
Мольное соотношение исходных реагентов, А:В = 1:7
Степень превращения, XA = 85%
Селективность основной реакции, Ф = 96%
Состав исходного реагента А,% масс.
C2H5OH = 96
H2O (примесь) = 4
Состав исходного реагента В,% масс.
Ch4COOH = 99
HCOOH = 1
Скачать решение задачи И-51 (цена 100р)
Задача И-52 Константа равновесия реакции
C2H6 = C2H4 + H2
при температуре 1100 К равна Кр = 1,67*10 Па. Энтальпия реакции -144451,4 Дж/моль. Определите равновесную степень превращения этана при температуре 1000 К и давлении р= 1,01*105 Па.
Энтальпия реакции -144451,4 Дж/моль. Определите равновесную степень превращения этана при температуре 1000 К и давлении р= 1,01*105 Па.
Скачать решение задачи И-52 (цена 100р)
Задача И-53 Рассчитать материальный баланс производства хлора методом электролиза водного раствора хлорида натрия:
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Концентрация NaCl в растворе 310г/л. плотность раствора при условиях электролиза 1,17кг/л. степень разложения 50%. Побочные процессы в расчет не принимать. расчет вести на 1000 м3 хлора.
Скачать решение задачи И-53 (цена 100р)
Задача И-54 Определить расходные коэффициенты извести и кокса в производстве технического карбида кальция (ТКК), имеющего по анализу следующий состав (в %): CaC2 = А; СаО = Б; С = В; прочие примеси (ПП) = Г. Расчет вести на 1000 кг технического продукта. Содержание в коксе (в %): золы – Д, летучих компонентов (ЛК) – Е, влаги – Ж, углерода – И. Известь содержит К % чистого СаО. Карбид кальция получается по следующей реакции:
Известь содержит К % чистого СаО. Карбид кальция получается по следующей реакции:
CaO + 3C CaC2 + CO.
Скачать решение задачи И-54 (цена 100р)
Задача И-54-1 Определить расходные коэффициенты извести и кокса в производстве технического карбида кальция (ТКК), имеющего по анализу следующий состав: СаС2 = А %, СаО = Б %, С = В %, прочие примеси (ПП) = Г %. Расчет вести на 1000 кг технического продукта. Содержание в коксе: золы – Д %, летучих компонентов (ЛК) – Е %, влаги – Ж %, углерода – И %. Известь содержит К % чистого СаО. Карбид кальция получается по следующей реакции СаО + 3С → СаС2 + СО. Варианты решения контрольного задания представлены в табл. 1
Скачать решение задачи И-54-1 (цена 100р)
Задача И-55 Материальный баланс приготовления пропиточного раствора
На приготовление сплава поступает 75 кг борной кислоты и 75 кг мочевины. Затем добавляется обессоленная вода до концентрации 10-14%:
(75+75)кг- сплав -10%
х кг –вода обес. -90%
-90%
Материальный баланс приготовления 1500кг пропиточного раствора
Материальный баланс приготовления 40тонн пропиточного раствора
Тепловой баланс приготовления пропиточного раствора
Скачать решение задачи И-55 (цена 100р)
Задача И-56 Определите состав реакционной смеси до и после реакции с учетом выхода продуктов реакции. Составьте таблицу материального баланса.
1 Химическая реакция для расчета материального баланса
FeCl3 + 3NaOH = Fe(OH)3 (осад) + 3NaCl
2 Характеристики исходных растворов
СМ (FeCl3) = 1 моль/л; Vр-ра (FeCl3) = 2л; p(FeCl3) = 1,08 г/мл;
Сн (NaOH) = 2 моль/л; Vр-ра (NaOH) = 3л; (NaOH) = 1,11 г/мл; a = 0,6.
Скачать решение задачи И-56 (цена 100р)
Задача И-57 Материальный и тепловой баланс
2СО + 4Н2 > С2Н4 + 2Н2О
СО – содержит 10% примеси СО2. Подается с избытком 1,1. Н2 – содержит 10% N2 и 5% Nh4 Конверсия Н2 – 65%. Температуру реагентов применять 1000С. Расчет вести на 1т. С2Н4.
Температуру реагентов применять 1000С. Расчет вести на 1т. С2Н4.
Схема движения материальных потоков
Скачать решение задачи И-57 (цена 100р)
Задача И-58 Составить материальный баланс обжига железного колчедана по реакции:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
на 100 кг/с FeS2. Состав колчедана: FeS2 – 90% масс., Fe2O3 – 10% масс. Коэффициент избытка воздуха по отношению к стехиометрическому – 2. Воздух абсолютно сухой.
Скачать решение задачи И-58 (цена 100р)
Задача И-59 Реакция протекает в присутствии катализатора с объемной скоростью Vоб=125 м3 (м3*ч). Диаметр реактора d=l,52 м, высота h = 3,05 м. Считая, что катализатор занимает 0,75 объема реактора, определить время контакта газа с катализатором и объем газовой смеси, проходящей через реактор в 1 ч.
Скачать решение задачи И-59 (цена 100р)
Задача И-60 Для получения этилового спирта способом прямой гидратации этилена в гидратор подали 16,5 моль этилена. Из них при Т=290°С и Р=7*106 Па гидратации подверглись 13,2 моль. Определите степень превращения этилена, начальный и конечный объемы газовой смеси при указанных условиях.
Из них при Т=290°С и Р=7*106 Па гидратации подверглись 13,2 моль. Определите степень превращения этилена, начальный и конечный объемы газовой смеси при указанных условиях.
Скачать решение задачи И-60 (цена 100р)
Задача И-61 Определить количество аммиака, требуемого для производства 1000кг азотной кислоты с концентрацией 60% масс и расход воздуха на окисление аммиака, если выход оксида азота 0,97, степень абсорбции оксидов азота 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 9,5% (об.).
Молекулярная масса: NH3 – 17; HNO3 – 63.
Скачать решение задачи И-61 (цена 100р)
Задача И-61-1 Определить количество аммиака, требуемого для производства 100000 т/год азотной кислоты, и расход воздуха на окисление аммиака, если цех работает 355 дней в году, выход оксида азота 0,97, степень абсорбции 0,92, содержание аммиака в сухой аммиачно-воздушной смеси 7,13% (масс.).
Молекулярная масса: NH3 – 17 ; HNO3 – 63.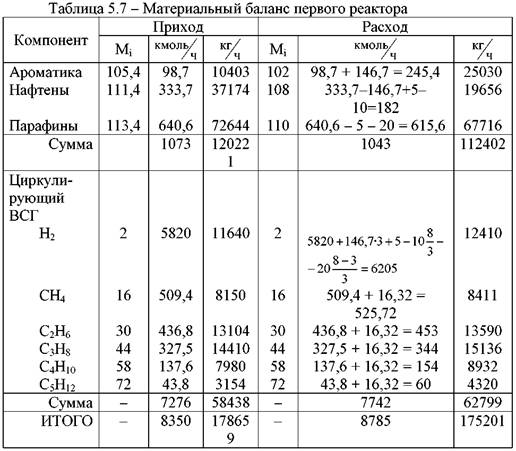
Скачать решение задачи И-61-1 (цена 100р)
Задача И-62 Составить материальный баланс производства NH3. Степень превращения CaCN2 составляет 75%, а степень превращения в NH3 = 8,5%. Расчет вести на производительность 70т/сутки.
Скачать решение задачи И-62 (цена 100р)
Задача И-63 Определите количество угля, необходимое для обжига (при 700 С) 200 кг/сут магнезита след. состава: MgCO3 = 80% масс, SiO2 = 20% масс. Сколько при этом образуется дымовых газов? Процесс идущий в барабанной печи условно считать идущим без потерь сырья и тепла через стенки аппарата. Температура отходящих газов 200 С, продукта на выходе 100 С. Конверсия угля до CO2 принять 100%.
Скачать решение задачи И-63 (цена 100р)
Задача И-64 Составьте материальный баланс гидратации оксида магния при следующих данных. Соотношение исходных компонентов на реакцию 1:2, производительность гасителя 200 кг/сут по продукту. Исходный компонент имеет состав (%масс): МgO – 90 (активными из них являются 80%), МgCO – 5, SiO2 – 5. Температура в гасителе -100 C.
Исходный компонент имеет состав (%масс): МgO – 90 (активными из них являются 80%), МgCO – 5, SiO2 – 5. Температура в гасителе -100 C.
Скачать решение задачи И-64 (цена 100р)
Задача И-65 Составьте материальный баланс гидратации оксида магния острым паром с Т = 125 С при следующих данных. Соотношение исходных компонентов на реакцию 1:1,5, производительность гасителя по оксиду 100 тыс.т/год. Магнезит имеет состав (%масс): МgO-92 (активными из них являются 80%), SiO2 – 5, CaO – 3.
Скачать решение задачи И-65 (цена 100р)
Задача И-66 Составить материальный баланс производства 5т обычного стекла, если известняк содержит 10% примесей, сода используется следующего состава (%масс.): Nа2СО3 – 93%; NаНСО3 – 6%; другие примеси – 1%. Степень превращения соды и известняка 81% и 85% соответственно. Для расчета принимаем, что кварцевый песок без примесей. Сырьем для производства обычного стекла служит кварцевый песок, сода и известняк.
Скачать решение задачи И-66 (цена 100р)
Задача И-67 Определить интенсивность печи, т.е. количество колчедана (в пересчете на 45 %-ный), сжигаемого на 1 м2 пода печи в сутки, если площадь основного пода печи 16,7 м2. В печи КС-200 сгорает в 1 ч 10 т колчедана, содержащего 41% серы.
Скачать решение задачи И-67 (цена 100р)
Задача И-68 (вар 3) Составить материальный баланс печи для сжигания серы. Расчет вести на производительность печи по сжигаемой сере в кг/ч. Процесс горения описывается уравнением: S + O2 → SO2.
Производительность печи 60 т/сутки Степень окисления серы 0,95 Коэффициент избытка воздуха 1,3
Скачать решение задачи И-68 (цена 100р)
Задача И-68-1 Составить материальный баланс печи для сжигания серы производительностью 40 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,4.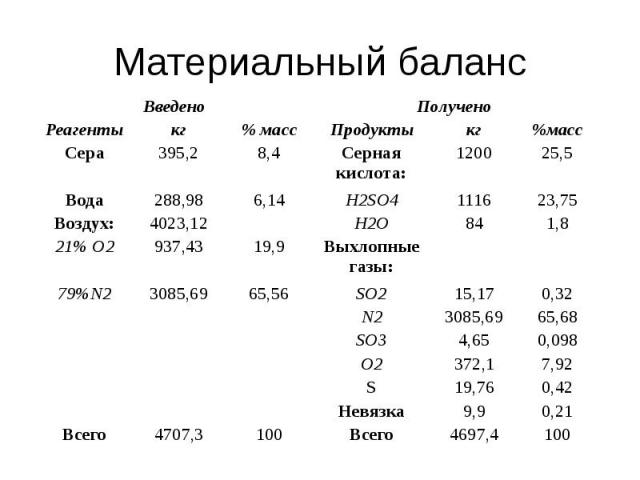 Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-1 (цена 100р)
Задача И-68-2 Составить материальный баланс печи для сжигания серы производительностью 60 т/сутки. Степень окисления серы 0,95 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха a = 1,5. Расчет следует вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-2 (цена 100р)
Задача И-68-3 Составить материальный баланс печи для сжигания серы производительностью 3 т/час. Степень окисления серы 0,98 (остальная сера возгоняется и сгорает вне печи). Коэффициент избытка воздуха 1,15. Расчет вести на производительность печи по сжигаемой сере в кг/ч.
Скачать решение задачи И-68-3 (цена 100р)
Задача И-68-4 Составить материальный баланс (в кг/ч) печи для сжигания серы производительностью 7000 серного ангидрида. Степень превращения исходной серы составляет 95%, коэффициент избытка воздуха 4,7.
Скачать решение задачи И-68-4 (цена 100р)
Задача И-69 Определить выход продукта R и степень превращения реагента А, если обратимая реакция А ↔ 2R + S протекает до равновесия, когда хАр = 0,65. Соотношение концентраций продукта и реагента СR:СА = 2
Скачать решение задачи И-69 (цена 100р)
Задача И-70 Составить материальный баланс процесса получения железного купороса, если состав огарка Fe2O3 – 45% , FeO – 25% , FeS – 15% выход продукта 98%. Расчет вести на 1 тонну железного купороса.
DeO + h3SO4 = DeSO4 + h3O
Скачать решение задачи И-70 (цена 100р)
Задача И-71 В равновесной смеси, полученной в результате пиролиза метана при 1600С
2CH4 = C2H2 + 3H2
концентрация метана составляет 3 моль/л. Считая, что превращению подверглось только 25% исходного количества метана, определите константы равновесия и при указанной температуре.
Скачать решение задачи И-71 (цена 100р)
Задача И-72 Газофазная реакция A + 3B → 2R протекает при постоянном давлении. Исходные концентрации А и В равны соответственно 0,4; 0,5 молярной доли. В продуктах содержится 0,7 молярной доли продукта R. Определить концентрации других веществ и степень превращения В.
Скачать решение задачи И-72 (цена 100р)
Задача И-73 Производительность в печи сжигания мазута 8 тонн в час. Содержание S в мазуте 6%, твердый остаток 4%. Степень сгорания мазута до CO2 – 96%, до CO – 4%. Определить выбросы SO2, CO, CO2.Степень улавливания 0%. Ставить материальный баланс.
Скачать решение задачи И-73 (цена 100р)
Задача И-74 В реакторе протекает реакция:
C2h5 + h3O = C2H5OH
В реактор поступает 582кг исходной смеси реагентов в мольном соотношении H2O:C2H4 = 0,3:0,5. Конверсия этилена 5%.
Определить состав реакционной смеси и выразить его в кмоль, кг, %масс, %мольн, %об, кмоль/м3. Определить конверсию водяного пара.
Скачать решение задачи И-74 (цена 100р)
Задача И-75 Составить материальный баланс производства кальцинированной соды аммиачным пособом, который протекает по реакциям:
NaCl + NH3 + H2O + CO2 = NaHCO3 + NH4Cl
2NaHCO3 = Na2CO3 + CO2 + H2O
Производительность установки производства соды 100 тонн. Состав рассола, % (масс.): NaCl – 25; NH3 – 6,8; H2O – 68,2. Содержание углекислого газа, % (об.): CO2 – 68, N2 – 32. Потери CO2, % (масс.): 5. Конверсия CO2 – 65%.
Скачать решение задачи И-75 (цена 100р)
Задача И-76 Составьте материальный и тепловой баланс получения 980000т/год нитрата магния из порошка ПМК состава (%масс): оксид магния – 85%, карбонат магния – 10% песок кварцевый – 5%. Концентрация азотной кислоты – 63%. Принять потери на транспортировку и упаковку продукта в количестве 3% от производительности. Температура процесса 60 С.
Концентрация азотной кислоты – 63%. Принять потери на транспортировку и упаковку продукта в количестве 3% от производительности. Температура процесса 60 С.
Скачать решение задачи И-76 (цена 100р)
Задача И-77 Этилен получают путем пиролиза пропана:
C3H8 = C2H4 + CH4
В продуктах реакции содержится 1,0% об% пропана.
Рассчитать степень превращения пропана, выход этилена и расходный коэффициент по сырью в кг и м3. Расчет провести на 4 тонн этилена.
Скачать решение задачи И-77 (цена 100р)
Задача И-78 Составить материальный баланс процесса получения поташа (карбоната калия), если исходный раствор содержит 154г/л KOH и 180г/л KCl. Топочный газ, на карбонизацию содежит CO2 – 10% . Степень карбонизации едкого калия 90%. Выход продукта K2CO3 = 98% и KCl = 1% . Расчет вести на 1000кг карбоната калия.
Скачать решение задачи И-78 (цена 100р)
Задача И-79 Определите количество активного оксида магния образующееся при непрерывном разложении 20000 т/год магнезита следующего состава (%масс. ): карбонат магния – 83, гидроксид магния – 7, доломит – 10. Составьте таблицу материального баланса. Какое количество теплоты необходимо затратить на разложение этого минерала?
): карбонат магния – 83, гидроксид магния – 7, доломит – 10. Составьте таблицу материального баланса. Какое количество теплоты необходимо затратить на разложение этого минерала?
Скачать решение задачи И-79 (цена 100р)
Задача И-80 Рассчитать материальный баланс производства серной кислоты методом сжигания сероводорода производительностью 20 т/час, если известен состав исходного сырья:
h3S = 90%, h3O = 5%, N2 = 5%. Соотношение сероводород-воздух: 10 м3. Содержание влаги в воздухе составляет 1% .Производственные потери 5% .
Скачать решение задачи И-80 (цена 100р)
Задача И-81 Рассчитать материальный и тепловой баланс печи для сжигания сероводорода.
на сжигание подается газ следующего состава в расчете на сухой газ, % объемные: H2S = 91,3; SO2 = 5,5; H2 = 0,8; CH4 = 0,9; C2H6 = 0,5; C3H8 = 0,5; C4H10 = 0,5
газ поступает в количестве 2250 м3/час; коэффициент избытка воздуха равен 2,5; -относительная влажность воздуха 60%.
Скачать решение задачи И-81 (цена 100р)
Задача И-82 Определить степень превращения соды и выход продукта при получении известковым способом 10т 40%-ного раствора NaOH, если для производства взято 5,75т содового сырья, содержащего Na2CO3 = 95% и NaHCO3 = 5% .
Реакции процесса
Na2CO3 + CaO + H2O = 2NaOH + CaCO3
2NaHCO3 = Na2CO3 + CO2 + H2O
Скачать решение задачи И-82 (цена 100р)
Задача И-83 Составить материальный баланс процесса получения фосфатных солей из экстракционной фосфорной кислоты без её предварительной очистки, если: марганца: P2O5 – 52%, F – 0,4%, марганца – 0,35г/л, меди: 0,02г/л, ванадия: 0,12г/л. Выход фосфатных солей – 73%. Расчет вести на 1000кг солей.
2NH3 + H3PO4 = (NH4)2HPO4
Скачать решение задачи И-83 (цена 100р)
Задача И-84 Составить материальный баланс для 1000кг тетрабората натрия по уравнению:
NaBrO +F +2NaOH → NaBrO +2NaF+H2O, если:
NaBrO -63%;
NaOH-40%.
Скачать решение задачи И-84 (цена 100р)
Задача И-85 Рассчитать расход бензола и пропан-пропиленовой фракции газов крекинга [30% (об.) пропилена и 70% (об.) пропана] для производства 1 т фенола, если выход изопропилбензола из бензола составляет 90% от теоретического, а фенола из изоропилбензола – 93%.
Скачать решение задачи И-85 (цена 100р)
Задача И-86 Определить расходные коэффициенты в производстве карбида кальция (технического), содержащего [% (масс.)]: CaC2 -78; CaO – 15; C – 3; прочие примеси- 4. Известь содержит 96,5% CaO. Содержание (%) в коксе: золы – 4, летучих – 4, влаги- 3. Расчёт вести на 1 т технического продукта. Молекулярная масса: CaC2 – 64, CaO – 56.
Скачать решение задачи И-86 (цена 100р)
Задача И-87 Рассчитать расходный коэффициент природного газа, содержащего 97% (об.) метана, в производстве уксусной кислоты (на 1 т) из ацетальдегида. Выход ацетилена из метана составляет 15% от теоретически возможного, ацетальдегида из ацетилена – 60%, а уксусной кислоты из ацетальдегида – 90% (масс. ).
).
Скачать решение задачи И-87 (цена 100р)
Задача И-88 Составить материальный баланс производства оксида этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %об.: этилен – 2,5, воздух – 97,5. Степень окисления этилена Х=0,6. Расчет вести на 1,5т оксида этилена. Для расчета принять состав воздуха [%об.]: .
Окисление этилена происходит по реакции:
2CH4 + O2 = 2C2H4O
Скачать решение задачи И-88 (цена 100р)
Задача И-88-1 Составить материальный баланс производства окиси этилена прямым каталитическим окислением этилена воздухом. Состав исходной газовой смеси в %(об): этилен – 3, воздух – 97. Степень окисления этилена Х = 0,6. Расчет вести на 2000 кг оксида этилена.
Производство оксида этилена происходит по следующей схеме:
2CH2=CH2 + O2 → 2(CH2-CH2)O
Скачать решение задачи И-88-1 (цена 100р)
Задача И-89 При крекинге бутана объемом 3. 36 л образуются этан и этилен. Рассчитайте массу бромной воды, которые могут обесцветить продукты крекинга.
36 л образуются этан и этилен. Рассчитайте массу бромной воды, которые могут обесцветить продукты крекинга.
Скачать решение задачи И-89 (цена 100р)
Задача И-90 Восстановление олова из минерала касситерита происходит по схеме 2SnO2 + 3C = 2Sn + 2CO + CO2. Сколько касситерита содержащий 76% SnO2 и кокса, который содержит 87% углерода, нужно для выплавки 1 т черного олова, содержащий 90% чистого олова.
Скачать решение задачи И-90 (цена 100р)
Подготовка к ЕГЭ по химии, расчетные задачи
РЕШЕНИЕ ЗАДАЧ ВЫСОКОГО УРОВНЯ СЛОЖНОСТИ 33 ЗАДАНИЕ ЕГЭ ХИМИЯ
ПОРЯДОК РЕШЕНИЯ ЗАДАЧ
1. Краткая запись условия задачи
2. Запись уравнения химической реакции
3. Запись известных и неизвестных величин над формулами веществ
4. Запись под формулами веществ :
- Молярной массы Объема Количества веществ
- Молярной массы
- Объема
- Количества веществ
5. Решение задачи
Решение задачи
(2 части : I) химическая и II) математическая )
ХИМИЧЕСКАЯ ЧАСТЬ ЗАДАЧИ:
1. Чтение текста
2. Запись условия задачи
3. Определение типа задачи
4. Анализ задачи – составление плана решения
Математическая часть задачи
1. Выбор способа решения
2. Решение
3. Запись ответа
4. Анализ решения
СХЕМА РЕШЕНИЯ ЗАДАЧ
Условие задачи
Запись уравнения
химической реакции
Расчеты по уравнениям
химической реакции
Ответ
1. Расчеты по уравнению реакций
2. Задачи на смеси веществ
3. Задачи на “ тип соли ” ( определение состава продукта реакции )
ЗАДАЧИ
5. Нахождение массы одного из исходных веществ по уравнению материального баланса
4.
ЗАДАЧА 1
Сероводород объемом 5,6л (н.у.) прореагировал без остатка с 59,02мл раствора гидроксида калия с массовой долей 20% ( ρ =1,186г/мл). Определите массу соли, полученной в результате этой химической реакции.
1. Тип 3 «Тип соли».
2. Избыток и недостаток.
3. Определение состава соли.
4. Определение массы продуктов реакции – соли.
ЗАДАЧА 2
Магний массой 4,8г растворили в 200мл 12%-ного раствора серной кислоты ( ρ =1,5г/мл). Вычислите массовую долю сульфата магния в конечном растворе.
1. Тип 4 «Нахождение массовой доли одного из продуктов реакции в растворе по уравнению материального баланса».
2. Избыток и недостаток.
3. Вычисление массовой доли вещества в растворе.
4. Определение массы растворенного вещества.
ЗАДАЧА 3
Карбид алюминия растворили в 380г раствора хлороводородной кислоты с массовой долей 15%. Выделившийся при этом газ занял объем 6.72л (н.у.). Рассчитайте массовую долю хлороводорода в полученном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества
ЗАДАЧА 4
Нитрит калия массой 8,5г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объем (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе?
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнения реакции.
3. Нахождение количества вещества, их массы, объема.
4. Составление уравнения для расчета массовой доли исходного вещества.
ЗАДАЧА 5
К раствору гидроксида натрия массой 1200 г прибавили 490г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143г кристаллической соды Na 2 CO 3 *10H 2 O. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Составление уравнения для расчета массовой доли исходного вещества.
ЗАДАЧА 6
Определите массовые доли (в %) сульфата железа и сульфида алюминия в смеси, если при обработке 25г этой смеси водой выделился газ, который полностью прореагировал с 960г 5%-ного раствора сульфата меди.
1. Тип 5 «Нахождение массы и массовой доли одного из исходных веществ по уравнению материального баланса».
2. Составление уравнений реакций.
3. Нахождение количества вещества, их массы.
4. Определение массовой доли исходных веществ смеси.
ЗАДАНИЯ 7
1. Объясните, почему при нитровании толуола происходит замещение атомов водорода только у 2-го, 4-го и 6-го атомов углерода, но никогда не замещаются атомы водорода у 3-го и 5-го атомов углерода.
2. Составьте схема получения бензола из целлюлозы. Запишите уравнения реакций с указанием условий их протекания.
3. Какое из оснований сильнее – аммиак или диметиламин? Объясните почему. Приведите уравнения реакций, подтверждающих их основные свойства.
СПИСОК ЛИТЕРАТУРЫ
Несомненно большую помощь Вам окажут книги:
- Доронькин, В.Н. Химия. 9 класс. Тематические тесты по подготовке к ГИА-9 / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева. – Ростов на/Д.: Легион, 2011. – 368 с.
- Корощенко, А.
 С. ГИА. Химия. Типовые тестовые задания / А.С. Корощенко, Ю.Н. Медведев – М.: Экзамен, 2014. – 96 с.
С. ГИА. Химия. Типовые тестовые задания / А.С. Корощенко, Ю.Н. Медведев – М.: Экзамен, 2014. – 96 с. - Медведев, Ю.Н. ЕГЭ. Химия. Практикум / Ю.Н. Медведев. – М.: Экзамен, 2010. – 125 с.
- Медведев, Ю.Н. ЕГЭ. Типовые тестовые задания / Ю.Н. Медведев. – М.: Экзамен, 2011. – 160 с.
- Задания ГИА-9 (книга)
СПИСОК ЛИТЕРАТУРЫ
- Медведев, Ю.Н. Типовые тестовые задания / Ю.Н. Медведев. – М.: Экзамен, 2013. – 112 с.
- Доронькин, В.Н. Химия. Тематические тесты для подготовки к ЕГЭ. Задания высокого уровня сложности (С1 – С5) / В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралёва – Ростов на/Д.: Легион, 2012. – 242 с.
- Доронькина, В.Н. Химия. Тематические тесты. Новые задания ЕГЭ. Химический эксперимент (С2) / В. Н. Доронькина, А.Г. Бережная, Т.В. Сажнева, В.А. Февралёва. – Ростов н/Д.: Легион, 2012. – 92 с.
- Кузьменко Н.Е. Начала химии. Современный курс для поступающих в вузы: Учебное пособие для вузов / Н.

С П А С И Б О З А В Н И М А Н И Е !
Материальный баланс химико-технологического процесса
Расчет материального баланса является необходимой вещью в химической технологии. Материальный баланс или массовый баланс – это расчет количества каждого компонента на входе и выходе на каждом этапе процесса.
Перед расчетом материального баланса мы должны иметь правильное представление о системе, границах системы и окружающей среде. Система — это область или количество материи, которое мы выбрали для изучения. Все, что находится за пределами системы, является окружающим. Реальная или воображаемая поверхность, отделяющая систему от ее окружения, является границей.
Рекламные объявления
В промышленном процессе мы вводим материалы в систему, а продукты извлекаем из системы. При расчете материального баланса мы рассчитываем проценты или массы того, что мы вводим, и того, что мы получаем на выходе.
Расчет материального баланса всего процесса является сложной задачей. Поэтому мы рассчитываем материальный баланс для каждой отдельной технологической операции. Общее уравнение материального баланса выглядит следующим образом.
Входящий материал + Генерация = Выходной материал + Потребление + Накопление Реклама
Рисунок 01: Основная функция системыМатериальный баланс может применяться к общей массе или общему количеству молей потока, массе отдельного соединения, массе атомарных частиц, моли соединения, моли атомарных частиц и т. д.
Существуют процессы с химической реакцией или без нее, а также стационарные и нестационарные процессы. В зависимости от типа процесса приведенное выше уравнение изменяется.
- Нестационарный процесс с химической реакцией или ядерной реакцией
В нестационарном процессе скорость на входе не равна скорости на выходе. Следовательно, в системе происходит накопление материала.
Входящий материал + Генерация = Выходной материал + Расход + Накопление
- Стационарный процесс с химической реакцией или ядерной реакцией
В стационарном процессе внутри системы не происходит накопления материала. Скорость ввода равна скорости вывода. Следовательно, срок накопления будет равен нулю. если происходит химическая реакция или ядерная реакция, создаются новые материалы, а некоторые материалы потребляются. Итак, материальный баланс для такой системы будет
Входящий материал + Образование = Выход материала + Расход Реклама
- Нестационарный процесс без химической реакции или ядерной реакции
В нестационарном процессе происходит накопление материала. Если нет химической реакции или ядерной реакции, нет производства или потребления материала. Следовательно, эти два члена будут равны нулю. В таких системах учитываются только физические процессы, такие как дистилляция, адсорбция, конденсация и т. д. Уравнение материального баланса для такой системы будет следующим:
Если нет химической реакции или ядерной реакции, нет производства или потребления материала. Следовательно, эти два члена будут равны нулю. В таких системах учитываются только физические процессы, такие как дистилляция, адсорбция, конденсация и т. д. Уравнение материального баланса для такой системы будет следующим:
Входящий материал = Выходной материал + Накопление
- Стабильный процесс без химической реакции или ядерной реакции потребление. Мы получаем тот же материал, который мы вводим. Но произошли только физические изменения. Следовательно, материальный баланс можно упростить следующим образом:
Входящий материал = Выходной материал
Задачи материального баланса, не связанные с химическими реакциями
Рассмотрим процесс извлечения этанола из газовой смеси, содержащей воздух, пары воды и пары этанола. Мы собираемся отделить этанол от газа. Перед расчетом материального баланса в первую очередь необходимо составить блок-схему процесса. Простая блок-схема вышеописанного процесса выглядит следующим образом.
Простая блок-схема вышеописанного процесса выглядит следующим образом.
В описанном выше процессе не происходит никаких химических реакций. И абсорбция, и дистилляция являются методами физического разделения. Следовательно, в этом процессе нет материального производства или потребления. Если считать, что этот процесс работает в стационарном режиме, накопления материала нет. Для простоты расчета весь процесс можно разделить на две системы.
Первая система – абсорбционная колонна. Абсорбционная колонна имеет два входа и два выхода. Массовые проценты каждого входа и выхода абсорбционной колонны следующие.
Figure 03: Recovery process of ethanol from a gas mixture – The first system – The absorption column| Stream | Water | Air | Ethanol | |||||
| Stream – A Input gas | 2% | 95% | 3% | |||||
| Stream – B Output gas | 0. 5% 5% | 99.5% | 0% | |||||
| Stream – C Входная вода | 100% | 0% | 0% | |||||
| Поток – D Выходная вода | 81% | 0% | 1 | 90% | % | 90% | 9% |
| Stream | Flow rate (Kg/hr) |
| Stream – A Input gas | 1000 |
| Stream – B Output gas | 954.77 |
| Stream – C Вода на входе | 112,66 |
| Поток – D Вода на выходе | 157,89 |
Ввод водно-этанольной смеси
Выходной дистиллят
Выходные дни.
 : Массовые проценты каждого входа и выхода ректификационной колонны и конденсатора в процессе извлечения этанола из газовой смеси
: Массовые проценты каждого входа и выхода ректификационной колонны и конденсатора в процессе извлечения этанола из газовой смесиМатериал на входе = Материал на выходе
D = E + F
Этанол
Вода
Решив два приведенных выше уравнения (уравнение 1 и уравнение 2), мы можем рассчитать расход E и F.
Подставив приведенное выше значение в уравнение 2, мы можем вычислить значение F.
Для системы 2 скорости потока на входе и выходе можно обобщить следующим образом.
| Поток | Расход (кг/час) |
| Поток – D Входная смесь этанола-вода | 157,89 |
| Поток-E Выходной дистиллят | 24,93 |
| Поток F Поток | 132. 96 96 | 9075 9015 9075. дистилляционная колонна и конденсатор в процессе извлечения этанола из газовой смеси


 В окислителе SO 2 превращается в газ SO 3 .
В окислителе SO 2 превращается в газ SO 3 .



