Дидактическая таблица в решении задач по теме “Растворы”
Дидактическая таблица в решении задач по теме «Растворы»
Суворова Анна Александровна,
учитель химии МКОУ СОШ №2 п.Жигалово
Решение задач по теме «Растворы» имеет большую практическую значимость: подкормка растений минеральными удобрениями, консервирование овощей и салатов, приготовление растворов штукатурки, затирки, бетона и т.д.
Знания и умения, полученные на уроках химии, пригодятся в жизни, особенно тем, кто желает связать свою жизнь с агрохимией, медициной, строительством, да и просто с химией в быту.
Выделяют различные типы решения задач:
Решение задач на упаривание растворов
Решение задач на концентрирование растворов (добавление вещества)
Решение задач на разбавление растворов
Решение задач на смешивание растворов
Существуют различные способы, с помощью которых можно решать такие задачи:
– математический способ, с помощью пропорций;
– алгебраический способ, через использование формул;
– правило креста.
Но многие из них громоздки, сложны в решении. Для упрощения решения задач мне удалось разработать дидактическую таблицу.
Что такое дидактическая таблица?
Это таблица, в которой заложен способ действий через использование формул. Рассмотрим это на примерах решения типовых задач по теме «Растворы» с использованием формулы:
w= | m (р.в.) | /m (р-ра) *100% , где w – массовая доля растворённого вещества, m (р.в. ) – масса растворённого вещества (г), m (р-ра) – масса раствора (г). Из общей формулы можно вывести две рабочие формулы: m (р. m (р-ра) = m (р.в.)/w Создаём таблицу, в котором первый столбец – w, второй столбец – m (р-ра), третий столбец- m (р.в. ). И всегда так! | ||
w | m (р-ра) (г) | m (р.в. ) (г) | ||
Как работает дидактическая таблица?
(Инструкция по работе)
1.Если по условию задачи известны массовая доля растворённого вещества, масса раствора, и нужно найти массу растворённого вещества, то двигаясь по таблице слева направо, мы первый столбец умножаем на второй и получаем искомое значение, т. е. используем первую рабочую формулу.
е. используем первую рабочую формулу.
2.Если по условию задачи известны масса растворённого вещества, массовая доля и нужно найти массу раствора, то двигаясь по таблице справа налево, мы третий столбец делим на первый и получаем необходимое значение, т.е. используем вторую рабочую формулу.
Рассмотрим на примерах.
Решение задач на упаривание растворов
Необходимо помнить, что масса раствора уменьшается, так как при упаривании вода испаряется.
Задача 1. Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
Решение:
Распределяем данные задачи по столбцам. Увеличить массовую долю на 5, значит получить 20% раствор (0,2).
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,15 | 800 | |
Новый раствор | 0,2 |
Используя инструкцию №1, получаем 120г растворённого вещества. В новом растворе масса растворённого вещества сохраняется, поэтому переносим в третью строку.
В новом растворе масса растворённого вещества сохраняется, поэтому переносим в третью строку.
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,15 | 800 | 120 |
Новый раствор | 0,2 | 120 |
Используя инструкцию №2, мы 120/0,2 получаем 600г и заносим полученный результат в третью строку, второй столбец.
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,15 | 800 | 120 |
Новый раствор | 0,2 | 600 | 120 |
Находим массу воды, которую надо испарить.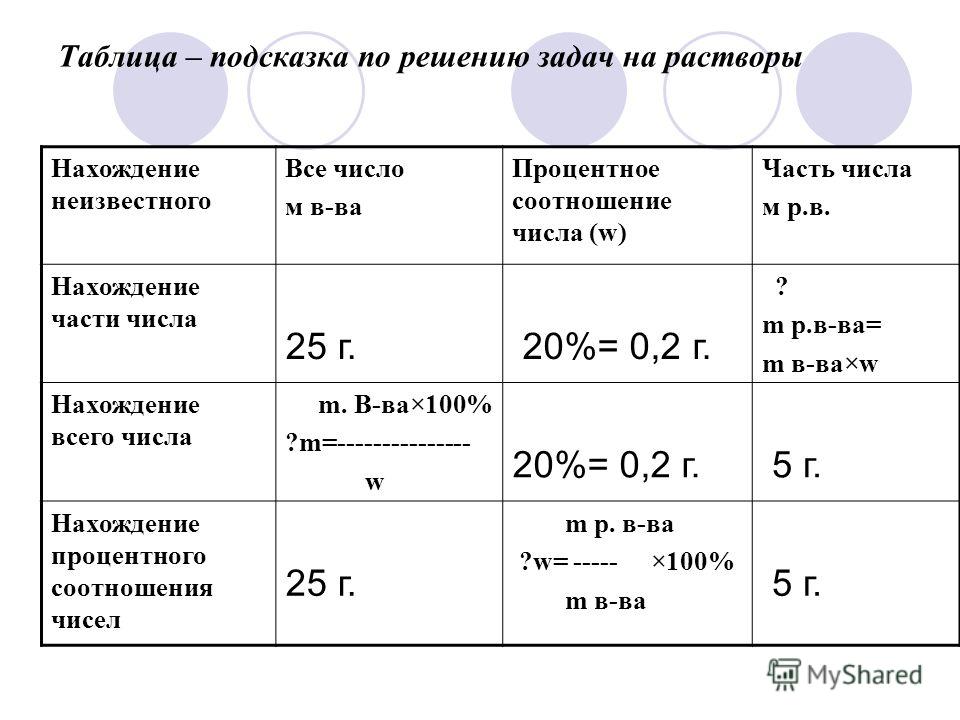 Для этого от массы первоначального раствора отнимаем массу нового раствора. 800-600=200г.
Для этого от массы первоначального раствора отнимаем массу нового раствора. 800-600=200г.
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,15 | 800 | 120 |
Новый раствор | 0,2 | 600 | 120 |
Ответ: 200г
Решение задач на концентрирование растворов (добавление вещества)
Необходимо помнить, что при добавлении вещества масса растворённого вещества и масса раствора увеличиваются.
Задача 2. К 180г 8%–го раствора хлорида натрия добавили 20г хлорида натрия. Определите массовую долю хлорида натрия в образовавшемся растворе.
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,08 | 180 | 14,4 |
Добавили вещество | 20 | 20 | |
Новый раствор | 0,172 | 200 | 34,4 |
Ответ: 0,172 или 17,2%
Решение задач на разбавление растворов
Необходимо помнить, что при добавлении воды масса раствора увеличивается, а масса растворённого вещества не меняется.
Задача 3. К 200 г 15%–го раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе.
W | m (р-ра) (г) | m (р.в. ) (г) | |
Первоначальный раствор | 0,15 | 200 | 30 |
Добавили воду | 40 | ||
Новый раствор | 0,125 | 240 | 30 |
Ответ: 0,125 или 12,5%
Решение задач на смешивание растворов
Необходимо помнить, что при смешивании растворов складываются массы растворов и массы растворённых веществ.
Задача 4. Определите массовую долю сульфата натрия в растворе, полученном сливанием 120 г 10%–го раствора Na2SO4 и 200г 4%–го раствора того же вещества.
W | m (р-ра) (г) | m (р.в. ) (г) | |
1-й раствор | 0,1 | 120 | 12 |
2-й раствор | 0,04 | 200 | 8 |
Новый раствор | 0,0625 | 320 | 20 |
Ответ: 0,0625 или 6,25%
Решение задач на приготовление растворов
Задача 5.Определите, сколько нужно взять растворов соли 60%-й и 10%-й концентраций для приготовления 300 г раствора 25%-й концентрации.
W | m (р-ра) (г) | m (р. (г) | |
1-й раствор | 0,6 | х | 0,6х |
2-й раствор | 0,1 | у | 0,1у |
Новый раствор | 0,25 | 300 | 0,6х+0.1у |
Получаем систему уравнений:
х + у = 300
0,6х +0,1у/300 = 0.25
х=90г
у= 210г
Ответ: 90г; 210г
Проверка:
W | m (р-ра) (г) | m (р.в. ) (г) |
0,6 | 90 | 54 |
0,1 | 210 | 21 |
0,25 | 300 | 75 |
75/300=0. 25
25
Задача 6. 3%-ный раствор пероксида водорода h3O2 используется в медицине как дезинфицирующее средство для промывания ран. В аптеку поступил 30%-ный раствор h3O2, называемый пергидроль. Как молодому фармацевту приготовить 2 кг 3%-ного раствора h3O2, исходя из пергидроля?
W | m (р-ра) (г) | m (р.в. ) (г) | |
Новый раствор | 0,03 | 2000 | 60 |
Пергидроль | 0.3 | 200 | 60 |
Масса воды | 2000- 200= 1800 |
Ответ: масса пергидроля – 60г, масса воды – 1800г
Задача 7. Бабушке при консервировании необходим маринад, для приготовления которого нужно 350 г девятипроцентного уксуса. Бабушка купила в гастрономе 70%-ный уксус (уксусная кислота). Сколько грамм уксусной кислоты и воды нужно взять, чтобы приготовить нужный раствор?
Бабушка купила в гастрономе 70%-ный уксус (уксусная кислота). Сколько грамм уксусной кислоты и воды нужно взять, чтобы приготовить нужный раствор?
W | m (р-ра) (г) | m (р.в. ) (г) | |
9% раствор | 0,09 | 350 | 31,5 |
Уксусная кислота | 0,7 | 45 | 31,5 |
Масса воды | 350-45= 305 |
Ответ: 45г, 305г
Эффективность использования дидактической таблицы
при решении задач по теме «Растворы»
1. Учащиеся создают таблицу, в которой указывают характеристики растворов: массовую долю растворённого вещества (процентную концентрацию), массу раствора и массу растворённого вещества.
2. Таблица помогает понять условие задачи: распределяя данные по столбцам и строкам, учащиеся представляют происходящий процесс, видят зависимость между данными и искомой величиной.
3. Сокращается время на решение задачи.
Задачи использованы из Он-лайн школа Фоксфорд:
https://foxford.ru/wiki/himiya/reshenie-zadach-s-izmeneniem-kontsentratsii-rastvorov
Нахождение серной кислоты в растворе — способ решения II
К 400 миллилитрам 28-процентного раствора серной кислоты (H2SO4) (плотность раствора равна 1,2 г/см3) добавили 200 миллилитров 10-процентного раствора (плотность раствора равна 1,07 г/см3) этого же вещества. Какова массовая доля серной кислоты (H2SO4) в растворе?
Решение задачи
II способ решения (I способ, III способ)
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, добавленный как 2 раствор, а полученный как 3 раствор.
Введем обозначения:
ω1, ω2, ω3 – массовая доля растворенного вещества соответственно в 1 растворе, во 2 растворе и 3 растворе;
m1 (вещества), m2 (вещества), m3 (вещества) – массы растворенных веществ в соответствующих растворах;
m1 (раствора), m2 (раствора), m3 (раствора) – массы соответствующих растворов.
Запишем общую формулу для нахождения массовой доли растворенного вещества в полученном растворе:
После смешения растворов масса
После смешения растворов масса 3 вещества будет равна:
Найдем массу 1 раствора серной кислоты (H2SO4) по формуле:
Получаем:
m1 (раствора) = 1,2 г/см3 ∙ 400 см3 =480 (г).
Вычислим массу 1 вещества, по формуле:
Получаем:
m1 (вещества) = 480 ∙ 0,28 = 134,4 (г).
Если раствор 28-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,28.
Найдем массу 2 раствора серной кислоты (H2SO
Получаем:
m2 (раствора) = 1,07 2 г/см3 ∙ 200 см3 = 214 (г).
Вычислим массу 2 вещества, по формуле:
Получаем:
m2 (вещества) = 214 ∙ 0,1 = 21,4(г).
Если раствор 10-процентный, то массовая доля серной кислоты (H2SO4) в нем 0,1.
Найдем массу 3 раствора по формуле:
Получаем:
m3 (раствора) = 480 + 214 = 694 (г).
Найдем массу 3 вещества по формуле:
Получаем:
m3 (вещества) = 134,4 + 21,4 = 155,8 (г).
Найдем массовую долю серной кислоты (H
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора.
Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Ответ: массовая доля серной кислоты в растворе = 0,22.
Химия Пошаговые решения: Химические растворы | by Tech-Based Teaching Editor | Техническое обучение: вычислительное мышление в классе
Следующее было изначально опубликовано в блоге Wolfram. Оригинальный пост можно посмотреть здесь .
В нашем последнем посте мы начали серию из четырех статей о пошаговых предложениях Wolfram|Alpha по химии с химическими реакциями. Будущие посты будут охватывать химическую структуру и связи, а также квантовую химию. Мы продолжаем этот пост с химическими растворами, еще одним основополагающим компонентом всех классов химии.
От крови в ваших венах до океанов, покрывающих планету, решения есть везде! Понимание их химических свойств необходимо для поддержания жизни, создания новых материалов и лечения болезней. Таким образом, все дисциплины, начиная от биологии и материаловедения и заканчивая медициной, должны быть удобными для выполнения вычислений, связанных с решением.
Таким образом, все дисциплины, начиная от биологии и материаловедения и заканчивая медициной, должны быть удобными для выполнения вычислений, связанных с решением.
Чтобы освоить такие расчеты, пошаговые результаты предоставляют пошаговые руководства, которые можно просматривать пошагово или все сразу. Прочтите, например, задачи, касающиеся концентрации растворенных веществ, приготовления раствора, стр. 9.0003 K ₐ и коллигативные свойства.
Анализ химических растворов начинается с определения концентрации компонентов в указанном растворе. Доступны пошаговые результаты для расчета доли количества, массовой доли и моляльности в дополнение к молярности. Во всех случаях общая структура для решения этих проблем концентрации обеспечивается на этапе планирования. Детали того, какую формулу использовать и как вычислить необходимую информацию, выделены.
Пример задачи
Образец безалкогольного напитка объемом 355 мл содержит 0,133 моль сахарозы. Какова молярная концентрация сахарозы в пробе?
Пошаговое решение
Для этой задачи введите «молярность 0,133 моль сахарозы в 355 мл воды».
Химические лаборатории по всему миру ежедневно производят растворы с желаемой концентрацией. Доступны пошаговые результаты для приготовления растворов с использованием исходных растворов более высокой концентрации и формулы разбавления или с использованием определения молярности. В обоих случаях общая структура для решения этих типов проблем предоставляется на шаге «Планирование». Детали того, какую формулу использовать и как вычислить необходимую информацию, выделены.
Пример задачи
Сколько миллилитров концентрированной HCl требуется для приготовления 250 мл 2,00 М раствора HCl?
Пошаговое решение
Чтобы узнать, сколько миллилитров вам нужно, введите «приготовить 250 мл 2,00 М HCl из концентрированной HCl», поскольку Wolfram|Alpha знает молярность концентрированной HCl.
Понимание того, насколько прочно протон связан с другим атомом, имеет решающее значение для понимания и предсказания химических реакций с участием кислот и оснований. Экспериментальное значение, содержащее эту информацию, представляет собой константу кислотности, 9-10”.
Экспериментальное значение, содержащее эту информацию, представляет собой константу кислотности, 9-10”.
Физические свойства раствора отличаются от физических свойств чистого растворенного вещества и растворителя, составляющих раствор. Свойства раствора, которые в первую очередь зависят от количества частиц растворенного вещества, а не от химической природы этих частиц, известны как коллигативные свойства. Доступны пошаговые результаты для расчета повышения температуры кипения и понижения температуры замерзания, а также коэффициента Ван’т-Гоффа, используемого во всех формулах коллигативных свойств.
Пример задачи
Какова температура кипения 0,33 м раствора, содержащего нелетучее вещество в толуоле ( K b = 3,4 K кг/моль), при условии идеального поведения раствора?
Пошаговое решение
Известную информацию можно ввести в необходимый калькулятор напрямую через «повышение температуры кипения m=0,33 моляль, i=1, Kb=3,4 K кг/моль».
Проверьте свои навыки решения задач с химическими растворами, используя инструменты Wolfram|Alpha, описанные для решения этих текстовых задач. Ответы будут даны в следующем блоге этой серии.
Ответы будут даны в следующем блоге этой серии.
- Хорошим соотношением для соляной ванны, используемой в старинных мороженицах, является пять чашек льда на одну чашку соли. Какова массовая доля полученной смеси?
- Какова моляльность этиленгликоля для раствора, который замерзает при –5,00 °C?
Вот ответы на контрольные задачи из прошлого поста по химическим реакциям.
1. Рассчитайте молекулярную массу ацетаминофена. Является ли элемент с наибольшим числом атомов также и элементом с наибольшим массовым процентом?
Может возникнуть соблазн выполнить два запроса Wolfram|Alpha, если только вы не помните, что количество атомов и молекулярная масса вычисляются во время расчета массового состава.
Молекулярная масса 151,165 ед. Водород имеет наибольшее количество атомов, но дает наименьшую общую массу. Это результат того, что атомная масса водорода очень мала.
2. Каков предельный реагент и теоретический выход, когда 24,8 г белого фосфора и 0,200 моль кислорода реагируют с образованием 10,0 г пятиокиси фосфора?
Подобно первой проблеме, сначала можно подумать, что необходимо отправить несколько запросов Wolfram|Alpha. Но на самом деле оба ответа можно вычислить одновременно. Обратите внимание, что Wolfram|Alpha вычисляет химические формулы, выполняет химические преобразования и уравновешивает химическое уравнение автоматически.
Но на самом деле оба ответа можно вычислить одновременно. Обратите внимание, что Wolfram|Alpha вычисляет химические формулы, выполняет химические преобразования и уравновешивает химическое уравнение автоматически.
Ограничивающим реагентом является кислород, и теоретический выход продукта составляет 11,36 грамма.
Увидимся в нашем следующем посте, когда мы продолжим структуру и соединение. Если у вас есть предложения по другим пошаговым материалам (по химии или другим предметам), сообщите нам об этом! Вы можете связаться с нами, оставив комментарий ниже или отправив отзыв внизу любой страницы запроса Wolfram|Alpha.
Этот пост был написан командой Wolfram|Alpha Chemistry.
Глобальные проблемы, решения в области химии
Дейдра Блэк, Королевское химическое общество
От продовольственной безопасности и доступа к чистой воде до загрязнения окружающей среды и здоровья человека — наше глобальное общество сталкивается со многими проблемами, в решении которых могут помочь химические науки решения. Чуть более пяти лет назад мы опубликовали нашу дорожную карту «Химия для мира завтрашнего дня» — документ, в котором представлены сотни примеров того, как достижения в области химии будут лежать в основе технологических решений глобальных проблем. С тех пор мы работали, чтобы поддерживать людей на разных этапах карьеры, создавать новые междисциплинарные исследовательские сети, работали с химическим сообществом над выявлением новых областей и выступали в качестве сторонников достижения прогресса в них.
Чуть более пяти лет назад мы опубликовали нашу дорожную карту «Химия для мира завтрашнего дня» — документ, в котором представлены сотни примеров того, как достижения в области химии будут лежать в основе технологических решений глобальных проблем. С тех пор мы работали, чтобы поддерживать людей на разных этапах карьеры, создавать новые междисциплинарные исследовательские сети, работали с химическим сообществом над выявлением новых областей и выступали в качестве сторонников достижения прогресса в них.
В начале 2015 года мы уже можем ожидать еще один год амбициозных и захватывающих мероприятий, направленных на решение глобальных проблем в химическом сообществе. Но почему решение глобальных проблем является для нас приоритетом? Каковы возможности для нас и нашего сообщества? И на какие направления мы обращаем особое внимание? Здесь мы делимся с вами обзором наших планов.
Устойчивое развитие
«Новые технологии открывают возможности для устойчивого развития. Решения, которые они могут создать, и уровни доступа, которые они могут обеспечить, будут иметь решающее значение для нашего видения мира после 2015 года».
Решения, которые они могут создать, и уровни доступа, которые они могут обеспечить, будут иметь решающее значение для нашего видения мира после 2015 года».
Пан Ги Мун, Генеральный секретарь ООН (декабрь 2014 г.)
В начале 21 века ООН поставила свои Цели развития тысячелетия с первоначальной целью 2015 года. Хотя многие из этих целей еще не достигнуты были достигнуты, они придали беспрецедентный импульс диалогу и последующим действиям и прогрессу во всем мире.
После конференции Рио+20 по устойчивому развитию в 2012 г. Рабочая группа открытого состава разработала предложение по целям в области устойчивого развития (ЦУР) на период после 2015 г., которые лягут в основу межправительственного процесса на период после 2015 г. ООН. Ликвидация бедности во всех формах возглавляет этот список. Остальные цели включают в себя множество взаимосвязанных глобальных задач, от искоренения голода, обеспечения образования и расширения прав и возможностей женщин до обеспечения всех водой и энергией и содействия устойчивому производству и потреблению.
Решение этих глобальных проблем потребует активизации усилий в экономической, политической и социальной сферах. Наука также внесет важный вклад в решение многих проблем, например, путем разработки низкоуглеродных технологий, мембран и датчиков для очистки и мониторинга воды и воздуха, новых лекарств и средств диагностики для здравоохранения. Многие из наших мероприятий, запланированных на 2015 год, направлены на развитие науки и технологий в этих областях.
Экономические возможности
«Борьба с изменением климата не только совместима с экономическим ростом, но только путем системной борьбы с изменением климата мы можем обеспечить рост мировой экономики в 21 веке».
Пол Полман, генеральный директор Unilever (апрель 2014 г.)
Существует множество причин для поиска решений глобальных проблем, включая фундаментальные опасения по поводу прав человека и качества жизни сегодня и в будущем. Поэтому решения должны быть ориентированы как на экологическую, так и на экономическую устойчивость.
В то же время разработка новых решений открывает новые экономические возможности, и во всем мире мы наблюдаем растущую связь между исследованиями, инновациями и глобальными вызовами. Например, более одной трети почти 80-миллиардного бюджета программы EU Horizon 2020 предназначено для решения «социальных проблем». В Великобритании «Восемь великих технологий», которые составляют центральный элемент текущей Промышленной стратегии, включают в себя сельское хозяйство и накопление энергии в дополнение к фундаментальной науке, которая обеспечит прогресс в таких областях, как энергетика и здоровье.
Борьба с устойчивостью к антибиотикам
«Если мы не будем действовать, мы столкнемся с почти немыслимым сценарием, когда антибиотики перестанут работать, и мы вернемся в темные века медицины, где излечимые инфекции и травмы снова будут убивать».
Дэвид Кэмерон, премьер-министр Великобритании (июль 2014 г.)
Устойчивость к антибиотикам или, в более широком смысле, устойчивость к противомикробным препаратам (УПП) представляет собой глобальную угрозу. Потребуются люди из разных научных дисциплин, а также из академических кругов, промышленности и клинической практики, которые будут работать вместе, чтобы найти решение этой проблемы. Химия играет центральную роль не только в улучшении диагностики, но и в понимании УПП и его причин, разработке новых методов лечения и стратегий смягчения последствий. Вот почему мы сделали это приоритетом в нашей деятельности по защите интересов и поддержке сообщества в 2015 году.
Потребуются люди из разных научных дисциплин, а также из академических кругов, промышленности и клинической практики, которые будут работать вместе, чтобы найти решение этой проблемы. Химия играет центральную роль не только в улучшении диагностики, но и в понимании УПП и его причин, разработке новых методов лечения и стратегий смягчения последствий. Вот почему мы сделали это приоритетом в нашей деятельности по защите интересов и поддержке сообщества в 2015 году.
С ноября мы объединились с шестью другими научными обществами, включая Общество биологии и Британское общество противомикробной химиотерапии, в партнерстве, чтобы возглавить борьбу с УПП, поддерживая исследователей и взаимодействуя с правительством и другими спонсорами исследований для добиться финансовой и политической поддержки исследовательского сообщества УПП.
Узнайте больше о нашей работе в области УПП и здравоохранения в целом.
Смягчение последствий изменения климата
«… если мы продолжим наш текущий путь, к 2050 году прибрежная недвижимость в США стоимостью от 66 до 106 миллиардов долларов будет находиться ниже уровня моря, а к 2100 году недвижимость на сумму 238-507 миллиардов долларов окажется ниже уровня моря».
Отчет о рискованном бизнесе (июль 2014 г.)
Еще одним приоритетным направлением является смягчение последствий изменения климата. Например, химики уже работают над новыми решениями в области энергетики и сокращения выбросов углерода, а также помогают сельскохозяйственным культурам переносить меняющиеся условия. Мы хотим поддержать сообщество ученых-химиков в разработке технологий для адаптации к изменению климата и смягчения его последствий.
В прошлом году наш президент Доминик Тилдесли и его предшественники Лесли Йеллоулиз и Дэвид Филлипс опубликовали официальное заявление, в котором говорилось, что «огромное количество научных данных указывает на то, что деятельность человека является основной причиной недавнего изменения климата». Заявление было подписано Джеффри Мейтлендом, президентом Института инженеров-химиков, и его предшественниками.
Узнать больше
Когда в мае Всемирная организация здравоохранения представит свой проект глобального плана действий по борьбе с устойчивостью к противомикробным препаратам, а в декабре в Париже начнется конференция ООН по изменению климата, мы знаем, что химики всего мира будут участвовать в разработке эти и многие другие глобальные вызовы.

 в.)= m(р-ра) *w
в.)= m(р-ра) *w в. )
в. ) Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.