Задачи на смеси (задание № 33)
Похожие презентации:
Задачи, включаемые в задание 33 тестов ЕГЭ
Задачи на смеси и сплавы
Задачи на сплавы и смеси
Текстовые задачи. Задачи на смеси и сплавы
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Электролиз. Расчетные задачи
Химическая термодинамика. Задачи
Задачи на «избыток-недостаток»
Олимпиадные задачи муниципального этапа по химии
Решение расчетных задач по уравнениям реакций
1. ЗАДАЧИ НА СМЕСИ (задание № 33)
Выполнила учитель химииМАОУ СОШ №25
Журавлева Л.А.
2. ЗАДАЧИ НА СМЕСИ
Тип IВ реакцию
вступает
один компонент
смеси
Тип II
В реакцию
вступает
несколько компонентов
смеси
(параллельные реакции)
Тип III
Комбинированные задачи
3. Типичные ошибки
• Попытка записать оба вещества в однуреакцию. «Смесь оксидов кальция и бария
растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2h3O
Это ошибка, ведь в этой смеси могут быть
любые количества каждого оксида.
 А в
А вприведенном уравнении предполагается, что
их равное количество.
• Предположение, что мольное соотношение веществ соответствует
коэффициентам в уравнениях
реакций.
Например:
Zn + 2HCl = ZnCl2 + h3
2Al + 6HCl = 2AlCl3 + 3h3
Количество цинка принимается за х, а
количество алюминия — за 2х (в
соответствии с коэффициентом в уравнении
реакции). Это тоже неверно. Эти количества
могут быть любыми, и они никак между
собой не связаны.
• Попытки найти «количество вещества
смеси», поделив её массу на сумму
молярных масс компонентов.
Это действие вообще никакого смысла не
имеет. Каждая молярная масса может
относиться только к отдельному веществу
(если это не газовая смесь – молярная масса
смеси!).
6. РЕШЕНИЕ ЗАДАЧ I ТИПА (в реакцию вступает один компонент смеси)
• I. 1. Смесь алюминия и железа обработали избытком соляной кислоты,при этом выделилось 8,96 л газа (н.у.).
Это же количество смеси обработали
избытком раствора гидроксида натрия,
выделилось 6,72 л газа (н.
 у.). Найти
у.). Найтимассовую долю железа в исходной
смеси.
7. РЕШЕНИЕ ЗАДАЧ I ТИПА (в реакцию вступает один компонент смеси)
• I. 2. Смесь карбоната и гидрокарбоната калия массой 320г прокалили допостоянной массы. Масса остатка
после прокаливания составила 293,6г.
Определите массовую долю средней
соли в смеси.
8. РЕШЕНИЕ ЗАДАЧ II ТИПА (параллельные реакции)
• C реагентом (реагентами) взаимодействуют всекомпоненты смеси. Для определения порций
отдельных компонентов используется
алгебраический алгоритм.
Решают задачи такого типа с использованием
двух (х и у) или одной (х) переменной.
В качестве неизвестной величины лучше всего
выбрать количество вещества.
9. Алгоритм 1. Решение через систему уравнений с двумя неизвестными (подходит для любой задачи такого типа)
1. Составить уравнения реакций.2. Количества веществ (ν) в исходной смеси
обозначить через х, у моль и, согласно мольным соотношениям в уравнениях реакций
выразить через х, у моль количества веществ
в образовавшейся смеси.

3. Составить математические уравнения. Для
этого следует выразить массу (или объем) веществ через х, у и молярную массу (молярный объем) по формулам:
m = ν • M;
V = ν•Vm.
4. Составить систему уравнений и решить ее.
5. Далее решать согласно условию задачи.
11. РЕШЕНИЕ ЗАДАЧ II ТИПА (параллельные реакции)
• II. 1. Пластинку из магниево-алюминиевого сплава массой 3,9 г поместилив раствор соляной кислоты. Пластинка
растворилась, и выделилось 4,48 л
газа. Найти массовые доли металлов в
сплаве.
12. РЕШЕНИЕ ЗАДАЧ II ТИПА (параллельные реакции)
• II. 2. К раствору, содержащему 5,48гсмеси сульфата и силиката натрия,
прибавили избыток хлорида бария, в
результате образовалось 9,12г осадка.
Найти массы солей в исходной смеси.
13. Алгоритм 2. Решение через уравнение с одним неизвестным (подходит только для задач, в которых можно найти общее количество
продукта,образующегося во всех
параллельных реакциях)
1.
 Составить уравнения реакций.
Составить уравнения реакций.2. Найти количество образовавшегося
вещества.
3. Обозначить количество вещества, получившегося в результате одной реакции, через х
моль, тогда количество вещества, получившегося в результате второй реакции, будет
равно: (νобщ – х) моль. Выразить, согласно
уравнениям реакций, количества веществ в
исходной смеси.
4. Выразить массы веществ, составить и
решить уравнение с одним неизвестным.
15. ТИП III. КОМБИНИРОВАННЫЕ ЗАДАЧИ
• III. 1. При обработке 17,4 г смесиалюминия, железа и меди избытком
соляной кислоты выделилось 8,96 л
(н.у.). Не растворившийся в соляной
кислоте остаток растворился в
концентрированной азотной кислоте с
выделением 4,48 л газа (н.у.). Определите состав исходной смеси (в %).
16. ЗАДАЧИ НА КИСЛЫЕ СОЛИ
Эти задачи можно решать разными способами.В любом случае вначале нужно составить уравнения всех возможных реакций, найти количества реагирующих веществ и, сравнив их соотношение с числом моль по уравнению, определить,
какие соли получаются.

При более простом варианте (алгоритм 1)
можно не учитывать последовательность протекания реакций, исходить из предположения,
что одновременно происходят две реакции, и
использовать алгебраический способ решения.
17. Алгоритм 1 (Параллельные реакции)
1. Составить уравнения всех возможных реакций.2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество вещества одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества веществ реагентов или получившихся солей согласно молярным соотношениям по уравнениям.
5. Составить и решить систему уравнений с двумя
неизвестными, найти количества реагирующих
веществ, затем количества получившихся солей.
Далее решать задачу согласно условию.
19. ЗАДАЧИ НА КИСЛЫЕ СОЛИ
• Задача 1. Газ, полученный при сжигании 19,2 г серы в избытке кислорода,без остатка прореагировал с 682,5 мл
5%-го раствора гидроксида натрия
(плотность 1,055 г/мл).
 Определите
Определитесостав полученного раствора и рассчитайте массовые доли веществ в этом
растворе.
• При более сложном для понимания, но более
глубоко раскрывающем химизм происходящих
процессов способе решения нужно учитывать то,
что в некоторых случаях продукты реакции зависят от порядка смешивания веществ. Нужно
учитывать последовательность реакций, протекающих при взаимодействии многоосновной
кислоты и щелочи. Так, при постепенном
добавлении гидроксида натрия к раствору
фосфорной кислоты будут протекать реакции:
h4PO4 + NaOH = Nah3PO4 + h3O
Nah3PO4 + NaOH = Na2HPO4 + h3O
Na2HPO4 + NaOH = Na3PO4 + h3O
• При обратном же порядке смешивания
реагентов последовательность протекания и
сами реакции будут иными:
3NaOH + h4PO4 = Na3PO4 + 3h3O
2Na3PO4 + h4PO4 = 3Na2HPO4
Na2HPO4 + h4PO4 = 2Nah3PO4
Если образующаяся соль нерастворима, то
вначале образуется осадок – средняя соль, а
затем кислая соль.
22. Алгоритм 2 (Последовательные реакции.
 Нейтрализация щелочи) 1. Составить уравнение реакции образования
Нейтрализация щелочи) 1. Составить уравнение реакции образованиясредней соли.
Количество вещества средней соли и количество
вещества прореагировавшей кислоты или кислотного оксида рассчитывается по количеству
вещества щелочи.
2. Найти количество вещества оставшейся
(непрореагировавшей) кислоты или кислотного
оксида:
νост = νисх – νпрореаг
Составить уравнение реакции избытка кислоты
или оксида со средней солью.
3. По количеству вещества избытка кислоты или
кислой соли и количество прореагировавшей
средней соли.
4. Найти количество вещества оставшейся средней соли.
Алгоритм 3
(Последовательные реакции.
Нейтрализация кислоты.)
1. Составить уравнение реакции образования
кислой соли.
2. Найти количество вещества избытка
щелочи (оставшейся):
νост = νисх – νпрореаг
Составить уравнение реакции избытка
щелочи с кислой солью.
3. По количеству щелочи найти количество
вещества средней соли и количество
прореагировавшей кислой соли.

4. Найти количество вещества оставшейся
кислой соли.
English Русский Правила
Задачи «на смеси и сплавы» с решениями.
Довольно часто приходится смешивать различные жидкости, порошки, разбавлять что-либо водой или наблюдать испарение воды. В задачах такого типа эти операции приходится проводить мысленно и выполнять расчёты.
Итак, пусть смесь массы М содержит некоторое вещество массой m. Тогда:
- концентрацией данного вещества в смеси (сплаве) называется величина c=m/M;
- процентным содержанием данного вещества называется величина с?100%;
Из последней формулы следует, что при известных величинах концентрации вещества и общей массы смеси (сплава) масса данного вещества определяется по формуле
Задачи на смеси (сплавы) можно разделить на два вида:
- Задаются, например, две смеси (сплава) с массами m1 и m2 и с концентрациями в них некоторого вещества, равными соответственно с1 и с2.
 Смеси (сплавы) сливают (сплавляют). Требуется определить массу этого вещества в новой смеси (сплаве) и его новую концентрацию. Ясно, что в новой смеси (сплаве) масса данного вещества равна c1m1+c2m2, а концентрация c=(c
Смеси (сплавы) сливают (сплавляют). Требуется определить массу этого вещества в новой смеси (сплаве) и его новую концентрацию. Ясно, что в новой смеси (сплаве) масса данного вещества равна c1m1+c2m2, а концентрация c=(c - Задается некоторый объем смеси (сплава) и от этого объема начинают отливать (убирать) определенное количество смеси (сплава), а затем доливать (добавлять) такое же или другое количество смеси (сплава) с такой же концентрацией данного вещества или с другой концентрацией. Эта операция проводится несколько раз.
При решении таких задач необходимо установить контроль за количеством данного вещества и его концентрацией при каждом отливе, а также при каждом доливе смеси. В результате такого контроля получаем разрешающее уравнение. Рассмотрим конкретные задачи.

Из сосуда ёмкостью 54 литра, наполненного кислотой, вылили несколько литров и доли сосуд водой. Потом опять вылили столько же литров смеси. Тогда в оставшейся в сосуде смеси оказалось 24 литра чистой кислоты. Сколько кислоты вылили в первый раз?
Решение.
Пусть x литров кислоты вылили в первый раз. Тогда в сосуде осталось (54-x) литров. Долив сосуд водой, получим 54 литра смеси, в которой растворилось (54-х) литров кислоты. Значит в одном литре смеси содержится (54-x)/54литров кислоты. Всего за два раза вылили 54-24=30 литров кислоты. В результате получили уравнение: x+x(54-x)/54=30
Решив это уравнение, найдём два корня: х=90 и х=18. Ясно, что значение 90 не удовлетворяет условию задачи.
Ответ: в первый раз было вылито 18 литров воды.
При решении задач на смеси считается, что рассматриваемые смеси однородны: не делается различия между литром как единицей массы и как единицей ёмкости. Концентрацией вещества называется отношение массы этого вещества к массе всей смеси (раствора, сплава). Концентрация вещества, выраженная в процентах, называется процентным отношением вещества в смеси (растворе, сплаве).
Концентрация вещества, выраженная в процентах, называется процентным отношением вещества в смеси (растворе, сплаве).
Задача №2
В каких пропорциях нужно смешать раствор 50%-й и 70%-й кислоты, чтобы получить раствор 65%-й кислоты?
Решение.
1 способ
Пусть х г – масса 50%-й кислоты, y г – масса 70%-й кислоты, 0,5х г – масса чистой кислоты в первом растворе, (x+y)г – масса смеси, 0,65(x+y)г – масса чистой кислоты в смеси. Составим уравнение (рис. 6а):
0,5x+0,7y=0,65(x+y)
Получаем соотношение 1:3.
Ответ: 1:3.
Существует и другой способ решения этой задачи. Он называется арифметическим (или старинным) способом.
2 способ
Обоснуем старинный способ решения задач «на смеси».
Пусть требуется смешать растворы а%-й и b%-й кислот, чтобы получить
с%-й раствор.
Пусть х г – масса а%-го раствора, y г – масса b%-го раствора, ax/100 г – масса чистой кислоты в первом растворе, а by/100 г – масса чистой кислоты во втором растворе, c(x+y)/100 г – масса чистой кислоты в смеси.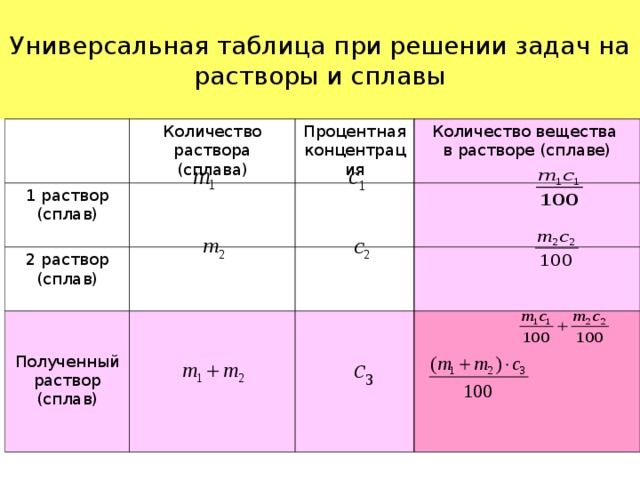
ax/100+by/100=c(x+y)/100
,
при упрощении которого станет ясно, что x:y=(b-c):(c-a).
Задача №3.
Имеется два сплава, состоящие из цинка, меди и олова. Известно, что первый сплав содержит 40% олова, а второй – 26% меди. Процентное содержание цинка в первом и во втором сплавах одинаково. Сплавив 150 кг первого сплава и 250 кг второго, получили новый сплав, в котором оказалось 30% цинка. Определите, сколько килограммов олова содержится в получившемся новом сплаве.
Решение.
Пусть х кг – количество олова в новом сплаве. Так как новый сплав весит 400 кг и в нём находится 30 % цинка, то он содержит 400*30/100=120 кг, а во втором сплаве (120-y) кг цинка. По условию задачи процентное содержание цинка в двух сплавах равно, следовательно, можно составить уравнение: 100y/150=100(120-y)/250
Из этого уравнения находим, что у=45. Поскольку первый сплав содержит 40% олова, то в 150 кг первого сплава олова будет 150*40/100=60 кг, а во втором сплаве олова будет (х-60) кг.
х-60+75+65=250, откуда х=170 кг
Ответ: 170 кг.
Задача №4.
В 500 кг руды содержится некоторое количество железа. После удаления из руды 200 кг примесей, содержащих в среднем 12,5 % железа, содержание железа в оставшейся руде повысилось на 20 %. Определите, какое количество железа осталось ещё в руде?
Решение.
Сначала составим таблицу, в которой напишем массу руды, массу железа, концентрацию (долю железа в рудеапишем массу руды, массу железа, концентрацию () руде?
нем 12,5 % железа, содержание железа в оставшейся руде повысилось на 20) до и после удаления примесей.
|
|
Масса руды, кг |
Масса железа, кг |
Концентрация (доля железа в руде) |
|
Руда |
500 |
х |
x/500 |
|
Руда после удаления примесей |
500-200=300 |
х-0,125?200=x-25 |
(x-25)/300 |
Пусть х кг – масса железа в руде. Так как масса всей руды равна 500 кг, то концентрация железа в ней равна x/500%.
Так как масса всей руды равна 500 кг, то концентрация железа в ней равна x/500%.
Так как масса железа в 200 кг примесей равна 0,125?200=25 (кг), то его масса в руде после удаления примесей равна (х-25) кг. Из того, что масса оставшейся руды равна 500-200=300 кг следует, что концентрация железа в ней равна (x-25)/300.
По условию, содержание железа в оставшейся руде повысилось на 20%=1/5. Составим уравнение:
(x-25)/300-1/5=x/500,
5(x-25)-300=3x
x=212,5
Найдём, что х=212,5 кг – масса железа в руде.
Найдём остаток железа в руде после удаления примесей:
212,5-25=187,5 (кг)
Ответ: 187,5 кг.
Мы решили вторую задачу путём составления таблицы, помогающей зрительно воспринимать задачу.
Вывод: задачи «на смеси и сплавы» решаются множеством способов, но в них всегда присутствует концентрация (доля содержания одного вещества в другом), и они всегда решаются путём составления уравнений.
Лучшие смеси и растворы Занятия и уроки
Ищете занятия со смесями и растворами?
Смеси и растворы, вероятно, одна из тех единиц, о которых ваши ученики ничего не знали в начале , но к концу она стала одной из их самых любимых!
Смеси и растворы для обучения могут стать забавным практическим пособием для вашего класса.
Как и у любого предмета, определенно есть сложные концепции, чтобы усвоить , но к включая практические занятия и уроки , которые привлекут их внимание с самого начала , есть , несомненно, смеси и решения, которые они всегда будут помнить. 🙂
Этот пост даст вам несколько идей для вводного урока, ресурсы для оценки , а также другие действия, которые можно использовать во всем вашем отделе смесей и растворов.
Кроме того, не забудьте ознакомиться с моим сообщением в блоге о сопоставлении учебных программ по естественным наукам – . Нажмите здесь, чтобы прочитать .
Вы и ваши ученики будете веселиться! Смеси и растворы и вводные уроки не легко отделить.
Определенно есть словарных терминов которые вы захотите внедрить в свой блок до научите своих учеников:
- Смесь – Все, что сделано путем объединения 2 или более разных вещей
- Раствор – Смесь двух или более видов частиц, равномерно распределенных
- Растворенное вещество – вещество, растворенное в растворе (т.
 е. соль в соленой воде)
е. соль в соленой воде) - Растворитель – вещество, осуществляющее растворение (т. е. вода в соленой воде)
- Растворенное вещество – вещество, растворенное в растворе (т.
Вот несколько способов, которыми вы можете представить свое устройство , чтобы помочь оживить эти словарных терминов :
Snack Mix и Kool-Aid
Есть ли лучший способ представить устройство, чем устройство? с закусками и напитками?
Не думаю. 😉
Для имитации создания смеси принесите ингредиенты, чтобы приготовить смесь для закусок со своим классом.
Брецели, M&M’s, хлопья Chex, Cheerios – любое сочетание, которое предпочитаете вы и ваш класс!
Обсудите со своими учениками идею о том, что смесь содержит 2 или более веществ и что они никогда не меняют свой состав или химический состав, комбинируя их.
Вы также можете объяснить, что когда вы зачерпываете чашку смеси для закусок , есть неравные части к смеси .
Пусть каждый ученик возьмет чашку и разделит ингредиенты, которые им дали.
Некоторые студенты, возможно, получили больше кренделей, в то время как другие, возможно, получили больше M&M’s!
Для приготовьте раствор , возьмите кувшин с водой, 1 пакетик смеси Kool-Aid и сахарный песок – измерьте сахар сердцем!
Я рекомендую готовить раствор в прозрачном кувшине или контейнере , если он у вас есть, чтобы ваши учеников могли видеть, что происходит внутри.
Начните с того, что высыпьте сахар из чашки в кувшин с водой.
Ничего не перемешивайте до самого конца эксперимента!
Затем добавьте пакет порошка Kool-Aid.
Обсудите со своим классом то, что вы видите – сахар, вероятно, осел на дне кувшина, а смесь Kool-Aid окрасила воду в цвет Kool-Aid.
Наконец, перемешайте воду, сахар и смесь Kool-Aid.
Это будет представлять растворенное вещество и растворитель, создающие раствор.
Когда учащиеся получат по чашке раствора сейчас, они смогут отведать равные части всех продуктов вместе взятых!
Холодильник Гипотезы и наблюдения
В качестве еще одной вводной идеи для вашего блока смесей и растворов попросите ваших учеников просмотреть содержимое своих холодильников дома.
Попросите их составить и записать гипотезу о том, что, по их мнению, некоторые продукты или приправы находятся в их холодильниках.
Является ли приправа для ранчо смесью или раствором?
Как насчет запеканки с картошкой?
Или суп, который они ели прошлой ночью? 🙂
Учащиеся могут выдвигать свои гипотезы дома , возвращать их в школу , обсуждать свои выводы всем классом определять, какие продукты являются смесями, а какие растворами!
Манипулятивные смеси
Я считаю важным, чтобы ваши ученики осознали, что смеси и растворы — это больше, чем просто продукты питания.
Один из способов объяснить это – попросить ваших учеников создать смесь небольших манипуляций, которые есть у вас в классе.
Например, разложите различных контейнеров с игральными костями, фишками для бинго, лего, единицами с основанием — любыми небольшими манипуляторами, которые у вас есть или которые вы можете одолжить для этого урока.
Тогда пусть ваши ученики создадут свои собственные смеси!
Можно попросить их взять по горсти из каждого контейнера и и сложить их вместе на своем столе.
Это похоже на действие смеси для закусок – в смеси неравных частей.
Ресурсы для оценки и деятельность подразделений
Смеси и решения для Google Classroom
Чтобы ваш блок смесей и растворов был веселым и интерактивным, я всегда предлагаю использовать оценки, которые ваши ученики не будут воспринимать как оценки. 😉
😉
Этот ресурс Google Classroom включает словарных работ , примеров сортировки смесей и растворов, диаграммы Венна, вопросы с краткими ответами и многое другое!
Конечно, у вас нет этого ресурса для оценки — он может быть отличным инструментом для быстрой домашней работы задания или даже групповая работа тоже!
Если вы хотите увидеть фотографии, а также более подробное объяснение ресурса, вы можете найти его здесь!
Интерактивная тетрадь для смесей и растворов
Другим вариантом, который вы можете использовать в качестве оценки или дополнительного задания, является интерактивная тетрадь для смесей и растворов.
Основное внимание уделяется словарному запасу, вопросам критического мышления , а также , идентифицирующих данные предметы как смеси или растворы.
Он также поставляется с 3 уровнями дифференциации и ключами ответов так что вы готовы независимо от того, как вы решите использовать его в своем подразделении.
Вы можете просмотреть предварительный просмотр здесь !
Мне всегда казалось, что мои ученики лучше всего справляются со своей работой, когда они чувствовали, что не сдают тест , , но могут получать удовольствие от заполнения своих интерактивных тетрадей на том уровне, который им больше всего подходит. 🙂
Эксперименты с водой
Наконец, чтобы добавить к вашему списку интерактивных действий со смесями и растворами – экспериментов с водой!
Это поможет вашим учащимся понять, что смеси — это не просто соединенные твердые объекты, а растворы — это не просто жидкости.
Проведите эксперименты , добавляя различных веществ в маленьких стаканов воды , чтобы увидеть что растворяется, а что нет.
Обязательно используйте прозрачные пластиковые чашки или стаканы!
Пусть ваши учеников выдвинут гипотезу , запишут свои наблюдения , а найдут ответ.
Некоторые из вещей, с которыми вы можете смешивать воду, могут быть мукой, пищевыми красителями, песком, сахаром, краской – все, что вы думаете!
Ваши ученики удивятся, когда увидят, что не все растворяется в воде, что некоторые жидкости на самом деле могут быть смесями, а не растворами!
Я надеюсь, что вы покинете этот пост с тоннами смесей и растворов, действий и идей для вашего научного подразделения!
Ваши учеников быстро станут одержимы практическим обучением , и к концу вашего модуля у вас будет классов, полных ученых. 😉
Приятного обучения!
Смеси и растворы | CPD
Каким образом знание химических смесей предотвратило крупный инцидент в лондонском метро?
Когда случайная утечка влажного быстросохнущего бетона затопила диспетчерскую станции лондонского метрополитена Виктория, сообразительность инженеров и их химические знания предотвратили полную катастрофу. Они подмешали в бетон большое количество сахара, что замедлило процесс схватывания и дало им время на устранение разлива.
Они подмешали в бетон большое количество сахара, что замедлило процесс схватывания и дало им время на устранение разлива.
Когда случайная утечка влажного, быстросохнущего бетона затопила диспетчерскую станции лондонского метро Виктория, сообразительность и химические знания инженеров предотвратили полную катастрофу. Они подмешали в бетон большое количество сахара, что замедлило процесс схватывания и дало им время на устранение разлива. (Читать полностью: rsc.li/EiC-concrete)
Смеси и растворы – обычное явление в нашей повседневной жизни. Это воздух, которым мы дышим, еда и напитки, которые мы потребляем, и ткани, которые мы носим. Изучая, как химики отличают чистые вещества от смесей и растворов, студенты начнут понимать, как материя организована на атомном уровне. Обладая этими знаниями, мы можем манипулировать материей, чтобы улучшить свое здоровье и качество жизни.
Что нужно знать учащимся о смесях и растворах?
- Смеси – это материалы, которые содержат два или более химических вещества, диспергированных между собой (смешанных вместе).

- Если при смешивании двух материалов не происходит химической реакции, они образуют смесь. Химические свойства компонентов не меняются.
- Смеси можно разделить физическими методами.
- Существует два основных типа смесей: гомогенные и гетерогенные.
- Гомогенные смеси: частицы веществ смешаны друг с другом (нет комкования частиц) – например, воздух.
- Растворы – это гомогенные смеси: частицы одного вещества (растворенного вещества) смешиваются с частицами другого вещества (растворителя) – например, соленой воды.
- Гетерогенные смеси: большие скопления (комки) веществ смешиваются друг с другом – например, эмульсии типа масла в воде.
Когда учащиеся изучают, как правильно использовать технический язык, количество новых слов, которые нужно выучить, и требуемая точность их использования могут пугать их. Слово «вещь» является полезной отправной точкой: хотя это и не общепринятый научный термин, оно имеет осязаемое значение для большинства студентов, поэтому является полезным лингвистическим трамплом.
Учащиеся понимают, что мир состоит из вещества, а разные вещества обладают разными свойствами. Наша задача — помочь им выйти за пределы своего представления о мире, основанного на их чувствах, в субмикроскопический мир, где разные химические вещества устроены по-разному. Пакет «Материалы и субстанции» программы Gatsby Science Enhancement Program предлагает множество простых действий и анимаций.
Учащиеся понимают, что мир состоит из вещей, а разные вещи обладают разными свойствами. Наша задача — помочь им выйти за пределы своего представления о мире, основанного на их чувствах, в субмикроскопический мир, где разные химические вещества устроены по-разному. Пакет «Материалы и вещества» Программы развития науки Гэтсби предоставляет множество простых действий и анимаций (bit.ly/2DoV2o1).
Идеи для занятий в классе
Источник: Дэвид Патерсон
Использование физических моделей дает учащимся возможность развить свое понимание. Например, подарите им набор горшков, содержащих одинаковые простые бусины, бусины одинакового размера, но разного цвета, а также бусины одного цвета, но разных размеров.
После того, как у них было пару минут, чтобы посмотреть на них и обсудить, задать вопросы …
Какой из горшков содержит смеси? Как вы можете сказать? Какие свойства содержимого вы используете, чтобы принять это решение?
Учащиеся должны назвать последние две бусины смесью, так как они содержат бусины разного размера или цвета. Попросите учащихся представить классу свои рассуждения и попросите других согласиться или не согласиться и объяснить, почему. Бросьте вызов тем, кто представляет изощренные аргументы, чтобы расширить свои рассуждения. Например, для третьего горшка: «Достаточно ли сказать, что бусины разные, потому что они разного размера?» Стали бы вы приводить такой же аргумент в пользу яблок разного размера?» Этот тип вопросов может помочь учащимся выйти за рамки поверхностных свойств и рассмотреть, существуют ли другие, более важные свойства объектов и веществ.
Повторите упражнение и дополните его более «химическими» примерами, предоставив учащимся запечатанные пробирки с солью, песком, солью и песком, а также кусочки цинка и медную стружку.
В вашем классе
Хотите попробовать это задание со своим классом? Загрузите слайды PowerPoint для пошагового руководства в классе (ppt или pdf).
Хотите попробовать это задание со своим классом? Загрузите слайды PowerPoint для пошагового руководства для занятий (rsc.li/2Gnctsm).
Когда учащиеся смогут определять и объяснять смеси, переходите к свойствам смесей. Учащиеся должны понимать, что вещества в смесях сохраняют свои свойства, а свойства смеси представляют собой совокупность этих свойств. Реальные примеры могут помочь студентам с этими понятиями. Например, сахар сладкий, вода влажная, раствор сахара сладкий и влажный. Упражнение «Разделение смесей» в Learn Chemistry обеспечивает полезную подсказку для понимания учащимися.
Когда учащиеся смогут определять и объяснять смеси, переходите к свойствам смесей. Учащиеся должны понимать, что вещества в смесях сохраняют свои свойства, а свойства смеси представляют собой совокупность этих свойств. Реальные примеры могут помочь студентам с этими понятиями. Например, сахар сладкий, вода влажная, раствор сахара сладкий и влажный. Упражнение «Разделение смесей» в Learn Chemistry предоставляет полезную подсказку для понимания учащимися (rsc.li/2tIg0yJ).
Реальные примеры могут помочь студентам с этими понятиями. Например, сахар сладкий, вода влажная, раствор сахара сладкий и влажный. Упражнение «Разделение смесей» в Learn Chemistry предоставляет полезную подсказку для понимания учащимися (rsc.li/2tIg0yJ).
Продемонстрируйте приготовление растворов путем растворения сахара в воде и наоборот путем осторожного нагревания небольших объемов раствора в чашках для выпаривания. Покажите смешивающиеся жидкости (жидкости, которые смешиваются) и несмешиваемые жидкости (жидкости, которые не смешиваются) путем смешивания спирта и воды, масла и воды соответственно. Продемонстрируйте другие виды смесей, такие как суспензии, гели и пены, с мукой в воде, желе и взбитых сливках.
В ходе изучения химии учащиеся столкнутся со многими примерами смесей, что даст им регулярную возможность закрепить свое понимание смесей и растворов.
Например:
- воздух – это однородная смесь, содержащая кислород, азот, аргон и другие газы;
- железных опилок с порошком серы – обычно используемая гетерогенная смесь;
- соленая вода представляет собой раствор, содержащий частицы соли, смешанные с частицами воды.

Предложите учащимся найти собственные примеры из своего дома.
В вашем классе
Нужно вдохновение для планирования урока? Загрузите этот пример плана урока, который включает эти идеи (MS Word или pdf).
Нужно вдохновение для планирования урока? Загрузите этот пример плана урока, который включает эти идеи (rsc.li/2Gnctsm).
Распространенные заблуждения
Большинство «чистых» материалов, с которыми мы сталкиваемся в повседневной жизни, на самом деле представляют собой смеси нескольких химических веществ. Разница между бытовой чистотой (например, «100% чистый апельсиновый сок») и химической чистотой (т. е. материалами, содержащими частицы только одного химического вещества) вызывает значительную путаницу. Полезно подчеркнуть, что изучение науки — это не только изучение нового языка, но и изучение понятий и навыков.
Когда образуются растворы, многие учащиеся думают, что масса растворенного вещества теряется, когда оно растворяется в растворе, хотя они с готовностью описывают сладкую воду как сладкую на вкус. Они редко осознают, что свойства смеси зависят от ее точного состава.
Они редко осознают, что свойства смеси зависят от ее точного состава.
Наконец, учащиеся редко признают воду (очень распространенный растворитель) частицей. Нарисованные учащимися изображения растворения сахара в воде часто показывают частицы сахара на непрерывном фоне воды.
Химические заблуждения содержит много полезных идей и рабочих листов, которые помогут диагностировать мышление учащихся. Разделы «Элементы, соединения и смеси» (rsc.li/1pXL7iV) и «Масса и растворение» (rsc.li/2HuAT2F) особенно полезны.
Пример диагностического вопроса
У вас есть стакан с водой весом 200 г. Вы добавляете 10 г сульфата меди в стакан с водой. Сначала в воде можно увидеть твердое вещество сульфата меди, но через 10 минут твердое вещество исчезает, и вода становится синей.
Какова масса стакана и его содержимого при первом добавлении сульфата меди? Какова масса, когда все это окончательно растворится в воде? Объясните свои ответы.
Формирующее оценивание
Учащиеся не получат четкого представления о смесях и растворах, когда впервые столкнутся с этими идеями.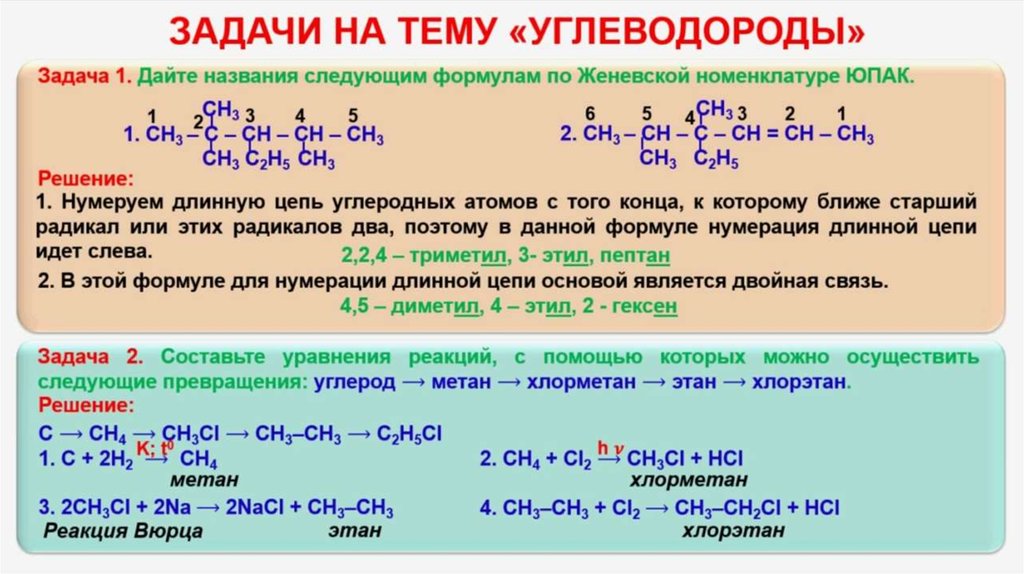 Регулярная формирующая оценка поможет им развить свое понимание. Например, попросите учащихся:
Регулярная формирующая оценка поможет им развить свое понимание. Например, попросите учащихся:
- написать объяснение для описания материала как смеси или раствора;
- нарисовать диаграмму частиц вещества, четко различая различные компоненты;
- пройти небольшой тест по определениям ключевых слов.
Затем предоставьте им обратную связь и попросите их выполнить задание заново.
Повышение до 14–16 лет
Природа химических веществ — фундаментальное понятие в химии, лежащее в основе большей части химии 14–16 лет. Понятия элементов, соединений, атомов и молекул добавят понимания смесей и растворов, наряду с методами разделения. Эти концепции будут закреплены и контекстуализированы в возрасте 14–16 лет, когда учащиеся изучают такие материалы, как сырая нефть и каменные руды. Учащиеся также должны понимать природу химических моделей. Подумайте о том, чтобы освежить свои знания в этой области с помощью бесплатного онлайн-курса «Разработка и использование моделей».
Природа химических веществ является фундаментальным понятием в химии, лежащим в основе большей части химии 14–16. Понятия элементов, соединений, атомов и молекул добавят понимания смесей и растворов, наряду с методами разделения. Эти концепции будут закреплены и контекстуализированы в возрасте 14–16 лет, когда учащиеся изучают такие материалы, как сырая нефть и каменные руды. Учащиеся также должны понимать природу химических моделей. Подумайте о том, чтобы освежить свои знания в этой области с помощью бесплатного онлайн-курса «Разработка и использование моделей» (rsc.li/CPD-models).
Пункты самовывоза
- Смеси — это материалы, которые содержат два или более химических вещества, смешанных вместе (но не прореагировавших вместе). Вещества сохраняют свои химические свойства в смесях.
- Вещества, которые в повседневной жизни называют «чистыми», скорее всего, представляют собой химические смеси.
- Послушайте, как учащиеся используют язык и идеи смесей в классе, и помогите им переосмыслить и перефразировать по мере необходимости.


 Смеси (сплавы) сливают (сплавляют). Требуется определить массу этого вещества в новой смеси (сплаве) и его новую концентрацию. Ясно, что в новой смеси (сплаве) масса данного вещества равна c1m1+c2m2, а концентрация c=(c
Смеси (сплавы) сливают (сплавляют). Требуется определить массу этого вещества в новой смеси (сплаве) и его новую концентрацию. Ясно, что в новой смеси (сплаве) масса данного вещества равна c1m1+c2m2, а концентрация c=(c е. соль в соленой воде)
е. соль в соленой воде)

