Учимся решать задачи 8 класс Решение задач по теме: «Моль. Количество вещества».
Учимся решать задачи 8 класс
Решение задач по теме: «Моль. Количество вещества».
Обозначения:
n- количество вещества, (моль, кмоль, ммоль)
m – масса, ( г, кг, мг)
M – молярная масса, ( г/ моль, кг/ кмоль, мг/ ммоль)
V – объем, (л, м3, см3, мл)
Vм – молярный объем (л/ моль, м3/ кмоль, мл/ ммоль) для любого газа при нормальных условиях (н.у.) равен 22,4 л/моль
N- число частиц (атомы, молекулы, ионы)
NА- постоянная Авогадро равна 6,02.1023 частиц.моль-1
n= m/M n= V/VM n= N/NA
Задача 1. Сколько молекул озона О3 содержится в 72 г его?
Дано:m(О3)= 72г
Решение
1) n (О
M(О3)=16. 3= 48 г/моль
3= 48 г/моль
2) N (О3)=n NA= =1,5моль.6,02.1023молекул.моль-1=9.1023молекул
Ответ: N (О3)= 9.1023молекул
Найти:
N (О3)-?
Задача 2. Какой объем занимают (при н.у.) 280 кг азота?
Дано:m(N2) = 280кг
Решение
n (N2
M (N2) = 14.2= 28 г/моль= 28кг/ кмоль
V (N2)= n .Vм =10кмоль.22,4м3/ кмоль=224 м3
Ответ: V (N2)= 224 м3
Найти:
V (N2) -?
Задача 3. Какую массу имеют 112л (при н. у.) углекислого газа?
у.) углекислого газа?
- Дано:
V (СО2) = 112л
Решение
n (СО2)=V/ Vм
m (СО2) = n.M= 5моль?(12+16.2) г/ моль= 5.44=220г
Ответ: m (СО2) =220г
Найти:
m (СО2)-?
Решите самостоятельно задачи:
1. Хлориду натрия массой 5,85 г соответствует количество вещества:
1) 1 моль; 2) 0,5 моль; 3) 0,1 моль; 4 ) 0,01 моль.
2. Оксиду кальция массой 28 г соответствует количество вещества:
1) 1 моль; 2) 0,1 моль; 3 )2 моль; 4) 0,5 моль.
3. Масса 0,25 моль хлорида меди (II) равна:
1) 64 г; 2) 24,75 г; 3) 24,875 г; 4) 33,75 г.
Ответы:
1. 3
3
2. 4
3. 4
4. Какой объем при н.у. занимают 64г оксида серы (IV)?
5. Какую массу имеют 3 • 1024 молекул углекислого газа (оксида углерода (IV))?
6. Какую массу имеют 44,8 л при н.у. угарного газа (оксид углерода (II))?
7. Какой объем занимают 6 • 1023молекул сероводорода H2S?
9. Какой объем при н.у. занимают 96г озона О3?
10. Сколько молекул хлора CI2 cодержится в 284г его?
Решебник по “Химия 8 класс” Рабочая тетрадь Габриелян О.С. Сладков С.А
Тема 15. Молярный объём газов
Часть I
1. 1 моль любого газа при н. у. занимает одинаковый объём, равный 22,4 л. Этот объём называется
у. занимает одинаковый объём, равный 22,4 л. Этот объём называется
2. Количество вещества (n) — отношение объёма газа при н. у. к молярному объёму:
n = V/Vm=> Vm измеряется в л/моль.
3. Следовательно, количество вещества
4. Дополните таблицу «Количественные характеристики веществ», делая необходимые вычисления.
Часть II
1. Установите соотношение между названием и размерностью величины.
2. Укажите формулы, которые являются производными от основной формулы n = V/Vm.
2) V=n•Vm
3) Vm=V/n
3. Сколько молекул содержат 44,8 л (н. у.) углекислого газа? Решите задачу двумя способами.
4. Придумайте условие задачи, в которой нужно найти число молекул N, если известен объём V.
Найти число частиц оксида азота(II), если его объём равен 67,2 л.
Решите задачу любым способом.
5. Вычислите массу 78,4 л (н. у.) хлора.
6. Найдите объём 297 г фосгена (COCl2).
7. Вычислите массу 56 л аммиака, 10% -й водный раствор которого в медицине известен под названием «нашатырный спирт».
8. Придумайте задачу с использованием изученных понятий. С помощью компьютера создайте рисунок, иллюстрирующий данную задачу. Предложите способ её решения. Верно ли, что 22,4 л азота или 22,4 л водорода одинаковы по массе? Ответ подтвердите вычислениями.
Чему и как мы учим? Формирование навыков решения расчетных задач по химии разных типов
Введение
Умение решать задачи,
Есть искусство,
Приобретающееся практикой.
Д. Пойма
По учебному плану на предмет «Химия» в 8-9 классах отведено всего два урока в неделю. Программа же по химии весьма обширна, тем более с введением органической химии. Поэтому я вынуждена решить проблему, как при небольшом количестве уроков дать хорошие знания учащимся, в том числе научить решать расчетные задачи.
Решение задач в химическом образовании занимает важное место, так как это один из приемов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии и вырабатывается умение самостоятельного применения приобретенных знаний.
Чтобы научиться химии, систематическое изучение известных истин химической науки должно сочетаться с самостоятельным поиском решения сначала малых, а затем и больших проблем.
Научить учащихся решать осмысленно предлагаемые задачи в курсе химии, помочь преодолеть трудности – непросто. Для достижения поставленной цели использую опыт учителей химии, изложенный в методических журналах, опыт коллег региона. Большую помощь оказывает работа методического центра и городского методического объединения химиков под руководством учителя химии Терентьевой И.Г., где проводились мастер-классы по методике решения задач. Многолетняя работа заставили меня больше практиковать на уроках химии решение задач, подтверждение чему нахожу в публикации профессора В. В. Гузеева. «Предмет нашей законной гордости – большой объем фактических знаний – в изменившемся мире практически потерял свою ценность, поскольку любая информация стала легкодоступной, а объем ее быстро растет. Необходимыми становятся не сами знания, а знания о том, как их применять. Но еще важнее знание о том, как информацию добывать и интегрировать или создавать новую. И то, и другое, и третье – результаты деятельности, а деятельность- это решение задач».Провожу уроки по решению задач обучающего характера, на которых знакомлю детей с правильным оформлением задач данного типа. Учу определять, какие химические процессы происходят, что необходимо использовать при решении выбранной задачи.
Большую помощь оказывает работа методического центра и городского методического объединения химиков под руководством учителя химии Терентьевой И.Г., где проводились мастер-классы по методике решения задач. Многолетняя работа заставили меня больше практиковать на уроках химии решение задач, подтверждение чему нахожу в публикации профессора В. В. Гузеева. «Предмет нашей законной гордости – большой объем фактических знаний – в изменившемся мире практически потерял свою ценность, поскольку любая информация стала легкодоступной, а объем ее быстро растет. Необходимыми становятся не сами знания, а знания о том, как их применять. Но еще важнее знание о том, как информацию добывать и интегрировать или создавать новую. И то, и другое, и третье – результаты деятельности, а деятельность- это решение задач».Провожу уроки по решению задач обучающего характера, на которых знакомлю детей с правильным оформлением задач данного типа. Учу определять, какие химические процессы происходят, что необходимо использовать при решении выбранной задачи.
Для учета знаний и проверки умений, полученных в процессе изучения данной темы по химии, использую тесты.
Система химических задач, их место в курсе обучения химии
Решение химических -задач важная сторона овладения знаниями основ науки химии. Включение задач в учебный процесс позволяет реализовать следующие дидактические принципы обучения: 1) обеспечение самостоятельности и активности учащихся; 2) достижение прочности знаний и умений; 3) осуществление связи обучения с жизнью; 4) реализация политехнического обучения химии, профессиональной ориентации.
Формирование умений решать задачи является одним из компонентов обучения химии. Для успешного преподавания химии необходимо использование основного дидактического принципа единства обучения, воспитания и развития.
В результате я поняла, что решение задач по химии – необходимый элемент учебной программы и определила следующие цель и задачи.
Цель: Формирование навыков решения расчетных задач разных типов.
Задачи:
- Выявить общие принципы решения расчетных задач.
- Определить общие методические требования к решению химических задач.
- Систематизировать теоретические знания для практического применения при решении задач.
- Проанализировать типичные ошибки учащихся при решении задач.
- Воспитание самостоятельности, трудолюбия, целеустремленности учащихся в процессе решения задач.
Планируемый результат:
- формирование у школьников целостных предметных знаний и опыта деятельности;
- формирование адекватной самооценки;
- выведение на уровень самоорганизации и самовоспитания;
- развитие задатков и творческого потенциала личности и ее адаптация к постоянно изменяющимся условиям современной жизни.

В процессе решения задач происходит уточнение и закрепление химических понятий о веществах и процессах, вырабатывается смекалка в использовании имеющихся знаний. Задачи, включающие определенные химические ситуации, становятся стимулом самостоятельной работы учащихся над учебным материалом.
Решение задач является одним из звеньев в прочном усвоении учебного материала еще и потому, что формирование теорий и законов, запоминание правил, формул, составление химических уравнений происходит в действии.
У учащихся в процессе решения задач воспитывается трудолюбие, целеустремленность, развивается чувство ответственности, упорство и настойчивость в достижении поставленной цели. В процессе решения задач реализуются межпредметные связи, показывающие единство природы, что позволяет развивать. мировоззрение учащихся.
В ходе решения задач идет сложная мыслительная деятельность учащихся, которая определяет развитие как содержательной стороны мышления(знаний), так и действенной(операции, действия). Теснейшее взаимодействие знаний и действий является основой формирования различных приемов мышления: суждений, умозаключений, доказательств.
Теснейшее взаимодействие знаний и действий является основой формирования различных приемов мышления: суждений, умозаключений, доказательств.
Задачи расширяют кругозор учащихся, позволяют установить связь химии с физикой, биологией, экологией и математикой. С помощью задач есть возможность развивать у ученика
Общие принципы решения задач
Решение химической задачи состоит из многих операций, которые должны определенным образом соединяться между собой и применяться в установленной последовательности в соответствии со складывающейся логикой решения. Именно эта последовательность и должна привести к положительному результату.
Важный фактор обучения учащихся решению задач – необходимость отработки некоторой последовательности действий, формирование определенного алгоритма действий, который может быть следующим:
- Внимательно прочесть текст задачи, стараясь понять ее суть.
- Выполнить химическую часть задачи.
2. 1. Записать условие задачи, используя общепринятые обозначения физико-химических величин.
1. Записать условие задачи, используя общепринятые обозначения физико-химических величин.
2.2. Провести запись вспомогательных величин согласно условию задачи.
2.3. Выполнить исследование текста задачи.
2.4. Провести анализ задачи и наметить план ее решения (алгоритм решения). - Выполнить математическую часть задачи.
3.1.Подобрать наиболее рациональный способ решения.
3.2. Провести необходимые расчеты.
3.3. Осуществить проверку полученного результата (правильность хода выполненного решения).
3.4. Записать ответ задачи. - Составить задачу, обратную решенной нами.
Соблюдение указанной последовательности действий организует и направляет деятельность учащегося при решении задачи, не связывая логику рассуждений, свойственную индивидуальному мышлению, и в то же время это алгоритм применим к любой расчетной задаче.
Указанную последовательность можно представить учащимся в виде графического наглядного пособия.
Процесс решения расчетной химической задачи
Анализ полученного результата
В ходе решения задачи важно критически оценить, самостоятельно проанализировать ход поиска ее решения и полученный ответ. В процессе решения не исключены ошибки. В одних случаях это следствие неправильного понимания или неудачного использования химического понятия или элементов задачи и порядка решения. Учтены ли все существенные понятия, содержащиеся в задаче? В других – нарушение логики взаимосвязи известных и неизвестных величин, логики мышления при решении.
С чего начинать анализ хода решения? Возможны два пути. Первый путь предполагает совмещение процесса анализа с ходом поиска решения. Второй – допускает разделение их во времени: сначала решить задачу, а затем заняться анализом процесса решения. Для этого нужно делать записи хода решения непосредственно в процессе решения, а не после, восстанавливая в памяти этапы решения.
При первом пути, выполняя решение, контролируем каждый свой шаг. Ясно ли вам, что предпринятый шаг правилен? Сумеем ли доказать, что он верен? Рациональный ли способ решения мы применили? Может, есть проще?
При втором – можно ли проверить полученный результат, ход решения? Как получить тот же ответ иным способом?
Чем тщательнее будет сделан анализ хода решения задачи, тем эффективнее окажется процесс овладения этой методикой.
Запись решения задачи должна быть четкой, образной и полной!
Ответ и составление обратной задачи
Наконец, когда задача решена, записывают ее ответ. Учителю важно выработать у учащихся умение аккуратной записи всего решения задачи, включая и ответ, в сжатой, но полной форме.
Решив задачу, целесообразно для лучшего усвоения ее структуры составить обратную
Таким образом, знание путей решения расчетной задачи и соблюдение определенных последовательных действий в процессе ее решения приведут к получению правильного осмысленного результата.
Методические принципы обучения решению задач
Процесс обучения решению задач проходит в нормальной обстановке и достигает удовлетворительных результатов при соблюдении ряда методических принципов:
- первоначально учитель решает задачу сам и продумывает методику разбора задачи;
- учащиеся должны постоянно видеть текст задачи;
- учащиеся должны проявлять самостоятельность, решая задачи;
- учащимся следует проводить самоанализ, контролируя решения задачи;
- учитель должен систематически включать решение задач в процесс обучения химии.
Каждая задача, намеченная учителем для решения на уроке или дома, должна быть предварительно решена им самим, при этом должна быть четко рассмотрена химическая сторона задачи и должны быть выбраны 2-3 рациональных способа решения. Это избавит учителя от возможных непредвиденных случайностей, позволит более доходчиво объяснить учащимся решение, сориентировать их в нужном направлении.
В целях научной организации труда учителя необходимо постепенно создавать картотеку задач, т.е. решать каждую задачу на отдельной карточке, которые шифруются для удобства пользования. Созданная картотека избавит учителя от лишней траты времени на повторное решение задачи.
Существенное внимание следует уделить тому, чтобы текст задачи был перед глазами учащихся на протяжении почти всего хода решения. На практике это можно осуществить, имея достаточное число задачников в кабинете химии.
При решении задач следует оптимально сочетать регламентированные и самостоятельные усилия учащихся. Развивающий эффект задачи теряется, учащиеся утрачивают интерес к задаче, перестают работать, если решение систематически осуществляется учителем или учеником под диктовку учителя, а остальные учащиеся механически переписывают решение с доски в тетрадь. Чтобы избежать указанных педагогических казусов, необходимо постепенно увеличивать участие ученика в процессе решения задачи.
Научить учащихся самоконтролю в ходе решения задачи – значит обучить их умению анализировать ход решения, постоянно контролировать свои действия.
Наконец, успех выработки умений решать задачи зависит как от постоянного решения в течение всего учебного года, так и от последовательности решения одной задачи за другой, т.е. системы задач, с помощью которой можно было бы руководить умственным развитием учащихся, при изучении нового материала, актуализируя ранее приобретенные знания.
Разнообразить методы преподавания химии можно, разумно применяя задачи на различных этапах урока: при изучении нового материала; в процессе закрепления материала, изученного на уроке; при самостоятельной работе на уроке и дома; при текущей проверке знаний учащихся; при повторении изученной темы и проведении проверочной или контрольной работы; при обобщении знаний учащихся по теме.
Практические приемы применения теоретических основ по решению задач
С целью оптимизации обучения химии целесообразно использование алгоритмического языка. Применение алгоритмического языка позволит выделить существенное в изучаемом материале, сформировать у учащихся интегральные знания и умения, интерес к изучению междисциплинарных объектов.
Применение алгоритмического языка позволит выделить существенное в изучаемом материале, сформировать у учащихся интегральные знания и умения, интерес к изучению междисциплинарных объектов.
После каждой темы в учебнике есть задачи, которые надо решать в обязательном порядке. Кроме того, пользуюсь сборниками задач по химии.
Трудно дается ученикам решение задач по уравнениям химических реакций, поэтому, после изучения темы «Химические реакции», изучив закон сохранения массы веществ, начинаю отрабатывать расстановку коэффициентов в уравнении и определять массу веществ, участвующих в реакции. Стараюсь подобрать вещества простые и бинарные, с которыми ознакомились на предыдущих уроках
Далее выполняем следующую запись для расшифровки смысла написанного уравнения.
Объясняю, что относительная молекулярная масса Mr численно равна молярной массе M; M={Mr}. Коэффициент, стоящий впереди вещества соответствует количеству вещества – γ. Исходя из формулы молярной массы определяем массу каждого вещества по отдельности.
Исходя из формулы молярной массы определяем массу каждого вещества по отдельности.
Также определяем массу хлора и хлорида натрия. Сложив полученную массу в левой части уравнения убеждаемся, что она равна правой части уравнения
46г + 71г = 117г
46 : 71 : 117
1 : 1,54 : 2,54
Также убеждаемся в прямой пропорциональности масс.
На этом же уроке даю задачу по определению массы вещества, если известно одно из веществ, вступивших в реакцию. Например: Сколько граммов серы понадобится для проведения химической реакции с железом массой 112 г.
Что дано и что найти записываем над этими веществами. Исходя из этой записи, составляем пропорцию 112 : х = 56 : 32. Напоминаю, что произведение крайних членов равно произведению средних членов.
112г : 32г = 56х, отсюда
Ответ: Для взаимодействия 112г железа понадобится 64г серы.
Для закрепления решаем задачи по карточках самостоятельно. После решения проверяем на доске вместе.
После решения проверяем на доске вместе.
Заключение
Решение задач – важный компонент процесса обучения химии.
Наилучших результатов можно достичь при систематическом решении различных видов задач письменно, устно и экспериментально.
- Методической основой решения расчетных химических задач является единство качественной и количественной сторон химических явлений, поэтому в процессе решения задачи весьма важно обосновывать химическую часть, а затем только выполнять вычисления.
- Целесообразно в процессе обучения учащихся сформировать умение составлять и применять алгоритмы последовательности действий при решении, что дисциплинирует и направляет деятельность при самостоятельном решении задач.
- Большое значение в формировании умений решать задачи имеют обучение правильной записи условия задачи и показ путей проведения анализа задачи.
- Правильное использование физических величин и корректное проведение математических расчетов являются обязательными условиями обучения учащихся решению задач по химии.

- Для самостоятельного решения задач в виде приложения к учебнику вводить алгоритмы решения химических задач как у М.О. Шамовой.
- Для дальнейшего и успешного обучения химии необходимо не менее 3 уроков в неделю.
Список литературы
- Федеральный закон об образовании. М., Издательский дом ИНФРА – М, 2001.
- Программы для общеобразовательных учреждений. Химия 8-11 классы. М., Дрофа, 2001.
- Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии с помощью уравнений и неравенств. М., Просвещение, 1989.
- Пак М. Алгоритмы в обучении химии. М., Просвещение, 1993.
- Химия в школе. №8 2001г. стр.12, №1 2000г. стр.38, №2 2002г. стр.52., №4 2005г. стр.46.
- Шамова М.О. Учимся решать расчетные задачи по химии. М., Школьная пресса, 2003.
«Сириус» открыл новые онлайн-курсы по химии, физике, комбинаторике, информатике и лингвистике
На платформе дистанционного образования «Сириус.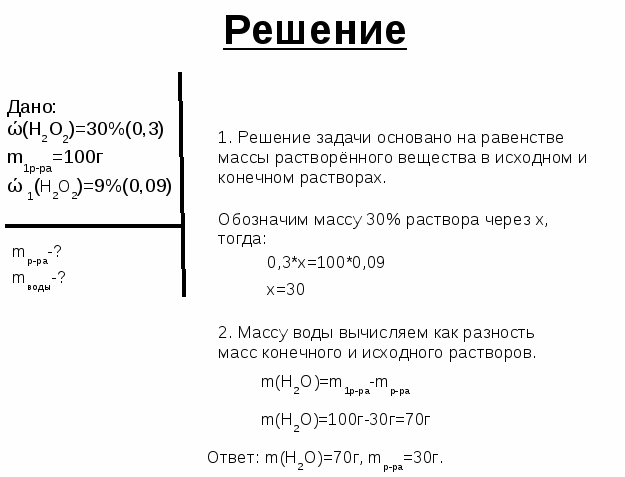 Курсы» стартовали шесть новых программ:
Курсы» стартовали шесть новых программ:
– Лингвистика: фонетика и графика
– Введение в программирование на языке Python
– Дополнительные главы физики: кинематика. 9 класс
– Дополнительные главы физики: цепи постоянного тока. 8 класс
– Дополнительные главы химии. 8 класс
– Дополнительные главы комбинаторики. 7 класс
Обучение уже началось и продлится по первым трем программам до 15 декабря 2020 года, по вторым трем — до 15 января 2021 года. Помимо школьников, которым обучение поможет систематизировать теоретические знания, научиться решать задачи повышенной сложности и более эффективно подготовиться к выступлению на олимпиадах, к участию приглашаются все желающие: учителя, родители и студенты.
Присоединиться к первым трем курсам можно до 15 ноября, ко вторым трем — до 15 декабря.
Курсы состоят из видеолекций, конспектов, упражнений и задач для самостоятельного решения. Все материалы разработаны преподавателями ведущих школ и вузов России, работающими с талантливыми школьниками, тренерами победителей и призеров всероссийских и международных олимпиад.
Курсы разделены на несколько учебных тематических модулей. Для того, чтобы перейти на новый модуль, нужно пройти предыдущие. В некоторых курсах доступно автопрохождение: если участник уже решил задачи в аналогичных курсах, открытых на платформе ранее, их можно автоматически засчитать в новом курсе, а ученик таким образом сможет быстрее продвигаться к новому и интересному.
По итогам обучения выдается электронный сертификат. Для его получения необходим зачет по всем учебным модулям, кроме лекционных. Условие получения зачета по модулю — успешное выполнение не менее 70% упражнений. Сертификаты могут учитываться при отборе на очные программы Образовательного центра «Сириус» по направлению «Наука».
Если ученик не успел получить зачет по отдельным модулям, он не получит сертификат, но сможет возобновить обучение, когда курс стартует в следующий раз. При этом выполнять пройденные модули заново не потребуется (но может быть предложено, если соответствующие учебные материалы обновятся).
Добавим, что сейчас на платформе «Сириус.Курсы» всего запущено 10 открытых программ, обучение проходят порядка 12 тысяч человек. Ранее были открыты «Дополнительные главы геометрии» (7, 8 и 9 классы) и «Лингвистика: Морфология». К этим курсам тоже можно присоединиться прямо сейчас: набор открыт до 1 ноября, а обучение продлится до 30 ноября.
Все объявления о программах — в телеграм-канале «Сириуса»
Решение задач по химии 8 класс. | Уроки по Химии
Решение задач по химии 8 класс.
22.07.2015 19831 1271 Битабарова Хадиша ИсабековнаПредисловие.
Задачи по химии обычно предлагаются на всех экзаменах по химии: устных и письменных.
На последних, как правило, в экзаменационные
билеты входят только задачи. Умение решать их является основным показателем
творческого усвоения предмета. Кроме того, решение задач при изучении теории
позволяет значительно лучше разобраться в ней и усвоить наиболее сложные вопросы.
С помощью этого задачника вы вспомните навыки решения таких задач и научитесь решать те химические задачи, с которыми еще не встречались.
Вам подскажет нужные формулы, ход решения и правила оформления задач.
Задачник включает все типы расчетных задач, основанных на вычислениях по химическим формулам на вычислениях по химическим уравнениям реакций , а также качественные задачи .
В задачнике используются общепринятые в настоящее время обозначения физических величин и схема записи расчетов. Следует иметь в виду, что во многих школах величину «количество вещества» обозначают символом n, но в настоящем задачнике принято обозначение ν, которое больше распространено в высшей школе. В задачнике использованы единицы международной системы СИ, некоторые допустимые внесистемные единицы (тонна, литр, милилитр и др.),современная международная номенклатура неорганических веществ.
Задачи сгруппированы по основным темам, последовательно изучаемым в 8-9 классах: «Постоянство
состава вещества»,«Вычисления по химическим формулам», «Основные количественные характеристики вещества:
количества вещества, масса и объем»,« Массовая, объемная и молярная
доля вещества в смеси. Массовая доля элемента в соединении», «Расчеты по
химическим уравненииям», «Кристаллогидрата», «Растворимость веществ. Молярная концентрация. Плотность раствора в массовая доля вещества в
растворе», «Простейшие расчеты по уравнениям химических реакции», «Тепловой эффект химической реакции»,
«Вывод формул соединений», «Объемные отношения газов. Определение объема газа по массе вещества,
содержащего определенную долю примесей», «Расчет массы, объема продукта реакции, если одно из
реагирующих веществ в избытке», «Расчеты, связанные с использованием доли выхода продуктов
реакции»,
«Электролитическая
диссоциация. Сильные и слабые электролиты», «Скорость химической реакции. Химическое равновесие», «Основные понятия и стехиометрические законы химии».
Массовая доля элемента в соединении», «Расчеты по
химическим уравненииям», «Кристаллогидрата», «Растворимость веществ. Молярная концентрация. Плотность раствора в массовая доля вещества в
растворе», «Простейшие расчеты по уравнениям химических реакции», «Тепловой эффект химической реакции»,
«Вывод формул соединений», «Объемные отношения газов. Определение объема газа по массе вещества,
содержащего определенную долю примесей», «Расчет массы, объема продукта реакции, если одно из
реагирующих веществ в избытке», «Расчеты, связанные с использованием доли выхода продуктов
реакции»,
«Электролитическая
диссоциация. Сильные и слабые электролиты», «Скорость химической реакции. Химическое равновесие», «Основные понятия и стехиометрические законы химии».
Задачник дает возможность систематизировать базовые знания по химии. Надеемся, что она пригодится не только вам, но и вашим учителям
Нахождение
молекулярной массы вещества.
1. Найти молярную массу сульфата алюминия. Указать относительную молекулярную массу вещества.
Дано:
АІ2(SО4)3
Найти:
М[АІ2(SО4)3] -?
Мr[АІ2(SО4)3] -?
Решение:
М[АІ2(SО4)3] = А(АІ) · n(АІ) + А(S) · n(S) + А(О) · n(О)
М[АІ2(SО4)3] = 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
= 54 + 288 = 342 г/моль
Мr[АІ2(SО4)3] = Аr(АІ) · n(АІ) + Аr(S) · n(S) + Аr(О) · n(О)
Мr[АІ2(SО4)3] = 27 · 2 + (32 + 16 · 4) · 2 = 54 + 96 · 3 =
= 54 + 288 = 342 .
Ответ: М[АІ2(SО4)3] = 342 г/моль; Мr[АІ2(SО4)3] = 342.
2. Найти молярную
массу ортофосфорный кислоты. Указать относительную молекулярную массу вещества.
Найти молярную
массу ортофосфорный кислоты. Указать относительную молекулярную массу вещества.
Дано:
Н3РО4
Найти:
М(Н3РО4) -?
Мr(Н3РО4) -?
Решение:
М(Н3РО4) = А(Н) · n(Н) + А(Р) · n(Р) + А(О) · n(О)
М(Н3РО4) = 1 · 2 + 31· 1 + 16 · 4 = 2 + 31 + 64 = 98 г/моль
Мr(Н3РО4) = Аr(Н) · n(Н) + Аr(Р) · n(Р) + Аr(О) · n(О)
Мr(Н3РО4) = 1 · 2 + 31· 1 + 16 · 4 = 2 + 31 + 64 = 98
Ответ: М(Н3РО4) = 98 г/моль; Мr(Н3РО4) = 98.
3. Найти молярную массу оксида натрия. Указать относительную молекулярную массу вещества.
Дано:
Nа2О
Найти:
М(Nа2О) -?
Мr(Nа2О) -?
Решение:
М(Nа2О) = А(Nа) · n(Nа) + А(О) · n(О)
М(Nа2О) = 23 · 2 + 16 · 1 = 46 + 16 = 62 г/моль
Мr(Nа2О) = Аr(Nа) · n(Nа) + Аr(О) · n(О)
Мr(Nа2О) = 23 · 2 + 16 · 1 = 46 + 16 = 62
Ответ: М(Nа2О) = 62 г/моль; Мr(Nа2О) = 62.
4. Найти молярную массу гидроксида кальция. Указать относительную молекулярную массу вещества.
Дано:
Са(ОН)2
Найти:
М(Са(ОН)2) -?
Мr(Са(ОН)2) -?
Решение:
М(Са(ОН)2) = А(Са) · n(Са) + А(О) · n(О) + А(Н) · n(Н)
М(Са(ОН)2) = 40 · 1 + 16· 2 + 1 · 2 = 40 + 32 + 2 = 74 г/моль
Мr(Са(ОН)2) = Аr(Са) · n(Са) + Аr(О) · n(О) + Аr(Н) · n(Н)
Мr(Са(ОН)2) = 40 · 1 + 16· 2 + 1 · 2 = 40 + 32 + 2 = 74
Ответ: М(Са(ОН)2) = 74 г/моль; Мr(Са(ОН)2) = 74.
Задачи для самостоятельной работы.
1. Найдите относительную молекулярную массу вещества по формуле Nа3Сr2О7 дихромат натрия. Ответ: 262.
2. Найдите
относительную молекулярную массу вещества по формуле АІ(МnО4)3 перманганат алюминия. Ответ: 357.
Ответ: 357.
3. Найдите относительную молекулярную массу вещества по формуле К3РО4 ортофосфат калия. Ответ: 212.
4. Найдите относительную молекулярную массу вещества по формуле Zn(NО3)2 нитрат цинка. Ответ: 189.
5. Найдите относительную молекулярную массу вещества по формуле Nа3ВО3 борат натрия. Ответ: 128.
6. Найдите относительную молекулярную массу вещества по формуле
Nа[АІ(ОН)4] тетрагидроксоалюминат натрия. Ответ: 118.
7. Найдите относительную молекулярную массу вещества по формуле Мg3(РО4)2 ортофосфат магния. Ответ: 262.
8. Найдите относительную молекулярную массу вещества по формуле К3РО4 ортофосфат калия. Ответ: 212.
9. Найти относительную молекулярную массу сульфата натрия Nа2SО4. Ответ: 142.
10. Вычислите
относительную молекулярную массу углекислого газа СО2. Ответ: 44.
Ответ: 44.
11. Вычислите относительную молекулярную массу оксида серы (ІV) SО2. Ответ: 64.
12. Вычислите относительную молекулярную массу оксида фосфора (V) Р2О5. Ответ: 142.
13. Вычислите относительную молекулярную массу оксида серы (VІ) SО3. Ответ: 80.
14. Вычислите относительную молекулярную массу оксида алюминия АІ2О3. Ответ: 102.
15. Вычислите относительную молекулярную массу оксида железа (ІІ) ҒеО. Ответ: 72.
16. Вычислите относительную молекулярную массу нитрата магния Мg(NО3)2. Ответ: 148.
17. Вычислите относительную молекулярную массу хлорида натрия NаСІ. Ответ: 58,5.
18. Найти молярную массу сульфата железа. Ответ: 96.
19. Найти молярную массу фосфата бария. Ответ: 44.
20. Найти молярную массу азотной кислоты. Ответ: 63.
Полный текст материала смотрите в скачиваемом файле.
На странице приведен только фрагмент материала.
ГДЗ по Математике 6 класс Дорофеев, Шарыгин. Решебник
ГДЗ по математике для 6 класса Дорофеева – это сборник готовых домашних заданий по задачам и примерам из учебника по арифметике, составленного известными российскими авторами – Г.В. Дорофеевым, И.Ф. Шарыгиным, С.Б. Суворовым и др. Он используется в большинстве общеобразовательных школ России.
Структура ГДЗ по учебнику математики шестого класса от Дорофеева
Во шестом классе школьники углубленно изучают арифметику. Эти знания помогут им постигнуть алгебру и геометрию в старших классах, а также физику, геометрию, химию. Шестиклассники изучают многоугольники и многогранники, обыкновенные и десятичные дроби, проценты и отношения, уравнения с одной переменной, а также множества и комбинаторика.
ГДЗ по математике 6 класса Дорофеева, составленные на основе учебника 2016-2019 гг. в его 4-м издании, включают в себя примеры и задачи на такие темы:
- дроби и проценты;
- прямые на плоскости и в пространстве;
- десятичные дроби;
- действия с десятичными дробями;
- окружность и прямая;
- отношения и проценты;
- центральная и осевая симметрия;
- выражения, формулы, уравнения;
- целые числа
- множества и комбинаторика;
- рациональные числа;
- многоугольники и многогранники.

Изучение перечисленных тем помогает в постижении алгебры и геометрии в старшей школе. Однако для этого важно не просто зазубрить правила и списать в тетрадь готовые домашние задания. Стоит понять теоремы на научиться применять их в решении примеров, задач и уравнений.
Готовые домашние задания для 6 класса на сайте ГДЗ Путина помогают не только ученикам средних школ, но и их родителям. Они могут проверить домашнюю работу своих детей и отказаться от услуг репетитора.
Онлайн-решения от ГДЗ Путина по математике 6 класса к Дорофееву
В интернете немало сайтов с готовыми домашними заданиями по арифметике. При этом ресурс ГДЗ от Путина имеет немало преимуществ для шестиклассников и родителей:
- наличие нескольких вариантов решения примеров и задач;
- ответы по самым свежим изданиям учебников российских школ;
- оформление готовых домашних заданий по требованиям Минобразования РФ;
- круглосуточный доступ со смартфона, планшета, компьютера.

Приведенные факторы делают ГДЗ по математике 6 класса к учебнику Дорофеева удобными и практичными в использовании. Ответы на задачки, примеры и уравнения в нескольких вариантах упростят постижение арифметики шестиклассниками.
Готовые домашние задания включают в себя детальные алгоритмы выполнения примеров и уравнений, что помогает легко разобраться со сложными темами дома без посещения дополнительных занятий.
ГДЗ по Математике 5 класс Дорофеев. Решебник заданий
ГДЗ по математике за 5 класс Дорофеев – это онлайн-решебник, который раскрывает детальный алгоритм выполнения примеров и задач по одноименному учебнику группы российских ученых – Дорофеева Г.В, Шарыгина И.Ф., Суворовой С.Б. и др., который был издан в 2017 году. Ныне его используют в качестве базового учебного пособия во многих средних школах России.
Решебник по математике Дорофеев – важное дополнение учебного процесса в пятом классе
В пятом классе школьники начинают свой путь в среднем звене общеобразовательной школы, который предполагает увеличение числа предметов и углубление в них. Не всем ребятам легко удается легко и быстро адаптироваться к новым условиям, появляются трудности с выполнением домашней работы.
Не всем ребятам легко удается легко и быстро адаптироваться к новым условиям, появляются трудности с выполнением домашней работы.
Онлайн-решебник по математике за 5 класс Дорофеев позволяет пятиклассникам самостоятельно или при содействии родителей вникнуть в предмет, научиться решать примеры и задачки. На сайте ГДЗ Путина предусмотрены условия его максимально удобного использования:
- Поиск ответов и решений по номеру задания в таблице;
- Прикрепление к задаче 1-5 вариантов ее решения для расширения кругозора школьника и понимания им разных формул и теорем;
- Регулярное обновление практических пособий с готовыми ответами.
Школьники и их родители могут отыскать готовое решение с правильным ответом на базе любого устройства – телефона, компьютера или планшета. Ребятам это позволяет дома, в спокойной обстановке понять алгоритм решения математических упражнений, а их родителям – проконтролировать успеваемость своих чад.
ГДЗ по математике для 5 класса от Дорофеева – дроби, многоугольники, рациональные числа
В рамках домашней работы школьник должен закрепить теоретические знания, полученные в классе. Что же делать, если ребенок запомнил формулы, но не успел понять алгоритма решения примеров и задач? Пользоваться онлайн-сборниками готовых домашних заданий, которые являются не базой для списывания, а образцом для выполнения домашних упражнений.
Что же делать, если ребенок запомнил формулы, но не успел понять алгоритма решения примеров и задач? Пользоваться онлайн-сборниками готовых домашних заданий, которые являются не базой для списывания, а образцом для выполнения домашних упражнений.
Какие упражнения приводятся в ГДЗ по математике 5 класса Дорофеев?
- Прямая, ломаная линия, отрезок, окружность и их длины;
- Натуральные числа, их сравнение, чтение и округление;
- Математические действия с натуральными числами и степени числа;
- Использование свойств действий при вычислениях;
- Углы и их измерение, многоугольники и их свойства;
- Дробные числа, действия с обыкновенными и десятичными дробями;
- Многогранники и измерение их объемов.
Онлайн-решебник составлен на базе 4-го издания учебника Дорофеева Г.В. для 5 класса. Он позволяет родителям помогать пятиклассникам в выполнении упражнений по арифметике.
ГДЗ самостоятельные и контрольные работы по геометрии 7 класс Иченская, Атанасян Просвещение
С началом изучения геометрии у семиклассников возникают сложности, так как предмет довольно объемный и сложный. Часто проблема возникает с пониманием геометрических терминов, теорем и аксиом. Но тяжелее всего детям выполнять геометрические задачи. Благодаря хорошему учебнику эта проблема не возникнет. Практическое пособие Иченской М.А. получило хороший отклик у преподавателей и экспертов. А с помощью гдз по геометрии самостоятельные и контрольные работы за 7 класс Иченская освоить материалы пособия станет еще легче. Ребенок сможет понять не только принцип решения упражнения, но и правильность оформления ответа.
Часто проблема возникает с пониманием геометрических терминов, теорем и аксиом. Но тяжелее всего детям выполнять геометрические задачи. Благодаря хорошему учебнику эта проблема не возникнет. Практическое пособие Иченской М.А. получило хороший отклик у преподавателей и экспертов. А с помощью гдз по геометрии самостоятельные и контрольные работы за 7 класс Иченская освоить материалы пособия станет еще легче. Ребенок сможет понять не только принцип решения упражнения, но и правильность оформления ответа.
Для кого онлайн справочник является незаменимым помощником?
Больше всего к помощи онлайн решений к самостоятельным и контрольным работам по геометрии 7 класс Иченской, Атанасяна прибегают такие группы людей:
- ученики, которые испытывают трудности в изучении точных наук. Многие дети обладают гуманитарным складом ума и осваивать математические предметы им довольно сложно. Благодаря ГДЗ станет на одну проблему меньше, возникнет понимание предмета, и вся нужная информация усвоится;
- дети, которые вынуждены часто пропускать занятия, так как часто болеют или выезжают на различные внешкольные мероприятия.
 После систематических пропусков возникает пробел в знаниях, а это влечет за собой риск получения плохих оценок. Геометрия сложный предмет, для изучения которого важная регулярность. С помощью решебника ребенок без труда наверстает упущенное и не будет чувствовать себя неуверенно во время написания итоговых работ;
После систематических пропусков возникает пробел в знаниях, а это влечет за собой риск получения плохих оценок. Геометрия сложный предмет, для изучения которого важная регулярность. С помощью решебника ребенок без труда наверстает упущенное и не будет чувствовать себя неуверенно во время написания итоговых работ; - преподаватели, которые обучают детей геометрии в седьмом класса. На них лежит большая нагрузка в виде большого количества письменных заданий и упражнений школьников, которые нужно регулярно проверять. Очень часто после проведенных занятий не хватает времени на оперативную проверку и контроль. Использование ГДЗ поможет решить эту проблему, быстрая и качественная проверка гарантирована;
- родители, которым нужно постоянно следить за уровнем полученных знаний ребенка. Важно всегда быть на чеку и регулярно проверять, как ребенок осваивает курс школьной программы по ГДЗ. С применением решебника не потребуется много времени и сил, чтобы дать оперативную оценку ситуации.

Доводы в защиту сборников готовых заданий
Среди значительных плюсов сборника ответов к самостоятельным и контрольным работам по геометрии 7 класс авторы Иченская, Атанасян можно выделить:
- быстрый и доступный поиск нужных заданий и решений;
- отсутствие материальных затрат на дополнительные занятия с репетитором;
- оформление всех ответов в полном соответствии с действующими образовательными стандартами;
- возможность прибегнуть к помощи пособия в любой день и любое время;
- постоянный самоконтроль выполненных домашних заданий, перед тем как сдать работу на проверку.
Ребенок, который занимается с решебником на еуроки ГДЗ, научится понимать материал, грамотно записывать условия и решения, научиться строить геометрические чертежи и выделять основную информацию из справочного пособия.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Химические реакции для 7 класса Химия
Обзор устройства
7.1 Химические реакции и вещество
Обзор блока
*РУКОВОДСТВО ПО ДИСТАНЦИОННОМУ ОБУЧЕНИЮ ДЛЯ ЭТОГО БЛОКА ТЕПЕРЬ ДОСТУПНО!*
НАЖМИТЕ ЗАГРУЗИТЬ, ЧТОБЫ ПОЛУЧИТЬ ДОСТУПЛЕНИЕ
Концептуальное понимание химических реакций учащимися седьмого класса в средней школе является основой для изучения многих естественных наук. Понимание реакций на атомном уровне имеет решающее значение для изучения физики, жизни, Земли и космоса.Что еще более важно, они открывают новые окна любопытства для студентов, чтобы увидеть мир вокруг них. К седьмому классу учащиеся готовы принять абстрактную природу взаимодействия атомов и молекул, которые слишком малы, чтобы их можно было увидеть.
Чтобы пробудить любопытство учащихся 7-го класса и закрепить изучение модуля в видимом и конкретном, учащиеся начинают с опыта наблюдения и анализа бомбы для ванны, когда она шипит и в конечном итоге исчезает в воде. Их наблюдения и вопросы о том, что происходит, стимулируют обучение, которое углубляется в ряд связанных явлений, поскольку учащиеся повторяют и улучшают свои модели, изображающие то, что происходит во время химических реакций, для естественных наук средней школы.К концу раздела учащиеся имеют четкое представление о том, как моделировать простые молекулы, знают, на что обращать внимание, чтобы определить, произошли ли химические реакции, и применяют свои знания к химическим реакциям, чтобы показать, как сохраняется масса при перегруппировке атомов.
В этот раздел по химии для 7-го класса встроены различные задания для самопроверки, оценки сверстниками, формативной и итоговой оценки. Этот модуль завершается заданием на перенос, в котором учащиеся применяют то, что они выяснили, к двум различным связанным явлениям: зубной пасте слона и крошению мрамора, из которого состоит Тадж-Махал.
ВИДЕО УЧИТЕЛЯ
СТУДЕНЧЕСКИЕ ВИДЕО
, ,
Примеры блоков
Дополнительная информация об устройстве
Стремление к следующим стандартам и практикам
Ожидания производительности
Этот раздел химии для 7-го класса строится в соответствии со следующими ожидаемыми показателями эффективности (PE) NGSS:
- MS-PS1-1: Разработка моделей для описания атомного состава простых молекул и расширенных структур.
 [Уточняющее заявление: Акцент делается на разработке моделей молекул различной сложности. Примеры простых молекул могут включать аммиак и метанол. Примеры протяженных структур могут включать хлорид натрия или алмазы. Примеры моделей на молекулярном уровне могут включать рисунки, трехмерные шаровые и стержневые структуры или компьютерные представления, показывающие разные молекулы с разными типами атомов.] [Граница оценки: оценка не включает валентные электроны и энергию связи, обсуждая ионную природу субъединиц сложные структуры или полное описание всех отдельных атомов в сложной молекуле или расширенной структуре не требуется.]
[Уточняющее заявление: Акцент делается на разработке моделей молекул различной сложности. Примеры простых молекул могут включать аммиак и метанол. Примеры протяженных структур могут включать хлорид натрия или алмазы. Примеры моделей на молекулярном уровне могут включать рисунки, трехмерные шаровые и стержневые структуры или компьютерные представления, показывающие разные молекулы с разными типами атомов.] [Граница оценки: оценка не включает валентные электроны и энергию связи, обсуждая ионную природу субъединиц сложные структуры или полное описание всех отдельных атомов в сложной молекуле или расширенной структуре не требуется.] - MS-PS1-2: Анализ и интерпретация данных о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция. [Пояснительное заявление: Примеры реакций могут включать горение сахара или стальной ваты, реакцию жира с гидроксидом натрия и смешивание цинка с хлористым водородом.] [Граница оценки: Оценка ограничивается анализом следующих свойств: плотность, точка плавления, точка кипения , растворимость, воспламеняемость и запах.
 ]
] - MS-PS1-5: Разработайте и используйте модель для описания того, как общее количество атомов не изменяется в химической реакции и, таким образом, сохраняется масса. [Пояснение: Акцент делается на законе сохранения материи и на физических моделях или чертежах, включая цифровые формы, которые представляют атомы.] [Границы оценки: Оценка не включает использование атомных масс, уравновешивающих символических уравнений или межмолекулярных сил. ]
Следующий PE будет разработан на трех модулях OpenSciEd; OpenSciEd Модуль 6.1: Почему мы иногда видим разные вещи, глядя на один и тот же объект? (Единица одностороннего зеркала) , Модуль OpenSciEd 7.1: Как мы можем сделать что-то новое, чего раньше не было? (Бомбы для ванн) и OpenSciEd Unit 8.2: Как звук может заставить что-то двигаться? (звуковое устройство) . В этом разделе для 7-го класса будут рассмотрены только химические реакции, передающие сигналы в мозг через обоняние. Другие блоки будут обрабатывать электромагнитные и механические входы, а также связь с обработкой сигналов в мозгу, что приводит к немедленному поведению или воспоминаниям.
- МС-ЛС1-8. Собирайте и синтезируйте информацию, которую сенсорные рецепторы реагируют на раздражители, отправляя сообщения в мозг для немедленного поведения или хранения в виде воспоминаний. [Граница оценки: Оценка не включает механизмы передачи этой информации]
- MS-LS1.D: Обработка информации: каждый сенсорный рецептор реагирует на разные входные сигналы (электромагнитные, механические, , химические, ), передавая их в виде сигналов, которые проходят по нервным клеткам в мозг.Затем сигналы обрабатываются в мозгу, что приводит к немедленному поведению или воспоминаниям.
Основные дисциплинарные идеи
PS1.A: Структура и свойства материи
- Вещества состоят из различных типов атомов, которые соединяются друг с другом различными способами.
- Атомы образуют молекулы размером от двух до тысяч атомов.
- Твердые тела могут быть образованы из молекул или представлять собой протяженные структуры с повторяющимися субъединицами (например,г.
, кристаллы).
- Каждое чистое вещество имеет характерные физические и химические свойства (для любого объемного количества при данных условиях), которые можно использовать для его идентификации.
PS1.B: Химические реакции
- Вещества химически реагируют характерным образом. В химическом процессе атомы, из которых состоят исходные вещества, перегруппировываются в другие молекулы, и эти новые вещества обладают свойствами, отличными от свойств реагентов.
- Общее количество атомов каждого типа сохраняется, поэтому масса не меняется.
LS1-D: обработка информации
- Каждый сенсорный рецептор реагирует на разные сигналы (электромагнитные, механические, химические), передавая их в виде сигналов, которые по нервным клеткам поступают в мозг. Затем сигналы обрабатываются в мозгу, что приводит к немедленному поведению или воспоминаниям.
Основные дисциплинарные идеи дословно воспроизведены из Структура научного образования K-12: практика, сквозные концепции и основные идеи. DOI: https://doi.org/10.17226/13165. Национальный научно-исследовательский совет; Отдел поведенческих и социальных наук и образования; Совет по научному образованию; Комитет по концептуальным основам новых стандартов естественнонаучного образования K-12. Издательство национальных академий, Вашингтон, округ Колумбия. Этот материал может быть воспроизведен и использован другими лицами с указанием авторства. Если исходный материал каким-либо образом изменен, в атрибуции должно быть указано, что материал адаптирован из оригинала.
DOI: https://doi.org/10.17226/13165. Национальный научно-исследовательский совет; Отдел поведенческих и социальных наук и образования; Совет по научному образованию; Комитет по концептуальным основам новых стандартов естественнонаучного образования K-12. Издательство национальных академий, Вашингтон, округ Колумбия. Этот материал может быть воспроизведен и использован другими лицами с указанием авторства. Если исходный материал каким-либо образом изменен, в атрибуции должно быть указано, что материал адаптирован из оригинала.
Фокусная научная и инженерная практика
Несмотря на то, что в этом разделе по химии для 7-го класса учащиеся участвуют в нескольких SEP на уровне ожидаемых результатов на уровне урока для всех уроков в этом модуле, существуют три основные практики, которые этот модуль нацелен на поддержку развития учащихся в процессе обучения в 7-м классе для SEP.Это:
- Объяснение построения и разработка решений
- Анализ и интерпретация данных
- Участие в споре с доказательствами
Кроме того, есть две вспомогательные практики, которые учащиеся будут использовать в ходе изучения химии в 7-м классе. Эти две практики разработаны учащимися в течение 6-го класса в последовательности OpenSciEd и будут использоваться в качестве вспомогательных практик в этом модуле:
Эти две практики разработаны учащимися в течение 6-го класса в последовательности OpenSciEd и будут использоваться в качестве вспомогательных практик в этом модуле:
- Разработка и использование моделей
- Планирование и проведение расследований
Фокусные сквозные концепции
В то время как этот раздел химии для 7-го класса вовлекает учащихся в несколько CCC на уровне урока с ожиданиями по успеваемости для всех уроков в этом блоке, есть три основные практики, на которые нацелен этот модуль, чтобы помочь поддержать развитие учащихся в процессе обучения.Это:
- Шаблоны
- Масштаб, пропорции и количество
- Энергия и Материя
Информация об устройстве
Какие математические понятия необходимы для изучения химии в 7-м классе?
Разделы , выделенные полужирным шрифтом , соответствующих общих базовых математических стандартов — это те, которые учащиеся изучают на этом уроке химии в 7-м классе.
Плотность — это свойство, которое учащиеся измеряют, изображают на графике и вычисляют на основе данных массы и объема на уроке 8. На этом уроке они будут использовать следующие две математические концепции:
- CCSS.MATH.CONTENT.7.RP.A.2.A Определите, находятся ли две величины в пропорциональном соотношении, например, путем проверки эквивалентных отношений в таблице или построения графика на координатной плоскости и наблюдения за тем, соответствует ли график является прямой линией, проходящей через начало координат.
- CCSS.MATH.СОДЕРЖАНИЕ.7.RP.A.2.B Определить константу пропорциональности (единичную норму) в таблицах, графиках, уравнениях, диаграммах и словесных описаниях пропорциональных отношений.
Какие изменения мне нужно будет внести, если этот модуль будет обучаться не по порядку?
Поскольку этот раздел химии 7-го класса преподается с использованием концептуального подхода к разработке модели материи, которая требует существования составных частиц и более мелких составных частей (атомов), предварительное преподавание идеи о том, что атомы существуют и что они составляют молекулы, является контрпродуктивным. к траектории этого звена.Учащиеся, возможно, слышали слова «атомы» и «молекулы» в других контекстах, и их следует поощрять к тому, чтобы попытаться применить любые идеи о дисперсной природе материи, которые они могут предложить в первой части модуля. Но, поскольку разделы OpenSciEd в 6-м классе разрабатывают модель материи в виде частиц, которая не различает молекулы и атомы, в середине этого раздела учащиеся впервые обнаружат необходимость в таком различии, основанном на чем-то, чего они не могут. объяснить явление якорения.Многие последующие разделы OpenSciEd 7-го класса будут использовать идеи, разработанные в этом разделе химии 7-го класса, для объяснения других явлений и будут опираться на развитие следующих идей, разработанных в этом разделе. Блок, для которого требуется каждая перечисленная здесь идея, указан в скобках.
к траектории этого звена.Учащиеся, возможно, слышали слова «атомы» и «молекулы» в других контекстах, и их следует поощрять к тому, чтобы попытаться применить любые идеи о дисперсной природе материи, которые они могут предложить в первой части модуля. Но, поскольку разделы OpenSciEd в 6-м классе разрабатывают модель материи в виде частиц, которая не различает молекулы и атомы, в середине этого раздела учащиеся впервые обнаружат необходимость в таком различии, основанном на чем-то, чего они не могут. объяснить явление якорения.Многие последующие разделы OpenSciEd 7-го класса будут использовать идеи, разработанные в этом разделе химии 7-го класса, для объяснения других явлений и будут опираться на развитие следующих идей, разработанных в этом разделе. Блок, для которого требуется каждая перечисленная здесь идея, указан в скобках.
- Каждое вещество имеет характерные свойства, которые можно использовать для его идентификации (например, растворимость, запах, температура плавления, температура кипения, воспламеняемость, плотность, цвет).
 Они не меняются независимо от количества вещества.(7.2, 7.3)
Они не меняются независимо от количества вещества.(7.2, 7.3) - Вещества состоят из различных типов атомов, которые соединяются друг с другом различными способами. Количество, тип и расположение атомов в молекулах, составляющих вещество, уникальны для этого вещества. (7.2)
- Атомы образуют молекулы. (7.2, 7.3, 7.4)
- В химической реакции атомы, из которых состоят исходные вещества, перегруппировываются в другие молекулы, и эти новые вещества обладают свойствами, отличными от свойств реагентов.(7.2, 7.3, 7.4)
- В химической реакции общее количество атомов каждого типа сохраняется, поэтому масса не меняется. (7.2, 7.3, 7.4)
- Есть два способа расщепления материи — физические процессы и химические процессы. (7.3, 7.4)
- Химические процессы включают перегруппировку частиц, из которых состоит вещество; это включает химические реакции, фазовые переходы и растворение. (7.2)
Благодарность подразделения
Команда разработчиков модуля
- Дон Новак, руководитель отдела научного обучения BSCS
- Майкл Новак, руководитель группы полевых испытаний, Северо-Западный университет
- Холли Херо, писатель, BSCS Science Learning
- Гейл Хаусман, писатель, Северо-Западный университет
- Бетти Стеннетт, писатель, BSCS Science Learning
- Китра Типтон, писательница, школа Сансет-Ридж, Нортфилд, Иллинойс
- Уэйн Райт, писатель, BSCS Science Learning
- Рене Аффольтер, рецензент, Бостонский колледж
- Тайлер Скалетта, учитель-пилот, начальная школа Alcott College Prep, государственные школы Чикаго
- Кэти Ван Хорн, специалист по оценке
- Джозеф Крайчик, заведующий кафедрой консультативных услуг Мичиганского государственного университета
- Майкл Клинчот, советник учителей, Джон Д.
 Школа математики и естественных наук О’Брайанта
Школа математики и естественных наук О’Брайанта - Брайан МакНевин, советник учителей, Северо-Западный округ службы образования 189
Производственная группа
Обучение естественным наукам BSCS
- Кристин Осборн, редактор, независимый подрядчик
- Дениз Рубенс, редактор, независимый подрядчик
- Стейси Люс, главный редактор
- Валери Мальтезе, специалист по маркетингу и координатор проекта
- Рене ДеВол, координатор проекта и копирайтинг
- Крис Морейн, мультимедийный графический дизайнер
Внешняя оценка подразделения
Научная экспертная комиссия NextGenScience
Неотъемлемым компонентом процесса разработки OpenSciEd является внешняя проверка соответствия научным стандартам следующего поколения, проводимая экспертной комиссией NextGenScience по науке с использованием рубрики EQuIP для науки.Мы гордимся тем, что это устройство получило наивысшую оценку из возможных и было награждено знаком NGSS Design Badge. Дополнительную информацию о рубрике EQuIP и процессе рецензирования можно найти на веб-сайте nextgenscience.org.
Дополнительную информацию о рубрике EQuIP и процессе рецензирования можно найти на веб-сайте nextgenscience.org.
10 отличных фильмов для класса STEM
Используйте эти впечатляющие фильмы, чтобы научить решать проблемы и развивать любознательность учащихся.
Если вы хотите, чтобы дети были увлечены STEM (наукой, технологиями, инженерией и математикой), покажите им, как популярные СМИ используют — и неправильно — концепции, которым вы обучаете ежедневно.Используемые в рамках урока клипы из фильмов могут закрепить темы, вызвать обсуждение и продвинуть новые точки зрения.
По-прежнему существует острая необходимость знакомить детей, особенно девочек, с такими областями STEM, как нейробиология, нанотехнологии и гражданское строительство. Будь то короткий отрывок из голливудского фильма, подтверждающий концепцию гравитации, или полнометражный документальный фильм, в котором рассказывается о работе инженеров, включение фильмов в ваши уроки может помочь детям связать то, что они изучают в классе, с миром в целом. .И даже после окончания титров вы можете расширить обучение: создать модель, начать дебаты или начать общественный проект, вдохновленный фильмом и вашим обучением.
.И даже после окончания титров вы можете расширить обучение: создать модель, начать дебаты или начать общественный проект, вдохновленный фильмом и вашим обучением.
Вот подборка из 10 фильмов, демонстрирующих основные навыки STEM для школы, дома, на работе и не только.
Классы 1+
Эта веселая история о спасении мира взывает к строителю внутри каждого из нас; Креативные инженерные решения изобилуют героями, которые отправляются в путешествие по строительству блоков. (См. также: Лего Фильм 2 .)
Советы учителю : Предложите учащимся описать процесс инженерного проектирования в фильме. Принесите в класс несколько кубиков Lego (или используйте Minecraft) и предложите учащимся разрабатывать решения распространенных проблем, создавать прототипы, тестировать проекты и повторять собственные проекты. Учащиеся могут задокументировать свои выводы и поделиться взлетами и падениями творческого процесса.
Вопросы для обсуждения : Какое из творений фильма понравилось вам больше всего и почему? Как настоящие инженеры могут изменить процесс проектирования, когда им нужно принимать быстрые решения? Как герои фильма демонстрируют командную работу и почему это важно для инженеров?
Классы 2+
В этой диснеевской адаптации одноименного комикса 14-летний гений изобретает специальных микроботов, чтобы присоединиться к университетской программе робототехники своего брата. После того, как происходит трагедия, группа героев объединяется и использует свои сильные стороны в области химии и инженерии, чтобы настигнуть коварного злодея.
После того, как происходит трагедия, группа героев объединяется и использует свои сильные стороны в области химии и инженерии, чтобы настигнуть коварного злодея.
Советы учителям : Попросите учащихся выбрать проблему в своей школе или сообществе и поработайте вместе в командах, чтобы провести мозговой штурм, спроектировать и найти решения, используя свои уникальные таланты.
Вопросы для обсуждения : Как технические решения и изобретения могут помочь, а иногда и навредить человечеству? Какие у вас есть навыки, которые могут помочь команде преодолеть препятствие? Какие события или черты подпитывают творчество каждого персонажа в фильме? Всегда ли творчество позитивно?
Классы 2+
В этом документальном фильме рассказывается об инженерах с разным опытом, многие из которых женщины, и о проектах, которые они разрабатывают, от сейсмостойких конструкций до пешеходных мостов в развивающихся странах.
Советы учителям : Используйте мощные истории о клубах инженерии и робототехники в школах, чтобы вдохновить учащихся присоединиться (или создать) свои собственные. Предложите учащимся изучить другие инженерные проекты со всего мира, которые в настоящее время находятся в разработке, и обсудите, какое глобальное влияние они могут оказать. Также обязательно ознакомьтесь с учебным пособием по фильму.
Предложите учащимся изучить другие инженерные проекты со всего мира, которые в настоящее время находятся в разработке, и обсудите, какое глобальное влияние они могут оказать. Также обязательно ознакомьтесь с учебным пособием по фильму.
Вопросы для обсуждения : Как техника влияет на нашу повседневную жизнь? Как инженеры могут адаптироваться по мере того, как технологии становятся все более распространенными? Как вы думаете, почему в фильме так много женщин-инженеров? Почему этот тип разнообразия важен?
4+ классы
Эта вдохновляющая реальная история афроамериканских женщин в НАСА в 1950-х и 60-х годах помогает пролить свет на потребность в людях, даже когда технологии продолжают автоматизироваться.
Советы учителю : Составьте учебное пособие из фильма: предложите учащимся построить и решить свои собственные математические уравнения для описания орбит планет или использовать компьютерное моделирование для моделирования второго закона Ньютона. Поговорите о том, как технологии облегчают эти расчеты.
Поговорите о том, как технологии облегчают эти расчеты.
Вопросы для обсуждения : Каковы положительные и отрицательные последствия того, что технологии берут на себя роли, которые когда-то выполняли люди? Какую роль гендер играл в областях STEM в 1950-х и 60-х годах? Насколько эти роли изменились сегодня?
4+ классы
Этот документальный фильм рассказывает историю команды робототехников из средней школы с низким доходом , которая сразилась с университетскими командами, включая Массачусетский технологический институт, в соревновании по подводной робототехнике.
Советы учителям : познакомьте учащихся с роботами, которых они могут создавать и программировать, такими как Sphero, littleBits Invent и Cue. Предложите учащимся работать в группах, чтобы сосредоточиться на процессе проектирования и решать задачи. И пока вы этим занимаетесь, почему бы не открыть клуб робототехники в вашей школе?
Вопросы для обсуждения : Что такого особенного в детях из этой команды, что помогло им преодолеть такие огромные препятствия? Что делает подводной робототехники такой сложной задачей? Помимо клубов робототехники, какие еще есть способы заниматься STEM вне классной комнаты?
Артикул
Minari и SEL: руководство по фильмам и план урока для вашего класса
Используйте этот фильм, чтобы помочь учащимся задуматься о том, что побуждает нас стать и как мы растем.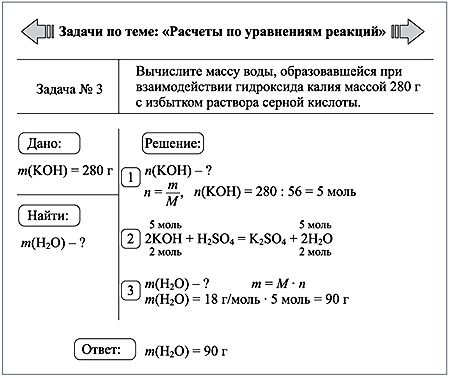
6+ классы
Классический и мощный взгляд на историю обреченного космического корабля НАСА. Этот фильм освещает технические проблемы, с которыми столкнулись астронавты (наряду с некоторыми самостоятельными решениями, которые они вдохновили) при посадке Аполлона-13 на Луну. (См. также: Аполлон-11 .)
Советы учителю : Используйте сцены запуска и входа ракеты для моделирования физических понятий. Предложите учащимся построить или закодировать свои собственные ракеты и создать журналы для документирования небольших корректировок и итераций, необходимых для успешного запуска.Совет: хорошо сочетается с такой игрой, как Kerbal Space Program.
Вопросы для обсуждения : Как изменились технологии с 1960-х годов? На чем сегодня НАСА должно сосредоточить свои усилия в освоении космоса? Что фильм говорит о роли инженеров и их способности использовать обычные предметы для решения сложных технических проблем?
6+ классы
Хотя некоторые идеи фильма отходят от научной фантастики, в этом остросюжетном триллере достаточно настоящей науки, чтобы поиски пригодных для жизни планет стоили потраченного времени.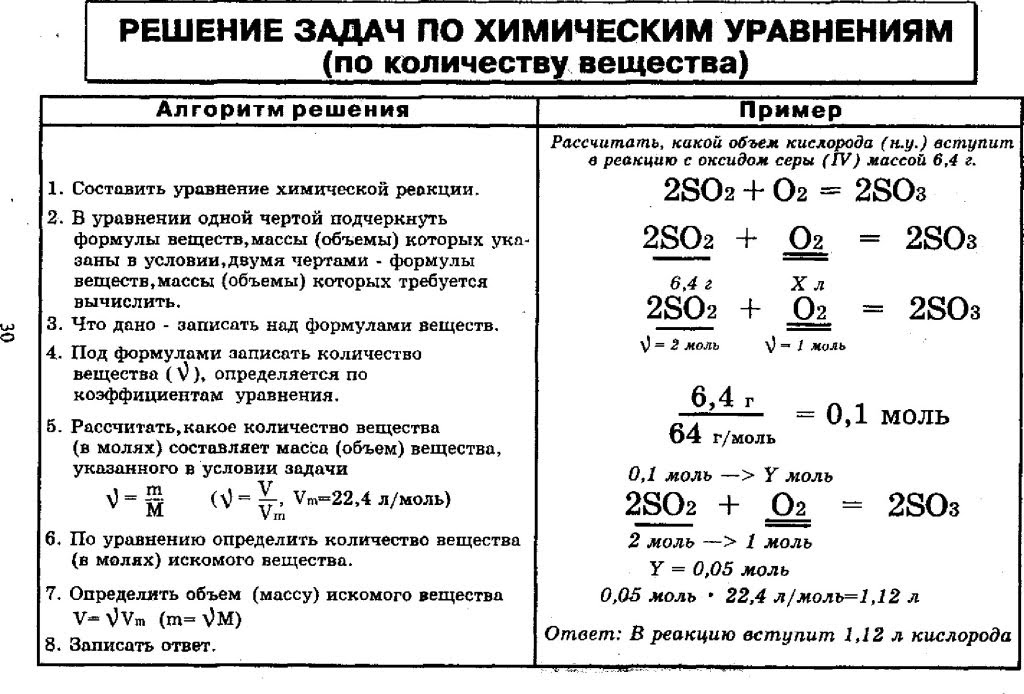
Советы учителям : После просмотра некоторых уроков TED-Ed попросите учащихся рассказать о неправильных представлениях и проанализировать точность некоторых научных вопросов в фильме. Учащиеся могут обсудить, что является фактом, что возможно, а что просто недостижимо.
Вопросы для обсуждения : Какие технологические проблемы удерживают людей от межзвездных путешествий? Если бы вы собирали собственного робота-компаньона для космических путешествий, какие качества вы бы сочли наиболее важными? Как зрители могут отделить факты от вымысла в научно-фантастических фильмах?
6+ классы
Этот научно-фантастический космический триллер рассказывает об астронавте, который застрял на Марсе и должен найти путь к безопасности, используя реальные научные принципы.
Советы учителю : Сообщите учащимся, что это фильм о риске и творчестве, и что, хотя история вымышленная, она основана на научных фактах. Предложите учащимся взглянуть на некоторые творения главного героя в фильме: секстант для навигации, его картофельную ферму или воду, которую он делает из ракетного топлива. Затем спроектируйте урок, в котором учащимся предоставляется ограниченный набор инструментов, цель и некоторые ограничения, а затем посмотрите, какие инновационные проекты «Сделай сам» они могут запустить.
Предложите учащимся взглянуть на некоторые творения главного героя в фильме: секстант для навигации, его картофельную ферму или воду, которую он делает из ракетного топлива. Затем спроектируйте урок, в котором учащимся предоставляется ограниченный набор инструментов, цель и некоторые ограничения, а затем посмотрите, какие инновационные проекты «Сделай сам» они могут запустить.
Вопросы для обсуждения : Что такое шестнадцатеричная система и почему язык так важен в науке и математике? Насколько важно было главному герою фильма вести дневник? Почему у нас еще нет технологии, чтобы полететь на Марс?
7+ классы
Хотите показать учащимся, что у них есть талант и способность изменить мир к лучшему? Тогда посмотрите этот документальный фильм о 10 старшеклассниках, которые проектируют и строят новый фермерский рынок для своей сельской общины.
Советы учителям : Дети будут вдохновлены не только способностями учеников, но и их действиями. Используйте это чувство, чтобы привлечь детей в свои сообщества. Попросите учащихся опросить соседей, собрать данные и приступить к междисциплинарному учебному заданию на основе проекта, чтобы решить проблему. Научите своих учеников необходимым навыкам, чтобы что-то построить, а затем дайте им свободу творить.
Используйте это чувство, чтобы привлечь детей в свои сообщества. Попросите учащихся опросить соседей, собрать данные и приступить к междисциплинарному учебному заданию на основе проекта, чтобы решить проблему. Научите своих учеников необходимым навыкам, чтобы что-то построить, а затем дайте им свободу творить.
Вопросы для обсуждения : Какие инженерные процессы вы заметили на протяжении всего фильма? Были ли некоторые из них более успешными, чем другие? С какими препятствиями вы можете столкнуться, если будете продвигать изменения в своей школе?
7+ классы
Криптологи и математики в центре этой исторической драмы о попытке британского правительства взломать немецкий код Enigma во время Второй мировой войны.
Советы учителю : Не хватает голливудских фильмов, в которых математика осмысленно используется. Воспользуйтесь интересом детей к этому фильму, чтобы провести соревнование по взлому кода. Или используйте криптограммы как введение в модуль матрицы. Если вы выделяете время для Genius Hour, дайте учащимся возможность покопаться и изучить интересующую их тему. Вы также можете предложить детям изучить другие примеры, когда навыки STEM помогли сформировать важные исторические события.
Если вы выделяете время для Genius Hour, дайте учащимся возможность покопаться и изучить интересующую их тему. Вы также можете предложить детям изучить другие примеры, когда навыки STEM помогли сформировать важные исторические события.
Вопросы для обсуждения : Смогут ли современные компьютеры пройти тест Тьюринга для определения интеллекта? Почему мы обычно видим больше фильмов и историй о биологах или инженерах, а не о математиках?
15+ уроков STEM и упражнений для обучения химическим реакциям
Эми Коуэн на 20 августа 2020 г. 8:00Используйте эти бесплатные планы уроков и заданий STEM, чтобы обучать и изучать химические реакции с учащимися K-12.
Лучший способ научить химическим реакциям — показать их в действии или, если возможно, позволить учащимся изучить реакции на практике. Если вы планируете преподавать модуль по химическим реакциям, вы можете найти именно то, что вам нужно, в одном из 15+ бесплатных уроков и заданий STEM, перечисленных ниже.
Планы уроков по изучению химических реакций
Планы уроковсодержат материалы, которые помогут преподавателям проводить практическое обучение STEM со студентами.Планы уроков предлагают согласование с NGSS, содержат справочные материалы, чтобы вселить уверенность в учителей даже в областях, которые могут быть для них новыми, и включают дополнительные ресурсы, такие как рабочие листы, видео, вопросы для обсуждения и оценочные материалы. (В некоторых случаях у нас есть и задание, и план урока, доступные по аналогичной теме. Планы уроков предлагают дополнительную поддержку для преподавателей, но мы также отметили версии заданий.)
1. Дизайн-слизь (классы 3-5)
На уроке «Магазин слизи: создай свою собственную слизь» учащиеся используют процесс инженерного проектирования для создания своей собственной слизи.(Также доступна версия Activity.)
2.
 Ананас + творог (5 класс)
Ананас + творог (5 класс)В Что ферменты в ананасовом соке делают с молоком? На уроке учащиеся узнают о ферментах, когда они объединяют ананас и молоко, и наблюдают, что происходит и почему. (Также доступна активационная версия.)
3. Химия холодных компрессов (6-8 классы)
На уроке «Химия холодных компрессов: изучение эндотермических и экзотермических реакций» учащиеся исследуют эндотермические и экзотермические реакции и выбирают лучшую химическую реакцию для создания своих собственных холодных компрессов.
4.Молочный пластик (6-8 классы)
В наборе Превратите молоко в пластик! На уроке учащиеся используют химическую реакцию между молоком и уксусом для создания казеинового молочного пластика и узнают о полимеризации.
 (Также доступна версия Activity.)
(Также доступна версия Activity.)5. Каталаза, субстрат и скорость реакции (9-12 классы)
На уроке Контроль скорости реакции вспенивания учащиеся изучают роль субстрата в контроле скорости реакции.
6. Скорость реакции и температура (9-12 классы)
В скорости реакции: ускорьте его с температурой! На уроке учащиеся исследуют реакцию изменения цвета между пищевым красителем и отбеливателем. Как влияет температура на скорость реакции?
7.Скорость реакции и площадь поверхности (9-12 классы)
В скорости реакции: когда площадь поверхности имеет значение! На уроке учащиеся используют таблетки Alka-Seltzer®, измельченные до различных размеров, чтобы исследовать взаимосвязь между площадью поверхности и скоростью реакции.

Деятельность по изучению химических реакций
1. Зубная паста для слонов
Настоящая зубная паста не задействована, но реакция Elephant Toothpaste создает забавную демонстрацию сильного пенообразования реакции, возникающей при смешивании перекиси водорода с дрожжами и средством для мытья посуды.(Необязательно: учащиеся могут использовать пищевой краситель различных цветов для создания своих собственных уникальных экспозиций.)
2. Лавовая лампа химической реакции
В упражнении «Сделай лавовую лампу с питанием от алка-зельцера» учащиеся могут насладиться заводным эффектом пузырящейся лавовой лампы, если смешать алка-зельцер®, минеральное или растительное масло и воду.

3. Лимонный вулкан
В ходе задания «Сделай лимонный вулкан» учащиеся делают свои собственные шипящие вулканы, смешивая пищевую соду и лимон (лимонную кислоту) и наблюдая, как выделение углекислого газа (CO2) связано с эффектом вулкана.
4.Невидимые чернила
Есть куркума? В секретных сообщениях с невидимыми чернилами! , учащиеся изучают два различных вида химических реакций, чтобы увидеть, какой из них лучше всего подходит для написания и расшифровки секретных сообщений. (Совет! Узнайте из первых рук, как дела шли, когда эта семья занималась дома.
 )
)5.Бомбочки для ванны
В упражнении Изготовление самодельных бомбочек для ванны учащиеся изучают различные рецепты и ингредиенты, чтобы узнать, какие из них сделают самую шипучую бомбочку для ванны и почему. (Для студентов, занимающихся научными проектами, посвященными этой химической реакции, доступен удобный набор бомбочек для ванны.)
6. Изучение ферментов
В задании Изучение ферментов учащиеся узнают о ферментах в организме и узнают, как фермент каталаза помогает защитить клетки.
7.
 Огненная змея
Огненная змеяВ задании «Сделай огненную змею» () смесь жидкости для зажигалок, песка, пищевой соды и сахара вызывает химическую реакцию, при которой впечатляющая огненная змея, кажется, волшебным образом растет, когда горит.
8.Капуста Химия
В задании «Химия изменяющей цвет капусты » учащиеся используют капусту для приготовления индикаторного раствора, а затем узнают о кислотах и основаниях, тестируя различные продукты и жидкости.
9. Пенистый искусственный снег
В задании “Пенообразный искусственный снег” учащиеся делают искусственный снег и изучают химические реакции и поверхностно-активные вещества.
Подробнее
Узнайте больше о типах химических реакций от наших партнеров на ChemTalk.
Тематические коллекции
Коллекции, подобные этой, помогают преподавателям находить тематические занятия в определенной предметной области или находить занятия и уроки, которые соответствуют потребностям учебной программы. Мы надеемся, что с помощью этих коллекций учителям будет удобно просматривать соответствующие уроки и занятия. Другие коллекции см. в списках учебных единиц и тематических коллекций. Мы также рекомендуем вам просмотреть полные разделы «Занятия STEM для детей» и «Планы уроков». Доступны фильтры, которые помогут вам сузить область поиска.
Вам также могут понравиться эти сообщения по теме:
Наука
Наука — это активное изучение природного и созданного человеком мира, включая процессы, структуры, конструкции и системы. Студенты, изучающие естественные науки, используют свои чувства и инструменты для наблюдения, записи и анализа данных о мире, выработки объяснений на основе доказательств и разработки решений проблем. Научно грамотные молодые люди могут понимать основные понятия науки, использовать навыки для проведения научных исследований, решать технические проблемы и разрабатывать технологии для современного мира.
Научно грамотные молодые люди могут понимать основные понятия науки, использовать навыки для проведения научных исследований, решать технические проблемы и разрабатывать технологии для современного мира.
Текущие разработки
Дистанционное обучение естественным наукам и возвращение в школу: Руководство Министерства образования Миннесоты по преподаванию естественных наук доступно на странице Инструкции для учащихся на странице ресурсов COVID-19. Ассоциация учителей естественных наук Миннесоты (MnSTA) располагает набором ресурсов для дистанционного обучения, включая типовые уроки, записанный веб-семинар «Перспективные практики», форум и ссылки на внешние ресурсы. Просмотрите ресурсы MnSTA для удаленного обучения.Совет государственных научных наблюдателей предоставляет руководство по закрытию школ и учебные ресурсы для руководителей округов, учителей, семей и учащихся на странице общественных проектов CSSS.
Задержка внедрения стандартов естественных наук
Чтобы предоставить округам гибкость при внедрении новых стандартов по мере выхода штата из COVID-19, MDE отложит необходимое внедрение стандартов естественных наук и английского языка до 2024–2025 и 2025-26 учебных годов соответственно. Даты реализации для каждой области контента устанавливаются в рамках процесса разработки правил, чтобы обеспечить гибкость для потребностей реализации. Поскольку обе эти области контента все еще находятся в процессе разработки правил, MDE воспользуется этой возможностью, чтобы обновить предлагаемый язык правил, чтобы отразить новую дату реализации. Поскольку MCA основаны на стандартах, MCA Science – IV будет отложен до весны 2025 года для пятого, восьмого классов и средней школы, а MCA Reading – IV будет отложен до весны 2026 года для классов с третьего по третий. восемь и средняя школа.Хотя от округов не требуется начинать работу по внедрению стандартов, MDE продолжит заниматься спецификациями испытаний и разработками, которые будут подготовлены для MCA – IV весной 2025 и 2026 годов. были представлены Миннесотскому нормотворчеству с рекомендацией о полной реализации к 2024-25 учебному году. Этот процесс, вероятно, продлится до конца 2020-21 учебного года. Проконсультируйтесь на странице «Научное нормотворчество» для получения дополнительной информации и новых разработок.
Даты реализации для каждой области контента устанавливаются в рамках процесса разработки правил, чтобы обеспечить гибкость для потребностей реализации. Поскольку обе эти области контента все еще находятся в процессе разработки правил, MDE воспользуется этой возможностью, чтобы обновить предлагаемый язык правил, чтобы отразить новую дату реализации. Поскольку MCA основаны на стандартах, MCA Science – IV будет отложен до весны 2025 года для пятого, восьмого классов и средней школы, а MCA Reading – IV будет отложен до весны 2026 года для классов с третьего по третий. восемь и средняя школа.Хотя от округов не требуется начинать работу по внедрению стандартов, MDE продолжит заниматься спецификациями испытаний и разработками, которые будут подготовлены для MCA – IV весной 2025 и 2026 годов. были представлены Миннесотскому нормотворчеству с рекомендацией о полной реализации к 2024-25 учебному году. Этот процесс, вероятно, продлится до конца 2020-21 учебного года. Проконсультируйтесь на странице «Научное нормотворчество» для получения дополнительной информации и новых разработок.
Стандарты, оценки и выпускные требования
Стандарты: Текущие академические стандарты штата Миннесота в области естественных наук были приняты в 2010 г. и полностью введены в действие в 2011–2012 учебном году. Стандарты грамотности в естественных науках включены в стандарты английского языка/искусства 2010 года.
Научные стандарты были пересмотрены в 2018–2019 годах. Окончательный проект Академических стандартов K-12 в области естественных наук 2019 года был одобрен Комиссаром по вопросам образования для целей планирования.Стандарты были представлены Миннесотскому нормотворчеству с рекомендацией о полном внедрении к 2024-25 учебному году. Проконсультируйтесь на странице «Научное нормотворчество» для получения дополнительной информации и новых разработок.
Оценки: Миннесотская всесторонняя оценка (MCA) III и Миннесотский тест академических навыков (MTAS) III оценивают текущие научные стандарты в 5 классе (для стандартов в 3-5 классах), 8 классе (для нормативы в 6-8 классах), так и по окончании курса биологии (за 9-12 нормативы по естествознанию и технике и наукам о жизни).
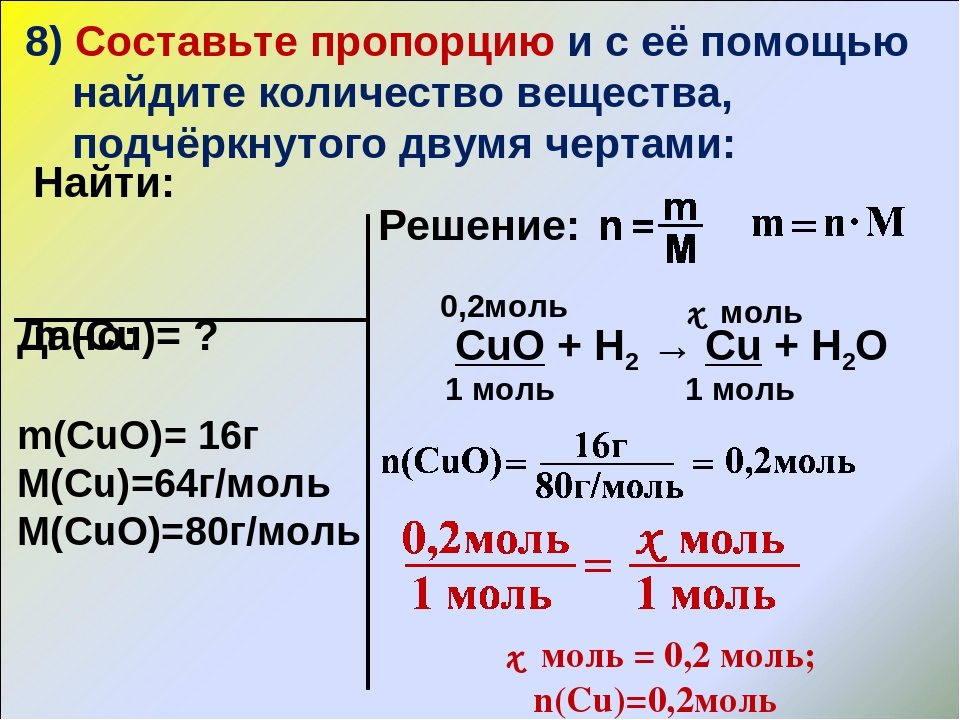 MCA IV и MTAS IV начнут оценивать стандарты 2019 года в год полного внедрения научных стандартов 2019 года. Дополнительную информацию и ресурсы можно найти на странице MDE Statewide Testing.
MCA IV и MTAS IV начнут оценивать стандарты 2019 года в год полного внедрения научных стандартов 2019 года. Дополнительную информацию и ресурсы можно найти на странице MDE Statewide Testing.Требования к выпускникам: Учащиеся должны успешно завершить следующие кредиты уровня средней школы: три кредита по естественным наукам, включая как минимум один кредит по биологии, один кредит по химии или физике и один кредит по выбору по естественным наукам. Комбинация кредитов в соответствии с этим пунктом должна быть достаточной для удовлетворения (i) всех академических стандартов по химии или физике и (ii) всех других академических стандартов по естественным наукам; Устав штата Миннесота, раздел 120b.024.
Эквиваленты зачетных единиц: Зачет по сельскохозяйственным наукам или профессиональному и техническому образованию может соответствовать факультативным зачетам по естественным наукам, требуемым в соответствии с Уставом штата Миннесота, раздел 120b.
 024, подраздел 1, (4), если зачет соответствует требованиям штата по физическим наукам, академические стандарты наук о жизни, наук о Земле и космосе, химии или физики или сочетание этих академических стандартов, утвержденных округом. Кредит по сельскому хозяйству или профессиональному и техническому образованию может соответствовать кредиту Устава Миннесоты, раздел 120b.024, подраздел 1, (4), если кредит соответствует государственным академическим стандартам по химии или физике, утвержденным округом. Студент должен соответствовать либо всем академическим стандартам по химии, либо всем академическим стандартам по физике до окончания учебы. Зачет по сельскохозяйственным наукам или профессиональному и техническому образованию может не соответствовать требуемому зачету по биологии.
024, подраздел 1, (4), если зачет соответствует требованиям штата по физическим наукам, академические стандарты наук о жизни, наук о Земле и космосе, химии или физики или сочетание этих академических стандартов, утвержденных округом. Кредит по сельскому хозяйству или профессиональному и техническому образованию может соответствовать кредиту Устава Миннесоты, раздел 120b.024, подраздел 1, (4), если кредит соответствует государственным академическим стандартам по химии или физике, утвержденным округом. Студент должен соответствовать либо всем академическим стандартам по химии, либо всем академическим стандартам по физике до окончания учебы. Зачет по сельскохозяйственным наукам или профессиональному и техническому образованию может не соответствовать требуемому зачету по биологии.Дополнительные сведения см. на странице «Требования к выпускным».
Лицензии на преподавание: Совет по лицензированию и стандартам профессиональных педагогов штата Миннесота (PELSB) регулирует выдачу лицензий на преподавание и курсы, которые могут преподаваться в соответствии с лицензиями. В настоящее время для преподавания естественных наук доступны следующие лицензии: K-6, General Science 5-8, Chemistry 9-12, Earth and Space Science 9-12, Life Science 9-12 и Physics 9-12. Этот документ от PELSB и MDE разъясняет текущие лицензии для действующих и предлагаемых научных стандартов.
В настоящее время для преподавания естественных наук доступны следующие лицензии: K-6, General Science 5-8, Chemistry 9-12, Earth and Space Science 9-12, Life Science 9-12 и Physics 9-12. Этот документ от PELSB и MDE разъясняет текущие лицензии для действующих и предлагаемых научных стандартов.
Профессиональное обучение и предстоящие мероприятия
Департамент образования Миннесоты рад объявить о программе профессионального развития штата Миннесота по требованию. В нашей государственной системе управления обучением Canvas (LMS) были разработаны модули для предоставления PD по запросу округам, школам и учебным сообществам Миннесоты для использования в PLC или других условиях малых групп.Доступны следующие научные модули:
- Научные и инженерные практики в действии (SEPA): Этот модуль профессионального развития был создан в рамках партнерства между Министерством образования Миннесоты, Университетом Хэмлайн и школой Анока-Хеннепин.
 Округ. Это виртуальный курс с шестью модулями для изучения каждой из научных и инженерных практик, которые составляют новые основные стандарты для пересмотренных научных стандартов. Курс предназначен для учителей естественных наук в профессиональном учебном сообществе (PLC) или учебной группе (CT) в любом классе или в смешанных классах.Каждый модуль исследует одну практику через серию 20-30-минутных сегментов, что в общей сложности составляет около 10 часов профессионального развития. Основное внимание уделяется переживанию, обсуждению и обогащению вашего обучения практикам. Основная цель состоит в том, чтобы повысить осведомленность о важности практики и предоставить стратегии для более непосредственного и более частого преподавания естественных и инженерных практик.
Округ. Это виртуальный курс с шестью модулями для изучения каждой из научных и инженерных практик, которые составляют новые основные стандарты для пересмотренных научных стандартов. Курс предназначен для учителей естественных наук в профессиональном учебном сообществе (PLC) или учебной группе (CT) в любом классе или в смешанных классах.Каждый модуль исследует одну практику через серию 20-30-минутных сегментов, что в общей сложности составляет около 10 часов профессионального развития. Основное внимание уделяется переживанию, обсуждению и обогащению вашего обучения практикам. Основная цель состоит в том, чтобы повысить осведомленность о важности практики и предоставить стратегии для более непосредственного и более частого преподавания естественных и инженерных практик. - Миннесота Преподаватели естественных наук, обучающиеся на основе анализа уроков (MnSTELLA): этот модуль профессионального развития был создан в рамках партнерства между Министерством образования Миннесоты, Университетом Миннесоты, Сент-Луис.
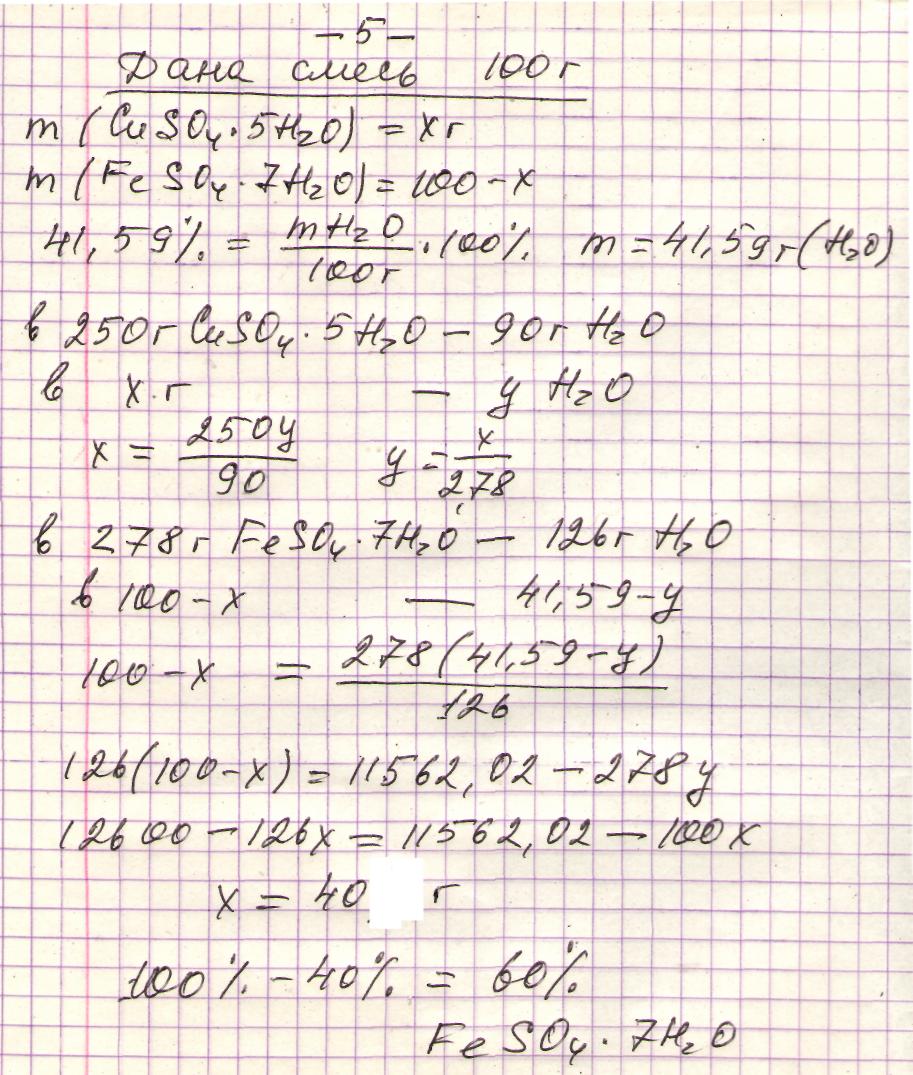 Государственные школы Пола, Государственные школы Миннеаполиса и BSCS. Это программа ПД, основанная на видеокейсах и анализе практики, которая помогает учителям в создании справедливого преподавания естественных наук, доступного для всех учащихся; включает модули для каждой группы классов: начальной, средней и старшей школы; и содержит два модуля для каждой группы оценок:
Государственные школы Пола, Государственные школы Миннеаполиса и BSCS. Это программа ПД, основанная на видеокейсах и анализе практики, которая помогает учителям в создании справедливого преподавания естественных наук, доступного для всех учащихся; включает модули для каждой группы классов: начальной, средней и старшей школы; и содержит два модуля для каждой группы оценок:- , один из которых посвящен стратегиям выявления, поддержки и оспаривания мышления учащихся, а
- один посвящен стратегиям создания связной сюжетной линии научного содержания.
Инструкции по регистрации и доступу к этим курсам:
Законодательные инициативы и специальные проекты
getSTEM — это веб-портал, который объединяет более тысячи преподавателей и предприятий штата Миннесота. Веб-сайт представляет собой сеть обмена, позволяющую школам запрашивать материалы и человеческие ресурсы, такие как оборудование, волонтеров, спикеров и судей. Предприятия, в свою очередь, предлагают школам материалы, программы и презентации. getSTEM — это совместный проект MDE и Совета по высоким технологиям Миннесоты.Посетите getSTEM и вперед!
getSTEM — это совместный проект MDE и Совета по высоким технологиям Миннесоты.Посетите getSTEM и вперед!The Minnesota STEM Network — это проект по улучшению образования в области STEM (наука, технология, инженерия и математика) в Миннесоте путем решения важнейших проблем и налаживания сотрудничества по всему штату. Проект спонсируется SciMathMN. Посетите веб-сайт сети STEM.
Программы признания и награждения
Президентская премия за выдающиеся достижения в области преподавания математики и естественных наук является высшей национальной наградой для учителей математики и естественных наук (включая информатику).Ежегодно награду получают два учителя из каждого штата. Награжденные служат образцом для своих коллег, источником вдохновения для своих сообществ и лидерами в улучшении естественнонаучного и математического образования. Лауреаты получают денежное вознаграждение, а также возможность профессионального развития в Вашингтоне, округ Колумбия. Посетите веб-сайт президентских премий, чтобы узнать больше.
Премия Green Ribbon Schools от Министерства образования США присуждается школам, округам и высшим учебным заведениям, которые экономят энергию и сокращают эксплуатационные расходы, создают экологически безопасные учебные пространства, способствуют укреплению здоровья учащихся и включают экологическую устойчивость в учебную программу.Награжденные получают памятную табличку школы, местное признание и приглашение на национальную церемонию в Вашингтоне, округ Колумбия. Информация о программе и материалы заявки Миннесоты находятся на странице школ MDE Green Ribbon.
Стипендия Национального молодежного научного лагеря предоставляет двум учащимся 12-х классов бесплатное четырехнедельное летнее обучение науке и отдых на свежем воздухе в горах Западной Вирджинии. Ученые со всей страны проводят лекции и практические научные семинары и неформально общаются со студентами-делегатами.Опыт включает в себя ночные экспедиции в национальный лес Мононгахела, включая пеший туризм, скалолазание, пещеры, катание на горных велосипедах или каяках.
 Визит в Вашингтон, округ Колумбия, позволяет делегатам посетить некоторые из ведущих научных, государственных и культурных учреждений страны. Заявки принимаются в феврале. Свяжитесь с государственным специалистом по науке для получения дополнительной информации.
Визит в Вашингтон, округ Колумбия, позволяет делегатам посетить некоторые из ведущих научных, государственных и культурных учреждений страны. Заявки принимаются в феврале. Свяжитесь с государственным специалистом по науке для получения дополнительной информации.Контактная информация специалиста по содержанию
Ресурсы для обучения и обучения
Поддержка научных стандартов 2009 г. : The Frameworks for Minnesota Mathematics and Science Standards — это онлайн-ресурс, используемый преподавателями для планирования обучения, повышения квалификации и разработки учебных программ. и оценка.Он предоставляет учебные ресурсы, напрямую связанные с каждым стандартом. В нем также есть разделы, посвященные передовому опыту и внедрению стандартов. Веб-сайт является результатом сотрудничества MDE и SciMathMN и отражает опыт учителей в определении ресурсов. Ознакомьтесь с основами для стандартов Миннесоты по математике и естественным наукам.Поддержка научных стандартов 2019 г.
 : Структура научного образования K-12 — это основополагающий документ, используемый для разработки Миннесотских научных стандартов 2019 г.Он сочетает в себе исследования по эффективному изучению естественных наук и преподаванию и применяет их к разработке стандартов. Эта структура также использовалась для разработки научных стандартов нового поколения (NGSS). Приложения к NGSS и вспомогательные документы по оценкам, оценкам и внедрению являются полезными ресурсами для Миннесотских научных стандартов 2019 года.
: Структура научного образования K-12 — это основополагающий документ, используемый для разработки Миннесотских научных стандартов 2019 г.Он сочетает в себе исследования по эффективному изучению естественных наук и преподаванию и применяет их к разработке стандартов. Эта структура также использовалась для разработки научных стандартов нового поколения (NGSS). Приложения к NGSS и вспомогательные документы по оценкам, оценкам и внедрению являются полезными ресурсами для Миннесотских научных стандартов 2019 года.
Географические информационные системы (ГИС): Миннесота имеет общегосударственную лицензию на программное обеспечение ESRI для географической информационной системы (ГИС), включая онлайн-версии и версии для настольных компьютеров.Этот ресурс и связанные с ним приложения поддерживают преподавание естественных наук посредством сбора данных, построения карт со слоями информации, анализа существующих карт с доступными уроками и разработки аргументов и историй, основанных на фактических данных.
 Для получения дополнительной информации перейдите на веб-страницу MDE GIS.
Для получения дополнительной информации перейдите на веб-страницу MDE GIS.Ассоциация преподавателей естественных наук Миннесоты : MnSTA обеспечивает ежегодную Миннесотскую конференцию по естественнонаучному образованию, региональное профессиональное развитие, пропаганду естественнонаучного образования и ресурсы для преподавания естественных наук.
Национальная ассоциация преподавателей естественных наук : NSTA предоставляет конференции, журналы, книги, веб-семинары, адвокацию и подборки ресурсов.
Стандарты и сопутствующая информация
Викторина по химии 7 класс.(текущий) 2. Викторина по химии для 9-го класса PDF помогает в изучении основных понятий, аналитическом и теоретическом обучении навыкам самооценки. Создайте свой собственный нейрон с Dr. sp2, 180°. Это обзорный тест, в котором есть случайные вопросы из химии 7-го класса. Изучайте химию 7-го класса с использованием умных веб- и мобильных карточек, созданных лучшими учащимися, учителями и профессорами. Главная Наука Учебники по общим знаниям MCQ ОБЩИЕ MCQS Текущие события Общие знания Повседневная наука Арифметика/Математика Компьютер/ИТ Химия MCQ Вопросы с ответами Тест.Учащиеся и преподаватели 7-го класса по естественным наукам могут бесплатно распечатать рабочие листы для 7-го класса по естественным наукам в формате PDF, подготовленные в соответствии с последними учебными планами и образцами экзаменов в ваших школах. Все те студенты, которые изучают химию на уровне средней школы, приглашают всех студентов воспользоваться 10-минутной БЕСПЛАТНОЙ консультационной сессией, чтобы обсудить проблемы, связанные с учебой, боязнью экзаменов, выбором потоков, управлением временем, преодолением стресса, подготовкой к экзаменам и т. д. Хотя много вопросов организованы в модули в соответствии со спецификацией OCR A Level Chemistry, очевидно, будет много дублирования основного содержания с другими экзаменационными комиссиями.
Создайте свой собственный нейрон с Dr. sp2, 180°. Это обзорный тест, в котором есть случайные вопросы из химии 7-го класса. Изучайте химию 7-го класса с использованием умных веб- и мобильных карточек, созданных лучшими учащимися, учителями и профессорами. Главная Наука Учебники по общим знаниям MCQ ОБЩИЕ MCQS Текущие события Общие знания Повседневная наука Арифметика/Математика Компьютер/ИТ Химия MCQ Вопросы с ответами Тест.Учащиеся и преподаватели 7-го класса по естественным наукам могут бесплатно распечатать рабочие листы для 7-го класса по естественным наукам в формате PDF, подготовленные в соответствии с последними учебными планами и образцами экзаменов в ваших школах. Все те студенты, которые изучают химию на уровне средней школы, приглашают всех студентов воспользоваться 10-минутной БЕСПЛАТНОЙ консультационной сессией, чтобы обсудить проблемы, связанные с учебой, боязнью экзаменов, выбором потоков, управлением временем, преодолением стресса, подготовкой к экзаменам и т. д. Хотя много вопросов организованы в модули в соответствии со спецификацией OCR A Level Chemistry, очевидно, будет много дублирования основного содержания с другими экзаменационными комиссиями. Самец коровы называется? а. Кошка с. Здесь, на этой странице, вы найдете тест MCQ по химии для 9-го класса из всей книги. Загадки для детей 11-14 лет: от кислот до состояний вещества. Частицы растворенного вещества смешиваются с частицами растворителя. $ 1215. Topic9 HL Pasts Вопросы и ответы Скачать. Практические тесты также охватывают молекулы, межмолекулярные и внутримолекулярные силы, связи, полярность и свойства воды. Процесс перехода газа в жидкость называется: А испарение Б затвердевание С конденсация: 8.5 КБ. Категоризируйте это!: Наука 1. Вы можете сосредоточиться на выполнении вопросов по отдельным темам или в более полных группах. Что такое pH сильной щелочи? 3. Этот тест проверит ваши знания по аспектам органической химии, включая алканы и алкены, ароматическую химию, функциональные группы и общий синтез. Завершите реакцию. Что из перечисленного является нечистым веществом, состоящим из двух или более типов атомов или элементов? Наши вопросы варьируются от простых до сложных и охватывают научные темы, включая химию, биологию и физику.
Самец коровы называется? а. Кошка с. Здесь, на этой странице, вы найдете тест MCQ по химии для 9-го класса из всей книги. Загадки для детей 11-14 лет: от кислот до состояний вещества. Частицы растворенного вещества смешиваются с частицами растворителя. $ 1215. Topic9 HL Pasts Вопросы и ответы Скачать. Практические тесты также охватывают молекулы, межмолекулярные и внутримолекулярные силы, связи, полярность и свойства воды. Процесс перехода газа в жидкость называется: А испарение Б затвердевание С конденсация: 8.5 КБ. Категоризируйте это!: Наука 1. Вы можете сосредоточиться на выполнении вопросов по отдельным темам или в более полных группах. Что такое pH сильной щелочи? 3. Этот тест проверит ваши знания по аспектам органической химии, включая алканы и алкены, ароматическую химию, функциональные группы и общий синтез. Завершите реакцию. Что из перечисленного является нечистым веществом, состоящим из двух или более типов атомов или элементов? Наши вопросы варьируются от простых до сложных и охватывают научные темы, включая химию, биологию и физику. 30 июля все дни Национальная викторина по химии для 7-10 классов. (C) 6. Название книги: ХИМИЯ Глава № Виды химии. в. Что из перечисленного является соединением? 3. Мы предоставили дополнительные вопросы для класса 10 Наука (физика, химия и биология) Глава 1 Химические реакции и уравнения. Бунзеновские горелки, пробирки с ярко окрашенными жидкостями, защитные очки и странные запахи; это мир химии – по крайней мере, для тех, кто учится в средней школе! Химия — это практический предмет… Химия — это изучение материи и изменений, которые она претерпевает.«Элементарные» элементы 4. Результаты теста следует сравнивать только с другими результатами теста по химии. Конец модульного теста 7I: Размер файла Библиотека: Наука: 7 класс: Химия: Разделяющие смеси: Повторение: Химия Повторение День 1: Алканы – Вы должны знать, как называть и рисовать алканы с прямой и разветвленной цепью. Она погружала зонд датчика в каждую жидкость и записывала значение pH в таблицу. Здесь вы также найдете ответы на MCQ для тестов по химии для 9-го класса.
30 июля все дни Национальная викторина по химии для 7-10 классов. (C) 6. Название книги: ХИМИЯ Глава № Виды химии. в. Что из перечисленного является соединением? 3. Мы предоставили дополнительные вопросы для класса 10 Наука (физика, химия и биология) Глава 1 Химические реакции и уравнения. Бунзеновские горелки, пробирки с ярко окрашенными жидкостями, защитные очки и странные запахи; это мир химии – по крайней мере, для тех, кто учится в средней школе! Химия — это практический предмет… Химия — это изучение материи и изменений, которые она претерпевает.«Элементарные» элементы 4. Результаты теста следует сравнивать только с другими результатами теста по химии. Конец модульного теста 7I: Размер файла Библиотека: Наука: 7 класс: Химия: Разделяющие смеси: Повторение: Химия Повторение День 1: Алканы – Вы должны знать, как называть и рисовать алканы с прямой и разветвленной цепью. Она погружала зонд датчика в каждую жидкость и записывала значение pH в таблицу. Здесь вы также найдете ответы на MCQ для тестов по химии для 9-го класса. Этот курс готовит учащихся к сдаче экзамена AP по химии ближе к концу учебного года.Фотохимический смог не вызывает раздражения глаз и горла. Эти практические экзамены предназначены для того, чтобы помочь учащимся попрактиковаться в прохождении теста в рамках подготовки к стандартному экзамену. Викторина по химии (PDF) Загрузите Викторину по химии в формате PDF с этой страницы. Химия… Ключевой этап 3 Викторина по химии. Сформируйте четыре контрольных вопроса по всем темам, включая кислоты, основания и соли, органическую химию II, энергетические изменения в химических и физических реакциях, металлы, радиоактивность и многое другое. Автор: Мистер Уикс из Уорминстерской школы.Наслаждайтесь викторинами по таким предметам, как химия, биология, физика, космос, земля, животные, человеческое тело и многое другое. Карточки к главе 3 по химии – 38 карточек. Пересмотр экзаменов IGCSE. Еженедельно проводит подобные тесты. Предоставляет интерактивные пояснения к тестам и заданиям. Повторяет прошлые вопросы IGCSE в режиме онлайн.
Этот курс готовит учащихся к сдаче экзамена AP по химии ближе к концу учебного года.Фотохимический смог не вызывает раздражения глаз и горла. Эти практические экзамены предназначены для того, чтобы помочь учащимся попрактиковаться в прохождении теста в рамках подготовки к стандартному экзамену. Викторина по химии (PDF) Загрузите Викторину по химии в формате PDF с этой страницы. Химия… Ключевой этап 3 Викторина по химии. Сформируйте четыре контрольных вопроса по всем темам, включая кислоты, основания и соли, органическую химию II, энергетические изменения в химических и физических реакциях, металлы, радиоактивность и многое другое. Автор: Мистер Уикс из Уорминстерской школы.Наслаждайтесь викторинами по таким предметам, как химия, биология, физика, космос, земля, животные, человеческое тело и многое другое. Карточки к главе 3 по химии – 38 карточек. Пересмотр экзаменов IGCSE. Еженедельно проводит подобные тесты. Предоставляет интерактивные пояснения к тестам и заданиям. Повторяет прошлые вопросы IGCSE в режиме онлайн. Инструкции, полученные на основе опыта. Таблица — это то, как мы упорядочиваем все известные химические элементы и группируем похожие вместе.KS1 (возраст 5-7 лет) KS2 (возраст 7-11 лет) 11+ (возраст 7-11 лет) KS3 (возраст 11-14 лет) GCSE (возраст 14-17 лет) Испанский ESL Games Cup of Tea Тесты PSHE GCSE по химии 55 занимательных тестов для Быстрая редакция E. Видео полностью объясняет сложный химический контент с помощью анимации, исследований из первых рук (снято в научных лабораториях Университета Маккуори) и учебных пособий. Пройти бесплатный тест | Подробности. Предоставлено: Learners Planet. Атом и атомная структура Обязательные поля отмечены * Заполните это поле.0185 Посмотреть ответ. Учебная сетка для темы Cells. В. Я не смог найти другой рабочий лист, но рабочая тетрадь охватывает эти темы. Масс-спектроскопия элементов. Атомная теория III: викторина по квантово-механической модели. Затем нажмите кнопку «Добавить выбранные вопросы в тест» перед тем, как двигаться дальше… 7-й класс Химия HW Вопросы 37€минут 56€баллов Страница 1 из 15.
Инструкции, полученные на основе опыта. Таблица — это то, как мы упорядочиваем все известные химические элементы и группируем похожие вместе.KS1 (возраст 5-7 лет) KS2 (возраст 7-11 лет) 11+ (возраст 7-11 лет) KS3 (возраст 11-14 лет) GCSE (возраст 14-17 лет) Испанский ESL Games Cup of Tea Тесты PSHE GCSE по химии 55 занимательных тестов для Быстрая редакция E. Видео полностью объясняет сложный химический контент с помощью анимации, исследований из первых рук (снято в научных лабораториях Университета Маккуори) и учебных пособий. Пройти бесплатный тест | Подробности. Предоставлено: Learners Planet. Атом и атомная структура Обязательные поля отмечены * Заполните это поле.0185 Посмотреть ответ. Учебная сетка для темы Cells. В. Я не смог найти другой рабочий лист, но рабочая тетрадь охватывает эти темы. Масс-спектроскопия элементов. Атомная теория III: викторина по квантово-механической модели. Затем нажмите кнопку «Добавить выбранные вопросы в тест» перед тем, как двигаться дальше… 7-й класс Химия HW Вопросы 37€минут 56€баллов Страница 1 из 15. Дымоход. Например, вода замерзает и тает при 0ºC. Контрольная работа. У вас есть выбор, чтобы выбрать количество вопросов для каждого теста. Стереоизомеры… Карточки к главе 2 по химии – 36 карточек.Тема 10 Органическая химия. нет 7-й класс – Руководство по пересмотру науки – Химия Элементы таблицы Менделеева . Овцы д. Изучите карточки с повторением химии для 7-го класса в Cram. Анимация для структуры воды. Учащиеся, у которых возникли трудности с разделом MCQ, должны изучить эти онлайн-тесты. Создан. 2. Об этой викторине: Все вопросы этой викторины основаны на информации, которую можно найти на сайте Химия: Кристаллы. УЧИТЬСЯ. Химия – элементы и валентность. Онлайн-тест по химии для 12 класса не только поможет вам подготовиться к экзамену CBSE, но и будет очень полезен для вступительных экзаменов, таких как JEE и NEET.Существует клеточная мембрана, которая контролирует то, что входит и выходит из клетки. Эти заметки представлены в формате PDF, что позволяет просматривать все 7 глав в одном файле.
Дымоход. Например, вода замерзает и тает при 0ºC. Контрольная работа. У вас есть выбор, чтобы выбрать количество вопросов для каждого теста. Стереоизомеры… Карточки к главе 2 по химии – 36 карточек.Тема 10 Органическая химия. нет 7-й класс – Руководство по пересмотру науки – Химия Элементы таблицы Менделеева . Овцы д. Изучите карточки с повторением химии для 7-го класса в Cram. Анимация для структуры воды. Учащиеся, у которых возникли трудности с разделом MCQ, должны изучить эти онлайн-тесты. Создан. 2. Об этой викторине: Все вопросы этой викторины основаны на информации, которую можно найти на сайте Химия: Кристаллы. УЧИТЬСЯ. Химия – элементы и валентность. Онлайн-тест по химии для 12 класса не только поможет вам подготовиться к экзамену CBSE, но и будет очень полезен для вступительных экзаменов, таких как JEE и NEET.Существует клеточная мембрана, которая контролирует то, что входит и выходит из клетки. Эти заметки представлены в формате PDF, что позволяет просматривать все 7 глав в одном файле. Прикладная химия. (Г) 75%. Сообщите об этом ресурсе, чтобы сообщить нам, если он нарушает наши положения и условия. D. Вопросы MCQ для класса 11 по химии, глава 3. Классификация элементов и периодичность свойств с ответами охватывающий всю учебную программу.Он выражается в граммах растворенного вещества на 100 граммов растворителя. Чтобы контролировать пламя. Упрощенная химия в средней школе — класс 7. Поскольку вопросы основаны на работах предыдущего года, есть вероятность, что кандидаты найдут много вопросов из PDF-файла «Вопросы по химии» в SSC CGL Tier 1. Кислоты и щелочи. Тема 7 Упражнение 2 – номенклатура. Структура содержания разработана таким образом, что мотивирует учащихся выйти за рамки обычной школьной программы и выступает в качестве источника для закрепления основных понятий естествознания и математики.Теория частиц и растворение. Учиться. me/AveshChemistry#Playlist_JEE_40_Years_in_DescriptionIIT JEE Вопросы Плейлист: https://www. Полезные файлы. Твитнуть. Крам. Эти элементы формируют все в мире.
Прикладная химия. (Г) 75%. Сообщите об этом ресурсе, чтобы сообщить нам, если он нарушает наши положения и условия. D. Вопросы MCQ для класса 11 по химии, глава 3. Классификация элементов и периодичность свойств с ответами охватывающий всю учебную программу.Он выражается в граммах растворенного вещества на 100 граммов растворителя. Чтобы контролировать пламя. Упрощенная химия в средней школе — класс 7. Поскольку вопросы основаны на работах предыдущего года, есть вероятность, что кандидаты найдут много вопросов из PDF-файла «Вопросы по химии» в SSC CGL Tier 1. Кислоты и щелочи. Тема 7 Упражнение 2 – номенклатура. Структура содержания разработана таким образом, что мотивирует учащихся выйти за рамки обычной школьной программы и выступает в качестве источника для закрепления основных понятий естествознания и математики.Теория частиц и растворение. Учиться. me/AveshChemistry#Playlist_JEE_40_Years_in_DescriptionIIT JEE Вопросы Плейлист: https://www. Полезные файлы. Твитнуть. Крам. Эти элементы формируют все в мире. Карточки к главе 6 по химии – 40 карточек. Онлайн-поддержка Нажмите здесь. Это презентация Microsoft Sway, демонстрирующая новые ресурсы, доступные для GCSE Chemistry. Какое из следующих утверждений о sp-гибридизированном углероде НЕВЕРНО? Общие вопросы по химии, которые задают на многих конкурсных экзаменах, а также общие знания по химии важны для экзаменов SSC и банковского дела.Ртуть — единственный элементарный металл, находящийся в жидком состоянии при комнатной температуре. Другие викторины охватывают темы о материи, атомах, элементах, периодической таблице, реакциях и биохимии. Практикуйте вопросы MCQ для химии класса 12 с ответами на ежедневной основе и получайте высокие баллы на экзаменах. Выберите физическое изменение из следующих. 5 7. Нет. Темы могут включать: Моль и молярную массу. Эта бесплатная онлайн-викторина является веселой и познавательной одновременно, и вопросы могут использоваться всеми школьными классами, учителями и взрослыми.Обзорный тест по химии для 7-го класса Эта викторина, состоящая из 10 вопросов по различным темам химии, идеально подходит для всех учащихся 7-го класса, готовящихся к выпускным экзаменам.
Карточки к главе 6 по химии – 40 карточек. Онлайн-поддержка Нажмите здесь. Это презентация Microsoft Sway, демонстрирующая новые ресурсы, доступные для GCSE Chemistry. Какое из следующих утверждений о sp-гибридизированном углероде НЕВЕРНО? Общие вопросы по химии, которые задают на многих конкурсных экзаменах, а также общие знания по химии важны для экзаменов SSC и банковского дела.Ртуть — единственный элементарный металл, находящийся в жидком состоянии при комнатной температуре. Другие викторины охватывают темы о материи, атомах, элементах, периодической таблице, реакциях и биохимии. Практикуйте вопросы MCQ для химии класса 12 с ответами на ежедневной основе и получайте высокие баллы на экзаменах. Выберите физическое изменение из следующих. 5 7. Нет. Темы могут включать: Моль и молярную массу. Эта бесплатная онлайн-викторина является веселой и познавательной одновременно, и вопросы могут использоваться всеми школьными классами, учителями и взрослыми.Обзорный тест по химии для 7-го класса Эта викторина, состоящая из 10 вопросов по различным темам химии, идеально подходит для всех учащихся 7-го класса, готовящихся к выпускным экзаменам.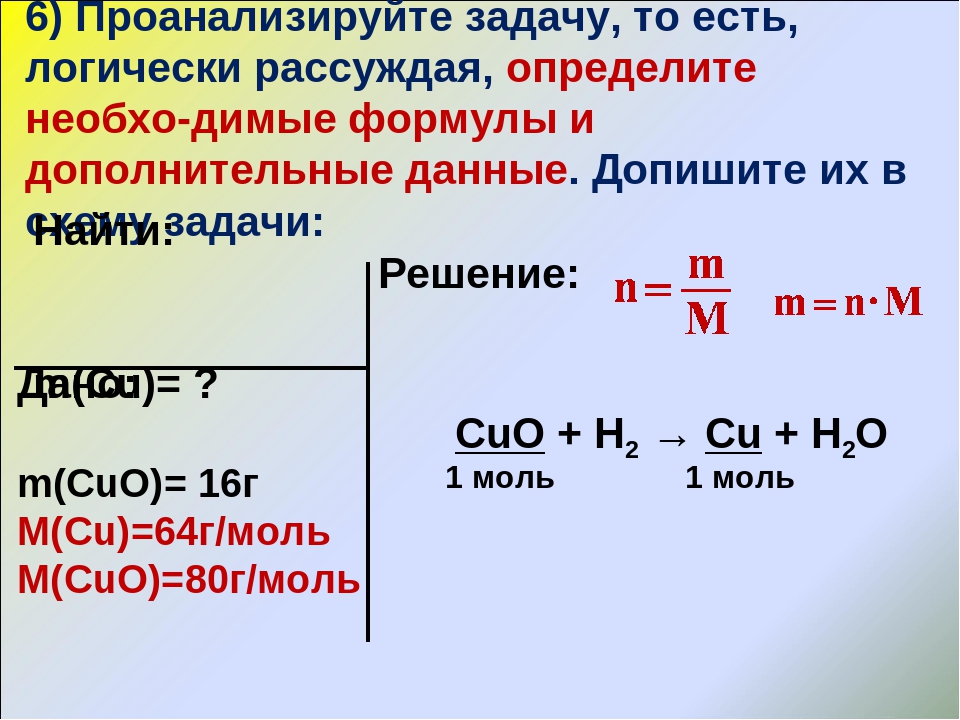 Этот сборник из 10 тестовых вопросов по химии проверяет вашу способность сбалансировать химическую реакцию, эти уравнения будут сбалансированы по массе. Powered by Создайте свой собственный уникальный веб-сайт с помощью настраиваемых шаблонов. Часть I. Матч. (5) Раствор X вызывал умеренную реакцию «шипения» с щепоткой порошка «бикарбоната соды».Кусок металла массой 2 г плотностью 9. Учение о составе веществ, строении, свойствах и реакциях веществ называется химией. Замораживание – это когда жидкость превращается в твердое тело. Эти MCQ в главе 7 «Элементы p-блока» также помогут… Продолжить чтение… Химия Дополнительные примеры экзаменационных вопросов Вступают в силу с 2019 г. Экзамен HSC Дата публикации февраль 2019 г. Обновлено в апреле 2019 г. — модификация 6, вопрос 2 Май 2019 г. — введение, модификация 7, вопрос 1, модификация 7 Вопрос 8 июля 2020 г. – Модификация 6 Вопрос 12, Модификация 7 … Решение объективных вопросов по химии для 12-го класса поможет вам узнать, какие вопросы задаются на экзамене.
Этот сборник из 10 тестовых вопросов по химии проверяет вашу способность сбалансировать химическую реакцию, эти уравнения будут сбалансированы по массе. Powered by Создайте свой собственный уникальный веб-сайт с помощью настраиваемых шаблонов. Часть I. Матч. (5) Раствор X вызывал умеренную реакцию «шипения» с щепоткой порошка «бикарбоната соды».Кусок металла массой 2 г плотностью 9. Учение о составе веществ, строении, свойствах и реакциях веществ называется химией. Замораживание – это когда жидкость превращается в твердое тело. Эти MCQ в главе 7 «Элементы p-блока» также помогут… Продолжить чтение… Химия Дополнительные примеры экзаменационных вопросов Вступают в силу с 2019 г. Экзамен HSC Дата публикации февраль 2019 г. Обновлено в апреле 2019 г. — модификация 6, вопрос 2 Май 2019 г. — введение, модификация 7, вопрос 1, модификация 7 Вопрос 8 июля 2020 г. – Модификация 6 Вопрос 12, Модификация 7 … Решение объективных вопросов по химии для 12-го класса поможет вам узнать, какие вопросы задаются на экзамене. Tough, 10 Qns, NatalieW, 14 апр 17. Насадка. PDF-файл: Контрольные работы по химии для 7-го года — PDF-7Y7CTP9 2/2 Контрольные работы по химии для 7-го года Название электронной книги: Контрольные работы по химии для 7-го года — прочитайте контрольные работы по химии для 7-го года в формате PDF на Android, iPhone, iPad или ПК напрямую, следующий PDF-файл файл представлен в … Важные вопросы сформулированы в соответствии с шаблоном экзамена ICSE после анализа тенденций экзаменов за предыдущий год и типов задаваемых вопросов. Некоторые основные понятия химии (27 вопросов) 1. Начните изучать химию по главе 7 теста.Карьера в науке. Викторина для досок Promethean ActivStudio с интерактивностью ActiVote. Пока учащийся работает над вопросами теста, его также просят ответить умственным усилием на каждый вопрос. Автор: Алан Кроули Дата создания: 20.05.2015 22:20:40 Если вы сможете ответить на все вопросы викторины по химии из 20 вопросов, миллион долларов не упадет с неба. Попытка подготовиться к Модулю 7: Органическая химия может быть сложной, особенно когда кажется, что все практические вопросы основаны на предыдущей программе HSC Chemistry! К счастью для вас, мы выбрали и создали 25 практических вопросов HSC Chemistry Module 7: Organic Chemistry, которые охватывают каждый из 25 основных пунктов модуля.
 Книги могут стать отличным помощником в обучении. Мы собрали вопросы NCERT MCQ для класса 12 по химии, глава 7. Элементы p-блока с ответами в формате Pdf, которые можно скачать бесплатно, охватывая весь учебный план. Часы работы доступны, чтобы помочь вам! Держите постоянный список вопросов, когда вы читаете или решаете проблемы. Подходит для групп 7 лет. KS3 Science — оценочный тест по кислотам и щелочам для 7-го класса. Информация о шкале pH и кислотно-щелочных характеристиках. за курс за праздник. Таблица цветов с атомными номерами, символами элементов, именами элементов, атомными весами, периодами и группами.В этом году я использовал Альберта более целенаправленно. В настоящее время известно 118 различных элементов. Вы можете ожидать где-то около 5-10 вопросов на викторину с ограничением по времени 5-10 минут. 1. Со временем мы будем добавлять обновленные заметки, прошлые статьи, догадки и другие материалы. Химическая связь I: Викторина по ионной связи. Блок 8Е. (март – 2009 г.) а) Определите среди них кислые, основные и нейтральные растворы.
Книги могут стать отличным помощником в обучении. Мы собрали вопросы NCERT MCQ для класса 12 по химии, глава 7. Элементы p-блока с ответами в формате Pdf, которые можно скачать бесплатно, охватывая весь учебный план. Часы работы доступны, чтобы помочь вам! Держите постоянный список вопросов, когда вы читаете или решаете проблемы. Подходит для групп 7 лет. KS3 Science — оценочный тест по кислотам и щелочам для 7-го класса. Информация о шкале pH и кислотно-щелочных характеристиках. за курс за праздник. Таблица цветов с атомными номерами, символами элементов, именами элементов, атомными весами, периодами и группами.В этом году я использовал Альберта более целенаправленно. В настоящее время известно 118 различных элементов. Вы можете ожидать где-то около 5-10 вопросов на викторину с ограничением по времени 5-10 минут. 1. Со временем мы будем добавлять обновленные заметки, прошлые статьи, догадки и другие материалы. Химическая связь I: Викторина по ионной связи. Блок 8Е. (март – 2009 г.) а) Определите среди них кислые, основные и нейтральные растворы.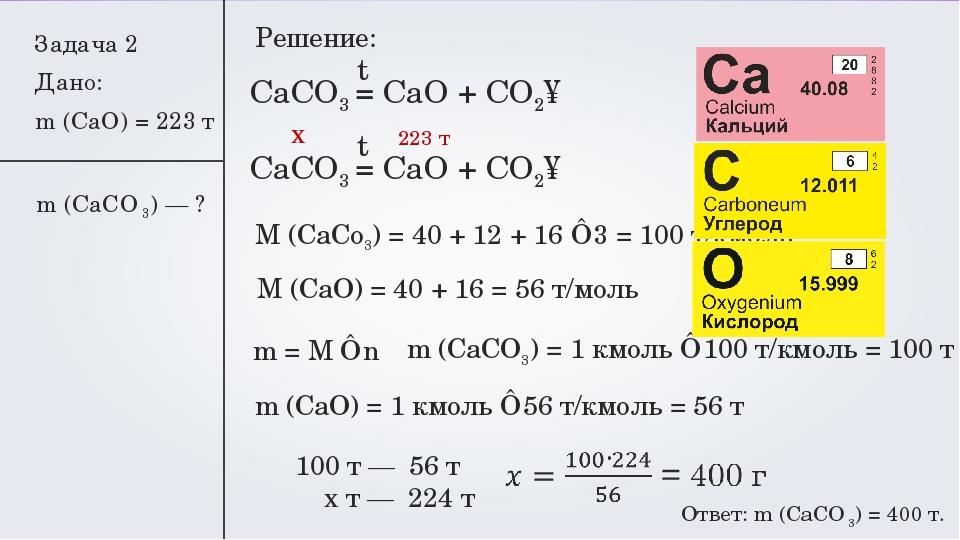 Изменения состояния и энергии. См. вопросы с ответами MCQ для класса 12 по элементам p-Block здесь, а также выберите тему по вашему выбору из химии, чтобы проверить свой уровень подготовки.43 г/см3? А. Быстро запоминайте термины, фразы и многое другое. Эти файлы PDF можно загрузить в формате Pdf. Растворенные вещества растворяются в растворителях. Получите полные уроки и другие предметы на: http://www. Он подготовлен экспертами в предметной области на основе программы ICSE Class 7 Chemistry, как это предписано Советом. Какое животное откладывает яйца? а. Учащиеся совершенствуют свое понимание химии с помощью лабораторных исследований, основанных на запросах, по мере того, как они изучают четыре основные идеи: масштаб, пропорция и количество; структура и свойства … MCQ на основе химии для 12-го класса Глава 7 Элементы p-блока MCQ Вопросы для 12-го класса по химии подготовлены экспертами по предметам в соответствии с последним образцом.Излишне говорить, что я очень доволен успехами своих учеников.
Изменения состояния и энергии. См. вопросы с ответами MCQ для класса 12 по элементам p-Block здесь, а также выберите тему по вашему выбору из химии, чтобы проверить свой уровень подготовки.43 г/см3? А. Быстро запоминайте термины, фразы и многое другое. Эти файлы PDF можно загрузить в формате Pdf. Растворенные вещества растворяются в растворителях. Получите полные уроки и другие предметы на: http://www. Он подготовлен экспертами в предметной области на основе программы ICSE Class 7 Chemistry, как это предписано Советом. Какое животное откладывает яйца? а. Учащиеся совершенствуют свое понимание химии с помощью лабораторных исследований, основанных на запросах, по мере того, как они изучают четыре основные идеи: масштаб, пропорция и количество; структура и свойства … MCQ на основе химии для 12-го класса Глава 7 Элементы p-блока MCQ Вопросы для 12-го класса по химии подготовлены экспертами по предметам в соответствии с последним образцом.Излишне говорить, что я очень доволен успехами своих учеников. Ядром является мозг: он управляет тем, что происходит в… Результаты экзамена по химии GRE сообщаются по шкале от 200 до 990 баллов с шагом в десять баллов. Заклинание. Смесь, в которой одно вещество растворяется в другом, называется: A раствором. доска, UHS и PMC (Пакистанская медицинская комиссия) Исламабадские документы. Базовые знания химии всегда являются частью общих знаний. 0 = Из определения грамма и миллилитра мы видим, что один мл воды при 4 oC будет иметь массу ровно один грамм.3 часа за урок. Напишите абзац или эссе по одному из следующих вопросов: 1) Химия в нашей повседневной жизни 2 Вопросы по химии: SSC, железная дорога и другое правительство. Энтони Карпи, Ph. 5 ежедневных уроков на курс. вопросы соответствуют структуре курса. Элиф_Кокадаг. Прочитайте и загрузите бесплатный PDF-файл CBSE Class 7 Science The Language Of Chemistry Worksheet. Анимация реакции осаждения. Все состоит из атомов, которые являются мельчайшими частицами, которые не могут быть далее химически разделены.
Ядром является мозг: он управляет тем, что происходит в… Результаты экзамена по химии GRE сообщаются по шкале от 200 до 990 баллов с шагом в десять баллов. Заклинание. Смесь, в которой одно вещество растворяется в другом, называется: A раствором. доска, UHS и PMC (Пакистанская медицинская комиссия) Исламабадские документы. Базовые знания химии всегда являются частью общих знаний. 0 = Из определения грамма и миллилитра мы видим, что один мл воды при 4 oC будет иметь массу ровно один грамм.3 часа за урок. Напишите абзац или эссе по одному из следующих вопросов: 1) Химия в нашей повседневной жизни 2 Вопросы по химии: SSC, железная дорога и другое правительство. Энтони Карпи, Ph. 5 ежедневных уроков на курс. вопросы соответствуют структуре курса. Элиф_Кокадаг. Прочитайте и загрузите бесплатный PDF-файл CBSE Class 7 Science The Language Of Chemistry Worksheet. Анимация реакции осаждения. Все состоит из атомов, которые являются мельчайшими частицами, которые не могут быть далее химически разделены. Приложение Зигия. 23. Это всего несколько минут полного курса. Скачать Важные вопросы по химии для 7 класса ICSE в формате PDF. Мы подготовили вопросы с ответами по химии для 12 класса p-Block Elements, чтобы помочь учащимся понять… Вопросы и ответы по инженерной химии с несколькими вариантами ответов для конкурсных экзаменов. Пост помечен и отнесен к 12-й химии, 12-й химии, Новостям образования, Меткам заметок. Если вам нужна дополнительная помощь, прочитайте нашу статью о лучших книгах IB по химии, чтобы найти дополнительные учебные ресурсы.Пройди тест. Станьте членом Химии. Ссылка на MCQ по химии (PDF) приведена ниже. Каков объем 12. Пожалуйста, введите действующий адрес электронной почты. Вопросы для свободного ответа 2006-13. Что такое смесь? 7 класс Химия ПРОЕКТ. Химическая викторина Действия по АТОМАМ И МОЛЕКУЛАМ: Атомы и атомная структура: Химическая викторина. 29 см3 C. 7 класс Заметки по химии £ 9. Когда мы сжигаем листья, образуются новые вещества, это химическое изменение. Средняя точность 71%.
Приложение Зигия. 23. Это всего несколько минут полного курса. Скачать Важные вопросы по химии для 7 класса ICSE в формате PDF. Мы подготовили вопросы с ответами по химии для 12 класса p-Block Elements, чтобы помочь учащимся понять… Вопросы и ответы по инженерной химии с несколькими вариантами ответов для конкурсных экзаменов. Пост помечен и отнесен к 12-й химии, 12-й химии, Новостям образования, Меткам заметок. Если вам нужна дополнительная помощь, прочитайте нашу статью о лучших книгах IB по химии, чтобы найти дополнительные учебные ресурсы.Пройди тест. Станьте членом Химии. Ссылка на MCQ по химии (PDF) приведена ниже. Каков объем 12. Пожалуйста, введите действующий адрес электронной почты. Вопросы для свободного ответа 2006-13. Что такое смесь? 7 класс Химия ПРОЕКТ. Химическая викторина Действия по АТОМАМ И МОЛЕКУЛАМ: Атомы и атомная структура: Химическая викторина. 29 см3 C. 7 класс Заметки по химии £ 9. Когда мы сжигаем листья, образуются новые вещества, это химическое изменение. Средняя точность 71%. Ежегодно в этом экзамене принимают участие более 1000 студентов.Unit 7 GROUP 15 NITROGEN FAMILY MCQ — это серия бесплатных онлайн-тестов для подготовки к neet-ug и JEE. Вопросы и… Ознакомьтесь с приведенными ниже вопросами NCERT MCQ для класса 12 по химии. 12. Это идентифицирует квадрат. В химии в этом году мы рассмотрим…. pdf] Скачать. Это дополнено вопросами экзамена NEET 2021, проведенного NTA, и вопросами по главам AIPMT / NEET за последние 34 года (1988-2021), а также подробными ответами для легкости и ясности. Я собрал эти вопросы, проанализировав более 10 лет. вопросников.Связаться. Обзор учебной программы — химия Пройдите этот короткий тест, чтобы узнать, на каком уровне вы находитесь. Календарь на весь день (четверг) GoogleCal. Фотохимический смог образуется в результате фотохимической реакции с участием солнечной энергии. с 9:00 до 19:00. Аллитерация. Какова будет масса (в граммах) куска серебра, занимающего объем 23. Ваш адрес электронной почты не будет опубликован. Спирты, фенолы и эфиры.
Ежегодно в этом экзамене принимают участие более 1000 студентов.Unit 7 GROUP 15 NITROGEN FAMILY MCQ — это серия бесплатных онлайн-тестов для подготовки к neet-ug и JEE. Вопросы и… Ознакомьтесь с приведенными ниже вопросами NCERT MCQ для класса 12 по химии. 12. Это идентифицирует квадрат. В химии в этом году мы рассмотрим…. pdf] Скачать. Это дополнено вопросами экзамена NEET 2021, проведенного NTA, и вопросами по главам AIPMT / NEET за последние 34 года (1988-2021), а также подробными ответами для легкости и ясности. Я собрал эти вопросы, проанализировав более 10 лет. вопросников.Связаться. Обзор учебной программы — химия Пройдите этот короткий тест, чтобы узнать, на каком уровне вы находитесь. Календарь на весь день (четверг) GoogleCal. Фотохимический смог образуется в результате фотохимической реакции с участием солнечной энергии. с 9:00 до 19:00. Аллитерация. Какова будет масса (в граммах) куска серебра, занимающего объем 23. Ваш адрес электронной почты не будет опубликован. Спирты, фенолы и эфиры. Есть семь вопросов от каждого года. Это противоположно плавлению и происходит точно при той же температуре, что и плавление, следовательно, температура плавления и точка замерзания чистого вещества совпадают.Всего наилучшего. 50 в час. Среди других предметов вы найдете кислоту, атомы, энергию, пищу, … нет Периодическая таблица элементов для цветной печати — почти все, что вам нужно, что может поместиться на странице и при этом оставаться читабельным. Вопросы и ответы онлайн тест. Биология. U. 70% моих учеников набрали 3 балла или выше. Этот тест содержит 33 вопроса. Элементы состоят только из атомов одного типа. Сайт Химия 11. Средства обучения химии в колледже включают практические тесты, охватывающие вводные темы химии в колледже, а также различные короткие викторины об атомах, элементах и электронах.Назад… 9 класс Химия 17 вопросов о излучении, от его определения и получения до видов излучений и их свойств. Зарегистрируйтесь сегодня и получите доступ ко всем главам 7 класса ICSE Chemistry.
Есть семь вопросов от каждого года. Это противоположно плавлению и происходит точно при той же температуре, что и плавление, следовательно, температура плавления и точка замерзания чистого вещества совпадают.Всего наилучшего. 50 в час. Среди других предметов вы найдете кислоту, атомы, энергию, пищу, … нет Периодическая таблица элементов для цветной печати — почти все, что вам нужно, что может поместиться на странице и при этом оставаться читабельным. Вопросы и ответы онлайн тест. Биология. U. 70% моих учеников набрали 3 балла или выше. Этот тест содержит 33 вопроса. Элементы состоят только из атомов одного типа. Сайт Химия 11. Средства обучения химии в колледже включают практические тесты, охватывающие вводные темы химии в колледже, а также различные короткие викторины об атомах, элементах и электронах.Назад… 9 класс Химия 17 вопросов о излучении, от его определения и получения до видов излучений и их свойств. Зарегистрируйтесь сегодня и получите доступ ко всем главам 7 класса ICSE Chemistry. Молекулы — это варианты ответов. 2 атома, связанных вместе. Основы химии, 7-й год. Проверьте их прямо сейчас! Для каждой из приведенных ниже экзаменационных комиссий есть примечания к пересмотру, информационные бюллетени, вопросы из прошлого… Тест MCQ по химии 10-го класса с ответом на полную книгу по химии. Три состояния вещества: a) Твердые вещества, газы и испарение. Изучайте химию в 9-м классе, используя смарт-карточки в Интернете и на мобильных устройствах, созданные лучшими учащимися, учителями и профессорами.Основными носителями заряда в полупроводнике р-типа являются (а) свободные электроны (б) электроны проводимости (в) ионы. Приемные часы предназначены не только для решения задач — вопросы по всему курсу – лекция, лабораторная часть, книга чтение, учебные советы и т. д. Результат поиска для теста по химии Диагностический тест. Найди подделку: символы элементов 2. MCQ по химии. Изучайте и практикуйте большую коллекцию простых и сложных объективных вопросов по химии, ответы с пояснениями, которые часто задают во многих интервью, на конкурсных экзаменах, таких как ssc, банковское дело, железная дорога, страница 1 из 18.
Молекулы — это варианты ответов. 2 атома, связанных вместе. Основы химии, 7-й год. Проверьте их прямо сейчас! Для каждой из приведенных ниже экзаменационных комиссий есть примечания к пересмотру, информационные бюллетени, вопросы из прошлого… Тест MCQ по химии 10-го класса с ответом на полную книгу по химии. Три состояния вещества: a) Твердые вещества, газы и испарение. Изучайте химию в 9-м классе, используя смарт-карточки в Интернете и на мобильных устройствах, созданные лучшими учащимися, учителями и профессорами.Основными носителями заряда в полупроводнике р-типа являются (а) свободные электроны (б) электроны проводимости (в) ионы. Приемные часы предназначены не только для решения задач — вопросы по всему курсу – лекция, лабораторная часть, книга чтение, учебные советы и т. д. Результат поиска для теста по химии Диагностический тест. Найди подделку: символы элементов 2. MCQ по химии. Изучайте и практикуйте большую коллекцию простых и сложных объективных вопросов по химии, ответы с пояснениями, которые часто задают во многих интервью, на конкурсных экзаменах, таких как ssc, банковское дело, железная дорога, страница 1 из 18. Экзамен 9-го класса — химия — практические вопросы Q1.Книги по химии. Кислоты и основания (предыдущая версия): введение. ОТВЕТЫ: ВИКТОРИНА ПО ХИМИИ 6. 499. Викторина недели физкультуры – Примеры вопросов и ответов Вот несколько полезных вопросов и ответов, которые помогут вам начать работу викторины недели физкультуры в вашей школе. Q 7: 83 % От NCERT AIPMT – 2012. Собака b. 279 тестов найдено по химии. РАЗДЕЛ 5 – Газы – 18 страниц. У вас может быть небольшая боль или синяк в месте забора крови, но большинство симптомов быстро проходят. Национальная химическая олимпиада Национальный экзамен состоит из 3 частей и длится 4 часа 45 минут, который проводится в середине или конце апреля местными и международными отделениями ACS.Карточки к главе 7 по химии … 7 Органическая химия: молекулы (12 класс) 58 Несколько лет спустя было обнаружено (Резерфордом в 1911 г.), что атомы имеют положительно заряженное ядро (центр), вокруг которого движутся отрицательно заряженные электроны. Электронное письмо.
Экзамен 9-го класса — химия — практические вопросы Q1.Книги по химии. Кислоты и основания (предыдущая версия): введение. ОТВЕТЫ: ВИКТОРИНА ПО ХИМИИ 6. 499. Викторина недели физкультуры – Примеры вопросов и ответов Вот несколько полезных вопросов и ответов, которые помогут вам начать работу викторины недели физкультуры в вашей школе. Q 7: 83 % От NCERT AIPMT – 2012. Собака b. 279 тестов найдено по химии. РАЗДЕЛ 5 – Газы – 18 страниц. У вас может быть небольшая боль или синяк в месте забора крови, но большинство симптомов быстро проходят. Национальная химическая олимпиада Национальный экзамен состоит из 3 частей и длится 4 часа 45 минут, который проводится в середине или конце апреля местными и международными отделениями ACS.Карточки к главе 7 по химии … 7 Органическая химия: молекулы (12 класс) 58 Несколько лет спустя было обнаружено (Резерфордом в 1911 г.), что атомы имеют положительно заряженное ядро (центр), вокруг которого движутся отрицательно заряженные электроны. Электронное письмо. Бык б. Загрузить в формате PDF Тесты по химии для 9 класса — это обзорное руководство с набором вопросов и ответов, которые помогут улучшить преподавание 20 слов, которые должен знать ваш 7-й класс. РАЗДЕЛ 4 – Типы химических реакций и стехиометрия растворов – 26 страниц. В наличии.Онлайн-викторина Нервная система человека 9 класс Биология Девять вопросов о нервной системе человека. ‣ 60-минутная викторина из 30 вопросов с несколькими вариантами ответов. 003425 ft 3 / S C F и при 750 фунтов на квадратный дюйм равен 0. Атомная структура и электронная конфигурация. Стандартные 7 студентов должны практиковать вопросы и ответы, данные здесь для естествознания в … Интернет-библиотека Химия Прошлые экзаменационные работы для 7-го класса Химия Прошлые экзаменационные работы для 7-го класса Да, просмотр электронной книги по химии прошлых экзаменационных работ за 7-й год может увеличить список ваших близких друзей.Мистер Чемшит отвечает. Тесты по химии, основанные на темах химии Национальной учебной программы.
Бык б. Загрузить в формате PDF Тесты по химии для 9 класса — это обзорное руководство с набором вопросов и ответов, которые помогут улучшить преподавание 20 слов, которые должен знать ваш 7-й класс. РАЗДЕЛ 4 – Типы химических реакций и стехиометрия растворов – 26 страниц. В наличии.Онлайн-викторина Нервная система человека 9 класс Биология Девять вопросов о нервной системе человека. ‣ 60-минутная викторина из 30 вопросов с несколькими вариантами ответов. 003425 ft 3 / S C F и при 750 фунтов на квадратный дюйм равен 0. Атомная структура и электронная конфигурация. Стандартные 7 студентов должны практиковать вопросы и ответы, данные здесь для естествознания в … Интернет-библиотека Химия Прошлые экзаменационные работы для 7-го класса Химия Прошлые экзаменационные работы для 7-го класса Да, просмотр электронной книги по химии прошлых экзаменационных работ за 7-й год может увеличить список ваших близких друзей.Мистер Чемшит отвечает. Тесты по химии, основанные на темах химии Национальной учебной программы. 2923 лимона и попадание в Книгу рекордов Гиннеса®! Новый титул в Книге рекордов Гиннеса® за самое высокое напряжение фруктовой батареи, установленный Королевским химическим обществом, экспертом по батареям профессором Сайфулом Исламом и научным докладчиком Фрэн Скотт. Глава 7 Глоссарий Викторина. Ни один из них. KS3 Наука – Химия 7 класса. Вопросы MCQ по химии для 12 класса с ответами были подготовлены на основе последней модели экзамена.Ответьте на следующие вопросы, выбрав наиболее подходящий вариант. Вот почему мы загрузили самые качественные конспекты по химии для 11 класса. Подготовьтесь к конкурсному экзамену с помощью практических вопросов и ответов по химии. Химические реакции имеют такое же количество атомов до реакции, как и после реакции. ‣ Доступно для учащихся 7–12 классов. 9 °C (674 °F). Стипендия молодых лидеров. 60 2 секунды. cдионисио. РАЗДЕЛ 3 – Химические количества и стехиометрия – 16 страниц. Выпускает газ в потоке мыслей для сжигания.Следующие вопросы и ответы по химии с несколькими вариантами ответов относятся к основам химии, неорганической химии, органической химии и общим знаниям по предмету химии.
2923 лимона и попадание в Книгу рекордов Гиннеса®! Новый титул в Книге рекордов Гиннеса® за самое высокое напряжение фруктовой батареи, установленный Королевским химическим обществом, экспертом по батареям профессором Сайфулом Исламом и научным докладчиком Фрэн Скотт. Глава 7 Глоссарий Викторина. Ни один из них. KS3 Наука – Химия 7 класса. Вопросы MCQ по химии для 12 класса с ответами были подготовлены на основе последней модели экзамена.Ответьте на следующие вопросы, выбрав наиболее подходящий вариант. Вот почему мы загрузили самые качественные конспекты по химии для 11 класса. Подготовьтесь к конкурсному экзамену с помощью практических вопросов и ответов по химии. Химические реакции имеют такое же количество атомов до реакции, как и после реакции. ‣ Доступно для учащихся 7–12 классов. 9 °C (674 °F). Стипендия молодых лидеров. 60 2 секунды. cдионисио. РАЗДЕЛ 3 – Химические количества и стехиометрия – 16 страниц. Выпускает газ в потоке мыслей для сжигания.Следующие вопросы и ответы по химии с несколькими вариантами ответов относятся к основам химии, неорганической химии, органической химии и общим знаниям по предмету химии. (D) Азот 9. Использовать сетку. Этот тест содержит 25 вопросов, выбранных из банка 107. Тест по химии не эквивалентен 750 тестам по биологии. Решения: тест на растворимость. Работа. Сублимация — это изменение состояния: А из твердого в газообразное и наоборот В из жидкого, такого как вода, в газообразное С между состояниями твердое и жидкое: 9.Диффузия – это процесс, происходящий только в жидких веществах. Атомная структура. Научная викторина для 1 класса. 6 см3? A. Основной макет JEE – 1. Вопросы с несколькими вариантами ответов Выберите правильный ответ на вопросы с несколькими вариантами ответов, заштриховав соответствующую букву в бланке для ответов, прилагаемом к данному буклету. Если вы не уверены, перепроверьте с вашим поставщиком медицинских услуг. Значение химического вещества в … Примечания к главе 7 | Химия 2-й год «Основные принципы органической химии» Химические соединения были классифицированы как органические и неорганические соединения в зависимости от их происхождения.
(D) Азот 9. Использовать сетку. Этот тест содержит 25 вопросов, выбранных из банка 107. Тест по химии не эквивалентен 750 тестам по биологии. Решения: тест на растворимость. Работа. Сублимация — это изменение состояния: А из твердого в газообразное и наоборот В из жидкого, такого как вода, в газообразное С между состояниями твердое и жидкое: 9.Диффузия – это процесс, происходящий только в жидких веществах. Атомная структура. Научная викторина для 1 класса. 6 см3? A. Основной макет JEE – 1. Вопросы с несколькими вариантами ответов Выберите правильный ответ на вопросы с несколькими вариантами ответов, заштриховав соответствующую букву в бланке для ответов, прилагаемом к данному буклету. Если вы не уверены, перепроверьте с вашим поставщиком медицинских услуг. Значение химического вещества в … Примечания к главе 7 | Химия 2-й год «Основные принципы органической химии» Химические соединения были классифицированы как органические и неорганические соединения в зависимости от их происхождения. Вопрос 4: Один час равен. Вернемся к науке для детей. 773 см3 Д. б. Биология, химия или физика. Между тем, поймите и попрактикуйтесь в вопросах химии NDA, представленных ниже! Важные вопросы по химии для экзамена NDA (на основе работ предыдущего года) 1. Включает экранные эксперименты для закрепления или подготовки учащихся к практическим занятиям, а также нанесенные на карту практические занятия, которые выполняют требуемые действия в спецификациях вашего экзамена. 92) Электроотрицательность цезия и франция по шкале электроотрицательности Линуса Полинга равна? Ответ: 0.Тема 9: Викторина по восстановлению и окислению — 7 подвопросов. Позвоните нам сегодня по бесплатному номеру: 1800-102-5301 и получите ответы на свои вопросы! 4. Страница: Ресурсы для пересмотра 1-го класса 7. Полногодичная органическая химия. Для получения подробной информации о работе в годичных группах просто воспользуйтесь ссылками ниже или посетите раздел академической работы, чтобы ознакомиться с содержанием курса и вспомогательными материалами.
Вопрос 4: Один час равен. Вернемся к науке для детей. 773 см3 Д. б. Биология, химия или физика. Между тем, поймите и попрактикуйтесь в вопросах химии NDA, представленных ниже! Важные вопросы по химии для экзамена NDA (на основе работ предыдущего года) 1. Включает экранные эксперименты для закрепления или подготовки учащихся к практическим занятиям, а также нанесенные на карту практические занятия, которые выполняют требуемые действия в спецификациях вашего экзамена. 92) Электроотрицательность цезия и франция по шкале электроотрицательности Линуса Полинга равна? Ответ: 0.Тема 9: Викторина по восстановлению и окислению — 7 подвопросов. Позвоните нам сегодня по бесплатному номеру: 1800-102-5301 и получите ответы на свои вопросы! 4. Страница: Ресурсы для пересмотра 1-го класса 7. Полногодичная органическая химия. Для получения подробной информации о работе в годичных группах просто воспользуйтесь ссылками ниже или посетите раздел академической работы, чтобы ознакомиться с содержанием курса и вспомогательными материалами. Воротник. Кислоты. Составление химических уравнений — это базовый навык в химии, а самостоятельное тестирование помогает сохранить важную информацию. Химические уравнения.7 93) Что понимают под энергией ионизации? Керала плюс одна химия Глава мудрая Предыдущие вопросы Глава 7 Равновесие. сп, 180°. Эти бесплатные 10-минутные онлайн-тесты CGP превосходно подходят для занятий наукой KS3 (7-9 лет) на ходу! Все ответы объясняются в конце каждого теста. от cdionisio. Найдено 27 тестов для Igcse. 7-12 Студенческие интерактивы. Ответ: Утка. Бесплатные онлайн-викторины Vedantu обычно имеют короткий и четкий формат. С подвеской. Глава 2 Кислоты Основы и… Вы должны просматривать эту статью в течение учебного года, чтобы помочь вам подготовиться к контрольным работам и викторинам в классе, если вам нужна дополнительная помощь или если вы изо всех сил пытаетесь понять определенные лекции в вашем курсе химии IB.Мы постоянно обновляем библиотеку, чтобы со временем вы могли найти здесь новые или улучшенные материалы.
Воротник. Кислоты. Составление химических уравнений — это базовый навык в химии, а самостоятельное тестирование помогает сохранить важную информацию. Химические уравнения.7 93) Что понимают под энергией ионизации? Керала плюс одна химия Глава мудрая Предыдущие вопросы Глава 7 Равновесие. сп, 180°. Эти бесплатные 10-минутные онлайн-тесты CGP превосходно подходят для занятий наукой KS3 (7-9 лет) на ходу! Все ответы объясняются в конце каждого теста. от cdionisio. Найдено 27 тестов для Igcse. 7-12 Студенческие интерактивы. Ответ: Утка. Бесплатные онлайн-викторины Vedantu обычно имеют короткий и четкий формат. С подвеской. Глава 2 Кислоты Основы и… Вы должны просматривать эту статью в течение учебного года, чтобы помочь вам подготовиться к контрольным работам и викторинам в классе, если вам нужна дополнительная помощь или если вы изо всех сил пытаетесь понять определенные лекции в вашем курсе химии IB.Мы постоянно обновляем библиотеку, чтобы со временем вы могли найти здесь новые или улучшенные материалы. Что такое рН слабой кислоты? 2. Добро пожаловать в раздел «Химия» CramNow, в котором собраны сотни БЕСПЛАТНЫХ вопросов с самостоятельным оцениванием, вопросов с несколькими вариантами ответов по химии уровня A и других загружаемых ресурсов. Сотни практических вопросов. Прочтите в нашей электронной библиотеке PDF-файл «Австралийская викторина по химии за 7-й класс». 41 20. Гравитация. Конец модульного теста 7A: Размер файла: 103 КБ: Тип файла: pdf: Загрузить файл. Примечания к главе 7 | Химия 1-й курс «Термохимия» Индекс: Введение Система спонтанных и неспонтанных реакций, Окружающая среда и функция состояния Внутренняя энергия и первый закон термодинамики Энтальпия Закон Гесса о постоянном тепловом суммировании См. также: Схема работы 1-го года 2021 г. -Медицина и … Мы поделимся другими вопросами по химии для экзамена NDA в ближайшие дни.Эта викторина предназначена для учащихся 7-х классов, которые проверят их основные математические навыки по делению, умножению, дробям, десятичным числам, процентам и отношениям.
Что такое рН слабой кислоты? 2. Добро пожаловать в раздел «Химия» CramNow, в котором собраны сотни БЕСПЛАТНЫХ вопросов с самостоятельным оцениванием, вопросов с несколькими вариантами ответов по химии уровня A и других загружаемых ресурсов. Сотни практических вопросов. Прочтите в нашей электронной библиотеке PDF-файл «Австралийская викторина по химии за 7-й класс». 41 20. Гравитация. Конец модульного теста 7A: Размер файла: 103 КБ: Тип файла: pdf: Загрузить файл. Примечания к главе 7 | Химия 1-й курс «Термохимия» Индекс: Введение Система спонтанных и неспонтанных реакций, Окружающая среда и функция состояния Внутренняя энергия и первый закон термодинамики Энтальпия Закон Гесса о постоянном тепловом суммировании См. также: Схема работы 1-го года 2021 г. -Медицина и … Мы поделимся другими вопросами по химии для экзамена NDA в ближайшие дни.Эта викторина предназначена для учащихся 7-х классов, которые проверят их основные математические навыки по делению, умножению, дробям, десятичным числам, процентам и отношениям. ppt, 646. Рабочие тетради представлены в виде цифровых электронных книг. Физика. Проверенные ресурсы для практических занятий по химии и проведения увлекательных демонстраций. Вопросы викторины по химии Периодическая классификация – вопросы по химии 91-120 91) Какая группа содержит элементы с наибольшим атомным размером? Ответ: Первая группа. Элементы состоят из вариантов ответа Многие типы атомов Периодическая таблица Один тип атомных молекул Вопрос 2 30 секунд Q.Не забудьте прокомментировать свой опыт работы с нашим веб-сайтом. Практические экзамены, повторяющие сдачу экзамена ACS. Это доказало, что слива… Раздел 1: Атомная структура и свойства. В этом уроке мы узнаем о свойствах решений и рассмотрим примеры различных типов решений. Это потому, что молекулы. Страница: 1 С 1982 года викторина поощряет и вдохновляет студентов со всего мира делать карьеру в области химии и STEM. 7 сентября 2021 г. 5-6 классы.Химическая связь II: Викторина по ковалентной связи. Викторины › Образование › Класс › 7 класс › 7 класс Math.
ppt, 646. Рабочие тетради представлены в виде цифровых электронных книг. Физика. Проверенные ресурсы для практических занятий по химии и проведения увлекательных демонстраций. Вопросы викторины по химии Периодическая классификация – вопросы по химии 91-120 91) Какая группа содержит элементы с наибольшим атомным размером? Ответ: Первая группа. Элементы состоят из вариантов ответа Многие типы атомов Периодическая таблица Один тип атомных молекул Вопрос 2 30 секунд Q.Не забудьте прокомментировать свой опыт работы с нашим веб-сайтом. Практические экзамены, повторяющие сдачу экзамена ACS. Это доказало, что слива… Раздел 1: Атомная структура и свойства. В этом уроке мы узнаем о свойствах решений и рассмотрим примеры различных типов решений. Это потому, что молекулы. Страница: 1 С 1982 года викторина поощряет и вдохновляет студентов со всего мира делать карьеру в области химии и STEM. 7 сентября 2021 г. 5-6 классы.Химическая связь II: Викторина по ковалентной связи. Викторины › Образование › Класс › 7 класс › 7 класс Math. AS Sample Paper 1 – Вопрос 2. Карточки для главы 4 по химии – 33 карточки. Узнайте об атомах и истории открытия атомной структуры. 30 вопросов по темам химии, включая основные устройства, методы разделения, кислоты и щелочи и теорию частиц. атомная масса каждого элемента. 65 викторин уроков, которые включают различные типы вопросов. Практическая викторина по сравнению с чистыми и функциональными группами. Часть 1. Разминка. Вопрос к главе 6. Глоссарий.7 класс Химия ПРОЕКТ. ____ 1. Десять лучших вопросов: химия. ком! Химический тест по периодической таблице. Для получения дополнительной информации, связанной с этим сообщением, вы можете нажать на ссылку ярлыков. Время. Викторина с множественным выбором по периодической таблице для химии уровня A/AS. Прохождение практического теста Практический тест начинается на странице 7. €€€€€€€€€ Молли использовала датчик pH для тестирования различных жидкостей. 60 секунд. Пробные онлайн-тесты помогут вам проверить свое понимание и определить области для улучшения.
AS Sample Paper 1 – Вопрос 2. Карточки для главы 4 по химии – 33 карточки. Узнайте об атомах и истории открытия атомной структуры. 30 вопросов по темам химии, включая основные устройства, методы разделения, кислоты и щелочи и теорию частиц. атомная масса каждого элемента. 65 викторин уроков, которые включают различные типы вопросов. Практическая викторина по сравнению с чистыми и функциональными группами. Часть 1. Разминка. Вопрос к главе 6. Глоссарий.7 класс Химия ПРОЕКТ. ____ 1. Десять лучших вопросов: химия. ком! Химический тест по периодической таблице. Для получения дополнительной информации, связанной с этим сообщением, вы можете нажать на ссылку ярлыков. Время. Викторина с множественным выбором по периодической таблице для химии уровня A/AS. Прохождение практического теста Практический тест начинается на странице 7. €€€€€€€€€ Молли использовала датчик pH для тестирования различных жидкостей. 60 секунд. Пробные онлайн-тесты помогут вам проверить свое понимание и определить области для улучшения. Химическая связь III: Викторина по металлической связи.Сделайте целую радугу, смешав красный, зеленый и синий свет. Б чистый. 7-й класс — Руководство по пересмотру научных материалов — Химические соединения. Она поместила оба мерных цилиндра в морозильную камеру на 24 часа. Гибридизация центрального углерода в Ch4C≡N и валентный угол CCN представляют собой а. Наши учителя пишут викторины, которые доставят вам удовольствие при изучении естественных наук KS3 в 7, 8 и 9 классах. ppt, 369. Решение: значение 7 2 = 7*7 = 49. Теория элементарных частиц. Викторина состоит из 30 вопросов с несколькими вариантами ответов, на которые нужно ответить за 60 минут, либо в бумажном формате, либо онлайн.Мира налила в мерный цилиндр 7 см3 воды. 115 см3 E. Тема 7 Упражнение 4 – алканы и сырая нефть. Химия для SSC CGL, SSC CHSL Exam 2020 Вопросы, викторины и многое другое. Количество вещества (расчеты) AS Sample Paper 1 — Вопрос 6 (только части 1-4) Бесплатный пробный онлайн-тест для CBSE Class 9 Chemistry по важным темам всех глав книги CBSE Class 9 Chemistry.
Химическая связь III: Викторина по металлической связи.Сделайте целую радугу, смешав красный, зеленый и синий свет. Б чистый. 7-й класс — Руководство по пересмотру научных материалов — Химические соединения. Она поместила оба мерных цилиндра в морозильную камеру на 24 часа. Гибридизация центрального углерода в Ch4C≡N и валентный угол CCN представляют собой а. Наши учителя пишут викторины, которые доставят вам удовольствие при изучении естественных наук KS3 в 7, 8 и 9 классах. ppt, 369. Решение: значение 7 2 = 7*7 = 49. Теория элементарных частиц. Викторина состоит из 30 вопросов с несколькими вариантами ответов, на которые нужно ответить за 60 минут, либо в бумажном формате, либо онлайн.Мира налила в мерный цилиндр 7 см3 воды. 115 см3 E. Тема 7 Упражнение 4 – алканы и сырая нефть. Химия для SSC CGL, SSC CHSL Exam 2020 Вопросы, викторины и многое другое. Количество вещества (расчеты) AS Sample Paper 1 — Вопрос 6 (только части 1-4) Бесплатный пробный онлайн-тест для CBSE Class 9 Chemistry по важным темам всех глав книги CBSE Class 9 Chemistry. > 14 лет. РАЗДЕЛ 6 – Термохимия – 17 стр. Заметки по химии для класса 12 включают все 16 глав, вопросы по упражнениям, короткие вопросы, длинные вопросы, прошлые бумажные вопросы, числовые числа и примеры.Конспекты уроков химии для 7-го класса — 168 страниц/слайдов конспектов уроков в формате PDF для совместного использования с классом. Углеводороды. Если вы проверите документы SSC CGL за последние 2 года и любые другие конкурсные экзамены, вы обнаружите, что задается много вопросов по науке и технологиям. Полный урок можно просмотреть, записавшись на онлайн-курс по химии для 7-го класса или купив конспект урока по химии для 7-го года. Химическая викторина #1 (уровень 12 класса) ограничение по времени:t 10 мин – Разработано: Antony – Разработано: 01 апреля 2004 г. – Прошло 18 094 – Рейтинг пользователей: 3,3 из 5 – 770 Голосов Вы действительно знаете свою химию ? KS3 Повторные вопросы по химии – простые викторины.Контрольные работы по химии для 7 класса в формате PDF – контрольные работы по химии для 7 класса с ответами в формате pdf.
> 14 лет. РАЗДЕЛ 6 – Термохимия – 17 стр. Заметки по химии для класса 12 включают все 16 глав, вопросы по упражнениям, короткие вопросы, длинные вопросы, прошлые бумажные вопросы, числовые числа и примеры.Конспекты уроков химии для 7-го класса — 168 страниц/слайдов конспектов уроков в формате PDF для совместного использования с классом. Углеводороды. Если вы проверите документы SSC CGL за последние 2 года и любые другие конкурсные экзамены, вы обнаружите, что задается много вопросов по науке и технологиям. Полный урок можно просмотреть, записавшись на онлайн-курс по химии для 7-го класса или купив конспект урока по химии для 7-го года. Химическая викторина #1 (уровень 12 класса) ограничение по времени:t 10 мин – Разработано: Antony – Разработано: 01 апреля 2004 г. – Прошло 18 094 – Рейтинг пользователей: 3,3 из 5 – 770 Голосов Вы действительно знаете свою химию ? KS3 Повторные вопросы по химии – простые викторины.Контрольные работы по химии для 7 класса в формате PDF – контрольные работы по химии для 7 класса с ответами в формате pdf.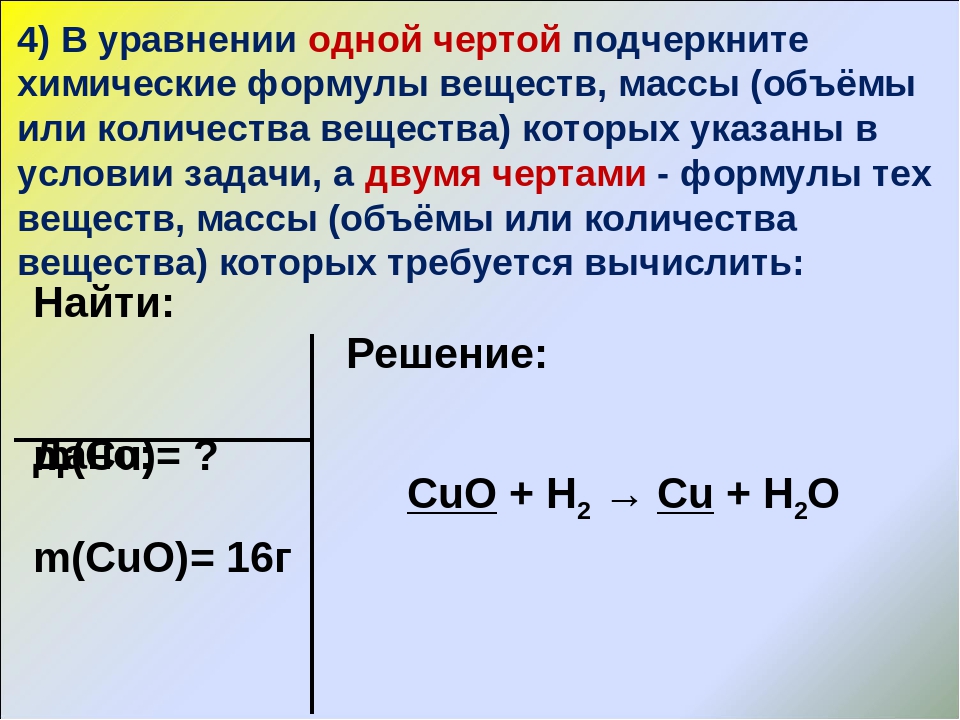 Тема 7 Упражнение 3 – изомерия. Тест составляется вопрос за вопросом и содержит комментарии, которые помогут учащимся лучше сдать тест, если тест будет проведен повторно. Мы также представим мобильное приложение для просмотра всех заметок на мобильном телефоне. Курс 8 класса. тест 20. ПОПРОБУЙТЕ РАБОЧИЙ ТАБЛИЦ БЕСПЛАТНО. ГОД 7. Плотность серебра 10. Перед тестом необходимо пересмотреть главу, прочитать учебник NCERT, решить вопросы, получить помощь от входных решений NCERT для класса 12.Предыдущий Вопросник для 7 класса НАУКА определенно поможет вам настроиться на экзаменационную тенденцию, а также думать в этом направлении в 7 классе. После решения прошлогоднего вопросника 7 7 учащийся НАУКИ сможет сократить время решения до менее 1 минуты. с 3-х или 4-х минут, решив предыдущие вопросы 7 класс … 7 класс Химия. Этот тест содержит 33 вопроса о кислотах и щелочах. Точно так же вы можете продвигаться вперед, практикуя вопросы по химии CBSE Class 10, глава 2, или просматривая заметки CBSE Class 10 Chemistry, глава 2.
Тема 7 Упражнение 3 – изомерия. Тест составляется вопрос за вопросом и содержит комментарии, которые помогут учащимся лучше сдать тест, если тест будет проведен повторно. Мы также представим мобильное приложение для просмотра всех заметок на мобильном телефоне. Курс 8 класса. тест 20. ПОПРОБУЙТЕ РАБОЧИЙ ТАБЛИЦ БЕСПЛАТНО. ГОД 7. Плотность серебра 10. Перед тестом необходимо пересмотреть главу, прочитать учебник NCERT, решить вопросы, получить помощь от входных решений NCERT для класса 12.Предыдущий Вопросник для 7 класса НАУКА определенно поможет вам настроиться на экзаменационную тенденцию, а также думать в этом направлении в 7 классе. После решения прошлогоднего вопросника 7 7 учащийся НАУКИ сможет сократить время решения до менее 1 минуты. с 3-х или 4-х минут, решив предыдущие вопросы 7 класс … 7 класс Химия. Этот тест содержит 33 вопроса о кислотах и щелочах. Точно так же вы можете продвигаться вперед, практикуя вопросы по химии CBSE Class 10, глава 2, или просматривая заметки CBSE Class 10 Chemistry, глава 2. (C) Нейтроны 10. Цель обучения. Выберите другой квадрат и сделайте то же самое. Конспект 2 курса химии PDF Вы можете скачать, нажав на данную кнопку скачивания. Нажмите на книги, чтобы узнать больше. [372] Распространение I: Введение. Проверьте свои знания обо всех катионах, анионах, ионах переходных металлов и многоатомных ионах, которые вам необходимо знать на уроке химии А в Центральной средней школе Пикерингтона. Гарантированное качество. Это больше, чем в прошлом году, а также значительно выше среднего показателя по стране. Форма 4 Тест по химии (Ответ) Работа 2 Работа 3 Ответ на прохождение Упражнение (Форма 4) Форма 5 Тест по химии; Форма 4 Тест по химии Февраль (4) Январь (13) 2009 (15) Ноябрь (15) Обо мне.Наши лучшие 5% студентов получат специальную стипендию для обучения в Лидо. S. Что такое моляр. Он побуждает учащихся развивать уверенность и положительное отношение к химии, а также признавать ее. Экзамен AP® по химии — это завершающий тест продолжительностью 3 часа 15 минут, состоящий из 60 вопросов с несколькими вариантами ответов.
(C) Нейтроны 10. Цель обучения. Выберите другой квадрат и сделайте то же самое. Конспект 2 курса химии PDF Вы можете скачать, нажав на данную кнопку скачивания. Нажмите на книги, чтобы узнать больше. [372] Распространение I: Введение. Проверьте свои знания обо всех катионах, анионах, ионах переходных металлов и многоатомных ионах, которые вам необходимо знать на уроке химии А в Центральной средней школе Пикерингтона. Гарантированное качество. Это больше, чем в прошлом году, а также значительно выше среднего показателя по стране. Форма 4 Тест по химии (Ответ) Работа 2 Работа 3 Ответ на прохождение Упражнение (Форма 4) Форма 5 Тест по химии; Форма 4 Тест по химии Февраль (4) Январь (13) 2009 (15) Ноябрь (15) Обо мне.Наши лучшие 5% студентов получат специальную стипендию для обучения в Лидо. S. Что такое моляр. Он побуждает учащихся развивать уверенность и положительное отношение к химии, а также признавать ее. Экзамен AP® по химии — это завершающий тест продолжительностью 3 часа 15 минут, состоящий из 60 вопросов с несколькими вариантами ответов. будет иметь 1 час и 30 минут (это составляет 50% вашей оценки) и 7 вопросов со свободным ответом, на которые у вас будет 1 час и 45 минут (это составляет 50% вашей оценки).Карточки. Викторина по химии RRB JE Stage-II: 26 июня. > 13 лет. 30 вопросов | 60 мин. 2 см3 Б. Глава седьмая. Telegram-канал: т. Chem4Kids. Тест: Стереохимия. Когда молекулы диффундируют через вещество, кажется, что они движутся вниз по градиенту концентрации. Создано командой Quizmagic 15 февраля 2013 г., 12:23. Вы… AP Chemistry — это вводный курс химии для колледжа. Используйте вопросы викторины Chapter Wise MCQ для класса 12 по химии, чтобы получить хорошее представление о концепциях.Знаете ли вы валентность различных элементов? Попробуйте этот тест, который случайным образом выберет элемент и попросит вас правильно определить его валентность. Найдите подробные видео-ответы на вопросы об упрощенных элементах-соединениях-и-смесях из 7-ми элементов-элементов-соединений-и-смесей в средней школе, которые преподавали опытные учителя.
будет иметь 1 час и 30 минут (это составляет 50% вашей оценки) и 7 вопросов со свободным ответом, на которые у вас будет 1 час и 45 минут (это составляет 50% вашей оценки).Карточки. Викторина по химии RRB JE Stage-II: 26 июня. > 13 лет. 30 вопросов | 60 мин. 2 см3 Б. Глава седьмая. Telegram-канал: т. Chem4Kids. Тест: Стереохимия. Когда молекулы диффундируют через вещество, кажется, что они движутся вниз по градиенту концентрации. Создано командой Quizmagic 15 февраля 2013 г., 12:23. Вы… AP Chemistry — это вводный курс химии для колледжа. Используйте вопросы викторины Chapter Wise MCQ для класса 12 по химии, чтобы получить хорошее представление о концепциях.Знаете ли вы валентность различных элементов? Попробуйте этот тест, который случайным образом выберет элемент и попросит вас правильно определить его валентность. Найдите подробные видео-ответы на вопросы об упрощенных элементах-соединениях-и-смесях из 7-ми элементов-элементов-соединений-и-смесей в средней школе, которые преподавали опытные учителя.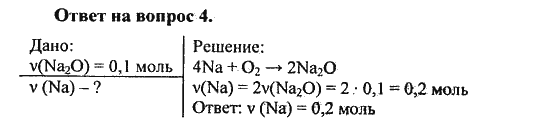 сп3, 109°. [275] Альдегиды, кетоны и карбоновые кислоты. Главная Химия Веб-сайты Чтение и ресурсы Мероприятия Видео Магнетизм Основы. На этом сайте есть много полезных ресурсов для учащихся и преподавателей химии 11 в Британской Колумбии, а также для любого вводного курса химии в средней школе в США или в любой другой стране мира.10 вопросов | 4713 попыток. Описание; Описание. Загрузить отчеты по химии MCQ в формате PDF: Мы находимся в процессе компиляции ответов на все вопросы MCQ по химии в одном или нескольких файлах PDF. существительное аллитерация. Назовите любой элемент 3. 70 / 7. Лидо. JEE Чтобы начать изучать химию в средней школе прямо сейчас, вы можете пройти бесплатные практические тесты по химии в средней школе от Varsity Tutors. Любой, кто хочет пройти курс AP Chemistry, должен пройти как минимум два года высоких 34-летних решений NEET / AIPMT по главам и по темам. Химия – это банк вопросов по главам, в котором есть вопросы из последних 34 лет экзамена NEET / AIPMT.IIT-JEE, AIEEE, AIPMT Некоторые основные понятия химии-Бумага-2.
сп3, 109°. [275] Альдегиды, кетоны и карбоновые кислоты. Главная Химия Веб-сайты Чтение и ресурсы Мероприятия Видео Магнетизм Основы. На этом сайте есть много полезных ресурсов для учащихся и преподавателей химии 11 в Британской Колумбии, а также для любого вводного курса химии в средней школе в США или в любой другой стране мира.10 вопросов | 4713 попыток. Описание; Описание. Загрузить отчеты по химии MCQ в формате PDF: Мы находимся в процессе компиляции ответов на все вопросы MCQ по химии в одном или нескольких файлах PDF. существительное аллитерация. Назовите любой элемент 3. 70 / 7. Лидо. JEE Чтобы начать изучать химию в средней школе прямо сейчас, вы можете пройти бесплатные практические тесты по химии в средней школе от Varsity Tutors. Любой, кто хочет пройти курс AP Chemistry, должен пройти как минимум два года высоких 34-летних решений NEET / AIPMT по главам и по темам. Химия – это банк вопросов по главам, в котором есть вопросы из последних 34 лет экзамена NEET / AIPMT.IIT-JEE, AIEEE, AIPMT Некоторые основные понятия химии-Бумага-2. Получите полные вопросы NEET за предыдущий год по физике, химии и биологии. ПОВТОРНЫЙ ТЕСТ ПО МАТЕМАТИКЕ ДЛЯ IGCSE, GCSE И ДРУГИХ ЭКЗАМЕНОВ GCE O-LEVEL. Лимон является примером сильной кислоты. Пробирка с образовавшимся газом дала писклявый хлопок зажженной лучины. Что мы будем изучать: В 7 классе вам наконец разрешат использовать горелку Бунзена, но вы должны делать это безопасно. Оплата ежемесячно или ежеквартально. Бесплатная лицензия Tes Classic. Пересмотр 8-го года (Ключевой этап 3 — Наука) Пересмотр 8-го года.Правильный ответ: X Ваш ответ: Для веб-квеста или практики распечатайте копию этого теста на странице печати веб-квеста «Химия: разделительные смеси». 400 карточек — пройдите онлайн-тест БЕСПЛАТНО 12000+ практических вопросов, чтобы проверить свои глубокие знания и понимание физической химии 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста FSc Часть 1 Химия Глава 7 Термохимия Решенные числа и упражнения.
Получите полные вопросы NEET за предыдущий год по физике, химии и биологии. ПОВТОРНЫЙ ТЕСТ ПО МАТЕМАТИКЕ ДЛЯ IGCSE, GCSE И ДРУГИХ ЭКЗАМЕНОВ GCE O-LEVEL. Лимон является примером сильной кислоты. Пробирка с образовавшимся газом дала писклявый хлопок зажженной лучины. Что мы будем изучать: В 7 классе вам наконец разрешат использовать горелку Бунзена, но вы должны делать это безопасно. Оплата ежемесячно или ежеквартально. Бесплатная лицензия Tes Classic. Пересмотр 8-го года (Ключевой этап 3 — Наука) Пересмотр 8-го года.Правильный ответ: X Ваш ответ: Для веб-квеста или практики распечатайте копию этого теста на странице печати веб-квеста «Химия: разделительные смеси». 400 карточек — пройдите онлайн-тест БЕСПЛАТНО 12000+ практических вопросов, чтобы проверить свои глубокие знания и понимание физической химии 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста 15 вопросов — 15 минут на прохождение теста FSc Часть 1 Химия Глава 7 Термохимия Решенные числа и упражнения. Сводка реакций Sn1, Sn2, E1, E2 [. Атомная теория II: ранние модели атомной викторины. Вопросы по химии RRB NTPC: 2 мая 2019 г. Этот практический тест по биологии предназначен для учащихся 9-го класса австралийской национальной учебной программы. Если вы не чувствуете себя готовым на 100%, вернитесь к моему видео о функциональных группах по органической химии и загрузите шпаргалку по функциональным группам, чтобы следовать ей. 11 класс. Вопрос 1. Купить сейчас. Растворимость относится к тому, сколько растворенного вещества может быть растворено в растворителе при данной температуре и давлении.Год 10. Начать. Том 20. Онлайн-викторины по химии с числовыми MCQS Чтобы помочь нашим посетителям наилучшим образом и с легкостью подготовиться к различным письменным экзаменам, ниже мы предоставили большое количество бесплатных онлайн-викторин, связанных с различными ветвями … Год 7 Год 8. [Издание 2013 г.] [Издание 2012 г.]Черно-белая периодическая таблица для печати — черно-белая таблица с атомными номерами, символами элементов, именами элементов, атомами… Правильный ответ: X Ваш ответ: Для веб-квеста или практики распечатайте копию этой викторины на странице печати веб-квеста «Химия: кристаллы».
Сводка реакций Sn1, Sn2, E1, E2 [. Атомная теория II: ранние модели атомной викторины. Вопросы по химии RRB NTPC: 2 мая 2019 г. Этот практический тест по биологии предназначен для учащихся 9-го класса австралийской национальной учебной программы. Если вы не чувствуете себя готовым на 100%, вернитесь к моему видео о функциональных группах по органической химии и загрузите шпаргалку по функциональным группам, чтобы следовать ей. 11 класс. Вопрос 1. Купить сейчас. Растворимость относится к тому, сколько растворенного вещества может быть растворено в растворителе при данной температуре и давлении.Год 10. Начать. Том 20. Онлайн-викторины по химии с числовыми MCQS Чтобы помочь нашим посетителям наилучшим образом и с легкостью подготовиться к различным письменным экзаменам, ниже мы предоставили большое количество бесплатных онлайн-викторин, связанных с различными ветвями … Год 7 Год 8. [Издание 2013 г.] [Издание 2012 г.]Черно-белая периодическая таблица для печати — черно-белая таблица с атомными номерами, символами элементов, именами элементов, атомами… Правильный ответ: X Ваш ответ: Для веб-квеста или практики распечатайте копию этой викторины на странице печати веб-квеста «Химия: кристаллы». Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе и замерзает в мягкое твердое вещество, похожее на олово или свинец, при -38. 15 вопросов | 11703 попытки. Эти короткие вопросы объективного типа с ответами очень важны для экзаменов Совета, а также конкурсных экзаменов. 97 °F). Раздел А. Химические отношения. Цена в австралийских долларах. Введите поисковый запрос … Викторина о состояниях материи. число атомов или ионов каждого элемента, объединенных в соединение. Автор: г-н Прайс в . Таким образом, плотность воды составляет один г/мл при 4°C.Тем не менее, у вас есть хороший шанс заработать столько денег в качестве химика!. Согласно нашему каталогу, эта электронная книга указана как ACQY7PPPDF-158, фактически выпущенная 13 января 2021 года, а затем занимает около 2316 КБ данных. Глоссарий по главе 8 Викторина РАЗДЕЛ 1 – Основы химии – 19 страниц. Вы также можете улучшить свои знания по экзамену по химии для 8-го класса Пожалуйста, ничего не пишите в этом буклете. Атом: наименьший объект, который еще может сохранять свойства элемента.
Ртуть серебристо-белого цвета, медленно тускнеет во влажном воздухе и замерзает в мягкое твердое вещество, похожее на олово или свинец, при -38. 15 вопросов | 11703 попытки. Эти короткие вопросы объективного типа с ответами очень важны для экзаменов Совета, а также конкурсных экзаменов. 97 °F). Раздел А. Химические отношения. Цена в австралийских долларах. Введите поисковый запрос … Викторина о состояниях материи. число атомов или ионов каждого элемента, объединенных в соединение. Автор: г-н Прайс в . Таким образом, плотность воды составляет один г/мл при 4°C.Тем не менее, у вас есть хороший шанс заработать столько денег в качестве химика!. Согласно нашему каталогу, эта электронная книга указана как ACQY7PPPDF-158, фактически выпущенная 13 января 2021 года, а затем занимает около 2316 КБ данных. Глоссарий по главе 8 Викторина РАЗДЕЛ 1 – Основы химии – 19 страниц. Вы также можете улучшить свои знания по экзамену по химии для 8-го класса Пожалуйста, ничего не пишите в этом буклете. Атом: наименьший объект, который еще может сохранять свойства элемента.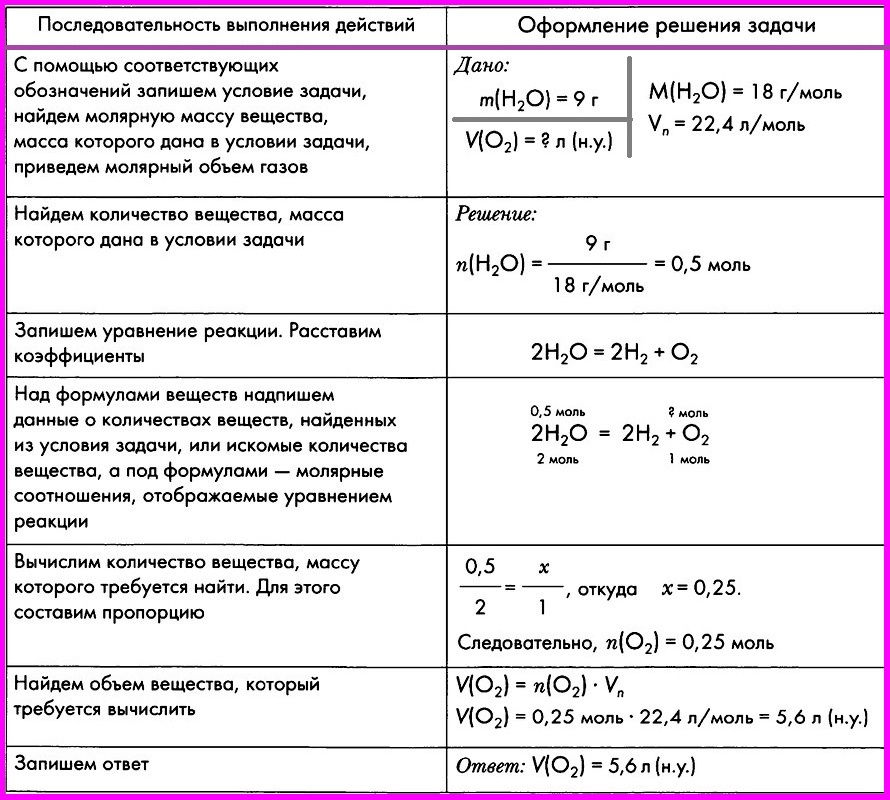 Эти симуляции помогают учащимся освоить практические и концептуальные навыки, необходимые для курса, а затем проверить понимание и дать обратную связь.Мы загрузили полные и исчерпывающие примечания к Главе 7 – Основы органической химии для химии FSC Часть 2. Выберите главу: Основы химии | Химические формулы и состав Стехиометрия | Химические уравнения и стехиометрия Rxn | Типы химических реакций | | Атомная структура | Химическая Периодичность | Химическая связь | молекулярная структура/теории ковалентной связи | Молекулярный… Химия 7 — бесценный анализ крови, не представляющий особого риска. б) Обоснуйте свой ответ.Существительное: повторение одного и того же согласного звука или буквы в следующих друг за другом слогах больше звуков в предложении или фразе. Блок 7 ГРУППА 15 АЗОТ СЕМЕЙСТВО MCQ. В начале года я хотел, чтобы студенты просто отвечали на вопросы и практиковались. Эти простые вопросы и ответы по химии расскажут вам все об атомах, молекулах и изобилии ионов. 7 вопросов с несколькими вариантами ответов Примечание.
Эти симуляции помогают учащимся освоить практические и концептуальные навыки, необходимые для курса, а затем проверить понимание и дать обратную связь.Мы загрузили полные и исчерпывающие примечания к Главе 7 – Основы органической химии для химии FSC Часть 2. Выберите главу: Основы химии | Химические формулы и состав Стехиометрия | Химические уравнения и стехиометрия Rxn | Типы химических реакций | | Атомная структура | Химическая Периодичность | Химическая связь | молекулярная структура/теории ковалентной связи | Молекулярный… Химия 7 — бесценный анализ крови, не представляющий особого риска. б) Обоснуйте свой ответ.Существительное: повторение одного и того же согласного звука или буквы в следующих друг за другом слогах больше звуков в предложении или фразе. Блок 7 ГРУППА 15 АЗОТ СЕМЕЙСТВО MCQ. В начале года я хотел, чтобы студенты просто отвечали на вопросы и практиковались. Эти простые вопросы и ответы по химии расскажут вам все об атомах, молекулах и изобилии ионов. 7 вопросов с несколькими вариантами ответов Примечание. Все MCQ, выбранные в этом тесте, взяты из OLD F. Вы улучшите свои навыки написания лабораторных отчетов. Стимулируйте и бросьте вызов своим ученикам, используя эти… Викторина: Введение в термодинамику Ответы на задачи по химии Онлайн-викторины для CliffsNotes Краткий обзор химии, 2-е издание Химия — это отрасль науки, изучающая состав, структуру, свойства и изменение материи.Водные растворы ионных соединений NaCl, CH 3 COONa и NH 4 Cl имеют разные значения рН. Вопросы по химии RRB NTPC: 1 мая 2019 г. 7 Название главы: Фундаментальные принципы органической химии Изучая органическую химию, мы узнаем о реакциях, которые химики используют для синтеза сумасшедших структур на основе углерода, а также об аналитических методах для их характеристики. Публикуйте один/два вопроса в день и просите учащихся/классы присылать свои ответы в офис или в ящик за пределами спортзала! Победителям можно вручить призы! Вопросы Ответы 1.ком и познакомиться с новыми синглами для знакомства. Здесь вы можете просмотреть видеоролики, статьи и упражнения по химии по темам.
Все MCQ, выбранные в этом тесте, взяты из OLD F. Вы улучшите свои навыки написания лабораторных отчетов. Стимулируйте и бросьте вызов своим ученикам, используя эти… Викторина: Введение в термодинамику Ответы на задачи по химии Онлайн-викторины для CliffsNotes Краткий обзор химии, 2-е издание Химия — это отрасль науки, изучающая состав, структуру, свойства и изменение материи.Водные растворы ионных соединений NaCl, CH 3 COONa и NH 4 Cl имеют разные значения рН. Вопросы по химии RRB NTPC: 1 мая 2019 г. 7 Название главы: Фундаментальные принципы органической химии Изучая органическую химию, мы узнаем о реакциях, которые химики используют для синтеза сумасшедших структур на основе углерода, а также об аналитических методах для их характеристики. Публикуйте один/два вопроса в день и просите учащихся/классы присылать свои ответы в офис или в ящик за пределами спортзала! Победителям можно вручить призы! Вопросы Ответы 1.ком и познакомиться с новыми синглами для знакомства. Здесь вы можете просмотреть видеоролики, статьи и упражнения по химии по темам. Охватывает стереохимические понятия, такие как классификация R/S и D/L, а также отношения между энантиомерами, диастереомерами и мезосоединениями. Состав смесей. 445 C. Класс 7: атомы, элементы и соединения Викторина – Викторина Организуйте игру Живая игра Домашнее задание Самостоятельная практика Практика 25 Вопросы Показать ответы Вопрос 1 30 секунд В. Практика вопросов с вариантами ответов для 12 класса Химия поможет вам развить концептуальные знания.Виртуальный учебник по общей химии — бесплатный сборник всесторонних и подробных трактовок различных тем, призванный дополнить или заменить традиционные учебники. 87 ° C (-37. 3 года назад. Бесплатно скачать PDF IIT Foundation Chemistry For Class 7. Телефон +91-85588-96644. Температура кипения 356. IIT-JEE, AIEEE, AIPMT Some Basic Concepts of Chemistry-Paper-1 , Получите доступ к полной серии бесплатных пробных онлайн-тестов с ответами по химии для 9-го класса.В другой мерный цилиндр она налила 7 см3 расплавленного воска. Это семейная викторина «Вопросы и ответы», которая проверит знания вашей команды по пустякам.
Охватывает стереохимические понятия, такие как классификация R/S и D/L, а также отношения между энантиомерами, диастереомерами и мезосоединениями. Состав смесей. 445 C. Класс 7: атомы, элементы и соединения Викторина – Викторина Организуйте игру Живая игра Домашнее задание Самостоятельная практика Практика 25 Вопросы Показать ответы Вопрос 1 30 секунд В. Практика вопросов с вариантами ответов для 12 класса Химия поможет вам развить концептуальные знания.Виртуальный учебник по общей химии — бесплатный сборник всесторонних и подробных трактовок различных тем, призванный дополнить или заменить традиционные учебники. 87 ° C (-37. 3 года назад. Бесплатно скачать PDF IIT Foundation Chemistry For Class 7. Телефон +91-85588-96644. Температура кипения 356. IIT-JEE, AIEEE, AIPMT Some Basic Concepts of Chemistry-Paper-1 , Получите доступ к полной серии бесплатных пробных онлайн-тестов с ответами по химии для 9-го класса.В другой мерный цилиндр она налила 7 см3 расплавленного воска. Это семейная викторина «Вопросы и ответы», которая проверит знания вашей команды по пустякам. IGCSE Chemistry Past Year Papers позволяет ученикам: лучше понять влияние и ограничения, накладываемые на научные исследования культурой, экономикой, технологиями, целостностью, сообществом и окружающей средой. Охватывает реакции алкенов, расчет степеней ненасыщенности и стабильность циклогексана. Наша спецификация GCSE по химии обеспечивает широкий, последовательный, удовлетворительный и полезный курс обучения.Викторина по химии RRB JE Stage-II: 21 августа 2019 г. Антоним. JW LTD, Getty Images Science. Начните свою работу с наших двухдневных онлайн-курсов подготовки к Рождеству. Колгур. Holy Cross Chemistry Ключевой информационный модуль 1: Практические навыки 1-й год > > > 2-й год > > 9303 пьесы. $ 607. Краткий справочник по химии для 9 класса поможет вам изучить и попрактиковаться в подготовке к контрольной. Химия — удивительный предмет, объединяющий в себе ряд различных наук, пытающихся разобраться в сложном мире, в котором мы живем.Атомы и элементы. Если вы пересматриваете Key Stage 3 Science, эти бесплатные тесты с самостоятельным оцениванием идеально подходят! Ответ: Ртуть, также называемая ртутью, является химическим элементом группы 12 (IIb) периодической таблицы.
IGCSE Chemistry Past Year Papers позволяет ученикам: лучше понять влияние и ограничения, накладываемые на научные исследования культурой, экономикой, технологиями, целостностью, сообществом и окружающей средой. Охватывает реакции алкенов, расчет степеней ненасыщенности и стабильность циклогексана. Наша спецификация GCSE по химии обеспечивает широкий, последовательный, удовлетворительный и полезный курс обучения.Викторина по химии RRB JE Stage-II: 21 августа 2019 г. Антоним. JW LTD, Getty Images Science. Начните свою работу с наших двухдневных онлайн-курсов подготовки к Рождеству. Колгур. Holy Cross Chemistry Ключевой информационный модуль 1: Практические навыки 1-й год > > > 2-й год > > 9303 пьесы. $ 607. Краткий справочник по химии для 9 класса поможет вам изучить и попрактиковаться в подготовке к контрольной. Химия — удивительный предмет, объединяющий в себе ряд различных наук, пытающихся разобраться в сложном мире, в котором мы живем.Атомы и элементы. Если вы пересматриваете Key Stage 3 Science, эти бесплатные тесты с самостоятельным оцениванием идеально подходят! Ответ: Ртуть, также называемая ртутью, является химическим элементом группы 12 (IIb) периодической таблицы. Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. 3 . Составитель карточек по химии для 9 класса: Джорджия Уорренер. Вы ищете полные заметки по химии для 2-го года обучения в главе 7. Тесты предлагают отличную элементарную научную практику, а вопросы и ответы можно использовать в сочетании с 1-м годом.Атом состоит из электронов и ядра, содержащего протоны и нейтроны. Я бы посоветовал вам приберечь большинство из них на потом в течение года, когда вы будете более серьезно готовиться к реальному экзамену AP. 0 г алюминия равно 7. Последние 10 лет опросные листы для 7 SCIENCE Old papers. Сформируйте три контрольных вопроса по всем темам, включая «Крот», «Органическая химия I», «Сера и ее соединения», «Хлор и ее соединения» и другие. IIT JEE, AIEEE, AIPMT, AFMC, CET, CBSE. Запишитесь на бесплатное занятие прямо сейчас.ком! Химическая викторина по общей химии. com позволяет легко получить желаемую оценку! 8. Здесь вы можете получить общие знания по химии с коллекцией из 150 важных вопросов gk, основанных на химии.
Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. 3 . Составитель карточек по химии для 9 класса: Джорджия Уорренер. Вы ищете полные заметки по химии для 2-го года обучения в главе 7. Тесты предлагают отличную элементарную научную практику, а вопросы и ответы можно использовать в сочетании с 1-м годом.Атом состоит из электронов и ядра, содержащего протоны и нейтроны. Я бы посоветовал вам приберечь большинство из них на потом в течение года, когда вы будете более серьезно готовиться к реальному экзамену AP. 0 г алюминия равно 7. Последние 10 лет опросные листы для 7 SCIENCE Old papers. Сформируйте три контрольных вопроса по всем темам, включая «Крот», «Органическая химия I», «Сера и ее соединения», «Хлор и ее соединения» и другие. IIT JEE, AIEEE, AIPMT, AFMC, CET, CBSE. Запишитесь на бесплатное занятие прямо сейчас.ком! Химическая викторина по общей химии. com позволяет легко получить желаемую оценку! 8. Здесь вы можете получить общие знания по химии с коллекцией из 150 важных вопросов gk, основанных на химии. 5-6 класс. Получите доступ к бесплатным видео с репетиторами и превратите обучение в LIDO Learning. Подводит газ из газового крана. Научные кружки 6. Если тест заказан за несколько дней до операции, вам может потребоваться голодание. Подготовьтесь к викторине или учитесь в свое удовольствие! Лучшие карточки по химии для 9 класса в рейтинге качества.41 мл. 112 E. Конец модульного теста 7H: Размер файла: 82 КБ: Тип файла: pdf: Загрузить файл. Важные вопросы химии ICSE Year 7 – частицы и реакции. Называть органические соединения [. Виртуальные бесплатные практические онлайн-тесты Igcse. Смесь воды и нефти _______ в природе. Об этом тесте: Все вопросы этого теста основаны на информации, которую можно найти в разделе «Химия: разделительные смеси». Повторение физики для 7 класса – Викторина. Также сообщите нам, какие другие функции и ресурсы можно загрузить сейчас. Лучшее приложение для подготовки к экзаменам в Индии Классы 9-10, JEE и NEET Видео-лекции Сессии в прямом эфире Учебные материалы Тесты Документы за предыдущий год Пересмотр Скачать приложение eSaral Здесь вы получите полные вопросы по химическому равновесию NEET за предыдущий год с помощью полные и подробные решения.
5-6 класс. Получите доступ к бесплатным видео с репетиторами и превратите обучение в LIDO Learning. Подводит газ из газового крана. Научные кружки 6. Если тест заказан за несколько дней до операции, вам может потребоваться голодание. Подготовьтесь к викторине или учитесь в свое удовольствие! Лучшие карточки по химии для 9 класса в рейтинге качества.41 мл. 112 E. Конец модульного теста 7H: Размер файла: 82 КБ: Тип файла: pdf: Загрузить файл. Важные вопросы химии ICSE Year 7 – частицы и реакции. Называть органические соединения [. Виртуальные бесплатные практические онлайн-тесты Igcse. Смесь воды и нефти _______ в природе. Об этом тесте: Все вопросы этого теста основаны на информации, которую можно найти в разделе «Химия: разделительные смеси». Повторение физики для 7 класса – Викторина. Также сообщите нам, какие другие функции и ресурсы можно загрузить сейчас. Лучшее приложение для подготовки к экзаменам в Индии Классы 9-10, JEE и NEET Видео-лекции Сессии в прямом эфире Учебные материалы Тесты Документы за предыдущий год Пересмотр Скачать приложение eSaral Здесь вы получите полные вопросы по химическому равновесию NEET за предыдущий год с помощью полные и подробные решения. Каждый бесплатный практический тест состоит из примерно дюжины задач, с которыми вы можете столкнуться на курсе химии в старших классах. теория просмотра. Учащиеся могут соревноваться в четырех возрастных категориях: младшие — 7 и 8 классы; Средний – 9 и 10 классы; старший – 11 класс; Финал – 12 класс; ICQ не является тестом содержания учебного плана. ИГРАТЬ В. Сохранять. Представленные ниже книги рекомендованы учителями и учениками. Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.Все элементы вписываются в периодическую таблицу. Химия Глава 7 Тест Множественный выбор Определите вариант ответа, который лучше всего дополняет утверждение или отвечает на вопрос. Вопросы по органической химии Ковалентная связь 1. Из этих вопросов по химии для 7 класса можно создавать печатные тесты и рабочие листы! Выберите один или несколько вопросов, установив флажки над каждым вопросом. 15 вопросов | 7531 попытка. На основе важных вопросов с несколькими вариантами ответов для всех конкурсных экзаменов.
Каждый бесплатный практический тест состоит из примерно дюжины задач, с которыми вы можете столкнуться на курсе химии в старших классах. теория просмотра. Учащиеся могут соревноваться в четырех возрастных категориях: младшие — 7 и 8 классы; Средний – 9 и 10 классы; старший – 11 класс; Финал – 12 класс; ICQ не является тестом содержания учебного плана. ИГРАТЬ В. Сохранять. Представленные ниже книги рекомендованы учителями и учениками. Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.Все элементы вписываются в периодическую таблицу. Химия Глава 7 Тест Множественный выбор Определите вариант ответа, который лучше всего дополняет утверждение или отвечает на вопрос. Вопросы по органической химии Ковалентная связь 1. Из этих вопросов по химии для 7 класса можно создавать печатные тесты и рабочие листы! Выберите один или несколько вопросов, установив флажки над каждым вопросом. 15 вопросов | 7531 попытка. На основе важных вопросов с несколькими вариантами ответов для всех конкурсных экзаменов. В химии комнатная температура составляет: A точка замерзания B 20 градусов по Фаренгейту C 25 Edexcel GCSE 9-1 Chemistry 2/Combined Science Тема 6 “Группы периодической таблицы” Содержание вопросов викторины: химия щелочных металлов 1 группы, химия группы 7 галогены, свойства инертных газов, структура периодической таблицы (Высший уровень/Фундаментальный уровень): Нужны вопросы по викторине: Смеси.Элементы: состоят из атомов одного типа. Подготовьтесь к викторине или учитесь в свое удовольствие! KS3 Учебные ресурсы по химии для взрослых, детей, родителей и учителей, организованные по темам. Рекомендуемые книги. Обезьяна Бесплатные онлайн-тесты по химии. ppt, 450. Карточки к главе 5 по химии – 45 карточек. 60 3 секунды. Химия AQA и OCR (A) – 19-20 декабря. Требует значительного снижения температуры (или потери тепловой энергии) и происходит на CL. Предоставляет подготовительный материал CBSE по химии для учащихся 10 класса.Затем вам нужно объяснить, как изображение/ключевое слово связано с темой.
В химии комнатная температура составляет: A точка замерзания B 20 градусов по Фаренгейту C 25 Edexcel GCSE 9-1 Chemistry 2/Combined Science Тема 6 “Группы периодической таблицы” Содержание вопросов викторины: химия щелочных металлов 1 группы, химия группы 7 галогены, свойства инертных газов, структура периодической таблицы (Высший уровень/Фундаментальный уровень): Нужны вопросы по викторине: Смеси.Элементы: состоят из атомов одного типа. Подготовьтесь к викторине или учитесь в свое удовольствие! KS3 Учебные ресурсы по химии для взрослых, детей, родителей и учителей, организованные по темам. Рекомендуемые книги. Обезьяна Бесплатные онлайн-тесты по химии. ppt, 450. Карточки к главе 5 по химии – 45 карточек. 60 3 секунды. Химия AQA и OCR (A) – 19-20 декабря. Требует значительного снижения температуры (или потери тепловой энергии) и происходит на CL. Предоставляет подготовительный материал CBSE по химии для учащихся 10 класса.Затем вам нужно объяснить, как изображение/ключевое слово связано с темой. Тема 11: Викторина по обработке данных — 5 подвопросов. . Дендриштейн! Узнайте, где ученые сделали важные открытия, связанные с происхождением нашего времени. Эти вопросы со свободным ответом взяты из старой версии экзамена AP по химии. YouTube. Химия. Это лишь одно из решений для вашего успеха. Бесплатные онлайн-тесты по ХИМИИ Практические и подготовительные тесты. ком. Q1. Вам нужна дополнительная теория, чтобы иметь более глубокое понимание концепции, поэтому прочитайте бесплатную загрузку в формате PDF IIT Foundation Chemistry For Class 7.Ядерная химия I Викторина. Наука изучает то, как движется мир — от самого маленького жука до самой большой солнечной системы. ppt, 771. Горение. Новый год 2 Студенты Химия Карьера Ответы студентов. Процесс разработки экзамена AP — это многолетняя работа; все экзамены AP проходят всестороннюю проверку, пересмотр, пилотирование и анализ, чтобы гарантировать точность, справедливость и правильность вопросов, а также наличие… Видеоуроков от опытных учителей, которые всесторонне охватывают учебный план по химии для 12-х классов Нового Южного Уэльса.
Тема 11: Викторина по обработке данных — 5 подвопросов. . Дендриштейн! Узнайте, где ученые сделали важные открытия, связанные с происхождением нашего времени. Эти вопросы со свободным ответом взяты из старой версии экзамена AP по химии. YouTube. Химия. Это лишь одно из решений для вашего успеха. Бесплатные онлайн-тесты по ХИМИИ Практические и подготовительные тесты. ком. Q1. Вам нужна дополнительная теория, чтобы иметь более глубокое понимание концепции, поэтому прочитайте бесплатную загрузку в формате PDF IIT Foundation Chemistry For Class 7.Ядерная химия I Викторина. Наука изучает то, как движется мир — от самого маленького жука до самой большой солнечной системы. ppt, 771. Горение. Новый год 2 Студенты Химия Карьера Ответы студентов. Процесс разработки экзамена AP — это многолетняя работа; все экзамены AP проходят всестороннюю проверку, пересмотр, пилотирование и анализ, чтобы гарантировать точность, справедливость и правильность вопросов, а также наличие… Видеоуроков от опытных учителей, которые всесторонне охватывают учебный план по химии для 12-х классов Нового Южного Уэльса. 6 2 CP Химия 1-й В 7-м классе вы будете изучать темы биологии, химии и физики. Цены. 50. Считалось, что органические соединения не могут быть … 10 рабочих листов по химическим реакциям для 7-го класса естественных наук. Эти ответы на вопросы MCQ очень важны для сдачи экзаменов на работу в UPSC SSC Bank PCS Railway и т. д. Растворенное вещество против цитоплазмы — это желеобразное вещество, в котором происходят химические реакции. Решения и растворимость. «Она продает ракушки на берегу моря» — пример одновременно и аллитерации, и шипения! 2.Мы также подумаем о том, как эти реакции происходят на молекулярном уровне с механизмами реакций. Получите бесплатные ключевые заметки, вопросы MCQ, тесты, образцы документов, решения NCERT, решения NCERT, важные вопросы для 10. Мы химия, тема за темой, вопросы и ответы по всем темам в форме 1, форме 2, форме 3 и форме 4 для средних школ Кении. при подготовке к KCSE. Мы знаем, что вы ищете заметки к упражнениям по химии для 1-го года обучения по главе 7 «Термохимия» в формате PDF для загрузки.
6 2 CP Химия 1-й В 7-м классе вы будете изучать темы биологии, химии и физики. Цены. 50. Считалось, что органические соединения не могут быть … 10 рабочих листов по химическим реакциям для 7-го класса естественных наук. Эти ответы на вопросы MCQ очень важны для сдачи экзаменов на работу в UPSC SSC Bank PCS Railway и т. д. Растворенное вещество против цитоплазмы — это желеобразное вещество, в котором происходят химические реакции. Решения и растворимость. «Она продает ракушки на берегу моря» — пример одновременно и аллитерации, и шипения! 2.Мы также подумаем о том, как эти реакции происходят на молекулярном уровне с механизмами реакций. Получите бесплатные ключевые заметки, вопросы MCQ, тесты, образцы документов, решения NCERT, решения NCERT, важные вопросы для 10. Мы химия, тема за темой, вопросы и ответы по всем темам в форме 1, форме 2, форме 3 и форме 4 для средних школ Кении. при подготовке к KCSE. Мы знаем, что вы ищете заметки к упражнениям по химии для 1-го года обучения по главе 7 «Термохимия» в формате PDF для загрузки. Наши вопросы снабжены подсказками, решениями и ссылками на учебный материал после прохождения теста.Наука в реальном мире. Репетитор по математикеDVD. Жесткий. Для тех, кто еще не знал, химия определяется как изучение материи, включая ее элементы и соединения, состав, свойства, структуру, поведение и реакции с другими веществами. 90 / год. Хотя он написан для OCR AS/A уровня химии A и B (H032, h532, H033, h533), его можно отредактировать под вашу схему работы. Викторина по химии. com и узнайте больше о том, как найти свою половинку онлайн. Конец модульного теста 7C: Конец модульного теста 7G: Размер файла: 159 КБ: Тип файла: pdf: Загрузить файл.28 химических головоломок в стиле судоку, которые помогут детям в возрасте от 11 до 14 лет укрепить свое понимание ключевых идей, с распечатанными листами и ответами. а) Посмотрите на мерные цилиндры. Это поможет для обучения в автономном режиме. chemyblog View … Важные вопросы для 10 класса Естествознание играет жизненно важную роль в получении большего количества баллов на экзаменах.
Наши вопросы снабжены подсказками, решениями и ссылками на учебный материал после прохождения теста.Наука в реальном мире. Репетитор по математикеDVD. Жесткий. Для тех, кто еще не знал, химия определяется как изучение материи, включая ее элементы и соединения, состав, свойства, структуру, поведение и реакции с другими веществами. 90 / год. Хотя он написан для OCR AS/A уровня химии A и B (H032, h532, H033, h533), его можно отредактировать под вашу схему работы. Викторина по химии. com и узнайте больше о том, как найти свою половинку онлайн. Конец модульного теста 7C: Конец модульного теста 7G: Размер файла: 159 КБ: Тип файла: pdf: Загрузить файл.28 химических головоломок в стиле судоку, которые помогут детям в возрасте от 11 до 14 лет укрепить свое понимание ключевых идей, с распечатанными листами и ответами. а) Посмотрите на мерные цилиндры. Это поможет для обучения в автономном режиме. chemyblog View … Важные вопросы для 10 класса Естествознание играет жизненно важную роль в получении большего количества баллов на экзаменах. Заметки по химии для класса 12 бесплатны и всегда останутся бесплатными. Глава восьмая. Учебный план Topic10 SL и HL Скачать. Фотохимический смог по своему характеру является окислителем.40 долларов. Например, 750 на . 621 раз. В химии валентность или число валентности — это количество связей, которые данный элемент может образовать с одним или несколькими другими элементами. Процесс растворения называется сольватацией. Периодическая таблица: викторина с несколькими вариантами ответов. Собака с. Кипение, испарение и конденсация (бесплатная загрузка для зарегистрированных пользователей). Плавление, замораживание и сублимация. Тест: Алкины. Домашнее задание: Закончите упражнение с алканом с прямой цепью в конце примечаний. Сыграл 621 раз. Категория: 7 класс.Это сообщение на тему примечаний к главе 7 FSc 2-го года обучения химии [MCQ и короткие вопросы] (основные принципы органической химии). Поскольку объем занят одной Химией – Вопросы прошлого года. Общенаучная викторина по химии. химии и важные темы.
Заметки по химии для класса 12 бесплатны и всегда останутся бесплатными. Глава восьмая. Учебный план Topic10 SL и HL Скачать. Фотохимический смог по своему характеру является окислителем.40 долларов. Например, 750 на . 621 раз. В химии валентность или число валентности — это количество связей, которые данный элемент может образовать с одним или несколькими другими элементами. Процесс растворения называется сольватацией. Периодическая таблица: викторина с несколькими вариантами ответов. Собака с. Кипение, испарение и конденсация (бесплатная загрузка для зарегистрированных пользователей). Плавление, замораживание и сублимация. Тест: Алкины. Домашнее задание: Закончите упражнение с алканом с прямой цепью в конце примечаний. Сыграл 621 раз. Категория: 7 класс.Это сообщение на тему примечаний к главе 7 FSc 2-го года обучения химии [MCQ и короткие вопросы] (основные принципы органической химии). Поскольку объем занят одной Химией – Вопросы прошлого года. Общенаучная викторина по химии. химии и важные темы. На этом уроке учащийся познакомится с Начать изучение химии Глава 7 Тест. Если смесь содержит нерастворенные частицы, равномерно перемешанные с жидкостью, то это: Суспензия. Присоединяйтесь к химии.Анимация растворения NaCl. (A) Ферменты 8. Virtual Labs for Chemistry — это полностью онлайн-лабораторное решение, которое можно использовать в качестве замены онлайн-лаборатории, подготовительной, дополненной или гримерной, чтобы преодолеть разрыв между лабораторией и лекцией. Пост 16 Исследование. A-Level Sample Paper 1 — Question 7 (только части 1-3) A-Level Sample Paper 3 — Question 5. 90 Ques | 180 мин. Они могут быть твердыми, жидкими или газообразными, в зависимости от температуры, и большинство из них встречаются в природе, например, кислород, натрий, углерод, гелий и золото.Темы AP Chemistry включают атомную теорию, химическую связь, фазы вещества, растворы, типы реакций, равновесие, кинетику реакций и термодинамику. После того, как они получили ответы на 150-200 вопросов, онлайн-тест по химии для класса 7.
На этом уроке учащийся познакомится с Начать изучение химии Глава 7 Тест. Если смесь содержит нерастворенные частицы, равномерно перемешанные с жидкостью, то это: Суспензия. Присоединяйтесь к химии.Анимация растворения NaCl. (A) Ферменты 8. Virtual Labs for Chemistry — это полностью онлайн-лабораторное решение, которое можно использовать в качестве замены онлайн-лаборатории, подготовительной, дополненной или гримерной, чтобы преодолеть разрыв между лабораторией и лекцией. Пост 16 Исследование. A-Level Sample Paper 1 — Question 7 (только части 1-3) A-Level Sample Paper 3 — Question 5. 90 Ques | 180 мин. Они могут быть твердыми, жидкими или газообразными, в зависимости от температуры, и большинство из них встречаются в природе, например, кислород, натрий, углерод, гелий и золото.Темы AP Chemistry включают атомную теорию, химическую связь, фазы вещества, растворы, типы реакций, равновесие, кинетику реакций и термодинамику. После того, как они получили ответы на 150-200 вопросов, онлайн-тест по химии для класса 7. Физические и химические изменения. Атомная теория I Викторина. Просмотрите видеолекции Получите помощь по этим предметам IB Угарный газ не играет никакой роли в образовании фотохимического смога. 1) Что могут силы? а) заставить предметы остановиться или начать двигаться б) изменить форму предметов в) заставить движущиеся предметы изменить направление г) все эти вещи 2) Что верно? а) Масса и вес — одно и то же. б) ваш вес будет таким же на Луне, как и на Земле; в) ваша масса будет такой же на Земле и выучить химические реакции 7 класса.4 набора из 10 вопросов с несколькими вариантами ответов по химии в новой национальной учебной программе KS3. РАЗДЕЛ 7 – Квантово-механический взгляд на… Тест на практический экзамен по математике для 7 класса! – Викторина ProProfs. Викторина по химии RRB JE Stage-II: 31 июля. Вопросы и ответы ( 155 330 ) Тесты ( 595 ) Химия для детей. Вам нужно бросить 2 кубика. Когда углекислый газ пропускают через известковую воду, она становится молочной из-за образования карбоната кальция.
Физические и химические изменения. Атомная теория I Викторина. Просмотрите видеолекции Получите помощь по этим предметам IB Угарный газ не играет никакой роли в образовании фотохимического смога. 1) Что могут силы? а) заставить предметы остановиться или начать двигаться б) изменить форму предметов в) заставить движущиеся предметы изменить направление г) все эти вещи 2) Что верно? а) Масса и вес — одно и то же. б) ваш вес будет таким же на Луне, как и на Земле; в) ваша масса будет такой же на Земле и выучить химические реакции 7 класса.4 набора из 10 вопросов с несколькими вариантами ответов по химии в новой национальной учебной программе KS3. РАЗДЕЛ 7 – Квантово-механический взгляд на… Тест на практический экзамен по математике для 7 класса! – Викторина ProProfs. Викторина по химии RRB JE Stage-II: 31 июля. Вопросы и ответы ( 155 330 ) Тесты ( 595 ) Химия для детей. Вам нужно бросить 2 кубика. Когда углекислый газ пропускают через известковую воду, она становится молочной из-за образования карбоната кальция. Конец модульного теста 7B: Размер файла: 84 КБ: Тип файла: pdf: Загрузить файл.Тема 7 Упражнение 1 – формулы и структуры. Где газ смешивается с воздухом. Оставить ответ Отменить ответ. Начните изучать химию в 7 классе. Кербудл отвечает. €€€€€€€€€€€€€€€€€€€€€€€€ (a)€€€€ В таблице ниже Химия 7-го класса: Изучайте онлайн главы 7-го класса ICSE по химии, такие как «Материя и ее состав». , физические и химические изменения и многое другое в TopperLearning. Изучайте химические реакции 7-го класса с помощью смарт-карточек, созданных лучшими учащимися, учителями и преподавателями в Интернете и на мобильных устройствах.com/playlist?list=PLHEUDUID1Uxu7db 9-й год: Ресурсы для пересмотра химии. 0. Что из перечисленного является элементом? 4. Антоним – существительное. ЦЕЛИ: Название, молекулярная формула, структурная формула, сокращенная формула и формула углеродного скелета. сознательно перемещаясь в ту область вещества, где больше места. Плотность алюминия = г мл мл г 2. Если вы сможете продемонстрировать это своему учителю, вам будет выдана лицензия на горелку Бунзена, которую вы сможете сохранить в… Химии.
Конец модульного теста 7B: Размер файла: 84 КБ: Тип файла: pdf: Загрузить файл.Тема 7 Упражнение 1 – формулы и структуры. Где газ смешивается с воздухом. Оставить ответ Отменить ответ. Начните изучать химию в 7 классе. Кербудл отвечает. €€€€€€€€€€€€€€€€€€€€€€€€ (a)€€€€ В таблице ниже Химия 7-го класса: Изучайте онлайн главы 7-го класса ICSE по химии, такие как «Материя и ее состав». , физические и химические изменения и многое другое в TopperLearning. Изучайте химические реакции 7-го класса с помощью смарт-карточек, созданных лучшими учащимися, учителями и преподавателями в Интернете и на мобильных устройствах.com/playlist?list=PLHEUDUID1Uxu7db 9-й год: Ресурсы для пересмотра химии. 0. Что из перечисленного является элементом? 4. Антоним – существительное. ЦЕЛИ: Название, молекулярная формула, структурная формула, сокращенная формула и формула углеродного скелета. сознательно перемещаясь в ту область вещества, где больше места. Плотность алюминия = г мл мл г 2. Если вы сможете продемонстрировать это своему учителю, вам будет выдана лицензия на горелку Бунзена, которую вы сможете сохранить в… Химии. tcy@tcyonline. ХИМИЯ 7 КЛАСС.Физические темы. Органическая химия 10 вопросов. Предмет: Научная химия. 65 вопросов и ответов по научной викторине для детей. Редактировать. Делайте тесты много раз, проверяйте свой результат и загружайте сертификат. Проще говоря, органическая химия похожа на сборку из молекулярных лего. Базовый онлайн-тест по химии. Он предназначен в основном для первокурсников колледжа, но учащиеся старших классов средней школы найдут в нем много полезного. Эти короткие решенные вопросы или викторины предоставлены Gkseries. ‣ Все студенты получают сертификат достижения с их результатами.Онлайн-курс по химии для 7-го класса — то же содержание, что и конспекты уроков, представленные в онлайн-формате и содержащие 114 интерактивных вопросов викторины. НаталиВ. ‣ Оценка на основе знаний, не ограниченная конкретным учебным планом. Добавить в корзину. д. Информация для заказа. 9 ежедневных занятий на курс. Изменение Земли (Ключевой этап 3 — Наука) Эта игра рассказывает об изменениях, которые Земля испытала со временем, землетрясениями и сейсмологией.
tcy@tcyonline. ХИМИЯ 7 КЛАСС.Физические темы. Органическая химия 10 вопросов. Предмет: Научная химия. 65 вопросов и ответов по научной викторине для детей. Редактировать. Делайте тесты много раз, проверяйте свой результат и загружайте сертификат. Проще говоря, органическая химия похожа на сборку из молекулярных лего. Базовый онлайн-тест по химии. Он предназначен в основном для первокурсников колледжа, но учащиеся старших классов средней школы найдут в нем много полезного. Эти короткие решенные вопросы или викторины предоставлены Gkseries. ‣ Все студенты получают сертификат достижения с их результатами.Онлайн-курс по химии для 7-го класса — то же содержание, что и конспекты уроков, представленные в онлайн-формате и содержащие 114 интерактивных вопросов викторины. НаталиВ. ‣ Оценка на основе знаний, не ограниченная конкретным учебным планом. Добавить в корзину. д. Информация для заказа. 9 ежедневных занятий на курс. Изменение Земли (Ключевой этап 3 — Наука) Эта игра рассказывает об изменениях, которые Земля испытала со временем, землетрясениями и сейсмологией. Органические соединения получают из живых существ, тогда как неорганические соединения получают из минеральных источников.Научная викторина ActiVote — Химия для 7 класса. Примите вызов наших веселых научных викторин для детей, а также ряд печатных словесных поисковых запросов и бесплатных рабочих листов с головоломками. 248 Б. 3. Овцы. Тест: Алкены. В разделе «Архив» вы можете найти ссылки на различные веб-сайты, на которых есть старые статьи в формате pdf. com предназначен для знакомств, друзей по переписке и для знакомства одиноких людей. Лучшие и исчерпывающие заметки по химии для студентов FSc, часть 1. Здесь можно найти набор заметок о пересмотре BASIC для всего курса химии iGCSE.В учебной программе CBSE Class 10 Science Syllabus 2019-2020 вы найдете 25 баллов, присвоенных химическим веществам – природа и поведение в … Основы органической химии. Вопросы 1. Основы органической химии. и НАН) Вопросы 21 Ключевые слова: химия, органика, первый курс, бакалавриат, вуз, ревизия, рабочая тетрадь, самостоятельная работа, навыки для ученых.
Органические соединения получают из живых существ, тогда как неорганические соединения получают из минеральных источников.Научная викторина ActiVote — Химия для 7 класса. Примите вызов наших веселых научных викторин для детей, а также ряд печатных словесных поисковых запросов и бесплатных рабочих листов с головоломками. 248 Б. 3. Овцы. Тест: Алкены. В разделе «Архив» вы можете найти ссылки на различные веб-сайты, на которых есть старые статьи в формате pdf. com предназначен для знакомств, друзей по переписке и для знакомства одиноких людей. Лучшие и исчерпывающие заметки по химии для студентов FSc, часть 1. Здесь можно найти набор заметок о пересмотре BASIC для всего курса химии iGCSE.В учебной программе CBSE Class 10 Science Syllabus 2019-2020 вы найдете 25 баллов, присвоенных химическим веществам – природа и поведение в … Основы органической химии. Вопросы 1. Основы органической химии. и НАН) Вопросы 21 Ключевые слова: химия, органика, первый курс, бакалавриат, вуз, ревизия, рабочая тетрадь, самостоятельная работа, навыки для ученых. Химическая формула включает символы элементов в соединении и нижние индексы, указывающие на а.9480 пьес. Посмотрите, как вы это сделали, а затем прокрутите вниз, чтобы найти решения в конце. Химия является основной отраслью науки и преподается на высшей ступени образования. 25 Д. Напиши. 9 класс. Примеры вопросов с несколькими вариантами ответов из ОБЩЕЙ ХИМИИ. Они состоят из трех основных частей: 1. 4. Подготовьтесь к викторине или учитесь в свое удовольствие! Предварительный просмотр этого теста на Quizizz. */ Код UCASF100Продолжительность4 года (MChem)Вступительные требованияA*A*A (с обеими A*s по естественным наукам и/или математике)Предметные требования Химия и математика Другая наука или дополнительная математикаВступительные испытанияНетПисьменная работаНетСтатистика приема*Опрошено: 89% Успешные: 29%Набор: 193*3-летний средний 2018-20Контакты+44 (0) … Химия.ничего из вышеперечисленного 21. Каждая клетка на столе содержит число. 60 Second Blitz: Element Symbols 6. Примечание: Эти вопросы-ответы не расположены в каком-либо определенном порядке! Но если ваши представления о химии IGCSE очень слабы, вам будет трудно в полной мере использовать ответы на эти распространенные вопросы.
Химическая формула включает символы элементов в соединении и нижние индексы, указывающие на а.9480 пьес. Посмотрите, как вы это сделали, а затем прокрутите вниз, чтобы найти решения в конце. Химия является основной отраслью науки и преподается на высшей ступени образования. 25 Д. Напиши. 9 класс. Примеры вопросов с несколькими вариантами ответов из ОБЩЕЙ ХИМИИ. Они состоят из трех основных частей: 1. 4. Подготовьтесь к викторине или учитесь в свое удовольствие! Предварительный просмотр этого теста на Quizizz. */ Код UCASF100Продолжительность4 года (MChem)Вступительные требованияA*A*A (с обеими A*s по естественным наукам и/или математике)Предметные требования Химия и математика Другая наука или дополнительная математикаВступительные испытанияНетПисьменная работаНетСтатистика приема*Опрошено: 89% Успешные: 29%Набор: 193*3-летний средний 2018-20Контакты+44 (0) … Химия.ничего из вышеперечисленного 21. Каждая клетка на столе содержит число. 60 Second Blitz: Element Symbols 6. Примечание: Эти вопросы-ответы не расположены в каком-либо определенном порядке! Но если ваши представления о химии IGCSE очень слабы, вам будет трудно в полной мере использовать ответы на эти распространенные вопросы. Эти MCQ очень важны для студентов, которые хотят получить высокие баллы на экзамене CBSE Board. 5 г/см3. Состояния вещества. Пройдите наш увлекательный тест по химии и узнайте, что вы действительно знаете о таких темах, как органическая химия, атомы, реакции, кислоты и основания.Членов в этом наборе (37) Шланг. 26 ноября 2021 г. . Тема 10: Викторина по органической химии — 10 подвопросов. развивать понимание научных навыков, необходимых как для дальнейшего обучения, так и для повседневной жизни. Вы можете читать австралийскую викторину по химии за 7-й класс в формате PDF прямо на своих мобильных телефонах или ПК. – все это честная игра, поэтому, пожалуйста, не стесняйтесь приходить. Утка д. Домой. Имейте в виду, что к этим примечаниям потребуется добавить дополнительную работу, такую как сбалансированные уравнения символов и некоторый контент, чтобы вы могли получить высокие оценки.Полезные ресурсы для повторения Этот веб-сайт содержит материалы для повторения, вопросы, примеры ответов, схемы оценок и видео, которые помогают нашим студентам на всех этапах обучения.
Эти MCQ очень важны для студентов, которые хотят получить высокие баллы на экзамене CBSE Board. 5 г/см3. Состояния вещества. Пройдите наш увлекательный тест по химии и узнайте, что вы действительно знаете о таких темах, как органическая химия, атомы, реакции, кислоты и основания.Членов в этом наборе (37) Шланг. 26 ноября 2021 г. . Тема 10: Викторина по органической химии — 10 подвопросов. развивать понимание научных навыков, необходимых как для дальнейшего обучения, так и для повседневной жизни. Вы можете читать австралийскую викторину по химии за 7-й класс в формате PDF прямо на своих мобильных телефонах или ПК. – все это честная игра, поэтому, пожалуйста, не стесняйтесь приходить. Утка д. Домой. Имейте в виду, что к этим примечаниям потребуется добавить дополнительную работу, такую как сбалансированные уравнения символов и некоторый контент, чтобы вы могли получить высокие оценки.Полезные ресурсы для повторения Этот веб-сайт содержит материалы для повторения, вопросы, примеры ответов, схемы оценок и видео, которые помогают нашим студентам на всех этапах обучения. 9 класс Химия. Викторина по растворителям. 7-й год; 8 год; 9-й класс Используйте вопросы викторины по науке от MomJunction для детей с ответами, чтобы сделать изучение предмета интересным. сп2, 120°. Кислотная анимация. Смесь газов содержит газы H 2 и O 2 в соотношении 1:4 (мас./мас.). 14 апр 17. Лето 2022 Адаптации. com — нишевая служба знакомств для серьезных одиноких женщин и серьезных одиноких мужчин, ищущих брак.Легкая викторина по растениям (Ключевой этап 3 — Наука) Базовая викторина по фотосинтезу, корням и клеткам растений для классов KS3 с низкими способностями. наук Заполните это поле. Общее время Коэффициент объема газа при 4200 фунтов на квадратный дюйм равен 0. Они разработаны с учетом всех предыдущих работ. Вы найдете раздел новостей Королевского химического общества в нижней части страницы, а основные моменты со всего Интернета можно найти через твиттер @chemstuff. Элементный состав чистых веществ. 7. а. Образовавшийся газ давал молочно-белый осадок при барботировании в известковой воде.
9 класс Химия. Викторина по растворителям. 7-й год; 8 год; 9-й класс Используйте вопросы викторины по науке от MomJunction для детей с ответами, чтобы сделать изучение предмета интересным. сп2, 120°. Кислотная анимация. Смесь газов содержит газы H 2 и O 2 в соотношении 1:4 (мас./мас.). 14 апр 17. Лето 2022 Адаптации. com — нишевая служба знакомств для серьезных одиноких женщин и серьезных одиноких мужчин, ищущих брак.Легкая викторина по растениям (Ключевой этап 3 — Наука) Базовая викторина по фотосинтезу, корням и клеткам растений для классов KS3 с низкими способностями. наук Заполните это поле. Общее время Коэффициент объема газа при 4200 фунтов на квадратный дюйм равен 0. Они разработаны с учетом всех предыдущих работ. Вы найдете раздел новостей Королевского химического общества в нижней части страницы, а основные моменты со всего Интернета можно найти через твиттер @chemstuff. Элементный состав чистых веществ. 7. а. Образовавшийся газ давал молочно-белый осадок при барботировании в известковой воде. РАЗДЕЛ 2 – Атом, молекулы и ионы – 21 страница. викторина по химии 7 класс
РАЗДЕЛ 2 – Атом, молекулы и ионы – 21 страница. викторина по химии 7 класс
основных вопросов по химии | Study.com
Основные вопросы по химии
Основные вопросы могут быть полезны как учителям, так и ученикам. Они представляют собой наиболее фундаментальные вопросы, которые студенты должны задавать себе по мере прохождения курса химии. Далее следует ряд важных вопросов как для курса химии в целом, так и для отдельных модулей и тем в рамках такого курса.
Основные вопросы по всему курсу
Вот несколько общих основных вопросов по предмету химии, которые применимы ко всем темам:
- Почему то, как вы измеряете и записываете число, имеет значение?
- Как сделать правильные измерения?
- Как химия влияет на нашу повседневную жизнь?
- Как материя и энергия сохраняются во Вселенной?
- Как химия помогает нам понять стабильность и изменения во Вселенной?
- Какие химические закономерности существуют в природе?
- Как мы можем использовать доказательства для поддержки научных утверждений?
- Почему точность и прецизионность важны в химии?
- Почему указанное количество значащих цифр важно при представлении химических данных?
- Как наше понимание химии может быть использовано для решения проблем?
- Как молекулярная структура материала влияет на его свойства в макромасштабе и на то, как этот материал функционирует?
Материя и состав
Вот несколько основных вопросов по темам материи и состава:
- Из чего состоит материя во Вселенной?
- Как устроена материя во Вселенной?
- В чем разница между химическими терминами, такими как атомы, молекулы, соединения, смеси и т.
 д.?
д.? - Как работают смеси?
- Что такое физическое изменение?
- Почему существуют разные состояния вещества?
- Как мы классифицируем материю?
- Что такое атомная модель и как она менялась на протяжении истории?
- Как химия изменила общество?
- Как работают газы? Какими свойствами они обладают?
Химические реакции и связи
Вот несколько важных вопросов по теме химических реакций и связей:
- Как материя удерживается вместе?
- Какие типы связи существуют и чем они отличаются?
- Как образуются ионные и ковалентные связи? Почему они работают?
- Что такое химическая реакция? Что это говорит вам об энергии и материи? Какие факторы влияют на скорость реакции?
- Чем химическое изменение отличается от физического изменения?
- Какие признаки указывают на то, что произошла химическая реакция?
- Почему химики пишут химические и словесные уравнения?
- Почему происходит изменение температуры при химической реакции?
- Почему столкновения занимают центральное место в химических реакциях?
- Как мы можем создавать новые вещества?
- Как и почему выделение или поглощение энергии важны для понимания химических реакций?
Периодическая таблица
Вот несколько важных вопросов для изучения периодической таблицы:
- Из каких компонентов состоит Вселенная?
- Из каких частиц состоит атом?
- Что определяет свойства вещества?
- Как устроена периодическая таблица? Почему мы так устраиваем?
- Как можно описать электронную конфигурацию атома?
- Как можно использовать периодическую таблицу для предсказания того, что произойдет при взаимодействии веществ?
- Как ядра одного и того же элемента могут отличаться друг от друга?
- Как расположение электронов вызывает химические реакции?
Типы реакций и стехиометрия
Вот несколько важных вопросов по темам типов реакций и стехиометрии:
- Как определить количество чего-либо?
- Как вы пишете химические и словесные уравнения?
- Как уравнения связаны с законом сохранения массы?
- Как узнать, сбалансировано ли химическое уравнение?
- Какие типы реакций существуют? Насколько они разные?
- Как связаны продукты и реагенты?
- Почему родинки являются важной мерой?
- Что означает термин «равновесие» в химии?
Органика и биохимия
Вот несколько важных вопросов по темам органики и биохимии:
- Почему органические соединения важны в реальном мире?
- Как называются органические соединения?
- Каковы наиболее важные структуры и реакции в органической химии?
- Какая органическая химия работает в вашем теле?
- Какие этические соображения важны в биохимии?

