Изотопы элементов | Задачи 206
Задача 206.
Символ одного из изотопов элемента . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A – Z = 28, где
N – число нейтронов в ядре, A – массовое число элемента (округленная масса атома), Z – заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор – символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид:
Ответ: .
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A – Z = 181 – 73 = 108, где
N – число нейтронов, A – массовое число атома, Z – заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов:  Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69
Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69
В сумме масса обоих изотопов будет равняться атомной массе галлия:
Освобождаемся от знаменателя и получим уравнение:
69x – 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
Ответ:
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после радиоактивного распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% – процент атомов изотопа, N0 – первоначальное число ядер изотопа, n – число периодов полураспада.
Отсюда
Ответ: 1,56%.
Задача 214.
Период полураспада – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение:
– распаду предшествует процесс , протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного – принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi – масса изотопа, оставшаяся после хранения, m0 – исходная масса изотопа, n – период полураспада.
Тогда
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18 г.
Глинка Н. Л. Задачи и упражнения по общей химии. Задачи 206-227
reshchem.ucoz.ru|reshchem.ucoz.ru|*none*
Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 206-227
206. Символ одного из изотопов элемента 5224Э. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома. Решение
207. Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.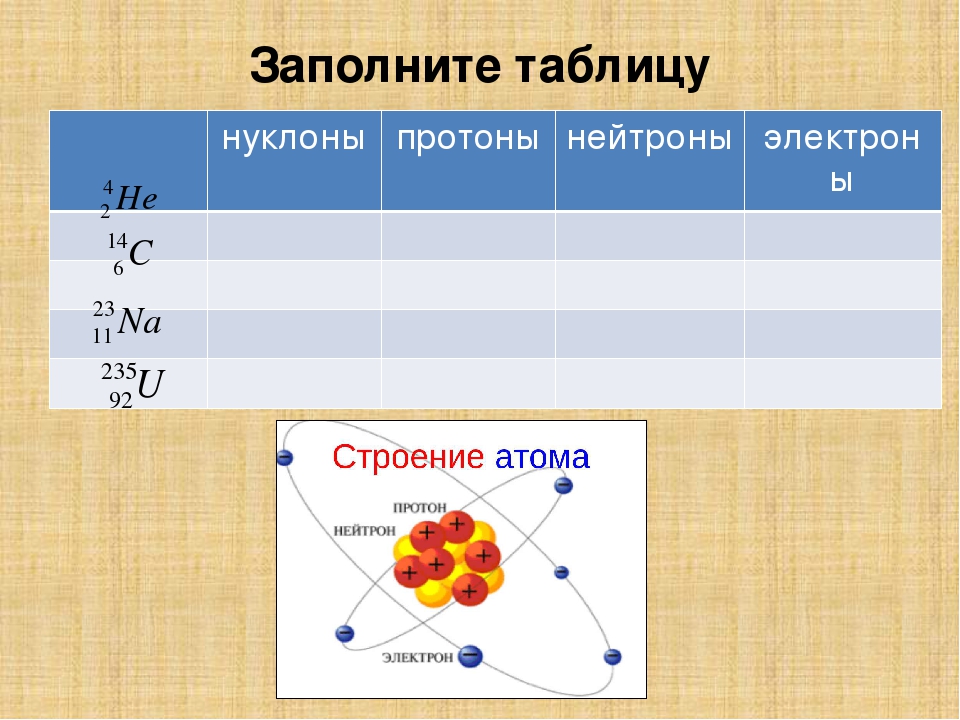
208. Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента. Решение
209. В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора. Решение
210. Природный магний состоит из изотопов
211. Природный галлий состоит из изотопов 71Ga и 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72? Решение с ключом
212. Найти массу изотопа 81Sr (T½=8,5 ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг. Решение
Решение
213. Вычислить процент атомов изотопа 128I (T½=25 мин), оставшихся не распавшимися после его хранения в течение 2,5 ч. Решение с ключом
214. Период полураспада β– – радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24 г 24Na за 29,6 ч. Решение с ключом
215. Закончить уравнения реакций радиоактивного распада: а) 23892U→α; б) 23592U→α; в) 23994Pu→α; г) 8637Rb→β–; д) 23490Th→β–; е) 5725Mn→β–; ж) 189F→β+; з) 116C→β+; и) 4522Ti→β+. В каких случаях дочерний атом является изобаром материнского атома? Решение с ключом
216. Какой тип радиоактивного распада наблюдается при следующих превращениях: а) 22688Ra→22286Rn; б) 23993Np→23994Pu; в) 15262Sm→14860Nd; г) 11146Pd→11147Ag? Решение с ключом
217. Записать уравнения ядерных реакций: а) 6128Ni+11H→?→?+10n; б) 105B+10n→?+42He; в) 2713Al+11H→?+42He; г) ?+11H→8335Br→?+10n. Решение с ключом
Записать уравнения ядерных реакций: а) 6128Ni+11H→?→?+10n; б) 105B+10n→?+42He; в) 2713Al+11H→?+42He; г) ?+11H→8335Br→?+10n. Решение с ключом
218. Написать полные уравнения ядерных реакций: а) 7030Zn[p, n]?; б) 5123V[α, n]?; в) 5626Fe[D, ?]5727Co; г) ?[α, D]3417Cl; д) 5525Mn[?, α]5223V. Решение с ключом
219. Как изменяются массовое число и заряд атома изотопа: а) при последовательном испускании α-частицы и двух β-частиц; б) при поглощении ядром двух протонов и испускании двух нейтронов; в) при поглощении одной α-частицы и выбрасывании двух дейтронов? Решение с ключом
220. Сколько α и β–-частиц должно было потерять ядро 226Ra для получения дочернего элемента с массовым числом 206, принадлежащего IV группе периодической системы элементов? Назвать этот элемент. Решение с ключом
Сколько α и β–-частиц должно было потерять ядро 226Ra для получения дочернего элемента с массовым числом 206, принадлежащего IV группе периодической системы элементов? Назвать этот элемент. Решение с ключом
221. Ядро атома изотопа 23892U в результате радиоактивного распада превратилось в ядро 22688Ra. Сколько α- и β–-частиц испустило при этом исходное ядро? Решение с ключом
222. Изотоп 40K превращается в изотоп 40Ca. Какой тип радиоактивного распада при этом реализуется: а) α-распад; б) β–-распад; в) β+-распад; г) захват электрона; д) спонтанное деление? Решение
223. Какой тип радиоактивного распада приведет к образованию дочернего ядра, являющегося изобаром по отношению к исходному ядру: а) α-распад; б) β–-распад; в) β+-распад; г) захват электрона; д) ни один из этих процессов? Решение
224. Как изменяется массовое число и заряд атома при испускании одной α-частицы и двух β–-частиц: а) заряд уменьшится на 2, а массовое число – на 4; б) заряд увеличится на 2, а массовое число уменьшится на 4; в) заряд не изменится, а массовое число уменьшится на 4; г) ни заряд, ни массовое число не изменятся? Решение
225. Фотон жесткого γ-излучения выбивает из ядра 2612Mg протон. При этом образуется: а) ядро-изотоп 2612Mg; б) ядро-изобар 2612Mg; в) ядро-изотоп 2311Na; г) ядро-изобар 2311Na. Решение
Фотон жесткого γ-излучения выбивает из ядра 2612Mg протон. При этом образуется: а) ядро-изотоп 2612Mg; б) ядро-изобар 2612Mg; в) ядро-изотоп 2311Na; г) ядро-изобар 2311Na. Решение
226. К какому радиоактивному семейству относится изотоп 207Pb: а) 232Th; б) 237Np; в) 227Ac; г) 238U? Решение
227. Может ли в природе находиться изотоп 222Rn с T½=3,2 дня а) да; б) нет? Потому что: 1) период полураспада этого изотопа много меньше времени существования Земли; 2) этот изотоп является членом радиоактивного семейства; 3) у радона есть более долгоживущие изотопы. Решение
Урок 1. химический элемент. нуклиды. изотопы. законы сохранения массы и энергии в химии – Химия – 11 класс
Химия, 11 класс
Урок № 1. Химический элемент. Нуклиды. Изотопы.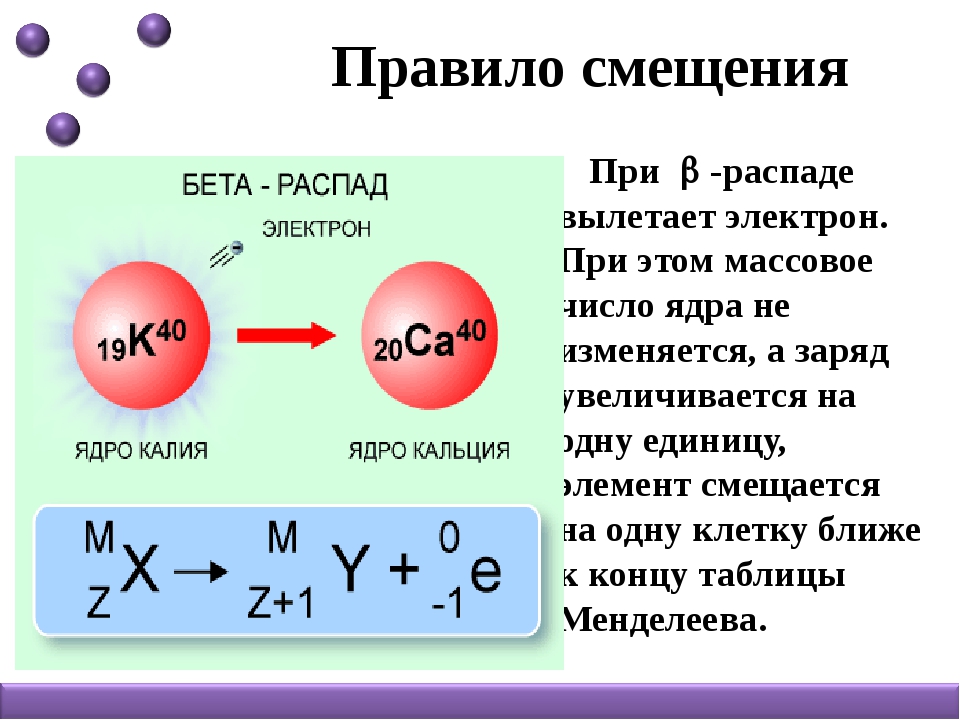 Законы сохранения массы и энергии в химии
Законы сохранения массы и энергии в химии
Перечень вопросов, рассматриваемых в теме
Урок посвящён изучению основных понятий химии (химический элемент, изотоп, нуклид) и двум важнейшим законам природы – закону сохранения массы и закону сохранения энергии. Учащиеся узнают о важнейших характеристиках химического элемента, смогут назвать различие между понятиями «химический элемент», «нуклид», «изотоп» и научатся применять закон сохранения массы веществ при составлении уравнений химических реакций.
Глоссарий
Атом – это наименьшая частица химического элемента, которая несет все его свойства.
Изотопы – это нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов
Нейтрон – это незаряженная элементарная частица.
Нуклиды – это различные виды ядер, которые отличаются зарядом или массовым числом.
Протон – это положительно заряженная элементарная частица.
Элементарная частица – это объект, который нельзя разделить на более мелкие составляющие.
Радиоактивный распад – это превращение ядер нуклидов, сопровождающиеся изменением числа протонов или нейтронов в ядре и испусканием элементарных частиц, гамма-квантов или кластеров.
Химический элемент – это вид атомов с определенным зарядом ядра.
Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра.
Ядро – это положительно заряженная центральная часть атома.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Одним из основных понятий химии является атом. Атом – это наименьшая частица химического элемента, которая несет все его свойства. Согласно планетарной модели, атом состоит из ядра и электронов. Электроны – это отрицательно заряженные элементарные частицы, которые движутся по орбиталям вокруг ядра. Ядро – это положительно заряженная центральная часть атома. Ядра атомов превращаются друг в друга в ходе ядерных реакций.
Ядро состоит из двух типов элементарных частиц: протонов (Z) и нейтронов (N). Заряд нейтронов равен нулю. Протоны обладают зарядом +1. Общее число нейтронов и протонов в ядре называется массовым числом (А). Оно близко, но не равно по значению к атомной массе элемента, указанной в Периодической таблице. Заряд ядра равен числу протонов и порядковому номеру элемента в Периодической системе.
Заряд ядра равен числу протонов и порядковому номеру элемента в Периодической системе.
Вид атомов с определенным зарядом ядра называется химическим элементом. Химический элемент существует в виде простого вещества (металла или неметалла) или соединений с другими элементами. К характеристикам химического элемента относятся: атомный номер, относительная атомная масса, изотопный состав, положение в Периодической системе, строение атома, электроотрицательность, степени окисления, валентность, энергия ионизации, сродство к электрону, распространенность в природе.
Нуклидами называют различные виды ядер, которые отличаются зарядом или массовым числом. Они обозначаются следующим образом: вверху перед символом нуклида пишется массовое число, внизу – порядковый номер элемента. Нуклиды с одинаковым зарядом ядра, но разным массовым числом и числом нейтронов называются изотопами. Изотопы одного элемента обладают одинаковыми химическими свойствами и почти не отличаются по физическим свойствам. Элементы представляют собой совокупность изотопов с разными массовыми числами, поэтому атомные массы многих элементов представлены дробными числами.
Элементы представляют собой совокупность изотопов с разными массовыми числами, поэтому атомные массы многих элементов представлены дробными числами.
Химические реакции подчиняются законам сохранения массы и энергии. Закон сохранения массы веществ впервые сформулировал великий ученый М.В. Ломоносов. Экспериментально его доказал А.Л. Лавуазье. Формулируется закон следующим образом: масса исходных веществ, вступивших в химическую реакцию, равна массе продуктов реакции. В ходе реакции атомы веществ только перегруппировываются.
В двадцатом веке ученые обнаружили, что закон сохранения массы не соблюдается в случае ядерных реакций. После того, как А. Эйнштейн открыл взаимосвязь между массой и энергией, выраженную в его знаменитой формуле E=mc2, стало понятно, что закон сохранения массы лишь частный случай закона сохранения энергии. Закон сохранения энергии гласит: в изолированной системе энергия системы не исчезает и не появляется, а только переходит из одного вида в другой. Для составления ядерных реакций важно помнить, что суммарный заряд ядер и массовое число сохраняются.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на работу с Периодической системой.
Условие задачи: Введите формулу простого вещества, при бета-распаде которого образуется висмут.
Решение: Висмут – элемент с порядковым номером 83. При бета распаде один из нейтронов превращается в протон, таким образом заряд ядра атома увеличивается на единицу. Следовательно, химический элемент, образующий исходное вещество, находится на одну клетку левее висмута. Это свинец.
Ответ: Pb.
2.Решение задачи на закон сохранения массы или закон сохранения числа атомов.
Условие задачи: Расставьте коэффициенты в реакции и выберите правильное значение их суммы.
Al + S = Al2S3
А) 3
Б) 5
В) 6
Г) 10
Решение: Составим электронный баланс. Каждый атом алюминия присоединил 3 электрона, а каждый атом серы отдал два электрона. Тогда коэффициенты 2Al + 3S = Al2S3
Сумма коэффициентов = 6.
Ответ: В.
Урок 2. Изотопы элементов – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
(Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.
 е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Уточнены атомные массы ряда химических элементов
Таблицы Менделеева в учебниках и классах химии по всему миру теперь нуждаются в переделке: атомные массы и форма их представления для десяти элементов изменены. Виной тому усовершенствование технологий определения изотопного состава почв и измерения атомной массы.
Впервые в истории химии, да и человечества, возникла необходимость изменить таблицу Менделеева (которая, к слову, используется во всем мире под названием «Периодическая таблица элементов», без указания авторства). Решение о корректировке данных принял Международный союз чистой и прикладной химии (IUPAC), устанавливающий стандарты и номенклатуру в химической науке. Циркуляр IUPAC опубликован в Pure and Applied Chemistry.
Решение о корректировке данных принял Международный союз чистой и прикладной химии (IUPAC), устанавливающий стандарты и номенклатуру в химической науке. Циркуляр IUPAC опубликован в Pure and Applied Chemistry.
Конечно, таблица постоянно дополняется новыми элементами, но это сверхтяжелые неустойчивые трансурановые металлы, сведения о которых не являются необходимыми ни школьнику, ни специалисту, проводящему расчеты с использованием данных об атомных массах элементов. Совсем другое дело – атомные массы легких распространенных элементов. Сейчас повсеместно используются стандартные значения атомных масс, изучение которых происходило по мере открытия элементов, то есть многие из них были определены еще до открытия периодического закона и создания периодической системы.
Со школьной скамьи мы помним, что атомные массы – нецелые числа.
03 сентября 11:50
Однако мало кто помнит, почему это так. Действительно, масса атома определяется числом протонов и нейтронов в ядре (масса электрона составляет 1/1836 массы протона, поэтому их число не вносит значительного вклада в массу элемента). Массы протона и нейтрона равны — именно они приняты за атомную единицу массы. Кажется, что и атомные массы, выраженные в атомных единицах массы, должны быть одинаковыми. Однако это не так: элементы существуют в виде разных изотопов, которые отличаются по числу нейтронов, то есть именно по массе. В таблице Менделеева приводится усредненная масса, определяющаяся тем, какова доля того или иного изотопа в земной коре.
Действительно, масса атома определяется числом протонов и нейтронов в ядре (масса электрона составляет 1/1836 массы протона, поэтому их число не вносит значительного вклада в массу элемента). Массы протона и нейтрона равны — именно они приняты за атомную единицу массы. Кажется, что и атомные массы, выраженные в атомных единицах массы, должны быть одинаковыми. Однако это не так: элементы существуют в виде разных изотопов, которые отличаются по числу нейтронов, то есть именно по массе. В таблице Менделеева приводится усредненная масса, определяющаяся тем, какова доля того или иного изотопа в земной коре.
«Почти полтора века мы пользуемся стандартным набором атомных весов, определенных дедовскими методами. Однако методы аналитической химии динамично развиваются: не так давно выяснилось, что атомные массы элементов получаются разными в зависимости от участка земной коры, где происходило извлечение химического элемента», — пояснил Майкл Визер, секретарь комиссии IUPAC по атомным массам.
Уточнение значения атомной массы не праздная научная задача.
Даже незначительные изменения значений весьма важны как для решения исследовательских задач, так и для практических вычислений.
В частности, знание точного изотопного состава «среднего» углерода необходимо для установления стандартов на определение качества пищи, особенностей происхождения продуктов питания. Изотопный состав простых газообразных веществ и элементов, составляющих атмосферные газы, исследуют для мониторинга миграции веществ-загрязнителей в гидросфере и атмосфере.
Знать точную атомную массу нужно даже для эффективного допинг-контроля.
Дело в том, что изотопные составы человеческого и синтетического тестостерона отличаются. Искусственный гормон получают из соевых бобов, в которых атомная масса углерода и водорода не совпадает с таковой в человеческом теле. Достаточно взять пробу мочи спортсмена и измерить соответствующие значения. Углерод и водород, полученные организмом из соевых бобов, будут иметь один профиль, а элементы человеческого тестостерона, который синтезируется из холестерина, другой.
Использование современных аналитических методов выявило необходимость
внести изменения в приводимые в таблице Менделеева массы десяти элементов: водорода, лития, бора, углерода, азота, кислорода, кремния, серы, хлора и таллия.
Новые значения более точно отражают распределение изотопов элементов в земной коре.
Для отражения различий в изотопном составе элемента в зависимости от местонахождения IUPAC предложил выражать массы этих элементов в виде интервалов, отвечающих аналитически наблюдаемому разбросу. Например, в современных таблицах указана масса серы в 32,07; а в новую таблицу будет внесен интервал 32,059–32,076. Так «пользователи» будут видеть, что атомная масса зависит от источника вещества, содержащего целевой элемент. Точное знание атомной массы, таким образом, в ряде случаев поможет точно установить происхождение образца.
Нововведение внесет некоторую сумятицу в работу преподавателей химии, признают в IUPAC. Для решения задач по химии учащимися и быстрой оценки верности численного решения необходимо использовать конкретное значение атомной массы любого элемента.
Изотопы: без них никуда
Тритий: для космоса, термояда и не толькоТритий вот уже много лет остается главной «рабочей лошадкой» для изотопного направления ВНИИНМа. Расскажу о самых интересных событиях последних лет, связанных с тритием.
Большую известность в последние годы получила так называемая ядерная батарейка, разработанная по комплексному заказу Роскосмоса, при выполнении которого ВНИИНМ сыграл ключевую роль. Такие устройства называются бета-вольтаическими источниками электроэнергии. Они нужны для бесперебойного питания отдельных элементов космических аппаратов в течение многих лет. В рамках этого проекта нами был реализован полный цикл изготовления бета-источников на основе трития, которые, собственно, и являются «сердцем» атомной (ядерной) батарейки. Энергия бета-излучения трития с помощью полупроводникового преобразователя превращается в электричество.
Как же получают бета-источники на основе трития? Сначала в цехе мехобработки готовят подложки в виде дисков. В качестве материала, как правило, используют медь или молибден. Подложка специальным образом подготавливается, и на нее наносят очень тонкий — порядка нескольких микрон или меньше — слой металлического титана; получают так называемую мишень. Затем на вакуумном стенде производят отжиг мишени — это нужно для того, чтобы ушли все газообразные примеси. Далее на том же стенде титановый слой мишени насыщается тритием. Тритий в газообразном виде подают в аппарат насыщения, где он химически связывается титаном. В результате получается источник излучения с большим потоком бета-частиц. Но мало получить такой источник, необходимо при этом еще убедиться, что тритий находится на поверхности мишени в нужном количестве и нужной форме, что поток испускаемых ею бета-частиц соответствует всем требованиям. Только после этого можно приступать к сборке изотопного источника питания. В едином корпусе монтируют бета-источник и полупроводниковый преобразователь так, чтобы бета-излучение попало непосредственно на него с минимальными потерями. Для этого необходимо откачать из корпуса воздух и обеспечить его герметичность, так как столкновение бета-частиц с молекулами газов сильно снижает выход электроэнергии. В состав изотопного источника может входить большое количество пар «бета-излучатель — полупроводник».
Получившаяся батарея способна работать в экстремальных условиях: выдерживать глубокий вакуум, очень низкие и очень высокие температуры, механическую нагрузку. Этот источник питания способен более чем на десятилетие решить вопрос обеспечения энергией жизненно важных для космического аппарата систем и элементов. Предполагается, что изотопный источник питания будет работать вместе с химическими источниками тока. Изготовление ядерных батареек — довольно дорогое удовольствие, поэтому они будут установлены только на самых ответственных узлах.
Тритий в качестве источника излучения в ядерной батарейке имеет ряд преимуществ по сравнению с другими радиоактивными изотопами. Во-первых, это один из самых дешевых радиоактивных изотопов. Во-вторых, это мягкий бета-излучатель, у него нет гамма-излучения, что обеспечивает безопасность эксплуатации устройств на его основе. В‑третьих, у трития очень удобный период полураспада — чуть более 12 лет: не слишком много и не слишком мало. В‑четвертых, технология нанесения трития на титановые мишени отработана многолетней практикой предприятий Росатома.
Еще одно перспективное направление в работе с тритием, которое мы начали осваивать в этом году, связано с экспериментальным термоядерным реактором «Игнитор», создаваемым в Троицке под руководством АО «ГНЦ РФ ТРИНИТИ» и на его промплощадке.
Термоядерная реакция основана на слиянии ядер водорода, дейтерия и трития. Первый, самый легкий и распространенный изотоп водорода называется протием. Дейтерий в два раза тяжелее, он достаточно редок, но вполне может быть получен из природной смеси изотопов ректификацией, методами химического обмена или электролизом. Тритий, в отличие от двух первых — стабильных — изотопов водорода, радиоактивен. В природе он встречается в таких ничтожных количествах, что выделять его нецелесообразно, поэтому его получают реакторным путем. Ядра дейтерия и трития при слиянии дают колоссальный выход энергии — именно это лежит в основе действия водородной бомбы. К сожалению, до сих пор не удалось реализовать управляемый термоядерный синтез, чтобы использовать эту энергию в мирных целях, как неиссякаемый источник электроэнергии. Проект «Игнитор» направлен как раз на решение этой задачи.
Для обеспечения установки «Игнитор» тритием необходимо осуществить его химическую очистку и выделение из смеси с другими изотопами водорода. После получения нужной смеси дейтерия и трития ее подают в плазменную камеру, где происходит термоядерная реакция. По завершении реакции необходимо снова вернуть дорогостоящий тритий в топливный цикл. В процессе слияния ядер дейтерия и трития образуются гелий, а также углеводороды, аммиак, пары тритийсодержащей воды. Из этого «бульона» тритий нужно выделить как можно более полно, обеспечив также безопасность технологического процесса, так как тритий обладает высокой радиотоксичностью.
По вопросам обеспечения безопасности при работе с тритием мы имеем успешный опыт многолетнего сотрудничества с коллегами из РХТУ им. Д. И. Менделеева. Разработанная ими колонна фазового изотопного обмена позволяет исключить попадание трития в окружающую среду из системы вентиляции. Принцип работы колонны фазово-изотопного обмена достаточно прост: пары́ радиоактивной воды вместе с потоком газа подаются в нижнюю часть колонны, а сверху она орошается небольшим количеством обычной воды природного изотопного состава. Специальная насадка обеспечивает контакт газа и жидкой фазы. Таким образом, пары́ воды, содержащей тритий, переходят в жидкую фазу, которая собирается в нижней части этой колонны в виде тритиевого концентрата, после чего безопасно захоранивается. Такую колонну РХТУ изготовил и для ВНИИНМа по нашему техническому заданию. Мы активно используем эту установку при демонтаже старого оборудования, загрязненного тритием. Интересно, что после такой очистки на выходе из колонны воздух получается даже чище, чем в обычном помещении.
Для безопасного захоронения тритийсодержащей воды мы осуществляем ее цементирование в герметичном контейнере. Молекулярный водород, содержащий следы трития, может быть сорбирован гранулами металлического титана, который не подвергается коррозии и окислению, поэтому может сотни лет хранить тритий, пока тот не распадется полностью.
Для концентрирования трития, содержащегося в воде, как правило, используют метод химического изотопного обмена в системе «вода-водород». Разработкой таких установок также занимаются наши коллеги из РХТУ.
Как происходит процесс химического изотопного обмена? В насадочной колонне, как и в предыдущем случае. Однако помимо насадки в колонне должен присутствовать специальный катализатор. В мире лишь немногие страны могут похвастать его наличием. Нам повезло: в РХТУ есть собственный катализатор, по характеристикам — один из лучших в мире. В верхней части колонны водород превращают в воду, сжигая его или с помощью каталитического окисления. Полученная вода течет вниз, орошая слои насадки и катализатора и вступая в реакцию изотопного обмена с газообразным водородом, который, наоборот, подается в колонну снизу вверх. Тритий накапливается внизу колонны, а сверху мы получаем очищенный от трития водород, который можно выбрасывать в атмосферу. Однако для протекания этой реакции необходимо воду, стекающую вниз, превращать в молекулярный водород. Для этого используют электролизеры.
Используя такую колонну в сочетании с описанной выше, можно не только уловить, но и сконцентрировать тритий. Так можно добиться значительного уменьшения объемов тритийсодержащих отходов, что удобно при последующем их захоронении.
Помимо этих двух направлений, тритий интересен в качестве радиоактивной метки. С его помощью, например, можно изучить и визуализировать взаимодействие водорода с конструкционными материалами — известно, что при насыщении водородом многие из них меняют свои механические свойства. При эксплуатации реакторных установок необходимо контролировать поведение трития, образующегося в ядерном топливе, его диффузию через оболочки твэлов и стенки теплообменников, его переход в другие химические формы. Это тоже входит в круг задач специалистов нашего изотопного отделения.
Как мы проводим такие исследования? Берем конструкционный материал, помещаем в специальный аппарат насыщения, откачиваем воздух и при определенной температуре подаем в аппарат тритий. После насыщения тритием образцы исследуемого материала разрезаем пополам и помещаем на специальную пластину, с помощью которой на компьютере визуализируется распределение трития. По характеру распределения трития и по скорости его проникновения в толщу материала можно определить коэффициенты диффузии, растворимость трития в материалах, что требуется для расчета ресурсных характеристик различных установок, в которых эти материалы используются. Теоретически этот метод исследования может применяться для решения многих промышленных задач, но на практике заказчиком таких работ выступает пока только атомная отрасль.
Геохимия. Часть 1 | Открытые видеолекции учебных курсов МГУ
Дисциплина «Геохимия» входит в блок профильной подготовки вариативной части ООП (В.Г). Её освоение базируется на курсах блоков общенаучной подготовки базовой и вариативной части, входящих в модули Общая Геология, Физика, Математика и Химия, на материалах дисциплин блока профильной подготовки вариативной части (В.Г) – «Кристаллография», «Минералогия», «Петрология».
Курс предоставляет возможность профессионального овладения современными проблемами, прогрессивными методами исследования, комплексной обработки и интерпретации в области геохимии и физико-химической петрологии.
Целями освоения дисциплины “Геохимия” является освоение студентами теоретических основ общей геохимии, изучение поведения химических элементов в геологических процессах, ознакомление с геохимическими методами решения теоретических (генетических) и прикладных задач геологии.
Список всех тем лекций
Лекция 1. Введение в геохимию.
Предмет геохимии
Методы исследования в геохимии
Направления геохимии
Литература по геохимии
История геохимии
Основоположники геохимии
Фрэнк Кларк
Владимир Иванович Вернадский
Виктор Мориц Гольдшмит
Александр Евгеньевич Ферсман
Александр Павлович Виноградов
Лекция 2. Космическая распространенность элементов.
Космическая распространенность элементов
Спектр абсолютно черного тела
Внешние зоны Солнца
Зависимость распространенности элемента от порядкового номера
Закономерности распространенности изотопов
Правило Оддо-Харкинса
Теория нуклеосинтеза
Диаграмма Герцшпрунга-Рассела
Водородное “горение”
Лекция 3. Метеориты.
Состав Земли и Солнца
Приток внеземного вещества на Землю
Метеориты
Железные метеориты
Хондриты
Хондры
Содержание металла
Углистые хондриты
Изотопный состав кислорода
Ахондриты
Лекция 4. Химия планетных тел.
Химия метеоритов
Катастрофический горизонт
Конденсация протопланетного облака
Резюме о метеоритах
Типы планет
Планеты-гиганты (газовые планеты)
Юпитер
Сатурн
Планеты Земной группы (каменные планеты)
Меркурий
Венера
Марс
Лекция 5. Геохимическая классификация элементов.
Геохимическая классификация элементов
Классификация химических элементов Вернадского
Классификация химических элементов Гольтшмита
Космохимическая классификация элементов
Закон всюдности Вернадского
Рассеянные элементы
Микро и макрокомпоненты
Лекция 6. Геохимия мантии Земли.
Мантия и ядро Земли
Источники информации о химическом составе Земли
Изменения плотности с глубиной в Земле
Изменение скоростей сейсмических волн с глубиной в Земле
Изменение скоростей сейсмических волн с глубиной в море
Физические параметры Земли
Главные сейсмические границы
Диаграмма состояния железа
Мантия Земли
Схема фазовых переходов в верхней части мантии
Минеральные включения в алмазах
Состав мантии
Хондритная модель состава мантии
Модель пиролита (Рингвуд)
Ксенолитовая модель
Современные представления о мантии
Лекция 7. Мантия Земли.
Слоистая модель строения мантии
Механизмы плавления
Плавление нижней мантии
Горячие точки
Происхождение Солнечной системы
Модель происхождения
Ранняя история Земли
Магматический океан
Сидерофильные элементы мантии Земли
Hadean (Годей)
Лекция 8. Эндогенные процессы.
Эндогенная энергия
Тепловой поток Земли
Современная радиогенная энергия
Абсолютная радиогенная энергия
Энергия ранней Земли
Энергия аккреции
Гравитационная дифференциация
Энергия Солнца
Формы нахождения элемента в Земле
Собственные минеральные формы
Изоморфизм
Ионные радиусы
Радиусы катионов в периодической системе
Изоморфизм изовалентный и гетеровалентный
Лекция 9. Изоморфизм и миграция химических элементов.
Изоморфизм
Применение изоморфизма
Коэффициенты распределения
Примеры изоморфизма
Значение изоморфизма для геохимии
Факторы миграции химических элементов
Радиусы ионов
Диаграмма ионных потенциалов
Внешние факторы миграции элементов
Геохимические барьеры
Лекция 10. Изотопная геохимия.
Изотопная геохимия
Изотопы
Нейтрон-протонная диаграмма
Геохимия радиоактивных изотопов
Виды радиоактивного распада
Альфа-распад
Бета-распад
Методы определения радиоактивности
Методы масс-спектрометрии
Источники ионов
Детектор
Радиоактивные и радиогенные изотопы
Закон радиоактивного распада
Радиоуглеродный метод датировки образцов
Лекция 11. Радиоизотопное датирование.
Радиоуглеродный метод датировки образцов
Определение количества дочернего изотопа
Долгоживущие изотопы
Калий-аргоновый метод
Потери аргона
Избыточный аргон в минералах
Методы определения
Аргон-аргоновый метод
Рубидий-стронциевый метод
Изохрона
Лекция 12. Изотопная геохимия.
Самарий-неодимовый метод (Sm/Nd)
Метод изохроны
Применение метода
Пример применения самарий-неодимового метода
Другие изохронные методы
Уран-торий-свинцовый метод (U-Th-Pb)
Ряды распада
Оценка нерадиогенной составляющей по свинцу
Метод конкордии
Циркон
Лекция 13. Геохимия стабильных изотопов.
Начальный изотопный состав стронция Земли
Эволюция изотопного состава стронция
Обедненная и обогащенная мантия
Вулканические породы в океане
Изотопные отношения благородных газов
Изотопные отношения гелия
Изменение соотношения стронция в морской воде
Стабильные изотопы легких элементов
Фракционирование стабильных изотопов
Исчисление изотопного состава объектов
Основные изотопные стандарты
Коэффициент изотопного фракционирования
Бета-фактор
Лекция 14. Применение изотопной геохимии.
Применение изотопной геохимии
Задачи изотопной геохимии
Изотопные признаки протекания процессов
Рэлеевское исчерпание
Диаграмма Тейлора
Линия Крэйга
Распределение кислорода и водорода на разных широтах
Фракционирование изотопов кислорода при образовании магматических систем
Разнообразие изотопных составов водорода
Разнообразие изотопных составов кислорода
Специфические процессы
Сульфатредукция
Фотосинтез
Палеотемпература
Лекция 15. Геохимия магматизма.
Геохимия стабильных изотопов
Коэффициент изотопного разделения
Масс-независимое фракционирование
Геохимия магматизма
Магматические расплавы
Магмообразующие факторы
Магматические породы
Диаграмма плавкости
Включения
Поведения микрокомпонентов
Распределение редкоземельных элементов между минералами
Лекция 16. Геохимия магматизма (продолжение).
Распространенность магматических пород
Частичное плавление мантии
Выплавка из мантии и гранитизация
Геотермический градиент континентальной коры
Диаграмма плавления пиролита
Первичная магма срединных океанических хребтов
Закономерности кристаллизационной дифференциации
Эволюция магм
Обеднение магмы
Толеитовые базальты
Лекция 17. Геохимия магматизма. Толеитовые и ищелочные базальты.
Толеитовые базальты
Толеитовый вулканизм
Месторождения хрома
Основные выводы
Щелочные базальты
Редкоземельные элементы
Изотопные источники
Обогащение мантии некогерентными элементами
Диаграмма плавкости
Полезные ископаемые
Основные выводы
Известково-щелочной магматизм
Зона субдукции
Лекция 18. Геохимия магматизма. Известково-щелочной и гранитоидный магматизм.
Известково-щелочной магматизм
Зона субдукции
Окислительно-восстановительные состояния магматических пород
Зависимость фугитивности кислорода от состава шпинели
Кристаллизация известково-щелочной серии
Петрологические диаграммы AFM
Многоэлементная диаграмма базальтов островных руд
Полезные ископаемые
Основные выводы
Граниты
Точка псевдобинарных эвтектик
Различия двух типов гранитов
Геохимия метаморфизма
Метаморфические фации
Основные геохимические закономерности метаморфизма
Лекция 19. Геохимия гидротермального процесса.
Геохимия гидротермального процесса
Гидротермальные процессы
Основные вопросы
Фазовое состояние воды
Состав гидротермальных растворов
Флюидные газово-жидкие включения
Растворимость минералов в воде
Разбавленные растворы
Изучение гидротермальных растворов
Перенос металлов в вулканических газах
Гетерогенные гидротермальные системы
Перенос металлов в газовой фазе
Комплексообразование в водных растворах
Лекция 20. Причины рудоразложения.
Метод растворимости
Растворение AgCl
Растворимость ZnS
Золото-кварцевые жилы
Перенос кремнезема и кварца
Факторы рудообразования
Источники вещества в геотермальном процессе
Происхождение воды
Источники серы
Черные курильщики
Лекция 21. Химическая модель земной коры.
Земная кора
Средний магматический состав магматического вещества
Оценка объема пород земной коры
Распространенность горных пород осадочной оболочки земной коры
Химический состав континентальной коры согласно моделям выплавления
Геохимия внешних оболочек Земли
Геохимические резервуары
Характеристика резервуаров
Геохимия осадочного процесса
Осадочная оболочка
Выветривание осадочных пород
Лекция 22. Геохимия осадочного процесса.
Осадочные образования
Классификация осадочных образований по Гольдшмидту
Сопоставление осадочной оболочки с магматическими породами
Парадокс кальция
Стационарное состояние
Эволюция осадкообразования
Геохимические барьеры
Лекция 23. Геохимия гидросферы.
Гидросфера
Распределение температур поверхности воды
Консервативные и неконсервативные элементы
Состав океана и его эволюция
Время пребывания компонентов в океане
Проблема анионного баланса
Редкоземельные элементы и их поведение в земной коре
Воды суши
Принципы накопления природных вод
Воды с различным рН
Галогенез
Лекция 24. Геохимия атмосферы.
Атмосфера
Состав атмосферы
Консервативные и неконсервативные газы
Биогенный состав атмосферы
Происхождение и эволюция атмосферы и гидросферы
Дегазация Земли
Первичная дегазация Земли
Парциальное давление кислорода в истории Земли
в атмосфере
Отложение карбонатов
Лекция 25. Геохимия биосферы.
Атмосфера
Вопросы глобального потепления
Биосфера
Элементы биосферы
Биогеохимия
Биогеохимические провинции
Функции живого вещества
Происхождение жизни на Земле
LUCA
Геотермальные поля
2.3: Расчет атомных масс (задачи)
ПРОБЛЕМА \ (\ PageIndex {1} \)
Определите количество протонов, нейтронов и электронов в следующих изотопах, которые используются в медицинских диагнозах:
(а) атомный номер 9, массовое число 18, заряд 1-
(б) атомный номер 43, массовое число 99, заряд 7+
(c) атомный номер 53, атомный массовый номер 131, заряд 1-
(d) атомный номер 81, атомное массовое число 201, заряд 1+
(e) Назовите элементы в частях (a), (b), (c) и (d)
- Ответить на
с: 9; п: 9; e: 10
- Ответ б
с: 43; п: 56; e: 36
- Ответ c
с: 53; п: 78; e: 54
- Ответ d
с .: 81; п: 120; e: 80
- Ответ
а – Ф; б – Тс; в – Я; г – Tl
- Нажмите здесь, чтобы посмотреть видео о решении.{77} _ {34} Se} \)
- Ответить на
человек: 5; n: 5
- Ответ б
человек: 80; n: 119
- Ответ c
человек: 29; n: 34
- Ответ d
человек: 6; n: 7
- Ответ
человек: 34; n: 43
ПРОБЛЕМА \ (\ PageIndex {3} \)
Элемент имеет следующие природные содержания и изотопные массы: 90.Изобилие 92% с 19,99 а.е.м., изобилие 0,26% с 20,99 а.е.м. и 8,82% с 21,99 а.е.м. Рассчитайте среднюю атомную массу этого элемента.
- Ответить
20,16 а.е.м.
- Нажмите здесь, чтобы посмотреть видео о решении.
ПРОБЛЕМА \ (\ PageIndex {4} \)
Средние атомные массы, перечисленные ИЮПАК, основаны на изучении экспериментальных результатов.Бром имеет два изотопа, 79 Br и 81 Br, массы (78,9183 и 80,9163 а.е.м.) и содержания (50,69% и 49,31%) были определены в более ранних экспериментах. Рассчитайте среднюю атомную массу Br на основе этих экспериментов. Как это соотносится со значением, указанным в периодической таблице?
- Ответить
79,90 а.е.м .; это соответствует значению в периодической таблице
ПРОБЛЕМА \ (\ PageIndex {5} \)
Коэффициент содержания 18 O: 16 O в некоторых метеоритах больше, чем тот, который используется для расчета средней атомной массы кислорода на Земле.Является ли средняя атомная масса атома кислорода в этих метеоритах больше, меньше или равна земному атому кислорода?
- Ответить
Больше, поскольку вклад в среднюю атомную массу 18 O больше, это увеличит среднюю атомную массу в метеоритах по сравнению с земной.
ПРОБЛЕМА \ (\ PageIndex {6} \)
Сравните 1 моль H 2 , 1 моль O 2 и 1 моль F 2 .
(а) Какая из молекул содержит наибольшее количество молекул? Объяснить, почему.
(b) Какая из них имеет наибольшую массу? Объяснить, почему.
- Ответить на
1 моль всегда 6,022 x 10 23 молекул. У них одинаковое количество молекул.
- Ответ б
Ф 2 ; он имеет самую высокую молярную массу.
ПРОБЛЕМА \ (\ PageIndex {7} \)
Который содержит наибольшую массу кислорода: 0.75 моль этанола (C 2 H 5 OH), 0,60 моль муравьиной кислоты (HCO 2 H) или 1,0 моль воды (H 2 O)? Объяснить, почему.
- Ответить
Муравьиная кислота. В его формуле вдвое больше атомов кислорода, чем в двух других соединениях (по одному). Следовательно, 0,60 моль муравьиной кислоты будет эквивалентно 1,20 моль соединения, содержащего один атом кислорода.
ПРОБЛЕМА \ (\ PageIndex {8} \)
Определите массу каждого из следующих элементов:
(а) 0.0146 моль KOH
(б) 10,2 моль этана, C 2 H 6
(в) 1,6 × 10 −3 моль Na 2 SO 4
(г) 6,854 × 10 3 моль глюкоза, C 6 H 12 O 6
(e) 2,86 моль Co (NH 3 ) 6 Cl 3- Ответить на
0,819 г
- Ответ б
307 г
- Ответ c
0.23 г
- Ответ d
1,235 × 10 6 г (1235 кг)
- Ответ
765 г
ПРОБЛЕМА \ (\ PageIndex {9} \)
Что из следующего представляет наименьшее количество молекул?
- 20,0 г H 2 O (18,02 г / моль)
- 77,0 г CH 4 (16,06 г / моль)
- 68.0 г CaH 2 (42,09 г / моль)
- 100,0 г N 2 O (44,02 г / моль)
- 84,0 г HF (20,01 г / моль)
- Ответ
20,0 г H 2 O представляет наименьшее количество молей, что означает наименьшее количество присутствующих молекул. Поскольку 1 моль = 6,022 × 10 23 молекул (или атомов) независимо от идентичности, наименьшее количество молей будет равно наименьшему количеству молекул.
- Нажмите здесь, чтобы посмотреть видео о решении.
Расчет атомной массы | Химия для неосновных
Цели обучения
- Определите атомную массу.
- Рассчитайте атомную массу с учетом соответствующей информации об изотопах.
Вы когда-нибудь пробовали переместить валун?
У вас есть куча камней, которую нужно переместить, и вам нужно решить, какое оборудование вы хотите арендовать для их перемещения.Если камни довольно маленькие, вы можете взять лопату, чтобы подобрать их. Большие камни можно перемещать вручную, но для больших валунов потребуется какой-то механический ковш. Количество камней каждого вида также определяет, сколько времени вам понадобится для выполнения работы. Знание относительного количества крупных, средних и мелких камней может быть очень полезным при принятии решения о подходе к работе.
Большинство элементов встречаются в природе в виде смеси двух или более изотопов. В таблице ниже показаны природные изотопы нескольких элементов, а также -процентное естественное содержание каждого из них.{65} _ {29} \ text {Cu} [/ латекс]
30,83 64,928 Для некоторых элементов один конкретный изотоп значительно преобладает над другими изотопами. Встречающийся в природе водород – это почти весь водород-1, а встречающийся в природе кислород – почти весь кислород-16. Однако для многих других элементов может существовать более одного изотопа в более существенных количествах. Хлор (атомный номер 17) – ядовитый газ желтовато-зеленого цвета. Около трех четвертей всех атомов хлора имеют 18 нейтронов, что дает этим атомам массовое число 35.Около четверти всех атомов хлора имеют 20 нейтронов, что дает этим атомам массовое число 37. Если бы вы просто вычислили среднее арифметическое из точных атомных масс масс , вы бы получили 36.
[латекс] \ displaystyle \ frac {\ left (34,969 + 36,966 \ right)} {2} = 35,968 \ text {amu} [/ latex]
Очевидно, фактическая средняя атомная масса из последнего столбца таблицы значительно ниже. Почему? Нам необходимо принять во внимание процентное естественное содержание каждого изотопа, чтобы рассчитать так называемое средневзвешенное значение.Атомная масса элемента – это средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента. В приведенном ниже примере задачи показано, как рассчитать атомную массу хлора.
Пример задачи: расчет атомной массы
Используйте атомные массы каждого из двух изотопов хлора вместе с их процентным содержанием, чтобы вычислить среднюю атомную массу хлора.
Шаг 1. Составьте список известных и неизвестных количеств и спланируйте проблему.
Известный
- хлор-35: атомная масса = 34,969 а.е.м. и содержание в% = 75,77%
- хлор-37: атомная масса = 36,966 а.е.м., содержание в% = 24,23%
Неизвестно
- Средняя атомная масса хлора
Преобразуйте каждый процент содержания в десятичную форму, разделив на 100. Умножьте это значение на атомную массу этого изотопа. Сложите для каждого изотопа, чтобы получить среднюю атомную массу.
Шаг 2: Вычислить
хлор-35 0.7577 × 34,969 = 26,50 а.е.м. хлор-37 0,2423 × 26,966 = 8,957 а.е.м. средняя атомная масса 26,50 + 8,957 = 35,45 а.е.м. Примечание. Применение правил значащих цифр дает результат 35,45 а.е.м. без чрезмерной ошибки округления. За один шаг:
(0,7577 × 34,969) + (0,2423 × 36,966) = 35,45 а.е.м.
Шаг 3. Подумайте о своем результате.
Рассчитанная средняя атомная масса ближе к 35, чем к 37, потому что больший процент встречающихся в природе атомов хлора имеет массовое число 35.Это согласуется со значением из Таблицы выше.
Посмотрите эти видео, чтобы узнать больше об этих расчетах:
http://www.kentchemistry.com/links/AtomicStructure/atomicmasscalc.htm
Сводка
- Атомная масса элемента – это средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента.
- При расчетах атомной массы используется процентное содержание каждого изотопа.
Практика
Щелкните ссылку ниже, чтобы получить некоторый опыт определения атомной массы:
http: // www.Collegeadjuncts.org/javascripts/AtomicMass.html
Обзор
- Определите атомную массу.
- Какая информация вам нужна для расчета атомной массы элемента?
- Рассчитайте атомную массу углерода, используя данные, приведенные в таблице ниже.
массовое число
точный вес
% изобилие
12
12.000000
98,90
13
13.003355
1,10
Глоссарий
- атомная масса: Средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента.
- процентное содержание: Чтобы вычислить средневзвешенное значение, примите во внимание процентное естественное содержание каждого изотопа.Атомная масса элемента – это средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента.
Изотопы и атомные массы
1.6 Изотопы и атомные массы
Цель обучения
- Чтобы знать значение изотопов и атомных масс.
Ядерная модель атома Резерфорда помогла объяснить, почему атомы разных элементов демонстрируют разное химическое поведение.Идентичность элемента определяется его атомным номером ( Z ) Число протонов в ядре атома элемента., Число протонов в ядре атома элемента. Следовательно, атомный номер для каждого элемента разный. . Известные элементы расположены в порядке возрастания Z в периодической таблице. Таблица химических элементов, расположенных в строках с возрастающим атомным номером, так что элементы в каждом столбце (группе) имеют аналогичные химические свойства.(Рисунок 1.24 «Периодическая таблица, показывающая элементы в порядке возрастания»; также см. Главу 32 «Приложение H: Периодическая таблица элементов»), в которой каждому элементу присвоен уникальный одно-, двух- или трехбуквенный символ. . Названия элементов перечислены в периодической таблице вместе с их символами, атомными номерами и атомными массами. Химический состав каждого элемента определяется количеством протонов и электронов. В нейтральном атоме количество электронов равно количеству протонов.
Рисунок 1.24 Периодическая таблица, показывающая элементы в порядке возрастания Z
Как описано в Разделе 1.7 «Введение в Периодическую таблицу», металлы находятся в нижнем левом углу периодической таблицы, а неметаллы – в верхнем правом углу. Полуметаллы лежат вдоль диагональной линии, разделяющей металлы и неметаллы.
В большинстве случаев символы для элементов являются производными непосредственно от названия каждого элемента, например, C для углерода, U для урана, Ca для кальция и Po для полония.Элементы также были названы из-за их свойств [например, радий (Ra) из-за его радиоактивности], в честь страны происхождения ученых, открывших их [полоний (Po) в Польше], для выдающихся ученых [кюрий (Cm) для Кюри], для богов и богинь [селен (Se) для греческой богини луны Селены] и по другим поэтическим или историческим причинам. Некоторые символы, используемые для элементов, которые были известны с древности, произошли от исторических названий, которые больше не используются; остались только символы, напоминающие нам об их происхождении.Примеры: Fe для железа, от латинского ferrum ; Na для натрия, от латинского natrium ; и W для вольфрама, из немецкого вольфрама . Примеры приведены в таблице 1.4 «Символы элементов, основанные на названиях, которые больше не используются». По мере проработки этого текста вы будете постоянно сталкиваться с названиями и символами элементов, и по мере того, как вы знакомитесь с персонажами пьесы или фильма, их имена и символы станут знакомыми.
Таблица 1.4 символа элементов, основанные на названиях, которые больше не используются
Элемент Символ Вывод Значение сурьма Сб стибий Латиница для «марки» медь Cu медь из Cyprium , латинское название острова Кипр, основного источника медной руды в Римской империи золото Au золотой Латиница для «золота» утюг Fe железо Латинское слово для «железа» свинец Пб отвес Латинское «тяжелое» ртуть рт. Ст. гидраргирум Латиница для «жидкого серебра» калий К калий от арабского al-qili , «щелочь» серебристый Ag серебристый Латиница для «серебра» натрий Na натрий Латинское слово для «натрия» банка Sn олова Латиница для «олова» вольфрам Вт вольфрам По-немецки «волчий камень», потому что он мешал плавлению олова и, как считалось, пожирал олово Отзыв из Раздела 1.5 «Атом» в том, что ядра большинства атомов содержат нейтроны, а также протоны. В отличие от протонов, количество нейтронов для большинства элементов не является абсолютно фиксированным. Атомы с одинаковым числом протонов и, следовательно, с одинаковым атомным номером, но с различным числом нейтронов , называются изотопами. Атомы с одинаковым числом протонов, но с различным числом нейтронов. количество протонов и электронов, что означает, что они обладают одинаковым химическим составом.Изотопы элемента различаются только их атомной массой, которая определяется массовым числом ( A ). Число протонов и нейтронов в ядре атома элемента., Сумма чисел протонов и нейтронов. .
Элемент углерод (C) имеет атомный номер 6, что означает, что все нейтральные атомы углерода содержат 6 протонов и 6 электронов. В типичном образце углеродсодержащего материала 98,89% атомов углерода также содержат 6 нейтронов, поэтому каждый имеет массовое число 12.Изотоп любого элемента может быть однозначно представлен как XZA, где X – атомный символ элемента. Таким образом, изотоп углерода с 6 нейтронами – это C612. Нижний индекс, указывающий атомный номер, на самом деле является избыточным, потому что атомный символ уже однозначно определяет Z . Следовательно, C612 чаще записывается как 12 C, что читается как «углерод-12». Тем не менее, значение Z обычно включается в обозначение для ядерных реакций , потому что эти реакции включают изменения в Z , как описано в главе 20 «Ядерная химия».
В дополнение к 12 C, типичный образец углерода содержит 1,11% C613 ( 13 C) с 7 нейтронами и 6 протонами, а также следы C614 ( 14 C) с 8 нейтронами и 6 протонами. . Однако ядро 14 C нестабильно, но подвергается медленному радиоактивному распаду, который лежит в основе метода датирования углерода-14, используемого в археологии (см. Главу 14 «Химическая кинетика»). Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов.Свойства некоторых распространенных изотопов приведены в Таблице 1.5 «Свойства выбранных изотопов».
Таблица 1.5 Свойства выбранных изотопов
Элемент Символ Атомная масса (а.е.м.) Массовое число изотопа Изотопные массы (а.е.м.) Процент изобилия (%) водород H 1.0079 1 1.007825 99.9855 2 2,014102 0,0115 бор B 10,81 10 10.012937 19,91 11 11.009305 80,09 углерод С 12.011 12 12 (определено) 99,89 13 13.003355 1,11 кислород O 15.9994 16 15,994915 99,757 17 16,999132 0,0378 18 17.999161 0,205 утюг Fe 55.845 54 53.939611 5,82 56 55.934938 91,66 57 56.935394 2,19 58 57.933276 0.33 уран U 238,03 234 234.040952 0,0054 235 235,043930 0,7204 238 238.050788 99.274 Источники изотопных данных: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; J. C. Kotz и K. F. Purcell, Chemistry and Chemical Reactivity , 2-е изд., 1991.
Пример 5
Элемент с тремя стабильными изотопами состоит из 82 протонов. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов.
Дано: число протонов и нейтронов
Запрошено: элемент и атомный символ
Стратегия:
A Обратитесь к таблице Менделеева (см. Главу 32 «Приложение H: Периодическая таблица элементов») и используйте количество протонов для идентификации элемента.
B Вычислите массовое число каждого изотопа, сложив количество протонов и нейтронов.
C Укажите символ каждого изотопа с массовым числом в качестве верхнего индекса и числом протонов в нижнем индексе, оба написанных слева от символа элемента.
Решение:
A Свинец с 82 протонами (атомный номер 82): Pb.
B Для первого изотопа A = 82 протона + 124 нейтрона = 206. Аналогично, A = 82 + 125 = 207 и A = 82 + 126 = 208 для второго и третьего изотопов соответственно. . Обозначения для этих изотопов – P82206b, P82207b и P82208b, которые обычно обозначаются сокращенно как 206 Pb, 207 Pb и 208 Pb.
Упражнение
Обозначьте элемент с 35 протонами и напишите символы для его изотопов с 44 и 46 нейтронами.
Ответ: B3579r и B3581r или, чаще, 79 Br и 81 Br.
Хотя массы электрона, протона и нейтрона известны с высокой степенью точности (Таблица 1.3 «Свойства субатомных частиц *»), масса любого данного атома – это не просто сумма масс его электроны, протоны и нейтроны. Например, отношение масс 1 H (водород) и 2 H (дейтерий) на самом деле равно 0.500384, а не 0,49979, как предсказывалось по количеству присутствующих нейтронов и протонов. Хотя разница в массе невелика, она чрезвычайно важна, поскольку является источником огромного количества энергии, выделяющейся в ядерных реакциях (глава 20 «Ядерная химия»).
Поскольку атомы слишком малы для измерения по отдельности и не имеют заряда, нет удобного способа точно измерить абсолютных атомных масс. Однако ученые могут очень точно измерить относительных атомных масс , используя инструмент, называемый масс-спектрометром .Этот метод концептуально аналогичен тому, который Томсон использовал для определения отношения массы к заряду электрона. Во-первых, электроны удаляются или добавляются к атомам или молекулам, в результате чего образуются заряженные частицы, называемые ионами. Заряженная частица образуется, когда один или несколько электронов удаляются или добавляются к атому или молекуле. При приложении электрического поля ионы ускоряются. в отдельную камеру, где они отклоняются от своей начальной траектории магнитным полем, как электроны в эксперименте Томсона.Степень отклонения зависит от отношения массы к заряду иона. Измеряя относительное отклонение ионов с одинаковым зарядом, ученые могут определить их относительные массы (рис. 1.25 «Определение относительных масс атомов с помощью масс-спектрометра»). Таким образом, невозможно точно рассчитать абсолютные атомные массы, просто сложив вместе массы электронов, протонов и нейтронов, и абсолютных масс атомов невозможно измерить, но относительных масс можно измерить очень точно.На самом деле в химии довольно часто встречаются величины, величина которых может быть измерена только относительно некоторой другой величины, а не абсолютно. Позже в этом тексте мы встретим много других примеров. В таких случаях химики обычно определяют стандарт, произвольно присваивая числовое значение одной из величин, что позволяет им вычислить числовые значения для остальных.
Рисунок 1.25. Определение относительных атомных масс с помощью масс-спектрометра
Хлор состоит из двух изотопов, 35 Cl и 37 Cl, примерно в соотношении 3: 1.(a) Когда образец элементарного хлора вводится в масс-спектрометр, электрическая энергия используется для диссоциации молекул Cl 2 на атомы хлора и преобразования атомов хлора в ионы Cl + . Затем ионы ускоряются в магнитном поле. Степень отклонения ионов магнитным полем зависит от их относительного отношения массы к заряду. Обратите внимание, что более легкие ионы 35 Cl + отклоняются сильнее, чем более тяжелые ионы 37 Cl + .Измеряя относительные отклонения ионов, химики могут определить их отношение массы к заряду и, следовательно, их массы. (b) Каждый пик в масс-спектре соответствует иону с определенным отношением массы к заряду. Содержание двух изотопов можно определить по высоте пиков.
Произвольным стандартом, установленным для описания атомной массы, является атомная единица массы (а.е.м.) Одна двенадцатая массы одного атома C12; 1 а.е.м. = 1,66 × 10-24 г., определяемая как одна двенадцатая массы одного атома из 12 C.Поскольку массы всех других атомов рассчитываются относительно стандарта 12 C, 12 C – единственный атом, указанный в Таблице 1.5 «Свойства выбранных изотопов», точная атомная масса которого равна массовому числу. Эксперименты показали, что 1 а.е.м. = 1,66 × 10 −24 г.
Масс-спектрометрические эксперименты дают значение 0,167842 для отношения массы 2 H к массе 12 C, поэтому абсолютная масса 2 H равна
масса h3масса C12 × масса C12 = 0.167842 × 12 а.е.м. = 2,104104 а.е.м.Масса остальных элементов определяется аналогичным образом.
Периодическая таблица (см. Главу 32 «Приложение H: Периодическая таблица элементов») перечисляет атомные массы всех элементов. Если вы сравните эти значения со значениями, приведенными для некоторых изотопов в Таблице 1.5 «Свойства выбранных изотопов», вы увидите, что атомные массы, указанные в периодической таблице, никогда не соответствуют в точности массам любого из изотопов. Поскольку большинство элементов существуют в виде смесей нескольких стабильных изотопов, атомная масса элемента определяется как средневзвешенное значение масс изотопов.Например, встречающийся в природе углерод в основном представляет собой смесь двух изотопов: 98,89% 12 C (масса = 12 а.е.м. по определению) и 1,11% 13 C (масса = 13,003355 а.е.м.). Процентное содержание 14 C настолько низкое, что его можно не учитывать в этом расчете. Тогда средняя атомная масса углерода вычисляется как
(0,9889 × 12 а.е.м.) + (0,0111 × 13,003355 а.е.м.) = 12,01 а.е.м.Углерод составляет преимущественно 12 C, поэтому его средняя атомная масса должна быть близка к 12 а.е.м., что согласуется с нашими расчетами.
Значение 12.01 показано под символом C в периодической таблице (см. Главу 32 «Приложение H: Периодическая таблица элементов»), хотя без сокращения amu , которое обычно опускается. Таким образом, приведенная в таблице атомная масса углерода или любого другого элемента является средневзвешенной массой встречающихся в природе изотопов.
Пример 6
Встречающийся в природе бром состоит из двух изотопов, перечисленных в следующей таблице:
Изотоп Точная масса (а.е.м.) Процент изобилия (%) 79 Br 78.9183 50,69 81 Br 80.9163 49,31 Вычислить атомную массу брома.
Дано: точная масса и процентное содержание
Запрошено: атомная масса
Стратегия:
A Преобразуйте процентное содержание в десятичную форму, чтобы получить массовую долю каждого изотопа.
B Умножьте точную массу каждого изотопа на его соответствующую массовую долю (процентное содержание ÷ 100), чтобы получить его взвешенную массу.
C Сложите взвешенные массы, чтобы получить атомную массу элемента.
D Убедитесь, что ваш ответ имеет смысл.
Решение:
A Атомная масса – это средневзвешенная масса изотопов.В общем можно написать
атомная масса элемента = [(масса изотопа 1 в а.е.м.) (массовая доля изотопа 1)] + [(масса изотопа 2) (массовая доля изотопа 2)] +…Бром состоит только из двух изотопов. Преобразование содержания в процентах в массовые доли дает
B79r: 50,69100 = 0,5069 B81r: 49,31100 = 0,4931B Умножение точной массы каждого изотопа на соответствующую массовую долю дает взвешенную массу изотопа:
79 Br: 79.9183 а.е.м. × 0,5069 = 40,00 а.е.м. 81 Br: 80,9163 а.е.м. × 0,4931 = 39,90 а.е.м.C Сумма взвешенных масс равна атомной массе брома
40,00 а.е.м. + 39,90 а.е.м. = 79,90 а.е.м.D Это значение находится примерно посередине между массами двух изотопов, что является ожидаемым, поскольку процентное содержание каждого из них составляет примерно 50%.
Упражнение
Магний содержит три изотопа, перечисленных в следующей таблице:
Изотоп Точная масса (а.е.м.) Процент изобилия (%) 24 мг 23.98504 78,70 25 мг 24.98584 10,13 26 мг 25.98259 11,17 Используйте эти данные для расчета атомной массы магния.
Ответ: 24,31 а.е.м.
Сводка
Каждый атом элемента содержит одинаковое количество протонов, которое составляет атомный номер ( Z ).У нейтральных атомов одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами . Каждый изотоп данного элемента имеет один и тот же атомный номер, но разное массовое число ( A ), которое является суммой количества протонов и нейтронов. Относительные массы атомов сообщаются с использованием единицы атомной массы
( а.е.м., ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.Атомная масса элемента является средневзвешенной массой встречающихся в природе изотопов. Когда один или несколько электронов добавляются к атому или молекуле или удаляются из них, образуется заряженная частица, называемая ионом , заряд которой обозначается надстрочным индексом после символа.Key Takeaway
- Масса атома – это средневзвешенная величина, которая в значительной степени определяется количеством его протонов и нейтронов, тогда как количество протонов и электронов определяет его заряд.
Концептуальные проблемы
Заполните следующую таблицу, чтобы указать недостающие элементы, символы и количество электронов.
Элемент Символ Число электронов молибден 19 титан В 53 см гелий 14 Заполните следующую таблицу, чтобы указать недостающие элементы, символы и количество электронов.
Элемент Символ Число электронов лантан Ir алюминий 80 натрий Si 9 Be Масса иона такая же, как масса его родительского атома? Поясните свой ответ.
Какой изотопный стандарт используется для определения массы атома?
Дайте обозначение XZA этим элементам, которые существуют как один изотоп.
- бериллий
- рутений
- фосфор
- алюминий
- цезий
- празеодим
- кобальт
- иттрий
- мышьяк
Дайте обозначение XZA этим элементам, которые существуют как один изотоп.
- фтор
- гелий
- тербий
- йод
- золото
- скандий
- натрий
- ниобий
- марганец
Определите каждый элемент, представленный X, который имеет данные символы.
- X2655
- X3374
- X1224
- X53127
- X1840
- X63152
Числовые задачи
Изотопы 131 I и 60 Co широко используются в медицине. Определите количество нейтронов, протонов и электронов в нейтральном атоме каждого из них.
Определите количество протонов, нейтронов и электронов в нейтральном атоме каждого изотопа:
- 97 TC
- 113 В
- 63 Ni
- 55 Fe
И технеций-97, и америций-240 производятся в ядерных реакторах.Определите количество протонов, нейтронов и электронов в нейтральных атомах каждого из них.
Следующие изотопы важны для археологических исследований. Сколько протонов, нейтронов и электронов содержится в нейтральном атоме каждого из них?
- 207 Pb
- 16 O
- 40 К
- 137 CS
- 40 Ar
Медь, отличный проводник тепла, имеет два изотопа: 63 Cu и 65 Cu.Используйте следующую информацию для расчета средней атомной массы меди:
Изотоп Процент изобилия (%) Атомная масса (а.е.м.) 63 Cu 69,09 62.9298 65 Cu 30,92 64.9278 Кремний состоит из трех изотопов со следующими процентными содержаниями:
Изотоп Процент изобилия (%) Атомная масса (а.е.м.) 28 Si 92.18 27.976926 29 Si 4,71 28.976495 30 Si 3,12 29.973770 Рассчитайте среднюю атомную массу кремния.
Заполните следующую таблицу для неона. Средняя атомная масса неона составляет 20,1797 а.е.м.
Изотоп Процент изобилия (%) Атомная масса (а.е.м.) 20 Ne 90.92 19,99244 21 Ne 0,257 20,99395 22 Ne Являются ли изотопы X2863 и X2962 одним и тем же элементом? Поясните свой ответ.
Заполните следующую таблицу:
Изотоп Число протонов Количество нейтронов Число электронов 238 х 95 238 U 75 112 Заполните следующую таблицу:
Изотоп Число протонов Количество нейтронов Число электронов 57 Fe 40 X 20 36 S Используя масс-спектрометр, ученый определил процентное содержание изотопов серы, равное 95.27% для 32 S, 0,51% для 33 S и 4,22% для 34 S. Используйте атомную массу серы из периодической таблицы (см. Главу 32 «Приложение H: Периодическая таблица элементов») и следующие атомные массы для определения точности этих данных, если предположить, что это единственные изотопы серы: 31,972071 а.е.м. для 32 S, 32,971459 а.е.м. для 33 S и 33,967867 а.е.м. для 34 S.
Процентное содержание двух из трех изотопов кислорода составляет 99.76% для 16 O и 0,204% для 18 O. Используйте атомную массу кислорода, указанную в периодической таблице (см. Главу 32 «Приложение H: Периодическая таблица элементов»), и следующие данные для определения массы из 17 O: 15.994915 а.е.м. для 16 O и 17.999160 а.е.м. для 18 O.
Какой элемент имеет более высокую массовую долю в NaI?
Какой элемент имеет более высокую массовую долю в KBr?
Убедитесь, что вы знакомы с темами, обсуждаемыми в разделе Основные навыки 1 (Раздел 1.9 «Основные навыки 1»), прежде чем переходить к числовым задачам.
Урок химии: расчет средней атомной массы
[См. Сопроводительную часть I «Практические задачи по атомной массе» здесь.]
Атомная масса
Атомная масса – это экспериментальное число, определяемое для всех встречающихся в природе изотопов элемента. Как мы видели в нашем уроке по атомной структуре, не все атомы элемента идентичны. Например, у водорода есть три разных изотопа, которые встречаются в природе: 1 H, 2 H, 3 H. Итак, если вы посмотрите на периодическую таблицу и увидите, что ее атомная масса равна 1,01 а.е.м. среднее значение масс всех трех изотопов, а не только одного из них.
Обратите внимание, что единицы были указаны как а.е.м., что означает единиц атомной массы . Эта единица основана на массе изотопа 12 C (углерод-12). Углерод-12 был выбран в качестве основы для всех масс в периодической таблице и определен как ровно 12 а.е.м. Итак, все остальные массы в таблице периодов относятся к массе углерода-12. В таком случае, почему атомная масса углерода в таблице Менделеева не равна точно 12 а.е.м.? Потому что не весь углерод в природе составляет 12 C! Большая его часть составляет 12 ° C, часть – 13 ° C и очень незначительное количество составляет 14 ° C.Когда они усредняются вместе, вы получаете среднюю атомную массу, указанную в периодической таблице, равную 12,01 а.е.м.
Поскольку численности не равны, мы не можем сделать типичное простое среднее, где мы просто складываем их и делим на три. Вместо этого нам нужно выполнить средневзвешенное значение. Формула для расчета средней атомной массы:
средняя атомная масса = (относительное содержание x масса изотопа)
Помните, что ∑ – это символ суммы . Другими словами, мы возьмем сумму относительного содержания каждого изотопа, умноженную на его массу.
Пример
Неон содержит три изотопа естественного происхождения.
Обозначение Массовое число Изотопная масса (а.е.м.) Процент естественного обилия Ne-20 20 19,9924 90,48% Ne-21 21 20,9938 0,27% Ne-22 22 21.9914 9,25% Помните, что массовое число – это не то же самое, что атомная масса или изотопная масса! Массовое число – это количество протонов + нейтронов, а атомная масса (или изотопная масса) – это масса, если вы каким-то образом взвесите ее на весах.
Чтобы найти среднюю атомную массу неона, мы воспользуемся приведенным выше уравнением и возьмем содержание первого изотопа, умноженное на массу первого изотопа плюс , содержание второго изотопа, умноженное на массу второго изотопа плюс . содержание третьего изотопа умножается на массу третьего изотопа.Тем не менее, вы могли вспомнить из своих курсов математики, что, когда вы используете процент в вычислениях, вы всегда хотите использовать десятичную форму, то есть вы должны сначала разделить процент на 100. Тогда уравнение будет выглядеть так:
= (0,9048 x 19,9924 а.е.м.) + (0,0027 x 20,9938 а.е.м.) + (0,0925 x 21,9914 а.е.м.)
= 18,089 а.е.м. + 0,0516 а.е.м. + 2,034 а.е.м.
= 20,1796 а.е.м.
Глядя на наши значащие цифры, мы видим, что 18.089 – с точностью до сотых долей, 0,0516 – с точностью до тысячных долей, а 2,034 – с точностью до сотых долей. Так что ответ может быть точным только до наименее точного или самого неопределенного места, до сотых долей. Поэтому мы округлим ответ до 20,18 а.е.м. . Это средняя атомная масса неона.
Давайте возьмем секунду и посмотрим, кажется ли 20,18 а.е.м. разумным ответом с учетом исходных данных. Согласно таблице, большая часть неона (более 90%) имеет массу около 20 а.е.м., крошечный кусочек имеет массу около 21 а.е.м., а около 9% имеет массу 22 а.е.м.Основываясь на этом, мы могли бы предсказать, что ответ будет близок к 20 а.е.м., но немного выше, что и есть!
Пример
Если серебро состоит на 51,84% из Ag-107 с массой 106,9051 а.е.м., а остальное Ag-109 с массой 108,9048 а.е.м., рассчитайте атомную массу серебра.
Как и раньше, нам нужно взять количество Ag-107, умноженное на массу Ag-107 , плюс количество Ag-109, умноженное на массу Ag-109. Но обратите внимание, что пока у нас в изобилии Ag-107, 51.84%, нам не дано количество Ag-109. Как мы можем это понять? Итак, оба содержания должны составлять 100%, поэтому если Ag-107 составляет 51,84%, тогда Ag-109 должно быть 100 – 51,84 = 48,16%.
= (0,5184 x 106,9051 а.е.м.) + (0,4816 x 108,9048 а.е.м.)
= 55,240 а.е.м. + 52,449 а.е.
= 107,869 а.е.м.
Глядя на значащие цифры, и 55,240 а. Е. И 52,449 а.Средняя атомная масса серебра составляет 107,87 а.е.м. .
[Дополнительные практические задачи по вычислению атомной массы см. В разделе «Практические задачи по атомной массе, часть I.»)
Комментарии
комментария
Как найти атомную массу
Рассчитайте атомную массу элементов бора и магния.Атомная масса – это совокупная масса всех протонов, нейтронов и электронов, составляющих атом. Электроны имеют почти 1/2000 массы протонов и нейтронов, поэтому электроны обычно игнорируются в расчетах с атомной массой.Это означает, что атомная масса – это сумма масс протонов и нейтронов в атоме. Для одиночного атома это массовое число, а для элемента – это средняя атомная масса.
Самый простой способ найти атомную массу – это найти ее в таблице Менделеева. Атомная масса каждого элемента дается в единицах атомной массы или граммах на моль атомов. Это значение представляет собой средних атомных масс элемента, поскольку элементы могут иметь более одного встречающегося в природе изотопа.
Пример: Найдите элемент медь (Cu или элемент номер 29) в периодической таблице. Атомная масса указана как 63,546. Это означает, что средняя масса моля атомов меди составляет 63,546 г. Среднее значение важно, поскольку существует два разных природных изотопа меди: медь-63 и медь-65. Медь-65 имеет на два дополнительных нейтрона, чем медь-63, и поэтому имеет большую массу.
Среднее значение важно, поскольку существует два разных природных изотопа меди: медь-63 и медь-65.Медь-65 имеет на два дополнительных нейтрона, чем медь-63, и поэтому имеет большую массу. Средняя масса меди учитывает естественное содержание каждого изотопа элемента. На медь-63 приходится чуть менее 70% всей меди, встречающейся в природе. Остальные 30% – это медь-65. Эти содержания используются для расчета значения атомной массы, указанного в периодической таблице.
Как рассчитать атомную массу по естественному содержанию. Пример
Этот пример покажет, как найти среднюю атомную массу элемента с учетом естественного содержания каждого из изотопов элемента.
Магний (Mg, элемент 12) имеет три природных изотопа: Mg-24, Mg-25 и Mg-26.
Mg-24 имеет массу 23,99 а.е.м. и составляет 78,99% всего природного магния.
Mg-25 имеет массу 24,99 а.е.м. и составляет 10,00% природного магния.
Mg-26 имеет массу 25,98 а.е.м. и составляет 11,01% природного магния.Какая атомная масса магния?
Ответ: Атомная масса магния – это средневзвешенное значение каждого из этих изотопов.Каждое из изобилиев дает в сумме 100%. Возьмите каждый изотоп, умножьте его на процентное содержание в десятичной форме и сложите все вместе. Поскольку каждое из распространений
масса магния = масса Mg-24 (0,7899) + масса Mg-25 ⋅ (0,1000) + масса Mg-26 ⋅ (0,1101)
масса магния = (23,99 а.е.м.) ⋅ (0,7899) + (24,99 а.е.м.) ⋅ (0,1000) + (24,99 а.е.м.) ⋅ (0,1101)
масса магния = 18,95 а.е.м. + 2,50 а.е.м + 2,86 а.е.м.
масса магния = 24,31 а.е.305 дано в периодической таблице.Как рассчитать естественное содержание изотопов по атомной массе
Обычная домашняя задача включает определение естественного содержания изотопов по атомным массам изотопов и атомной массе элемента.
Бор (B, элемент 5) имеет атомную массу 10,81 а.е.м. и имеет два природных изотопа: B-10 и B-11.
B-10 имеет атомную массу 10,01 а.е.м., а B-11 имеет атомную массу 11,01 а.е.м. Найдите естественное содержание каждого изотопа.
Ответ: Составьте уравнение так же, как в предыдущем примере.
масса бора = масса B-10⋅ (содержание B-10) + масса B-11⋅ (содержание B-10)
10,81 = (10,01) ⋅ (содержание B-10) + 11,01⋅ (обилие B-11)Теперь наша проблема в том, что у нас слишком много неизвестных. Поскольку мы работаем с процентным содержанием, мы знаем, что общая сумма численности равна 100%. В десятичной форме это означает
1 = (обилие B-10) + (обилие B-11)
(обилие B-10) = 1 – (обилие B-11)
Пусть X = обилие B-11, тогда
(содержание B-10) = 1 – X
Подставьте эти значения в приведенное выше уравнение
10.81 = (10.01) ⋅ (1 – X) + 11.01 ⋅ (X)
Решить относительно X
10.81 = 10.01 – 10.01 X + 11.01 X
10.81 – 10.01 = -10.01 ⋅ X + 11.01 ⋅ X
0.80 = 1 ⋅ X
0,80 = X = обилие B-111 – X = обилие B-10
1 – 0,80 = обилие B-10
0,20 = обилие B-10Умножьте оба ответа на 100 %, чтобы получить процентное содержание каждого изотопа.
% содержание B-10 = 0,20 x 100% = 20%
% содержание B-11 = 0,80 x 100% = 80%
Решение: бор состоит из 20% B-10 и 80% B -11.
Связанные сообщенияАТОМЫ И ИЗОТОПЫ
АТОМЫ И ИЗОТОПЫ
АКАДЕМИЯ NFL-YET
ХИМИЯ-I: atom.htm
ОСЕНЬ, 1999
ДР. ДЖЕРАЛЬД А. РОЗЕНТАЛЬ
ХИМИЧЕСКАЯ ПРИРОДА АТОМОВМасса атома сосредоточена в очень маленькой центральной части. атома, который называется атомным ядром. Атомное ядро сделано до электрически положительных протонов и электрически нейтральных нейтронов .Ядро атома окружают электрически отрицательных электронов . Массы и заряды этих трех основных составляющих атомов приведены ниже:
Заряд частиц МассаЭлектрон -1 0
Протон +1 1
нейтрон 0 1
Химическая природа атома, то есть химические свойства конкретный элемент, определяется числом протонов в ядре .Это число протонов называется атомным номером . Масса атом, его атомная масса, зависит как от числа протонов, так и от от количества нейтронов, присутствующих в ядре (помните, что масса электрона настолько мал, что его просто игнорируют с целью установление атомной массы).Прежде чем переходить к этому модулю, перейдите по ссылке: atom02.htm.
ИЗОТОПЫ И АТОМНЫЕ МАССЫ
Это сложное устройство, требующее внимания к деталям и внимательности. мысль.Это непросто.Для многих химических элементов известно несколько изотопов . Изотопы – это атомы с различными атомными массами , которые имеют одинаковых атомный номер . Атомы разных изотопов – это атомы одного и того же химический элемент; их различаются по количеству нейтронов в ядре.
ПОМНИТЕ:
Атомы одного химического элемента составляют не всегда имеют одинаковую массу, потому что, хотя количество протонов в ядро одинаково для всех атомов одного и того же элемента, количество нейтронов нет.
Большинство элементов в естественном виде на Земле представляют собой смеси нескольких изотопов.Например, элемент водород имеет атомы которые имеют один протон в ядре. Это самая распространенная форма водорода. Большинство атомов водорода во Вселенной равны 1 H. То есть они имеют атомный номер, равный единице из-за наличию одиночного протона в ядре, а масса одного из-за наличия одного протона.
Иногда можно найти и атом водорода в котором нейтрон включен в ядро. Это изотоп водорода характеризуется атомным номером, равным единице (только один протон; водород может иметь только один протон в ядре), но атомная масса два (один протон плюс один нейтрон). Этот изотоп водорода известен как «дейтерий» или тяжелый водород.
Наконец, еще более редким является третий изотоп водород [ 3 H].Его масса равна трем, что может произойти только от наличия в ядре двух нейтронов. Помните, что если бы в водороде-3 был еще один протон – это был бы не водород. Этот последний изотоп водорода известен как «тритий», и он радиоактивен.Позже мы снова рассмотрим изотопы, когда мы рассматриваем важный вопрос об атомной массе
Молей атомовИсторическая справка .Атомная масса элемента равна относительное количество. Первоначально атомная масса водорода, самого легкого элементов, была принята равной одному, а атомные массы всех остальных элементы были измерены по отношению к атомной массе водорода. Этот позже оказалось, что это был плохой выбор. Не только водород естественным образом состоят из более чем одного изотопа, но возник дополнительный вопрос (особенно среди ранних химиков) относительно того, одноатомный водород или двухатомный водород следует рассматривать как имеющий атомную массу один.
Вы видите проблему ?
Если бы весь водород существовал в виде одного атома (а это не так), он бы удалось использовать водород в качестве основы для сравнения его массы с масса любого другого элемента. Водород можно было принять за одна единица массы и все остальное по сравнению с водородом. Однако у водорода есть три изотопа, и он встречается в виде двухатомного водорода. (два атома в одной молекуле).После некоторых усилий и одного крупного фальстарта с кислородом, химиками и физики согласились с единой шкалой относительной атомной массы.Углерод изотопной массе двенадцать была присвоена атомная масса ровно двенадцать, а все другие атомные массы, будь то изотопы или элементы, были указаны относительно углерода с атомной массой двенадцать. Это привело к тому, что относительная атомная масса водорода 1,0079 … а не точно 1,0000 …. Разница менее 1% слишком мала, чтобы иметь значение во многих приблизительных расчетах. химические расчеты, но он достаточно велик, чтобы иметь значение при точных работа должна быть сделана.
Вы поняли? За эталон был взят
Карбон-12 и теперь все принято относительно к этому единственному изотопу углерода. Вот почему водород имеет атомную масса больше единицы.
Ученым нужна была единая установка, чтобы они могли сравнивать точные одинаковое количество атомов или молекул одного элемента или соединения по отношению к другому. В конце концов, они согласились использовать понятие родинки (моль) для этого. цель.По определению, один моль атомов – это то количество атомов, которые существуют ровно в двенадцати граммах углерода изотопной массы двенадцать ( 12 С). Напомним, ученые сошлись во мнении об изотопе углерода-12. для определения всех относительных масс атомов.
Число атомов в моль любого элемента или соединения называется Авогадро номер; лучший ток Определение его значения составляет 6,0221 x 10 23 .ВЫ ДОЛЖНЫ ЗАПОМНИТЬ НОМЕР АВОГАДРО И ИМЕТЬ АБСОЛЮТНО ЧЕТКОЕ ПОНИМАНИЕ, ЧТО ЭТО ОЗНАЧАЕТ И ПОЧЕМУ ЭТО ТАК ВАЖНО В СОВРЕМЕННОЙ ХИМИИ
Молярные атомные массы элементов
Молярная масса атома – это просто масса одного моля его идентичные атомы .Однако большинство химических элементов находится на Земля не как один изотоп, а как смесь изотопов , поэтому атомы одного элемента не все имеют одинаковую массу.Поэтому химики выделяют моляр атомная масса изотопа , которая представляет собой массу одного моля идентичного атомов, которые образуют этот изотоп, из молярной атомной массы элемента , которая представляет собой массу одного моля атомов различных изотопов этого элемент, имеющий естественное изобилие, какое они находятся на земле.
Я знаю, что это очень сложно, но если вы действительно понимаете это концепции, то вам ясно следующее:
Химики имеют дело с элементами в естественном виде, поэтому атомная масса конкретного изотопа представляет меньший интерес, чем взвешенная средняя молярная атомная масса отдельных изотопов , которая является молярной атомная масса встречающегося в природе элемента.Это свойство было открыто названо томической массой или химическим веществом. атомный вес элемента .Средневзвешенная молярная атомная масса элемент в естественном виде будет называться просто томик . масса элемента отныне.
Пример. Относительное содержание изотопов 6 Li и 7 Li в литии, встречающемся в природе, можно рассчитать следующим образом. Их атомные массы 6.0151214 и 7.0160030 соответственно. Атомная масса естественного Встречающийся литий, указанный в таблице атомной массы или веса, равен 6.941.
Если относительная численность 6 Li составляет 7,5%, а относительная содержание 7 Li составляет 92,5%, то атомный вес лития (для всей популяции атомов лития) составляет:
(0,075 x 6,0151214) + (0,925 x 7,0160030) = 0,451 + 6,49 или 6,941
Помните, что это средневзвешенное значение, в котором вклад каждого изотоп учитывается. Конечная атомная масса Li очень близка к атомной массе изотопа 7 Li, потому что так много этого изотопа (по сравнению с 6 Li) составляет естественную популяцию атомов лития.
Таким образом, атомная масса Li принята равной 6,941, поскольку это значение дублей учитывать естественное содержание изотопов лития.
Особая благодарность Джеймсу А. Пламбеку из Университета Альберты в г. Канада, автор некоторых из этих материалов.
изотопов | Атом | Сиявула
У атома A 5 протонов и 5 нейтронов, а у атома B 6 протонов и 5 нейтронов.{235} \ text {E} \)
Решение пока недоступно
Заполните таблицу ниже:
Изотоп
Z
A
Протоны
Нейтроны
9023
9042 9042 12Углерод – 14
Железо – 54
9507 9044 9150 9150
9507 9044 Железо – 57
Решение еще не доступно
Если образец содержит \ (\ text {19,9} \% \) бор – 10 и \ (\ text {80,1} \% \) бор – 11, рассчитайте относительную атомную массу атома бора в тот образец.
