Задачи на смеси и сплавы
Если в расчетной задаче используют смесь или сплав двух или более веществ, то можно говорить, что это задачи на смеси и сплавы. Ничего особенного в решении таких задач нет. При решении задач на смеси или сплавы необходимо учитывать, что при добавлении реагента в смесь или сплав уравнения химических реакций добавленного вещества с исходными веществами смеси записывают отдельно. Необходимо учитывать реакционную способность веществ.
Например, при добавлении к смеси алюминиевых и медных опилок щелочи только алюминий прореагирует с щелочью.
В некоторых случаях вещества в исходной смеси могут реагировать друг с другом (например, при нагревании).
Вещества в смеси не обязательно связаны между собой стехиометрическими соотношениями, поэтому записывать реакцию веществ в смеси с добавляемым веществом в одно уравнение будет ошибкой!
Например, при растворении смеси цинковых и алюминиевых опилок в соляной кислоте необходимо записать два отдельных уравнения химических реакций:
2Al + 6HCl = 2AlCl3 + 3H2
Mg + 2HCl = MgCl2 + H2
Также в некоторых ситуациях при решении задач на смеси и сплав вам понадобится умение решать системы линейных уравнений.
В современных задачах ЕГЭ по химии задачи на смеси являются одним из компонентов сложной многокомпонентной расчетной задачи.
Примеры задач на смеси из реальных ЕГЭ по химии.
1. (ЕГЭ 2012) Смесь порошкообразных серебра и меди массой 4,608 г с массовой долей серебра 60%, растворили при нагревании в концентрированной серной кислоте. Выделившийся газ пропустили через раствор гидроксида бария массой 42,75 г с массовой долей 20%. Вычислите массу образовавшегося осадка.
2. (ЕГЭ 2012) Смесь магниевых и цинковых опилок обработали избытком разбавленной серной кислоты, при этом выделилось 22,4 л (н.у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида натрия, то выделится 13,44 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
3. (ЕГЭ 2012) Смесь магниевых и алюминиевых опилок обработали избытком разбавленной соляной кислоты, при этом выделилось 11,2 л (н. у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида калия, то выделится 6,72 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида калия, то выделится 6,72 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
4. (ЕГЭ 2012) Смесь алюминиевых и железных опилок обработали избытком разбавленной соляной кислоты, при этом выделилось 8,96 л (н.у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида натрия, то выделится 6,72 л (н.у.) водорода. Рассчитайте массовую долю железа в исходной смеси.
5. (ЕГЭ 2013) На растворение смеси железа и оксида железа(III) потребовалось 146 г 20%-ного раствора соляной кислоты. При этом выделилось 2,24 л (н.у.) газа. Определите массовую долю железа в исходной смеси.
6. (ЕГЭ 2013) При обработке 6,07 г смеси сульфида цинка и оксида цинка избытком соляной кислоты выделилось 560 мл газа (н.у.). Вычислите объём раствора гидроксида натрия с массовой долей 36% и плотностью 1,4 г/мл, который потребуется затратить для превращения образовавшегося хлорида цинка в тетрагидроксоцинкат натрия.
7. (ЕГЭ 2013) В результате нагревания 12,96 г смеси порошков меди и оксида меди(II) на воздухе её масса увеличилась на 2,24 г. Вычислите объём раствора серной кислоты с массовой долей 96% и плотностью 1,84 г/мл, который потребуется для растворения исходной смеси.
8. (ЕГЭ 2013) Если смесь безводных хлорида железа(III) и сульфата меди(II) добавить к раствору гидроксида натрия, то образуется 15,6 г осадка. Если ту же смесь добавить к раствору нитрата бария, то выделится 11,65 г осадка. Определите массовую долю хлорида железа(III) в исходной смеси.
9. (ЕГЭ 2013) Смесь натрия и оксида натрия растворили в воде. При этом выделилось 4,48 л (н.у.) газа и образовалось 240 г раствора с массовой долей гидроксида натрия 10%. Определите массовую долю натрия в исходной смеси.
10. (ЕГЭ 2013) Если смесь хлоридов калия и кальция добавить к раствору карбоната натрия, то образуется 10 г осадка. Если ту же смесь добавить к раствору нитрата серебра, то образуется 57,4 г осадка. Определите массовую долю хлорида калия в исходной смеси
Определите массовую долю хлорида калия в исходной смеси
11. (ЕГЭ 2013) Смесь сульфида алюминия и алюминия обработали водой, при этом выделилось 6,72 л (н.у.) газа. Если эту же смесь растворить в избытке раствора гидроксида натрия, то выделится 3,36 л (н.у.) газа. Определите массовую долю алюминия в исходной смеси.
12. (ЕГЭ 2013) Смесь карбоната натрия и гидрокарбоната натрия может прореагировать с 73 г 20%-ного раствора соляной кислоты или 80 г 10%-ного раствора гидроксида натрия. Определите массовую долю карбоната натрия в исходной смеси.
13. (ЕГЭ 2013) Смесь сульфида алюминия и алюминия обработали водой, при этом выделилось 6,72 л (н.у.) газа. Если эту же смесь растворить в избытке соляной кислоты, то выделится 13,44 л (н.у.) газа. Определите массовую долю алюминия в исходной смеси.
14. (ЕГЭ 2013) Смесь меди и оксида меди(II) может прореагировать с 219 г 10%-ного раствора соляной кислоты или 61,25 г 80%-ного раствора серной кислоты. Определите массовую долю меди в смеси.
Определите массовую долю меди в смеси.
15. (ЕГЭ 2013) Смесь меди и оксида меди(II) может прореагировать с 243 г 10%-ного раствора бромоводородной кислоты, или с 28,8 г 85%-ного раствора серной кислоты. Определите массовую долю меди в смеси.
16. (ЕГЭ 2013) При растворении смеси меди и оксида меди(II) в концентрированной азотной кислоте выделилось 18,4 г бурого газа и было получено 470 г раствора с массовой долей соли 20%. Определите массовую долю оксида меди в исходной смеси.
17. (ЕГЭ 2013) На полное сжигание смеси углерода и диоксида кремния израсходовали кислород массой 22,4 г. Какой объём 20%-ного раствора гидроксида калия (ρ = 1,173 г/мл) может прореагировать с исходной смесью, если известно, что массовая доля углерода в ней составляет 70%?
18. (ЕГЭ 2013) Смесь гидросульфата и сульфата натрия с массовой долей сульфата в ней 60% может вступить в реакцию с 144 мл 10%-ного раствора гидроксида натрия (ρ = 1,11 г/мл). На исходную смесь подействовали избытком раствора гидроксида бария. Найдите массу осадка, образовавшегося при этом.
На исходную смесь подействовали избытком раствора гидроксида бария. Найдите массу осадка, образовавшегося при этом.
19. (ЕГЭ 2013) Смесь гидрокарбоната и карбоната калия с массовой долей карбоната в ней 73,4% может прореагировать с 40 г 14%-ного раствора гидроксида калия. Исходную смесь обработали избытком раствора серной кислоты. Какой объём (н.у.) газа выделяется при этом?
20. (ЕГЭ 2013) Смесь карбоната лития и карбоната бария обработали избытком раствора серной кислоты. При этом выделилось 4,48 л (н.у.) газа и образовалось 11,65 г осадка. Определите массовую долю карбоната лития в исходной смеси солей.
21. (ЕГЭ 2013) При сжигании смеси углерода и оксида кремния(IV) в избытке кислорода выделился газ массой 132 г. Какая масса 15%-ного раствора гидроксида натрия может прореагировать с исходной смесью, если известно, что массовая доля оксида кремния в ней составляет 60%?
22. (ЕГЭ 2014) Смесь карбоната кальция и оксида кальция массой 25,6 г растворили в 480 мл 10%-ного раствора азотной кислоты (плотность 1,05 г/мл), при этом выделилось 4,48 л (н. у.) газа. Найдите массовую долю веществ в полученном растворе.
у.) газа. Найдите массовую долю веществ в полученном растворе.
23. (ЕГЭ 2014) Смесь меди и цинка обработали избытком соляной кислоты. При этом выделилось 2,24 л (н.у.) водорода. Если эту же смесь обработать избытком разбавленной азотной кислоты, то выделится 8,96 л (н.у.) оксида азота(II). Рассчитайте массовую долю меди в исходной смеси.
24. (ЕГЭ 2014) Смесь кремния и алюминия определённой массы обработали избытком соляной кислоты. При этом выделилось 4,48 л (н.у.) газа. Если эту же смесь обработать избытком раствора гидроксида калия, то выделится 6,72 л (н.у.) газа. Рассчитайте массовую долю кремния в исходной смеси.
25. (ЕГЭ 2014) Смесь кремния и алюминия определённой массы обработали избытком разбавленной серной кислоты. При этом выделилось 0,336 л (н.у.) газа. Если эту же смесь обработать избытком раствора гидроксида натрия, то выделится 0,672 л (н.у.) газа. Рассчитайте массовую долю алюминия в исходной смеси.
26. (ЕГЭ 2014) Сухая смесь сульфата аммония и гидроксида натрия содержит 42% щёлочи по массе. В результате нагревания 22,86 г этой смеси выделился газ, который полностью прореагировал с гидрокарбонатом аммония, содержащимся в 234 г раствора. Определите массовую долю гидрокарбоната аммония в этом растворе.
27. (ЕГЭ 2015) Смесь хлорида натрия и бромида натрия может прореагировать с 4,48 л хлора (н.у.) или с 850 г 10%-ного раствора нитрата серебра. Определите массовую долю бромида натрия в исходной смеси.
28. (ЕГЭ 2015) Какой объём раствора азотной кислоты с массовой долей HNO3 32% (ρ = 1,2 г/мл) потребовался для растворения смеси меди и оксида меди(II), если в результате реакции выделился бесцветный газ объёмом 4,48 л (н.у.), а массовая доля металлической меди в смеси – 50%?
29. (ЕГЭ 2015) Смесь гидрокарбоната и карбоната натрия с массовой долей карбоната в ней 61,3% может прореагировать с 144 мл 10%-ного раствора гидроксида натрия (плотностью 1,11 г/мл). Какая масса 15%-ного раствора соляной кислоты потребуется для растворения исходной смеси?
Какая масса 15%-ного раствора соляной кислоты потребуется для растворения исходной смеси?
30. (ЕГЭ 2016) Определите массовые доли (в %) сульфида калия и сульфида алюминия в смеси, если при обработке 20 г этой смеси водой выделился газ, который полностью прореагировал с 480 г 10%-ного раствора сульфата меди.
31. (ЕГЭ 2016) Смесь, состоящую из 78 г порошка цинка и 32 г серы, прокалили без доступа воздуха, затем растворили в 365 г 30%-ного раствора соляной кислоты. Определите массовую долю кислоты в образовавшемся растворе.
32. (ЕГЭ 2016) Смесь кремния и алюминия определённой массы обработали избытком соляной кислоты. При этом выделилось 0,448 л (н.у.) газа. Если эту же смесь обработать избытком раствора гидроксида калия, то выделится 0,672 л (н.у.) газа. Рассчитайте массовую долю кремния в исходной смеси.
33. (ЕГЭ 2016) Смесь безводных сульфата алюминия и сульфата меди(II) добавили к избытку разбавленного раствора гидроксида натрия. При этом образовалось 4,9 г осадка. Если эту же смесь добавить к раствору нитрата бария, то выделится 46,6 г осадка. Определите массовую долю сульфата алюминия в исходной смеси.
При этом образовалось 4,9 г осадка. Если эту же смесь добавить к раствору нитрата бария, то выделится 46,6 г осадка. Определите массовую долю сульфата алюминия в исходной смеси.
34. (ЕГЭ 2016) Смесь порошков железа и алюминия реагирует с 806 мл 10%-ного раствора серной кислоты (ρ = 1,07 г/мл). При взаимодействии такой же массы смеси с избытком раствора гидроксида натрия выделяется 14,78 л водорода (н.у.). Определите массовую долю железа в смеси.
35. (ЕГЭ 2016) Смесь порошков железа и цинка реагирует с 153 мл 10%-ного раствора соляной кислоты (ρ = 1,05 г/мл). На взаимодействие с такой же массой смеси требуется 40 мл 20%-ного раствора гидроксида натрия (ρ = 1,10 г/мл). Определите массовую долю железа в смеси.
36. (ЕГЭ 2017) При растворении смеси меди и оксида меди(II) в концентрированной серной кислоте выделилось 8,96 л (н.у.) газа и было получено 400 г раствора с массовой долей соли 20%. Определите массовую долю оксида меди(II) в исходной смеси.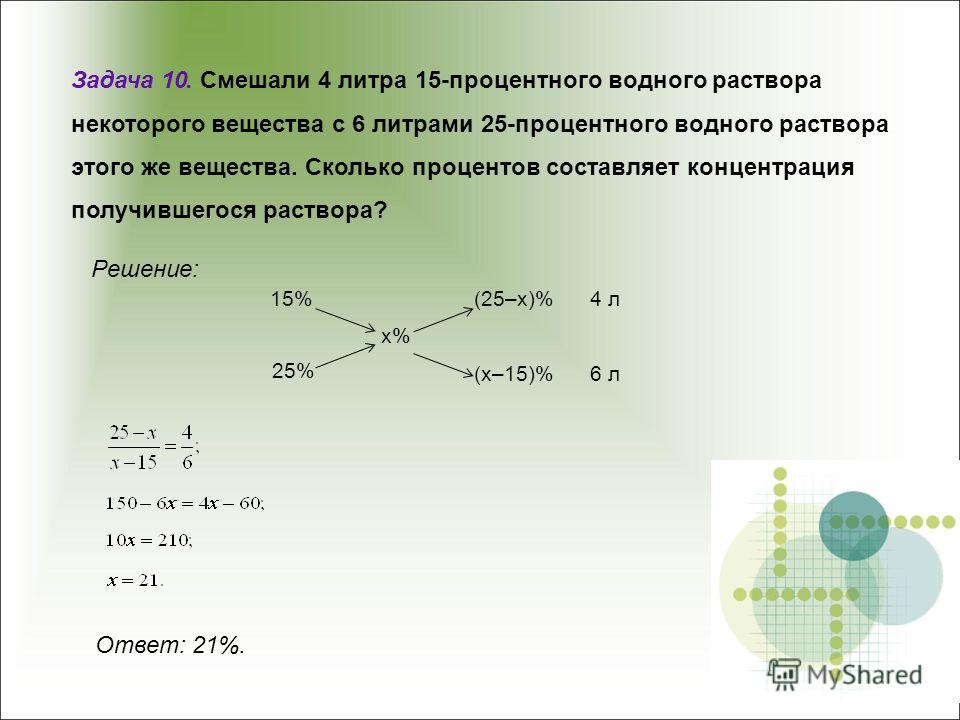
37. (ЕГЭ 2017) Смесь порошков оксида магния и карбоната магния общей массой 20,5 г нагрели до прекращения изменения массы. Масса смеси уменьшилась на 5,5 г. Вычислите объём раствора серной кислоты с массовой долей 28% и плотностью 1,2 г/мл, который потребуется для растворения исходной смеси.
38. (ЕГЭ 2017) В результате нагревания 28,4 г смеси порошков цинка и оксида цинка на воздухе её масса увеличилась на 4 г. Вычислите объём раствора гидроксида калия с массовой долей 40% и плотностью 1,4 г/мл, который потребуется для растворения исходной смеси.
39. (ЕГЭ 2017) Смесь безводных сульфата алюминия и хлорида меди(II) растворили в воде и добавили к избытку раствора гидроксида натрия. При этом образовалось 19,6 г осадка. А если тот же раствор солей добавить к раствору нитрата бария, то выделится 69,9 г осадка. Определите массовую долю сульфата алюминия в исходной смеси.
40. (ЕГЭ 2017) Избыток водорода пропустили при нагревании над 4 г смеси оксида меди(II) и оксида кремния(IV) с массовой долей оксида меди(II) 80%. Образовавшийся твердый остаток обработали 20 мл 60%-ного раствора азотной кислоты (плотностью 1,4 г/см3). Найдите массовую долю соли в образовавшемся растворе.
Образовавшийся твердый остаток обработали 20 мл 60%-ного раствора азотной кислоты (плотностью 1,4 г/см3). Найдите массовую долю соли в образовавшемся растворе.
41. (ЕГЭ 2017) При растворении смеси меди и оксида меди(II) в концентрированной серной кислоте выделилось 4,48 л (н.у.) газа и было получено 300 г раствора с массовой долей соли 16%. Определите массовую долю оксида меди(II) в исходной смеси.
42. (ЕГЭ 2017) Избыток водорода пропустили при нагревании над 4 г смеси оксида меди(II) и оксида кремния(IV) с массовой долей оксида меди(II) 80%. Образовавшийся твердый остаток обработали 20 мл 60%-ного раствора азотной кислоты (плотностью 1,4 г/см3). Найдите массовую долю соли в образовавшемся растворе.
43. (ЕГЭ 2019) Твёрдую смесь хлорида бария и сульфата алюминия общей массой 9,66 г добавили к 100 г воды. При этом в растворе не осталось ни ионов бария, ни сульфат-анионов. К полученному раствору добавили 53 г 10%-ного раствора карбоната натрия. Определите массовую долю карбоната натрия в конечном растворе.
Определите массовую долю карбоната натрия в конечном растворе.
44. (ЕГЭ 2021)Смесь, содержащую алюминий и кремний, растворили в 20%-ном растворе гидроксида натрия. В результате получили 232,5 г раствора, в котором массовая доля щёлочи оказалась в 4 раза меньше, чем в исходном. Выделившийся в результате реакции газ пропустили при нагревании над порошком оксида меди(II) массой 80 г, при этом оба вещества между собой прореагировали полностью. Вычислите массовую долю кремния в исходной смеси.
45. (ЕГЭ 2021) Смесь меди и оксида меди(II) массой 35,2 г может прореагировать с концентрированным 56%-ным раствором серной кислоты или с такой же массой разбавленного 14%-ного раствора серной кислоты. Вычислите массовую долю соли в растворе, полученном после добавления смеси к разбавленному раствору серной кислоты.
46. (ЕГЭ 2021) Смесь, состоящую из нитрата цинка, нитрата меди(II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди(II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди(II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди(II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе.
При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди(II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди(II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди(II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе.
47. (ЕГЭ 2021) Смесь бромида кальция и хлорида меди(II) растворили в воде. Полученный раствор разлили по трем колбам. К 200 г раствора в первой колбе добавили 785 г 30%-ного раствора нитрата серебра. При этом массовая доля нитрата серебра в растворе уменьшилась вдвое. К 340 г раствора во второй колбе добавили избыток раствора иодида калия, в результате чего в осадок выпало 64,94 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
48. (ЕГЭ 2021) Смесь бромида калия и иодида калия растворили в воде. Полученный раствор разлили по трем колбам. К 250 г раствора в первой колбе добавили 430 г 40%-ного раствора нитрата серебра. После завершения реакции массовая доля нитрата серебра в образовавшемся растворе составила 8,44%. К 300 г раствора во второй колбе добавили избыток раствора нитрата меди(II), в результате чего в осадок выпало 28,65 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
Полученный раствор разлили по трем колбам. К 250 г раствора в первой колбе добавили 430 г 40%-ного раствора нитрата серебра. После завершения реакции массовая доля нитрата серебра в образовавшемся растворе составила 8,44%. К 300 г раствора во второй колбе добавили избыток раствора нитрата меди(II), в результате чего в осадок выпало 28,65 г соли. Вычислите массовую долю каждой из солей в третьей колбе.
49. (ЕГЭ 2021) Смесь сульфата железа(II) и хлорида цинка растворили в воде. Полученный раствор разлили по трем колбам. К 800 г раствора в первой колбе добавили избыток раствора нитрата бария. При этом образовалось 116,5 г осадка. К 320 г раствора во второй колбе добавили 462 г 40%-ного раствора гидроксида натрия без доступа воздуха. При этом массовая доля щелочи в растворе уменьшилась в 2 раза. Вычислите массовую долю каждой из солей в растворе в третьей колбе.
50. (ЕГЭ 2021) Смесь хлорида магния и нитрата алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 750 г раствора в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 114,8 г осадка. К 300 г раствора во второй колбе добавили 868,54 г 20%-ного раствора гидроксида натрия. При этом массовая доля щелочи в растворе уменьшилась в 1,6 раза. Вычислите массовую долю каждой из солей в третьей колбе.
К 750 г раствора в первой колбе добавили избыток раствора нитрата серебра. При этом образовалось 114,8 г осадка. К 300 г раствора во второй колбе добавили 868,54 г 20%-ного раствора гидроксида натрия. При этом массовая доля щелочи в растворе уменьшилась в 1,6 раза. Вычислите массовую долю каждой из солей в третьей колбе.
51. (ЕГЭ 2021) Смесь хлорида бария и хлорида алюминия растворили в воде. Полученный раствор разлили по трем колбам. К 300 г раствора в первой колбе добавили 164 г 10%-ного раствора фосфата натрия. При этом все исходные вещества прореагировали полностью. К 120 г раствора во второй колбе добавили 155,61 г 20%-ного раствора сульфата натрия. При этом массовая доля сульфата натрия в полученном растворе оказалась вдвое меньше, чем в исходном. Вычислите массовую долю каждой из солей в третьей колбе. Процессами гидролиза пренебречь.
52. (ЕГЭ 2021) Смесь хлорида бария и гидроксида бария растворили в воде. Полученный раствор разлили по трем колбам. К 520 г раствора в первой колбе добавили избыток раствора серной кислоты. При этом образовалось 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите массовую долю хлорида бария и гидроксида бария в растворе в третьей колбе.
К 520 г раствора в первой колбе добавили избыток раствора серной кислоты. При этом образовалось 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20%-ной соляной кислоты. В результате массовая доля кислоты в растворе уменьшилась вдвое. Вычислите массовую долю хлорида бария и гидроксида бария в растворе в третьей колбе.
53. (ЕГЭ 2021) Смесь, содержащую оксид фосфора(V) и оксид натрия, в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели, а затем растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода составляет 7,36%. Вычислите массу фосфата натрия в полученном растворе.
Понравилось это:
Нравится Загрузка…
Примеры решения задач на смеси и растворы с использованием метода “Стаканчиков” | Методическая разработка по химии:
Опубликовано 02.06.2021 – 21:06 – Куляскина Светлана Юрьевна
Данный материал содержит примеры решения задач по химии и математике на смеси и растворы с использованием метода “Стаканчиков”. В данных примерах показаны образцы составления математических моделей (уравнений с одной неизвестной или системы уравнений с двумя неизвестными) по условию задачи с применением данного метода.
В данных примерах показаны образцы составления математических моделей (уравнений с одной неизвестной или системы уравнений с двумя неизвестными) по условию задачи с применением данного метода.
Скачать:
Предварительный просмотр:
Метод стаканчиков при решении задач на смеси
h3O – раствор с = 0%
Вещество – раствор с = 100%
Кристаллогидрат – раствор с *100 %
ств
Задача №1. Смешали некоторое количество 15%-ого раствора некоторого вещества с таким же количеством 19%-ого раствора этого вещества. Сколько процентов составляет концентрация получившегося раствора?
Задача №2. В сосуд, содержащий 5 литров 12%-ого водного раствора некоторого вещества, добавили 7 литров воды. Сколько процентов составляет концентрация получившегося раствора?
Задача №3. Первый сплав содержит 5% меди, второй 14% меди. Масса второго сплава больше массы первого на 2 кг. Из этих двух сплавов получили третий сплав, содержащий 11% меди. Найдите массу третьего сплава.
Первый сплав содержит 5% меди, второй 14% меди. Масса второго сплава больше массы первого на 2 кг. Из этих двух сплавов получили третий сплав, содержащий 11% меди. Найдите массу третьего сплава.
Задача №4. Какие массы 25%-ого и 5%-ого раствора серной кислоты потребуется для приготовления 40 г 20% -ого раствора этой кислоты смешиванием двух растворов?
Задача №5. Смешав 11%-ый и 72%-ый растворы кислоты и добавив 10 кг чистой воды, получили 31%-ый раствор кислоты. Если бы вместо 10 кг воды добавили 10 кг 50%-ого раствора той же кислоты, то получили бы 51%-ый раствор кислоты. Сколько килограммов 11%-ого раствора использовали для получения смеси?
По теме: методические разработки, презентации и конспекты
Различные способы решение задач на смеси, сплавы, растворы
Задачи на смеси, сплавы, растворы вызывают у учащихся общеобразовательных классов затруднения. Самостоятельно справиться с ними могут немногие. Задачи данного типа, ранее встречающиеся практически тол…
Задачи данного типа, ранее встречающиеся практически тол…
Решение задач по теме “Сплавы, растворы, смеси”
Интегрированный урок по алгебре и химии…
интегрированный урок математика + химия на тему: «Решение задач по теме «Сплавы, растворы, смеси» для учеников 9 класса.
Цели урока:Рассмотреть алгоритм решения задач на сплавы, смеси и растворы: познакомиться с приемами решения задач в математике и химии, развить практические умения решать задачи, расширить знания учащ…
Презентация по теме: Различные способы решение задач на смеси, сплавы, растворы
Часто при решении задач большую роль играет наглядный материал. Таким материалом и является данная презентация….
Решение задач на смеси и растворы с помощью уравнений
Что такое смесь?Какую смесь называют раствором?Что означает понятие «массовая доля вещества в растворе»…
Решение задач на смеси и растворы с помощью уравнений
Что такое смесь?Какую смесь называют раствором?Что означает понятие «массовая доля вещества в растворе». ..
..
Инновационный продукт “Различные способы решения задач на смеси, сплавы, растворы” (Интеграция математики и химии)
Недостаточно лишь понятьзадачу, необходимо желаниерешить ее. Без сильного желаниярешить трудную задачу невозможно, Но при наличии такового – возможно.Где есть желание, найдется путь!Пойя Д…
Поделиться:
Глава 9 – Раздел 6: Проблемы со смесями
%PDF-1.3 % 327 0 объект >/Metadata 324 0 R/OCProperties>/OCGs[368 0 R]>>/OpenAction[329 0 R/XYZ null null null]/Outlines 7 0 R/PageLabels 322 0 R/PageMode/UseNone/Pages 325 0 R/ PieceInfo>>>/StructTreeRoot 328 0 R/Тип/Каталог>> эндообъект 367 0 объект >/Шрифт>>>/Поля 372 0 R>> эндообъект 324 0 объект >поток Acrobat Distiller 5.0 (Windows)2001-10-24T16:09:57Z2013-04-18T09:55:40-05:002013-04-18T09:55:40-05:00Acrobat PDFMaker 5.0 для приложения Word/pdf
Смешанные задачи с решениями
 Проценты также используются для решения этих типов задач.
Проценты также используются для решения этих типов задач.Проблема 1: Сколько литров 20-процентного спиртового раствора надо добавить к 40 литрам 50-процентного спиртового раствора, чтобы получился 30-процентный раствор?
Решение проблемы 1:
Пусть x будет количеством 20%-го раствора спирта, которое нужно добавить к 40 литрам 50%-ного спирта. Пусть у будет количество конечного 30% раствора. Следовательно
Пусть у будет количество конечного 30% раствора. Следовательно
Выразим теперь математически, что количество спирта в x литрах плюс количество спирта в 40 литрах равно количеству спирта в y литрах. Но помните, алкоголь измеряется в процентах.
20% х + 50% * 40 = 30% у
Замените y на x + 40 в последнем уравнении, чтобы получить.
20% х + 50% * 40 = 30% (х + 40)
Преобразование процентов в дроби.
20 х / 100 + 50 * 40 / 100 = 30 х / 100 + 30 * 40 / 100
Умножьте все члены на 100, чтобы упростить.
20 х + 50 * 40 = 30 х + 30 * 40
Найдите x.
х = 80 литров
80 литров 20-процентного спирта добавляют к 40 литрам 50-процентного спиртового раствора, чтобы получить 30-процентный раствор.
Задача 2: Джон хочет приготовить 100 мл 5% спиртового раствора, смешав некоторое количество 2% спиртового раствора с 7% спиртовым раствором. Какое количество каждого из двух растворов (2% и 7%) он должен использовать?
Какое количество каждого из двух растворов (2% и 7%) он должен использовать?
Решение проблемы 2:
Пусть x и y будут количествами 2% и 7% спиртовых растворов, которые нужно использовать для приготовления 100 мл. Следовательно
х + у = 100
Теперь математически запишем, что количество спирта в x мл плюс количество спирта в y мл равно количеству спирта в 100 мл.
2% х + 7% у = 5% 100
2% х + 7% (100 – х) = 5% 100
Умножь на 100 и упрости
2 х + 700 – 7 х = 5 * 100
Найдите х
х = 40 мл
Подставьте x на 40 в первом уравнении, чтобы найти y
у = 100 – х = 60 мл
Задача 3: Стерлинговое серебро состоит из 92,5% чистого серебра. Сколько граммов стерлингового серебра нужно смешать с 90-процентным сплавом серебра, чтобы получить 500 г серебра 9 пробы?1% серебряный сплав?
Сколько граммов стерлингового серебра нужно смешать с 90-процентным сплавом серебра, чтобы получить 500 г серебра 9 пробы?1% серебряный сплав?
Решение проблемы 3:
Пусть x и y будут весами в граммах стерлингового серебра и сплава 90% для получения 500 граммов при 91%. Следовательно
х + у = 500
Количество граммов чистого серебра в x плюс количество граммов чистого серебра в y равно количеству граммов чистого серебра в 500 граммах. Чистое серебро указано в процентах. Следовательно
92,5% х + 90% у = 91% 500
Замените y на 500 – x в последнем уравнении, чтобы записать
92,5% х + 90% (500 – х) = 91% 500
Упрости и реши
92,5 х + 45000 – 90 х = 45500
х = 200 грамм.
Для изготовления сплава 91% требуется 200 граммов стерлингового серебра.
Задача 4: Сколько килограммов чистой воды нужно добавить к 100 килограммам 30-процентного солевого раствора, чтобы получить 10-процентный солевой раствор?
Решение проблемы 4:
Пусть x будет весом в килограммах чистой воды, которую необходимо добавить. Пусть у будет вес в килограммах 10% раствора. Следовательно
Пусть у будет вес в килограммах 10% раствора. Следовательно
х + 100 = у
Теперь выразим тот факт, что количество соли в чистой воде (которая равна 0) плюс количество соли в 30% растворе равно количеству соли в конечном солевом растворе при 10%.
0 + 30% 100 = 10% г
Замените y на x + 100 в последнем уравнении и решите.
30% 100 = 10% (х + 100)
Найдите x.
х = 200 кг.
Задача 5: 50 мл лосьона после бритья на 30% спирте смешивают с 30 мл чистой воды. Каково процентное содержание спирта в новом растворе?
Решение проблемы 5:
Количество конечной смеси определяется выражением
50 мл + 30 мл = 80 мл
Количество спирта равно количеству спирта в чистой воде (которое равно 0) плюс количество спирта в 30% растворе. Пусть x будет процентным содержанием спирта в конечном растворе. Следовательно
Пусть x будет процентным содержанием спирта в конечном растворе. Следовательно
0 + 30% 50 мл = х (80)
Найдите х
х = 0,1817 = 18,75%
Задача 6: Вы добавляете x мл 25% спиртового раствора к 200 мл 10% спиртового раствора, чтобы получить другой раствор. Найдите количество спирта в конечном растворе через х. Найдите отношение количества спирта в конечном растворе к общему количеству раствора через x. Как вы думаете, что произойдет, если x будет очень большим? Найдите х так, чтобы окончательное решение имело процент 15%.
Решение проблемы 6:
Сначала найдем количество спирта в 10% растворе 200 мл.
