как решать с процентным содержанием
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
Источник: thepresentation.ruНа бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле (\(\omega\)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или \(С\) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
\(С=n\div V\)
где \(n\) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
\(C_x=n\div M_{р-ля}\)
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» (\(Т\)).
\(T=M_{в-ва}\div V_{р-ра}\)
5. Под растворимостью (\(S\)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
\(S=(M_{в-ва}\div M_{р-ля})\times100 {}\)
6. Коэффициент растворимости (\(K_s\)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
\(K_s=M_{в-ва}\div M_{р-ля}\)
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
\(M_в=\omega_в\times M_р=0,15×800=120\)г, где \(M_в\) – масса вещества, \(M_р\) – масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. \(M_р=M_в\div\omega_в= 120÷0.2=600\)г
3. Теперь можно найти массу испаренной воды:
\(M{исп\;в}=M_р-M’=800-600=200\)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
\(M’=M_{р-ра}+M_{добh3O}=240\)г
2. Определение массы NaCl в начале процесса:
\(M_{NaCl}=(\omega_{NaCl}\times M_р)\div100\%=15\%\times200г\div100\%=30 {}\)г
В конечном растворе \(M’_ {NaCl}=M_{NaCl}\)
3. Определение массовой доли NaCl в конце процесса:
\(\omega’_{NaCl}=M_{NaCl}\div M’_р\times100\%=12,5\%\)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Какая массовая доля NaCl получилась в конце реакции?
Решение
1. Определение окончательной массы раствора:
\(M’_р=M_р+M_{доб}=200\)г
2. Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти \(M\) – массу в начале процесса.
\(M=(\omega_{NaCl}\times M_р)÷100%=14,4\)г
Тогда \(M’=14,4г+20г=34,4\)г
3. Определение массовой доли NaCl в конечном продукте:
\(\omega’=M’_{NaCl}\div M’_р\times100\%=17,2%\)
Решение задач на смешение растворов
Источник: image.slidesharecdn.comСмешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами \(M\) и \(M_1\). Массовые доли растворенного вещества обозначим соответственно \(ω\) и \(ω_1\).
Решение
1. Определение общей массы растворенного вещества:
\(M_1\omega_1+M_2\omega_2=\omega_3(M_1+M_2)\)
2. Математические действия:
\(M_1(\omega_1-\omega_3)=M_2=(\omega_3-\omega_2)\)
\(M_1\div M_2=(\omega_3-\omega_2)\div(\omega_1-\omega_3)\)
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Задача 1
Какая процентная концентрация раствора \(KNO_3\), если нормальная равна \(0,2\) моль/л. Плотность равна \(1\) г/мл.
Решение:
1. Определение массы раствора объемом \(1000\) мл:
\(M=\rho\times V=1\times1000=1000\)г
2. Составление и решение следующей пропорции:
\(20,0\)г \(KNO_3\) – \(1000\) г раствора
\(Х_г\) – \(100\) г раствора
\(Х=2,02\) г или \(ω=2,02%\)
Задача 2
Нужно приготовить \(300\) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
Источник: him.1sept.ru1. Определение веса одной из 50-ти частей образуемого раствора:
\(300\div5=6\)
2. Определение массы каждой части \(m_1\) и \(m_2\):
\(m_1=6\times15=90\)
\(m_2=6\times35=210\)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Источник: him.1sept.ruРешение
1. Масса одной части первичного раствора равна: \(250\div10=25\)г
2. Определение массы воды, что необходима: \(25\times35=875\)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
\(875+25=1125г\)
2. Для исходного раствора действует пропорция:
Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
1-й раствор | 2-й раствор | 3-й раствор | |
mр. в. в. | |||
mр-ра | |||
ωр.в. |
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | |||
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ωр. в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
в. = 100% ∙ mр.в./mр-ра , mр.в. = mр-ра ∙ ωр.в./100% , mр-ра = 100% ∙ mр.в. /ωр.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ωр.в., зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m(2)р.в. = m(2)р-ра ∙ ω(2)р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
1-й раствор | 2-й раствор | 3-й раствор | |
mр. в. в. | 22,5 г | 20 г | |
mр-ра | 150 г | 100 г | |
ωр.в. | 15% | 20% | искомая величина |
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m(3)р.в. и m(3)р-ра):
m(3)р.в. = m(1)р.в. + m(2)р.в. = 22,5 г + 20 г = 42,5 г
m(3)р-ра = m(1)р-ра + m(2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 22,5 г | 20 г | 42,5 г |
mр-ра | 150 г | 100 г | 250 г |
ωр. в. в. | 15% | 20% | искомая величина |
Вот теперь мы вплотную подобрались к расчету искомой величины ω(3)р.в.. В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω(3)р.в. = 100% ∙ m(3)р.в./m(3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:
mдоб.(H2O) = Vдоб.(H2O) ∙ ρ(H2O) = 50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше.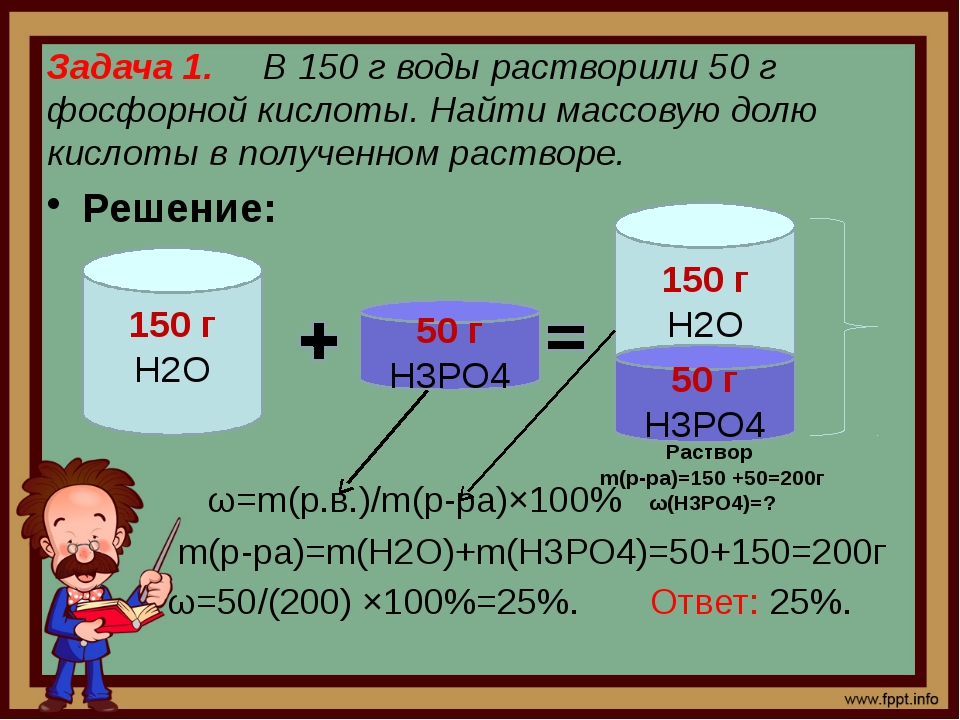 Начертим такую таблицу и вставим известные нам значения в нее:
Начертим такую таблицу и вставим известные нам значения в нее:
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 0 г | ||
mр-ра | 200 г | 50 г | |
ωр.в. | 15% | 0% | искомая величина |
В первом столбце известны два значения, значит можем посчитать третье:
m(1)р.в. = m(1)р-ра ∙ ω(1)р.в./100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m(3)р-ра = m(1)р-ра + m(2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
1-й раствор | 2-й раствор | 3-й раствор | |
mр. в. в. | 30 г | 0 г | |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь стали известны два значения в первой строке, значит можем посчитать значение m(3)р.в. в третьей ячейке:
m(3)р.в. = m(1)р.в. + m(2)р.в. = 30 г + 0 г = 30 г
1-й раствор | 2-й раствор | 3-й раствор | |
mр.в. | 30 г | 0 г | 30 г |
mр-ра | 200 г | 50 г | 250 г |
ωр.в. | 15% | 0% | искомая величина |
Теперь можем рассчитать массовую долю в третьем растворе:
ω(3)р.в. = 30/250 ∙ 100% = 12%.
| 1. |
Масса раствора
Сложность: лёгкое |
1 |
| 2. |
Масса растворённого вещества
Сложность: лёгкое |
1 |
3.
|
Масса растворителя
Сложность: лёгкое |
1 |
| 4. |
Массовая доля вещества в растворе
Сложность: среднее |
2 |
5.
|
Массовая доля (%)
Сложность: среднее |
2 |
| 6. |
Массовая доля вещества в растворе
Сложность: среднее |
2 |
7.
|
Вычисли массу раствора по количеству растворённого вещества
Сложность: сложное |
3 |
| 8. |
Вычисление массы раствора по числу молекул растворённого вещества
Сложность: сложное |
4 |
Интегрированный урок химии по теме «Решение задач по теме «Растворы» | Химия
Интегрированный урок химии по теме «Решение задач по теме «Растворы»
Автор: Битулина Елена Алексеевна
Организация: МАОУ «СОШ №1» г. Нурлат РТ
Нурлат РТ
Населенный пункт: Республика Татарстан, г. Нурлат
Одним из путей развития творчества в процессе обучения в школе являются интегрированные уроки. Именно на таких уроках учащиеся получают глубокие разносторонние знания об объектах изучения, используя информацию из различных предметов, по-новому осмысливают события и явления. Все это стимулирует аналитическую деятельность учащихся, развивает потребность в системном подходе к объекту познания, формирует умения анализировать и сравнивать сложные процессы и явления объективной действительности.
Роль учителя на интегрированном уроке меняется, его главной задачей становится организация такого познавательного процесса, при котором обучающиеся осознают взаимосвязь всех областей знаний, полученных ими на уроках предметов школьного курса, так и в результате кропотливой работы с дополнительными источниками информации
«Вы приглашены на безумно важное событие –
английское чаепитие…».

Льюис Кэрролл, английский писатель
Урок химии в 11 классе.
Тема: Решение задач по теме «Растворы»
Урок разработан на основе программы курса для 11 класса общеобразовательных учреждений, УМК О. С. Габриеляна Химия 11 класс.
На уроке используются разные формы организации учебного процесса, приемы, методы. Использование ИКТ, химический эксперимент.
Тип урока: обобщение и систематизация знаний.
Цели урока: Обобщить и закрепить теоретический материал из курса химии, понятия: растворы, процентное содержание растворенного вещества в растворителе. Закрепить навыки решения расчетных задач по теме растворы из ЕГЭ по химии
Задачи:
Образовательная: Обобщить и закрепить теоретический материал из курса химии, понятия: растворы, концентрация растворов (процентное содержание растворенного вещества в растворителе).
Развивающая: Способствовать развитию познавательного интереса, через реализацию межпредметных связей курсов математики, английского языка, литературы и химии
Воспитательная: способствовать осознанию роли знаний в развитии личности, воспитании характера, преодолении трудностей, адекватной оценке своей деятельности.
Основные понятия. Раствор, растворенное вещество, массовая доля растворенного вещества, конверт Пирсона.
Словарная работа: конверт Пирсона.
Планируемые результаты обучения. Научиться решать задачи по теме «Растворы»
Лабораторный опыт. Приготовление раствора.
Формы организации познавательной деятельности учащихся: самостоятельная, парная и индивидуальная, групповая.
Методы обучения: словесные, наглядные, практические, объяснительно-иллюстративный, репродуктивный метод, проблемное изложение изучаемого материала, частично-поисковый, методы контроля и самоконтроля за эффективностью учебно-познавательной деятельности.
Время реализации занятия: 45 мин.
Средства обучения:
– Химия 11 – учебник для 11 класса общеобразовательных учреждений под редакцией О.С.Габриеляна Химия 11 класс М.: Просвещение, 2016 г.
– Презентация Power Point.
– Карточки с заданием для групповой работы.
– Карточки для самостоятельной работы.
Авторский медиапродукт: наглядная презентация «Five O’ Clock» созданная в редакторе POWER POINT.
Ход урока
- Организационный момент: учащиеся приветствую друг друга и учителя, и садятся в группы по 4-5 человек. (Некоторые учащиеся получили опережающее задание, и участвуют в инсценировке английского чаепития)
- Мотивационная часть. Подготовка к восприятию нового материала.
Английское чаепитие. Часть кабинета у доски стилизована под английский дом, в кресле сидит герцогиня Бедфорд.
Герцогиня Бедфорд «О! Berimor, It’s Five O’ Clock! I believe now is a good time to make some tea… »
Сообщение учащегося о традиции Five O’ Clock
Культура английского чаепития самобытна, неповторима и крайне увлекательна в плане изучения. Каждый поклонник ароматного напитка непременно должен знать ее основы и ключевые аспекты «сугубо английского» чаепития. Чем же англичане выделяются на фоне других и что особенного в их традициях употребления чая?
Сразу хотелось бы акцентировать внимание на том, что англичане по праву считаются нацией, предрасположенной к чаю. По последним официальным исследованиям ежедневно в стране выпивают около 120 миллионов чашек этого замечательного напитка.
Неудивительно, что несколько лет тому назад в терминологии английского языка появилось понятие «a tea—aholic», под которым подразумевают человека, пристрастившегося к чаю.
Сейчас мало кто знает, но было время, когда в Англии местное население не употребляло чай и вовсе. Переломный момент пришелся на 1664 год, когда Карл Второй получил в дар несколько фунтов высушенных листьев чайного дерева от купцов, представлявших Ост-Индскую компанию. С того времени англичане начали высоко ценить необычный аромат, приятное послевкусие и исключительные целебные свойства напитка.
Переломный момент пришелся на 1664 год, когда Карл Второй получил в дар несколько фунтов высушенных листьев чайного дерева от купцов, представлявших Ост-Индскую компанию. С того времени англичане начали высоко ценить необычный аромат, приятное послевкусие и исключительные целебные свойства напитка.
Считается, что ввела традицию пить чай в пять часов Анна Рассел, герцогиня Бедфорд. В XVIII веке обед в Англии стали подавать все позже и позже, и к началу XIX время обеда приходилось на 7-8 часов вечера. Ланч, введенный между завтраком и обедом, представлял собой легкий перекус, поэтому люди испытывали чувство голода в течение дня.
В 1840 году герцогиня начала ставшую популярной традицию чаепития (Five o’clock Tea) в середине дня, на котором подавались легкие закуски. Она стала приглашать к себе гостей, и постепенно эта традиция распространилась среди элиты, а затем и простых англичан.
Так англичане приобрели свою знаменитую традицию пятичасового чаепития, которая стала недорогим способом приятно провести время в компании друзей.
Герцогиня Бедфорд: Я тоже приглашаю вас попить чайку.
Все готовят себе чай из наборов на столах и отпивают из своих чашек.
- Изучение нового материала
Эвристическая беседа по вопросам:
Учитель:
- А что такое чай с точки зрения химии?
- Что такое раствор? Из чего он состоит?
- Какие величины можно рассчитать для растворов?
Сообщение учащегося: Еще Шерлок Холмс в произведениях Артура Конан Дойла, с помощью чашки чая решал запутанейшие задачи.
Однажды мистер Шерлок Холмс и доктор Ватсон после очередного дела пили чай.
Холмс несколько минут, не мигая, глядел на стакан, как бы пытаясь разглядеть нечто, недоступное глазу простого смертного, и вдруг произнес:
– Держу пари, Ватсон, Вы ни за что не догадаетесь, сколько сахару можно насыпать в стакан чая, полный до краёв.
При этом, заметьте, нельзя пролить из стакана ни капли. А как вы думаете – сколько? Попробуйте проверить ваше предположение. Что вы наблюдали?
А как вы думаете – сколько? Попробуйте проверить ваше предположение. Что вы наблюдали?
Что происходит с плотностью чая в стакане? Увеличивается она, уменьшается или остаётся неизменной? Доктор Ватсон попросил Холмса объяснить нелогичное поведение чая.
Мистер Холмс оказался в затруднении, но всё-таки нашел объяснение. Что бы вы ответили доктору Ватсону?
Идет обсуждение в группах
Ответ:
Сахар растворяется и добавляется масса, а объём прибавляется в небольших количествах, которые не приводит к выливанию чая. Добавлять сахар можно до тех пор, пока он не перестанет растворяться. Плотность увеличивается.
Учитель: Давайте и мы рассчитаем массовые доли нашего чая!
Учащиеся решают задачу: Считая, что кусочек сахара рафинада имеет массу около 5,6 гр., А масса воды 200 гр. вычислите массовую долю сахара в вашем чае. (Кусочки сахара все положили по разному)
Озвучивают свои ответы.
Учитель: А где еще мы сталкиваемся с растворами?
Решим проблемы, с которыми сталкиваются хозяйки на кухне.
Учитель предлагает решить задачу с помощью конверта Пирсона. Идет объяснение решение таких задач новым способом, с помощью конверта Пирсона.
Задача № 1 Лимонная кислота содержится не только в лимонах, но также в незрелых яблоках, вишнях, ягодах смородины. Лимонная кислота часто используется в кулинарии и в домашнем хозяйстве (например, для выведения ржавых пятен с ткани). Определите, какая масса 10% и 70% раствора лимонной кислоты потребуется для приготовления 100 г 20% раствора?
Учитель: Знаете ли вы какая самая известная английская игра?
- Физкультминутка «Игра в крокет»
Встали улыбнулись
Вперед слегка нагнулись
Клюшкой воображаемой по мячу ударили
Ура!!! С победой друг друга поздравили!
- Закрепление
Врач пришел: учащийся в халате врача предлагает решить проблему, с которой он столкнулся «Помогите мне пожалуйста из того что имеется приготовить необходимые медикаменты». Он раздает карточки с заданиями.
Он раздает карточки с заданиями.
Учащиеся решают задачи
Вариант 1.
Сколько грамм йода и спирта нужно взять аптекарю, для приготовления 500 г 5% раствора йодной настойки?
Вариант 2.
В аптеке имеются растворы аммиака 5% и 25% . Как из них приготовить 1 кг нашатырного спирта (10% раствор аммиака).
6.Рефлексия.
Беседа по вопросам:
Что нового вы узнали сегодня на уроке?
Что запомнилось?
Что понравилось, а что нет?
Что было неожиданно интересно?
Где возникли затруднения?
- Подведение итогов Учитель совместно с учениками подводит итоги урока. Определяет вопросы для дальнейшей работы по изученной теме
- Домашнее задание
Решить задачи
1. Для полоскания горла используется 2 % раствор соды. Вычислите массу соды и массу воды, которые необходимо взять для приготовления 150 г такого раствора. (2 балла)
(2 балла)
2. Для засолки огурцов применяется 10 % раствор поваренной соли. Вычислите массу соли и объём воды, которые необходимо взять для приготовления 200 г такого раствора. (3 балла)
3. Для приготовления компотов из яблок, груш и т.д. используется 40 % раствор сахара. Вычислите массу сахара и массу воды, которые необходимо взять для приготовления 50 г такого раствора. ( 2 балла)
4. Из 250 г 20%-го раствора хлорида калия выпарили 100 мл воды. Какой стала массовая доля соли в растворе? ( 3 балла)
Список использованной литературы:
- Химия 11 – учебник для 11 класса общеобразовательных учреждений под редакцией О.С.Габриеляна Химия 11 класс М.: Просвещение, 2016 г
- А. М. Радецкий «Химический тренажер» из серии «Текущий контроль»,М.: Просвещение, 2007).
- Драхлер А.Б. Сеть творческих учителей: методическое пособие / А.Б. Драхлер. – М.: БИНОМ. Лаборатория знаний, 2008. – 171 с.: ил. ISBN 978-5-94774-837-6
- Библиотечка “Первого сентября”: Как готовить интегрированные уроки / Москва “Чистые пруды”, 2006
Приложения:
- file0.
 docx.. 29,0 КБ
docx.. 29,0 КБ
Задачи по химии | Подготовка к ЦТ и ЕГЭ по химии
ВНИМАНИЕ: все задания составлены автором самостоятельно и не являются копией заданий ЦТ и РТ. Если вам необходимы оригинальные задания, то вам надо записываться на этапы РТ (на сайте РИКЗ) и покупать сборники реальных заданий ЦТ и РТ в книжных магазинах.
1. Простейшие химические расчёты
2. Расчёты по химическим уравнениям
3. Закон постоянства состава
4. Вывод формул
5. Использование системы уравнений
6. Выход продукта реакции. Примеси. Потери
7. Стехиометрические цепочки
8. Избыток реагирующих веществ
9. Растворы
10. Образование кислых и средних солей
11. Разница масс и объёмов (задачи на пластинку и др.)
12. Электролиз
13. Скорость реакции
14. Равновесие. Тепловой эффект
15. Молярная масса смеси газов
16. Задачи на «атомистику» (соотношение атомов, ионов и др. частиц, массовая доля элемента в смеси и т.п.)
частиц, массовая доля элемента в смеси и т.п.)
17. Задачи и тесты в виде задач из всех этапов ЦТ, РТ и ДРТ
18. Задачи ЕГЭ всех лет
19. Задачи ЦТ, РТ и ДРТ всех лет по темам
20. Задачи без видео-объяснения (с ответами):
Материалы сайта (тесты, задания, задачи, видео) разработаны автором самостоятельно и не являются копией каких-либо других заданий, в том числе заданий, разработанных РИКЗом (Республиканским институтом контроля знаний). При составлении заданий использованы идеи, которые были использованы составителями ЦТ и РТ, что не является нарушением авторского права. Все материалы сайта используются исключительно в образовательных целях.В доказание вышесказанного, привожу выдержки из Закона Республики Беларусь «Об авторском праве и смежных правах»:Статья 7. Произведения, не являющиеся объектами авторского права
Пункт 2. Авторское право не распространяется на собственно идеи, методы, процессы, системы, способы, концепции, принципы, открытия, факты, даже если они выражены, отображены, объяснены или воплощены в произведении.
 Статья 32. Свободное использование объектов авторского права и смежных прав
Статья 32. Свободное использование объектов авторского права и смежных правПункт 2. Допускается воспроизведение отрывков из правомерно обнародованных произведений (цитирование) в оригинале и переводе в исследовательских, образовательных, полемических, критических или информационных целях в том объеме, который оправдан целью цитирования.Статья 36. Свободное использование произведений в образовательных и исследовательских целях
Пункт 2. Статьи и иные малообъемные произведения, правомерно опубликованные в сборниках, а также газетах, журналах и других печатных средствах массовой информации, отрывки из правомерно опубликованных литературных и иных произведений могут быть воспроизведены посредством репродуцирования и иного воспроизведения в образовательных и исследовательских целях.
Как решать 34 задание ЕГЭ по химии, примеры и алгоритмы решения заданий 34 по химии (Ростов-на-Дону)
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.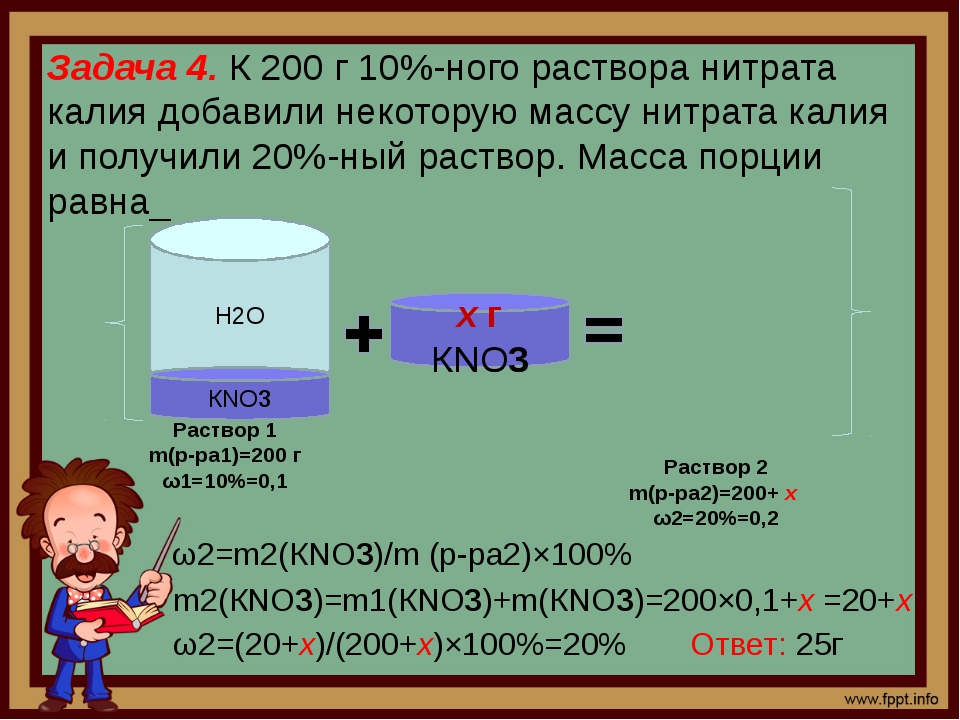
| Дано: | Анализ и решение: |
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».
При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».
Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, h3O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).
Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.
2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:
Пусть прореагировало x моль Cu(NO3)2, тогда
г)
3) По уравнению (1) находим количество прореагировавшего HNO3:
г)
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а)
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а)
в) находим количество вещества HNO3 в отобранной порции:
а)
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).
б) По уравнению (3).
в)
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Дано: | Анализ и решение: |
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова
и понятия и составляем уравнения реакций (химическая часть задачи).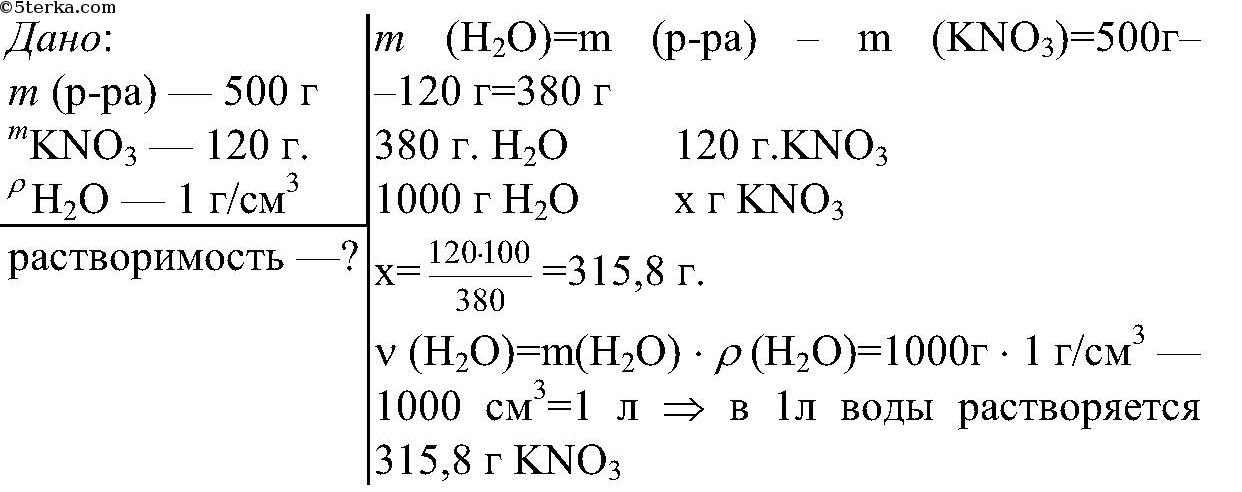
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».
2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»
3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»
4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество Nh5NO3.
Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.
В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество Nh5NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(Nh5NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12h3O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,
б)
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):
в) по уравнению (3):
г)
3) По уравнению (3) находим количество Nh5NO3:
а)
4) По уравнению (3) находим количество образовавшегося Al(OH)3:
5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
6) Находим массовую долю Nh5NO3 в растворе:
а)
б)
ЕГЭ химия, ЕГЭ математика: решение задач на растворы
В ряде заданий ЕГЭ по математике встречаются задачи на смешивание растворов. Эти задания могут вызывать затруднения, поскольку математики склонны считать концентрацию растворов разделом химии. На самом деле, эти задания решаются чисто математическим способом, с помощью линейного уравнения.
Преимущества этого способа для ЕГЭ по химии: легко восстановить в памяти (в отличие от метода креста), решает задачу одним уравнением.
В основе метода лежит определение:
масса компонентамассовая доля = ––––––––––––––––– (1)
масса целого
mв-ва
т. е. ω = ––––––––
m
где ω — массовая доля растворенного вещества,
mв-ва — масса растворенного вещества,
m — масса раствора.
Следовательно, масса растворенного вещества равна произведению массы раствора на массовую долю растворенного вещества:
mв-ва = m • ω (2).
При сливании растворов складываются как массы растворов:
m1 + m2 = m3 (3)
так и массы растворенных веществ:
mв-ва1 + mв-ва2 = mв-ва3
Подставляя вместо массы растворенных веществ произведение (2), получаем:
m1 • ω1 + m2 • ω2 = m3 • ω3
Заменяя неизвестную массу на выражение (3), получаем:
m1 • ω1 + m2 • ω2= (m1 + m2) • ω3 (4), или
m1 • ω1 + (m3 − m1) • ω2 = m3 • ω3 (5)
Пример:
Определите массы 10%-ного и 50%-ного (по массе) растворов, необходимые для получения 200 г 20%-ного раствора.
Решение:
ω1 = 10 %, ω2 = 50 %, ω3 = 20 %, m3 = 200 г, m2 = 200 − m1
Составляем уравнение (5):
m1 • 10 + (200 − m1) • 50 = 200 • 20
40 • m1 = 6000
m1 = 150 (г),
m2 = 200 − m1 = 200 − 150 = 50 (г)
Ответ: 150 г, 50 г.
Пример 2:
Определите массы 25%-ного (по массе) раствора и воды, необходимые для получения 200 г 10%-ного раствора.
Решение:
ω1 = 25 %, ω2 = 0 %, ω3 = 10 %, m3 = 200 г
Составляем уравнение (5):
m1 • 25 + m2 • 0 = 200 • 10
25 • m1 = 2000
m1 = 80 (г),
m2 = 200 − m1 = 200 − 80 = 120 (г)
Ответ: 80 г, 120 г.
Химические решения практических задач | Carolina.com
1. Молярные растворы
а. Опишите, как вы приготовили бы 1 л из 1 M
раствор натрия хлорида. Вес хлорида натрия в граммах формулы составляет 58,44.
г / моль.
Вес хлорида натрия в граммах формулы составляет 58,44.
г / моль.
Ответ: Сделать 1 М раствор натрия хлорида, растворите 58,44 г хлорида натрия в 500 мл воды в 1000 мл мерная колба. Когда все твердое вещество растворено и раствор находится при комнатной температуре. температуры, доведите до отметки и несколько раз переверните колбу для перемешивания.
г. Опишите, как вы приготовили бы 1 л из 2 млн раствор уксусной кислоты. Граммовая формула веса уксусной кислоты составляет 60,05 г / моль, плотность 1.049 г / мл.
Ответ: Чтобы приготовить 2 М раствор уксусной кислоты,
растворите 120,1 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в емкости объемом 1000 мл.
мерная колба. Поскольку уксусная кислота является жидкостью, ее также можно измерить
объем. Разделите массу кислоты на ее плотность (1,049 г / мл), чтобы определить
объем (114 мл).Для приготовления раствора используйте 120,1 г или 114 мл уксусной кислоты.
Осторожно покрутите колбу, чтобы перемешать раствор. Как только раствор будет в комнате
температуры, доведите до отметки и несколько раз переверните колбу для перемешивания.
Как только раствор будет в комнате
температуры, доведите до отметки и несколько раз переверните колбу для перемешивания.
2. Процентные решения
а. Опишите, как бы вы приготовили 100 г 0,5% раствора. фенолфталеин по массе.
Ответ: Поскольку растворенное вещество (фенолфталеин) является твердое вещество, раствор в процентах по массе. Массовый процент означает количество граммов растворенного вещества на 100 г раствора.
массовый процент = (масса растворенного вещества / масса раствора) × 100%
масса растворенного вещества = массовый процент × масса раствора / 100%
= 0,5% x 100 г / 100%
= 0,5 г
Так как общая масса раствора равна 100 г, оставшиеся 99,5 г раствор – вода. Для приготовления раствора растворите 0,5 г фенолфталеина. в 99,5 г дистиллированной или деионизированной воды.
г. Опишите, как вы приготовили бы 100 мл раствор, содержащий 22% уксусную кислоту по объему.
Ответ: Объемный процент означает количество
миллилитров растворенного вещества на 100 мл раствора. Разбавьте 22 мл уксусной кислоты
дистиллированная или деионизированная вода для приготовления 100 мл раствора.
Разбавьте 22 мл уксусной кислоты
дистиллированная или деионизированная вода для приготовления 100 мл раствора.
3. Разведения
а. Опишите, как приготовить 1,0 л 0,10 М раствора серной кислоты. кислота из 3,0 М раствора серной кислоты.
Ответ: Рассчитайте объем 3,0 М серной кислота, необходимая для приготовления разведения.
M реагент × V реагент = M разбавление × V разбавление
3.0 M × V реактив = 0,10 M × 1,0 л
V реактив = 0,033 л = 33 мл
Медленно добавьте 33 мл 3,0 М серной кислоты в мерную колбу на 1000 мл. наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать Один раз раствор комнатной температуры, разбавить водой до метки и перевернуть колбу несколько раз перемешать.
б. Опишите, как бы вы приготовили 500 мл
0,25 М раствор гидроксида натрия из 5. 0 М раствор гидроксида натрия.
0 М раствор гидроксида натрия.
Ответ: Рассчитать объем 5,0 М гидроксида натрия, необходимого для приготовления разведения.
M реагент × V реагент = M разбавление × V разбавление
5,0 M × V реактив = 0,25 M × 0,500 л
V реагент = 0.025 л = 25 мл
Медленно добавьте 25 мл 5,0 М гидроксида натрия в мерную колбу на 500 мл. наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать Один раз раствор комнатной температуры, разбавить водой до метки и перевернуть колбу несколько раз перемешать.
4. Особые случаи
а. Опишите, как приготовить 500 мл 1,0 М раствора калия. хлорид с чистотой 93,0%. Вес хлорида калия в граммах формулы 74.56 г / моль.
Ответ: Рассчитайте массу нечистого хлорида калия. нужный.
масса нечистого хлорида калия = M чистый × V чистый × грамм формулы вес / процент чистота
= 1,0 M × 0,500 L × 74,56 г / моль
0,930= 40 г
Медленно добавьте 40 г 93% хлорида калия в мерную емкость объемом 500 мл. колбу наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать.Когда все твердое вещество растворится и раствор достигнет комнатной температуры, разбавьте до отметки и несколько раз переверните колбу для перемешивания.
г. Опишите, как бы вы готовились 500 мл 1,0 М раствора фосфорной кислоты из 85,0% фосфорной кислоты, т.е. чистый. Вес фосфорной кислоты по формуле в граммах составляет 98,00 г / моль, а плотность 85,0% фосфорной кислоты составляет 1,685 г / мл.
Ответ: Рассчитать объем 85.Требуется 0% фосфорная кислота.
объем нечистой фосфорной кислоты = M чистый × V чистый × грамм формулы вес / (проценты чистота x плотность) = (1,0 M × 0,500 L x 98,00 г / моль) ÷ 1,685 г / мл
0,850= 34 мл
Медленно добавьте 34 мл 85,0% фосфорной кислоты в мерную емкость 500 мл. колбу наполовину заполните дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать. Как только раствор достигнет комнатной температуры, разбавьте водой до отметки и переверните колбу несколько раз, чтобы перемешать.
5. Нормальные решения
Опишите, как приготовить 1000 мл 1,0 н. Раствора магния. гидроксид. Граммовая формула веса гидроксида магния составляет 58,33 г / моль.
Ответ: Гидроксид магния. содержит две гидроксильные группы. Половина моля гидроксида магния, следовательно, принимает один моль протонов. Чтобы приготовить 1,0 н раствор гидроксида магния, медленно добавьте 29 г гидроксида магния в 500-миллилитровую мерную колбу, заполненную наполовину. с дистиллированной или деионизированной водой и встряхните колбу, чтобы перемешать.Когда все твердое вещество растворяется и раствор при комнатной температуре доводится до метки. и несколько раз переверните колбу для перемешивания.
Глава 7 – Растворы – Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Резюме 7.11 Ссылки7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого. Решения повсюду вокруг нас. Например, воздух – это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем не является чистым H 2 O, но, скорее всего, является решением. Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения – большая часть повседневной жизни.Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, которая происходит в нашем собственном организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите следующие термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.
Главный компонент раствора называется растворителем , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом.Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле – все это решения. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, представленных в стехиометрии в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 Типы решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ.Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются так тесно, что их можно рассматривать как единое вещество, хотя это не так. С другой стороны, гетерогенные смеси неоднородны и имеют участки смеси, которые отличаются от других участков смеси. Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид – это смесь, содержащая частицы диаметром от 2 до 500 нм.Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но являются мутными или непрозрачными. Молоко – хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы .Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами .Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы будем обсуждать, происходит в жидких растворах, в которых вода является растворителем.
- Многие сплавы, керамика и полимерные смеси – это твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью. Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду.Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы – это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна полезная классификация материалов – полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Диаграмма выше является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип и полярность связи. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , неполярные соединения , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 более высокая разность электроотрицательностей полярных соединений .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Подобно Растворяется Нравится.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и показан на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода – это высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели на (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия – пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl – . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией – растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют сходных характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г – 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация – распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми на , чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4. Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», – нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 – (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 – (водн.) → CO 2 2- (водн.) + H 2 O (л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента котловой накипи.
Рис. 7.5 Весы котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах горячего водоснабжения могут значительно снизить пропускную способность труб. Эти отложения, называемые котловыми отложениями, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать на поверхности более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. Для этой популяции оптимальная температура воды составляет от 12,8 до 17,8 ° ° C (55-65 ° ° F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других питателей, что затем уменьшило светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C – концентрация растворенного газа в состоянии равновесия, P – парциальное давление газа, а k – постоянная закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих сферах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 – соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 – концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. На этом этапе будет проще всего изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия: C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водный) и Cl – (водный), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.При открытии бутылки давление CO 2 над раствором быстро падает, и часть растворенного газа выходит из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой во внутренних жидкостях дайвера растворяется больше N 2 из воздуха. Если дайвер всплывает слишком быстро, резкое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низкие для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационной воды или гидратной воды .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n – количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi – 1/2
- моно – 1
- Sesqui – 1½
- Di – 2
- Три – 3
- Тетра – 4
- Пента – 5
- Hexa – 6
- Hepta – 7
- Окта – 8
- Нона – 9
- Дека – 10
- Undeca – 11
- Додека – 12
Гидрат, потерявший воду, называется ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества гигроскопичны, и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое – разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность (M) раствора – это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не М. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Перепишите приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на желаемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде родинок
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в обоих (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (m / m), тогда как в клинической химии обычно используется (m / v) с массой , выраженной в граммах, и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » – это префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, Centum или столетие . Он также обозначает 1/100 (от L. centesimus ) как сантиметр и денежная единица цент . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженное на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл – 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 частей на миллион) и части на миллиард (10 9 ; частей на миллиард). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации ионных растворенных веществ иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равен 1 экв. / Л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) – например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении эквивалент – это количество вещества, необходимое для выполнения одного из следующих действий:
- реагирует или поставляет один моль ионов водорода (H + ) в кислотно-основной реакции
- реагирует или поставляет один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент – это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества.Помните, что разбавление данного количества исходного раствора растворителем не приводит к изменению , а не количества присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора может быть математически выражено как:
где M s – концентрация основного раствора, V s – объем основного раствора, M d – концентрация разбавленного раствора, а V d – объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один ион Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, получается 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + . (Молекулы воды для ясности не показаны с молекулярной точки зрения.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 образует трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 может быть затем рассчитано путем деления 1,43 M на 4,29 M, что дает 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M In (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия – это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH – , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH – ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты – это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекулы CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия – это ионное соединение, которое содержит ионы In 3+ и ионы NO 3 –, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 –, поэтому 0,032 M In (NO 3 ) 3 Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 – , то есть [In 3+ ] = 0,032 M и [NO 3 – ] = 0,096 M
(Вернуться к началу)7.10 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой однородную смесь. Основным компонентом является растворитель , а второстепенным компонентом – растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор. Растворенные вещества растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся и несмешиваемый вместо растворимых и нерастворимых используются для жидких растворенных веществ и растворителей.Утверждение « подобно растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит за счет сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора. Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество.Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества.Таких решений насыщенных . Растворы с количеством меньше максимального – ненасыщенный . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- Канал 3 Канал 2 Канал 2 Канал
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора – моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 – слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF – слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 – это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего напоминающие химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl –), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl –) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 Мбайн 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Родинки Концентрация (млн) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием основного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] – эффективное дезинфицирующее средство для одежды и постельного белья. Если в растворе концентрация Ca (OCl) 2 равна 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1.08 M, h4PO4 = 0.816 M, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
Список литературы
- Chung (Peter) Chieh (2016) Неорганическая химия. Либретекстов . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д. У., Хилл, Дж. У.и Скотт Р.Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл Б.А., Элдридж П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
Деятельность – Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Введение
- Неидеальность в газах (летучесть)
- Неидеальность в растворах
- pH
- Ссылки
- Проблемы
- Растворы
Активность – это мера эффективной концентрации виды под неидеальным (напр.г., концентрированный) условиях. Это определяет реальный химический потенциал реального раствора, а не идеального.
Введение
Активности и концентрации могут использоваться для расчета констант равновесия и скоростей реакций. Однако в большинстве случаев мы используем концентрацию, хотя активность также является мерой состава, подобно концентрации. Удовлетворительно использовать концентрацию для разбавленных растворов, но когда вы имеете дело с более концентрированными растворами, разница между наблюдаемой концентрацией и расчетной концентрацией в равновесии увеличивается.{\ frac {\ mu – \ mu_o} {RT}} \ tag {1} \]
где
- \ (a \) = Действие
- \ (\ mu \) – химический потенциал (зависит от стандартного состояния), который представляет собой энергию Гиббса на моль
- \ (\ mu_0 \) – стандартный химический потенциал
- \ (R \) – газовая постоянная
- \ (T \) – абсолютная температура
Неидеальность в газах (летучесть)
Летучесть – это эффективное давление для неидеального газа. Давления идеального газа и реального газа эквивалентны, когда химический потенциал одинаков.Уравнение, связывающее неидеальное давление с идеальным газом:
\ [f = \ phi P \ tag {2} \]
с
- \ (f \) представляет летучесть,
- \ (P \) – давление идеального газа, а
- \ (\ phi \) – коэффициент летучести. +] \), но это уравнение не является точным при всех концентрациях.+] \) из-за использования закона Бера, который использует концентрацию, а не активность. 1
Проблемы
- Какова цель использования активности, а не концентрации?
- Если отношение летучести к давлению идеального газа равно 1, то каков коэффициент активности?
- Если pH не = -log [H +], то почему расчеты показывают правильную кислотность?
- Если концентрация не точна, означает ли это, что вместо этого мы должны начать использовать только активность?
Решения
- Активность более точна в более концентрированных растворах
- Коэффициент равен единице, потому что газ находится в состоянии, аналогичном идеальному газу.
- Применение закона Бера, который использует также концентрацию, а не активность, дает, казалось бы, правильные результаты.
- Активность требуется только для высококонцентрированных растворов.
AP Заметки Ответы на задачи 9 БЛОКОВ
AP ПРИМЕЧАНИЯ ОТВЕТЫ НА ЗАДАЧИ 9 БЛОКОВ
UNIT 00 – AP Chemistry Preamble
0,1
1. (а) 2,45 x 10 4
(б) 3.56 х 10 2
(в) 9,85 x 10 -4
(г) 2,22 x 10 -1
(д) 1,22 x 10 4
2. (а) 4200
(б) 0,000215
(в) 0,00000314
(г)0
e) 957
0,2
1. (а) 0,0186
(б) 0,852
(в) 331407.68
(г) 74,97
(д) 15.4195
2. (a) 3 мили = 4828,03 м
(б) 25 фунтов = 11.3398 кг
0,3
1. (а) -260
(б) 1663
2. При определении изменения один градус Цельсия равен (эквивалентен) одному Кельвину.
0,4
1. (а) 4
(б) 2
(в) 4
(г) 2
(д) 2
(ж) 4
2. (а) 809
(б) 40
(в) 92.9
(г) 67,64
(д) 12,7
(ж) 3
0.5
1. (а) Да
(б) Y
0,6
1. (а) p = 82, e = 82, n = 128
(б) p = 16, e = 16, n = 18
2. (а) 20
(б) 10
0,7
1. (а) Хлорид натрия
(б) Оксид стронция
(c) Нитрид алюминия
(г) Хлорид бария
(e) Оксид калия
(е) Оксид меди (II)
(г) Оксид меди (I)
2.(а) Mg 3 N 2
(б) BaBr 2
(в) AlP
(г) КИ
(д) LiCl
(ж) NaF
(г) SnBr 4
0,8
1. (а) NH 4 NO 3
(б) CuBr 2
(в) CuBr
(г) Zn (HSO 4 ) 2
(e) Al 2 (SO 4 ) 3
(е) NaClO 4
(г) Cu (IO 2 ) 2
2.(а) Нитрат натрия
(б) Манганат калия (VII) (перманганат калия)
(c) Этандиоат кальция (оксалат кальция)
(г) Сульфат меди (II)
(e) Сульфат меди (I)
(е) Нитрит калия
(г) Перхлорат лития
0,9
1. (а) N 2 O 4
(б) PCl 5
(c) IF 3
(г) НЕТ 2
(д) H 2 O
2.(а) Пятиокись азота
(б) Треххлористый фосфор
(c) Гексафторид серы
(г) Вода (монооксид дигидрогена)
(e) Окись дихлора
БЛОК 01 – Атомы, элементы и периодичность
1,1
1. (а) FeO
(б) Fe 2 O 3
(в) Fe 3 O 4
2. CH, CH 2 , CH 3 O, C 3 H 6 O 2 – все не может быть далее упрощено.
3. Это не один и тот же образец, не все могут быть чистыми.
1,2
1. CH
2. C 6 H 6
3. Да, НО также согласуется с примесью, в которой любое количество C меньше 92,31, так как% C снизился.
1,3
1. 58,5 г
2. 3,5 моль
3. 0,00234 моль
4. 0,523 моль
5. Ответы здесь – количество родинок, умноженное на число Авогадро (6.02 x 10 23 ), помня, что, например, NaCl содержит ионы Na + и ионы Cl – и что CuBr 2 содержит вдвое больше ионов Br –, чем ионы Cu 2+ , пр.
1,4
1. (a) Нет, разные элементы
(b) Да, один и тот же элемент с разным числом нейтронов, следовательно, с разными массами.
1,5
1. 20.18
2. 85,58
3. 69.76
1,6
1. 35,5; Класс 37 = 25%, Класс 35 = 75%
2. 5 вершин. Два одинаковой высоты на 79 и 81, и три при значениях m / z 158, 160 и 162, при этом пик 160 в два раза больше, чем у 158 и 162, которые были бы идентичными. Представьте, что двухатомная молекула брома состоит из атома Br «x» и атома Br «y».
Комбо а. x = 79 и y = 79, при сложении = 158
Комбо б. x = 81 и y = 79, при сложении = 160
Комбо c.x = 79 и y = 81, при сложении = 160
Комбо d. x = 81 и y = 81, при сложении = 162
160 в два раза вероятнее, чем 158 и 162, поэтому его вершина в два раза больше высоты.
3. 47.92
4. (a) Что существует три изотопа Mg
(b) (i) То, что это изотоп с наибольшим распространением
(ii) 24,3
1,7
1,8
1. (a) [Ar] 4s 1 3d 10
(б) [Ar] 4s 2 3d 7
(c) [Ar] 4s 2
(d) [He] 2s 2 2p 2
(e) [Ne] 3s 2 3p 6
(f) [Ar] 4s 2 3d 10 4p 1
2.(a) [He] 2s 2 2p 6 OR [Ne]
(b) [Ne] 3s 2 3p 6 OR [Ar] OR [Ar] 4s 0
(c) [Ne] 3s 2 3p 6 OR [Ar]
(d) [He] 2s 2 2p 6 OR [Ne]
(e) [He] 2s 2 2p 6 OR [Ne]
1,9
1,10
1. (a) Есть 4 занятых суб-оболочки
(b) 1s 2 2s 2 2p 6 3s 1 в порядке убывания пиковой энергии (т.е.е., 1s 2 электронов удалить труднее всего)
(в) 2п 6
2. (a) Три
(б) 1с 2
(в) 2п 6
3. Алюминий. Это первый элемент, у которого есть электроны в подоболочке 3p. Подоболочка 3p – пятая подоболочка, подлежащая заполнению
1,11
1. (а) Уменьшается. Большая защита перевешивает большее количество протонов
(b) Увеличивается. Такая же защита, больше протонов2.(а) Группа 1
(б) Группа 2
(в) В ней всего три электрона3. Энергия, необходимая для удаления одного моля электронов из одного моля газообразных атомов с образованием одного моля однозарядных ионов
Число протонов и степень защиты (расстояние от ядра).
4. (a) RO
(b) Меньшее взаимное отталкивание электронов, но такое же количество протонов5. Увеличивает. Такая же защита, больше протонов
6. Нулевое экранирование, электроны непосредственно прилегают к ядру
1.12
Изоэлектроник, НО разное количество протонов. Наибольшее количество протонов = наибольшее притяжение = наименьшее количество
УЗЕЛ 02 – Химическое соединение I
2,1
1.
Na + , Cl – ; NaCl
Ca 2+ , Cl – ; CaCl 2
Fe 3+ , Br – ; FeBr 3
Na + , O 2-; Na 2 O
2.
NaCl. Меньший радиус иона хлорида по сравнению с ионом бромида позволяет ионам в NaCl приближаться друг к другу, чем в NaBr, и поэтому кулоновское притяжение больше.
2,2
2,3
ПОЗ. 03 – Химическая связь II и газы
3,1
1. (a) LDF примерно одинаковы.
(b) Бутан-1-ол имеет дополнительную водородную связь в качестве IMF, что резко увеличивает притяжение между молекулами спирта, тем самым значительно повышая температуру кипения по сравнению с пентаном
2.Обе молекулы имеют LDF, но HCl также имеет диполь-дипольные взаимодействия
Несмотря на то, что диполь-дипольные взаимодействия обычно сильнее, чем у LDF, в случаях, когда молекулы большие (большая площадь поверхности и больше электронов), коллективные взаимодействия, создаваемые многими LDF, могут перевешивать более сильные диполь-дипольные взаимодействия, создавая большее притяжение между молекулы. В этом случае более крупные молекулы Cl 2 имеют LDF, которые в совокупности сильнее, чем LDF и диполь-дипольные взаимодействия в гораздо меньших, HCl
3.Повышение температуры кипения, поскольку LDF увеличивается с увеличением площади поверхности, количества электронов и поляризуемости.
3,2
A: Ионный – плохой проводник в твердом состоянии, потому что ионы не могут двигаться. Высокое т.пл. означает сильные ионные связи. Будет проводить в жидком состоянии, когда ионы могут свободно перемещаться.
B: Металлик – высокое т.пл., всегда хороший проводник со свободно движущимися электронами.
C: Молекулярный – никогда не бывает хорошим проводником (нет заряженных частиц, действующих как носители заряда.Низкая т.пл. из-за слабости МВФ.
3,3
1. 0,864 атм
2. 1.09 атм
3,4
1. 0,272 л
2. 422 мл
3,5
1. 10,4 л
2. 288 К
3,6
1. 8,21 л
2. 37,4 л
3,7
1,318 К
2. 247 К
3,8
1. 0,435 моль
2.266,4 г моль -1
3,9
1. 0,0255 моль
2. 717,6 кПа
Примените P1V1 = P2V2, закон Бойлса для КАЖДОГО газа, затем добавьте новые P (Далтона).
3,10
1. (а) 1363 мс -1
(б) 482 мс -1
(в) 183 мс -1
2. (а) 1419 мс -1
(б) 502 мс -1
(в) 191 мс -1
3.u rms ниже при более низких температурах и ниже при больших молярных массах
3,11
1. 0,192 л (192 мл)
2. 0,192 л (192 мл)
3. 1,75 л
4. Добавьте прибл. 250 мл дистиллированной / деионизированной воды в мерную колбу на 500 мл. Медленно и осторожно с помощью бюретки добавьте 192 мл азотной кислоты. Долить до отметки дистиллированной / деионизированной водой. Всегда носите защитные очки, химически стойкие перчатки, лабораторный халат или фартук и добавляйте только небольшое количество концентрированной кислоты в большие объемы воды.Разбавление концентрированной кислоты может быть очень экзотермическим процессом, поэтому безопасное разбавление очень важно. Использование стеклянной посуды с точной градуировкой, такой как бюретки, пипетки и мерные колбы, обеспечивает точность разведения
УЗЕЛ 04 – Химические реакции
4,1
1. (а) H 2 + CuO → Cu + H 2 O
(б) 2C + O 2 → 2CO
(в) Mg + H 2 SO 4 → MgSO 4 + H 2
2.(а) Ca + 2H 2 O → H 2 + Ca (OH) 2
(б) 2Cu + O 2 → 2CuO
(в) 4Na + O 2 → 2Na 2 O
(г) Fe + 2HCl → FeCl 2 + H 2
(д) 2Fe + 3Br 2 → 2FeBr 3
(ж) C 4 H 8 + 6O 2 → 4CO 2 + 4H 2 O
(г) Na 2 CO 3 + 2HI → 2NaI + CO 2 + H 2 O
(ч) CuCO 3 → CuO + CO 2
(i) 2Pb (NO 3 ) 2 → 2PbO + 4NO 2 + O 2
(к) H 2 SO 4 + 2KOH → K 2 SO 4 + 2H 2 O
(к) 2NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
(л) 4Al + 3O 2 → 2Al 2 O 3
4.2
1. (a) Образование пара (реакция является достаточно экзотермической, чтобы вырабатывать достаточно энергии для преобразования образовавшейся воды в газ)
(б) 2H 2 + O 2 → 2H 2 O
(c) Реагенты и продукты присутствуют в правильных соотношениях (т. Е. Уравнение сбалансировано в соответствии с ответом, данным в (b). Кислород, водород и вода все последовательно представлены черными и белыми кружками (т.е. соотношение атомов в каждом случае соответствуют известным формулам веществ)
4.3
1. Когда вода закипает, процесс можно резюмировать как: H 2 O (л) → H 2 O (г) . Таким образом, новые вещества не образуются, есть только изменение состояния, и нарушаются только межмолекулярных сил
2. Когда вода распадается на элементы, процесс можно описать уравнением: 2H 2 O → 2H 2 + O 2 . Таким образом, образуются новые вещества и разрываются внутренние (ковалентные) связи
4.4
1. (а) 3,24 г
(б) 76,5 г
2. (а) 1: 1
Х + Br 2 → XBr 2
(b) Кальций (молярная масса 40 гмоль -1 ), который соответствует тому, что он является элементом группы 2, образует ион 2+ и реагирует в соотношении в уравнении в (a)
3. 34,98 г
4. 1Cu 2+ : 2I –
5. 0.142 M
6. 0,981 г
7. 0,05 л или 50 мл
4.5
1. 27,7 г
2. 1,12 л
3. 83,7 гмоль -1
4,6
Хлор ограничен.
1,42 моль продукта (SCl 6 ), что равно 348 г
Осталось 157 г избыточного реагента (S)
4,7
88,9%
4,8
С 5 В 6 О 3
4,9
1. х = 6
2.Нагревание до тех пор, пока масса не перестанет изменяться, т. Е. Нагревание до тех пор, пока вся вода не будет удалена и соль полностью не обезвожена (безводна)
4,10
1.14 M
4,11
2KOH (водн.) + H 2 SO 4 (водн.) → K 2 SO 4 (водн.) + 2H 2 O (л)
2K + (водн.) + 2OH – (водн.) + 2H + (водн.) + SO 4 2- (водн.) → 2K + (водн.) + SO 4 2- (водн.) + 2H 2 O (л)
2H + (водн.) + 2OH – (водн.) → 2H 2 O (л)4.12
1. (а) +6
(б) -0,5
(в) -3
(д) +2
(д) +3
2. (а) Ca + S → CaS
Ca → Ca 2+ + 2e –
S + 2e – → S 2-
(б) 2Al + 3Br 2 → 2AlBr 3
Al → Al 3+ + 3e –
Br 2 + 2e – → 2Br –
(в) 4Al + 3O 2 → 2Al 2 O 3
Al → Al 3+ + 3e –
O 2 + 4e – → 2O 2-
3.(а) IO 3 – + 5e – + 6H + → ½I 2 + 3H 2 O
5I – → 2½I 2 + 5e –
IO 3 – + 6H + + 5I – → 3H 2 O + 3I 2
(б) I 2 + 2e – → 2I –
2S 2 O 3 2- → S 4 O 6 2- + 2e –
2S 2 O 3 2- + I 2 → S 4 O 6 2- + 2I –
(в) Br 2 + 2e – → 2Br –
2I – → I 2 + 2e –
Br 2 + 2KI → I 2 + 2KBr
(г) 2MnO 4 2- → 2MnO 4 – + 2e –
MnO 4 2- + 2e – + 4H + → MnO 2 + 2H 2 O
3MnO 4 2- + 4H + → 2MnO 4 – + MnO 2 + 2H 2 O
(e) НЕ РЕДОКС (все степени окисления одинаковы), поэтому половинных реакций не требуется
2CrO 4 2- + 2H + → Cr 2 O 7 2- + H 2 O
4.13
1. (а) MgO
(б) Он идет вверх, добавляется боковой кислород.
2. (а) Разложение.
(б) CaCO 3 → CaO + CO 2
(в) Масса CaCO 3 = 30,46 – 24,56 = 5,90 г
Масса CO 2 = 30,46 – 27,86 = 2,6 г
Моль CaCO 3 = 5,90 / 100 = 0,0590
Моль CO 2 = 2,6 / 44 = 0,059
, то есть соотношение 1: 1, которое согласуется с уравнением
4.14
0,0754 М
4,15
х = 12
Метод
1. Вычислите моль манганата (VII), умножив концентрацию на объем.
2. Осознайте (и ЭТО действительно квантовый скачок разума), что в этой огромной двойной соли окисляется Fe 2+ , поэтому недостающая половина реакции – Fe 2+ → Fe 3+ + e – .
3. Объедините половину реакции в пункте 2. выше с полуреакцией манганата (VII), чтобы получить реакционное отношение (5Fe 2+ : 1MnO 4 – ) и, таким образом, получить моль Fe 2+. в образце 25,0 мл из ответа на вопрос 1. выше.
4. Умножьте ответ в пункте 3. выше на 10, чтобы получить моль Fe 2+ в образце 250 мл, и поймите, что моль Fe 2+ также равняется молям ВСЕЙ соли (поскольку в 1 моль всей соли на 1 моль Fe 2+ , т.е.е. это соотношение 1: 1).
5. Рассчитайте молярную массу всей соли, разделив граммы (указанные в Q) на моли, рассчитанные в пункте 4. выше.
6. Вычтите все известные нам молярные массы кусков соли (N, H, Fe, S, O), чтобы получить массу H 2 O.
7. Ответ на 6. выше должен хорошо делиться на 18, т. Е. Должен давать вам целочисленное значение для x.
4,16
(а) Mg 2+ (водн.) + 2OH – (водн.) → Mg (OH) 2 (с)
(б) Ba 2+ (водн.) + S 2- (водн.) + Ni 2+ (водн.) + SO 4 2- (водн.) → NiS (с) + BaSO 4 (с)
(c) Нет реакции
(г) Al 3+ (водн.) + 3OH – (водн.) → Al (OH) 3 (с)
4.17
(а) AgCl
(б) 0,002 моль
(в) 0,002 моль
(г) 0,0709 г
(д) 39%
(f) Масса осадка будет слишком большой, из-за чего моли AgCl будут слишком большими, моли хлорида будут слишком большими, масса хлорида будет слишком большой, а рассчитанные% по массе будут слишком большими.
ПОЗ. 05 – Химическая кинетика
5,1
(a) Они оба являются катализаторами, поскольку оба увеличивают скорость реакции, и в конце эксперимента они регенерируются, т.е.е., без изменений
(b) В каждом случае регенерируются H 3 O + и OH –
5,2
1. Общая масса чипов в эксперименте была одинаковой, так как общий объем газа, производимого в каждом эксперименте, был одинаковым. (Кислоты было в избытке)
2. Эксперимент с маленьким чипом длился от 120 до 135 секунд. Эксперимент с большим чипом длился от 150 до 165 секунд. Реакция завершается, когда больше не производится газа, что показано на графике, когда линия
находится на плато.3.мл / с (подойдут многие другие варианты ответа)
4. 2HCl (водн.) + CaCO 3 (т.) → CO 2 (г) + H 2 O (л) + CaCl 2 (вод.)
5. Когда присутствуют твердые частицы, одним из факторов, влияющих на скорость химической реакции, является площадь поверхности твердого тела. Реакция между раствором и твердым телом происходит на поверхности твердого тела, поэтому большая площадь поверхности дает больше мест для столкновения и, следовательно, более быструю реакцию.Маленькие стружки имеют большую площадь поверхности, чем такая же масса более крупных стружек, поэтому реакция происходит быстрее с твердым телом меньшего размера
.6. Измерьте стружку на весах, используйте мерный цилиндр для измерения объема кислоты, а затем с помощью газового шприца соберите углекислый газ от реакции, происходящей в колбе Эрленмейера. См. Это для примера настройки
7. Нагрейте кислотный раствор до различных температур ИЛИ измените концентрацию кислоты до различных концентраций, каждый раз, сохраняя все остальные переменные одинаковыми
5.3
V 2 O 4 – промежуточное звено, V 2 O 5 – катализатор
5,4
1. Коэффициент = k [X] 2
Сумма заказа [Y] = 0
Общий заказ = 2 + 0 = 2
k = 40000 M -1 мин -1
2. Коэффициент = k [A] [B]
Общий заказ = 1 + 1 = 2
k = 8000 M -1 с -1
5,5
1.
2. Механизм № 2
3. X – промежуточный
5,6
1. 1-й заказ. График зависимости ln [A] от времени представляет собой прямую линию, соответствующую интегрированному закону скорости для реакций первого порядка
2. 7 минут (приблизительно с момента «из графика»)
3. 1.01 x 10 -1 мин -1
Примечание. Это значение было рассчитано путем взятия данных за полный временной диапазон 25 минут. Другие, очень похожие (но разные) значения могут быть рассчитаны с использованием меньших временных диапазонов
УЗЕЛ 06 – Химическая термодинамика I
6.1
1. (a) Из пропана в воду
(b) 23,83 K
(c) Экзотермический, поскольку при сгорании выделяется энергия6,2
1. (а) 7599 Дж
(б) 92.96 К6,3
1. -124 кДж
2. -95 кДж
3. -1198 кДж
4. 0 (ноль). По совпадению, идентичные ковалентные связи разорваны и , поэтому эндотермический (+ ve) и экзотермический (-ve) процессы имеют одинаковую величину и их сумма = 06.4
1. Ионные связи. Межмолекулярные водородные связи
2. Эндотермический, разрывы связей или сил.
3. Они полярные, экзотермические
6,5
1. C (графит) + 1½H 2 (г) + ½Br 2 (л) → CH 3 Br (л)
2. 4C (графит) + 4H 2 (г) + ½O 2 (г) → CH 3 COC 2 H 5 (л)
3. Na (с) + ½N 2 (г) + 1½O 2 (г) → NaNO 3 (с)
4.При формировании элемента «из его элементов», т. Е. САМОГО, нет никаких изменений. Например; Na (s) ==> Na (s) не представляет никаких изменений ни в одном аспекте, из которых энтальпия составляет всего одну
6,6
1. C 5 H 12 (л) + 😯 2 (г) → 5CO 2 (г) + 6H 2 O (л)
2. CO (г) + ½O 2 (г) → CO 2 (г)
3. H 2 (г) + ½O 2 (г) → H 2 O (л)
4.Al (т) + ¾O 2 (г) → ½Al 2 O 3 (с)
6,7
1. -84 кДж
2. -2005 кДж
3. (а) -852 кДж
(б) Все они равны нулю
(в) +852 кДж
4. (а) S (с) + O 2 (г) → SO 2 (г)
(б) -297 кДж
5. (а) -126 кДж
(б) -124 кДж
(c) Ответ (a), так как он рассчитывается на основе данных о пласте и горении, характерных для рассматриваемых соединений.В части (b) энтальпии связи являются средними значениями и, следовательно, не обязательно специфичны для участвующих соединений
ПОЗ. 07 – Химическое равновесие
7,1
1. Kc = 4.
Все эксперименты дают одно и то же значение для K, потому что каждая реакция проводится при одинаковой температуре
2. x = 0,845, поэтому моль кислоты = 0,155, спирта = 1,155, сложного эфира = 0,845, воды = 0,845
3. Kc = 13,1
4.Моль HBr = 8,62
7,2
Относительно большое количество HI предполагает, что равновесие находится в значительной степени справа и сбоку (продукты), и, следовательно, значение K будет относительно большим
7,3
1. (а) Kp = 3,05
(b) Выражение Kp = приводит к математическому уравнению, которое выходит за рамки химии AP, но может быть решено. Здесь просто важно увидеть, как дошла экспрессия. (Фактическое значение x = 0.58 (или 58% диссоциировано) соответствует более низкому общему давлению в соответствии с принципом Ле Шателье)
2. (а) Kp = 13,8
(б) Kp = 21,8
(c) Выражение Kp = 2,11 x 10 4 = приводит к математическому уравнению, которое выходит за рамки AP, но может быть решено. Здесь просто важно увидеть, как дошла экспрессия. Фактическое значение x = 0,986 (или 98,6% диссоциированного) согласуется с огромным изменением Kp при более высокой температуре
3.0,128
7,4
1. 1,72 х 10 -11
2. 2.36 x 10 -5
3. 0,0152 M, 4,75 г / л.
4. Осадок образуется, поскольку Q> Ksp, и для достижения равновесия концентрации ионов в растворе должны быть уменьшены. Это достигается за счет формирования файла ppt.
7,5
1. (а) 1,26 x 10 -5
(б) 2,87 x 10 -8
(в) 6,32 x 10 -9
2.Добавление сульфат-ионов из внешнего источника делает Q намного больше, чем K. Чтобы восстановить равновесие, Q должно уменьшиться, чтобы значение K было восстановлено, и реакция должна сместиться в ту сторону, где находится твердый сульфат бария. .
7,6
1. 4.5
2. (а) 6,7 x 10 -6
(б) 1,2 x 10 -9
(c) Высокая концентрация гидроксид-ионов в растворе с pH 11 вызывает смещение равновесия назад (принцип Ле Шаталье или Q v.K), и растворимость твердого вещества снижается. По сути, это обычная проблема с ионами.
ПОЗ. 08 – Кислота и основания
8,1
1. Диаграмма B
2. Диаграмма C
3. Диаграмма A – относительно разбавленная слабая кислота; Диаграмма D представляет собой относительно разбавленную сильную кислоту
.8,2
1. 1,5
2. 12
3. 4.8 x 10 -5
4. 13.15
8.3
1. 1,82 х 10 -5
2. 4.86
3. Этановая кислота, так как она имеет большую Ka, что означает большую степень ионизации
4. 2.37
5. 3,06 x 10 -5
6. 2,41 x 10 -10
8,4
1. 1,78 x 10 -5
2. 3.36
3. Метиламин, поскольку у него больше Kb, что означает большую степень ионизации
4. 11,45
5.3,06 х 10 -5
6. 6.95 x 10 -10
8,5
1. 4,74
2. Лучшими буферами обычно являются буферы с прибл. Соотношение кислотных и сопряженных основных (солевых) компонентов 1: 1, так как это позволяет им одинаково хорошо поглощать любую дополнительную кислоту и основание. Поскольку логарифм 1 равен 0, тогда pH буфера равен его pKa
.3. pH = pKa + log (депротонированный / протонированный) = 7,6 + log (0,67 / 0,33) = 7,9
4.4,62
5. 5.13
УСТАНОВКА 09 – Химическая термодинамика II и электрохимия
9,1
1. (a) Отрицательный
(б) Положительно
2. (а) 400 К. Более высокая температура означает больший беспорядок (энтропия)
(b) Мягкий металл будет иметь гибкую металлическую связь, которая вызывает больше беспорядка, чем очень твердое твердое тело, такое как алмаз
(c) Газ при более низком давлении, так как частицы имеют больше пространства для движения и, как таковые, могут быть более разупорядоченными.Газ под относительно высоким давлением означает, что частицы упакованы в относительно небольшое пространство с относительно небольшим пространством для перемещения. Это приводит к более низкому уровню беспорядка, т.е. меньшей энтропии
9,2
(a) Zn (s) | Zn 2+ (водн.) || 1/2 F 2 (г) | F – (водн.) | (Pt)
(b) Sn (s) | Sn 2+ (водн.) || H + (водн.) | 1/2 H 2 (г) | (Pt)
(c) Fe (s) | Fe 2+ (водн.) || Cu 2+ (водн.) | Cu (s) |
(d) (Pt) | 1/2 H 2 (г) | H + (водн.) || Fe 3+ (водн.) , Fe 2+ (водн.) | (Пт)9.3
(i) (Pt) | 1/2 H 2 (г) | H + (водн.) || Ag + (водн.) | Ag (s) ; +0,80 В
(ii) Al (s) | Al 3+ (водн.) || Ag + (водн.) | Ag (s) ; -1,66 В9,4
Нижний
Ресурсы для преподавания химии в Интернете
Ближе к началу пандемии COVID-19 ChemEd X начал составлять список как новых, так и ранее опубликованных сообщений и ресурсов ChemEd X, которые могут быть полезны учителям при дистанционном обучении.Этот список продолжает расти. Читателям рекомендуется часто проверять, чтобы найти новый контент и комментировать дополнительные ресурсы, которые мы можем добавить в наш список.
Опубликовано на ChemEd X
ChemEd X Talks : Посмотрите расписание предстоящих ChemEd X Talks и найдите записи предыдущих бесед.
Идеи уроков, подходящие для онлайн-обучения
Виртуальная адаптация сортировки карточек периодической таблицы и лабораторная работа , Хастинг: Эта виртуальная адаптация дает студентам возможность участвовать в процессе, аналогичном тому, который Менделеев использовал при построении первоначальной версии периодической таблицы, которую мы все еще используем сегодня.
Именование и написание формул для ионных соединений Виртуальная деятельность , О’Брайен: Это дистанционное обучение – интересный способ для студентов попрактиковаться в написании имен и формул, которое не будет таким скучным, как рабочий лист, полный практических вопросов.
Настройка лаборатории типов реакций для Virtual , Минц: Эта виртуальная версия этой лаборатории ни в коем случае не заменяет студентов, которые сами проводят реакции, но в это время это упражнение можно использовать для дополнения обучения химическим реакциям.
The Mole – Бесплатное занятие в виртуальной химической лаборатории, Kenney – В разделе 1 учащиеся узнают, как выглядит родинка для различных веществ. В разделе 2 студенты узнают, как количество протонов и нейтронов в ядре определяет молярную массу элемента, сравнивая отдельные изотопы в моделировании PhET.
Растворимость и концентрация – Бесплатное занятие в виртуальной химической лаборатории , Кенни – В этом упражнении учащиеся узнают о растворимости и концентрации.Они смотрят видео, в которых объясняется процесс растворения, как рассчитать молярность, перенасыщение и как приготовить леденец. Они также используют моделирование PhET для изучения факторов, влияющих на концентрацию раствора.
Знакомство с плотностью – бесплатное занятие в виртуальной химической лаборатории , Кенни – Автор объясняет деятельность виртуальной химической лаборатории для использования на уроках химии в средней школе. Это упражнение – отличный способ познакомить с измерениями, значащими цифрами и понятием плотности.
Стехиометрия – мероприятие в бесплатной виртуальной химической лаборатории , Кенни – В этом виртуальном упражнении видео знакомит со стехиометрией и помогает студентам мыслить концептуально, используя простую аналогию с выпечкой. Затем вычисления стехиометрии подключаются к аналогии, которые затем подкрепляются простым экспериментом. Наконец, студенты изучают симуляцию PhET, чтобы углубить свои знания.
Плотность “POGIL-Like” Activity , Belleau: Это POGIL-подобная плотность действия подходит для онлайн-обучения.
Типы ионизирующих излучений Лаборатория и моделирование , Стюарт. Радиоактивность – это химическая тема, преподавать которую может быть сложно. Это можно использовать в школе или в среде онлайн-обучения, чтобы дать учащимся аутентичный лабораторный опыт, чтобы они могли определить, есть три типа ионизирующего излучения без прямого указания.
Используйте свой смартфон в качестве «абсорбционного спектрофотометра» , Kuntzleman – Изучите простой и очень недорогой способ построить и использовать «абсорбционный спектрометр» с помощью смартфона.Это отличный способ реализовать эксперименты с законом Пива в классе или дома!
Химическая кинетика со смартфоном , Кунцлеман – Этот эксперимент по химической кинетике можно провести с использованием таких простых материалов, как смартфон, перекись водорода, раствор карбоната натрия и синий пищевой краситель! Эксперимент полезен при обсуждении порядка законов скорости по отношению к реагентам.
Моделирование распределения Максвелла-Больцмана на замену , Thomson: Моделирование для изучения кривых распределения Максвелла-Больцмана, поскольку предыдущее онлайн-моделирование больше не работало из-за проблем с Java.
Чего не следует делать Лаборатория, Рэган: С более чем 30 показанными нарушениями безопасности, мультфильм служит отличным ледоколом, поскольку я предлагаю каждому ученику представиться, а затем перечислить нарушение безопасности, показанное на рисунке.
Использование Isotopes Matter в качестве инструмента цифрового обучения , Okroy – Isotopes Matter – это инструмент цифрового обучения, разработанный Isotopic Periodic Table и предназначенный для объяснения изотопов, а также их важности. Этот ресурс включает данные масс-спектроскопии в каждую из ключевых идей, а также предоставляет множество примеров того, как обычно используются различные изотопы.Вы также найдете связанную деятельность того же автора: Extension Activity with Isotopes Matter
NGSS-ify Alka-Seltzer Rocket Activity – с виртуальными параметрами, О’Брайен: В этой лаборатории ученикам дается канистра с пленкой, количество Alka Seltzer по их собственному выбору и любые материалы, имеющиеся в комнате для исследования факторов, которые влияют на скорость реакции. Они работают со своими группами над созданием досок CER, а затем класс участвует в сеансе Glow and Grow.
Практика измерения с использованием значимых цифр лично или виртуально, Clippard: Это упражнение позволяет учащимся увидеть много разных типов шкал, чтобы научиться измерять и определять, сколько цифр записывать в любом измерении, будь то объемы, массы, длины и т. д.
Использование Desmos для создания органической номенклатуры. Сортировка карточек. Действие , Мичем: Desmos предлагает функцию построения заданий, которая позволяет учителям создавать и настраивать задания.
Periodic Trends Guided-Inquiry Activity, Baxley: Тенденции, связанные с размещением элементов в периодической таблице, часто преподаются с помощью диаграмм в учебниках. Учащиеся часто запоминают тенденции, но чтобы получить истинное представление об их значении и причинах определенных закономерностей, лучше всего понять, когда студенты создают свои собственные модели и обсуждают их с другими. Легко адаптируется к виртуальной среде.
Исследование растворимости зеленых яиц , Каллен: В этом упражнении исследуется связь растворимости газа с температурой.Он подходит для домашнего или гибридного использования.
Групповой урок с гидом по координационным соединениям и комплексным ионам , Морган: проводится групповой урок по химии координационных соединений и комплексных ионов, подходящий для студентов AP Chemistry и студентов-химиков первого курса колледжа.
Изучение диетической колы и эксперимента с Mentos , Кунцлеман: исследуйте науку о пищевых продуктах, решениях, растворимости газов и многое другое с помощью этого увлекательного занятия.
Airbag Challenge , В «Airbag Challenge» ученикам предлагается разработать безопасную подушку безопасности для автомобильной компании. Это формирующее оценивание исследует размышления учащихся над вопросом «Как можно контролировать химические изменения?»
Мыльная лодка 2.0 , Кунцлеман: В эксперименте с мыльной лодкой используется эффект Марангони, тенденция материала перемещаться из области с низким поверхностным натяжением в область с высоким поверхностным натяжением. Это упражнение полезно при обучении решениям.
Как апельсиновая корка лопнет воздушный шар? Конечно, химия! , Кунцлеман: Некоторые апельсиновые корки могут вызвать лопание воздушных шаров. За этот эффект отвечает соединение лимонен, содержащееся в апельсиновой корке. Лимонен отвечает за чудесный запах апельсинов, при комнатной температуре это жидкость.
Химия в бутылке , Кунцлеман: Вы знакомы с экспериментом с бутылкой с динамической плотностью? Этот интересный эксперимент был изобретен Линн Хиггинс и продается различными компаниями-поставщиками науки.Две несмешивающиеся жидкости (обычно соленая вода и изопропиловый спирт) и два разных типа пластиковых деталей содержатся в бутылке с динамической плотностью.
Развлечение с M&M , Кунцлеман: Этот простой, но интересный эксперимент был впервые описан Элизабет Самнер Уолтер в 2001 году. Она просто попросила студентов налить воду в тарелку с конфетами Gobstoppers. Возможно, вас заинтересует продолжение работы Тома: Решение загадки M&M? .
Какое давление в бутылке с газировкой? , Кунцлеман: Какое давление внутри бутылки с содовой? Прочтите эту короткую статью, чтобы найти неожиданный ответ на этот вопрос, а также узнать, как провести эксперимент, чтобы ответить на этот вопрос самостоятельно!
Лаборатория Energizer с виртуальными опциями, Каллен (с виртуальными опциями, добавленными М. Хемлингом): в этой лаборатории студенты связывают работу электрохимической ячейки в лаборатории с символическими уравнениями, используемыми в электрохимии, и манипулируют моделью, представляющей уровень твердых частиц в том, что происходит во время электрохимического процесса.
Технологические и учебные ресурсы
Зарядите класс с помощью GIF-изображений , Hemling: помогите учащимся визуализировать модели уровня твердых частиц с помощью GIF-файлов! Также можно анимировать трехмерные фигуры, направления и цифровые наклейки.
Веб-сайт для создания виртуальных действий – flippity , О’Брайен: Этот веб-сайт предоставляет учителям и учащимся возможность взять Google Таблицу и превратить ее в различные виды деятельности.
Повышение вовлеченности в онлайн-лекцию с использованием функций Zoom , Jennie Mayer: Описывает некоторые уроки, извлеченные для увеличения посещаемости, участия, вовлеченности, обсуждения, оценки и создания сообщества в онлайн-классе.
Pivot Interactives – ресурс, о котором должны знать все учителя химии. , Мичем. Для меня как учителя невероятно важно иметь возможность создавать или редактировать что-либо в рамках моих инструкций в зависимости от потребностей моих учеников. Итак, когда я узнал, что действия в Pivot Interactives полностью настраиваются, я был в восторге. (Первоначально опубликовано 14.12.18)
Формат виртуальной лаборатории для онлайн-обучения во время COVID-19 – Джош Кенни описывает, как он будет форматировать свои химические лаборатории, включая использование моделирования PhET в своем удаленном классе этой осенью.
Обзор приложения – Classkick – Дуг Рэган объясняет, как он использовал Classkick в качестве инструмента для формирующей оценки в Интернете.
Computer Based Labs – электронная книга , Manning: Эта книга наполнена компьютерными лабораториями, которые можно использовать в различных классах.
Заполнение пустоты: варианты аутентичных расследований в Интернете , Мичем: автор сосредотачивается на двух доступных вариантах, которые, по его мнению, имеют наибольший потенциал для предложения законного подхода к аутентичным расследованиям в цифровой среде.
Использование Desmos для создания органической номенклатуры. Сортировка карточек. Действие , Мичем: Desmos предлагает функцию построения заданий, которая позволяет учителям создавать и настраивать задания.
Адаптация сортировок карточек для цифрового обучения, Ramaswamy: Автор объясняет, как она использует Google Slides, чтобы адаптировать ранее использовавшиеся виды карточек для дистанционного обучения.
Новый онлайн-инструмент: Интернет-класс Atomsmith Classroom , Thomson: автор обсуждает свои мысли об Интернет-классе Atomsmith Classroom.Также см. «Почему я думаю, что люблю Atomsmith …» Хастинга.
Вещи, извлеченные из гибридного обучения (часть 1), Серкин: Ариэль объясняет настройку своего компьютера и то, как она управляет сценарием гибридного обучения.
Монтаж видео для использования в качестве виртуальных лабораторий , Мичем: Бен Мичем делится тем, что он узнал о редактировании видео для своих студентов, поскольку они не могут находиться в лаборатории. Студенты могут наблюдать за этапами процедуры и собирать данные из видео, чтобы они могли выполнить задание после лабораторной работы.
Как использовать EdPuzzle для поддержки виртуального и гибридного обучения , Кенни: EdPuzzle – это инструмент доставки контента, который может повысить вовлеченность учащихся и их метапознание. Здесь мы узнаем, как использовать это приложение, чтобы помочь вашим ученикам учиться в удаленной или гибридной среде.
Доска в виртуальном классе с Мелиссой Хемлинг , В этом записанном выступлении ChemEd X Мелисса рассказывает, как она использует цифровые доски для оценки понимания учащимися и выявления неправильных представлений, как это было до COVID.
Дистанционная обратная связь с Ариэлем Серкином , В этом записанном выступлении ChemEd X Ариэль рассказывает о процессе, который она использует, и о том, как она дистанционно предоставляет обратную связь своим ученикам.
Обратная связь: инструмент для решения проблем, связанных со временем и вовлечением , Мичем: Использование расширения Chrome Mote позволяет учителям прикреплять аудиозаписи своих отзывов к работе учащихся.
Создание интерактивных лекционных видео с помощью PlayPosit , Cox: PlayPosit предоставляет среду для встраивания интерактивных лекционных и / или лабораторных видео.
Формирующее оценивание с использованием Nearpod с Майклом Фарабо , В этом записанном выступлении ChemEd X Майкл рассказал, как он использует интерактивные функции Nearpod для создания формирующих заданий оценивания, которые обеспечивают ценную обратную связь и облегчают участие учащихся.
Стратегии и советы по обучению в ИнтернетеКак привлечь больше студентов в офис Часы , Майер: В этом сообщении блога описаны некоторые стратегии, в том числе инструмент Calendly, который значительно упрощает планирование встреч, что может помочь увеличить количество посещений в рабочее время.
Реалистичные ожидания для онлайн (удаленных) классов , Кэрриган: Автор предлагает советы и рекомендации относительно ожиданий при обучении онлайн.
Оригами кролики и перевернутый класс химии , Тарвин: важно учитывать, что если вы создаете видео для студентов, они должны понимать, как использовать эти видео. Если учащиеся ранее не использовали видео для обучения, им нужен совет.
Советы по сортировке карточек , Хемлинг: Сортировка карточек учителя может предоставить учащимся цифровую информацию для выполнения дома.
Действия POGIL в асинхронной среде обучения , О’Брайен: Хотя действия POGIL предназначены для синхронного выполнения в совместных командах, существуют способы использовать эти действия в асинхронной сетевой среде.
Переход к онлайн-инструкциям по химии в условиях COVID-19 , Кенни: Автор рассказывает, как он построил свой новый виртуальный курс химии.
Три необходимых корректировки для обучения во время COVID-19 , Кенни: Автор обсуждает стратегии и изменения своего курса в ответ на потребности своих учеников и характер онлайн-обучения.
NGSS Во время электронного обучения , О’Брайен: Методы решения четырех научных и инженерных практик NGSS.
Что творится у них в голове? – Созданные студентами видеоролики для решения метакогнитивных задач , Кенни: Несмотря на то, что виртуальные учебные среды создают проблемы для облегчения метакогнитивных действий, видеоролики, созданные студентами, эффективны для повышения метапознания в онлайн-обучении химии.
Действия по развитию мышления высшего порядка в виртуальном асинхронном обучении химии , Кенни: два метакогнитивных учебных мероприятия, которые легко включить в среду онлайн-обучения.
Особенности эффективных видео в перевернутом классе , Кенни: В течение некоторого времени автор создавал видеоуроки для использования в перевернутом классе. С годами формат его видео эволюционировал, поскольку он обнаружил передовой опыт в технике.
Советы по созданию собственных видеоуроков , Кенни: YouTube используют больше студентов, чем представители любой другой демографической группы. Принимая во внимание эту реальность, я начал создавать свой собственный видеоконтент на моем канале YouTube, The Science Classroom.Как опытный создатель контента на YouTube, я предлагаю советы по началу работы с собственными учебными пособиями по науке.
Глобальные эксперименты , Хемлинг: Поскольку миллионы учителей и студентов сталкиваются с дистанционным обучением из-за COVID-19, глобальный эксперимент может стать отличным способом вовлечь студентов дома.
Студенты ответили на вопрос, но что они думают? , Балицки: Поскольку физическое дистанцирование продолжается и мы упорно проводим наши уроки химии онлайн, нам как учителям надлежит потратить некоторое время на размышления о том, как мы можем целенаправленно наблюдать и расшифровывать письменные работы, которые представляют наши ученики.
Планирование неопределенного будущего , Husting: Идеи для проектов во время дистанционного обучения.
Преимущества преподавания химии в Интернете , Карриган: Двенадцать лет преподавания полностью онлайн-курса химии GOB (общая органическая биохимия) показали множество преимуществ как для преподавателей, так и для студентов. Этот блог посвящен некоторым положительным аспектам онлайн-обучения.
Переворачивая класс … Хорошее, Плохое и Уродливое … , Хустинг: Это краткая история попытки одного учителя “перевернуть” вещи.Вы получите хорошее, плохое и уродливое.
Размышления об использовании модели HyFlex для научного обучения. Villa: в этом блоге описывается опыт использования модели HyFlex.
Создание интерактивных диаграмм частиц для интерактивных инструкций , Фарабо. Автор описывает, как создавать интерактивные действия с диаграммами частиц, которые студенты могут легко использовать в Интернете. Эта стратегия применима практически к любой диаграмме частиц и должна быть полезна учителям во время виртуальных уроков.
Создание классной культуры
Build a Boat Collaboration был первоначально опубликован в 2014 году Кристин Грегори. Только что добавлено модифицированное слайд-шоу для удаленного использования занятия. Ее первоначальный пост был вдохновлен деятельностью Эрики Постумы, которой она поделилась в Build a Boat (и культуре в классе). Это задание «Снова в школу» может стать ценным способом создания в классе культуры командной работы и установки на рост.Сообщение Райана Бруика, Как «учебная яма» может помочь создать культуру обучения, , предлагает еще больше понимания того, как создать культуру в классе.
Капитал, поддержка и философское содержание
Преподавание во время COVID-19 , Серкин: Обсуждение борьбы за обеспечение справедливого образования во время дистанционного обучения.
Преподавание в трудные времена, стремление: автор обсуждает способы помочь нашим ученикам в это время.
Онлайн-лаборатории и вопрос об актуальности лабораторной программы , Кларисса Соренсен-Унру: сосредоточена на вопросе «Актуальны ли курсовые работы в химической лаборатории?»
Связь по химии / COVID
Химические иллюстрации сглаживания кривой , Кунцлеман, Кэмпбелл, Крафт, Липпинкотт, Розенгартен: две демонстрации химии, которые можно использовать для иллюстрации «сглаживания кривой».
Пузырьковые ВВ и вакцинированные Mentos: химические иллюстрации для продвижения мер общественного здравоохранения , Кэмпбелл, Липпинкотт: Приведенные выше демонстрации были изменены с целью популяризации таких мер общественного здравоохранения, как маскировка и вакцинация.
Демонстрация эффективности ношения маски с жидким азотом , Кунцлеман: В демонстрации используется жидкий азот для визуализации аэрозольных частиц, испускаемых при разговоре, кашле, дыхании и чихании.
Применение принципов химии к COVID-19: вопросы «Подумай-пара-поделись», Доннелли: Этот пост состоит из вопросов (Q), в которых учащимся предлагается применить знания, полученные в их химическом образовании, к COVID-19.
Объяснение коммуникаций в рамках научных исследований в эпоху COVID-19 , Харви: Помогая студентам понять ключевые элементы, влияющие на репутацию науки и ученых: что делает кого-то экспертом? Какова цель экспертной оценки и кто такие «коллеги»? Как научное сообщество может уравновесить немедленную потребность в новой информации с потребностью в надежной информации?
Другие внешние ресурсы, поддерживающие онлайн-образование
Движение лицом к лицу в онлайн… Пост от Элисон Флинн из Университета Оттавы содержит инфографику и список ресурсов
AACT – Американская ассоциация учителей химии : Даже если вы еще не являетесь членом AACT, вы все равно можете воспользоваться их ресурсами. AACT разблокировал некоторые из своих ресурсов, и теперь они бесплатно доступны для химического сообщества до 31 марта. Эти ресурсы включают в себя мероприятия, анимации, проекты, симуляции, видео и многое другое для начальной школы, средней школы, средней школы и Advanced Placement / общие химия.
Alchemie : Alchemie создает ресурсы для обучения химии. Они предлагают механизмы (программное обеспечение для моделирования механизмов реакций органической химии) и ModelAR (программа виртуального молекулярного моделирования) бесплатно.
Bretz Research Group – Университет Майами, штат Огайо, факультет химии и биохимии: Bretz Group составила список ресурсов для поддержки преподавателей химического и биохимического образования, которые переходят на дистанционное / онлайн-обучение из-за вируса короны.Большинство из них – ресурсы уровня колледжа.
ChemMatters – Американское химическое общество – журналы ChemMatters предназначены для старшеклассников и доступны в Интернете.
Desmos : Это больше, чем математика! Посмотрите сообщение Бена об использовании Desmos для сортировки карточек.
Flipgrid: Flipgrid бесплатен для учителей и студентов. Учащиеся и учителя могут записывать и публиковать короткие видеоролики.
FLINN AT-HOME SCIENCE : Ознакомьтесь с ресурсами, которые компания Flinn Science организовала, чтобы помочь учителям и родителям найти правильные решения в области содержания, чтобы продолжить обучение своих учеников дома в течение этого времени.
Flynn Research Group – Университет Оттавы: переход к очным онлайн-курсам … FAST (ресурсы и полезная инфографика)
Химия средней школы Линкольна : Эрин Отте-Мейер поделилась на странице учителя химии AP в Facebook – Химический факультет средней школы Линкольна только что завершил создание веб-сайта, согласованного с их учебной программой, для поддержки обучения в классе. Он содержит чтения, видео, практические листы с ключами, практические тесты с ключами.
OLI Chemistry бесплатно для организаций, пострадавших от COVID-19 – ChemCollective : Эти материалы бесплатны для использования организациями, пострадавшими от COVID-19.Курс охватывает общую химию I и общую химию II. Каждый модуль включает в себя короткие тексты, проработанные примеры (включая интерактивные проработанные примеры), множество продуманных практических задач (с адаптивной и целевой обратной связью) и оценки. Интеграция этих компонентов обеспечивает плавное и интерактивное обучение для ваших студентов. Учебный курс также предоставляет инструкторам данные об успеваемости учащихся, которые они могут использовать для адаптации своих инструкций к потребностям учащихся.
Опыт виртуальной реальности с открытым доступом для лабораторий органической химии : Опыт виртуальной реальности с открытым доступом для лабораторий органической химии, созданный в сотрудничестве между Департаментом химии Государственного университета Северной Каролины и приложениями для дистанционного образования и обучения (DELTA).
Открытая наука : контент на этом сайте Университета Ватерлоо находится в свободном доступе и предназначен для различных тем, относящихся к науке в средней школе.Новые уроки и задачи будут добавляться по мере их выполнения, поэтому регулярно проверяйте сайт.
Образовательные ресурсы по органической химии (OrganicERs) Учебное сообщество преподавателей – это интернет-сообщество, созданное спонсируемой NSF программой Chemistry Collaborations, Workshops and Community of Scholars ( c CWCS ). Он в первую очередь предназначен для преподавателей колледжа, чтобы общаться и сотрудничать; а также для доступа, обмена и разработки учебных материалов.
Интерактивные симуляторы PhET – Университет Колорадо в Боулдере: Многие симуляции PhET могут использоваться в качестве домашних лабораторий. На каждой странице моделирования есть коллекция уроков в разделе «Ресурсы для учителей». Вы можете улучшить онлайн-лекцию или видео с помощью демонстрации PhET. Моделирование PhET может быть вашим динамическим демонстрационным оборудованием или вашим рисунком на доске. PhET имеет 158 симуляций STEM! 83 из них в HTML5! Несмотря на то, что некоторые из их симуляций Java и Flash могут быть труднодоступными для учащихся, они работают на обычных компьютерах и по-прежнему могут служить обучению с помощью демонстраций и снимков экрана.
- Используйте возможность «снимка экрана» под кнопкой меню PhET, чтобы учащиеся запечатлели свою работу и описали свое обучение.
- Встраивайте симуляторы PhET на веб-сайт / LMS – PhET предоставляет HTML-код на всех страницах симуляторов, который вы можете скопировать и вставить, чтобы встроить живую копию симуляции!
- Поделиться симкой в Google Классе. Чтобы добавить симулятора в Google Класс, щелкните значок Google на странице симулятора. Симов можно добавлять в качестве заданий, дополнительных материалов или домашних заданий.
- Встраивание симуляторов PhET в OneNote – вставьте любую ссылку на симуляцию PhET на страницу OneNote, и она будет отображена как интерактивная встраиваемая версия.
- Запускайте только тот экран, который вам нужен – Используйте наш параметр запроса «Screens», чтобы запускать только те экраны, которые должен использовать ваш ученик. Попробуйте добавить «? Screen = 1» или «? Screen = 2,3» в конец URL-адреса многоэкранного симулятора.
- Требуется поддержка автономного использования? Без проблем! Каждую sim-карту можно загрузить отдельно и она будет работать даже без подключения, или вы можете установить наш автономный установщик. См. Их страницу автономного доступа.
Ресурсы для преподавания на уроке химии в Интернете: сборник бесплатных материалов от Американского химического общества и Отдела химического образования ACS : Публикации ACS и Отдел химического образования ACS делятся этой коллекцией ресурсов.Щелкните, чтобы получить доступ к бесплатному чтению статей из Journal of Chemical Education .
Стратегии преподавания химии онлайн Группа Facebook , инициированная Бриттландом ДеКорвером из Государственного университета Гранд-Вэлли.
Обучение во времена COV19: статья , Полетт Винсент-Рус, 16 марта 2020 г.
TechSmith : Tech Smith предоставит бесплатный доступ к своему инструменту записи экрана Snagit и платформе для совместной работы TechSmith Video Review для тех, кто переходит на удаленное обучение и рабочие среды.
Эксперимент с экраном титрования – Королевское химическое общество: эксперимент с экраном титрования был разработан как бесплатный гибкий инструмент для учителей и учеников. Вы можете выбрать титрование сильной кислотой и сильным основанием (или любое сочетание сильного и слабого кислотно-основного титрования). Также необходимо завершить эксперимент по окислительно-восстановительному титрованию, чтобы студенты могли попрактиковаться в своих знаниях и навыках.
Советы преподавателей по быстрой подготовке к обучению в Интернете – Delta News – Университет штата Северная Каролина: в заголовке раскрывается содержание этой статьи.Если вы раньше не преподавали онлайн, это хорошее место для начала.
VIPEr : Виртуальный неорганический педагогический электронный ресурс: VIPEr – это сообщество для преподавателей и студентов неорганической химии. Особый интерес согласно комментарию ниже: Асинхронное онлайн-обучение в эпоху COVID-19 , Адам Р. Джонсон, Колледж Харви Мадда (доступ 13.03.20)
Советы по быстрой установке
Как можно продезинфицировать продукцию Vernier?
У вас есть ресурс, который вы хотели бы порекомендовать? Вы можете добавить его в этот список, войдя в свою учетную запись ChemEd X и оставив комментарий ниже.Может быть, вы хотели бы чем-то поделиться, написав свой собственный пост в блоге, чтобы внести свой вклад. ( Узнайте больше о том, как внести свой вклад: https://www.chemedx.org/page/contribute. ) Мы приветствуем материалы по любой теме, интересующей преподавателей химии. Вы также можете использовать нашу контактную форму для вопросов / комментариев или поддержки для отправки.
Практическая химия – содержание
Практические занятия по химии с приложениями из реальной жизни.
Герр, Норм и Джеймс Каннингем. (1999)
John Wiley / Jossey-Bass, Publishers
638 страниц. (ISBN 0-87628-262-1).В наличии от многих книжных онлайн-компаний, в том числе:
Jossey-Bass | Джон Вили | Amazon | Barnes & Noble | Границы | BetterWorld | Книги Башни | EasonСодержание | О практической химии | О нас | Онлайн
Практические занятия по химии с использованием реальных приложений содержит более 300 увлекательных исследований, призванных вовлечь учащихся в искреннее стремление к науке.Из-за положительного отклика на практические занятия по физике авторы использовали тот же подход и философию при написании этого ресурса. Этот практический, основанный на запросах подход к преподаванию и изучению естествознания следует рекомендациям, изложенным в Национальных стандартах научного образования Национальной академии наук и в проекте по последовательности и координации Национальной ассоциации преподавателей естественных наук.
Мероприятия, включенные в этот ресурс, обеспечивают конструктивное взаимодействие между учащимися и их миром, поощряя разумные научные рассуждения.Многие занятия дают неожиданные или впечатляющие результаты, вызывающие интерес студентов. Каждому набору исследований предшествует краткое введение в соответствующие концепции, что дает студентам основу для их понимания. Этот ресурс содержит более 450 иллюстраций и 100 таблиц, которые помогут студентам и учителям в выполнении заданий. Чтобы стимулировать рассуждение учащихся, после каждого набора заданий включаются наводящие на размышления вопросы. После каждого раздела для учащихся идет материал, разработанный специально для учителя, в котором более подробно объясняются концепции, даются ответы на вопросы и даются указания для представления занятий в виде впечатляющих демонстраций в классе.На протяжении всего ресурса представлены интересные и практические применения научных принципов и концепций, помогая учащимся понять важность науки для их повседневной жизни.
Авторы приложили все усилия, чтобы включить упражнения, которые можно безопасно выполнять с материалами, которые обычно встречаются в повседневной среде студентов. Некоторым требуются материалы, которые можно найти в обычных классах естественных наук, или недорогое оборудование, которое можно получить в специализированных учреждениях. Мероприятия успешно реализованы и апробированы на занятиях опытными и начинающими преподавателями естественных наук.
Несмотря на то, что были предприняты все усилия для разработки мероприятий, которые могут быть выполнены безопасно, авторы подчеркивают, что химические исследования могут быть связаны с опасностями. Следовательно, учителя и ученики должны уделять особое внимание всем рекомендациям по безопасности, напечатанным курсивом на всем протяжении этого ресурса. При работе с химическими веществами необходимо носить защитную одежду и очки. Некоторые действия, хотя и драматичны, могут быть опасными и должны выполняться только инструктором, как указано в ресурсе.Если у вас есть сомнения относительно безопасности, не выполняйте никаких действий.
По мере того, как учащиеся проводят исследования, описанные в этом ресурсе, они вовлекаются в научные процессы и приобретают знания и понимание основных научных концепций и их актуальности для повседневной жизни.
Норман Херр, Ph.D.
Джеймс Каннингем, доктор философии
Нортридж, Калифорния 19981.1 язык химии
1.1.1 Номенклатура: Элементы
1.1.2 Номенклатура: Соединения
1.1.3 Химическая терминология: Понимание языка химии
Для учителя (Обсуждение и ответы на вопросы для занятий 1.1.1-1.1.3)
Применения в повседневной жизни1,2 Единицы измерения
1.2.1 Важность единиц
1.2.2 Единицы в химии
1.2.3 Решение задач (размерный анализ)
Для учителя (обсуждение и ответы на вопросы для занятий 1.2.1-1.2.3)
Применение в повседневной жизни1.3 Измерение
1.3.1 Длина: оценка и измерение
1.3.2 Площадь: оценка и измерение
1.3.3 Объем: оценка и измерение
1.3.4 Измерение массы
1.3.5 Плотность твердых тел
1.3.6 Плотность жидкостей
1.3. 7 Плотность растворов
1.3.8 Плотность растворов: Тайна Гибралтарского пролива
1.3.9 Плотность газов
Для учителя (ключи для обсуждения и ответы для занятий 1.3.1-1.3.9)
Применение в повседневной жизни2.1 Атомная структура
2.1.1 Атомы – это в основном пустое пространство
2.1.2 Атомные спектры
2.1.3 Волновые характеристики
2.1.4 Квантовые числа и электронные орбитали
2.1.5 Электронная конфигурация
для учителя (ключи для обсуждения и ответов для занятий 2.1.1 -2.1.5)
Применение в повседневной жизни2.2 Периодический закон
2.2.1 Поиск «недостающих элементов»
2.2.2 Составление своей собственной периодической таблицы
2.2.3 Семейные характеристики
2.2.4 Тенденции в семье
Для учителя (обсуждение и ответы для занятий 2.2.1-2.2.4)
Приложения к повседневной жизни2.3 Диффузия и осмос
2.3.1 Броуновское движение
2.3.2 Диффузия газов
2.3.3 Влияние температуры на диффузию
2.3.4 Влияние размера молекулы на скорость диффузии
2.3.5 Осмос
2.3.6 Осмотическое давление
2.3.7 Диализ
Для учителя (ключи для обсуждения и ответов на занятия 2.3.1-2.3.7)
Приложения в повседневной жизни2.4 Изменения состояния
2.4.1 Относительные объемы твердой, жидкой и газовой фаз
2.4.2 Теплоты плавления и испарения
2.4.3 Кипение: влияние давления
2.4.4 Дистилляция
2.4.5 Сублимация диоксида углерода
2.4.6 Тройная Точка; Фазовая диаграмма углекислого газа
2.4.7 Регеляция: фазовая диаграмма воды
для учителя (ключи для обсуждения и ответов для упражнений 2.4.1-2.4.7)
Применение в повседневной жизни2.5 Классификация материалов
2.5.1 Физические и химические изменения
2.5.2 Разделение чистых веществ и смесей: хроматография
2.5.3 Идентификация физических и химических изменений
2.5.4 Элементы и соединения
2.5.5 Экстенсивные и интенсивные физические свойства
2.5.6 Определение неизвестных по физическим и химическим свойствам
Для учителя (обсуждение и ответы на задания 2.5.1-2.5.6)
Применение в повседневной жизни3.1 Химическая связь
3.1.1 Закон определенных пропорций
3.1.2 Образование связи
3.1.3 Неполярные и полярные ковалентные связи
3.1.4 Ковалентные и ионные связи
3.1.5 Металлические связи
3.1.6 Межмолекулярные силы
Для учителя ( Ключи для обсуждения и ответов для мероприятий 3.1.1-3.1.6)
Приложения в повседневной жизни3.2 Типы химических реакций
3.2.1 Реакции состава (синтез, комбинация)
3.2.2 Реакции разложения
3.2.3 Реакции одинарного вытеснения (одиночного замещения)
3.2.4 Реакции двойного замещения (ионного объединения)
3.2.5 Реакции горения
3.2.6 Реакции присоединения
Для учителя (Обсуждение и ответы на задания 3.2.1-3.2.6)
Приложения к повседневной жизни3.3 Окислительно-восстановительные (окислительно-восстановительные) реакции
3.3.1 Состояния окисления
3.3.2 Окисление и восстановление
3.3.3 Драматические окислительные реакции
3.3.4 Уравновешивание окислительно-восстановительных реакций
Для учителя (Обсуждение и ключи для действий 3.3.1-3.3.4)
Применения в повседневной жизни3.4 Электрохимия
3.4.1 Электродные потенциалы
3.4.2 Преобразование энергии
3.4.3 Гальванический элемент
3.4.4 Батареи
3.4.5 Электролиз
3.4.6 Гальваника
Для учителя (обсуждение и ответы на задания 3.4.1-3.4. 6)
Применение в повседневной жизни3.5 Полимеры
3.5.1 Полимеризация
3.5.2 Сшивающие полимеры
3.5.3 Использование полимеров
3.5.4 Переработка пластиковых полимеров
Для учителя (обсуждение и ответы на вопросы 3.5.1-3.5.4)
Приложения для повседневного использования Жизнь3,6 Ядерная химия
3.6.1 Обнаружение излучения с помощью камеры облака
3.6.2 Обнаружение излучения с помощью электроскопа
3.6.3 Обнаружение излучения с помощью счетчика Гейгера
3.6.4 Моделирование ядерных реакций
Для учителя (ключи для обсуждения и ответов для занятий 3.6.1-3.6.4)
Применение в повседневной жизни
4.1 Термохимия
4.1.1 Эндотермические реакции
4.1.2 Теплота разведения и раствора
4.1.3 Химический подогреватель рук
4.1.4 Теплота реакции
4.1.5 Калорийность продуктов
4.1.6 Энтропия
4.1.7 Энтропия Реакции
4.1.8 Энтропия и энтальпия
Для учителя (ключи для обсуждения и ответа для мероприятий 4.1.1-4.1.8)
Приложения к повседневной жизни4.2 Теплообмен
4.2.1 Теплопроводность металлов
4.2.2 Электропроводность и горение
4.2.3 Электропроводность: предохранительная лампа Дэви
4.2.4 Конвекция в газах
4.2.5 Конвекция в жидкостях
4.2.6 Излучение
Для учителя (Обсуждение и Ключи ответов для мероприятий 4.2.1-4.2.6)
Приложения к повседневной жизни4.3 Химическая кинетика
4.3.1 Влияние концентрации на скорость реакции
4.3.2 Влияние температуры на скорость реакции
4.3.3 Влияние температуры и концентрации на скорость реакции
4.3.4 Катализаторы, скорости реакции и энергия активации
4.3.5 Ферменты
4.3.6 Колеблющиеся химические реакции
Для учителя (обсуждение и ответы на задания 4.3.1-4.3. 6)
Применение в повседневной жизни4.4 Химическое равновесие
4.4.1 Модели динамического равновесия
4.4.2 Нарушение равновесия
4.4.3 Влияние концентрации на равновесие
4.4.4 Влияние давления на равновесие
4.4.5 Влияние температуры на равновесие
Для учителя (ключи для обсуждения и ответов для занятий 4.4.1-4.4.5)
Приложения к повседневной жизни5.1 Газы
5.1.1 Свойства газов
5.1.2 Зависимость давления от объема газов (закон Бойля)
5.1.3 Зависимость температуры от объема газов (закон Чарльза)
5.1.4 Воздушные шары: применение закона Чарльза
5.1 .5 Зависимость температуры от давления газов (закон Гей-Люссака)
5.1.6 Принцип Авогадро
5.1.7 Измерение атмосферного давления
Для учителя (ключи для обсуждения и ответа для занятий 5.1.1-5.1.7)
Применения в повседневной жизни5.2 Коллоиды и суспензии
5.2.1 Эффект Тиндаля
5.2.2 Классификация дисперсий: растворы, коллоиды и суспензии
5.2.3 Броуновское движение в коллоидах
5.2.4 Изготовление коллоидов
Для учителя (обсуждение и ответы на упражнения 5.2.1-5.2 .4)
Применение в повседневной жизни5.3 Растворители, Растворители, Растворы
5.3.1 Растворимость (взаимодействие растворенного вещества / растворителя)
5.3.2 Площадь поверхности и скорость растворения
5.3.3 Температура и скорость растворения
5.3.4 Энтальпия раствора
5.3.5 Растворимость газов в жидкостях
Для учителя (Обсуждение и ключи ответов для действий 5.3.1-5.3.5)
Приложения для повседневной жизни5.4 Коллигативные свойства
5.4.1 Закон Рауля
5.4.2 Понижение точки замерзания
5.4.3 Повышение точки кипения
5.4.4 Осмотическое давление
Для учителя (Обсуждение и ответы для занятий 5.4.1-5.4.4)
Применение в повседневной жизни5.5 Кислоты и основания
5.5.1 Кислоты
5.5.2 Основания
5.5.3 Шкала pH
5.5.4 Концентрация, эквивалентность и интенсивность кислотно-щелочного баланса
5.5.5 Кислотный дождь
Для учителя (обсуждение и ответы для занятий 5.5.1- 5.5.5)
Применение в повседневной жизни5.6 Кислотные и основные реакции
5.6.1 Нейтрализация
5.6.2 Титрование
5.6.3 Буферизация
5.6.4 pH почвы
5.6.5 Контроль дыхания pH
Для учителя (обсуждение и ответы на вопросы 5.6.1-5.6.5)
Применение в повседневной жизни5.7 Кристаллы и кристаллизация
5.7.1 Перенасыщение и кристаллизация
5.7.2 Кристаллизация испарением
5.7.3 Выращивание кристаллов; Формы кристаллов
5.7.4 Металлические кристаллы
5.7.5 Силикатные кристаллы
5.7.6 Сталактиты и сталагмиты
5.7.7 Скорость кристаллизации и размер кристаллов
Для учителя (обсуждение и ответы на задания 5.7.1-5.7.7)
Применение в повседневной жизниПриложение
A.1 Единицы, величины и преобразования
1.1 Физические величины и их единицы в системе СИ
1.2 Префиксы метрической системы
1.3 СИ и обычные единицы измерения и преобразования
1.4 Общие преобразования
1.5 Единицы давления
1.6 Давление водяного пара
A.2 Химический язык
2.1 Рекомендации по стилю письма
2.2 Корневые слова, часто используемые в химии
2.3 Этимология названий элементов
2.4 Уравнения баланса
A.3 Безопасность
3.1 Образец договора о безопасности
3.2 Хранение химикатов
3.3 Утилизация химикатов
3.4 Таблички с общей химической опасностью
А.4 Приобретение и подготовка химикатов
4.1 Обычные и недорогие источники химикатов
4.2 Приготовление исходных растворов и разведений
4.3 Приготовление растворов кислоты и основного основного раствора
A.5 Химическая информация
5.1 Свойства общих элементов
5.2 Общие ионы
5.3 Стандартные восстановительные потенциалы
A.6 Периодическая таблица
6.1 Периодическая таблица элементовобучающее исследование по химии растворов в 8 классе
Эбенезер, Дж.В. и Эрикссон, Л. (1996), «Представления студентов-химиков о растворимости:
феноменография», Science Education, Vol. 80. С. 181-201.
Холмквист, М. (2011), «Обучение учителей в учебном исследовании», Instructional Science, Vol. 39
с. 497-511.
Holmqvist, M., Gustavsson, L. и Wernberg, A. (2008), «Теория вариаций: инструмент для улучшения образования
», в Kelly, AE and Lesh, R. (Eds), Handbook of Design Research Методы в образовании
, Эрлбаум, Махва, Нью-Джерси, стр.111-30.
Куллберг А. (2010), Чему учат и чему учат? Профессиональные знания, полученные и
, предоставленные учителями математики, Vol. 293, Acta Universitatis Gothoburgensis, Go
¨teborg.
Мартон Ф. и Бут С. (1997), Обучение и осведомленность, Лоуренс Эрлбаум Ассошиэйтс,
Махва, Нью-Джерси.
Мартон Ф. и Ло Л.М. (2007), «Обучение на основе учебного исследования», Tidskrift fo
rla
rarutbildning
och forskning (Журнал педагогического образования и исследований), Vol.14 No. 1.
Мартон Ф. и Моррис П. (2002), Что имеет значение? Выявление критических условий в классе
Learning, Go
Этеборг Исследования в области педагогических наук 181, Acta Universitatis
Gothoburgensis, Go
¨teborg.
Мартон Ф. и Панг М.Ф. (2006), «О некоторых необходимых условиях обучения», Journal of the
Learning Sciences, Vol. 15 No. 2, pp. 193-220.
Мартон Ф. и Цуй А. Б. (2004), Классный дискурс и пространство обучения, Лоуренс
Эрлбаум, Махва, Нью-Джерси.
Прието Т., Бланко А. и Родригес А. (1989), «Идеи учащихся от 11 до 14 лет о природе решений
», Международный журнал естественнонаучного образования, Vol. 11. С. 451-63.
Рунессон, У. (2006), «Чему можно научиться? Об вариации как необходимом условии обучения
», Scandinavian Journal of Educational Research, Vol. 50 No. 4, pp. 397-410.
Рунессон, У. и Густафссон, Л. (2010), «Обучение обучению – производство знаний для учителей?»,
Доклад, представленный на Международной конференции Всемирной ассоциации изучения уроков,
Бруней-Даруссалам, 9-10 декабря.
Vikstro
m, A. (2005), «Ett from
fo
rla
». обучение: изучение теории вариаций
преподавания и изучения биологии », докторская диссертация, Лулео
˚Технологический университет, Лулео
˚.
Дополнительная литература
Vikstro
m, A. (2008), «Что предполагается, что реализуется и чему учатся? Преподавание и
изучение биологии в классе начальной школы », Journal of Science Teacher Education,
Vol.19. С. 211-33.
Об авторах
Анна Викстро
Ом, кандидат наук, старший преподаватель Лулео
˚Технологический университет. Анна Викстро
¨mis
автор-корреспондент, с ней можно связаться по адресу: [email protected]
Анна Бильстро
¨m преподает естественные науки в средней школе.
Парвиз Фазели преподает естественные науки в средней школе.
Моника Холм преподает естественные науки в средней школе.
Керстин Йонссон преподает естественные науки в средней школе.
Гунилла Карлссон преподает естественные науки в средней школе.
Питер Ридстро
Ом преподает естественные науки в средней школе.
Чтобы приобрести оттиски этой статьи, напишите по электронной почте: reprints@emeraldinsight.

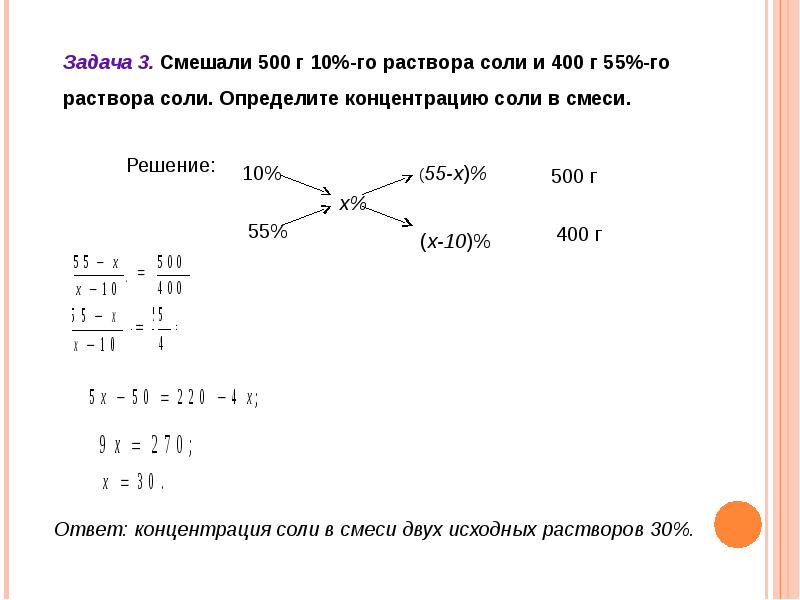 Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
Например, в случае раствора сахара в воде сахар является растворенным веществом, а вода является растворителем.
 Например:
Например:
 Химия, 8–9 класс: уроки, тесты, задания.
Химия, 8–9 класс: уроки, тесты, задания.
 docx.. 29,0 КБ
docx.. 29,0 КБ