Олимпиадные задачи по химии с решениями. 9 класс.
Задача 1.
“Азотносеребряная соль AgNO3, известная в практике под именем ляписа (lapis infernalis), получается растворением в азотной кислоте металлического серебра. Если для растворения взято нечистое серебро, то в растворе получается смесь азотномедной и азотносеребряной солей. Если такую смесь испарить досуха, а затем остаток осторожно сплавить до температуры начала каления, то вся азотномедная соль разлагается, а большинство азотносеребряной соли не изменяется. Обрабатывая сплавленную массу водой, извлекают эту последнюю…” (Д.И. Менделеев, “Основы химии”, т.2, стр.303–4, М.,Л., 1947)
Напишите уравнения реакций, происходящих при растворении “нечистого серебра” в конц. азотной кислоте и при прокаливании сухого остатка.
Определите содержание серебра (массовые доли в %), если для растворения было взято 2,000 г “нечистого серебра”, а масса остатка, полученного в результате прокаливания, составила 3,069 г.
Определите массу осадка, образующегося при добавлении избытка раствора хлорида натрия к раствору 2,000 г “нечистого серебра” в азотной кислоте.
Решение
а) Ag + 2HNO3 = AgNO3 + NO2 + h3O
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
б) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
Масса серебра в исходном сплаве – х (г), тогда масса меди – (2–х) г.
Количество серебра составляет: n Ag = x/107,87 (моль) и равно количеству образующегося нитрата серебра.
Количество меди равно: n Cu = (2–x)/63,55 (моль) и равно количеству образующегося оксида меди.
Тогда масса нитрата серебра равна: 169,87x/107,87 = 1,575x (г).
Масса оксида меди составляет: 79,55(2–x)/63,55 = 2,504 – 1,252х (г).
Общая масса сухого остатка после прокаливания равна:
По условию масса остатка после прокаливания равна 3,069 (г), тогда:
2,504 – 0,323x = 3,069
0,323x = 0,565
x = 1,749 (г)
1,75: 2 ? 100 = 87, 5 (%)
Масса хлорида серебра равна: 1,749 ? 143,45 : 108 =2,323 (г).
Задача 2.
В соответствии с продуктами и, сохраняя коэффициенты, восстановите уравнения реакций:1) . … + …. + …. = 3h4PO4 + 5NO
… + …. + …. = 3h4PO4 + 5NO
2) …. + …. = 5KI + KIO3 + 3h3O
3) …. + ….. = 2N2 + K2SO4 + 4h3O
4) …..+ ….. + …. = 4h3 + Na2SiO3
5) …. + …. + …. = K2SO4 + 2MnSO4 + 2h3SO4
Решение
1) 5HNO3 + 3P + 2h3O = 3h4PO4 + 5NO
2) 3I2 + 6KOH = 5KI + KIO3 + 3h3O
3) 2 KNO2 + (Nh5)2SO4 = 2N2 + K2SO4 + 4h3O
4) Sih5 + 2NaOH + h3O = 4h3 + Na2SiO3
5) 2KMnO4 + 5SO2 + 2h3O = K2SO4 + 2MnSO4 + 2h3SO4
Задача 3.
На схеме приведены превращения соединения X:X + O2 ® … + h3O X + CO2 ® … + h3O
X + Na ® … + h3 X + h3S ® …
X + CuO ® N2 + … + …
Предложите X и запишите уравнения осуществленных превращений.
Решение
X = Nh4
4Nh4 + 3O2 = 2N2 + 6h3O или 4Nh4 + 5O2 = 4NO + 6h3O (на платиновом катализаторе)
2Nh4 + 2Na = 2NaNh3 + h3
2Nh4 + 3CuO = N2 + 3Cu + 3h3O
2Nh4 + CO2 = (Nh3)2CO + h3O
Задача 4.
После проведения реакции в смеси двух газов (с исходной плотностью по воздуху 1,048) ее плотность по воздуху увеличилась до 1,310. При пропускании продуктов реакции через раствор гидроксида натрия их объем уменьшается вдвое, а плотность остатка по гелию составляет 8,000.
При пропускании продуктов реакции через раствор гидроксида натрия их объем уменьшается вдвое, а плотность остатка по гелию составляет 8,000.
Определите качественный и количественный состав (в объемных %) исходной газовой смеси и состав смеси после реакции.
Напишите уравнения происходящих реакций.
Решение
Молярная масса остатка составляет 8 ? 4 = 32 (г/моль), что может соответствовать кислороду – O2. Поскольку этот газ составлял ровно половину от продуктов реакции, то для х = мол. масса второго газа имеем (х+32)/2=1,31? 29, откуда х = 1,31? 29? 2 – 32 = 43,98 (г/моль), что может соответствовать газам CO2, N2O, C3H8. Раствором щелочи может поглощаться CO2. Тогда в смеси после реакции могут быть CO2 и O2 – (избыток) (1:1).
2CO + O2 = 2 CO2.
Тогда исходная газовая смесь – CO и O2 в соотношении 2:(1+2=3), или 40% CO и 60 % O2. Состав смеси после реакции : CO2 (50%), O2 (50%).
Реакция поглощения CO2: 2NaOH + CO2 = Na2CO3 + h3O.

Задача 5.
Смесь двух галогенидов калия общей массой 5,00 г растворили в воде. При добавлении к полученному раствору избытка раствора нитрата серебра было получено 8,58 г осадка. Определите, какие галогениды калия могли быть взяты в смеси, качественный состав и возможную окраску осадка.
Решение
Уравнение реакции образования осадка:
KX + AgNO3 = AgX? + KNO3, где X = Cl, Br, I.
Фторид калия осадка не дает, т.к. AgF хорошо растворим в воде (172 г на 100 г воды при 20о С).
Если осадок образован двумя галогенидами можно определить общее количество галогенидов в исходной смеси: n = (8,58 – 5) : (Ar(Ag) – Ar(K)) = 3,58 : (107,868 – 39,098) = 0,0521 (моль), что для индивидуальных галогенидов калия соответствует массе:
KCl – 3,816 (г)
KBr – 6,092 (г)
KI – 8,518 (г)
Т.о. в смеси могли находиться только пары KCl – KBr, KCl – KI (5 г смеси KBr – KI не могли бы дать такую массу осадков галогенидов серебра).
Если в смеси был фторид калия, то с ним в паре мог находиться только хлорид калия, т. к. бромид и иодид калия не могли бы дать такую массу осадка.
к. бромид и иодид калия не могли бы дать такую массу осадка.
Тогда для возможных смесей:
Смесь
Осадок
Окраска
KCl – KBr
AgCl + AgBr
светло–желтая
KCl – KI
AgCl + AgI
Желтая
KF – KCl
Белая
решение задач по химии практической напрвленности | Материал по химии (9 класс) по теме:
“Не для муки, а для науки.”
(Народная мудрость)
Расчеты по уравнениям химических реакций
Классификация химических реакций. Реакции соединения, разложения, замещения, двойного обмена, окислительно-восстановительные реакции. Уравнения химических реакций. Подбор стехиометрических коэффициентов в уравнениях реакций. Расчеты по уравнениям реакций. Определение количества вещества и массы реагентов и продуктов. Определение объема газообразных реагентов и продуктов. Теоретический и практический выход продукта реакции. Степень чистоты химических веществ.
Примеры решения типовых задач
Задача 1. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
BaO + h3SO4 = BaSO4 + h3O
m(BaSO4) = 100 г; M(BaSO4) = 233 г/моль
n(BaO) = ?
n(h3SO4) = ?
В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO4 требуются:
n(BaO) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
n(h3SO4) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Задача 2. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na2CO3, необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Решение. Запишем уравнения реакций и условия задачи в формульном виде:
(1) HCl + NaOH = NaCl + h3O
(2) 2HCl + Na2CO3 = 2NaCl + h3O + CO2
n(HCl) = 0,45 моль; M(NaOH) = 40 г/моль;
M(Na2CO3) = 106 г/моль; VM = 22,4 л/моль (н.у.)
n(NaOH) = ? m(NaOH) = ?
n(Na2CO3) = ? m(Na2CO3) = ?
V(CO2) = ? (н.у.)
Для нейтрализации заданного количества HCl в соответствии с уравнениями реакций (1) и (2) требуется:
n(NaOH) = n(HCl) = 0,45 моль;
m(NaOH) = n(NaOH) . M(NaOH) = 0,45 . 40
[моль . г/моль] = 18 г
n(Na2CO3) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
m(Na2CO3) = n(Na2CO3) / M(Na2CO3) = 0,225 . 106
106
[моль . г/моль] = 23,85 г
Для расчета объема углекислого газа, выделившегося при нейтрализации по реакции (2), дополнительно используется уравнение, связывающие между собой количество газообразного вещества, его объем и молярный объем:
n(CO2) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
V(CO2) = n(CO2) . VM = 0,225 . 22,4 [моль . л/моль] = 5,04 л
Ответ. 18 г NaOH; 23,85 г Na2CO3; 5,04 л CO2
Задача 3. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) – образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
Запишем уравнение реакции и условие задачи в формульном виде:
2HgO = 2Hg + O2
m(HgO) = 108,5 г; M(HgO) = 217 г/моль
VM = 22,4 л/моль (н.у.)
V(O2) = ? (н.у.)
Количество кислорода n(O2), который выделяется при разложении оксида ртути(II), составляет:
n(O2) = 1/2 n(HgO) = 1/2 m(HgO) / M(HgO) = 108,5 / (217 . 2}
[г : (г/моль)] = 0,25 моль,
а его объем при н.у. – V(O2) = n(O2) . VM = 0,25 . 22,4
[моль . л/моль] = 5,6 л
Ответ. 0,25 моль, или 5,6 л (при н.у.) кислорода.
Задача 4. Важнейшая проблема в промышленном производстве удобрений – получение так называемого “связанного азота”. В настоящее время ее решают путем синтеза аммиака из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом процессе, если объем исходного водорода равен 300 л, а практический выход (z) – 43 %?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
N2 + 3h3 = 2Nh4
V(h3) = 300 л; z(Nh4) = 43% = 0,43
V(Nh4) = ? (н. у.)
у.)
Объем аммиака V(Nh4), который можно получить в соответствии с условием задачи, составляет:
V(Nh4)практ = V(Nh4)теор . z(Nh4) = 2/3 . V(h3) . z(Nh4) =
= 2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
3.1. Оконные стекла и дверцы вытяжных шкафов в химической лаборатории часто бывают покрыты белым налетом, состоящим из кристаллов хлорида аммония. Причина этого явления – постоянное присутствие в воздухе лабораторий аммиака и хлороводорода. Рассчитайте количество и объем (при н.у.) этих газов, если образовалось 5 г хлорида аммония.
3.2. Природный газ содержит главным образом метан Ch5, но в нем присутствуют и примеси, например, ядовитый сероводород h3S – до 50 г на 1 кг метана. Чтобы удалить примесь сероводорода, можно провести его окисление перманганатом калия в кислой среде до серы. Рассчитайте количество серы, которую можно таким образом выделить из 1 т природного газа. Определите также, какая масса серной кислоты может быть получена, если всю выделенную серу направить в цех производства h3SO4.
3.3. Толщи известняка на земной поверхности и под землей медленно “размываются” под действием почвенных вод, где растворен диоксид углерода. Какую массу карбоната кальция CaCO3 может перевести в растворимый гидрокарбонат кальция состава Ca(HCO3)2 вода, в которой растворено 10 моль CO2? Практический выход для реакции химического растворения считайте равным 90%.
3.4. Предельно допустимая среднесуточная концентрация монооксида углерода в воздухе составляет 3,0 мг/м3. Простейший газоанализатор, позволяющий определить наличие в воздухе ядовитой примеси СО, содержит белый порошок оксида иода(V), нанесенный на пемзу и помещенный в стеклянную трубочку. При взаимодействии I2O5 c CO идет окислительно-восстановительная реакция с выделением иода, который окрашивает содержимое трубочки в черный цвет. Какое количество монооксида углерода вызовет выделение 0,1 г иода в трубке газоанализатора? Какой объем воздуха (при н.у.), содержащего 3,0 мг/м3 CO, надо будет пропустить через трубку, чтобы в ней выделилось 0,1 г иода?
3. 5. Коррозия железа на воздухе в присутствии большого количества воды приводит к образованию метагидроксида железа состава FeO(OH). Рассчитайте, какая масса железа подверглась коррозии, если количество полученного в результате этого процесса FeO(OH) составило 11,5 моль. Определите также объем (при н.у.) кислорода, участвовавшего в реакции.
5. Коррозия железа на воздухе в присутствии большого количества воды приводит к образованию метагидроксида железа состава FeO(OH). Рассчитайте, какая масса железа подверглась коррозии, если количество полученного в результате этого процесса FeO(OH) составило 11,5 моль. Определите также объем (при н.у.) кислорода, участвовавшего в реакции.
3.6. При выпечке печенья в качестве разрыхлителя теста используют пищевую соду (гидрокарбонат натрия) с добавкой уксусной кислоты. Эта смесь при нагревании разлагается, выделяя углекислый газ. Рассчитайте объем (при н.у.) CO2, который выделится при использовании 1 чайной ложки (5 г) NaHCO3 и избытка Ch4COOH.
3.7. Взаимодействие минерала магнетита (оксида железа состава Fe3O4) с монооксидом углерода CO приводит к получению железа и выделению углекислого газа CO2. В результате реакции было выделено 65,3 кг железа. Рассчитайте практический выход железа, если масса исходного магнетита составляла 110 кг. Определите объем (при н.у.) полученного газа.
3.8. Жженую известь, применяемую в строительстве, получают прокаливанием известняка. Определите массовую долю основного вещества (карбоната кальция) в известняке, если прокаливание его образца массой 5,0 кг привело к выделению 1,0 м3 углекислого газа (при н.у.).
3.9. Карл-Вильгельм Шееле в 1774 году получил кислород термическим разложением перманганата калия KMnO4. Помимо кислорода, при этом получаются оксид марганца(IV) и манганат калия K2MnO4. Кислород, выделенный при разложении 33,5 г перманганата калия, использовали для сжигания серы и при этом получили 2,1 л (при н.у.) диоксида серы SO2. Определите практический выход кислорода при разложении перманганата калия. Рассчитайте массу серы, затраченной на сжигание.
3.10. Разбитый термометр, в котором было 20,5 г ртути, выбросили в пруд. Прошло 4 месяца, и вследствие сложных биохимических процессов около 5% этого опасного металла перешло в раствор в виде солей ртути(II) типа нитрата ртути(II) Hg(NO3)2. Определите количество и массу катионов ртути(II) в пруду. Определите, представляет ли опасность прудовая вода, если объем воды в пруду 80 м3, а санитарная норма предусматривает содержание не более чем 0,01 г Hg2+ в 1 м3.
Определите, представляет ли опасность прудовая вода, если объем воды в пруду 80 м3, а санитарная норма предусматривает содержание не более чем 0,01 г Hg2+ в 1 м3.
3.11. Для обеззараживания воды ее часто хлорируют. При этом неизбежна утечка ядовитого газа в атмосферу. Чтобы удалить хлор из вентиляционного воздуха, используют “антихлор” – увлажненный сульфит натрия Na2SO3. Какая масса сульфита натрия потребуется для поглощения всего хлора из 5000 м3 воздуха, если содержание в нем Cl2 в 10 раз превышает среднесуточное предельно допустимое и составляет 0,3 мг/м3?
3.12. Рассчитайте объем (при н.у.) хлора, который идет на обеззараживание 10 м3 воды, если на каждый литр воды расходуется 0,002 мг хлора. Напишите уравнение реакции взаимодействия хлора с водой и поясните, на чем основано его обеззараживающее действие.
3.13. При сильных отравлениях белым фосфором пострадавшему назначают прием очень разбавленного раствора сульфата меди(II). Процессы, протекающие в организме больного, сводятся к окислительно-восстановительной реакции фосфора с катионами меди(II) с выделением металлической меди и образованием относительно безвредных количеств ортофосфорной и серной кислоты. Какое количество и массу сульфата меди(II) должен получить пострадавший для полного окисления 0,1 мг фосфора, если считать выход этого процесса 100%-ным?
Какое количество и массу сульфата меди(II) должен получить пострадавший для полного окисления 0,1 мг фосфора, если считать выход этого процесса 100%-ным?
3.14. Пролитую ртуть можно собрать с помощью медной проволоки, алюминиевой фольги и даже листом бумаги, но во всех этих случаях собранную ртуть нужно обезвредить (например, обработать концентрированной азотной кислотой). Какое количество HNO3 потребуется для обезвреживания 19,5 г ртути, собранной на полу после того, как в доме был разбит термометр? Каков объем выделяющегося при этом газа (при н.у.)? Если ртуть была собрана не полностью, рекомендуют обработать трещины и щели пола и другие “подозрительные” места в комнате порошком серы. Напишите уравнение реакции, протекающей с участием ртути и серы.
3.15. Оксид диазота (“веселящий газ”), обладающий слабонаркотическим действием был открыт английским химиком Гемфри Дэви в начале XIX века. Для получения N2O Дэви использовал реакцию термического разложения нитрата аммония. При этом, помимо основных продуктов разложения, образуются и другие газы (например, NO и NO2). Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна 11,5 г, а объем полученного N2O – 2,1 л (при н.у.).
Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна 11,5 г, а объем полученного N2O – 2,1 л (при н.у.).
3.16. Установлено, что для очистки газовых выбросов от диоксида азота применяется карбонат натрия, который при взаимодействии с NO2 дает нитрат натрия, нитрит натрия и углекислый газ. Рассчитайте массу карбоната натрия, который обезвреживает выбросы, содержащие 5 л диоксида азота (при н.у.).
3.17. Органические вещества растений образуются из углекислого газа, присутствующего в воздухе, и воды, поступающей из почвы. В зеленых листьях растений эти неорганические вещества превращаются в органическое вещество глюкозу C6h22O6. Этот процесс сопровождается выделением кислорода. Рассчитайте, какой объем кислорода (при н.у.) выделяется в атмосферу зелеными растениями при образовании 1 кг глюкозы.
3.18. Сжигая органическое топливо, человечество ежегодно отправляет в атмосферу 12 млн. т оксида азота(II) NO. Какую массу азотной кислоты можно было бы получить из всего этого количества NO при условии, что практический выход составит 80%?
3. 19. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы обеспечить годовую потребность одного автомобиля?
19. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы обеспечить годовую потребность одного автомобиля?
3.20. Известно, что сероводород, циркулируя в биосфере, может окисляться под действием аэробных бактерий до свободной серы. Именно это, как полагают геохимики, было причиной возникновения залежей самородной серы. Рассчитайте, какой объем (при н.у.) сероводорода был поглощен и переработан бактериями, если образовалось 450 т серы.
Ответы
3.1. 0,093 моль (2,09 л) Nh4 и 0,093 моль (2,09 л) HCl
3.2. 50 кг серы и 153 кг h3SO4
3.3. 900 г CaCO3
3.4. 0,0020 моль CO; 18 м3 воздуха
3.5. 644 г железа,193,2 л O2
3.6. 1,33 л CO2
3.7. Практический выход 82%
3.8. 0,893, или 89,3% карбоната кальция в известняке
3.9. Практический выход 88,4%, масса серы 3,0 г
3.10. 0,051 моль (1,025 г) Hg2+; вода опасна для здоровья, так как в ней содержится 0,013 г/м3 Hg2+ (выше нормы)
3. 11. 2,66 г Na2SO3
11. 2,66 г Na2SO3
3.12. 6,3 мл Cl2
3.13. 8,01 . 10–6 моль; 1,29 мг CuSO4
3.14. 0,39 моль HNO3; 4,35 л NO2
3.15. Практический выход 65,2%
3.16. 11,8 кг Na2CO3
3.17. 746,7 л кислорода
3.18. 20,2 млн.т азотной кислоты
3.19. 54,1 т HgO
3.20. 315000 м3 h3S (при н.у.)
Решение задач – Сайт учителя химии Кондратенко О.В.
Решение задач по химии. Примеры решений задач по химии выпускных экзаменов, вступительных экзаменов, олимпиад, контрольных и т.д.
1001 задача по химии с ответами, указаниями, решениями. Слета Л.А., Черный А.В., Холин Ю.В. (2005, 368с.) 2500 задач по химии с решениями для поступающих в вузы. Кузьменко Н.Е., Еремин В.В. (2007, 640с.) 700 задач по химии с примерами решений для старшеклассников и абитуриентов. Алгоритмы выполнения заданий по общей и неорганической химии. Грибанова О.В. (2013, 62с.) Введение в математическую химию. Практикум к элективному курсу для 9 класса. Перегудов А.В. (2013, 64с.) Вступительные экзамены и олимпиады по химии. Опыт МГУ. Кузьменко Н.Е., Теренин В.И. и др. (2011, 624с.) Вся химия в 50 таблицах. Стахеев А.Ю. (1998, 64с.) Задачи по химии. Будруджак П., пер. с рум. (1989, 343с.) Задачи по химии и способы их решения. 8-9 классы. Габриелян О.С., Решетов П.В., Остроумов И.Г. (2004, 160с.) Занимательные задания и эффектные опыты по химии. Степин Б.Д., Аликберова Л.Ю. (2002, 432с.) Карманный справочник по химии. Сечко О. Краткий курс химии. Пособие для поступающих в вузы. Кузьменко Н.Е., Еремин В.В., Попков В.А. (2002, 415с.) Краткий химический справочник. Рабинович В.А., Хавин З.Я. (1991, 432с.) Методика решения задач по химии. Абкин Г.Л. (1971, 200с.) Методика решения задач по химии. Ерыгин Д.П., Шишкин Е.А. (1989, 176с.) Начала современной химии. Рэмсден Э.Н., пер. с англ. (1989, 784с.) Начала химии. Современный курс для поступающих в вузы. В 2-х т. Кузьменко Н.Е, Еремин В.В., Попков В.А. (2002, 768с.) Новый справочник по химии для школьников и абитуриентов. Гузей Л.С., Кузнецов В.Н. (1999, 354с.) Общая и неорганическая химия. Коренев Ю.М., Овчаренко В.П. (2000, 144с. Общая и неорганическая химия. Базовый курс. Варламова Т.М., Кракова А.И. (2001, 288с.) Общая химия. Глинка Н.Л. (1985, 702с.) Общая химия в формулах, определениях, схемах. Шиманович И.Е. и др. (1996, 528с.) Пособие по химии. Под ред. Зеленина К.Н., Сергутиной В.В, Солода О.В. (2000, 256с.) Пособие по химии для поступающих в вузы. Пузаков С.А., Попков В.А. (2005, 623с.) Пособие по химии для поступающих в вузы. Хомченко Г.П. (2002, 480с.) Репетитор по химии. Белов Н.В. (2011, 768с.) Репетитор по химии. Под ред. Егорова А.С. (2010, 762с.) Решение задач по химии. Белавин И.Ю. (2006, 205с.) Решение задач по химии. Решение задач по химии. Справочник школьника. Сост.Берман Н.И. (1997, 578с.) Самоучитель. Неорганическая химия. Френкель Е.Н. (2018, 320с.) Самоучитель. Органическая химия. Френкель Е.Н. (2018, 414с.) Сборник задач и упражнений по химии для школьников и абитуриентов. Кузьменко Н.Е., Еремин В.В. (2001, 544с.) Сборник задач и упражнений по химии с решением типовых и усложненных задач. Лебедева М.И., Анкудимова И.А. (2002, 166с.) Сборник задач и упражнений по химии. Школьный курс. Еремин В.В., Кузьменко Н.Е. (2005, 528с.) Сборник задач по органической химии с решениями. Губанова Ю.К. (1999, 112с.) Сборник задач по химии для поступающих в вузы. Хомченко Г.П., Хомченко И. Сборник задач по химии с решениями. 8-11 классы. Кузьменко Н.Е., Еремин В.В. (2003, 640с.) Сборник конкурсных задач по химии. Кузьменко Н.Е., Еремин В.В., Чуранов С.С. (2001, 576с.) Составление химических уравнений. Кудрявцев А.А. (1968, 359с.) Справочник по элементарной химии. Под ред. Пилипенко А.Т. (1977, 544с.) Таблицы-схемы по неорганической химии. Турова Н.Я. (2009, 48с.) Теоретическая и математическая химия для школьников. Еремин В.В. (2007, 392с.) Типы химических задач и способы их решения. 8-11 классы. Новошинский И.И., Новошинская Н.С. (2005, 176с.) Тренажер по химии. Врублевский А.И. (2009, 656с.) Учимся решать задачи по химии. Учись решать задачи по химии. Магдесиева Н.Н., Кузьменко Н.Е. (1986, 160с.) Химические уравнения. Тренажер для подготовки к ОГЭ. Зыкова Е.В. (2019, 191с.) Химия. 2400 задач для школьников и поступающих в вузы. Кузьменко Н.Е., Еремин В.В. (1999, 560с.) Химия. Алгоритмы решения задач. Тесты. Олейников Н.Н., Муравьева Г.П. (2014, 248с.) Химия в задачах для поступающих в вузы. Литвинова Т.Н. и др. (2009, 832с.) Химия. Для школьников старших классов и поступающих в вузы. Лидин Р.А., Молочко В.А., Андреева Л.Л. (2001, 576с.) Химия. Для школьников старших классов и поступающих в вузы. Кузьменко Н.Е., Еремин В.В., Попков В.А. (2008, 480с.) Химия за 24 часа. Химия. Пособие-репетитор для поступающих в вузы. Под ред. А.С. Егорова. (2003, 768с.) Химия. Пособие для поступающих в вуз. Семенов И.Н. (1989, 224с.) Химия. Пособие для поступающих в вузы. Максименко О.О. (2003, 638с.) Химия. Решение задач. Хасанов А.Е. (1999, 448с.) Химия. Самоучитель. Френкель Е.Н. (2017, 351с.) Химия: сборник основных формул. Савинкина Е.В., Логинова Г.П. (2013, 96с.) Химия. Серия “Эрудит” (2007, 192с.) Химия. Современный курс для подготовки к ЕГЭ. Егоров А.С. (2013, 700с.) Химия. Справочник школьника. Сост. Кременчугская М., Васильев С. (1997, 480с.) Химия. Химия. Формулы успеха на вступительных экзаменах. Кузьменко Н.Е., Теренин В.И., Рыжова О.Н. и др. (2006, 377с.) Школьный справочник по химии. Копылова Н.А. (2015, 240с.) Шпаргалка по химии. Копылова Н.А. (2012, 94с.) Шпаргалки по химии. Соколов Д.И. (2007, 80с.) Шпаргалки по химии. Черникова Л.П. (2003, 144с.) Энциклопедический словарь юного химика. Сост. Крицман В.А., Станцо В.В. (1990, 320с.) Энциклопедия для детей. Том 17. Химия. (2000, 640с.) Занимательная химия. 8-11 классы. В 2-х ч. Леенсон И.А. (1996, 400с.) Занимательные задания и эффектные опыты по химии. |
Материя в нашем окружении Класс 9 Наука Глава 1 (Все виды деятельности)
Материя в нашем окружении Класс 9 Все действия — Здесь я рассмотрел все важные моменты или все обо всех действиях Главы 1 Материя в нашем окружении.
Щелкните здесь: Решения NCERT Класс 9 Наука Глава 1 Материя в нашем окружении.
Материя в нашем окружении, класс 9 (ЗАДАНИЕ 1.1)
- Возьмите химический стакан на 100 мл.
- Наполните стакан водой наполовину и отметьте уровень воды.
- Растворите немного соли/сахара с помощью стеклянной палочки.
- Следите за любым изменением уровня воды.
- Как вы думаете, что случилось с солью?
- Куда исчезает?
- Уровень воды меняется?
Как вы думаете, что случилось с
соль?
- Соль полностью растворена.

Куда исчезает?
- Диффундирует в воду.
Уровень воды меняется?
- Уровень воды не изменяется при растворении соли в воде, так как частицы соли диссоциируют и занимают межмолекулярные пространства между частицами воды.
- Поскольку заняты только пустые места, уровень воды не повышается.
Материя 9 класса в нашем окружении (ЗАДАНИЕ 1.2)
- Возьмите 2-3 кристалла калия перманганата и растворите их в 100 мл воды.
- Возьмите примерно 10 мл этого раствора и поместите его в 90 мл чистой воды.
• Возьмите 10 мл этого раствора и добавьте еще 90 мл чистой воды.
• Продолжайте разбавлять раствор таким образом от 5 до 8 раз.
• Вода все еще окрашена?
В операции 1.2 перманганат калия растворяется в воде, и после дальнейшего разбавления раствор становится светлее.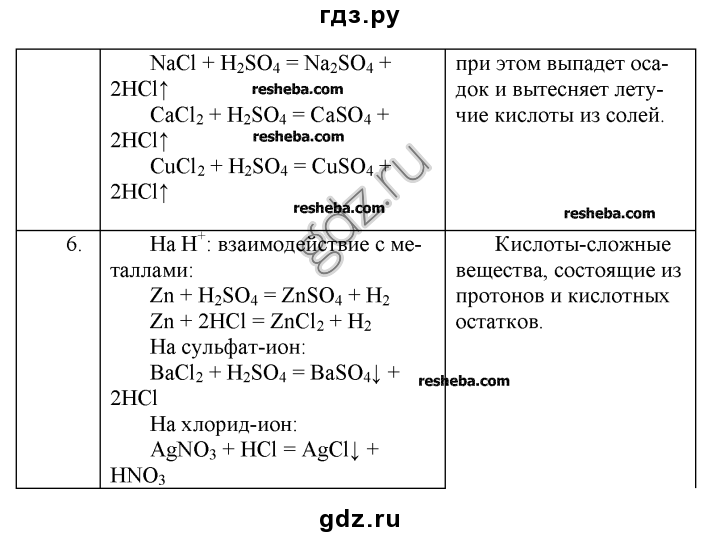 Даже после 8-кратного разбавления цвет все еще виден, что показывает, насколько мала частица.
Даже после 8-кратного разбавления цвет все еще виден, что показывает, насколько мала частица.
Итак, эта активность показывает, насколько малы эти частицы материи?
Вода все еще окрашена?
- Да, вода все еще окрашена, но при каждом разбавлении цвет становится светлее, она все еще видна.
ЗАКЛЮЧЕНИЕ
- Этот эксперимент показывает, что только в одном кристалле перманганата калия должны быть миллионы крошечных частиц, которые продолжают делиться на все более мелкие частицы.
- То же действие можно выполнить, используя 2 мл Деттола вместо перманганата калия. Мелкие можно обнаружить даже при повторном разведении.
Класс 9 Материя в нашем окружении (ЗАДАНИЕ 1.3)
- Положите незажженную ароматическую палочку в угол своего класса. Насколько близко нужно подойти к нему, чтобы почувствовать его запах?
• Теперь зажгите ароматическую палочку. Что происходит? Вы чувствуете запах сидя на расстоянии?
Что происходит? Вы чувствуете запах сидя на расстоянии?
• Запишите свои наблюдения.
Здесь происходит распространение.
Что такое диффузия?
Самостоятельное перемешивание частиц двух разных видов материи называется диффузией. ( ये तो हो गयी книга Ки определение ).
Распространение — это естественное явление, которое никогда не прекращается. В нашей повседневной жизни, Распространение во многих местах. Мы добавляем сахар в воду, чтобы сделать чай или соки; здесь молекула сахара диффундирует в воду посредством диффузии. Растение производит кислород; этот кислород диффундирует в воздух, и мы получаем кислород для дыхания.
Что происходит ? Вы чувствуете запах, сидя на расстоянии?
- Запах ароматической палочки распространился по всему классу. Да, мы чувствуем запах, сидя на расстоянии.
Материя в нашем окружении, класс 9 (ЗАДАНИЕ 1.
 4)
4)- Возьмите два стакана/меню, наполненных водой.
- Медленно и осторожно нанесите каплю синих или красных чернил вдоль стенок первой мензурки и таким же образом меда во вторую мензурку.
- Оставьте их в покое у себя дома или в углу класса.
- Запишите свои наблюдения.
- Что вы наблюдаете сразу после добавления капли чернил?
- Что вы наблюдаете сразу после добавления капли меда?
- Сколько часов или дней требуется, чтобы цвет чернил равномерно распространился по воде?
Что вы наблюдаете сразу после добавления капли чернил?
- Частицы чернил постепенно переходят во все количество воды и затем смешиваются с водой. (происходит диффузия).
Что вы наблюдаете сразу после добавления капли меда?
- После добавления капли меда наблюдаем, что он не смешивается и уходит на дно воды.

Сколько часов или дней требуется, чтобы цвет чернил равномерно распространился по воде?
- Требуется около часа, чтобы чернила распространились по воде.
Класс 9 Материя в нашем окружении (ЗАДАНИЕ 1.5)
- Бросьте кристалл сульфата меди или перманганата калия в стакан с горячей водой и другой стакан с холодной водой . Не перемешивайте раствор. Дайте кристаллам осесть на дно.
- Что вы видите прямо над твердым кристаллом в стакане?
- Что происходит со временем?
- Что это говорит о твердых и жидких частицах?
- Изменяется ли скорость перемешивания в зависимости от температуры? Почему и как?
Что вы видите прямо над твердым кристаллом в стекле?
- Твердые кристаллы начинают перемешиваться в воде в виде нитевидных структур.

- В холодной воде нитевидная структура возникает медленнее, чем в горячей воде.
Что происходит со временем?
- Со временем кристалл растворяется в горячей и холодной воде.
- Но растворение кристалла в холодной воде занимает больше времени, чем в горячей.
Что это говорит о твердых и жидких частицах?
- Это предполагает, что материя состоит из мельчайших частиц, и эти частицы постоянно находятся в движении.
Изменяется ли скорость перемешивания в зависимости от температуры? Почему и как?
- Скорость смешивания увеличивается с повышением температуры. Это связано с тем, что частицы вещества от тепла получают больше кинетической энергии и начинают двигаться быстрее.
Это происходит потому, что:
- Чернила имеют примерно равную или немного большую плотность, чем плотность воды. Итак, чернила сразу начали смешиваться с водой, потому что частицы материи находятся в постоянном движении.

- Плотность мёда выше, чем у воды, поэтому мёд начал устремляться ко дну.
Вопрос : При нагревании диффузия ускоряется. Почему это происходит?
Ответ: При нагревании диффузия ускоряется, потому что увеличивается кинетическая энергия и частицы начинают двигаться с большой скоростью. Частицы вещества быстро проникают внутрь или между частицами друг друга.
(Итак, вывод – при нагревании скорость диффузии увеличивается).
ЗАКЛЮЧЕНИЕ
- Частицы вещества непрерывно движутся, т.е. они обладают кинетической энергией.
- При повышении температуры частицы движутся быстрее.
- При повышении температуры кинетическая энергия частиц также увеличивается.
- Самостоятельное перемешивание частиц двух различных видов материи называется диффузией.
- При нагревании диффузия ускоряется.
Материя 9 класса в нашем окружении (ЗАДАНИЕ 1.6)
- Сыграйте в эту игру в полевых условиях — разделитесь на четыре группы и сформируйте цепочки из людей, как предлагается:
- Первая группа должна держать друг друга сзади и сцепить руки, как танцоры Иду-Мишми.

- Вторая группа должна взяться за руки, образуя живую цепочку.
- Третья группа должна образовать цепочку, касаясь друг друга только кончиками пальцев.
- Теперь четвертая группа учеников должна побегать и попытаться разорвать три человеческие цепи одну за другой на как можно больше маленьких групп.
- Какую группу было легче всего взломать? Почему?
Объяснение :
- Как мы видим, группу (1) труднее всего сломать.
- Если вы видели молекулы группы (1) (2) и (3), то эти молекулы присоединяются к другим молекулам силой притяжения. Эта сила притяжения удерживает их вместе.
Какую группу было легче всего взломать? Почему?
- Группу (3) легче всего сломать, потому что сила притяжения между пальцами намного меньше по сравнению с группой (1) и группой (2).
Материя в нашем окружении, класс 9 (ЗАДАНИЕ 1.7)
- Возьмите железный гвоздь, кусок мела и резиновую ленту.

- Попробуйте сломать их, ударяя молотком, разрезая или растягивая.
- Как вы думаете, в каком из трех перечисленных веществ частицы удерживаются вместе с большей силой?
Как вы думаете, в каком из этих трех веществ частицы удерживаются вместе с большей силой?
- Забивание железного гвоздя не ломает гвоздь, а выравнивает его поверхность.
- Стук мела ломает мелки, дайте нам механический мел.
- Мы можем растянуть резиновую ленту в большую сторону без разрыва.
- Все вышеприведенные объяснения ясно говорят о том, что частицы железного гвоздя удерживаются вместе с большей силой.
Материя в нашем окружении, класс 9 (ЗАДАНИЕ 1.8)
- Набери немного воды в контейнере, попробуй порезать пальцами поверхность воды.
- Вам удалось разрезать поверхность воды?
- Что может быть причиной того, что поверхность воды остается целой?
- Мы можем легко перерезать воду пальцем.
 Вода снова соединяется, как только мы убираем палец.
Вода снова соединяется, как только мы убираем палец. - (Вода обладает меньшей силой притяжения, чем твердые тела, поэтому мы можем легко провести по ней пальцем)
- Как только мы переместим палец, вода снова займет то же место.
- Аналогичный процесс происходит и с воздухом, здесь молекулы воздуха аналогичным образом занимают пустые места.
ЗАКЛЮЧЕНИЕ
- Из приведенных выше трех действий (1.6, 1.7 и 1.8) видно, что между частицами материи действует сила.
- Эта сила удерживает частицы вместе.
- Сила этой силы притяжения варьируется от одного вида материи к другому.
Класс 9 Материя в нашем окружении (ЗАДАНИЕ 1.9)
- Соберите следующие предметы: ручку, книгу, иголку и кусок деревянной палочки.
- Нарисуйте форму вышеуказанных предметов в своем блокноте, водя по ним карандашом.
- Имеют ли все они определенную форму, четкие границы и фиксированный объем?
- Что произойдет, если их ударить, потянуть или уронить?
- Способны ли они диффундировать друг в друга?
- Попробуйте сжать их, применив силу.
 Умеете ли вы их сжимать?
Умеете ли вы их сжимать?
Имеют ли все они определенную форму, четкие границы и фиксированный объем?
- Да, они имеют фиксированную форму и объем.
Что произойдет, если их ударить, потянуть или уронить?
- Если их забить или потянуть, они способны сломаться.
Способны ли они диффундировать друг в друга?
- Нет, твердые вещества не способны диффундировать друг в друга, но они способны диффундировать с жидкостью. (например, таблетки растворяются в воде)
Попробуйте сжать их, применив силу. Умеете ли вы их сжимать?
- Нет, их невозможно сжать, потому что твердые тела не имеют пространства между частицами, но в случае губки, т.е. легко сжимаются (они являются некоторыми исключениями).
- Все приведенные выше примеры являются твердыми.
- Все они имеют определенную форму, четкие границы и фиксированные объемы, т.
 е. имеют пренебрежимо малую сжимаемость.
е. имеют пренебрежимо малую сжимаемость. - Твердые тела имеют тенденцию сохранять свою форму под воздействием внешней силы.
- Твердые тела могут разрушиться под действием силы, но изменить их форму трудно. Поэтому они жесткие.
Материя в нашем окружении, класс 9 (ЗАДАНИЕ 1.10)
- Соберите следующее:
(a) вода, растительное масло, молоко, сок, холодный напиток.
(б) контейнеры различной формы. Поставьте отметку 50 мл на этих контейнерах с помощью мерного цилиндра из лаборатории. - Что произойдет, если эти жидкости прольются на пол?
- Отмерьте 50 мл любой жидкости и перелейте их в разные контейнеры один за другим. Объем остался прежним?
- Остается ли форма жидкости прежней?
- Когда вы переливаете жидкость из одной емкости в другую, легко ли она течет?
Что произойдет, если эти жидкости прольются на пол?
- Когда жидкость проливается на муку.
 Он полностью потерял свою форму.
Он полностью потерял свою форму.
Отмерьте 50 мл любой жидкости и по очереди перелейте их в разные емкости. Объем остался прежним?
- Да, объем остается прежним.
Остается ли форма жидкости прежней?
- Однако форма жидкости меняется в зависимости от конструкции контейнера. Таким образом, форма жидкости не остается прежней.
- Да, легко течет при переносе в другой контейнер.
Решения NCERT для науки класса 9
- Решения НЦЭРТ
- Класс 9
- Наука
Решения NCERT считаются чрезвычайно полезным ресурсом для подготовки к экзаменам. Meritnation.com предоставляет своим пользователям доступ к огромному количеству вопросов NCERT и их решений. Решения CBSE Class 9 Science NCERT созданы экспертами в данной области, поэтому они обязательно подготовят студентов к хорошим результатам. Вопросы, представленные в книгах NCERT, подготовлены в соответствии с CBSE, поэтому у них больше шансов появиться в вопросниках CBSE. Эти решения NCERT не только для класса 9Естествознание укрепляет основу учащихся в предмете, но также дает им возможность легко решать различные типы вопросов.
Meritnation.com предоставляет своим пользователям доступ к огромному количеству вопросов NCERT и их решений. Решения CBSE Class 9 Science NCERT созданы экспертами в данной области, поэтому они обязательно подготовят студентов к хорошим результатам. Вопросы, представленные в книгах NCERT, подготовлены в соответствии с CBSE, поэтому у них больше шансов появиться в вопросниках CBSE. Эти решения NCERT не только для класса 9Естествознание укрепляет основу учащихся в предмете, но также дает им возможность легко решать различные типы вопросов.
Наши учебники по естественным наукам для 9 класса дают учащимся преимущество при решении практических вопросов. Эти решения для учебников помогают учащимся на экзаменах, а также в выполнении повседневных домашних заданий. Включенные решения просты для понимания, и каждый шаг в решении описан так, чтобы соответствовать пониманию учащихся.
- Решения NCERT для класса 9Наука Глава 1. Материя в нашем окружении
Наука NCERT, класс 9, глава 1, Материя в нашем окружении касается основных понятий, которые потребуются учащимся для получения знаний по этому вопросу.
 В главе обсуждаются важные физических свойства материи . Глава Материя в нашем окружении вращается вокруг частиц, образующих материю, и свойств таких частиц.
В главе обсуждаются важные физических свойства материи . Глава Материя в нашем окружении вращается вокруг частиц, образующих материю, и свойств таких частиц.
Физическая природа материи и характеристики частиц вместе с подробным обсуждением трех состояний материи: 9В этой главе рассматривается 0003 твердое, жидкое и газообразное состояние . В главу также включены понятие испарения и факторы, влияющие на испарение. Каждый раздел дополнен многочисленными определениями, примерами, заданиями и изображениями, что делает его более увлекательным. Глава Материя в нашем окружении заканчивается кратким изложением вместе с набором упражнений, упомянутых в конце главы, чтобы проверить концептуальное понимание. - Решения NCERT для науки класса 9 Глава 2 – Является ли материя вокруг нас чистой
Наука NCERT 9 класс, глава 2, Является ли материя вокруг нас чистой? имеет дело с основными понятиями, связанными с материей.
 Подробная информация о смеси и растворах представлена в главе с помощью примеров из повседневной жизни. Также включены определения терминов смеси и растворов . Различные процессы, вовлеченные в разделения компонентов смеси объясняются всесторонне.
Подробная информация о смеси и растворах представлена в главе с помощью примеров из повседневной жизни. Также включены определения терминов смеси и растворов . Различные процессы, вовлеченные в разделения компонентов смеси объясняются всесторонне.
Концепция физических и химических изменений также рассматривается в главе Чиста ли окружающая нас материя? Кроме того, чистых вещества объясняются с помощью примеров. Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы , Чиста ли материя вокруг нас? выполняется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, за которыми следует групповое задание, проверяет концептуальное понимание главы Чиста ли материя вокруг нас? - Решения NCERT для науки класса 9 Глава 3 — Атомы и молекулы
Естествознание NCERT, класс 9, глава 3, Атомы и молекулы дает представление о концепциях, связанных с атомами и их молекулами .
 Эта глава проливает свет на концепции l законов химических соединений, атомную теорию Дальтона, символы атомов и атомную массу . Кроме того, он охватывает обсуждение процедуры написания химических формул с использованием символов и валентности элементов . Особое внимание уделяется концепции молекулярная масса и моль концепция . Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений.
Эта глава проливает свет на концепции l законов химических соединений, атомную теорию Дальтона, символы атомов и атомную массу . Кроме того, он охватывает обсуждение процедуры написания химических формул с использованием символов и валентности элементов . Особое внимание уделяется концепции молекулярная масса и моль концепция . Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений.
Тематическая оценка главы Атомы и молекулы осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Атомы и молекулы. - NCERT Solutions for Class 9 Science Chapter 4 — Structure of the Atom
Естествознание NCERT, класс 9, глава 4, Структура атома немного глубже раскрывает концепцию атома, изученную в предыдущей главе Атомы и молекулы.
 Акцент делается на субатомных частицах атома- электронов, протонов и нейтронов. Подробно объясняются три модели атомов вместе с их постулатами, диаграммой и недостатками:
Акцент делается на субатомных частицах атома- электронов, протонов и нейтронов. Подробно объясняются три модели атомов вместе с их постулатами, диаграммой и недостатками:- Модель атома Томсона
- Резерфордовская модель атома
- Боровская модель атома
атомная структура и валентность первых восемнадцати элементов представлены в главе. Понимание каждой темы главы «Структура атома» упрощается за счет добавления примеров, действий и диаграмм. В дополнение к этому, тематическая оценка понимания осуществляется с помощью вопросов, представленных в конце каждой темы. Резюме всех важных моментов главы, Структура атома приводится в конце, за которым следует набор упражнений, проверяющих общее понимание концепций, упомянутых в главе.
- NCERT Solutions for Class 9 Science Chapter 5 — Фундаментальная единица жизни
Наука NCERT, класс 9, глава 5, Фундаментальная единица жизни посвящена основным понятиям, которые потребуются учащимся для получения знаний о ячейка – фундаментальная единица жизни.
 В главе основное внимание уделяется характеристикам клетки, основанным на ее характеристиках, таких как форма, размер и функции . Кроме того, подробно рассматривается структурная организация ячейки . Важные части клетки, такие как плазматическая мембрана, ядро, клеточная стенка, цитоплазма и т. д., обсуждаются с помощью подходящих диаграмм вместе с клеточными органеллами .
В главе основное внимание уделяется характеристикам клетки, основанным на ее характеристиках, таких как форма, размер и функции . Кроме того, подробно рассматривается структурная организация ячейки . Важные части клетки, такие как плазматическая мембрана, ядро, клеточная стенка, цитоплазма и т. д., обсуждаются с помощью подходящих диаграмм вместе с клеточными органеллами .Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы «Фундаментальная единица жизни» осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы «Фундаментальная единица жизни» делается в конце. Набор упражнений, состоящий из различных вопросов, за которыми следует групповая деятельность, проверяет концептуальное понимание главы.
- Решения NCERT для научного класса 9 Глава 6 — Ткани
Наука NCERT, класс 9, глава 6, Ткани подробно описывает основы, связанные с тканями организма .
 В этой главе рассматриваются структура и функции важных тканей. Важные понятия, относящиеся к растительным тканям и животным тканям , рассматриваются отдельно в главе 9.0003 Ткани . Растительные ткани делятся на две категории: меристематические ткани и постоянные ткани .
В этой главе рассматриваются структура и функции важных тканей. Важные понятия, относящиеся к растительным тканям и животным тканям , рассматриваются отдельно в главе 9.0003 Ткани . Растительные ткани делятся на две категории: меристематические ткани и постоянные ткани .Аналогично, ткани животных делятся на различные типы, такие как (A) E Pithelial Ткани (B) Connective Ткани (C) Мышечные Ткани (D) Neversous ткани . Понимание каждой темы упрощается за счет добавления примеров, действий и диаграмм. В дополнение к этому, тематическая оценка понимания осуществляется с помощью вопросов, представленных в конце каждой темы.
Резюме всех важных моментов главы, Ткани приведены в конце, после чего следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе.
- Решения NCERT для науки класса 9 Глава 7 — Разнообразие живых организмов
Наука NCERT 9, глава 7, Разнообразие живых организмов знакомит учащихся с огромным разнообразием живых организмов, присутствующих на этой планете. Иерархическая классификация организмов по различным царствам всесторонне обсуждается в главе. Основное внимание уделяется классификации 5 царств Уиттакера , которая включает: Monera, Protozoa, Fungi, Plantae, Animalia. Подробно описаны подклассы царств растений и животных вместе с подходящими примерами. Концепция номенклатура организмов также объясняется в главе Разнообразие живых организмов .
Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы «Многообразие живых организмов» делается в конце. Набор упражнений, состоящий из различных вопросов, за которыми следует групповая деятельность, проверяет концептуальное понимание главы.
Тематическая оценка главы осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы «Многообразие живых организмов» делается в конце. Набор упражнений, состоящий из различных вопросов, за которыми следует групповая деятельность, проверяет концептуальное понимание главы. - Решения NCERT для науки класса 9 Глава 8 — Движение
Наука NCERT 9 класс, глава 8, Движение касается всех основных понятий, связанных с движением объекта. Особое внимание уделяется таким понятиям, как расстояние и перемещение, равномерное и неравномерное движение, скорость и скорость и ускорение . Помимо этого, графическое представление движения и уравнения движения также учитываются в главе Motion . Понимание каждой темы главы «Движение» упрощается за счет добавления примеров, действий и диаграмм.

В дополнение к этому проводится тематическая оценка понимания с помощью вопросов, представленных в конце каждой темы. Резюме всех важных моментов главы, Предложение , представлено в конце, за которым следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе. - NCERT Solutions for Class 9 Science Chapter 9 — Force and Laws of Motion
Наука NCERT 9 класс, глава 9, Сила и законы движения касается основных понятий, которые потребуются учащимся для получения знаний о силе и законах, управляющих различными аспектами объекта под влиянием силы. В главе особое внимание уделяется таким понятиям, как Сбалансированные и несбалансированные Силы , Закон Движения или Закон Инерции , Второй закон из Motion и третий из Motion и третий из Motion и третья .
 из движение . Все три закона объясняются с помощью примеров вместе с их применением в повседневной жизни. Он также охватывает концепцию сохранения из импульс .
из движение . Все три закона объясняются с помощью примеров вместе с их применением в повседневной жизни. Он также охватывает концепцию сохранения из импульс .
Вышеупомянутые темы подробно объясняются с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы Сила и законы движения осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Сила и законы движения. - Решения NCERT для науки класса 9 Глава 10 — Гравитация
Наука NCERT Класс 9, Глава 10, Гравитация касается основных основ, связанных с силой гравитации .
 В этой главе подробно объясняются различные аспекты, связанные с гравитацией. Такие понятия, как универсальный закон гравитации , центростремительной силы , Ньютона ‘ с обратного квадратного закона объясняются подробно. Помимо этого, глава Гравитация состоит из таких понятий, как свободное падение , ускорение до гравитация , масса и инерция.
В этой главе подробно объясняются различные аспекты, связанные с гравитацией. Такие понятия, как универсальный закон гравитации , центростремительной силы , Ньютона ‘ с обратного квадратного закона объясняются подробно. Помимо этого, глава Гравитация состоит из таких понятий, как свободное падение , ускорение до гравитация , масса и инерция.
В главе Гравитация также обсуждается принцип Архимеда и концепция плавучести и относительная плотность . Понимание каждой темы главы Gravitation упрощается за счет добавления примеров, действий и диаграмм. В дополнение к этому, тематическая оценка понимания осуществляется с помощью вопросов, представленных в конце каждой темы. Резюме всех важных моментов главы, Гравитация приводится в конце, за которым следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе.
Резюме всех важных моментов главы, Гравитация приводится в конце, за которым следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе. - NCERT Solutions for Class 9 Science Chapter 11 — Work and Energy
Естествознание NCERT, класс 9, глава 11, «Работа и энергия», включает частичное объяснение понятий, связанных с работой и энергией. В главе основное внимание уделяется таким понятиям, как работа , научная концепция работы и работа, выполняемая постоянной силой. Кроме того, акцент делается на такие понятия энергии, как формы энергии, кинетическая энергия, потенциальная энергия и потенциальная энергия объекта на высоте. Закон сохранения энергии также изложен в главе. Понимание каждой темы главы Работа и энергия упрощается за счет добавления примеров, действий и диаграмм.

В дополнение к этому проводится тематическая оценка понимания с помощью вопросов, представленных в конце каждой темы. Краткое изложение всех важных моментов главы, Работа и энергия приводится в конце, за которым следует набор упражнений, проверяющих общее понимание понятий, упомянутых в главе. - NCERT Solutions for Class 9 Science Chapter 12 — Sound
Наука NCERT 9 класс, глава 12, Звук касается основ звука и связанных с ним аспектов. Глава состоит из различных важных понятий, таких как производство звука, распространение звуковых продольных звуковых волн и скорость звука в различных средах . В дополнение к этому в главе объясняются концепции отражения звука и характеристики звуковой волны . Такие термины, как эхо , реверберация, ультразвук и сонар объясняются в главе Звук.
 Предоставляется подробное понимание механизма слуха вместе со структурой человеческого уха .
Предоставляется подробное понимание механизма слуха вместе со структурой человеческого уха .Глава «Звук» обобщается в конце, а оценка понимания понятий проводится с помощью набора упражнений, состоящих из различных вопросов.
- NCERT Solutions for Class 9 Science Chapter 13 – Почему мы заболеваем
Наука NCERT 9 класс, глава 13, Почему мы заболеваем? Знакомит учащихся с важностью хорошего здоровья. Подробно освещены темы, связанные со здоровьем. Понятия типа – значение здоровья, отличие здорового от здорового тело хорошо объяснено в главе.
Кроме того, глава Почему мы заболеваем? охватывает обсуждение острых и хронических заболеваний , инфекционных и неинфекционных – инфекционных заболеваний .
 Методы передачи болезней и принцип лечения а также профилактики болезней подробно описаны. Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы Почему мы заболеваем? выполняется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, за которыми следует групповое задание, проверяет концептуальное понимание главы Почему мы заболеваем?
Методы передачи болезней и принцип лечения а также профилактики болезней подробно описаны. Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы Почему мы заболеваем? выполняется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, за которыми следует групповое задание, проверяет концептуальное понимание главы Почему мы заболеваем? - Решения NCERT для науки класса 9 Глава 14 — Природные ресурсы
Наука NCERT, класс 9, глава 14, Природные ресурсы дает представление о деталях абиотических ресурсов , обнаруженных на Земле.
 Три основных природных ресурса, обсуждаемых в главе, — это земля, вода и воздух . Подробно объясняются характеристики каждого ресурса. Информация о таких понятиях, как ветер , воздушные потоки, дождь и т. д. обсуждаются всесторонне. Кроме того, в главе рассматриваются такие типы загрязнения, как воздух загрязнение и вода загрязнение . Также упоминается образование почвы и факторы, от которых зависит образование почвы. Глава Природные ресурсы делает акцент на различных биогеохимических циклах вместе с их схематическим представлением.
Три основных природных ресурса, обсуждаемых в главе, — это земля, вода и воздух . Подробно объясняются характеристики каждого ресурса. Информация о таких понятиях, как ветер , воздушные потоки, дождь и т. д. обсуждаются всесторонне. Кроме того, в главе рассматриваются такие типы загрязнения, как воздух загрязнение и вода загрязнение . Также упоминается образование почвы и факторы, от которых зависит образование почвы. Глава Природные ресурсы делает акцент на различных биогеохимических циклах вместе с их схематическим представлением.
Понимание каждой темы главы Природные ресурсы упрощается за счет добавления примеров, заданий и диаграмм. В дополнение к этому, тематическая оценка понимания осуществляется с помощью вопросов, представленных в конце каждой темы. В конце приводится краткий обзор всех важных моментов главы «Природные ресурсы», за которой следует ряд упражнений, проверяющих общее понимание концепций, упомянутых в главе.
- NCERT Solutions for Class 9 Science Chapter 15 — Улучшение пищевых ресурсов
Наука NCERT, класс 9, глава 15, Улучшение пищевых ресурсов проливает свет на концепции различных методов улучшения, применяемых в различных аспектах пищевых ресурсов. Глава «Улучшение продовольственных ресурсов» охватывает такие важные темы, как повышение урожайности, улучшение сортов сельскохозяйственных культур и управление растениеводством . В этой главе основное внимание уделяется управлению питательными веществами, орошению и схемам выращивания сельскохозяйственных культур . Кроме того, в главе содержится объяснение управления защитой растений и животноводством y, в котором учитываются животноводство, птицеводство, производство яиц и бройлеров, производство рыбы и пчеловодство.
Обобщение всех важных моментов главы делается в конце.
 Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Улучшение пищевых ресурсов.
Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Улучшение пищевых ресурсов.
NCERT Solutions for Class 9 Science Chapter 1
- Решения НЦЭРТ
- Класс 9
- Наука
- материя в нашем окружении
Наука NCERT, класс 9, глава 1, Материя в нашем окружении , как следует из названия, рассказывает о материи на основе ее физических свойств . Глава состоит из пяти различных разделов. В первом разделе главы обсуждается физическая природа материи. При этом основное внимание уделяется частицам, из которых состоят эти вещества, а во-вторых, размером этих частиц. Во втором разделе главы Материя в нашем окружении обсуждаются характеристики частиц материи. Здесь обсуждаются следующие три характеристики:
Глава состоит из пяти различных разделов. В первом разделе главы обсуждается физическая природа материи. При этом основное внимание уделяется частицам, из которых состоят эти вещества, а во-вторых, размером этих частиц. Во втором разделе главы Материя в нашем окружении обсуждаются характеристики частиц материи. Здесь обсуждаются следующие три характеристики:
Частицы вещества имеют пространство между собой
Частицы вещества постоянно движутся
Частицы вещества притягиваются друг к другу
Вышеуказанные свойства объясняются с помощью действий.
Третий раздел главы, Материя в нашем окружении , делает акцент на трех состояниях материи:
Твердотельный
Жидкое состояние
Газообразное состояние
В четвертом разделе эффект изменения температуры и давление по этому вопросу обсуждается с помощью примеров, демонстраций и действий. В последнем разделе главы понятие испарения рассматривается вместе с факторами, влияющими на процесс испарения. Два других состояния материи: плазма и конденсат Бозе-Эйнштейна также обсуждаются в конце главы, Материя в нашем окружении вместе с тремя другими состояниями.
В последнем разделе главы понятие испарения рассматривается вместе с факторами, влияющими на процесс испарения. Два других состояния материи: плазма и конденсат Бозе-Эйнштейна также обсуждаются в конце главы, Материя в нашем окружении вместе с тремя другими состояниями.
Глава Материя в нашем окружении рассматривается в следующих разделах –
1.1 Физическая природа материи
1.2 Характеристики частиц материи
1.3 Состояние материи
1.4 Может ли материя изменять свое состояние?
1,5 Испарение
Страница № 3:
Вопрос 1:
Что из следующего является материей?
Стул, воздух, любовь, запах, ненависть, миндаль, мысль, холод, холодный напиток, запах духов.
Ответ:
Все, что занимает пространство и имеет массу, называется материей.
Стул, Воздух, Запах, Миндаль, холодный напиток и запах духов – материя.
Любовь, Ненависть, Мысль, холод не имеют значения.
Примечание : Обоняние не имеет значения. Однако запах или запах вещества классифицируется как материя. Запах любого вещества (скажем, духов) можно классифицировать как материю. Это потому, что духи находятся в жидком состоянии внутри флакона. Он выходит в виде крошечных капелек. Эти капельки духов являются материей и распространяются в атмосфере, создавая обоняние. Этот запах может быть обнаружен нашей обонятельной системой.
Страница № 3:
Вопрос 2:
Обоснуйте следующее наблюдение:
Запах горячей шипящей пищи доносится до вас на несколько метров, но чтобы почувствовать запах холодной пищи, нужно подойти близко.
Ответ:
Твердые тела диффундируют очень медленно. Но если температура твердого тела повышается, то скорость диффузии твердых частиц в воздух увеличивается. Это связано с увеличением кинетической энергии твердых частиц. Следовательно, запах горячей шипящей пищи доносится до нас даже на расстоянии, а чтобы почувствовать запах холодной пищи, надо подойти близко.
Страница № 3:
Вопрос 3:
Дайвер может рассекать воду в бассейне. Какое свойство материи показывает это наблюдение?
Ответ:
Способность ныряльщика рассекать воду в бассейне показывает, что частицы вещества имеют межмолекулярные промежутки. Межмолекулярные пространства в жидкостях достаточно прозрачны, чтобы через них мог пройти ныряльщик.
Страница № 3:
Вопрос 4:
Каковы характеристики частиц вещества?
Ответ:
Характеристики частиц материи :
(i) Частицы материи имеют промежутки между ними.
(ii) Частицы вещества постоянно движутся.
(iii) Частицы вещества притягиваются друг к другу.
Страница № 6:
Вопрос 1:
Масса единицы объема вещества называется плотностью (плотность = масса/объем). Расположите в порядке возрастания плотности: воздух, выхлоп из трубы, мед, воду, мел, вату и железо.
Ответ:
Данные вещества в порядке возрастания плотности можно представить в виде:
Воздух < Выхлоп из трубы < Хлопок < Вода < Мед < Мел < Железо
Страница № 6:
Вопрос 2:
а) Запишите различия в характеристиках состояний материи.
(b) Прокомментируйте следующее: жесткость, сжимаемость, текучесть, заполнение газового баллона, форма, кинетическая энергия и плотность.
Ответ:
(а) Различия в характеристиках состояний материи приведены в следующей таблице.
С. № .
Твердотельный
Жидкое состояние
Газообразное состояние
1.
Определенная форма и объем.
Нет определенной формы, но есть определенный объем. Жидкости приобретают форму сосуда, в котором они находятся.
Газы не имеют ни определенной формы, ни определенного объема.
2.

Несжимаемый
Слабо сжимаемый.
Высокая сжимаемость
3.
Между частицами твердого тела мало места.
Эти частицы имеют большее пространство между собой.
Пространство между частицами газа самое большое.
4.
Эти частицы очень сильно притягиваются друг к другу.
Сила притяжения между жидкими частицами меньше, чем между твердыми частицами.
Сила притяжения наименьшая между частицами газа.
5.
Частицы твердого тела не могут свободно двигаться.
Эти частицы свободно перемещаются.
Газообразные частицы находятся в непрерывном беспорядочном движении.
(b) Жесткость может быть выражена как тенденция материи сопротивляться изменению формы.
Сжимаемость — это способность уменьшаться до меньшего объема при приложении силы.
Текучесть — это способность течь.
Под наполнением газового баллона подразумевается придание газом формы баллону.
Форма определяет определенную границу.
Кинетическая энергия — это энергия, которой обладает частица благодаря своему движению.
Плотность — масса на единицу объема.
Страница № 6:
Вопрос 3:
Объясните причины:
(а) Газ полностью заполняет сосуд, в котором он находится.
(b) Газ давит на стенки сосуда.
(c) Деревянный стол следует называть сплошным.
(d) Мы можем легко двигать рукой в воздухе, но чтобы сделать то же самое через твердый деревянный брусок, нам нужен специалист по карате.
Ответ:
(а) Между частицами газа мало притяжения. Таким образом, частицы газа свободно перемещаются во всех направлениях. Поэтому газ полностью заполняет сосуд, в котором находится.
Поэтому газ полностью заполняет сосуд, в котором находится.
(b) Частицы газа беспорядочно движутся во всех направлениях с большой скоростью. В результате частицы ударяются друг о друга, а также с силой ударяются о стенки контейнера. Поэтому газ давит на стенки сосуда.
(c) Деревянный стол имеет определенную форму и объем. Он очень жесткий и не может быть сжат, т. е. имеет характеристики твердого тела. Следовательно, деревянный стол следует называть цельным.
(d) Частицы воздуха имеют большие промежутки между собой. С другой стороны, в древесине мало места между частицами. Кроме того, он жесткий. По этой причине мы можем легко двигать руками в воздухе, но чтобы сделать то же самое через твердый деревянный брусок, нам нужен специалист по карате.
Видео Решение для материи в нашем окружении (Страница: 6 , Q.No.: 3)
NCERT Решение для науки класса 9 – материя в нашем окружении 6 , Вопрос 3
Страница № 6:
Вопрос 4:
Жидкости обычно имеют меньшую плотность по сравнению с твердыми телами. Но вы, должно быть, заметили, что лед плавает на воде. Узнайте, почему.
Но вы, должно быть, заметили, что лед плавает на воде. Узнайте, почему.
Ответ:
Масса единицы объема вещества называется плотностью (плотность = масса/объем). По мере увеличения объема вещества его плотность уменьшается.
Хотя лед является твердым телом, между его частицами имеется большое количество пустых пространств. Эти промежутки больше по сравнению с промежутками между частицами воды. Таким образом, объем льда больше объема воды. Следовательно, плотность льда меньше плотности воды. Вещество с меньшей плотностью, чем у воды, может плавать на поверхности воды. Следовательно, лед плавает на воде.
Видео Решение для материи в нашем окружении (Страница: 6 , Q.No.: 4)
NCERT Решение для науки класса 9 – материя в нашем окружении 6 , Вопрос 4
Страница № 9:
Вопрос 1:
Преобразуйте следующую температуру в шкалу Цельсия:
(a) 300 K
(b) 573 K
Ответ:
(a) 300 K = (300 − 273)°C
= 905°C
(b)573 K = (573 − 273)°C
= 300°C
Видео Решение для материи в нашем окружении (Страница: 9, Q.
 No.: 1)
No.: 1)NCERT Решение для науки 9 класса – материя в нашем окружении 9 , Вопрос 1
Номер страницы 9:
Вопрос 2:
Каково физическое состояние воды по адресу:
( а) 250°С
(б) 100°С
Ответ:
(а) Вода при 250°С существует в газообразном состоянии.
(b) При 100°C вода может находиться как в жидком, так и в газообразном состоянии. При этой температуре, получив теплоту, равную скрытой теплоте парообразования, вода начинает переходить из жидкого состояния в газообразное.
Видео Решение для материи в нашем окружении (Страница: 9 , Q.No.: 2)
NCERT Решение для науки класса 9 – материя в нашем окружении 9 , Вопрос 2
Страница № 9:
Вопрос 3:
Почему для любого вещества температура остается постоянной при изменении состояния?
Ответ:
При изменении состояния температура остается постоянной. Это связано с тем, что все тепло, подводимое для повышения температуры, используется для изменения состояния путем преодоления сил притяжения между частицами. Следовательно, это тепло не способствует повышению температуры вещества.
Следовательно, это тепло не способствует повышению температуры вещества.
Видео Решение для материи в нашем окружении (Страница: 9 , Q.No.: 3)
NCERT Решение для науки класса 9 – материя в нашем окружении 9 , Вопрос 3
Страница № 9:
Вопрос 4:
Предложите способ сжижения атмосферных газов.
Ответ:
Под давлением и понижением температуры атмосферные газы можно сжижать.
Видео Решение для материи в нашем окружении (Страница: 9, Q.No.: 4)
NCERT Решение для 9 класса науки – материя в нашем окружении 9 , Вопрос 4
Страница № 10:
Вопрос 1:
Почему пустынный холодильник лучше охлаждает в жаркий сухой день?
Ответ:
Когда жидкость испаряется, частицы жидкости поглощают энергию из окружающей среды, чтобы компенсировать потерю энергии при испарении. Это делает окрестности прохладными.
В пустынном охладителе вода внутри него испаряется. Это приводит к поглощению энергии из окружающей среды, тем самым охлаждая окружающую среду. Опять же, мы знаем, что испарение зависит от количества водяного пара, присутствующего в воздухе (влажности). Если количество водяного пара, присутствующего в воздухе, меньше, то испарение больше. В жаркий сухой день количество водяного пара в воздухе меньше. Таким образом, вода, находящаяся внутри пустынного охладителя, больше испаряется, тем самым сильнее охлаждая окружающую среду. Вот почему пустынный кулер лучше охлаждает в жаркий сухой день.
Опять же, мы знаем, что испарение зависит от количества водяного пара, присутствующего в воздухе (влажности). Если количество водяного пара, присутствующего в воздухе, меньше, то испарение больше. В жаркий сухой день количество водяного пара в воздухе меньше. Таким образом, вода, находящаяся внутри пустынного охладителя, больше испаряется, тем самым сильнее охлаждая окружающую среду. Вот почему пустынный кулер лучше охлаждает в жаркий сухой день.
Видео Решение для материи в нашем окружении (Страница: 10 , Q.No.: 1)
NCERT Решение для науки 9 класса – материя в нашем окружении 10 , Вопрос 1
Страница № 10:
Вопрос 2:
Как вода в глиняном горшке ( матка) становится прохладной летом?
Ответ:
В глиняном горшке есть поры, через которые испаряется жидкость внутри горшка. Это испарение делает воду внутри горшка прохладной. Таким образом, вода, хранящаяся в глиняном горшке, летом становится прохладной.
Видео Решение для материи в нашем окружении (Страница: 10 , Q.
 No.: 2)
No.: 2)NCERT Решение для науки 9 класса – материя в нашем окружении 10 , Вопрос 2
Страница № 10:
Вопрос 3:
Почему ладонь становится холодной, когда мы наносим на нее ацетон, бензин или духи?
Ответ:
Когда мы наносим на ладонь немного ацетона, бензина или духов, они испаряются. При испарении частицы жидкости поглощают энергию окружающей среды или поверхности ладони, чтобы компенсировать потерю энергии, охлаждая окружающую среду. Следовательно, наша ладонь кажется холодной, когда мы наносим на нее немного ацетона, бензина или духов.
Видео Решение для материи в нашем окружении (Страница: 10 , Q.No.: 3)
NCERT Решение для науки 9 класса – материя в нашем окружении 10 , Вопрос 3
Страница № 10:
Вопрос 4:
Почему мы быстрее пьем горячий чай или молоко из блюдца, чем из чашки?
Ответ:
Поверхность жидкости в блюдце больше, чем в чашке. Таким образом, в блюдце он быстрее испаряется и быстрее остывает, чем в чашке. По этой причине мы можем быстрее выпить горячий чай или молоко из блюдца, чем из чашки.
По этой причине мы можем быстрее выпить горячий чай или молоко из блюдца, чем из чашки.
Видео Решение для материи в нашем окружении (Страница: 10 , Q.No.: 4)
NCERT Решение для науки 9 класса – материя в нашем окружении 10 , Вопрос 4
Страница № 10:
Вопрос 5:
Какую одежду нам следует носить летом?
Ответ:
Летом мы должны носить хлопчатобумажную одежду. Летом мы больше потеем. С другой стороны, хлопок хорошо впитывает воду. Таким образом, он поглощает пот из нашего тела и выставляет жидкость в атмосферу, ускоряя испарение. Во время этого испарения частицы на поверхности жидкости получают энергию от поверхности нашего тела, охлаждая тело.
Видео Решение для материи в нашем окружении (Страница: 10 , Q.No.: 5)
NCERT Решение для науки 9 класса – материя в нашем окружении 10 , Вопрос 5
Страница № 12:
Вопрос 1:
Преобразуйте следующие температуры в шкалу Цельсия.
(a) 293 K
(b) 470 K
Ответ:
Кельвин — единица измерения температуры в системе СИ, где 0°C = 273,16 K (приблизительно 273 K)
(a) 293 K = (293 K − 273) °С
= 20 °C
(b) 470 K = (470 − 273) °C
= 197 °C
Видео Решение для материи в нашем окружении (Страница: 12, Q.No.: 1)
Решение NCERT для класса 9: материя в нашем окружении 12 , Вопрос 1
Страница № 12:
Вопрос 2:
Преобразуйте следующие температуры в шкалу Кельвина.
(a) 25°C
(b) 373°C
Ответ:
Кельвин — единица измерения температуры в системе СИ, где 0°C = 273,16 K (приблизительно 273 K)
(a) 25 °C = (25 + 273) K
= 298 K
(b) 373 °C = (373 + 273) K
= 646 K
Видео Решение для материи в нашем окружении (Страница: 12 , Q.
 No.: 2)
No.: 2)NCERT Решение для класса 9 науки – материя в нашем окружении 12 , Вопрос 2
Страница № 12:
Вопрос 3:
Объясните следующие наблюдения.
(a) Нафталиновые шарики со временем исчезают, не оставляя твердого вещества.
(б) Мы можем почувствовать запах духов, находясь на расстоянии нескольких метров.
Ответ:
(а) Нафталин легко подвергается сублимации, т. е. легко происходит переход нафталина из твердого состояния в газообразное. Таким образом, нафталиновые шарики со временем исчезают, не оставляя твердого вещества.
(b) Газовые частицы обладают высокой скоростью и большими расстояниями между ними. Частицы духов диффундируют в эти газообразные частицы с очень высокой скоростью и достигают наших ноздрей. Это позволяет нам чувствовать запах духов на расстоянии.
Видео Решение для материи в нашем окружении (Страница: 12 , Q.No.: 3)
NCERT Решение для науки 9 класса – материя в нашем окружении 12 , Вопрос 3
Страница № 12:
Вопрос 4:
Расположите следующие вещества в порядке возрастания сил притяжения между частицами – вода, сахар, кислород .
Ответ:
Сахар твердый; силы притяжения между частицами сахара велики.
Вода – это жидкость; силы притяжения здесь слабее сахара.
Кислород – это газ; силы притяжения самые слабые в газах.
Таким образом, порядок увеличения сил притяжения между частицами воды, сахара и кислорода следующий: Кислород < Вода < Сахар
Видео Решение для материи в нашем окружении (Страница: 12 , Q.No.: 4)
NCERT Решение для 9 класса науки – материя в нашем окружении 12 , Вопрос 4
Страница № 12:
Вопрос 5:
Каково физическое состояние воды при −
(a) 25°C
(b) 0°С
(в) 100°С
Ответ:
(a) Вода при 25°C находится в жидком состоянии.
(b) При 0 °C вода может существовать как в твердом, так и в жидком состоянии. При этой температуре, после получения теплоты, равной скрытой теплоте плавления, твердая форма воды, т. е. лед, начинает переходить в жидкую форму, т. е. воду.
е. лед, начинает переходить в жидкую форму, т. е. воду.
(c) При 100 °C вода может существовать как в жидком, так и в газообразном состоянии. При этой температуре, получив теплоту, равную скрытой теплоте парообразования, вода начинает переходить из жидкого состояния в газообразное, т. е. водяной пар.
Видео Решение для материи в нашем окружении (Страница: 12 , Q.No.: 5)
NCERT Решение для науки 9 класса – материя в нашем окружении 12 , Вопрос 5
Страница № 12:
Вопрос 6:
Приведите два аргумента в пользу −
(a) вода при комнатной температуре является жидкостью.
(b) железная альмира представляет собой твердое вещество при комнатной температуре.
Ответ:
(a) При комнатной температуре (25 °C) вода является жидкостью, поскольку имеет следующие характеристики жидкости:
(i) При комнатной температуре вода не имеет формы, но имеет фиксированный объем, т. е. принимает форму сосуда, в котором хранится.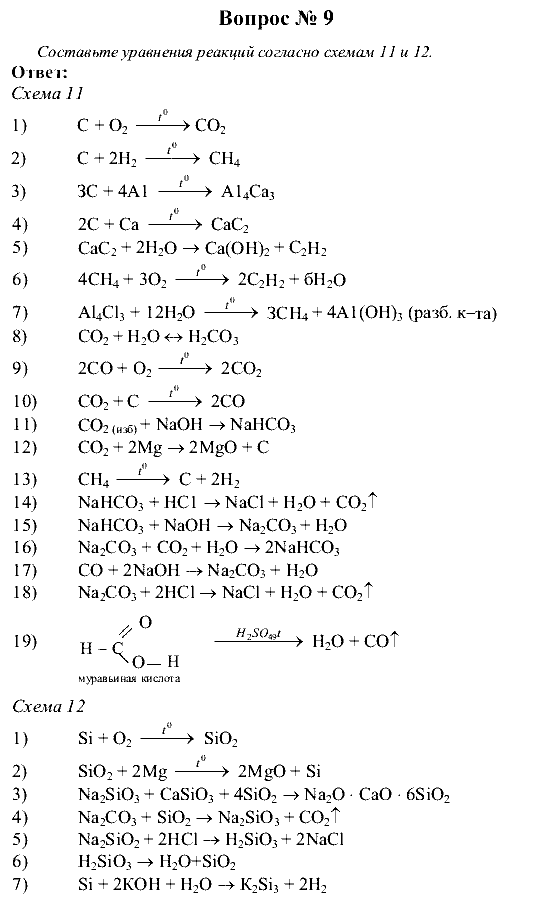
(ii) При комнатной температуре вода течет.
(b) Железный альмира является твердым телом при комнатной температуре (25 °C), потому что:
(i) он имеет определенную форму и объем, как твердое тело при комнатной температуре.
(ii) твердый при комнатной температуре.
Видео Решение для материи в нашем окружении (Страница: 12 , Q.No.: 6)
NCERT Решение для класса 9 Наука – материя в нашем окружении 12 , Вопрос 6
Страница № 12:
Вопрос 7:
Почему лед при температуре 273 К более эффективен для охлаждения, чем вода той же температуры?
Ответ:
Лед при температуре 273 К имеет меньше энергии, чем вода (хотя оба имеют одинаковую температуру). Вода обладает дополнительной скрытой теплотой плавления. Следовательно, при температуре 273 К лед более эффективен для охлаждения, чем вода.
Видео Решение для материи в нашем окружении (Страница: 12 , Q.No.: 7)
NCERT Решение для 9 класса науки – материя в нашем окружении 12 , Вопрос 7
Страница № 12:
Вопрос 8:
Что вызывает более сильные ожоги, кипяток или пар?
Ответ:
У пара больше энергии, чем у кипящей воды.

 Резяпкин В.И. (2002, 272с.)
Резяпкин В.И. (2002, 272с.) И. (2013, 217с.)
И. (2013, 217с.)  )
)  Хомченко И.Г. (2010, 256с.)
Хомченко И.Г. (2010, 256с.) Г. (2002, 278с.)
Г. (2002, 278с.)  8-11 классы. Бочарникова Р.А. (2013, 125с.)
8-11 классы. Бочарникова Р.А. (2013, 125с.) Коваценко Л.С. (2010, 318с.)
Коваценко Л.С. (2010, 318с.) Универсальный справочник школьника. Варавва Н.Э., Мешкова О.В. (2012, 528с.)
Универсальный справочник школьника. Варавва Н.Э., Мешкова О.В. (2012, 528с.) Степин Б.Д., Аликберова Л.Ю. (2002, 432с.)
Степин Б.Д., Аликберова Л.Ю. (2002, 432с.)
 Что происходит? Вы чувствуете запах сидя на расстоянии?
Что происходит? Вы чувствуете запах сидя на расстоянии? 




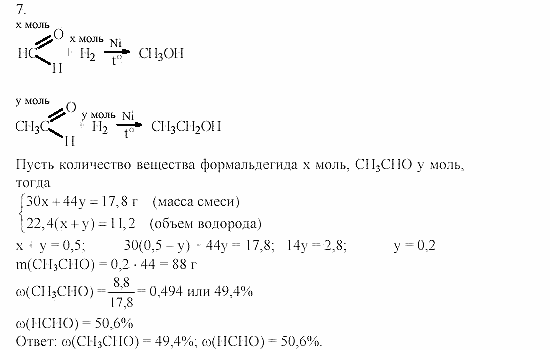 Вода снова соединяется, как только мы убираем палец.
Вода снова соединяется, как только мы убираем палец. Умеете ли вы их сжимать?
Умеете ли вы их сжимать?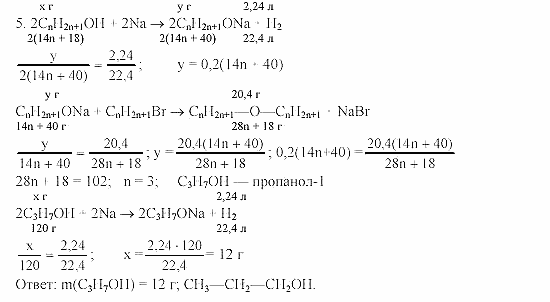 е. имеют пренебрежимо малую сжимаемость.
е. имеют пренебрежимо малую сжимаемость.  Он полностью потерял свою форму.
Он полностью потерял свою форму. В главе обсуждаются важные физических свойства материи . Глава Материя в нашем окружении вращается вокруг частиц, образующих материю, и свойств таких частиц.
В главе обсуждаются важные физических свойства материи . Глава Материя в нашем окружении вращается вокруг частиц, образующих материю, и свойств таких частиц.  Подробная информация о смеси и растворах представлена в главе с помощью примеров из повседневной жизни. Также включены определения терминов смеси и растворов . Различные процессы, вовлеченные в разделения компонентов смеси объясняются всесторонне.
Подробная информация о смеси и растворах представлена в главе с помощью примеров из повседневной жизни. Также включены определения терминов смеси и растворов . Различные процессы, вовлеченные в разделения компонентов смеси объясняются всесторонне.  Эта глава проливает свет на концепции l законов химических соединений, атомную теорию Дальтона, символы атомов и атомную массу . Кроме того, он охватывает обсуждение процедуры написания химических формул с использованием символов и валентности элементов . Особое внимание уделяется концепции молекулярная масса и моль концепция . Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений.
Эта глава проливает свет на концепции l законов химических соединений, атомную теорию Дальтона, символы атомов и атомную массу . Кроме того, он охватывает обсуждение процедуры написания химических формул с использованием символов и валентности элементов . Особое внимание уделяется концепции молекулярная масса и моль концепция . Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений.  Акцент делается на субатомных частицах атома- электронов, протонов и нейтронов. Подробно объясняются три модели атомов вместе с их постулатами, диаграммой и недостатками:
Акцент делается на субатомных частицах атома- электронов, протонов и нейтронов. Подробно объясняются три модели атомов вместе с их постулатами, диаграммой и недостатками: В главе основное внимание уделяется характеристикам клетки, основанным на ее характеристиках, таких как форма, размер и функции . Кроме того, подробно рассматривается структурная организация ячейки . Важные части клетки, такие как плазматическая мембрана, ядро, клеточная стенка, цитоплазма и т. д., обсуждаются с помощью подходящих диаграмм вместе с клеточными органеллами .
В главе основное внимание уделяется характеристикам клетки, основанным на ее характеристиках, таких как форма, размер и функции . Кроме того, подробно рассматривается структурная организация ячейки . Важные части клетки, такие как плазматическая мембрана, ядро, клеточная стенка, цитоплазма и т. д., обсуждаются с помощью подходящих диаграмм вместе с клеточными органеллами . В этой главе рассматриваются структура и функции важных тканей. Важные понятия, относящиеся к растительным тканям и животным тканям , рассматриваются отдельно в главе 9.0003 Ткани . Растительные ткани делятся на две категории: меристематические ткани и постоянные ткани .
В этой главе рассматриваются структура и функции важных тканей. Важные понятия, относящиеся к растительным тканям и животным тканям , рассматриваются отдельно в главе 9.0003 Ткани . Растительные ткани делятся на две категории: меристематические ткани и постоянные ткани .
 Тематическая оценка главы осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы «Многообразие живых организмов» делается в конце. Набор упражнений, состоящий из различных вопросов, за которыми следует групповая деятельность, проверяет концептуальное понимание главы.
Тематическая оценка главы осуществляется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы «Многообразие живых организмов» делается в конце. Набор упражнений, состоящий из различных вопросов, за которыми следует групповая деятельность, проверяет концептуальное понимание главы.
 из движение . Все три закона объясняются с помощью примеров вместе с их применением в повседневной жизни. Он также охватывает концепцию сохранения из импульс .
из движение . Все три закона объясняются с помощью примеров вместе с их применением в повседневной жизни. Он также охватывает концепцию сохранения из импульс .  В этой главе подробно объясняются различные аспекты, связанные с гравитацией. Такие понятия, как универсальный закон гравитации , центростремительной силы , Ньютона ‘ с обратного квадратного закона объясняются подробно. Помимо этого, глава Гравитация состоит из таких понятий, как свободное падение , ускорение до гравитация , масса и инерция.
В этой главе подробно объясняются различные аспекты, связанные с гравитацией. Такие понятия, как универсальный закон гравитации , центростремительной силы , Ньютона ‘ с обратного квадратного закона объясняются подробно. Помимо этого, глава Гравитация состоит из таких понятий, как свободное падение , ускорение до гравитация , масса и инерция.  Резюме всех важных моментов главы, Гравитация приводится в конце, за которым следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе.
Резюме всех важных моментов главы, Гравитация приводится в конце, за которым следует набор упражнений, которые проверяют общее понимание понятий, упомянутых в главе.
 Предоставляется подробное понимание механизма слуха вместе со структурой человеческого уха .
Предоставляется подробное понимание механизма слуха вместе со структурой человеческого уха . Методы передачи болезней и принцип лечения а также профилактики болезней подробно описаны. Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы Почему мы заболеваем? выполняется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, за которыми следует групповое задание, проверяет концептуальное понимание главы Почему мы заболеваем?
Методы передачи болезней и принцип лечения а также профилактики болезней подробно описаны. Каждая из вышеперечисленных тем подробно объясняется с помощью подходящих примеров, диаграмм и упражнений. Тематическая оценка главы Почему мы заболеваем? выполняется с помощью вопросов, представленных в конце каждой темы. Обобщение всех важных моментов главы делается в конце. Набор упражнений, состоящий из 11 различных вопросов, за которыми следует групповое задание, проверяет концептуальное понимание главы Почему мы заболеваем?  Три основных природных ресурса, обсуждаемых в главе, — это земля, вода и воздух . Подробно объясняются характеристики каждого ресурса. Информация о таких понятиях, как ветер , воздушные потоки, дождь и т. д. обсуждаются всесторонне. Кроме того, в главе рассматриваются такие типы загрязнения, как воздух загрязнение и вода загрязнение . Также упоминается образование почвы и факторы, от которых зависит образование почвы. Глава Природные ресурсы делает акцент на различных биогеохимических циклах вместе с их схематическим представлением.
Три основных природных ресурса, обсуждаемых в главе, — это земля, вода и воздух . Подробно объясняются характеристики каждого ресурса. Информация о таких понятиях, как ветер , воздушные потоки, дождь и т. д. обсуждаются всесторонне. Кроме того, в главе рассматриваются такие типы загрязнения, как воздух загрязнение и вода загрязнение . Также упоминается образование почвы и факторы, от которых зависит образование почвы. Глава Природные ресурсы делает акцент на различных биогеохимических циклах вместе с их схематическим представлением. 
 Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Улучшение пищевых ресурсов.
Набор упражнений, состоящий из 11 различных вопросов, сопровождаемых групповой деятельностью, проверяет концептуальное понимание главы, Улучшение пищевых ресурсов. 