Решение типовых задач по химии
- НОВОСТИ
- КУРС ХИМИИ
- Дополнительные уроки
- Курс химии
- Разбор заданий ЕГЭ
- ТЕСТЫ
- Вариаты ЕГЭ
- Тесты по заданиям
- Тесты по темам
- СТАТЬИ
- ОПЫТЫ
- ТАБЛИЦА МЕНДЕЛЕЕВА
Поиск
CHEM-MIND.com- НОВОСТИ
- Новости
Алгоритм обучения для подготовки к ЕГЭ по химии
НовостиОтветы в тестах вновь правильно отображаются!
НовостиТехнические проблемы
НовостиНовый раздел на сайте
НовостиС 8 марта
- Новости
- КУРС ХИМИИ
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
Разбор задания №11 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №10 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №9 ЕГЭ по химии
Разбор заданий ЕГЭРазбор задания №8 ЕГЭ по химии
- ВсеДополнительные урокиКурс химииРазбор заданий ЕГЭ
Разбор заданий ЕГЭ
- ТЕСТЫ
www.chem-mind.com
Задачи с решениями на смеси по химии с решениями
Один из внутренних односторонних углов образованных при пересечении двух параллельных прямых секущей в 3 раза больше другого. Найдите эти углы. Помогите пожалуйстааа, буду очень благодарна.. Попроси больше объяснений; Следить ? Отметить нарушение ? Talovska 28.02.2016. Войти чтобы.
Обсуждения
Задачи на смеси.
690 сообщений
Молекулярная масса (химический калькулятор)
При взаимодействии 20г смеси алюминия и меди с хлороводородной кислотой выделилось 2.24л газа. Найти массу каждого металла в смеси и определить какой газ выделился.
С кислотой реагирует только алюминий:
2Al + 6HСl → 2AlСl3 + 3h3 (г.) —> газ, выделившийся при реакции — водород.
N(h3) = V / Vm = 2,24/22,4 = 0,1 моль —> n(Al) = 0.1 * 2 / 3 = 0,067 моль
M(Al) = n(Al) * М(Al) = 0,067 * 27 = 1,8 г
При взаимодействии 4г смеси железа с магнием с h3SO4 Выделилось 2.24л водорода(н. у) . Определить массовую долю каждого металла в смеси.
Oба металла реагируют с кислотой.
Пусть в смеси было х моль Mg (М = 24 г/моль) и у моль Fe (М = 56 г/моль).
При реакции х моль магния выделяется х моль водорода.
Fe + h3SO4 → Fe SO4 + h3
При растворении у моль железа выделяется у моль водорода.
Всего водорода выделилось 2,24/22,4 = 0,1 моль.
M(Fe) = 56y = 56 * 0,05 = 2,8 г
Ω(Mg) = m(Mg) / m(смеси) * 100% = 1,2 / 4 * 100 = 30%
Ω(Fe) = m(Fe) / m(сплава) * 100% = 2,8 / 4 * 100 = 70%
При нагревании 10 г смеси нитрата натрия и хлорида натрия выделилось 1,12 л газа (н. у) . Массовая доля хлорида натрия в смеси равна (%) :
А) 15 ; б) 35 ; в) 57,5 ; г) 85.
Из двух солей при нагревании разлагается только нитрат натрия:
2NaNO3 = 2NaNO2 + O2↑
M(NaNO3) = n(NaNO3) x M(NaNO3)
M(NaCl) = m(смеси) — m(NaNO3)
Ω%(NaCl) = m(NaCl) x 100 / m(смеси)
Смесь газов хлора и хлороводорода объемом 22,4 л (н. у.) пропустили через нагретые железные опилки. При этом весь хлор и хлороводород вступили в реакцию с железом и масса опилок увеличилась на 42,6 г. Вычислите процентное содержание хлора и хлороводорода в смеси.
(1) Fe + 2HCl = FeCl2 + h3
(2) 2Fe + 3Cl2 = 2FeCl3
(3) 2FeCl2 + Cl2 =2FeCl3 (только если хлор был в большом избытке)
Отсюда — количества хлора и хлороводорода вместе составляют 1 моль.
Тогда: n(HCl) = (1- х) моль
71x + 36,5(1-x) = 42,6 + (1-х)
А хлороводорода было 1-х = 0,8 моль => V= 22,4(х-1) =17,92 л, m=36,5(1-х)=29,2 г
Поскольку в избытке в смеси хлороводород (а не хлор), то реакция (3) не идет.
Ω%об. (Cl2) = 4,48·100/22,4 = 20%, ω%об. (HCl) = 80%
Ω%масс. (Cl2) = 14,2·100/(14,2+29,2) = 32,7%, ω%масс. (HCl) = 67,3%
Как найти молярную массу смеси или, скорее, раствора, если в ней: m(h3)=4г и m(O2)=32г?
Мсмеси = M(Н2)∙ω(Н2) + M(О2)∙ω(О2), где M – молярная масса компонента, а ω – его массовая доля в смеси.
Ω = m(компонента) / m(смеси), отсюда:
Мсмеси = 2 ∙ (4/36) + 32 ∙ (32/36) = 28,67 г/моль
В какой массе раствора Ni(NO3)2 с массовой долей 10% нужно растворить 200г Ni(NO3)2∙6h3O, чтобы получить раствор с массовой долей Ni(NO3)2 16%? Какую среду будет иметь полученный раствор?
Среда кислая, т. к. соль образована анионом сильной кислоты и катионом слабого основания и гидролизуется по катиону: Ni 2+ + HOH ⇆ NiOH+ + H+
Задачка на адитивные смеси 🙂
Проверяем: в 2800 г 10%-ного раствора 2800 ∙ 0,1 = 280 г соли, добавили 200 г соли в раствор, получили 480 г соли и 2800 + 200 = 3000 г раствора, 480/3000 = 0,16 (16%).
Самое простое — по правилу креста.
Здесь не нарисовать, так что постараюсь просто объяснить.
Я хочу составить определенную смесь из 2-х других смесей или чистых веществ, и знаю все, кроме одного неизвестного (в данном случае — массы 10%-ного раствора).
Любой неизвестный параметр смеси по известным остальным легко рассчитать по соотношению:
C1∙m1+C2∙m2 = Cсмеси∙(m1+ m2),
В этой задаче С — конц-я, m — масса.
Преобразуем соотношение в отношение m1/m2:
M1/m2 = (Cсмеси – С2) / (С1 – Cсмеси)
В добавленной твердой соли не было воды, т. е. конц-я добавленной соли 100% (С1), а должна получиться 16% (Ссмеси):
С1 – Cсмеси = 100-16=84
Конц-я исходного раствора 10% (С2), а должна получиться 16% (Ссмеси):
Cсмеси – С2 = 16-10 = 6
M1/m2 =(Cсмеси – С2) / (С1 – Cсмеси)=6/84 = 1/14, т. е. на 1 часть добавленной соли нужны 14 частей 10%-ного раствора — в 14 раз больше: 200 ∙ 14 = 2800 г.
10 г смеси меди и аллюминия обработали 96% азотной кислотой, при этом выделилось 4,48 л газа. Определить количественный состав смеси.
HNO3(конц.) пассивирует Al (т. е. реакции практ. нет), но зато бурно реагирует с медью с выделением бурого газа NO2.
Поэтому весь газ образовался при реакции кислоты с медью, по уравнению:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2h3O
Из коэффициентов в уравнении видно, что из 1 моль Cu получим 2 моль NO2, т. е. отношение 1:2
В реакции образовались:
N(NO2) = V/Vm=4,48 / 5/22,4 = 0,2 моль
Тогда n(Cu) = 0,2 / 2 = 0,1 моль Cu
M(Cu) = n ∙ M = 0,1 ∙ 63,5 = 6,35 г
Следовательно, m(Al) = m(смеси) — m(Cu) = 10 — 6,35 = 3,65 г
Смесь водорода и хлора объемом 270 мл прореагировала без изменения объема. Полученная смесь газов пропущена через раствор йодида калия, из которого было выделено 0,254 г йода. Определите объемный состав газовой смеси в процентах.
HCl с йодидом калия не реагирует, а Cl2 реагирует, значит, в смеси с водородом был избыток хлора.
2KI + Cl2 → 2KCl + I2
N(I2) = m/M=0,254 / 254 = 0,001 моль, отсюда: в смеси было на 0,001 моль больше хлора, чем водорода.
Если объём измеряли при н. у., то объём хлора был больше объёма водорода на 0,001 ∙ 22,4 ∙ 1000 = 22,4 мл.
V(h3) = (270 — 22,4)/2 = 123,8 мл
W %об. (Н2) = 123,8 / 270 ∙ 100 = 45,85%
W %об. (Cl2 ) = 100 — 45,85 = 54,15%
Смесь этилена и водорода объёмом 10л, объёмная доля этилена в которой составляет 40%, пропустили при нагревании над катализатором.
Объёмные доли газов после реакции равны. % ?
V(С2Н4)=10 ∙ 0,4 = 4 л, V(Н2)=10 — 4 = 6 л
По закону Авогадро, объемы газов в реакции при равных условиях Р, Т соотносятся как их количества.
По уравнению реакции, n(С2Н4) = n(Н2) = n(С2Н6), поэтому 4 л С2Н4 прореагируют с 4 л Н2 и образуются 4 л С2Н6.
В исходной смеси были 6 л Н2, поэтому 2 л Н2 останутся в избытке.
Итого, по о
Задачи на «смеси», «материальный баланс»
Урок химии в 9 классе
Тема: Задачи на «смеси», «материальный баланс»
Цель: рассмотреть типы смесей, составить алгоритм решения и привести примеры.
Задачи:
– установить типы смесей по составу и способу математического решения их;
– отработать электролиз расплавов и растворов на примерах усложненных и комбинированных заданий.
Ход работы.
Объяснение учителя:
Смеси – это системы, состоящие из двух или более компонентов. Смеси различают механические (твердые, жидкие и газообразные) и сплавы (твердые смеси). Простейшая по составу смесь состоит из двух компонентов.
Компоненты смеси могут реагировать с действующим на них веществом по – разному:
– могут реагировать оба, но образовывать разные продукты, например, кальций с поверхности покрыт оксидной пленкой и при действии на него соляной кислоты выделяется водород, который может помочь установить количественный состав смеси:
Ca + 2HCl → CaCl2 + H2
CaO + 2HCl → CaCl2 + H2O;
– смесь состоит из двух компонентов, один из которых не реагирует с действующим веществом на смесь, например, смесь меди и цинка в реакции с соляной кислотой. Медь, как неактивный металл, стоящий в ряду активности после водорода, не реагирует, а цинк реагирует с выделением водорода ввиду активности его;
– смесь состоит из двух компонентов, которые одинаково реагируют с действующим на них веществом, например, цинк и магний с соляной кислотой. Оба металла активные и одинаково образуют в реакции водород. Такого типа задачи решают с использованием системы уравнений.
Смеси могут состоять из трех и более компонентов, поэтому способы решения их различны и такие задачи относят к комбинированным.
Рассмотрим алгоритм решения задачи на смесь двух газов:
Задача 1: Доронькина В.Н. № 13
19 г смеси метана и этана (н.у.) занимает объем 16,8 л. Определите объемную долю газов в смеси.
Решение: необходимо ввести дополнительную величину – количество вещества, которая поможет составить систему уравнений для получения результата. Примем моль метана за «х», моль этана за «у» и составим систему уравнений.
С учетом массы: m(СН4) + m(С2Н6) = 19 г; М(СН4) = 16 г/моль; М(С2Н6) = 30 г/моль
С учетом объема смеси можно рассчитать υ смеси = 16,8 л / 22,4 л/моль = 0,75 моль.
Составляем и решаем систему уравнений:
х + у = 0,75 х = 0,25
16х + 30у = 19 у = 0,5
φ(СН4) = 0,25 моль * 22,4 л/моль / 16,8 л = 0,3333; 33,33%
φ(С2Н6) = 0,5 моль * 22,4 л/моль / 16,8 л = 0,6667; 66,67%
Задача 2.
Доронькина В.Н. № 4.29. Для того, чтобы полностью растворить 5,12 г железа, содержащего, возможно, примеси его оксида, было израсходовано 62,75 мл раствора соляной кислоты с массовой долей 10% и плотностью 1,047 г/мл. Объем выделившегося газа составил при этом 1,12 л (н.у.). Определите состав смеси.
0,05 моль 0,1 моль 0,05 моль
Решение: Fe + 2HCl → FeCl2 + H2 (1)
2,32 г 0,08 моль
FeхОу + 2уHCl → хFeCl2у/х + уН2О (2)
56х + 16у 2у моль
Рассчитаем количества вещества: υ (Н2) = 1,12 л / 22,4 л/моль = 0,05 моль;
υ (НСl) = 62,7 мл * 0,1 * 1,047 г/мл / 36,5 г/моль = 0,18 моль. По УХР (1) υ (Fe) = υ (H2) = 0,05 моль; m (Fe) = 0,05 моль * 56 г/моль = 2,8 г. m (HCl) = 0,1 моль * 36,5 г/моль = 3,65 г. υ (НСl) ост на (2) УХР = 0,18 – 0,1 = 0,08 моль. m (FeхОу) = 5,12 – 2,8 = 2,32 г; υ (FeхОу) = 2,32 / 56х + 16у; составляем отношение: 2,32 / 56х + 16у = 0,08 / 2у; х : у = 3 : 4, Fe3O4
w (Fe) = 2,8 / 5,12 = 54,69%; w (Fe3O4) = 2,32 / 5,12 = 45,31%.
Врублевский, с. 11, № 6.
В смеси гидридов кальция и натрия массой 6,4 г w (H) = 0,04688. Определите массы CaH2 NaH.
х моль х моль у моль 2у моль
Решение: NaH ——- H CaH2 ——– 2H
24 г 42 г
m (H) = 6,4 * 0, 04688 = 0,3 г. υ (Н) = 0,3 моль
24х + 42у = 6,4 х = 0,0334 моль m (NaH) = 0,8 г
х + 2у = 0,3 у = 0,13333 моль m (CaH2) = 5,6 г
№ 55, с. 44. При анализе природного образца хлорида натрия в нем обнаружено 55% хлора по массе. Чему равна массовая доля хлорида натрия в природном образце.
Решение: пусть масса образца равна 100 г, тогда масса хлора составит 55 г. υ (Сl) = 1,55 моль. 1,55 моль 1,55 моль
NaCl ——- Cl m (NaCl) = 58,5 г/моль * 1,55 моль = 90,63 г, значит w (NaCl) = 90,63%.
№ 61. В каком количественном (моль) соотношении надо взять хлориды натрия и калия, чтобы при получении из них хлорида серебра масса последнего на 129,6% превысила массу исходной смеси?
Решение: пусть масса смеси равна 100 г. тогда масса хлорида серебра составит (100 + 129,6) = 229,6 г; υ (AgCl) = 1,6 моль.
х + у = 1,6 х = 1,2 моль х : у = 1,2 : 0,4 = 3 : 1
58,5х + 74у = 100 у = 0,4 моль
Задачи для самостоятельного решения.
1. К раствору, полученному из 3,076 г смеси медного купороса и глауберовой соли, прибавили избыток раствора хлорида бария, при этом выпало 2,33 г осадка. Определите массовый состав исходной смеси.
2. (Свешникова Г.В.), стр. 128, № 7.37)
Светильный газ, являющийся одним из продуктов перегонки каменного угля, состоит в основном из водорода и метана. Кроме того, в его состав входят этилен, монооксид и диоксид углерода, азот. При встряхивании пробы светильного газа объемом 100 мл (н.у.) с раствором едкого натра, объем смеси уменьшился на 2,5 мл, с бромной водой – на 4 мл. Адсорбция с помощью аммиачного раствора однохлористой меди выводит из состава такой же пробы монооксид углерода, при этом объем пробы становится меньше на 7,5 мл. при сгорании пробы такого же объема образовалось 0,0944 г диоксида углерода и 0,0948 г воды. Определите состав светильного газа.
4
kopilkaurokov.ru
Задачи на смеси и сплавы .
Задачи на смеси, сплавы и растворы.
1. Подход к решению задач на смеси.
Человеку часто приходится смешивать различные жидкости, порошки, или твердые вещества, или разбавлять что-либо водой.
Задачи на смеси имеют практическую направленность. Например, мы пьём чай и кладем в чашку столько сахара, чтобы не пересластить (создаём нужную нам концентрацию), а если пересластили, то добавляем воды.
Летом мы ходим за грибами, затем их сушим. И мы понимаем, что чем дольше их сушить, тем меньше в них остается воды, при этом масса сухого вещества не меняется.
Врач выписывает рецепт, и мы покупаем мази, микстуры с определенной концентрацией лекарственных веществ. Решая задачи данного типа, нам нужно будет выделить компоненты, которые изменяются, и те, что остаются неизменными.
Говоря о смесях, растворах и сплавах будем употреблять термин «смесь» независимо от её вида (твердая, жидкая, сыпучая, газообразная). Смесь состоит из основного вещества и примеси. Что такое основное вещество, в каждой задаче определяется отдельно.
Текстовые задачи на смеси, сплавы и растворы входят в различные сборники заданий по математике и химии ОГЭ и ЕГЭ.
При решении любых задач, прежде всего, нужно грамотно прочитать условие, последовательно остановиться на каждой строчке, и попытаться выразить условие в качестве какого-то уравнения.
. Что же отличает задачи на смеси? Уравнение трудно составить, если не знать основную формулу для всех задач на смеси.
В «Занимательной алгебре» Я.И. Перельмана есть любопытная задача под названием: «В парикмахерской»:
Задача: Может ли алгебра понадобиться в парикмахерской? Оказывается, такие случаи бывают. Мне пришлось убедиться в этом, когда однажды в парикмахерской подошел ко мне мастер с неожиданной просьбой:
-Не поможете ли нам разрешить задачу, с которой мы никак не справимся?
– Уж сколько раствора испортили из-за этого!- добавил другой
– В чем задача?
– У нас имеется два раствора перекиси водорода: 30%- ыйи 3 % -ый. Нужно их смешать так, чтобы составился 12% -ый раствор. Не можем подыскать правильной пропорции.
Мне дали бумажку, и требуемая пропорция была найдена.
Она оказалась очень простой. Какой именно?
Решение: Пусть для составления 12%-ной смеси требуется взять x граммов 3%-ного раствора и y граммов 30% -ного раствора. Тогда в первой пропорции содержится 0,03x граммов чистой перекиси водорода, во второй 0,3y, а всего 0,03x + 0,3y
В результате получается (x + y) граммов раствора, в котором чистой перекиси должно быть 0,12 (x + y)
Имеем уравнение: 0,03x + 0,3y=0,12 (x + y)
Из этого уравнения находим x =2y, т.е. 3%-ного раствора надо взять вдвое больше.
Задача, описанная Перельманом, встречается не только в парикмахерских.
Например, для зарядки аккумуляторов бывает необходимо приготовить электролит, который должен содержать 24% серной кислоты из двух растворов с содержанием 92% и 10% серной кислоты.
2. Теоретические основы решения задач на смеси и сплавы.
Задачи на смеси, растворы и сплавы называют еще задачами на процентное содержание или концентрацию. Данный тип задач охватывает большой круг ситуаций – смешение товаров разной цены, жидкостей с различным содержанием соли, кислот различной концентрации, сплавление металлов с различным содержанием некоторого металла и пр. При решении задач данного типа используются следующие допущения:
1. Все получающиеся смеси и сплавы однородны;
2.Всегда выполняется «Закон сохранения объема или массы»:
если два раствора (сплава) соединяют в «новый» раствор (сплав), то выполняются равенства:
V = V1+V2 –сохраняется объем;
m = m1 + m2 – сохраняется масса.
3 Данный закон выполняется и для отдельных составляющих частей (компонентов)сплава (раствора).
Определение. Процентным содержанием (концентрацией или массовой долей) вещества в смеси называется отношение его массы к общей массе всей смеси. Это отношение может быть выражено либо в дробях, либо в процентах.
3.Задачи на смешение растворов разных концентраций.
Решим типовую задачу в общем виде и выведем формулу.
Задача:Имеются два куска сплава меди с цинком. Процентное содержание меди в них p1% иp2 % соответственно. В каком отношении нужно взять массы этих сплавов, чтобы, переплавив взятые куски вместе, получить сплав, содержащий p%меди?
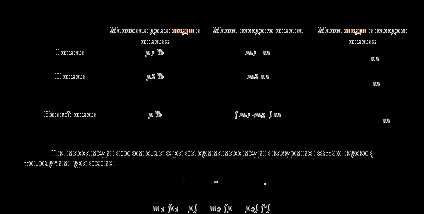 Решение.Понаблюдаем за содержанием меди.
Решение.Понаблюдаем за содержанием меди.
Исследуем уравнение (*) при условии, что будем брать ненулевые массы сплавов.
I случай. Если p1 ,p2 и p попарно не равны, то получим формулу
m1 (p1 – p) =m2(p – p2) (*)
II случай. Возьмём два сплава с одинаковым процентным содержанием меди, т.е. p1=p2 . Решая уравнение (*), получим, что p1=p2=p, т. к. ни большей, ни меньшей концентрации сплав просто не получится, если исходные материалы имеют одинаковую процентную концентрацию меди, каковы бы ни были массы исходных сплавов.
III случай. Если p2 =p, или p1= p ,то вывод тот же.
Если взять два сплава, массы которых одинаковы, т.е. m1 = m2 , то
то есть процентное содержание нового сплава станет равно среднему арифметическому процентных концентраций исходных сплавов. А теперь рассмотрим однотипные задачи, решение которых очень удобно по этой формуле:
Смешали некоторое количество 11%-го раствора некоторого вещества с таким же количеством 19%-го раствора этого же вещества. Найдите концентрацию раствора.
11%
19%
Или т. к. массы исходных растворов равны, то
Сколько килограммов 20%-го раствора соли нужно добавить к 1 кг 10%-го раствора, чтобы получить 12%-ый раствор соли?
20%
1кг
10%
12%
В сосуд, содержащий 13л 18%-го водного раствора некоторого вещества, добавили 5л воды. Найти концентрацию получившегося раствора.
13л
18%
5л
0%
%
Старинный способ решения задач на смешивание двух веществ.
Предположим, что смешиваются два вещества – первое стоимостью а гривен за фунт и второе стоимостью b гривен за фунт. Желательно получить вещество стоимостью с гривен за фунт. Будем считать, что а<b( если с>b или c<a , то задача неразрешима, ибо, смешивая дешевые вещества, дорогое не получишь). Поэтому можно считать, что a<c<b. Смешиваем один фунт первого вещества и q фунт второго. В результате получится 1+q фунтов вещества стоимостью a+bq гривен. Один фунт смеси должен стоить с гривен. Значит должно выполняться равенство
a+bq=c*(1+q). Отсюда находим q=(c-a)/(b-c) или (b-c):(c-a).
Это соотношение дает старинный способ.
«Правило креста»
При решении задач на смешивание растворов разных концентраций используется «правило креста». В точке пересечения двух прямых обозначают концентрацию смеси. У концов этих прямых слева от точки пересечения указывают концентрации составных частей смеси, а справа – разности концентраций смеси и ее составных частей:
Для приготовления 30 г 80%-го раствора кислоты требуется взять 20 г 90%-го и 10 г 60%-го растворов кислоты.
Задача:У некоторого человека были на продажу масла двух сортов: одно ценою 10 гривен за ведро, другое же 6 гривен за ведро. Захотелось ему сделать из этих двух масел, смешав их, масло ценою 7 гривен за ведро. Какие части этих двух масел нужно взять, чтобы получить ведро масла ценою 7 гривен?
Из схемы делаем заключение, что дешевого масла нужно взять втрое больше, чем дорогого, т.е. для получения одного ведра ценою 7 гривен нужно взять дорогого масла 1/4 ведра, а дешевого масла 3/4.
Способ Л.Ф.Магницкого для трех веществ
Указанный Л. Ф. Магницким способ состоит в следующем. Надо дважды применить способ записи исходных данных и необходимых количеств веществ, причем в первый раз взять вещества с большей и меньшей стоимостью, а во второй раз с наименьшей и средней стоимостью. Повторив действие вычитания и соответствующей записи разности, получим доли, в которых нужно смешивать вещества наибольшей и средней стоимости (на соответствующих строках). Сложив доли дешевого вещества, найденные в первый и во второй раз, получим долю дешевого вещества в общей смеси.
Задача: Некто имеет чай трех сортов – цейлонский по 5 гривен за фунт, индийский по 8 гривен за фунт и китайский по 12 гривен за фунт. В каких долях нужно смешать эти сорта, чтобы получить чай стоимостью 6 гривен за фунт?
Взять 6+2=8 частей чая ценой по 5 гривен и по одной части ценой 8 гривен и 12 гривен за один фунт.
Возьмем 8/10 фунта чая ценой по 5 гривен за фунт и по1/10 фунта чая ценой 8 и 12 гривен за фунт, то получим 1 фунт чая ценой 8/10*5 + 1/10*8 + 1/10*12 = 6 гривен
Ответ: 100 т и 40 т.
4. Задачи на многократные переливания.
Рассмотрим задачи, при решении которых можно выявить общую закономерность изменения концентрации раствора в результате многократно повторяющейся операции.
Решим в общем виде такую задачу:
В сосуде, объём которого равен V0 литров, содержится раствор соли концентрации С0. Из сосуда выливается a литров смеси и доливается a литров воды, после чего раствор тщательно перемешивается. Эта процедура повторяется n раз. Какова станет концентрация соли в растворе после n таких процедур?
Если в задаче n раз отливают некоторое количество раствора и затем столько же раз приливают такое же количество воды или другого однородного вещества, то для решения задачи пригодится формула:
Где n– количество шагов, V0– начальный объём, который сохраняют неизменным при каждом шаге Сn– конечная концентрация,C0– начальная концентрация,
a – объём отливаемой каждый раз смеси
Докажем эту формулу:
Последовательность С0, С1, С2, Сn-1, Сn представляет собой убывающую
геометрическую прогрессию концентраций раствора.
Выражение Сn* V0соответствует количеству соли после проведения n-ой процедуры.
Но эта же соль присутствовала в (V0 – a) л предыдущего раствора
в количестве Сn-1 (V0 –a)л Составим уравнение: Сn* V0 = Сn-1 (V0 –a) и разделим обе части на V0 , откуда получаем .
Однотипные задачи, которые уже легко решить с помощью данной формулы.
С0
V0
a
n
Cn
В сосуде имелось 1250 л 80%-го р-ра к-ты. Из него три раза отливали некоторое кол-во р-ра, добавляя такое же кол-во воды. В результате в сос. осталось 125л чистой к-ты. Какое кол-во р-ра брали изсосуда каждый раз?
Ответ:625 л.
С3=С0(1-a/1250)3
0,1=0,8(1-a/1250)3
0,125=(1-a/1250)3
0,5=1-a/1250
a/1250=0,5
a=625
Сколько литров чистого спирта останется в сосуде, если из 50л 80%-ного раствора 20 раз отливать по 1л раствора, каждый раз добавляя по 1 л воды?
Ответ:26,7 л.
С20=0,8(1-1/50)20
С20=0,534
0,534*50=26,7(л)
Существуют задачи, внешне похожие на применение формулы Сn, но при внимательном чтении оказывается, что цикл переливаний не закончен. В таких случаях надо быть очень внимательным.
Задача:Из сосуда, наполненного кислотой, вылили несколько литров и долили водой; потом опять вылили столько же литров смеси; тогда в сосуде осталось 24 л чистой кислоты. Ёмкость сосуда 54 л. Сколько кислоты вылили в первый раз и второй раз?
Решение: Будем иметь в виду, что на втором шаге воду не доливали.
По условию задачи объём сосуда, наполненного кислотой, 54 л. Её концентрация 100%. Пусть вылили х литров смеси, тогда в сосуде осталось (54-х) литров 100%-ной кислоты. В сосуд доливают хл воды. По определению концентрации надо массу кислоты разделить на массу раствора: (54-х)/54.
Опять выливают х литров смеси, в сосуде остаётся (54-х) л смеси с массовой долей кислоты (54-х)/54.
Чтобы найти массу кислоты в этой оставшейся смеси, надо массу раствора умножить на концентрацию кислоты в этом растворе. По условию масса чистой кислоты в этом растворе стала 24л.
Составим и решим уравнение:
(54-х)* ((54-х)/54) = 24,
(54-х)2= 1296,
зная, что х<54, получим единственное решение: х = 18.
В первый раз вылили 18 литров чистой кислоты. Но во второй раз выливали 18 литров смеси, в ней чистой кислоты было
18* (54-18)/5 =12 (л)
Ответ: 18 л; 12л
Задача: Имеются сплавы золота и серебра. В одном эти металлы находятся в отношении 2: 3, а в другом в отношении 3: 7. Сколько нужно взять от каждого сплава, чтобы получить 1 кг нового, в котором золото и серебро находились бы в отношении 5: 11?
По этой схеме уравнение х + у =1 показывает массу нового сплава.
Определяем массу золота в каждом сплаве и получаем уравнение
Аналогично определяем массу серебра и получаем уравнение
Записываем одну из систем:
Решая ее, получаем х = 0,125 и у = 0,875
Ответ: 125 г и 875 г.
Есть очень легкий, быстрый и «хитрый» способ решения подобных задач, предложенный американским физиком ( русского происхождения) Алексеем Султановым:
= ==
Использованная литература.
Алгебра-7:учебник автор: Ю.Н. Макарычев, Н.Г. Миндюк, К.Н. Нешков,
С.Б. Суворова, Просвещение, 2010
Прокопенко Н. И.Задачи на смеси и сплавы. – М.: Чистые пруды, 2010.
Под редакцией М.И. Сканави. Сборник задач по математике. Москва, 2002г.
И.Н. Сергеев ,С. Н. Олехник. Примени математику. Москва «Наука»,1990 г.
Сборник задач по математике. Под редакцией А. И. Прилепко.
Москва «Высшая школа», 1998 г.
О. А.Городнова Статья «Учимся решать задачи на«смеси и сплавы»,
г-та«Математика»№36 за 2004 г.
А.В. Шевкин Школьные математические олимпиады,
изд-во «Русское слово», 2002г.
8.« Занимательной алгебры» авт. Я.И. Перельман.
infourok.ru
Задачи на смеси газов
Задачи на смеси газов.
Задача 1. При нагревании 25% состава аммиака распалось на простые вещества. Найдите объёмные доли газов в конечной смеси.
Дано: Решение
1 способ
Рассмотрим 100 л.
тогда
Ответ:
2 способ
Рассмотрим 200 л (более удобные для расчетов числа)
Ответ:
31
3 способ
Рассмотрим 5 молей аммиака. Тогда
5 моль – 100%
x моль – 25%
Пояснение:
100% – 25% = 75% NH3 не разложившегося
конеч
4 способ (табличный).
Удобнее взять 16 моль, чтобы производить расчёты в уме.
исходные
16 моль
–
–
прореагиров.
4 моль
2 моль
6 моль
осталось
12
2
6
0,6
0,1
0,3
60%
10%
30%
32
Задача 2. При нагревании половина SO3 распалась на SO2 и O2. Определите среднюю молярную массу полученной смеси (SO3 – газ).
Дано: Решение
исходные
4 моль
–
–
прореагиров.
2 моль
2 моль
1 моль
осталось
2 моль
2 моль
1 моль
Мср.смеси – ?Задача 3. Смесь равных объёмов пропущена над катализатором; при этом 80% превратилось в . Какова плотность по водороду полученной газовой смеси (SO3 – газ)?
Дано: Решение
Берём 5 моль
исходные
5 моль
5 моль
–
прореагиров.
4 моль
2 моль
4 моль
осталось
1 моль
3 моль
4 моль
Ответ:
Задача 4. Имеется смесь N2 и Н2, в которой объёмы газов относятся соответственно как 1 : 3. При пропускании этой смеси над катализатором прореагировало 40% смеси. Найдите объёмные доли газов в конечной смеси.
33
Дано: Решение
исходные
5 моль
15 моль
–
прореагиров.
2 моль
6 моль
4 моль
осталось
3 моль
9 моль
4 моль
16 моль
0,1875
0,5625
0,25
Ответ:
Задача 5. Реагируют равные объёмы с образованием . Каков будет объёмный состав конечной смеси в объёмных долях, если только 90% молекул превратится в (считайте
Дано: Решение
исходные
10 моль
10 моль
прореагиров.
9 моль
4,5 моль
9 моль
осталось
1 моль
5,5 моль
9 моль
15,5 моль
64,5%
35,6%
58,06%
34
infourok.ru
Задачи на смеси веществ
Сплав меди и алюминия массой 3,68 г. обработали избытком соляной кислоты и получили 1,77 дм3 (н.у.) водорода. Рассчитайте массовые доли металлов в их смеси.
Сплав меди и серебра массой 1,2 г. с массовой долей серебра равной 45%, обработали разбавленным раствором азотной кислоты. К полученному раствору прилили избыток раствора бромида натрия. Рассчитайте массу полученного осадка.
Имеется смесь гидроксида кальция, карбоната кальция и сульфата бария массой 10,5 г. При обработке смеси соляной кислотой выделилось 672 мл газа (н.у.). Определить массовый состав смеси, если в реакцию вступило 71,2 г 10% раствора соляной кислоты.
При обработке 7,6 г. смеси гидридов калия и натрия водой выделилось 5,6 дм3 водорода (н.у.). Определите массовые доли гидридов в смеси.
На хлорирование 3,00 г. смеси железа и меди потребовалось 1,12 дм3 хлора (н.у.). Найдите массы металлов в смеси.
Смесь 18,20 г. хлорида натрия, гидрокарбоната натрия и карбоната аммония прокалили до постоянной массы. Масса сухого остатка составила 11,15 г. Этот сухой остаток обработали избытком соляной кислоты, при этом выделилось 0,05 моль газа. Раствор выпарили и полученное вещество высушили. Определить состав полученного вещества и его массу. Каковы массы веществ в исходной смеси?
Смесь цинка и сульфида цинка массой 22,7 г. полностью растворили в соляной кислоте. При этом выделился газ объёмом (н.у.) 6,72 дм3. Определите массовую долю цинка в смеси.
Смесь железа и оксида железа (III) прореагировала с хлором объёмом 2,24 дм3. На растворение такого же образца была затрачена соляная кислота массой 100 г с массовой долей хлороводорода 14,6%. Рассчитайте массовую долю железа в смеси.
Кусочек латуни (состав латуни: 60% меди и 40% цинка) массой 10,0 г обработали соляной кислотой с массовой долей кислоты 30% (плотность 1,15 г/см3). Какой объём газа выделится при реакции и какой объём кислоты при этом израсходовался?
Раствор нитрата двухвалентного металла разделили на две равные части. Одну часть обработали сульфидом аммония, при этом выпало 4,78 г осадка. Другую часть обработали сульфатом калия, при этом выпало 6,06 г осадка. Определите металл.
videouroki.net
Методическая разработка по химии (9 класс) по теме: Решение задач на смеси исплавы
Муниципальное бюджетное образовательное учреждение “Средняя общеобразовательная школа №11 с углубленным изучением отдельныхпредметов Зеленодольского муниципального района Республики Татарстан” | “Татарстан Республикасы Зеленодол муниципаль районының аерым предметлар тирәнтенөйрәнелә торган 11нче урта гомуми белем мәктәбе” гомуми белем муниципаль учреждениесе |
422540, РТ, г. Зеленодольск, ул. Гоголя, д.40а
тел. (84371) 5-27-08, 5-44-15, факс 5-27-08,
Е-mail: [email protected]
Интегрированный урок математики и химии на тему:
«Решение текстовых задач на смеси и сплавы»
9 класс.
Выполнил: учитель математики высшей квалификационной категории
Имамеева Ф.Р.,
учитель химии высшей квалификационной категории
Абдулина М.И.
Интегрированный урок математики и химии на тему:
«Решение текстовых задач на смеси и сплавы»
9 класс.
Цели:
образовательная: обобщить и углубить знания учащихся необходимые для решения текстовых задач, продолжить формирование математической и химической грамотности учащихся.
воспитательная: применять полученные математические и химические знания в повседневной жизни.
развивающая: продолжить развитие логического и креативного мышления.
Ход урока:
Учитель математики:
Растворы и сплавы – это то, что окружает человека повсеместно и ежедневно. Сегодня на уроке мы вспомним не только математические, но и химические понятия, чтобы в очередной раз показать, насколько тесно связаны все науки с математикой. Мы будем решать задачи на смеси и сплавы, которые встречаются в экзаменационных тестах, как по математике, так и по химии. Задачи такого типа часто вызывают затруднения, но «решение задач – практическое искусство, подобное игре на фортепьяно, научиться ему можно только постоянно решая задачи и рассматривая решения трудных задач в качестве образцов». (Слайд №2)
Учащиеся записывают тему урока – «Решение текстовых задач на смеси и сплавы»
На нашем уроке математики присутствует учитель химии, так как: все задачи, которые мы будем решать, связаны с химическими процессами и кроме того мы покажем три способа решения задач на смеси и сплавы, среди которых один – химический.
Для решения задач необходимо повторить некоторые теоретические моменты.
Учитель задает вопрос: «Что такое процент?» Учащиеся отвечают.
Учитель просит соотнести проценты и соответствующие им десятичные дроби (слайд№3)
9% 17% 123% 0,3% 75%
0,003 0,75 0,09 0,17 1,23
Предлагает учащимся решить задачу (слайд№4):
Приготовить 500 грамм 9% раствора уксуса из 75% уксусной эссенции.
Эта задача имеет практическое применение, когда в домашних условиях нужно из уксусной эссенции приготовить столовый 9% уксус для консервирования овощей.
Учитель химии. Для решения задачи необходимо повторить некоторые химические формулы и понятия. С понятием растворы мы сталкиваемся на протяжение всего изучения химии. При изучении темы «Растворы», мы говорим о процентной концентрации, вспомним, из чего складывается масса раствора. Учащиеся записывают формулу: mраствора = mвещества + mводы. В качестве растворителя в нашем случае рассматривается вода. Исходя из этой формулы, можно найти массу воды.
Mводы. = mраствора – mвещества
Учитель химии спрашивает, изменится ли масса вещества при добавлении воды. Учащиеся отвечают, что масса вещества не меняется.
Учитель математики предлагает рассмотреть первый способ решения задачи – с помощью таблицы (этим способом мы решали задачи на движение).
Учитель математики вместе с учениками составляет таблицу.
Раствор №1 | Раствор №2 | Вода | |
Масса раствора | Хг | 500г | 500-Х г |
Процентное содержа- ние уксуса | 75%=0,75 | 9%=0,09 | 0% |
Масса чистой уксусной кислоты. | 0,75 х Х | 0,09х 500 |
Учитель математики просит составить уравнение для нахождения массы уксусной эссенции на основании данных таблицы.
Ученик составляет и решает уравнение у доски:
0,75×Х = 0,09×500
0,75×Х = 45
Х = 60
500 – 60 = 440
Ответ: для приготовления 500г 9% уксуса необходимо взять 60 г уксусной эссенции и 440 г воды.
Учитель химии. На уроках математики вы говорите о процентном содержании вещества в растворе, в химии мы называем это массовая доля растворенного вещества. Учитель предлагает записать формулу, по которой рассчитывается массовая доля растворенного вещества в растворе.
Учащиеся записывают формулу на доске и в тетради.
W=mв-ва/mр-ра ×100%, выводим из этой формулы массу раствора. mр-ра=mв-ва/ W×100%.
Учитель химии предлагает решить задачу вторым способом, используя химические формулы.
W=mв-ва/mр-ра ×100%, mв-ва = W× mр-ра / 100%; mв-ва = 9%×500/100 =45г.
Учитель химии напоминает, что при разбавлении растворов водой масса растворенного вещества не меняется, следовательно mр-ра=45 / 75×100%. или 0,75× mр-ра =45; mр-ра =60. Учитель химии обращает внимание учащихся на то, что в итоге получается такое же уравнение с одним неизвестным, которое учащиеся получили, решая задачу математическим способом:
Учитель математики:
Третий способ – это универсальный способ. В математике этот способ известен как старинный способ решения задач (его ещё называют методом креста, диагональной схемы). В химии он называется методом смешения растворов.
Если p – концентрация воды,q- концентрация 75% раствора,r – концентрация 9% раствора, то работает следующая диагональная схема:
p q – r
r
q r – p
Если концентрацию растворов выразить не в процентах, а в частях, то по задаче имеем:
0 75 – 9 = 66
9 75
75 9 – 0 = 9
9/75 × 500 = 60г уксусной эссенции;
500 – 60 = 440г воды;
Учитель химии показывает решение задачи по правилу смешения растворов.
0,75 0,09
0,09 0,75 (общее количество частей двух растворов)
- 0,66
Находим массу 75% раствора уксусной эссенции:
mр-ра= 0,09/0,75×500=60 г.
Находим массу воды
. mводы= 0,66/0,75×500=440 г.
Учитель математики. Мы предложили три способа решения одной и той же задачи: математический, химический, универсальный.
На оставшейся части урока ребятам предлагаются задачи на сплавы.
Учитель химии напоминает, что растворы бывают твердыми, жидкими и газообразными, то есть сплавы – это те же растворы, поэтому любой из ранее предложенных способов подходит для решения задач на сплавы.
Учащиеся решают, выбирая один из выше показанных способов решения. Задачи проверяются учителем и более сильными учениками
Задачи:
- Сплав олова с медью весом 12 кг содержит 45% меди. Сколько чистого олова надо добавить, чтобы получить сплав, содержащий 40% меди.
- Имеются два сплава, в первом содержится 40% серебра, а во втором-20% серебра. Сколько килограммов второго сплава необходимо добавить к 20кг первого сплава, чтобы получить сплав, содержащий 30% серебра?
Учитель математики подводит итог урока: Способов решения задач много, выбирайте тот, который каждому из вас кажется более простым и понятным. Главное, чтобы задача была решена правильно.
Учитель математики оценивает работу учащихся, задаёт домашнее задание.
nsportal.ru
