Задачи на растворы и способы их решения
Решение задач на растворы является важным разделом курса химии в современной школе. У многих ребят возникают определенные затруднения при проведении вычислений, связанные с отсутствием представлений о последовательности выполнения задачи. Проанализируем некоторые термины, которые включают в себя задачи на растворы по химии, и приведем примеры готовых решений.
Процентная концентрация
Задачи предполагают составление и решение пропорции. Учитывая, что выражается этот вид концентрации в массовых долях, можно определить содержание вещества в растворе.
Упомянутая величина является количественной характеристикой раствора, предложенного в задаче. В зависимости от типа задания, необходимо определять новую процентную концентрацию, рассчитывать массу вещества, вычислять объем раствора.
Молярная концентрация
Некоторые задачи на концентрацию растворов связаны с определением количества вещества в объеме растворителя. Единицами измерения такой величины является моль/л.
Единицами измерения такой величины является моль/л.
В школьной программе задания такого вида встречаются только на старшей ступени обучения.
Особенности задач на растворы
Приведем некоторые задачи на растворы по химии с решением, чтобы показать последовательность действий при их разборе. Для начала заметим, что можно делать рисунки, чтобы понять суть процессов, описываемых в предложенном задании. При желании можно оформлять задачу и в виде таблицы, в которой будут поставлены исходные и искомые величины.
Задача 1
В емкость, содержащую 5 литров 15%-раствора соли, влили семь литров воды. Определите процентную концентрацию вещества в новом растворе.
Для того чтобы определить искомую величину, обозначим ее через Х. Через пропорцию вычислим количественное содержание вещества в первом растворе: если 5 умножить на 0,15, получаем 0,75 грамма.
Далее вычисляем массу нового раствора, учитывая, что влили 7 литров воды, и получаем 12 граммов.
Находим содержание в процентах поваренной соли в полученном растворе исходя из определения данной величины, получаем: (0,75 : 12) х 100% = 6,25%
Приведем еще один пример задания, связанного с использованием при расчетах математической пропорции.
Задача 2
Сколько по массе меди необходимо добавить к куску бронзы, имеющему массу 8 килограммов, содержащему 13 процентов чистого металла, чтобы увеличить процентное содержание меди до 25 %.
Такие задачи на растворы сначала требуют определить массу чистой меди в исходном сплаве. Для этого можно воспользоваться математической пропорцией. В результате получается, что масса составляет: 8 х 0,13 = 1,04 кг
Искомую величину возьмем за х (граммов), тогда в новом сплаве получим ее значение (1,04 + х) килограммов. Выразим массу получаемого сплава, получаем: (8 + х) килограммов.
В задаче содержание металла в процентах в новом сплаве составляет 25 процентов, можно составить математическое уравнение.
Разнообразные задачи на растворы включают в тестовые задания для проверки уровня предметных знаний выпускников одинадцатых классов. Приведем некоторые условия и решения заданий такого типа.
Приведем некоторые условия и решения заданий такого типа.
Задача 3
Определите объем (при нормальных условиях) газа, который был собран после введения 0,3 моль чистого алюминия в 160 миллилитрах теплого 20% раствора едкого калия (1,19 г/мл).
Последовательность проведения расчетов в данной задаче:
- Сначала необходимо определить массу раствора.
- Далее вычисляется количество щелочи.
- Полученные параметры сравниваются между собой, определяется недостача. Последующие вычисления проводят по веществу, взятому в недостаточном количестве.
- Пишем уравнение реакции, происходящей между исходными веществами, расставляем стереохимические коэффициенты. Проводим вычисления по уравнению.
Масса раствора щелочи, используемой в задаче, составляет 160 х 1,19 = 190,4 г.
Масса вещества составит 38,08 грамма. Количество взятой щелочи – 0,68 моль. В условии сказано, что количество алюминия 0,3 моль, следовательно, в недостатке присутствует именно этот металл.
Последующие вычисления осуществляем именно по нему. Получается, что объем газа составит 0,3 х 67,2/2 = 10,08 л.
Задачи на растворы такого типа у выпускников вызывают максимальные затруднения. Причина в неотработанности последовательности действий, а также в отсутствии сформированных представлений об основных математических вычислениях.
Задача 4
Задачи по теме «Растворы» могут включать и определение чистого вещества при заданном процентном содержании примесей. Приведем пример подобного задания, чтобы у ребят не возникало сложностей с его выполнением.
Вычислите объем газа, полученного при воздействии концентрированной серной кислоты на 292,5 г соли с 20% примесей.
Последовательность действий:
- Учитывая, что в условии задачи говорится о наличии 20 процентов примесей, необходимо определить содержание вещества по массе (80 %).
- Прописываем уравнение химической реакции, расставляем стереохимические коэффициенты. Проводим вычисления объема выделяющегося газа, используя молярный объем.

Масса вещества, исходя из того, что есть примеси, получается 234 грамма. А при проведении вычислений по данному уравнению, получим, что объем будет равен 89,6 литров.
Задача 5
Какие еще предлагаются в школьной программе по химии задачи на растворы? Приведем пример задания, связанного с необходимостью вычисления массы продукта.
Сульфид свинца (II), имеющий массу 95,6 г, взаимодействует с 300 миллилитрами 30%-раствора перекиси водорода (плотность 1,1222 г/мл). Продукт реакции составляет (в граммах) …
Порядок решения задачи:
- Растворы веществ переводим через пропорции в массу.
- Далее определяем количество каждого исходного компонента.
- После сравнения полученных результатов, выбираем то вещество, которое взято в недостаточном количестве.
- Вычисления проводим именно по веществу, взятому в недостатке.
- Составляем уравнение химического взаимодействия и вычисляем массу неизвестного вещества.
Вычислим раствор перекиси, он составляет 336,66 грамма.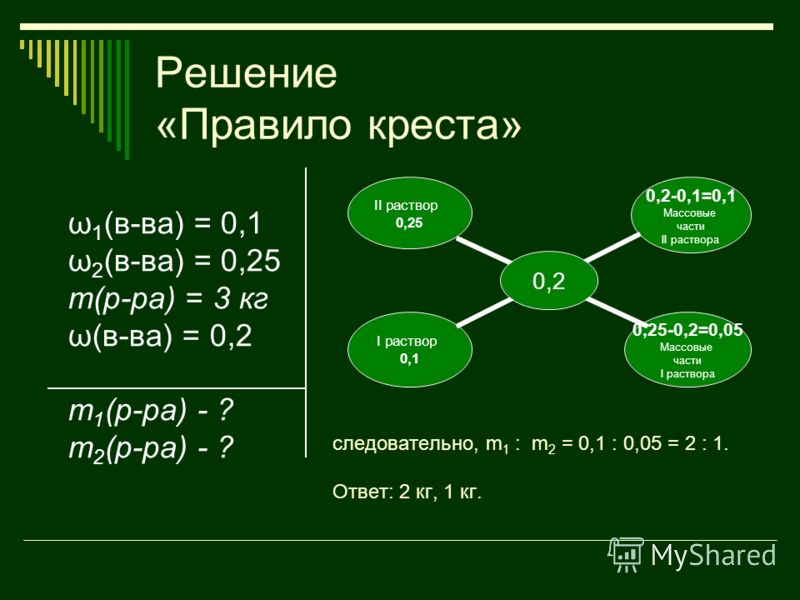 Масса вещества будет соответствовать 100,99 грамма. Вычислим количество моль, оно составит 2,97. Сульфида свинца будет 95,6 /239 =0,4 моль, (он содержится в недостатке).
Масса вещества будет соответствовать 100,99 грамма. Вычислим количество моль, оно составит 2,97. Сульфида свинца будет 95,6 /239 =0,4 моль, (он содержится в недостатке).
Составляем уравнение химического взаимодействия. Определяем по схеме искомую величину и получаем 121,2 граммов.
Задача 6
Найти количество газа (моль), которое можно получить при термическом обжиге 5,61 кг сульфида железа (II), имеющего степень чистоты 80%.
Порядок действий:
- Вычисляем массу чистого FeS.
- Записываем уравнение химического взаимодействия его с кислородом воздуха. Проводим вычисления по реакции.
По массе чистое вещество составит 4488 г. Количество определяемого компонента будет 51 литр.
Задача 7
Из 134,4 литров (при нормальных условиях) оксида серы (4) приготовили раствор. К нему прилили 1,5 литра 25%-раствора едкого натра (1,28 г/мл). Определите массу получившейся соли.
Алгоритм вычислений:
- Рассчитываем массу раствора щелочи по формуле.

- Находим массу и число моль едкого натра.
- Вычисляем эту же величину для оксида серы (4).
- По соотношению полученных показателей определяем состав образующейся соли, определяем недостаток. Расчеты проводим по недостатку.
- Записываем химическую реакцию с коэффициентами, вычисляем массу новой соли по недостатку.
В итоге у нас получается:
- раствор щелочи составит 1171,875 грамма;
- по массе гидроксида натрия составит 292,97 грамма;
- в молях данного вещества содержится 7,32 моль;
- анологично вычисляем для оксида серы (4), получаем 6 моль;
- в результате взаимодействия будет образовываться средняя соль;
- получаем 756 граммов.
Задача 8
К 100 граммам 10%-раствора хлорида аммония прилили 100 г 10%-раствора нитрата серебра. Определите массу (в граммах) осадка.
Алгоритм вычислений:
- Вычисляем массу и количество вещества хлорида аммония.
- Рассчитываем массу и количество вещества соли – нитрата серебра.

- Определяем, какое из исходных веществ было взято в недостаточном количестве, проводим по нему расчеты.
- Записываем уравнение происходящей реакции, проводим по ней расчеты массы осадка.
Холрида аммония по массе будет 10 г, по количеству – 0,19 моль. Нитрата серебра взято 10 граммов, что составляет 0,059 моль. При вычислениях по недосттаку, получим массу соли 8,46 грамма.
Для того чтобы справиться со сложными заданиями, которые предлагаются на выпускных экзаменах в девятом и одиннадцатом классе (по курсу неогранической химии), необходимо владеть алгоритмами и иметь определенные вычислительные навыки. Кроме того, важно владеть технологией составления химических уравнений, уметь расставлять коэффициенты в процессе.
Без таких элементарных умений и навыков даже самая простая задача на определение процентной концентрации вещества в растворе либо смеси, покажется выпускнику трудным и серьезным испытанием.
Задачи на растворы – презентация онлайн
Похожие презентации:
Задачи на растворы
Задачи на массовую долю растворённого вещества в растворе
Задачи на смеси и сплавы.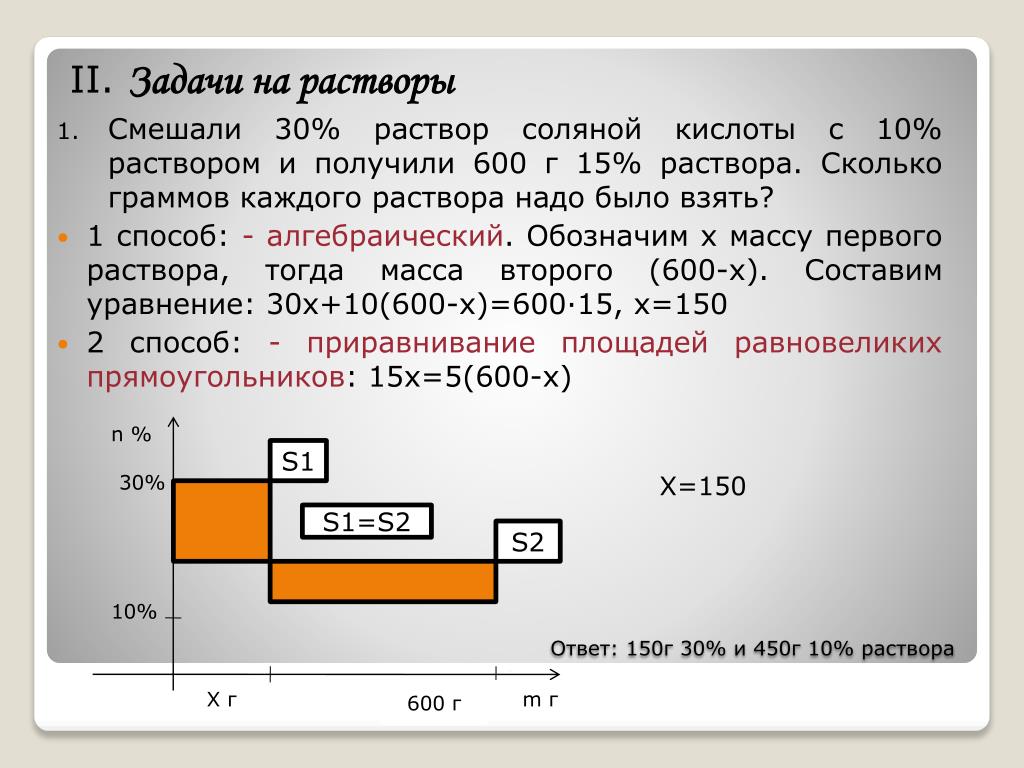 Метод Пирсона
Метод Пирсона
Задачи на смеси и сплавы
Задачи в школьном курсе химии
Задачи на процентную концентрацию
Текстовые задачи. Задачи на смеси и сплавы
Задачи на «избыток-недостаток»
Задачи на смеси (задание № 33)
Химическая термодинамика. Задачи
1. Задачи на растворы
Способы выражения концентрацииМассовая доля растворенного вещества (ω),
процентная концентрация (С%) – показывает,
какая масса вещества растворена в 100 г раствора
и вычисляется по формуле
mвещества(г)
ω =—————–m раствора(г)
Из этой формулы можно получить другие расчетные
формулы:
mв-ва = ω * mр-ра
mв-ва
m (раствора) =———ω
Действия с растворами
1
растворов
2
Концентрирование
растворов
3
Смешивание
2 и более
растворов
«Метод стаканчиков»
1. Изобразить 3 стаканчика.
W1
W2
W3
m1
m2
m3
исходные
конечный
растворы
раствор
2.
 Сверху стаканчиков записывают
Сверху стаканчиков записываютмассовую долю растворенного вещества
3.Под стаканчиками – массы компонентов.
«Метод стаканчиков»
4.Составляем математическое выражение
W1
W2
W3
m1
m2
m3
исходные
растворы
конечный
раствор
w1 ∙ m1 + w2 ∙ m2 = w3 ∙ m3
с одним неизвестным)
Традиционный способ решения
Решение задач связанные с разбавлением
растворов.
Задача. К 120 граммам 5% раствора соли добавили
80 г воды. Вычислите массовую долю соли в
полученном растворе.
Решение:
Составляем схему приготовления раствора.
0,05
0
х
│▬│
+
│▬│ =
│▬│
120
80
200
Составляем уравнение и решаем его относительно х
• 120 *0,05 + 0 * 80 = 200х
• 6 +0 = 200х
NB!! Доля в воде
• х = 6/200
всегда принимается
за 0
х = 0,03 или 3%
Ответ: ω (соли)=0,03 или 3%
Решение задач связанные со смешиванием
растворов.
Задача.

долей соли 0,1 и 20 граммов этого же раствора с
массовой долей соли 0,3. Вычислите массовую
долю растворенного вещества во вновь полученном
растворе?
Решение: Составляем схему приготовления раствора.
0,1
0,3
х
│▬│
+
│▬│ =
│▬│
200
20
220
Составляем уравнение и решаем его относительно х
• 200 *0,1 + 20 * 0,3 = 220х
• 20 +6 = 220х
• х = 0,11 или 11%
Ответ: ω (соли)=0,11 или 11%
Решение задач связанные с
концентрированием раствора
Задача. К 200 граммам 4% раствора соды добавили
еще 5 г вещества. Определите массовую долю
Дано:
Решение:
m(р-ра) = 200г
Составляем схему приготовления раствора
ω1 = 4%или 0,04
0,04
1
х
m добав. в-ва = 5г
│▬│
+ │▬│ =
│▬│
Найти ω2 -?
200
5
205
Составляем уравнение и решаем его относительно х
• 200 *0,04 + 5 * 1= 205х
NB!! Доля самого
• 8+5 = 205х
cухого вещества
• х = 0,063 или 6,3%
(без раствора)
Ответ: ω (соды)=0,063 или 6,3%
всегда =1 (100%).

Решение задач связанные с
концентрированием раствора
Задача. Из 400 граммов 20% раствора соли
стала равна массовая доля соли в полученном
растворе?
Дано:
Решение:
m(р-ра) = 400г
Составляем схему приготовления раствора
ω1 = 20%или 0,2
0,2
0
х
│▬│ ▬ │▬│ = │▬│
m удал. в-ва = 100г
Найти ω2 -?
400
100
300
Составляем уравнение и решаем его относительно х
• 400 *0,2 – 100 * 0 = 300х
NB!! Доля в воде
• 80 = 300х
всегда принимается
• х = 0,266 или 26,6%
за 0
Ответ: ω (соли)=0,266 или 26,6%
1) К раствору хлорида кальция массой 160г и массовой долей
5% добавили 12г этой же соли. Массовая доля соли в
полученном растворе равна ____ %. (Запишите число с
(11,63 %)
2) Массовая доля сахара в сиропе, полученном упариванием 1
кг 10%-го раствора сахара до массы 250 г, равна _____ %.
(Запишите число с точностью до целых).
 (40%)
(40%)1) К 200 г 20%-го раствора гидроксида натрия добавили 80 г воды и 16 г гидроксида
натрия. Массовая доля щелочи в полученном растворе равна_______(Запишите
число с точностью до целых).
(19%)
2)Массовая доля соли в растворе, полученном при добавлении 120г воды к 200 г
раствора с массовой долей соли 8% равна ______%. (Запишите число с точностью до
(5%)
целых)
3)Рассчитайте массу(г)соли, которую необходимо добавить к 240 мл воды, чтобы
4)Смешали 120 г 12%-го раствора натриевой селитры и 360 г 8%-го раствора этой же
соли. Массовая доля соли в полученном растворе составила ______%. (Запишите
число с точностью до целых).
(9%)
English Русский Правила
Химия: проблемы и решения
Преподает концепции общей химии, представляя реальные проблемы в области производства энергии, разработки материалов, биохимии и защиты окружающей среды. Курс фокусируется на основных темах, изучаемых во вводной химии, обеспечивая прочную основу для учащихся, чтобы продолжить изучение науки. Видеоролики включают лабораторные демонстрации ключевых законов и процессов, интервью с учеными-исследователями и промышленными химиками, а также пояснительные анимации.
Курс фокусируется на основных темах, изучаемых во вводной химии, обеспечивая прочную основу для учащихся, чтобы продолжить изучение науки. Видеоролики включают лабораторные демонстрации ключевых законов и процессов, интервью с учеными-исследователями и промышленными химиками, а также пояснительные анимации.
Химия: задачи и решения
Эпизод 1
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 1
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 2
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 2
28 минут 28 секунд
Уровень класса: 10–12
Химия: задачи и решения
Эпизод 3
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 3
28 минут 28 секунд
Уровень обучения: 10–12
Химия: задачи и решения
Эпизод 4
28 минут 27 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 4
28 минут 27 секунд
Уровень класса: 10–12
Химия: задачи и решения
Эпизод 5
28 минут 26 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 5
28 минут 26 секунд
Уровень класса: 10–12
Химия: вызовы и решения
Эпизод 6
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 6
28 минут 28 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 7
28 минут 30 секунд
Уровень: 10–12
Химия: вызовы и решения
Эпизод 7
28 минут 30 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 8
28 минут 29 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 8
28 минут 29 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 9
28 минут 27 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 9
28 минут 27 секунд
Уровень: 10–12
Химия: вызовы и решения
Эпизод 10
28 минут 30 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 10
28 минут 30 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 11
28 минут 26 секунд
Уровень: 10–12
Химия: вызовы и решения
Эпизод 11
28 минут 26 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 12
28 минут 27 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 12
28 минут 27 секунд
Уровень класса: 10–12
Химия: задачи и решения
Эпизод 13
28 минут 26 секунд
Уровень: 10–12
Химия: задачи и решения
Эпизод 13
28 минут 26 секунд
Уровень: 10–12
Руководство по приготовлению раствора | Carolina.
 com Руководство по приготовлению раствора | Каролина.com
com Руководство по приготовлению раствора | Каролина.com- Моя учетная запись
Войдите или зарегистрируйтесь сейчас, чтобы максимально сэкономить и получить доступ к информации профиля, истории заказов, отслеживанию, спискам покупок и многому другому.
Авторизоваться Завести аккаунт
- Обслуживание и поддержка
Связаться с нами
Наша служба поддержки клиентов работает с 8:00 до 18:30 по восточноевропейскому времени с понедельника по пятницу. Онлайн-чат доступен с 8:00 до 17:30 по восточному времени с понедельника по пятницу.
- Телефон:
- 800.334.5551
- Факс:
- 800.222.7112
- Электронная почта:
- Электронная почта Служба поддержки клиентов
Подробнее Обслуживание и поддержка
Международные продажи и обслуживание
Мы обслуживаем преподавателей более чем в 170 странах мира.
 Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж.
Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж.Международная информация для заказа
- Покупки
СпискиВойдите или зарегистрируйтесь сейчас, чтобы максимально сэкономить и получить доступ к информации профиля, истории заказов, отслеживанию, спискам покупок и многому другому.
Авторизоваться Завести аккаунт
- Быстрый заказ
Каролина предлагает множество типов готовых растворов, но некоторые учителя предпочитают делать свои собственные. Если это вас интересует, продолжайте читать. Это краткое руководство предоставит вам информацию, необходимую для создания ряда решений, обычно используемых в учебных лабораториях.
Рассмотрим некоторые соображения безопасности:
- Всегда надевайте соответствующие средства индивидуальной защиты (СИЗ) при работе с химическими веществами и приготовлении растворов.
 Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям.
Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям. - Дважды прочитайте этикетку на химическом веществе перед использованием. Прочтите его, когда берете химическое вещество с полки, и еще раз перед тем, как вынуть какое-либо химическое вещество из бутылки.
- При использовании концентрированных химикатов для приготовления растворов убедитесь, что вы медленно добавляете более концентрированный раствор к менее концентрированному. Обратная процедура может привести к закипанию и разбрызгиванию раствора.
Приготовление раствора
Молярные растворы
Молярность (М) означает количество молей растворенного вещества на литр раствора. Для приготовления 1 М раствора медленно добавляют 1 формульную массу соединения в чистую мерную колбу емкостью 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте соединению полностью раствориться, осторожно встряхивая колбу, если это необходимо. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте пробку и, положив большой палец на пробку, а руку на горлышко колбы. несколько раз перевернуть колбу для перемешивания. Вот несколько примеров использования этого метода:
Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте пробку и, положив большой палец на пробку, а руку на горлышко колбы. несколько раз перевернуть колбу для перемешивания. Вот несколько примеров использования этого метода:
Чтобы приготовить 1 М раствор гидроксида натрия, медленно добавьте 40 г гидроксида натрия к 500 мл дистиллированной или деионизированной воды в мерной колбе емкостью 1 л. Когда твердые вещества полностью растворятся и раствор станет комнатной температуры, разбавьте до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Чтобы приготовить 1 М раствор уксусной кислоты, растворите 60,05 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в мерной колбе вместимостью 1 л. Поскольку уксусная кислота является жидкостью, кислоту также можно измерять по объему.
 Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разведения
При приготовлении разбавления определите необходимый объем и молярную концентрацию полученного раствора. Используйте следующее уравнение, чтобы определить, сколько концентрированного реагента необходимо для приготовления разбавленного раствора,
, где M , где M . Медленно добавьте рассчитанный объем концентрированного реагента в мерную колбу подходящего размера, наполовину заполненную дистиллированной или деионизированной водой, и перемешайте колбу. Например, какой объем 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты? 10 М × В реагент = 0,50 М × 1,0 л Для приготовления 1,0 л 0,50 М уксусной кислоты требуется объем 50 мл 10 М уксусной кислоты. Для приготовления этих растворов медленно добавляйте необходимые ингредиенты в мерную колбу объемом 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте ингредиентам полностью раствориться, осторожно встряхивая колбу при необходимости. Когда растворенное вещество полностью растворится и раствор станет комнатной температуры, разбавьте его водой до метки. Вставьте и закрепите пробку и несколько раз переверните колбу, чтобы перемешать. Каждый реагент в следующей таблице связан с нашим онлайн-каталогом для получения дополнительной информации и удобной покупки. Для жидкостей мы указали объем 500 мл реагента или химиката класса ACS, упакованного в безопасную бутылку с пластиковым покрытием. Для гидроксида натрия мы указали 500-граммовый размер реактивного химиката. Могут быть доступны другие размеры и классы. Пожалуйста, обратитесь к нашим каталогам для получения дополнительной информации. Если вы решите сделать свои собственные решения или купить их у нас готовые, вы найдете все, что вам нужно в Каролине. Артикул № 867861 $9,65 Быстрый просмотр Артикул № 867863 16,50 долларов США Быстрый просмотр Артикул № 847841 $6,75 Быстрый просмотр Артикул № 867788 $6,30 Быстрый просмотр Артикул № 867821 $7,15 Быстрый просмотр Артикул № 867843 $11,70 Быстрый просмотр Артикул № 867868 $9,65 Быстрый просмотр Артикул № 867823 $9,65 Быстрый просмотр Артикул № 841733 $18,60 Быстрый просмотр Артикул № 850120 48,95 долларов США Быстрый просмотр Артикул № 849180 6,50 долларов США Быстрый просмотр Артикул № 867790 $20,30 Быстрый просмотр Артикул № 974070 42,93 доллара США Быстрый просмотр Артикул № 867792 $35,35 Быстрый просмотр Артикул № 974462A $13,25 Быстрый просмотр Артикул № 867791 22,70 доллара США Быстрый просмотр Как только раствор станет комнатной температуры, разбавьте его водой до метки, вставьте и закрутите пробку и несколько раз переверните колбу для перемешивания.
Как только раствор станет комнатной температуры, разбавьте его водой до метки, вставьте и закрутите пробку и несколько раз переверните колбу для перемешивания.
В реагент = 0,050 л = 50 мл
Рецепты обычных растворов
Решение Количество для добавления на 1 л воды Конечная концентрация Уксусная кислота ледяная (17,4 М) 5,7 мл уксусной кислоты 0,1 М 57 мл уксусной кислоты 1 М Соляная кислота (12,1 М) 8,3 мл соляной кислоты 0,1 М 83 мл соляной кислоты 1 М 248 мл соляной кислоты 3 М 496 мл соляной кислоты 6 М Гидроксид натрия 4 г гидроксида натрия 0,1 М 40 г гидроксида натрия 1 М Серная кислота (18,1 М) 56 мл серной кислоты 1 М 
Загрузить руководство по приготовлению раствора
Shop Chemicals Вам также может понравиться
Вам также может понравиться
Соляная кислота, 3 М (9% об./об.), лабораторная чистота, 500 мл
Соляная кислота, 3 М (9% по объему), лабораторного качества, 1 л
Соляная кислота, 1 М (3% по объему), лабораторная чистота, 500 мл
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 30 мл
Соляная кислота, 0,1 М (0,3 % по объему), лабораторная чистота, 500 мл
Соляная кислота, 1 М (3% по объему), лабораторного качества, 1 л
Соляная кислота, 6 М, лабораторная чистота, 500 мл
Соляная кислота, 0,1 М (0,3 % об.
 /об.), ч. д. а., 1 л
/об.), ч. д. а., 1 л Кислотный спирт, 3% соляная кислота в 95% этаноле, лабораторная чистота, 500 мл
Bromthymol Blue ChemCapsule, лабораторный класс, упаковка из 5 шт.
Бромтимоловый синий ChemCapsule, лабораторного качества, каждая
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 500 мл
Соляная кислота, 0,07 М, флакон 30 мл, упаковка из 8 шт.
Соляная кислота, 12,1 М, в стеклянной бутылке, класс ACS, 2,5 л
Соляная кислота, 1,0 М, 500 мл
Соляная кислота, 12,1 М, в безопасной бутылке с пластиковым покрытием, класс ACS, 500 мл
Соляная кислота, 10 М (30% об.




 Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж.
Создать предложение
запросите на нашем веб-сайте или свяжитесь с нашим международным отделом продаж. Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям.
Используйте это руководство, чтобы выбрать средства индивидуальной защиты, соответствующие вашим потребностям.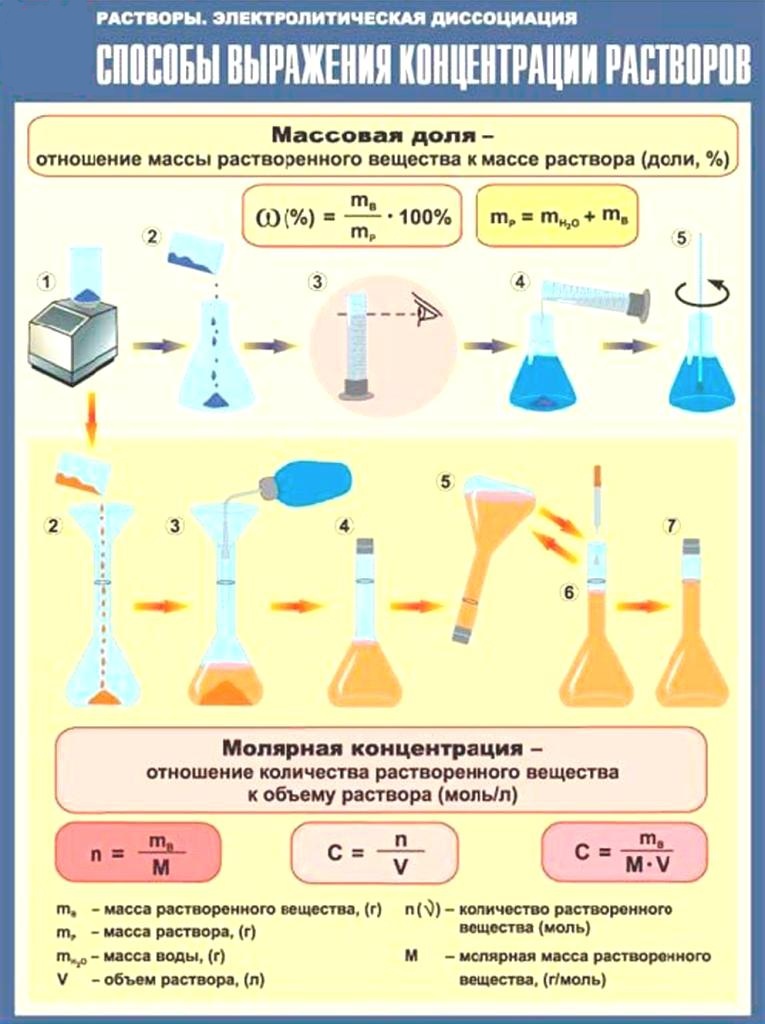 Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разделите массу кислоты на ее плотность (1,049г/мл) для определения объема (57,24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Аккуратно встряхните колбу, чтобы перемешать раствор. Когда раствор станет комнатной температуры, разбавьте его до метки, вставьте и закрепите пробку большим пальцем и несколько раз переверните колбу для перемешивания.