Закономерности в таблице Д. И. Менделеева
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Задание
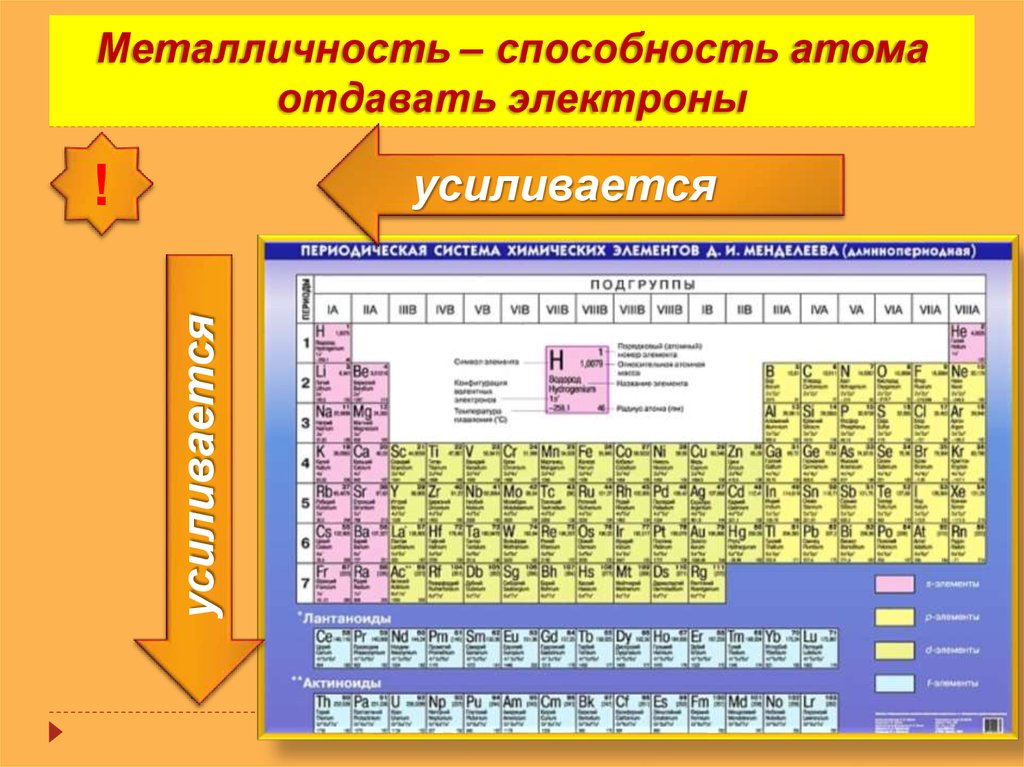
2. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
Физический смысл порядкового номера:порядковый номер равен числу
протонов и электронов и заряду ядра
Физический смысл номера периода:
номер
периода
равен
числу
заполняемых электронных слоёв
Физический смысл номера группы:
номер главной подгруппы равен
числу электронов на внешнем слое
(валентных электронов)
3. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.
 И. МЕНДЕЛЕЕВАЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И.
И. МЕНДЕЛЕЕВАЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И.В периоде слева направо ⇒
МЕНДЕЛЕЕВА
Увеличивается:
Заряд ядра атома
Электротрицательность
Неметаллические свойства
Число валентных электронов
Высшая степень окисления
Кислотные свойства гидроксидов, образованные
элементами
Не меняется число электронных слоев
Уменьшается:
Радиус атома
Легкость отдачи электрона
Металлические свойства
Основные свойства гидроксидов, образованные
элементами
Основные
свойства
соединений
(оксидов,
гидроксидов)
уменьшаются,
сменяются
амфотерными,
кислотные свойства (оксидов,
кислородных кислот) увеличиваются.
4. ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И. МЕНДЕЛЕЕВА
ЗАКОНОМЕРНОСТИ В ТАБЛИЦЕ Д.И.В группе сверху вниз ⇓
МЕНДЕЛЕЕВА
Увеличивается:
Заряд ядра атома;
Радиус атома
Легкость отдачи электрона
Металлические свойства
Основные свойства гидроксидов, образованные
элементами
Число электронных слоев
Основные свойства соединений (оксидов, гидроксидов)
увеличиваются, кислотные свойства соединений
(оксидов, кислородных кислот) уменьшаются;
Кислотные
свойства
бескислородных
кислот
увеличиваются.
Уменьшается:
Электроотрицательность
Неметаллические свойства
Кислотные
свойства
соединений
(оксидов,
кислородных кислот) уменьшаются
решите
В ряду химичeских элементов Si – P – S
1. Увеличивается число валентных электронов в атомах
2. Уменьшается число валентных электронов в атомах
3. Уменьшается число протонов в ядрах атомов
4. Увеличиваются радиусы атомов
Степень окисления
Валентность
Определение Условный заряд атома в
молекуле, вычисленный исходя
из предположения, что все
связи в молекуле – ионные.
Число химических
связей, которые
образует атом в
химическом
соединении.
Знак
Валентность не имеет
знака.
Имеет знак – она может быть
отрицательной, нулевой или
положительной.
Обозначение Арабские цифры со знаком
Римские цифры
Примеры
N (V), C (IV)
Cl (-1), Fe (+3)
7. Правила подсчета степени окисления
• Степень окисления элемента в составе простого веществапринимается равной нулю
• Ряд элементов проявляют в соединениях постоянную степень
(табл.
 растворимости)
растворимости)• Кислород, как правило, проявляет степень окисления -2 (искл:
пероксид Н2О2(-1) и фторид кислорода OF2 (+2)).
• Водород в соединениях с металлами (в гидридах) проявляет степень
окисления -1, как правило, +1(кроме Sih5, B2H6).
• Алгебраическая сумма степеней окисления всех атомов в молекуле
должна быть равной нулю, а в сложном ионе – заряду этого иона.
решите
1) Степени окисления фосфора в соединениях
K3PO4 и Mg3P2 соответственно равны:
1. +5 и -3
2. +5 и +3
3. +3 и +5
4. +2 и -3
2) Максимальная валентность атома фосфора:
1. +5
2. V
3. +4
4. IV
9. Теория к заданию №8 ОГЭ по химии
• Реакция ионного обмена – одна из видов химических реакций,продуктами которой являются вода, газ или осадок
На практике чаще всего мы сталкиваемся с реакциями в
растворах, в результате которых образуется осадок, либо
газ, либо вода. Чаще всего это реакции обмена.
Пример – реакция карбоната натрия и серной кислоты с
выделением углекислого газа:
Na2CO3 + h3SO4 → Na2SO4 + CO2↑ +h3O
Для успешного решения задач
нам необходимо запомнить
следующие правила:
• используем таблицу
растворимости: если видим,
что продукт (то, что слева в
уравнении) нерастворим, то
реакция идет.

• если видим в левой части газ
(CO2, h3S, SO2 – типичные для
ионного обмена), реакция
идет.
• если видим воду (h3O),
реакция идет.
11. Правила подсчета валентности
Валентные возможности атома определяются числом:• Неспаренных электронов.
• Неподелённых электронных пар.
• Вакантных валентных пар.
Примеры: Н –водород IА группа, имеет 1 валентный электрон,
образует 1 ковалентную связь с каким-либо другим атомом.
Валентность I.
металлы образуют между атомами
металлическую связь
Неметаллы располагаются справа от
проведенной линии (кроме синих клеток на
этой таблице – синие клетки это металлы).
Неметаллы образуют друг с другом
ковалентную связь.
Если два атома неметалла представлены
одним элементом, например атом хлора и
еще один атом хлора образуют молекулу Cl2 то это неполярная ковалентная связь. Если
же атомы разные – то это ковалентная
полярная связь
металл и неметалл- ионная связь
13.
 решитеВеществами с ионной и ковалентной полярной связью являются
решитеВеществами с ионной и ковалентной полярной связью являютсясоответственно
1. Сероводород и фторид цезия
2. Хлорид натрия и кислород
3. Фосфид кальция и оксид азота(IV)
4. Кислород и озон
14. Теория к заданию №9 ОГЭ по химии
Химические свойства металлов1. металлы реагируют с неметаллами всегда
2. металлы реагируют с кислотами
Записать
3. металлы реагируют с кислородом
Химические свойства неметаллов
1. неметаллы реагируют с металлами
2. неметаллы реагируют с водородом
3. неметаллы реагируют с кислородом
и Выучить
С водой реагируют металлы, стоящие в ряду напряжений
до алюминия:
16. решите
• Не реагируют друг с другом1.
хлор и водород
2.
кислород и кальций
3.
азот и вода
4.
железо и сера
• Какой из указанных металлов
проявляет наибольшую химическую
активность в реакции с водой?
1. кальций
2. алюминий
3. свинец
4. железо
1.
2.

3.
4.
1.
2.
3.
4.
С водой при комнатной температуре реагирует
Сu
Ag
Са
Hg
В реакцию с соляной кислотой вступает каждый
из двух металлов:
Hg и Ag
Fe и Zn
Аu и Сu
Zn и Ag
17. Теория к заданию №10 ОГЭ по химии
Химические свойства оксидов• оксиды реагируют с водой
• основные оксиды реагируют с кислотами
• кислотные оксиды реагируют с основаниями
• амфотерные металлы и их оксиды – цинк и алюминий – реагируют и с кислотами, и с
основаниями
• основания реагируют как с кислотами, так и с амфотерными основаниями (цинк и алюминий)
• кислоты реагируют как с основаниями, так и с амфотерными основаниями (цинк и алюминий)
Многие варианты построены на свойстве амфотерности, поэтому про алюминий и цинк
необходимо помнить всегда.
18. решите
• Оксид цинка реагирует с каждым из двух веществ:1. Na2O и h3O
2. SiO2 и Ag
3. NaOH и HCl
4. HNO3 и O2
19. РАЗБОР И РЕШЕНИЕ ЗАДАНИЯ №11 ОГЭ ПО ХИМИИ ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ И ОСНОВАНИЙ
• Кислоты• Напомню, что кислоты – это химические соединения,
диссоциирующие на протоны (H+).
 Примеры простейших кислот соляная (HCl), серная (h3SO4), азотная (HNO3).
Примеры простейших кислот соляная (HCl), серная (h3SO4), азотная (HNO3).• Основания
• Основания же – вещества, диссоциирующие на гидроксид ионы
(OH-).
20. Химические свойства кислот
1.реакция с основными оксидами: В данной реакции продуктами
являются соль и вода
2.
3.
реакция с амфотерными оксидами соль + вода
реакция кислот со щелочами носит название нейтрализации
:продуктами являются соль и вода.
обменные реакции с солями, если в результате реакции образуется
нерастворимое вещество (осадок) либо газ.
реакция с нерастворимыми основаниями: соль и вода
реакция с металлами, стоящими в ряду напряжений до водорода – с
4.
5.
6.
выделением водорода
21. химические свойства оснований
1. вышеприведенная реакция с кислотами – реакциянейтрализации
2. реакция с амфотерными основаниями: соли
3. реакция с кислотными оксидами с образованием соли и воды.
4. обменные реакции с солями, если образуется осадок или газ
(аммиак).

22. решите
• В реакцию с соляной кислотой вступает:1. нитрат серебра
2. нитрат бария
3. серебро
4. оксид кремния
English Русский Правила
Закономерности изменения свойств элементов и их соединений по периодам и группам / Справочник :: Бингоскул
Важнейшей природной аксиомой без преувеличения можно назвать периодический закон Д.И. Менделеева. Это гениальное открытие великий химик сделал тогда, когда ещё не было знаний об атомном строении.
Основной закон химической науки
Менделеев в начале марта 1869 года создал прообраз будущей систематизации, назвав его «Опыт системы элементов, основанной на их атомном весе и химическом родстве». В течение последующих 2-х лет он дорабатывал свой труд. Ввёл понятия о группах, рядах, периодах, придав системе очертания, близкие к современной.
Из-за отсутствия знаний о реальной атомной структуре в редакции первооткрывателя закон гласил: «свойства всех элементов, а вследствие и качества образуемых ими простых, а также сложных веществ, стоят в периодической зависимости от их атомного веса».
Более того, Дмитрий Иванович сумел этот постулат изобразить графически в виде таблицы. Сегодня усовершенствованная периодическая менделеевская систематизация вполне отвечает нынешним знаниям о строении вещества.
С учётом современных воззрений на атомное строение периодический закон (ПЗ) сегодня читается так: «Свойства атомов хим. элементов и образованных ими простых веществ состоят в периодической зависимости от зарядов ядер их атомов».
Устройство таблицы периодической системы
Матрица таблицы ПЗ фиксирует хим. элементы в конкретных клеточках во взаимосвязи с определённой физико-химической характеристикой. В таблице образца 1869 г. систематизировались в её рядах и столбиках 60 открытых к тому времени элементов. Сегодня их открыто 118 и ещё 8 принято считать гипотетическими.
Их расположение позволяет получить представление о валентности хим. элементов, числе электронов и других его параметрах.
Упорядочение хим. элементов в конструкции таблицы производится по горизонтали в рядах и по вертикали в столбцах.
Ряды носят названия периодов. Элементы располагаются в них по возрастающей порядкового номера и соответственно атомного веса.
В табличной матрице – 7 периодов. На первых 3-х, получивших название малых, распределилось 2,8 и 8 хим.элементов. Следующие периодические ряды – большие. В 4-м и 5-м рядах – по 18 элементов, в периоде под №6 их 32, в незаконченном седьмом – пока 31элемент.
Номер периода служит указателем количества энергетических уровней вокруг ядра атома с расположившимися на них отрицательно заряженными электронами. В частности, фосфор P, сера S и хлор Cl – элементы 3-го периода. Атомные ядра их окружены трёхслойной оболочкой из электронов.
Столбцы названы группами. В табличной матрице их 8. Хим. элементы в них находятся в самой высокой окислительной степени в отвечающих им окислах.
В группах происходит разделение на подгруппы: главные и побочные. Главные – содержат элементы, размещённые в малых периодах. В них также входят элементы с подобными характеристиками больших периодов.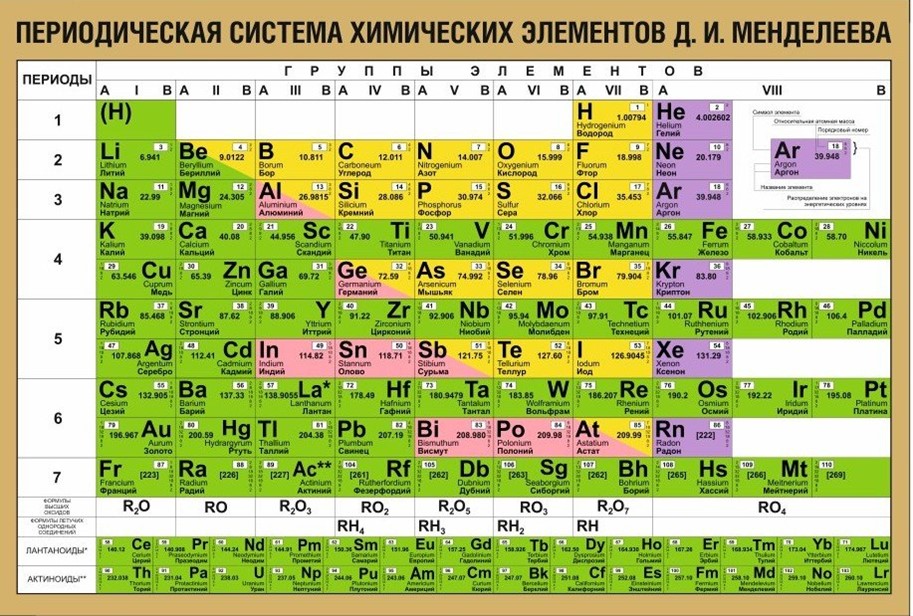
В состав побочных подгрупп включены только те хим. элементы, которые находятся в больших периодах.
Физической сутью порядкового номера нужно считать число протонов и электронов в атоме.
ПЗ – источник любой информации о веществе!
Не надо зубрить тексты о природе и особенностях хим. соединений, надо понять лишь логику менделеевской систематики элементов и правила видоизменений по группам и периодам.
Развитие свойств по группам:
По структуре электронных оболочек элементы в группах похожи.
Замечание первое: Размеры атомов в группе сверху донизу растут. Это означает:
- у электронов, находящихся на наружной орбите притяжение к атомному ядру слабеет;
- у атома растёт склонность к потере электронов;
- эта возрастающая способность отдавать электроны говорит об усилении металлических свойств.
Отсюда первая закономерность: В группах в направлении сверху донизу идёт возрастание металлических свойств хим. элементов, а также усиливаются основные свойства соединений этих элементов.
элементов, а также усиливаются основные свойства соединений этих элементов.
Внутри одного периода при увеличении количества электронов ядро атома сжимается, возрастает энергия связи каждого электрона внешнего уровня с ядром. Например, ядро атома хлора будет удерживать электроны своего внешнего уровня намного сильнее, чем ядро атома натрия единственный электрон внешнего электронного уровня. При образовании химической связи между атомом натрия и хлора хлор «отберет» единственный электрон у атома натрия, то есть электронная оболочка хлора станет такой же, как у благородного газа аргона, а у натрия — такой же, как у благородного газа неона. Способность атома какого-либо химического элемента оттягивать на себя электроны другого химического элемента при столкновении при образовании химической связи называется электроотрицательностью. Электроотрицательность, как и многие другие параметры химических элементов, также подчиняется периодическому закону Д. И. Менделеева. Внутри одной подгруппы химических элементов электроотрицательность убывает, а при движении по ряду одного периода вправо электроотрицательность возрастает.
И. Менделеева. Внутри одной подгруппы химических элементов электроотрицательность убывает, а при движении по ряду одного периода вправо электроотрицательность возрастает.
Если представить себе циферблат обычных круглых часов и его центр поместить в правый нижний угол таблицы Д.И. Менделеева, то свойства химических элементов будут однообразно изменяться при движении по ней вверх и вправо (по часовой стрелке) и противоположно вниз и влево (против часовой стрелки)
Развитие свойств в периодах:
Замечание второе:
- при движении в периоде с левой стороны в правую сторону величина атомов уменьшается;
- растёт число электронов на наружных орбитах атома, при этом происходит рост его электроотрицательности;
- электроотрицательность характеризует неметаллические свойства.
Вторая закономерность: с движением в периоде в правую сторону наблюдается рост неметаллических свойств и электроотрицательности элементов. Также усиливаются кислотные свойства образованных этими элементами соединений.
Также усиливаются кислотные свойства образованных этими элементами соединений.
Основные направления эволюции свойств можно запомнить по следующей таблице.
Закон Д.И. Менделеева о периодичности химических явлений универсален. Он объективно функционирует в природе и всегда будет актуален. Более того, учёные установили, что периодическим изменениям подчиняется не только электронная структура атома, но ещё более тонкое строение атомного ядра. А это значит, что существует периодический характер изменения свойств в сложнейшем мире элементарных частиц.
Смотри также:
- Электронная конфигурация атомов и ионов. Основное и возбужденное состояние атомов
- Общая характеристика металлов IА–IIIА групп
- Характеристика переходных элементов (меди, цинка, хрома, железа)
- Общая характеристика неметаллов IVА–VIIА групп
Закономерности испарения фосфатов элементов IVA группы периодической таблицы
- “>
Тананаев И.В., Розанов И.А., Авдуевская К.А., Береснев Е.Н., Бердников В.Р. Фосфаты четырехвалентных элементов . М.: Наука, 1972.
7. Google ученый
Тиен Т.Г. и Hummel, F.A., The System SiO2-P2O5, J. Am. Керам. соц. , 1962, том. 45, нет. 9, стр. 422-424.
Google ученый
Авдуевская К.А. О фосфате германия, Тананаев И.В., Ж. неорг. хим. , 1965, том. 10, нет. 2, стр. 366-371.
Google ученый
Huang, C.-H., Knop, O., Othen, D.A., Woodhams, F.
 D.W., and Howie, R.A., Фосфаты элементов TetravaGLASS и мессбауэровское исследование SnP2O7, Can. Дж. Хим. , 1975, том. 53, нет. 1, стр. 79-91.
D.W., and Howie, R.A., Фосфаты элементов TetravaGLASS и мессбауэровское исследование SnP2O7, Can. Дж. Хим. , 1975, том. 53, нет. 1, стр. 79-91.Google ученый
Флемиш, Дж. Р. и Тресслер, Р. Э., P x Испарение O9 из SiP2O7 и его связь с пленками из фосфосиликатного стекла, J. Electrochem. соц. , 1991, том. 138, нет. 12, стр. 3743-3746.
Google ученый
Шульц М.М., Столярова В.Л., Шорников С.И., Иванов Г.Г., Бондарь И.А., Мальшиков А.Е. Масс-спектрометрическое исследование процессов парообразования и термодинамических свойств системы GeO2-P2O5.0005 Специал вяжущие и изделия (технология и свойства). тр. Центрального исследовательского ин-та. Строительных Конструкций им. В.А. Кучеренко. Специальные вяжущие и изделия (технология и свойства). Кучеренко ЦРЗ Инст. строительных конструкций. Москва, 1992. С.
 32-46.
32-46.Камбаяши С. и Като Э. Масс-спектрометрическое определение активности P2O5 в системах PbO-P2O5 и Fe t O-P2O5 Systems, J. Iron Steel Inst. Япония. , 1984, том. 70, нет. 12, с. 863.
Google ученый
Камбаяси С., Авака Х. и Като Э., Масс-спектрометрическое определение активности P2O5 в системах PbO-P2O5 и Fe t O-P2O5, Tetsu-to-Hagane , 1985 , том. 71, нет. 16, стр. 1911-1918.
Google ученый
Лопатин С.И., Семенов Г.А., Закономерности испарения фосфатов элементов III группы Периодической таблицы,
Google ученый
Лопатин С.И., Семенов Г.
 А. Процессы парообразования в дифосфатах кремния и германия. общ. хим. , 1995, том. 65, нет. 7, стр. 1060-1064.
А. Процессы парообразования в дифосфатах кремния и германия. общ. хим. , 1995, том. 65, нет. 7, стр. 1060-1064.Google ученый
Лопатин С.И., Семенов Г.А. Масс-спектрометрическое исследование испарения Sn2P2O7, Ж. общ. хим. , 1996, том. 66, нет. 2, стр. 180-183.
Google ученый
Семенов Г.А., Францева К.Е., Урих В.А. Масс-спектрометрическое исследование испарения фосфатов свинца и висмута // Фосфаты-84 . -84″), Алма-Ата, 1984, ч. 1, с. 202-203.
Семенов Г.А. 2. Термодинамические свойства газообразных фосфатов германия, олова и свинца методом высокотемпературной масс-спектрометрии, Тезисы докладов XIV конференции IUPAC. по химической термодинамике) , Осака, 1996, с. 583.
Энергия разрыва химических связей. Потенциалы ионизации и вещество к электрону.

Google ученый
Алиханян А.С., Стеблевский А.С., Горгораки В.И., Соколова И.Д. Термодинамические свойства щелочных металлов, Докл. акад. Наук СССР, 1975, вып. 22, нет. 3, стр. 629-632.
Google ученый
Пол, Р.К. и Мандель, Дж., Анализ межлабораторных измерений давления паров золота, Pure Appl. хим. , 1972, том. 31, нет. 3, стр. 371-394.
Google ученый
Вол А.Е., Каган И.К., Строение и свойства двойных металлических систем (Структура и свойства бинарных металлических систем), М.: Наука, вып. 3, 1976.
Google ученый
“>Кузьменков М.И., Печковский В.В., Плышевский С.В.,
Google ученый
Дроварт Дж., Майерс С.Е., Шварц Р., ван дер Ауера-Майе А. и Уй О.М. Определение с помощью масс-спектрометрии методом ячейки Кнудсена энергий атомизации молекул PO и PO2, J. Chem. Soc., Faraday Trans. 2 , 1972, том. 68, нет. 10, стр. 1749-1757.
Google ученый
Семенов Г.А., Николаев Е.Н., Кулигина Л.А., Францева К.Е. О температурном коэффициенте масс-спектров сложных оксидных соединений // Химия парообразных неорганических соединений и процессов парообразования. -Всесоюзная конф.

Термодинамические свойства индивидуальные ‘ных вещей. Справочник. Справочник по термодинамическим свойствам индивидуальных соединений. Под ред. Глушко В.П. М.: Наука, 1978, т. 1, с. 1, Книга 2; 1979, том. 2, Книга 2.
Google ученый
Лопатин С.И. Термическая диссоциация щелочноземельных металлов и фосфатов магния по данным высокотемпературной масс-спектрометрии,
Казенас, Э.К. . Испарение оксидов . М.: Наука, 1997.
. Google ученый
Столярова В.Л. Высокотемпературное масс-спектрометрическое исследование оксидных систем и материалов, Rapid Commun. Масс-спектр. , 1993, том.
 7, стр. 1022-1032.
7, стр. 1022-1032.Google ученый
Лопатин С.И. Испарение в фосфатных системах, Ж. общ. хим. , 1997, том. 67, нет. 2, стр. 208-227.
Google ученый
Лопатин С.И., Семенов Г.А., Селевич А.Ф. Испарение фосфатов индия. Журн. общ. хим. , 1997, том. 76, нет. 11, стр. 1783-1787.
Google ученый
Лопатин С.И. Термическая диссоциация монофосфатов бора и алюминия. Журн. общ. хим. , 1997, том. 67, нет. 7, стр. 1057-1060.
Google ученый
Лопатин С.И., Семенов Г.А., Селевич А.Ф. Масс-спектрометрическое исследование испарения фосфата таллия // Журн. общ. хим.
Google ученый
“>Лопатин С.И., Семенов Г.А., Масс-спектрометрическое исследование испарения борфосфата BPO4, Rapid Commun. Масс-спектр. , 1999, том. 13, стр. 1398-1400.
Google ученый
Бондарь И.А. Фосфаты элементов четвертой группы (Фосфаты элементов IV группы). СПб.: Наука, 1992.
. Google ученый Алма-Ата: Наука Каз. ССР, 1979.
Google ученый
Семенов Г.А., Николаев Е.Н., Францева К.Е. Применение масс-спектрометрии в неорганической химии . Google ученый
Лопатин С.И., Семенов Г.А., Селевич А.Ф. Испарение монофосфата галлия по данным высокотемпературной масс-спектрометрии, Ж. общ. хим. , 1999, том. 69, нет. 4, стр. 555-557.
Google ученый
Скачать ссылки
Проблема в периодической таблице | Особенность
Как химики, мы видим периодическую таблицу в виде значка. Но ее конструкция продолжает развиваться и является источником многочисленных споров.
Периодическая таблица существует уже почти 140 лет и пережила множество революционных открытий, включая открытие субатомной структуры и развитие квантовой механики и теории относительности.
Первоначально порядок элементов определялся их возрастающим атомным весом (рис. 1), но позже было обнаружено, что атомный номер обеспечивает лучший принцип упорядочения. Например, элементы теллур и йод идеально встали на свои места в соответствии с их химическим поведением, но их положение в таблице было бы обратным, если бы они были упорядочены строго по их атомным весам.
1), но позже было обнаружено, что атомный номер обеспечивает лучший принцип упорядочения. Например, элементы теллур и йод идеально встали на свои места в соответствии с их химическим поведением, но их положение в таблице было бы обратным, если бы они были упорядочены строго по их атомным весам.
Порядок элементов
Источник: © Журнал Русское Физико-Химство, 1871, 3, 25
. Но периодическая таблица — это двумерное представление, полученное путем «отрезания» одномерной последовательности в определенных точках и размещения следующих последовательностей элементов под предыдущими полосами или последовательностями.
Если упорядочение на основе атомного номера можно рассматривать как первичную классификацию, то вертикальную группировку элементов, полученных с помощью процедуры обрезки и размещения, можно рассматривать как вторичную классификацию.
Узнать больше
Взгляните на все наши статьи и ресурсы о периодической таблице элементов или посетите нашу интерактивную периодическую таблицу, включающую историю, алхимию, подкасты, видео и тенденции данных.
Квантово-механическое решение
Современное объяснение того, почему элементы располагаются в вертикальных столбцах, демонстрирующих сходные свойства, было дано квантовой механикой и описывает оболочечную структуру электронов, вращающихся вокруг ядра атома каждого типа.
Элементы группы 1, например, все имеют один электрон на внешней оболочке, хотя они различаются по структуре внутренней оболочки.
Литий 1s 2 2s 1
Натрий 1s 2 2s 2 2p 6 3s 1
Potassium 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
It is the outer-shell electrons which govern их химические свойства, и поэтому они ведут себя одинаково. Например, все эти металлы реагируют с водой, хотя их реакционная способность возрастает по мере перехода от лития к калию и далее к цезию и рубидию.
Изобилие дизайнов
Принимая во внимание эти основные факты, несколько удивительно обнаружить так много различных форм таблицы Менделеева. 1 Более 1000 из них опубликованы в статьях или на сайтах.
1 Более 1000 из них опубликованы в статьях или на сайтах.
Любопытно, что первые два элемента, водород и гелий, представляют собой некоторую аномалию, и всегда были некоторые разногласия относительно того, к каким именно группам их следует отнести. В обычной современной периодической таблице, известной как среднедлинная форма, эти элементы попадают в группы 1 и 18 соответственно — щелочные металлы и благородные газы (рис. 2).
Рисунок 2. Обычная таблица Менделеева
В результате получается довольно неудобная форма башни-близнеца, которая дополняет и без того неровную форму таблицы Менделеева. Начальная неравномерность возникает из-за того, что щелочные и щелочноземельные металлы располагаются слева в виде высокого блока, за которым следует более мелкий блок шириной в десять элементов, содержащий переходные металлы. За ним справа следует еще один более высокий блок шириной в шесть элементов, содержащий смесь металлов, полуметаллов и неметаллов.
С точки зрения квантовой механики эти блоки характеризуются заполнением (слева направо) s-орбиталей, d-орбиталей и p-орбиталей. Есть еще одна странность в разрозненном блоке элементов, который выступает как своего рода сноска ко всей системе. Эти элементы связаны с заполнением f-орбиталей.
Место для гелия
Еще одно более правильное представление, левошаговая таблица (рис. 3), было предложено почти 90 лет назад французом Шарлем Жане.
Рисунок 3. Периодическая таблица с левым шагом
Недавно эта форма пережила возрождение, поскольку она также, кажется, более четко отображает порядок заполнения орбит, чем обычная форма. 2 Также отображает элементы в одной непрерывной последовательности без пропусков и перерывов. Досадным недостатком является то, что элемент гелий смещается со своего обычного места среди благородных газов и перемещается, чтобы присоединиться к щелочноземельным элементам, таким как бериллий, магний и кальций.
Этот шаг можно обосновать на основе внешнеэлектронной структуры гелия, который имеет два таких электрона, как и члены щелочноземельной группы.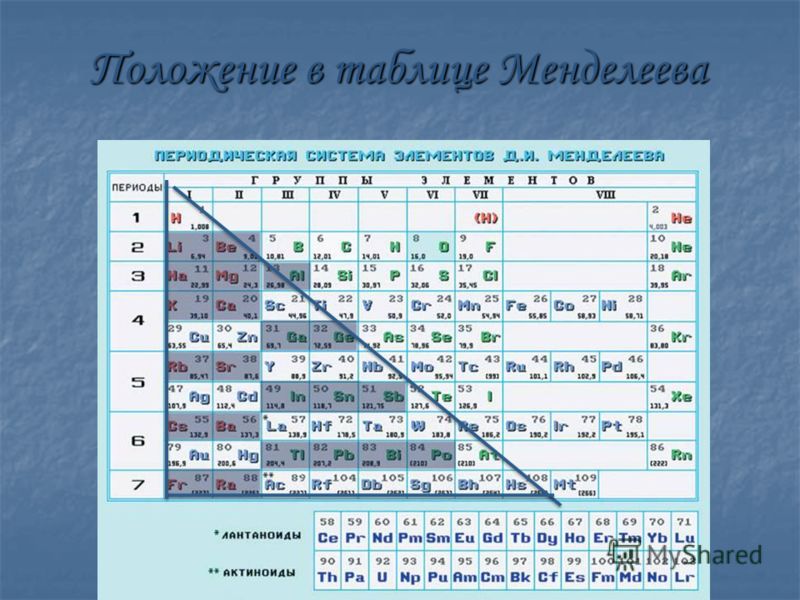 С химической точки зрения отнесение гелия к этим металлам равносильно полной ереси. В то время как гелий является самым нереакционноспособным из всех элементов в периодическом реактивном. Вопрос о том, куда поместить гелий, — один из признаков проблемы в периодической таблице.
С химической точки зрения отнесение гелия к этим металлам равносильно полной ереси. В то время как гелий является самым нереакционноспособным из всех элементов в периодическом реактивном. Вопрос о том, куда поместить гелий, — один из признаков проблемы в периодической таблице.
Водород тоже не подходит
Даже первый элемент, водород, некоторое время вызывал проблемы. Он может как потерять, так и получить электрон. В результате его можно поместить в группу 1, как это обычно бывает, или с галогенами в группу 17 ( рис. 4 ). Высказывались даже предположения, что водород следует группировать во главе углеродной группы, так как его атом, как и углерод, имеет наполовину заполненную внешнюю оболочку.
Рисунок 4. Периодическая таблица с водородом в группе 17
Некоторые авторы полностью избегают проблемы водород-гелий, удаляя их из основного корпуса и позволяя им парить над остальной частью таблицы.
Совсем недавно было предложено изменить таблицу левого шага, чтобы избежать ереси размещения гелия среди щелочноземельных элементов. Эта новая версия перемещает водород в верхнюю часть галогенов, сохраняя при этом общую форму таблицы левого шага (рис. 4).
Эта новая версия перемещает водород в верхнюю часть галогенов, сохраняя при этом общую форму таблицы левого шага (рис. 4).
Представление таблицы Менделеева таким способом дает дополнительный бонус. Первоначальная таблица левого шага Джанет приводит к потере идеальной триады атомных чисел при перемещении гелия из группы благородных газов, тогда как эта новая таблица сохраняет триаду гелия.
Работа с триадами
Триадой называют группу из трех элементов, попадающих вертикально в любую группу периодической таблицы. Атомный номер среднего элемента равен среднему значению элементов выше и ниже него.
Исторически сложилось так, что открытие триад с использованием атомных весов, а не атомных номеров, было первым намеком на какие-либо количественные закономерности среди атомных весов элементов. Теперь в предложенной модифицированной таблице левого шага перемещение водорода в группу галогена дает новую триаду совершенных атомных номеров среди элементов водорода, фтора и хлора.
Проблема в группе 3
Другая форма проблемы связана с группой 3. Во многих периодических таблицах учебников и настенных диаграмм группа 3 представлена как состоящая из элементов скандий, иттрий, лантан и актиний. Аналогичное количество таблиц показывает разницу в последних двух элементах, но вместо них используются лютеций и лоуренсий.
Хотя существуют некоторые весьма убедительные химические и физические аналогии в пользу большего сходства между вторым набором из четырех элементов, не все были убеждены внести изменение. 3
Чего не хватает, так это категорического критерия. 4 Опять же, таким критерием может служить попытка максимизировать количество триад атомных чисел в периодической таблице. Глядя на второй выбор из четырех элементов, Sc, Y, Lu, Lr, последние три образуют идеальную триаду. Однако последних трех элементов среди группы Sc, Y, La и Ac нет (табл. 1).
| Д | 39 | Д | 39 | |
| Ла | 57 | Лу | 71 | |
| Ас | 89 | Лр | 103 | |
| (39+89)/2=64 (не 57) | (39=103)/2=71 Совершенная триада | |||
Возиться со сверхтяжелыми элементами
Переходя к сверхтяжелым элементам на другом конце таблицы Менделеева, мы находим еще больше проблем, по крайней мере, так казалось еще несколько лет назад.
Источник: Science Photo Library
Таблица Менделеева претерпела некоторые интересные изменения…
Уже давно известно, что чем тяжелее атом, тем большую роль начинают играть релятивистские эффекты. С увеличением заряда ядра атома увеличивается и скорость внутренних электронов. Если скорости достаточно высоки, это может привести к искажению орбиталей атома и, как следствие, к изменению его химических свойств.
Первоначально, когда они были впервые синтезированы, химические реакции элементов 104 и 105 (резерфордий и дубний) не могли быть изучены, так как время жизни их изотопов было чрезвычайно коротким. Но через несколько лет были синтезированы другие более стабильные изотопы и проведены химические эксперименты.
Например, резерфордий попадает в группу 4, и поэтому ожидается, что он будет вести себя так же, как его собратья, цирконий и гафний. Эксперименты, проведенные в 1990-х годах, показали, что релятивистские эффекты были достаточно значительными, чтобы резерфордий и дубний вели себя аномально. Например, RfCl 4 имеет аномально высокую летучесть.
Рассыпающаяся периодичность
Казалось, что концепция химической периодичности, наконец, начинает иссякать. Казалось, что релятивистские эффекты портят химическое обобщение, которое до сих пор выдержало испытание временем, самое общее из всех химических обобщений.
Источник: © www. mayanperiodic.com
mayanperiodic.com
Периодическая таблица элементов майя основана на электронных оболочках. Оболочки показаны концентрическими окружностями. Каждая строка в табличной форме показана в виде кольца.
Вскоре были синтезированы еще более высокие элементы. Неудивительно, что ожидалось, что они будут вести себя еще более аномально из-за их еще более высоких атомных номеров, но, как оказалось, это не то, что произошло.
Когда были исследованы химические свойства элемента 106 (сиборгия), в заголовках новостных сообщений были слова «Скучный сиборгий». Когда элемент 107 (борий) был синтезирован, а затем исследован химически, это также показало, что химическая периодичность снова в деле.
То, что казалось угрозой или проблемой для таблицы Менделеева, оказалось недолгим беспокойством. Классификация элементов с более высоким атомным номером по-прежнему в значительной степени определяется периодической таблицей, независимо от наличия релятивистских эффектов.
Доберейнер и триады
Возвращаясь к борию, мы можем рассмотреть некоторые количественные данные, полученные по этому элементу, чтобы более подробно рассмотреть вопрос о его классификации.
Как мы видели, концепция триад элементов существует гораздо дольше, чем периодическая таблица. Эта концепция была первоначально открыта химиком Доберейнером за добрых пятьдесят лет до того, как Менделеев опубликовал первую вполне зрелую периодическую систему. 5
Когда атомный номер сменил атомный вес, триады, которые были только приблизительными, стали точными. Возникновение триад стало объясняться как следствие двойникования длин периодов, которое происходит в периодической таблице. Помимо исключительного первого очень короткого периода из двух элементов, следующий период из восьми повторений повторяется, затем период из восемнадцати повторений, а затем период из тридцати двух повторений.
В результате этой закономерности любые три элемента, попадающие вертикально в периодическую таблицу, образуют идеальную триаду, если второй и третий из них являются членами периодов равной длины.
Предсказания для бория
Источник: © Martyn Poliakoff
Наименьшая в мире таблица Менделеева, выгравированная на волоске
Какое отношение все это имеет к элементу 107?
Если рассматривать энтальпии сублимации TcO 3 Cl, ReO 3 Cl и BhO 3 Cl, значения равны 49, 66 и 89 кДж моль -1 соответственно. Если бы кто-то попытался предсказать значение для бория по двум другим на основе принципа триады, предсказание составило бы 83 кДж моль -1 , что всего на 6,7% от экспериментального значения.
Если бы кто-то попытался предсказать значение для бория по двум другим на основе принципа триады, предсказание составило бы 83 кДж моль -1 , что всего на 6,7% от экспериментального значения.
Эта небольшая ошибка помогает поддержать представление о том, что борий твердо принадлежит к группе 7, независимо от каких-либо релятивистских эффектов.
Две триады направлений
Когда Менделеев сделал свои знаменитые предсказания свойств галлия, германия и скандия, он в основном использовал вычисления, подобные триадам. На самом деле, просто для верности, он использовал трезвучия в двух направлениях.
Например, он объяснил, как можно предсказать атомный вес селена, хотя он был фактически известен и мог использоваться для демонстрации эффективности метода (таблица 2).
Триады имеют прекрасную родословную, когда дело доходит до периодической таблицы. Может быть, теперь они снова помогут нам в решении этих постоянных проблем, связанных с размещением определенных элементов в таблице Менделеева.
Споры продолжаются
Источник: © Science & Society Picture Library
Спираль Крукса (1888 г.), представляющая порядок эволюции элементов Периодическая таблица теперь утихла, по крайней мере, на данный момент. Проблема с низкими атомными номерами, а именно с водородом и гелием, до сих пор остается открытым вопросом.
Видно, что в обычной таблице водород и гелий хорошо классифицированы, но таблица нерегулярна и содержит неудобные промежутки между многими элементами. В левой таблице закономерность проявляется в наибольшей степени, но химики по понятным причинам беспокоятся о том, чтобы отнести гелий к щелочноземельным элементам.
Что бы вы ни думали об этих дебатах, факт остается фактом: периодическая система, которую представляет периодическая таблица, является одним из самых замечательных открытий во всей науке. Он обеспечивает базовую связь между всеми 118 элементами, открытыми или синтезированными до сих пор. Такие разные вещества, как золото, гелий, сера, ртуть и кислород, связаны друг с другом в двумерном массиве.

 D.W., and Howie, R.A., Фосфаты элементов TetravaGLASS и мессбауэровское исследование SnP2O7, Can. Дж. Хим. , 1975, том. 53, нет. 1, стр. 79-91.
D.W., and Howie, R.A., Фосфаты элементов TetravaGLASS и мессбауэровское исследование SnP2O7, Can. Дж. Хим. , 1975, том. 53, нет. 1, стр. 79-91.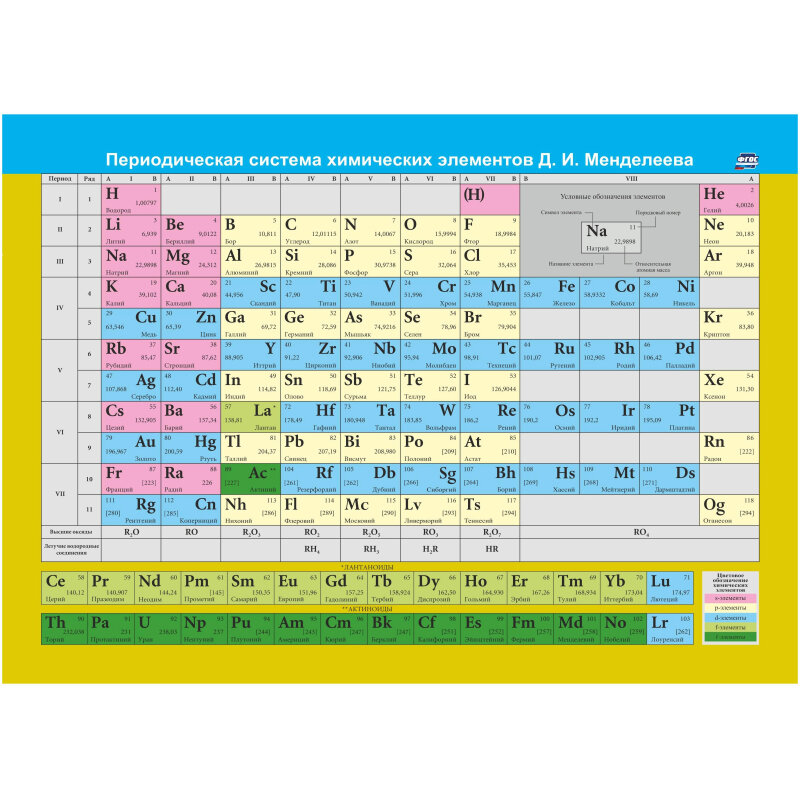 32-46.
32-46. А. Процессы парообразования в дифосфатах кремния и германия. общ. хим. , 1995, том. 65, нет. 7, стр. 1060-1064.
А. Процессы парообразования в дифосфатах кремния и германия. общ. хим. , 1995, том. 65, нет. 7, стр. 1060-1064.
 7, стр. 1022-1032.
7, стр. 1022-1032.