Законы термодинамики
Энергия и ее перевоплощения всегда была одним из самых интересных вопросов, который заботил научный мир. Одновременно с раскрытием закона о сохранении энергии появился и бесконечный интерес к исследованиям в области термодинамики, а также законы термодинамики. Само понятие термодинамика представляет собой теорию тепловых процессов в количественной интерпретации. Несмотря на то, что термодинамика рассматривается как часть молекулярной физики, она рассматривает процессы в большом масштабе, на уровне макроскопических явлений. Исследование процессов на гранях различных масштабов позволяет лучше понимать и объяснять различные процессы, поэтому различные методы имеют места быть.
Основное понятие для изучения в термодинамике это энергия, основные процессы – ее превращение и способы передачи. Большая часть процессов происходит с выделением тепла и, исходя из этого появляется еще один параметр, которого нужно учитывать и носит он название температура. Современная наука термодинамика основана на постулатах, которые появились долгое время тому назад и были подтверждены, так как временем, так и заявлениями различных ученых. Различные законы термодинамики были озвучены известными физиками в конкретных формулировках. Те заявления, которые были достаточно изучены и подтверждены различными заявлениями и стали законами термодинамики.
Современная наука термодинамика основана на постулатах, которые появились долгое время тому назад и были подтверждены, так как временем, так и заявлениями различных ученых. Различные законы термодинамики были озвучены известными физиками в конкретных формулировках. Те заявления, которые были достаточно изучены и подтверждены различными заявлениями и стали законами термодинамики.
Всего существует три закона термодинамики, некоторые из них известны в несколько интерпретациях. Понятие закон означает, что явление происходит с определенной регулярностью и без существенных изменений условий. Термодинамические наблюдения можно применять в отношении любого вещества в любом состоянии. Правда обобщенность больше мешает, когда не известны свойства конкретного вещества, так как от его свойств будут зависеть определенные параметры. Это единственный серьезный минус метода термодинамики в изучении отдельных процессов. Недостаток проявляется тем, что приходится тратить больше времени на изучение всей информации о веществе.
Законы термодинамики: первый, второй и третий закон термодинамики
Первый закон термодинамики сформулировал М.В. Ломоносов: Энергия не исчезает и не теряется в никуда, она всего лишь переходит из одного состояния в другое. (Закон известен также как «закон сохранения энергии»).
Второй закон термодинамики известен в несколько интерпретациях: Больцмана, Клаузиуса, Томсона и Кельвина. Первая формулировка принадлежит Клаузиусу, поэтому именно ее необходимо озвучить в первую очередь: Любое холодное тело не способно передавать тепло другому телу с более высокой температурой.
Томсон заявил: «Никакой процесс не может считаться возможным, если для его исполнения требуется тепло другого тела».
Согласно Больцману: «Энергия может превратиться в энное количество тепла, но только в одно направление, так как в обратное направление речь уже только о частичной трансформации».
Кельвин считал что: “Невозможны те процессы, которые должны повторяться и происходить с учетом использования тепла от конкретного тела. Не реально создать тепловой двигатель на основе принципа использования тепла постороннего тела.”
Третий закон термодинамики известен также как теорема Нернста, ссылается на то же состояние энтропии, о которой упоминал Больцман при формулировке второго закона термодинамики. «Состояние энтропии будет стремиться к пределу в том случае, когда изменения температуры в системе направлены к нулю. Это происходит, потому что энтропия перестает зависеть от любых других параметров состояния.»
Законы термодинамики и их практическое применение
Термодинамика играет особую роль в различных областях науки и повседневной жизни. Ее закономерности и правила применяются для решения задач в области теплотехники, энергетики, космических исследований, биологии, машиностроении и много других областей. Гораздо проще свершать какие-то новые открытия, когда уже есть общеизвестные и неоспоримые факты. Великие открытия в прошлом всегда продолжают решать задачи человечества, несмотря на наступающий прогресс, потому что он не был бы возможным без всех тех свершений в прошлом.
Гораздо проще свершать какие-то новые открытия, когда уже есть общеизвестные и неоспоримые факты. Великие открытия в прошлом всегда продолжают решать задачи человечества, несмотря на наступающий прогресс, потому что он не был бы возможным без всех тех свершений в прошлом.
Курс физики (Геворкян Р. Г.)
Курс физики (Геворкян Р. Г.)
ОглавлениеПРЕДИСЛОВИЕЧасть I. МЕХАНИКА § 1. СИСТЕМЫ ОТСЧЕТА; ЛИНЕЙНЫЕ И УГЛОВЫЕ СКОРОСТИ И УСКОРЕНИЯ ДВИЖЕНИЕ ПО КРИВОЛИНЕЙНОЙ ТРАЕКТОРИИ § 2. ЗАКОНЫ МЕХАНИКИ НЬЮТОНА. СИСТЕМЫ ЕДИНИЦ СИЛА. ДЕФОРМАЦИЯ. МАССА ОСНОВНЫЕ ЗАКОНЫ МЕХАНИКИ ИМПУЛЬС. РАБОТА. МОЩНОСТЬ ЕДИНИЦЫ ФИЗИЧЕСКИХ ВЕЛИЧИН § 3. ДВИЖЕНИЕ ТЕЛА В ПОЛЕ ТЯГОТЕНИЯ ЗЕМЛИ ГРАВИТАЦИОННОЕ ПОЛЕ. ВЕС ТЕЛА ДВИЖЕНИЕ КОСМИЧЕСКИХ ОБЪЕКТОВ § 4. ДВИЖЕНИЕ ТЕЛ С ПЕРЕМЕННОЙ МАССОЙ § 5. ПРИНЦИП ОТНОСИТЕЛЬНОСТИ В МЕХАНИКЕ ПРЕОБРАЗОВАНИЯ КООРДИНАТ, СКОРОСТЕЙ И УСКОРЕНИЙ Глава 2. ВРАЩЕНИЕ ТВЕРДОГО ТЕЛА § 6. КИНЕТИЧЕСКАЯ ЭНЕРГИЯ ВРАЩАЮЩЕГОСЯ ТЕЛА; МОМЕНТ ИНЕРЦИИ ТЕЛ § 7. ЗАКОНЫ МЕХАНИКИ ДЛЯ ВРАЩАТЕЛЬНОГО ДВИЖЕНИЯ  БАЛАНСИРОВКА РОТОРОВ. ГИРОСКОПЫ БАЛАНСИРОВКА РОТОРОВ. ГИРОСКОПЫГлава 3. ЗАКОНЫ СОХРАНЕНИЯ В СИСТЕМЕ ВЗАИМОДЕЙСТВУЮЩИХ ТЕЛ § 9. ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА (КОЛИЧЕСТВА ДВИЖЕНИЯ) § 10. ЗАКОН СОХРАНЕНИЯ МОМЕНТА ИМПУЛЬСА (МОМЕНТА КОЛИЧЕСТВА ДВИЖЕНИЯ) § 11. ЗАКОН СОХРАНЕНИЯ МЕХАНИЧЕСКОЙ ЭНЕРГИИ § 12. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ НЕКОТОРЫХ СИСТЕМ § 13. СТОЛКНОВЕНИЕ ШАРОВ § 14. О ЦЕНТРЕ МАСС СИСТЕМЫ Глава 4. КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ ТЕЛ § 15. ПЕРИОДИЧЕСКОЕ ДВИЖЕНИЕ; ГАРМОНИЧЕСКИЕ КОЛЕБАНИЯ § 16. СКОРОСТЬ И УСКОРЕНИЕ КОЛЕБЛЮЩЕГОСЯ ТЕЛА. ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ГАРМОНИЧЕСКИХ КОЛЕБАНИЙ § 18. СОБСТВЕННЫЕ, СВОБОДНЫЕ И ВЫНУЖДЕННЫЕ КОЛЕБАНИЯ. ПАРАМЕТРИЧЕСКОЕ ВОЗБУЖДЕНИЕ КОЛЕБАНИЙ § 19. ПОНЯТИЕ О НЕЛИНЕЙНЫХ КОЛЕБАНИЯХ § 20. СЛОЖЕНИЕ И РАЗЛОЖЕНИЕ КОЛЕБАНИЙ § 21. АВТОКОЛЕБАНИЯ Глава 5. ВОЛНОВЫЕ ПРОЦЕССЫ; ОСНОВЫ АКУСТИКИ § 22. ОБРАЗОВАНИЕ И РАСПРОСТРАНЕНИЕ ВОЛН В УПРУГОЙ СРЕДЕ § 23. 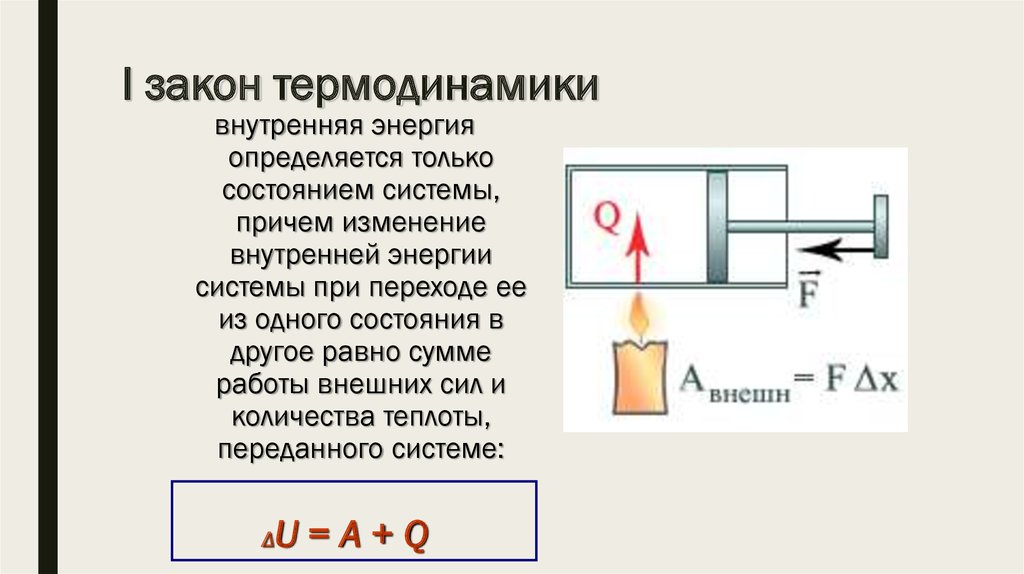 ФОРМУЛА ГАРМОНИЧЕСКОЙ ВОЛНЫ ФОРМУЛА ГАРМОНИЧЕСКОЙ ВОЛНЫВОЛНА В УПРУГОЙ СРЕДЕ § 24. ПОТОК ЭНЕРГИИ В ВОЛНОВЫХ ПРОЦЕССАХ § 26. СТОЯЧИЕ ВОЛНЫ § 27. ЗВУКОВЫЕ КОЛЕБАНИЯ И ВОЛНЫ ЭФФЕКТ ДОПЛЕРА ХАРАКТЕРИСТИКИ ЗВУКОВОГО ОЩУЩЕНИЯ § 28. УЛЬТРАЗВУКИ И ИХ ПРИМЕНЕНИЯ Глава 6. МЕХАНИКА ЖИДКОСТЕЙ И ГАЗОВ § 29. ГИДРОСТАТИЧЕСКОЕ ДАВЛЕНИЕ. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА § 30. ЛАМИНАРНОЕ И ТУРБУЛЕНТНОЕ ТЕЧЕНИЯ. ФОРМУЛА БЕРНУЛЛИ СЖИМАЕМОСТЬ И ВЯЗКОСТЬ В ПОТОКЕ РАСПРЕДЕЛЕНИЕ СКОРОСТЕЙ В ЛАМИНАРНОМ ПОТОКЕ Часть II. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА § 1. ТЕПЛОВОЕ ДВИЖЕНИЕ § 2. ВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ; ЭНЕРГИЯ СВЯЗИ МОЛЕКУЛ § 3. АГРЕГАТНЫЕ СОСТОЯНИЯ И ФАЗОВЫЕ ПЕРЕХОДЫ. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ СОСТОЯНИЯ И ПРОЦЕССЫ ВИДЫ ТЕРМОДИНАМИЧЕСКИХ ПРОЦЕССОВ § 4. ВНУТРЕННЯЯ ЭНЕРГИЯ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ § 5. ВНЕШНЯЯ РАБОТА СИСТЕМЫ И ТЕПЛООБМЕН С ОКРУЖАЮЩЕЙ СРЕДОЙ.  ТЕПЛОЕМКОСТЬ ТЕЛ ТЕПЛОЕМКОСТЬ ТЕЛ§ 6. ИЗОПРОЦЕССЫ; АДИАБАТИЧЕСКИЙ ПРОЦЕСС. ЭНТРОПИЯ СИСТЕМЫ. ЗАМКНУТЫЕ (КРУГОВЫЕ) ПРОЦЕССЫ ГРАФИЧЕСКОЕ ИЗОБРАЖЕНИЕ ИЗОПРОЦЕССОВ КРУГОВЫЕ ПРОЦЕССЫ § 7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ. ЗАКОН ВОЗРАСТАНИЯ ЭНТРОПИИ ТЕПЛОВЫЕ И ХОЛОДИЛЬНЫЕ МАШИНЫ ЭНТРОПИЯ И ВЕРОЯТНОСТЬ Глава 2. ИДЕАЛЬНЫЙ ГАЗ § 8. ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ. СРЕДНИЕ СКОРОСТИ МОЛЕКУЛ § 10. ИЗОПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ; ТЕПЛОЕМКОСТИ ГАЗОВ § 11. КРУГОВЫЕ ПРОЦЕССЫ, СОВЕРШАЕМЫЕ ИДЕАЛЬНЫМ ГАЗОМ; ЦИКЛ КАРНО. ЭНТРОПИЯ ИДЕАЛЬНОГО ГАЗА ЦИКЛ КАРНО ПРОЦЕССЫ, ВЫЗЫВАЮЩИЕ ИЗМЕНЕНИЕ ЭНТРОПИИ ПАРАДОКС ГИББСА § 12. ДИФФУЗИЯ, ТЕПЛОПРОВОДНОСТЬ И ВНУТРЕННЕЕ ТРЕНИЕ В ГАЗАХ; ЧИСЛО СТОЛКНОВЕНИЙ И ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ Глава 3. РЕАЛЬНЫЕ ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ТЕЛА § 13. ОТСТУПЛЕНИЯ ОТ ЗАКОНОВ ИДЕАЛЬНЫХ ГАЗОВ. НАСЫЩЕННЫЕ ПАРЫ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ГАЗОВ ПАР ПЕРЕХОДЫ в СИСТЕМЕ ЖИДКОСТЬ — ПАР — ГАЗ § 14.  ПАРАМЕТРЫ КРИТИЧЕСКОГО СОСТОЯНИЯ ПРИМЕНЕНИЯ УРАВНЕНИЯ ВАН-ДЕР-ВААЛЬСА § 15. ЖИДКОСТИ; ИХ ОСНОВНЫЕ СВОЙСТВА. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ И ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ СВОЙСТВА ЖИДКОСТЕЙ МОЛЕКУЛЯРНЫЕ СИЛЫ В ПОВЕРХНОСТНОМ СЛОЕ § 16. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ § 17. ИСПАРЕНИЕ И КИПЕНИЕ ЖИДКОСТЕЙ; КОНДЕНСАЦИЯ ПАРОВ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ КИПЕНИЕ УДЕЛЬНАЯ ТЕПЛОТА ПАРООБРАЗОВАНИЯ § 18. КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА. КРИСТАЛЛИЗАЦИЯ, ПЛАВЛЕНИЕ И ИСПАРЕНИЕ ТВЕРДЫХ ТЕЛ КРИСТАЛЛИЗАЦИЯ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ТРОЙНАЯ ТОЧКА § 19. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК. ТЕПЛОВЫЕ И УПРУГИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ ТЕПЛОВОЕ РАСШИРЕНИЕ КРИСТАЛЛОВ УПРУГОСТЬ И ПЛАСТИЧНОСТЬ ЖИДКИЕ КРИСТАЛЛЫ Часть III. ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ § 1. ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ. ПРОВОДНИКИ И ДИЭЛЕКТРИКИ § 2. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ; ИНДУКЦИЯ И НАПРЯЖЕННОСТЬ ПОЛЯ. ЗАКОН КУЛОНА § 3. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ СИСТЕМЫ ЗАРЯДОВ; ТЕОРЕМА ОСТРОГРАДСКОГО—ГАУССА ПРИМЕНЕНИЕ ТЕОРЕМЫ ОСТРОГРАДСКОГО—ГАУССА ФОРМУЛЫ ДЛЯ НАПРЯЖЕННОСТИ ПОЛЯ § 4.  РАБОТА ПЕРЕМЕЩЕНИЯ ЗАРЯДА В ЭЛЕКТРИЧЕСКОМ ПОЛЕ; РАЗНОСТЬ ПОТЕНЦИАЛОВ. ЭНЕРГИЯ ВЗАИМОДЕЙСТВИЯ ЗАРЯДОВ РАБОТА ПЕРЕМЕЩЕНИЯ ЗАРЯДА В ЭЛЕКТРИЧЕСКОМ ПОЛЕ; РАЗНОСТЬ ПОТЕНЦИАЛОВ. ЭНЕРГИЯ ВЗАИМОДЕЙСТВИЯ ЗАРЯДОВ§ 6. ДИЭЛЕКТРИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ ЭЛЕКТРОСТРИКЦИЯ ПЬЕЗОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ СЕГНЕТОЭЛЕКТРИКИ ЭЛЕКТРЕТЫ § 7. ЭЛЕКТРОЕМКОСТЬ. ЭНЕРГИЯ ЗАРЯЖЕННОГО ПРОВОДНИКА. ПЛОТНОСТЬ ЭНЕРГИИ ПОЛЯ Глава 2. ЭЛЕКТРИЧЕСКИЙ ТОК § 8. ЭЛЕКТРИЧЕСКИЙ ТОК ПРОВОДИМОСТИ; ПЛОТНОСТЬ ТОКА § 9. ЭЛЕКТРОННАЯ ТЕОРИЯ ПРОВОДИМОСТИ МЕТАЛЛОВ. ЗАКОНЫ ОМА И ДЖОУЛЯ—ЛЕНЦА В ДИФФЕРЕНЦИАЛЬНОЙ ФОРМЕ. СВЯЗЬ МЕЖДУ ЭЛЕКТРОПРОВОДНОСТЬЮ И ТЕПЛОПРОВОДНОСТЬЮ § 10. РАБОТА ЭЛЕКТРИЧЕСКОГО ТОКА. СОПРОТИВЛЕНИЕ ПРОВОДНИКОВ. СВЕРХПРОВОДИМОСТЬ § 11. ЭЛЕКТРОДВИЖУЩАЯ СИЛА; ЗАКОН ОМА И ПРАВИЛА КИРХГОФА ЗАКОН ОМА ДЛЯ ЗАМКНУТОГО КОНТУРА ПРАВИЛА КИРХГОФА ЭЛЕКТРОСТАТИЧЕСКИЙ ГЕНЕРАТОР ТОКА ЭМИССИЯ ЭЛЕКТРОНОВ ИЗ МЕТАЛЛА КОНТАКТНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ ЗАКОН ВОЛЬТА.  ТЕРМОЭЛЕМЕНТЫ ТЕРМОЭЛЕМЕНТЫЭФФЕКТ ПЕЛЬТЬЕ § 13. ТЕРМОЭЛЕКТРОННАЯ ЭМИССИЯ. ЭЛЕКТРИЧЕСКИИ ТОК В ВАКУУМЕ. ЭЛЕКТРОННАЯ ЛАМПА § 14. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ. ПОНЯТИЕ О ПЛАЗМЕ ДВИЖЕНИЕ ИОНОВ В ГАЗЕ ВИДЫ РАЗРЯДОВ В ГАЗАХ ПЛАЗМА § 15. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ. ЗАКОНЫ ФАРАДЕЯ § 16. ПОЛУПРОВОДНИКИ И ИХ ПРИМЕНЕНИЯ ЭЛЕКТРОПРОВОДНОСТЬ ПОЛУПРОВОДНИКОВ ЯВЛЕНИЯ НА ГРАНИЦЕ ДВУХ ПОЛУПРОВОДНИКОВ Глава 3. ЭЛЕКТРОМАГНЕТИЗМ § 17. МАГНИТНОЕ ПОЛЕ § 18. НАПРЯЖЕННОСТЬ МАГНИТНОГО ПОЛЯ ВОКРУГ ДВИЖУЩЕГОСЯ ЗАРЯДА И ПРОВОДНИКОВ С ТОКАМИ § 19. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА ЗАРЯДЫ И ПРОВОДНИКИ С ТОКОМ; СИЛА ЛОРЕНЦА И ЗАКОН АМПЕРА. ИНДУКЦИЯ МАГНИТНОГО ПОЛЯ § 20. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА КОНТУР С ТОКОМ. ДВИЖЕНИЕ ЗАРЯДА В МАГНИТНОМ ПОЛЕ МАГНИТНЫЙ МОМЕНТ ЭЛЕКТРОНА ДВИЖЕНИЕ ЗАРЯДА В МАГНИТНОМ ПОЛЕ ЭФФЕКТ ХОЛЛА § 21. РАБОТА ПЕРЕМЕЩЕНИЯ ПРОВОДНИКА С ТОКОМ В МАГНИТНОМ ПОЛЕ § 22. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ; ЗАКОНЫ ФАРАДЕЯ И ЛЕНЦА.  РАМКА В МАГНИТНОМ ПОЛЕ ЗАКОНЫ ФАРАДЕЯ И ЛЕНЦА § 23. ЯВЛЕНИЯ САМОИНДУКЦИИ И ВЗАИМОИНДУКЦИИ. ЭНЕРГИЯ МАГНИТНОГО ПОЛЯ. ВИХРЕВЫЕ ТОКИ ИНДУКТИВНОСТЬ СОЛЕНОИДА РАСЧЕТ ИНДУКЦИОННЫХ ТОКОВ ВЗАИМНАЯ ИНДУКЦИЯ ЭНЕРГИЯ МАГНИТНОГО ПОЛЯ ТОКИ ФУКО § 24. ТОК СМЕЩЕНИЯ И ЕГО МАГНИТНОЕ ПОЛЕ; ТЕОРИЯ МАКСВЕЛЛА § 25. МАГНИТНОЕ ПОЛЕ В ВЕЩЕСТВЕ. ДИАМАГНЕТИЗМ; ПАРАМАГНИТНЫЕ И ФЕРРОМАГНИТНЫЕ ВЕЩЕСТВА НАМАГНИЧЕННОСТЬ МАГНИТНЫЕ СВОЙСТВА АТОМОВ И МОЛЕКУЛ ДИАМАГНЕТИЗМ И ПАРАМАГНЕТИЗМ ФЕРРОМАГНЕТИКИ ПАРАМАГНИТНЫЙ РЕЗОНАНС § 26. МАГНИТНОЕ ПОЛЕ В ФЕРРОМАГНИТНЫХ ТЕЛАХ РАЗЛИЧНОЙ ФОРМЫ; МАГНИТОДВИЖУЩАЯ СИЛА И МАГНИТНОЕ СОПРОТИВЛЕНИЕ Глава 4. ЭЛЕКТРОМАГНИТНЫЕ КОЛЕБАНИЯ И ВОЛНЫ § 27. КОЛЕБАТЕЛЬНЫЙ КОНТУР. НЕЗАТУХАЮЩИЕ И ЗАТУХАЮЩИЕ КОЛЕБАНИЯ § 28. ВЫНУЖДЕННЫЕ КОЛЕБАНИЯ; ЭЛЕКТРИЧЕСКИЙ РЕЗОНАНС § 29. ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ УРАВНЕНИЕ ЭЛЕКТРОМАГНИТНОЙ ВОЛНЫ ЭНЕРГИЯ ЭЛЕКТРОМАГНИТНОЙ ВОЛНЫ ИЗЛУЧЕНИЕ ВОЛНЫ ЭЛЕКТРОНОМ ЧЕРЕНКОВСКОЕ ИЗЛУЧЕНИЕ Часть IV.  ОПТИКА И ФИЗИКА АТОМА ОПТИКА И ФИЗИКА АТОМА§ 1. ВОЛНОВАЯ (ЭЛЕКТРОМАГНИТНАЯ) И КОРПУСКУЛЯРНАЯ (ФОТОННАЯ) ТЕОРИИ СВЕТА СПЕКТРАЛЬНЫЙ СОСТАВ ИЗЛУЧЕНИЯ ХАРАКТЕРИСТИКИ ИЗЛУЧЕНИЯ ИДЕАЛИЗАЦИЯ СВЕТОВОЙ ВОЛНЫ § 2. ФОТОМЕТРИЧЕСКИЕ ПОНЯТИЯ И ВЕЛИЧИНЫ. ДАВЛЕНИЕ СВЕТА § 3. РАСПРОСТРАНЕНИЕ, ОТРАЖЕНИЕ, ПРЕЛОМЛЕНИЕ И ПОГЛОЩЕНИЕ СВЕТА. ДИСПЕРСИЯ. РАССЕЯНИЕ СВЕТА СБЕТ НА ГРАНИЦЕ ДВУХ СРЕД СВЕТ И ЦВЕТ ДИСПЕРСИЯ СВЕТА РАССЕЯНИЕ СВЕТА § 4. ИНТЕРФЕРЕНЦИЯ СВЕТА; КОГЕРЕНТНОСТЬ СВЕТОВЫХ ЛУЧЕЙ. ИНТЕРФЕРОМЕТРЫ § 5. ДИФРАКЦИЯ СВЕТА; ДИФРАКЦИОННЫЙ СПЕКТР ДИФРАКЦИЯ ПЛОСКОЙ ВОЛНЫ ОТ ПРЯМОЛИНЕЙНОЙ ТОНКОЙ ЩЕЛИ ДИФРАКЦИЯ ПЛОСКОЙ ВОЛНЫ ОТ НЕСКОЛЬКИХ ЩЕЛЕЙ ДИФРАКЦИОННАЯ РЕШЕТКА § 6. РАСПРОСТРАНЕНИЕ СВЕТА В АНИЗОТРОПНОЙ СРЕДЕ, ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ПОЛЯРИЗОВАННОГО СВЕТА ПОЛЯРИЗОВАННЫЙ СВЕТ СПОСОБЫ ПОЛУЧЕНИЯ ПОЛЯРИЗОВАННОГО СВЕТА ИНТЕРФЕРЕНЦИЯ ПОЛЯРИЗОВАННОГО СВЕТА ОПТИЧЕСКАЯ АНИЗОТРОПИЯ § 7. ЛИНЗЫ; ИХ ОПТИЧЕСКАЯ СИЛА. АБЕРРАЦИИ. ДИАФРАГМЫ В ОПТИЧЕСКИХ ПРИБОРАХ ТОЛСТЫЕ ЛИНЗЫ.  АБЕРРАЦИИ АБЕРРАЦИИ§ 8. ПОНЯТИЕ О ГОЛОГРАФИИ Глава 2. ФИЗИКА АТОМОВ И МОЛЕКУЛ. ОСНОВЫ КВАНТОВОЙ ТЕОРИИ § 9. СТРОЕНИЕ АТОМА. ОПЫТЫ РЕЗЕРФОРДА, ФРАНКА И ГЕРЦА. ЭЛЕМЕНТАРНАЯ ТЕОРИЯ АТОМА ВОДОРОДА ОПЫТ ФРАНКА И ГЕРЦА СПЕКТРЫ ИЗЛУЧЕНИЯ АТОМОВ ТЕОРИЯ АТОМА ВОДОРОДА § 10. КОРПУСКУЛЯРНО-ВОЛНОВЫЕ СВОЙСТВА ЧАСТИЦ. ФОТОЭЛЕКТРИЧЕСКИЙ ЭФФЕКТ. ФОРМУЛА ДЕ БРОЙЛЯ. ДИФРАКЦИЯ ЭЛЕКТРОНОВ ЭФФЕКТ КОМПТОНА ФОТОН И ЭЛЕКТРОМАГНИТНАЯ ВОЛНА ФОРМУЛА ДЕ БРОЙЛЯ ДИФРАКЦИЯ ЭЛЕКТРОНОВ § 11. ОСНОВНЫЕ ПОЛОЖЕНИЯ КВАНТОВОЙ ТЕОРИИ. УРАВНЕНИЕ ШРЕДИНГЕРА. СООТНОШЕНИЕ НЕОПРЕДЕЛЕННОСТЕЙ ГЕЙЗЕНБЕРГА УРАВНЕНИЕ ШРЕДИНГЕРА РЕШЕНИЯ УРАВНЕНИЯ ШРЕДИНГЕРА СВОБОДНЫЙ ЭЛЕКТРОН ПОТЕНЦИАЛЬНЫЙ БАРЬЕР ЧАСТИЦА В ПОТЕНЦИАЛЬНОЙ ЯМЕ АТОМ ВОДОРОДА. КВАНТОВЫЕ ЧИСЛА СООТНОШЕНИЕ НЕОПРЕДЕЛЕННОСТЕЙ § 12. ЧАСТИЦЫ И ФИЗИЧЕСКИЕ СИСТЕМЫ. СТАТИСТИЧЕСКИЕ РАСПРЕДЕЛЕНИЯ ЧАСТИЦ ПО СОСТОЯНИЯМ. ПОНЯТИЕ ТЕМПЕРАТУРЫ РОЛЬ ТЕПЛОВОГО ДВИЖЕНИЯ ЧАСТИЦ ФУНКЦИИ РАСПРЕДЕЛЕНИЯ ПО СОСТОЯНИЯМ ТЕМПЕРАТУРА ЭНЕРГЕТИЧЕСКИЙ СПЕКТР СИСТЕМЫ РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ § 13.  ВЗАИМОДЕЙСТВИЕ АТОМОВ И МОЛЕКУЛ. ЭНЕРГИЯ СВЯЗИ АТОМОВ ВЗАИМОДЕЙСТВИЕ АТОМОВ И МОЛЕКУЛ. ЭНЕРГИЯ СВЯЗИ АТОМОВВЗАИМОДЕЙСТВИЕ МОЛЕКУЛ ИОННАЯ СВЯЗЬ РОЛЬ ЭЛЕКТРОННОГО ГАЗА В МЕТАЛЛАХ Глава 3. ИЗЛУЧЕНИЕ И ПОГЛОЩЕНИЕ ЭНЕРГИИ АТОМАМИ И МОЛЕКУЛАМИ § 14. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ СПЕКТРЫ ИЗЛУЧЕНИЯ; СПОСОБЫ ВОЗБУЖДЕНИЯ СТРУКТУРА ЭЛЕКТРОННОЙ ОБОЛОЧКИ СПЕКТРЫ ИЗЛУЧЕНИЯ АТОМОВ СПЕКТРЫ ИЗЛУЧЕНИЯ МОЛЕКУЛ КОМБИНАЦИОННОЕ РАССЕЯНИЕ СВЕТА § 15. ТЕПЛОВОЕ ИЗЛУЧЕНИЕ ФОРМУЛА ПЛАНКА ЗАКОНЫ ИЗЛУЧЕНИЯ ЧЕРНОГО ТЕЛА ПРИМЕНЕНИЕ ЗАКОНОВ ТЕПЛОВОГО ИЗЛУЧЕНИЯ § 16. РЕНТГЕНОВСКИЕ ЛУЧИ. ХАРАКТЕРИСТИЧЕСКИЙ РЕНТГЕНОВСКИЙ СПЕКТР ЭЛЕМЕНТОВ ХАРАКТЕРИСТИЧЕСКИЙ РЕНТГЕНОВСКИЙ СПЕКТР ДИФРАКЦИЯ И ИНТЕРФЕРЕНЦИЯ РЕНТГЕНОВСКИХ ЛУЧЕЙ ДОЗИМЕТРИЯ § 17. ЛЮМИНЕСЦЕНТНОЕ ИЗЛУЧЕНИЕ ПРИРОДА ЛЮМИНЕСЦЕНЦИИ ХАРАКТЕРИСТИКИ ЛЮМИНЕСЦИРУЮЩИХ ВЕЩЕСТВ ГАШЕНИЕ ЛЮМИНЕСЦЕНЦИИ ПРИМЕНЕНИЯ ЛЮМИНЕСЦЕНЦИИ § 18. ИНДУЦИРОВАННОЕ ИЗЛУЧЕНИЕ. ЛАЗЕРЫ ЛАЗЕРЫ ПРЕИМУЩЕСТВА ЛАЗЕРОВ ПРИМЕНЕНИЕ ЛАЗЕРОВ Глава 4. АТОМНЫЕ ЯДРА И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ § 19.  ОСНОВНЫЕ СВОЙСТВА АТОМНЫХ ЯДЕР ОСНОВНЫЕ СВОЙСТВА АТОМНЫХ ЯДЕРРАДИОАКТИВНОСТЬ ВНУТРИЯДЕРНЫЕ СИЛЫ ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЯДЕР МЕХАНИЧЕСКИЙ МОМЕНТ ЯДРА МАГНИТНЫЕ МОМЕНТЫ ЯДЕР ЭЛЕКТРИЧЕСКИЕ МОМЕНТЫ ЯДЕР СПЕКТР ВОЗБУЖДЕННЫХ СОСТОЯНИЙ § 20. МОДЕЛЬНЫЕ ПРЕДСТАВЛЕНИЯ О СТРУКТУРЕ ЯДЕР КАПЕЛЬНАЯ МОДЕЛЬ ЯДРА ОБОЛОЧЕЧНАЯ МОДЕЛЬ ОБОБЩЕННАЯ МОДЕЛЬ ОПТИЧЕСКАЯ МОДЕЛЬ УСЛОВИЕ СТАБИЛЬНОСТИ § 21. РАДИОАКТИВНЫЕ ЯДРА И ИХ ИЗЛУЧЕНИЯ СЕМЕЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ ВЗАИМОДЕЙСТВИЯ ЯДЕРНЫХ ИЗЛУЧЕНИЙ С ВЕЩЕСТВОМ БЕТА-РАСПАД ЯДЕР ЭНЕРГИЯ СВЯЗИ ЯДЕР ИЗОМЕРЫ § 22. ЯДЕРНЫЕ РЕАКЦИИ ДЕЛЕНИЯ И СИНТЕЗА. ТЕРМОЯДЕРНЫЕ РЕАКЦИИ БОМБАРДИРОВКА ЯДЕР ЧАСТИЦАМИ ЭФФЕКТИВНЫЕ СЕЧЕНИЯ РЕАКЦИЙ ЯДЕРНЫЕ РЕАКТОРЫ ЯДЕРНЫЙ СИНТЕЗ § 23. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ РАСПАДЫ ЧАСТИЦ ВИДЫ ВЗАИМОДЕЙСТВИЯ ЗАКЛЮЧЕНИЕ § 1. ФИЗИЧЕСКИЕ ИЗМЕРЕНИЯ. СВЯЗЬ МЕЖДУ СПОСОБАМИ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН И ФОРМУЛИРОВКАМИ ЗАКОНОВ ФИЗИКИ § 2. О ТЕОРИИ ОТНОСИТЕЛЬНОСТИ ЭЙНШТЕЙНА § 3. 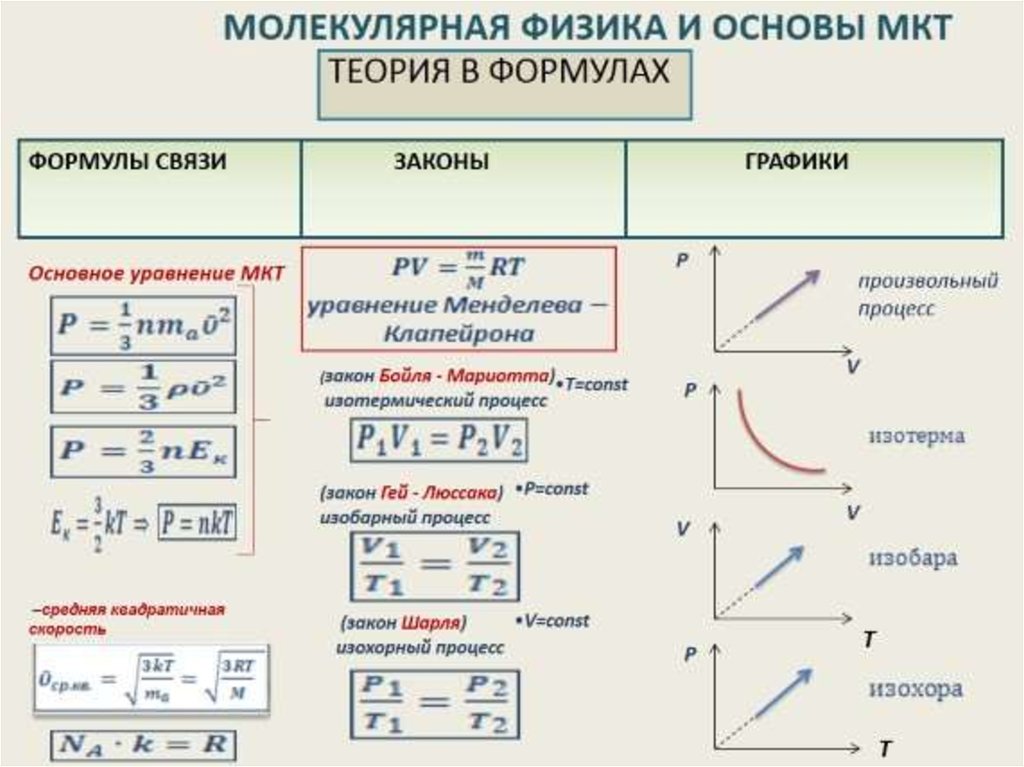 ЗАКОНЫ СОХРАНЕНИЯ, ПРЕВРАЩЕНИЯ И ПЕРЕРАСПРЕДЕЛЕНИЯ ЭНЕРГИИ В ФИЗИЧЕСКИХ СИСТЕМАХ ЗАКОНЫ СОХРАНЕНИЯ, ПРЕВРАЩЕНИЯ И ПЕРЕРАСПРЕДЕЛЕНИЯ ЭНЕРГИИ В ФИЗИЧЕСКИХ СИСТЕМАХ§ 4. О ВАРИАЦИОННЫХ ПРИНЦИПАХ ФИЗИКИ § 5. СТАТИСТИЧЕСКИЕ ЗАКОНЫ И ФЛУКТУАЦИИ § 6. О ДУАЛИЗМЕ В ФИЗИКЕ |
Термодинамика – законы, определения и уравнения
Ищете примечания к пересмотру, относящиеся к экзаменационной комиссии, которую вы изучаете? Если это так, щелкните ссылки ниже, чтобы просмотреть наши сжатые, простые для понимания примечания к пересмотру для каждой экзаменационной комиссии, буклеты с практическими экзаменационными вопросами, наглядные пособия по ментальным картам, интерактивные викторины, презентации PowerPoint и библиотеку прошлых работ непосредственно с экзаменационных комиссий.
Содержание
Термодинамика – это наука, определяющая отношения между теплом и другими видами энергии, особенно механической энергией или работой. Классическая термодинамика имеет дело с макроскопическими свойствами, такими как давление, температура, массовая плотность и т. д.; это означает, что он не изучает системы на атомном или молекулярном уровне. С другой стороны, статистическая термодинамика — это наука, изучающая изменения таких свойств на атомарном уровне.
д.; это означает, что он не изучает системы на атомном или молекулярном уровне. С другой стороны, статистическая термодинамика — это наука, изучающая изменения таких свойств на атомарном уровне.
Существует четыре закона термодинамики; первый, второй, третий и нулевой. Понятия этих законов были разработаны в девятнадцатом веке, но законы были провозглашены в разное время; первая и вторая в девятнадцатом веке, третья и нулевая в двадцатом веке. Нулевой закон был назван так потому, что переставить нумерацию было невозможно.
Теперь вам может быть интересно, почему он назван нулевым; почему не четвертый закон. Просто потому, что это логический ход вещей. Нулевой закон пришел, чтобы установить измерения температуры и поставить термин «температура» в конкретные рамки. Простыми словами, пришло определение температуры на основе измерений. Закон гласит, что «если система А находится в тепловом равновесии с системой В, а эта система В находится в тепловом равновесии с другой системой С, то система А будет находиться в тепловом равновесии с системой С». Вам может показаться, что эти наблюдения очевидны; это правда, и именно по этой причине этот закон был изложен с опозданием. Это похоже на то, когда вы доказываете математическое уравнение и пропускаете шаг, потому что это очевидно, но доказательство не будет полным без его формулировки; очевидно, как это.
Вам может показаться, что эти наблюдения очевидны; это правда, и именно по этой причине этот закон был изложен с опозданием. Это похоже на то, когда вы доказываете математическое уравнение и пропускаете шаг, потому что это очевидно, но доказательство не будет полным без его формулировки; очевидно, как это.
Первый закон термодинамики — это просто другая версия или расширение закона сохранения энергии. Итак, вы не можете победить, потому что вы не можете получить то, чего не было изначально. Другими словами, энергия остается постоянной. Это приводит нас к выражению первого закона, который гласит, что «внутренняя энергия данной системы равна теплоте, переданной системе, за вычетом работы, совершаемой системой».
Это выражение можно записать следующим образом:
∆U=Q-W
U: Внутренняя энергия
Q: Теплота
Вт: Работа
Если вы видите определение со словами «работа, выполненная в системе» тогда выражение изменится и будет иметь плюс вместо минуса.
∆U=Q+W
Второй закон – это тот, который рассматривает все в перспективе и добавляет к уравнению случайность реального мира; это тот, который вводит выражение эффективности и энтропии. Вы даже не можете безубыточности, вы не можете получить то, что вкладываете в систему; всегда есть цена или потеря. Второй закон гласит, что теплота не может переходить от более холодного тела к более горячему без компенсации. Другими словами, тепло самопроизвольно переходит от более горячего тела к более холодному. Это означает, что система всегда движется в направлении увеличения случайности или энтропии.
Энтропия — это мера случайности или беспорядочности системы. Все природные системы имеют тенденцию идти в сторону увеличения энтропии. То же самое относится и к отношениям между различными формами энергии. Если бы работу можно было легко преобразовать в теплоту, которая представляет собой более беспорядочную форму энергии, но для преобразования теплоты в работу большая часть энергии будет потеряна в окружающей среде, а энергия покинет свой источник и будет потеряна в форме, которая становится непригодным для использования, т. е. эффективность снижается. Представьте себе, что машина работает на топливе, которое сгорает, преобразуя химическую энергию в тепловую, а затем преобразуя ее в работу для работы машины, но не с той же эффективностью, потому что большая часть тепла теряется в виде тепла в окружающий воздух, в обратную сторону. этот процесс, больше энергии будет потеряно в окружающий воздух.
е. эффективность снижается. Представьте себе, что машина работает на топливе, которое сгорает, преобразуя химическую энергию в тепловую, а затем преобразуя ее в работу для работы машины, но не с той же эффективностью, потому что большая часть тепла теряется в виде тепла в окружающий воздух, в обратную сторону. этот процесс, больше энергии будет потеряно в окружающий воздух.
Второй закон термодинамики утверждает, что полная энтропия никогда не может уменьшаться с течением времени для изолированной системы, то есть системы, в которую ни энергия, ни материя не могут входить и выходить .
Второй закон — самый важный из всех четырех. Это наиболее применимо в промышленных целях, например. автомобильные двигатели, кондиционеры и холодильники. Это также приносит больше всего разочарований, потому что заявляет, что мы не можем иметь всю потраченную энергию в той форме, в которой мы хотим, например, мы не можем управлять машиной без непрерывной подачи топлива.
Баланс энтропии и внутренней энергии системы определяет, будет ли реакция (или процесс) самопроизвольной или нет. Результатом этих двух терминов является «свободная энергия», общее изменение которой указывает путь реакции.
∆G = ∆H – T∆S
∆G = изменение свободной энергии
∆H = изменение энтальпии
∆S = изменение энтропии протекать, даже если ∆H = +ve (хотя это может быть очень медленно, если реагенты обладают кинетической стабильностью).
Если ∆G = +ve, то реакция не пойдет, даже если ∆H = -ve.
Вы не можете выйти из игры; третий закон . В отличие от других законов, третий закон интерпретируется на молекулярном уровне. В нем говорится, что все процессы в системе перестанут существовать при температуре абсолютного нуля, или, альтернативно, ни одна система не может достичь абсолютного нуля. Молекулы перестанут двигаться при абсолютном нуле, не будет энергии; вот почему ни одна система не может достичь абсолютного нуля.
Подробнее о первом, втором и третьем законах термодинамики
Ключевые положения- Существует четыре закона термодинамики; первый, второй, третий и нулевой.
- 1-й закон сформулирован так: «внутренняя энергия данной системы равна количеству тепла, переданному системе, за вычетом работы, выполненной системой». ∆U=QW
- Энтропия — это мера случайности или беспорядочности системы.
- Второй закон термодинамики указывает, что полная энтропия никогда не может уменьшаться с течением времени для изолированной системы, то есть системы, в которую ни энергия, ни материя не могут входить и выходить.
- “Свободная энергия” – это разница между внутренней энергией и энтропией, которая определяет спонтанность реакции. ∆G = ∆H – T∆S
- Третий закон гласит, что все процессы в системе перестанут существовать при температуре абсолютного нуля, или, альтернативно, ни одна система не может достичь абсолютного нуля.
 Молекулы перестанут двигаться при абсолютном нуле, не будет энергии; вот почему ни одна система не может достичь абсолютного нуля.
Молекулы перестанут двигаться при абсолютном нуле, не будет энергии; вот почему ни одна система не может достичь абсолютного нуля.
Часто задаваемые вопросы
Что такое второй закон термодинамики?
Второй закон термодинамики гласит, что «в изолированной системе, куда энергия не может ни входить, ни выходить, энтропия этой системы со временем увеличивается, и невозможно построить двигатель со 100%-ным КПД».
Что такое энтропия?
Энтропия — это мера случайности системы. Обычно она измеряется с точки зрения энергии, которая недоступна для выполнения работы. Эта энергия, недоступная для совершения работы, находится в форме тепла.
Что такое спонтанные реакции?
Самопроизвольная реакция может протекать сама по себе без какого-либо внешнего подвода энергии к системе. Если изменение свободной энергии в системе имеет значение для реакции, то она может протекать самостоятельно и является самопроизвольной реакцией.
Есть ли система со 100% эффективностью?
Нет, согласно второму закону термодинамики, мы никогда не сможем создать систему со 100% КПД, потому что часть энергии всегда теряется в виде тепла, что приводит к увеличению общей энтропии системы.
- Химический Либретекст https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Thermodynamics
- https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Thermodynamics/
Законы_термодинамики/Второй_закон_термодинамики - https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Thermodynamics/
Законы_термодинамики/Третий_закон_термодинамики
Второй закон термодинамики – Утверждение, формула и часто задаваемые вопросы
Второй закон термодинамики определяет, что тепло не может перемещаться из резервуара с более низкой температурой в резервуар с более высокой температурой в циклическом процессе. Второй закон термодинамики касается естественной передачи тепла от более горячего тела к более холодному. Второй закон термодинамики является одним из трех законов термодинамики. Слово «термодинамика» происходит от двух корневых слов: «термо», что означает тепло, и «динамический», что означает мощность. Таким образом, Законы Термодинамики – это Законы «Теплосилы». Первый закон термодинамики широко известен как закон сохранения материи. Хотя второй закон термодинамики широко известен как закон возрастающей энтропии.
Таким образом, Законы Термодинамики – это Законы «Теплосилы». Первый закон термодинамики широко известен как закон сохранения материи. Хотя второй закон термодинамики широко известен как закон возрастающей энтропии.
Что такое Второй закон термодинамики?
Согласно второму закону термодинамики любой естественный процесс всегда приводит к увеличению энтропии Вселенной (S). Закон просто гласит, что энтропия изолированной системы никогда не будет уменьшаться с течением времени.
Второй закон термодинамики гласит, что тепловая энергия не может передаваться от тела с более низкой температурой к телу с более высокой температурой без добавления энергии.
Общая энтропия системы и ее окружения остается постоянной в некоторых случаях, когда система находится в термодинамическом равновесии или проходит обратимый процесс. Закон возрастающей энтропии — другое название второго закона.
Различные формулировки второго закона термодинамики
Второй закон термодинамики может быть выражен многими конкретными способами разными учеными в разное время. Вот утверждения второго закона термодинамики:
Вот утверждения второго закона термодинамики:
Трудно превратить все тепло, выделяемое нагретым телом, в работу. Рабочее тело тепловой машины поглощает тепло от горячего тела, часть его превращает в работу, а оставшуюся часть отдает холодному телу. Ни один двигатель не может преобразовать всю теплоту от источника в работу без потерь тепла. Это указывает на то, что для непрерывной работы требуется раковина.
Формулировка Клаузиуса о втором законе термодинамикиНевозможно создать технологию, которая могла бы передавать тепло от более холодного тела к более теплому без потери энергии. Другими словами, холодильник не будет работать, если компрессор не питается от внешнего источника. Утверждение Клаузиуса используется тепловыми насосами и холодильниками.
Эквивалентность двух утвержденийХолодильник, например, может передавать определенное количество тепла от холодного тела к горячему, не требуя никакой внешней энергии.
В результате утверждение Клаузиуса нарушается. Предположим, что двигатель, работающий между одними и теми же горячими и холодными телами, поглощает тепло от горячего тела, превращает часть W в работу, а затем передает оставшееся тепло холодному телу.
Двигатель сам по себе не нарушает второй закон термодинамики. Когда двигатель и холодильник работают вместе, они создают механизм, который поглощает все тепло от горячего тела и преобразует его в работу, не жертвуя теплом холодного тела. Утверждение Кельвина-Планка нарушается. В результате мы можем заключить, что две версии второго закона термодинамики эквивалентны во всех отношениях.
Читайте также:
- Нулевой закон термодинамики
- Первый закон термодинамики
Второй закон термодинамики Формула
Второй закон термодинамики выражается математически как;
ΔS univ > 0
Здесь ΔS univ — изменение энтропии Вселенной.
Давайте посмотрим на определение энтропии и на то, как оно связано со вторым правилом термодинамики. Энтропия системы определяется как количество изменений, которые она претерпела от своего предыдущего состояния до своего текущего состояния. В результате энтропия обычно выражается как изменение энтропии системы, обозначенное ∆S. Если необходимо измерить значение энтропии при данном состоянии системы, то ранее выбранному состоянию системы присваивается значение нулевой энтропии.
Изэнтропический процесс — это процесс, при котором энтропия системы остается постоянной во времени. Энтропия системы как в начальном, так и в конечном состоянии остается постоянной во время изоэнтропического процесса. В результате значение S=0 при изоэнтропическом процессе. Только в идеальном случае имеет место обратимый изоэнтропический процесс. На практике всякий раз, когда происходит изменение состояния системы, энтропия системы возрастает.
Применение второго закона термодинамики
Вот применение и использование второго закона термодинамики:
- Закон гласит, что тепло всегда переходит от более теплого тела к более холодному.
 Это правило распространяется на все циклы тепловых двигателей, включая циклы Отто, Дизеля и т. д., а также все рабочие жидкости, используемые в двигателях. Современные автомобили развивались благодаря этому закону.
Это правило распространяется на все циклы тепловых двигателей, включая циклы Отто, Дизеля и т. д., а также все рабочие жидкости, используемые в двигателях. Современные автомобили развивались благодаря этому закону. - Холодильники и тепловые насосы, использующие обратный цикл Карно, являются еще одним примером применения этой концепции. Вы должны совершить внешнюю работу, если хотите передать теплоту от тела с более низкой температурой к телу с большей температурой. В отличие от обратного цикла Карно, который использует работу для перемещения тепла из резервуара с более низкой температурой в резервуар с более высокой температурой, исходный цикл Карно использует тепло для производства работы.
Ограничения второго закона термодинамики
Давайте теперь зачитаем недостатки или недостатки второго закона термодинамики:
- Второй закон термодинамики — это концепция, которая ограничивает возникновение многих процессов, которые, несмотря на то, что разрешены других физических законов, известных нам из опыта, не происходит.
 Например, вода в стакане, нагретая до температуры окружающей среды, никогда самопроизвольно не охлаждается, образуя кубики льда, которые выделяют энергию в окружающую среду.
Например, вода в стакане, нагретая до температуры окружающей среды, никогда самопроизвольно не охлаждается, образуя кубики льда, которые выделяют энергию в окружающую среду. - Предполагая, что Вселенная закончится в состоянии «тепловой смерти», когда все имеет одинаковую температуру, второе правило также предсказывает конец Вселенной. Когда все имеет одинаковую температуру, работа не может совершаться, и вся энергия тратится впустую на беспорядочное движение атомов и молекул, что представляет собой крайний уровень беспорядка.
Часто задаваемые вопросы по второму закону термодинамики
Вопрос 1: Назовите второй закон термодинамики.
Ответ:
Второй закон термодинамики гласит, что тепловая энергия не может передаваться от тела с более низкой температурой к телу с более высокой температурой без добавления энергии.
Вопрос 2: В чем разница между первым и вторым законом термодинамики?
Ответ:
Первый закон термодинамики гласит, что Энергия не может быть создана или уничтожена.
Однако Второй закон термодинамики утверждает, что при спонтанном процессе энтропия Вселенной увеличивается.
Вопрос 3: Каковы приложения второго закона термодинамики
Ответ:
Вот приложения и использование второго закона термодинамики:
- Закон, который всегда движется от тепла тело более теплое к телу более холодному. Это правило распространяется на все циклы тепловых двигателей, включая циклы Отто, Дизеля и т. д., а также все рабочие жидкости, используемые в двигателях. Современные автомобили развивались благодаря этому закону.
- Холодильники и тепловые насосы, использующие обратный цикл Карно, являются еще одним примером применения этой концепции. Вы должны совершить внешнюю работу, если хотите передать теплоту от тела с более низкой температурой к телу с большей температурой. В отличие от обратного цикла Карно, который использует работу для перемещения тепла из резервуара с более низкой температурой в резервуар с более высокой температурой, исходный цикл Карно использует тепло для производства работы.


 В книге нашли отражение новейшие достижения физики, получившие практическое применение
В книге нашли отражение новейшие достижения физики, получившие практическое применение
 Молекулы перестанут двигаться при абсолютном нуле, не будет энергии; вот почему ни одна система не может достичь абсолютного нуля.
Молекулы перестанут двигаться при абсолютном нуле, не будет энергии; вот почему ни одна система не может достичь абсолютного нуля. В результате утверждение Клаузиуса нарушается. Предположим, что двигатель, работающий между одними и теми же горячими и холодными телами, поглощает тепло от горячего тела, превращает часть W в работу, а затем передает оставшееся тепло холодному телу.
В результате утверждение Клаузиуса нарушается. Предположим, что двигатель, работающий между одними и теми же горячими и холодными телами, поглощает тепло от горячего тела, превращает часть W в работу, а затем передает оставшееся тепло холодному телу.
 Это правило распространяется на все циклы тепловых двигателей, включая циклы Отто, Дизеля и т. д., а также все рабочие жидкости, используемые в двигателях. Современные автомобили развивались благодаря этому закону.
Это правило распространяется на все циклы тепловых двигателей, включая циклы Отто, Дизеля и т. д., а также все рабочие жидкости, используемые в двигателях. Современные автомобили развивались благодаря этому закону. Например, вода в стакане, нагретая до температуры окружающей среды, никогда самопроизвольно не охлаждается, образуя кубики льда, которые выделяют энергию в окружающую среду.
Например, вода в стакане, нагретая до температуры окружающей среды, никогда самопроизвольно не охлаждается, образуя кубики льда, которые выделяют энергию в окружающую среду. Однако Второй закон термодинамики утверждает, что при спонтанном процессе энтропия Вселенной увеличивается.
Однако Второй закон термодинамики утверждает, что при спонтанном процессе энтропия Вселенной увеличивается.