Степени окисления атомов химических элементов (таблица)
Степень окисления — это условная величина, которая указывает на состояние окисления отдельного атома молекулы химического элемента и представляет метод учёта переноса электронов, не является истинным зарядом атома в молекуле.
— Степень окисления атомов хим. элементов простых веществ равна 0.
— Степень окисления водорода H в соединениях +1, за исключением гидридов (NaH-1)
— Степень окисления кислорода O в соединениях равна -2, за исключением пероксидов и соединений с фтором F
— Сумма всех степеней окисления атомов в соединении равна 0.
— Сумма всех степеней окисления атомов в ионе равна = заряду иона.
Таблица степени окисления атомов химических элементов
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
|
1 |
Водород / Hydrogen |
H |
+1, 0, –1 |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
+1 |
|
4 |
Бериллий / Beryllium |
Be |
+2 |
|
|
Бор / Boron |
B |
+3 |
|
6 |
Углерод / Carbon |
C |
-4, (+2), +4 |
|
7 |
Азот / Nitrogen |
N |
-3, -2, -1, 0, (+1), +2, +3, +4, +5 |
|
8 |
Кислород / Oxygen |
O |
-2 |
|
9 |
Фтор / Fluorine |
F |
-1, 0 |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
+1 |
|
12 |
Магний / Magnesium |
Mg |
+2 |
|
13 |
Алюминий / Aluminum |
Al |
+3 |
|
14 |
Кремний / Silicon |
Si |
-4, 0, (+2), +4 |
|
15 |
Фосфор / Phosphorus |
P |
-3, -1, 0, 1, 3, 5 |
|
16 |
Сера / Sulfur |
S |
-2, -1, 0, +1, +4, +6 |
|
17 |
Хлор / Chlorine |
Cl |
-1, +1, (+2), +3, (+4), +5, +7 |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
+1 |
|
20 |
Кальций / Calcium |
Ca |
+2 |
|
21 |
Скандий / Scandium |
|
+3 |
|
22 |
Титан / Titanium |
Ti |
+2, +3, +4 |
|
23 |
Ванадий / Vanadium |
V |
+2, +3, +4, +5 |
|
24 |
Хром / Chromium |
Cr |
0, +2, +3, +6 |
|
25 |
Марганец / Manganese |
Mn |
|
|
26 |
Железо / Iron |
Fe |
+2, +3, (+4), (+6), (+8) |
|
27 |
Кобальт / Cobalt |
Co |
(+1), +2, (+3), (+4) |
|
28 |
Никель / Nickel |
Ni |
(+1), +2, (+3), (+4) |
|
29 |
Медь / Copper |
Сu |
|
|
30 |
Цинк / Zinc |
Zn |
+2 |
|
31 |
Галлий / Gallium |
Ga |
(+1), +3 |
|
32 |
Германий / Germanium |
Ge |
+2 |
|
33 |
Мышьяк / Arsenic |
As |
-3, +3, +5 |
|
34 |
Селен / Selenium |
Se |
-2, +4, +6 |
|
35 |
Бром / Bromine |
Br |
-1, 0, +1, +3, +5, +7 |
|
36 |
Криптон / Krypton |
Kr |
+2, +4, +6 |
|
37 |
Рубидий / Rubidium |
Rb |
+1 |
|
38 |
Стронций / Strontium |
Sr |
+2 |
|
39 |
Иттрий / Yttrium |
Y |
+3 |
|
40 |
Цирконий / Zirconium |
Zr |
0, +1, +2, +3, +4 |
|
41 |
Ниобий / Niobium |
Nb |
+1, +2, +3, +4, +5 |
|
42 |
Молибден / Molybdenum |
Mo |
(+2), (+3), (+4), (+5), +6 |
|
43 |
Технеций / Technetium |
Tc |
-1, 0, +1, +2, +3, +4, +5, +6, +7 |
|
44 |
Рутений / Ruthenium |
Ru |
+2, +3, +4, +5, +6, +7, +8 |
|
45 |
Родий / Rhodium |
Rh |
+1, +2, +3, +4, +6 |
|
46 |
Палладий / Palladium |
Pd |
0, +1, +2, +3, +4, +5 |
|
47 |
Серебро / Silver |
Ag |
0, +1, +2, +3, +4, +5, +6 |
|
48 |
Кадмий / Cadmium |
Cd |
+2 |
|
49 |
Индий / Indium |
In |
+1, +3 |
|
50 |
Олово / Tin |
Sn |
-4, +2, +4 |
|
51 |
Сурьма / Antimony |
Sb |
-3, +3, +5 |
|
52 |
Теллур / Tellurium |
Te |
-2, (+2), +4, +6 |
|
53 |
Иод / Iodine |
I |
-1, 0, +1, (+3), +5, +7 |
|
54 |
Ксенон / Xenon |
Xe |
0, +1, +2, +4, +6, +8 |
|
55 |
Цезий / Cesium |
Cs |
+1 |
|
56 |
Барий / Barium |
Ba |
+2 |
|
57 |
Лантан / Lanthanum |
La |
+3 |
|
58 |
Церий / Cerium |
Ce |
+3, +4 |
|
59 |
Празеодим / Praseodymium |
Pr |
+3, +4 |
|
60 |
Неодим / Neodymium |
Nd |
+3 |
|
61 |
Прометий / Promethium |
Pm |
+3 |
|
62 |
Самарий / Samarium |
Sm |
+2, +3 |
|
63 |
Европий / Europium |
Eu |
+2, +3 |
|
64 |
Гадолиний / Gadolinium |
Gd |
+3 |
|
65 |
Тербий / Terbium |
Tb |
+3, +4 |
|
66 |
Диспрозий / Dysprosium |
Dy |
+3 |
|
67 |
Гольмий / Holmium |
Ho |
+3 |
|
68 |
Эрбий / Erbium |
Er |
+3 |
|
69 |
Тулий / Thulium |
Tm |
+2, +3 |
|
70 |
Иттербий / Ytterbium |
Yb |
+2, +3 |
|
71 |
Лютеций / Lutetium |
Lu |
+3 |
|
72 |
Гафний / Hafnium |
Hf |
+2, +3, +4 |
|
73 |
Тантал / Tantalum |
Ta |
(+3), (+4), +5 |
|
74 |
Вольфрам / Tungsten |
W |
0, (+2), (+3), (+4), (+5), +6 |
|
75 |
Рений / Rhenium |
Re |
(-1), +2, (+3), +4, (+5), +6, +7 |
|
76 |
Осмий / Osmium |
Os |
-2, 0, +2, +3, +4, +6, +8 |
|
77 |
Иридий / Iridium |
Ir |
(+1), (+2), +3, +4, +5, +6 |
|
78 |
Платина / Platinum |
Pt |
0, +2, +4 |
|
79 |
Золото / Gold |
Au |
-1, 0, +1, (+2), +3, +5 |
|
80 |
Ртуть / Mercury |
Hg |
+1, +2 |
|
81 |
Талий / Thallium |
Tl |
+1, +3 |
|
82 |
Свинец / Lead |
Pb |
-4, 0, +2, +4 |
|
83 |
Висмут / Bismuth |
Bi |
-3, +3, +5 |
|
84 |
Полоний / Polonium |
Po |
+2, +4, +6 |
|
85 |
Астат / Astatine |
At |
-1, 0, +1, +5, +7 |
|
86 |
Радон / Radon |
Rn |
0 |
|
87 |
Франций / Francium |
Fr |
+1 |
|
88 |
Радий / Radium |
Ra |
+2 |
|
89 |
Актиний / Actinium |
Ac |
+3 |
|
90 |
Торий / Thorium |
Th |
+2, +3, +4 |
|
91 |
Проактиний / Protactinium |
Pa |
+4, +5 |
|
92 |
Уран / Uranium |
U |
+3, +4, +5, +6 |
|
93 |
Нептуний / Neptunium |
Np |
+3, +4, +5, +6, +7 |
|
94 |
Плутоний / Plutonium |
Pu |
+2, +3, +4, +5, +6, +7 |
|
95 |
Америций / Americium |
Am |
+3, +4, +5, +6 |
|
96 |
Кюрий / Curium |
Cm |
+3, +4 |
|
97 |
Берклий / Berkelium |
Bk |
+3, +4 |
|
98 |
Калифорний / Californium |
Cf |
+2, +3, +4 |
|
99 |
Эйнштейний |
Es |
+2, +3, +4 |
|
100 |
Фермий / Fermium |
Fm |
+3 |
|
101 |
Менделевий / Mendelevium |
Md |
+1, +2, +3 |
|
102 |
Нобелий / Nobelium |
No |
+2, +3 |
|
103 |
Лоуренсий / Lawrencium |
Lr |
+3 |
|
104 |
Резерфордий / Rutherfordium |
Rf |
+4 |
|
105 |
Дубний |
Db |
+3, +4, +5 |
|
Порядковый (атомный) номер |
Химический элемент |
Символ |
Степени окисления атомов элементов |
Таблица степени окисления химических элементов
Понятие степень окисления химических элементов
Она принимает как положительные, так и отрицательные значения. Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Чтобы указать степень окисления элемента в соединении нужно поставить сверху над его символом арабскую цифру с соответствующим знаком («+» или «-»).
Следует помнить, что степень окисления — величина, не имеющая физического смысла, так как не отражает реальный заряд атома. Однако это понятие весьма широко используется в химии.
Таблица степени окисления химических элементов
Максимальную положительную и минимальную отрицательную степень окисления можно определить с помощью Периодической таблицы Д.И. Менделеева. Они равны номеру группы, в которой расположен элемент, и разнице между значением «высшей» степени окисления и числом 8, соответственно.
Если рассматривать химические соединения более конкретно, то в веществах с неполярными связями степень окисления элементов равна нулю (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na+1I-1, Mg+2Cl-12, Al+3F-13, Zr+4Br-14.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Существуют элементы, для которых характерно только одно значение степени окисления (фтор, металлы IA и IIA групп и т.д.). Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Однако, имеются и такие химические элементы, для которых характерны несколько значений степени окисления (сера – (-2), 0, (+2), (+4), (+6) и др.).
Для того, чтобы легче было запомнить сколько и какие степени окисления характерны для конкретного химического элемента используют таблицы степеней окисления химических элементов, которые выглядят следующим образом:
|
Порядковый номер |
Русское / англ. |
Химический символ |
Степень окисления |
|
1 |
Водород / Hydrogen |
H |
(+1), (-1) |
|
2 |
Гелий / Helium |
He |
0 |
|
3 |
Литий / Lithium |
Li |
(+1) |
|
4 |
Бериллий / Beryllium |
Be |
(+2) |
|
5 |
Бор / Boron |
B |
(-1), 0, (+1), (+2), (+3) |
|
6 |
Углерод / Carbon |
C |
(-4), (-3), (-2), (-1), 0, (+2), (+4) |
|
7 |
Азот / Nitrogen |
N |
(-3), (-2), (-1), 0, (+1), (+2), (+3), (+4), (+5) |
|
8 |
Кислород / Oxygen |
O |
(-2), (-1), 0, (+1), (+2) |
|
9 |
Фтор / Fluorine |
F |
(-1) |
|
10 |
Неон / Neon |
Ne |
0 |
|
11 |
Натрий / Sodium |
Na |
(+1) |
|
12 |
Магний / Magnesium |
Mg |
(+2) |
|
13 |
Алюминий / Aluminum |
Al |
(+3) |
|
14 |
Кремний / Silicon |
Si |
(-4), 0, (+2), (+4) |
|
15 |
Фосфор / Phosphorus |
P |
(-3), 0, (+3), (+5) |
|
16 |
Сера / Sulfur |
S |
(-2), 0, (+4), (+6) |
|
17 |
Хлор / Chlorine |
Cl |
(-1), 0, (+1), (+3), (+5), (+7), редко (+2) и (+4) |
|
18 |
Аргон / Argon |
Ar |
0 |
|
19 |
Калий / Potassium |
K |
(+1) |
|
20 |
Кальций / Calcium |
Ca |
(+2) |
|
21 |
Скандий / Scandium |
Sc |
(+3) |
|
22 |
Титан / Titanium |
Ti |
(+2), (+3), (+4) |
|
23 |
Ванадий / Vanadium |
V |
(+2), (+3), (+4), (+5) |
|
24 |
Хром / Chromium |
Cr |
(+2), (+3), (+6) |
|
25 |
Марганец / Manganese |
Mn |
(+2), (+3), (+4), (+6), (+7) |
|
26 |
Железо / Iron |
Fe |
(+2), (+3), редко (+4) и (+6) |
|
27 |
Кобальт / Cobalt |
Co |
(+2), (+3), редко (+4) |
|
28 |
Никель / Nickel |
Ni |
(+2), редко (+1), (+3) и (+4) |
|
29 |
Медь / Copper |
Cu |
+1, +2, редко (+3) |
|
30 |
Цинк / Zinc |
Zn |
(+2) |
|
31 |
Галлий / Gallium |
Ga |
(+3), редко (+2) |
|
32 |
Германий / Germanium |
Ge |
(-4), (+2), (+4) |
|
33 |
Мышьяк / Arsenic |
As |
(-3), (+3), (+5), редко (+2) |
|
34 |
Селен / Selenium |
Se |
(-2), (+4), (+6), редко (+2) |
|
35 |
Бром / Bromine |
Br |
(-1), (+1), (+5), редко (+3), (+4) |
|
36 |
Криптон / Krypton |
Kr |
0 |
|
37 |
Рубидий / Rubidium |
Rb |
(+1) |
|
38 |
Стронций / Strontium |
Sr |
(+2) |
|
39 |
Иттрий / Yttrium |
Y |
(+3) |
|
40 |
Цирконий / Zirconium |
Zr |
(+4), редко (+2) и (+3) |
|
41 |
Ниобий / Niobium |
Nb |
(+3), (+5), редко (+2) и (+4) |
|
42 |
Молибден / Molybdenum |
Mo |
(+3), (+6), редко (+2), (+3) и (+5) |
|
43 |
Технеций / Technetium |
Tc |
(+6) |
|
44 |
Рутений / Ruthenium |
Ru |
(+3), (+4), (+8), редко (+2), (+6) и (+7) |
|
45 |
Родий / Rhodium |
Rh |
(+4), редко (+2), (+3) и (+6) |
|
46 |
Палладий / Palladium |
Pd |
(+2), (+4), редко (+6) |
|
47 |
Серебро / Silver |
Ag |
(+1), редко (+2) и (+3) |
|
48 |
Кадмий / Cadmium |
Cd |
(+2), редко (+1) |
|
49 |
Индий / Indium |
In |
(+3), редко (+1) и (+2) |
|
50 |
Олово / Tin |
Sn |
(+2), (+4) |
|
51 |
Сурьма / Antimony |
Sb |
(-3), (+3), (+5), редко (+4) |
|
52 |
Теллур / Tellurium |
Te |
(-2), (+4), (+6), редко (+2) |
|
53 |
Иод / Iodine |
I |
(-1), (+1), (+5), (+7), редко (+3), (+4) |
|
54 |
Ксенон / Xenon |
Xe |
0 |
|
55 |
Цезий / Cesium |
Cs |
(+1) |
|
56 |
Барий / Barium |
BA |
(+2) |
|
57 |
Лантан / Lanthanum |
La |
(+3) |
|
58 |
Церий / Cerium |
Ce |
(+3), (+4) |
|
59 |
Празеодим / Praseodymium |
Pr |
(+3) |
|
60 |
Неодим / Neodymium |
Nd |
(+3), (+4) |
|
61 |
Прометий / Promethium |
Pm |
(+3) |
|
62 |
Самарий / Samarium |
Sm |
(+3), редко (+2) |
|
63 |
Европий / Europium |
Eu |
(+3), редко (+2) |
|
64 |
Гадолиний / Gadolinium |
Gd |
(+3) |
|
65 |
Тербий / Terbium |
Tb |
(+3), (+4) |
|
66 |
Диспрозий / Dysprosium |
Dy |
(+3) |
|
67 |
Гольмий / Holmium |
Ho |
(+3) |
|
68 |
Эрбий / Erbium |
Er |
(+3) |
|
69 |
Тулий / Thulium |
Tm |
(+3), редко (+2) |
|
70 |
Иттербий / Ytterbium |
Ib |
(+3), редко (+2) |
|
71 |
Лютеций / Lutetium |
Lu |
(+3) |
|
72 |
Гафний / Hafnium |
Hf |
(+4) |
|
73 |
Тантал / Tantalum |
Ta |
(+5), редко (+3), (+4) |
|
74 |
Вольфрам / Tungsten |
W |
(+6), редко (+2), (+3), (+4) и (+5) |
|
75 |
Рений / Rhenium |
Re |
(+2), (+4), (+6), (+7), редко (-1), (+1), (+3), (+5) |
|
76 |
Осмий / Osmium |
Os |
(+3), (+4), (+6), (+8), редко (+2) |
|
77 |
Иридий / Iridium |
Ir |
(+3), (+4), (+6), редко (+1) и (+2) |
|
78 |
Платина / Platinum |
Pt |
(+2), (+4), (+6), редко (+1) и (+3) |
|
79 |
Золото / Gold |
Au |
(+1), (+3), редко (+2) |
|
80 |
Ртуть / Mercury |
Hg |
(+1), (+2) |
|
81 |
Талий / Thallium |
Tl |
(+1), (+3), редко (+2) |
|
82 |
Свинец / Lead |
Pb |
(+2), (+4) |
|
83 |
Висмут / Bismuth |
Bi |
(+3), редко (+3), (+2), (+4) и (+5) |
|
84 |
Полоний / Polonium |
Po |
(+2), (+4), редко (-2) и (+6) |
|
85 |
Астат / Astatine |
At |
— |
|
86 |
Радон / Radon |
Ra |
0 |
|
87 |
Франций / Francium |
Fr |
— |
|
88 |
Радий / Radium |
Ra |
(+2) |
|
89 |
Актиний / Actinium |
Ac |
(+3) |
|
90 |
Торий / Thorium |
Th |
(+4) |
|
91 |
Проактиний / Protactinium |
Pa |
(+5) |
|
92 |
Уран / Uranium |
U |
(+3), (+4), (+6), редко (+2) и (+5) |
Примеры решения задач
Периодическая таблица с зарядами – Science Trends
Элементы периодической таблицы имеют разные ионные заряды. Периодическая таблица с зарядами является важным инструментом для студентов, изучающих естественные науки.
Периодическая таблица с зарядами является важным инструментом для студентов, изучающих естественные науки.
Лучший способ узнать, каков ионный заряд для конкретного элемента, — проверить Периодическую таблицу.
«Чудо — самый тяжелый элемент в таблице периоидов. Даже малюсенькая его частичка останавливает время». — Диана Акерман
Существует также очень простой способ узнать, имеет ли элемент положительный или отрицательный ионный заряд. Все металлические элементы, расположенные в левой части периодической таблицы, имеют положительный ионный заряд, а все металлические элементы, расположенные в правой части периодической таблицы, имеют отрицательный ионный заряд.
Что такое ион?
Ион — это название субатомных частиц, которые являются компонентами всех атомов. Такими частицами могут быть нейтроны, представляющие собой нейтральные субатомные частицы, находящиеся в самом центре (ядре) атома вместе с протонами с положительным зарядом. Изотоп атома определяется количеством нейтронов и протонов в нем.
Изотоп атома определяется количеством нейтронов и протонов в нем.
Электроны — субатомные частицы, характеризующиеся отрицательным зарядом. Еще одна вещь, которая делает электроны знаменитыми, — это их свободное движение вокруг ядра в круговых направлениях, образующих трехмерную орбиту. Именно эта способность электронов двигаться по орбиталям, прыгая между разными атомами, способствует образованию ионов.
В процессе образования ионов атомы отдают электроны для образования других атомов. Затем это приводит к образованию катионов (положительно заряженных ионов), а также атомы затем подбирают электроны друг от друга, что приводит к образованию анионов (отрицательно заряженных ионов).
Что такое катионы? Катионы – это положительно заряженные атомы, образованные атомами металлов. Например, золото, серебро, медь или натрий. Любые электроны, потерянные атомами, которые будут подхвачены нейтральными атомами, превратят эти нейтральные атомы в положительные атомы.
Поскольку электроны легко перемещаются между атомами, металлы являются отличными проводниками электричества. Электроны несут с собой электрическую энергию, когда они перемещаются между атомами.
Если изучение периодической таблицы ничему другому меня не научило, так это тому, что доверчивость людей к панацеям периодической таблицы практически безгранична. – Сэм Кин
Если вы посмотрите на периодическую таблицу, вы найдете металлы в группах (от одного до 16). Первая группа состоит из металлов с зарядом +1, в то время как все металлы групп 2,3,4,5,6,7,8,9,10,11,12 и 16 имеют заряд +2. Тогда металлы в тринадцатой и пятнадцатой группах имеют заряд +3. Наконец, все металлы группы 14 имеют заряд +4.
Что такое анионы?Анионы образуются из всех неметаллических элементов. Например, сера, кислород и углерод. Все эти элементы сгруппированы в периодической таблице в следующие группы: 13, 14, 15, 16 и 17.
Каждый из анионов получает свои электроны от других атомов, поскольку происходит процесс ионной связи. Весь этот процесс приводит к увеличению числа электронов с отрицательным зарядом. Основное различие между этими отрицательно заряженными электронами и катионами заключается в том, что анионы не проводят электричество.
Весь этот процесс приводит к увеличению числа электронов с отрицательным зарядом. Основное различие между этими отрицательно заряженными электронами и катионами заключается в том, что анионы не проводят электричество.
Элементы групп 13 и 15 образуют катион с зарядом -3 каждый. А элементы в группе 14 имеют заряд -4. Элементы 16-й группы имеют заряд -2, а все элементы 17-й группы – галогены с зарядом -1 каждый.
Щелочные металлы: Группа 1Вот полный список металлов первой группы (+1 заряд):
- Литий (Li).
- Натрий (Na).
- Калий (К).
- Рубидий (Rb).
- Цезий (Cs).
- Франций (фр.).
Вот полный список металлов второй группы (+2 заряда):
- Бериллий (Be).
- Магний (Mg).
- Кальций (Ca).
- Стронций (Sr).
- Барий (Ba).
- Радий (Ra).
Элементы группы 3Повсюду во Вселенной периодическая таблица имеет одинаковую базовую структуру.
Даже если бы таблица инопланетной цивилизации не была построена в форме замка с башнями, которую мы, люди, любим, их спиральная, пирамидальная или любая другая периодическая таблица естественно остановилась бы после 118 элементов. – Сэм Кин
Вот полный список металлов третьей группы (+1 заряд):
- Скандий (Sc).
- Иттрий (Y).
- Лантан (La) или Лютеций (Lu).
- Актиний (Ac) или лавренций (Lr).
Вот полный список металлов четвертой группы (+1 заряд):
- Титан (Ti).
- Цирконий (Zr).
- Гафний (Hf).
- Резерфордий (Rf).
Вот полный список металлов пятой группы (+1 заряд):
- Ванадий (V).
- Ниобий (Nb).
- Тантал (Та).
- Дубний (Db).
Вот полный список металлов шестой группы (+1 заряд):
- Хром (Cr).

- Молибден (Mo).
- Вольфрам (W).
- Сиборгиум (Sg).
Вот полный список металлов седьмой группы (+1 заряд):
- Марганец (Mn).
- Технеций (Tc).
- Рений (Re).
- Борий (Bh).
Вот полный список металлов восьмой группы (+1 заряд):
- Железо (Fe).
- Рутений (Ru).
- Осмий (Os).
- Хассиум (Hs).
Вот полный список металлов девятой группы (+1 заряд):
- Кобальт (Co).
- Родий (Rh).
- Иридий (Ir).
Вот полный список металлов десятой группы (+1 заряд):
- Никель (Ni).
- Палладий (Pd).
- Платина (Pt).
Вот полный список металлов одиннадцатой группы (+1 заряд):
- Медь (Cu).

- Серебро (Ag).
- Золото (золото).
- Рентгений (Rg).
Вот полный список металлов двенадцатой группы (+1 заряд):
- Цинк (Zn).
- Кадмий (Cd).
- Ртуть (Hg).
- Копернициум (Cn).
Вот полный список металлов шестнадцатой группы (+2 заряда):
- Кислород (О).
- Сера (S).
- Селен (Se).
- Теллур (Te).
- Полоний (Po).
Вот полный список металлов тринадцатой группы (+3 заряда):
- Бор (B).
- Алюминий (А).
- Галлий (Ga).
- Индий (In).
- Таллий (Ti).
- Нигоний (Nh).
Вот полный список металлов пятнадцатой группы (+3 заряда):
- Азот (N).
- Фосфор (P).
- Мышьяк (As).
- Сурьма (Sb).

- Висмут (Би).
- Московиум (Мк).
Вот полный список металлов четырнадцатой группы (+4 заряда):
- Углерод (C).
- Кремний (Si).
- Германий (Ge).
- Олово (Sn).
- Свинец (Pb).
- Флеровиум (Fl).
Все остальные элементы имеют отрицательный заряд, как указано выше. Если вы хотите проверить их, посмотрите Периодическую таблицу: группы 13, 14, 15, 16 и 17.
Таблица Менделеева: Затраты на элементы основной группы Видеоруководство и практика
Итак, давайте сначала поговорим об элементах нашей основной группы. Помните, что ваши основные групповые элементы – это элементы, находящиеся в первой группе А или первой группе, двусторонние или групповые, а затем из трех, две восьмерки А или то, что мы называем группами с 13 по 18. Элементы здесь, в большом почтовом ящике. Это наши переходные металлы. Мы поговорим о них позже, в четверке. Сейчас. Давайте просто сосредоточимся на нашей основной группе. Элементы теперь помнят, что атомный номер, который использует переменные e атома, равен количеству протонов в его ядре. Например, мы бы сказали, что бериллий имеет атомный номер четыре, поэтому у него четыре протона. У нейтрального элемента количество электронов равно количеству протонов. Итак, бериллий год имеет атомный номер четыре, что означает, что у него четыре протона. И здесь, если мы имеем дело с нейтральным элементом, у него будет такое же количество электронов. Так что у него также будет четыре электрона. Теперь мы сказали, что все эти элементы таблицы Менделеева пытаются стать такими же, как наши благородные газы, элементами восьмой а-группы. У них оптимальное количество электронов у гелия по сравнению с 10 у Неона. У Ардена 18, и по мере того, как мы спускаемся вниз, это все их атомные номера, что дает нам количество электронов, которое у них есть сейчас. Элементы пытаются получить или потерять электроны, чтобы соответствовать количеству электронов благородных газов.
Сейчас. Давайте просто сосредоточимся на нашей основной группе. Элементы теперь помнят, что атомный номер, который использует переменные e атома, равен количеству протонов в его ядре. Например, мы бы сказали, что бериллий имеет атомный номер четыре, поэтому у него четыре протона. У нейтрального элемента количество электронов равно количеству протонов. Итак, бериллий год имеет атомный номер четыре, что означает, что у него четыре протона. И здесь, если мы имеем дело с нейтральным элементом, у него будет такое же количество электронов. Так что у него также будет четыре электрона. Теперь мы сказали, что все эти элементы таблицы Менделеева пытаются стать такими же, как наши благородные газы, элементами восьмой а-группы. У них оптимальное количество электронов у гелия по сравнению с 10 у Неона. У Ардена 18, и по мере того, как мы спускаемся вниз, это все их атомные номера, что дает нам количество электронов, которое у них есть сейчас. Элементы пытаются получить или потерять электроны, чтобы соответствовать количеству электронов благородных газов. Итак, благородные газы, поскольку они совершенны, их заряды. Ноль, поэтому у них нет заряда. Им не нужно приобретать или терять электроны. Давайте посмотрим на группы 78 все элементы групп. Семь. Флорин. Давайте посмотрим, что F Flooring имеет девять электронов, когда он нейтрален. Если он хочет иметь 10 электронов, как у неона, он должен получить один. Электронный хлор имеет 17 электронов с нейтралью, чтобы иметь 18, как будто они снова ушли и должны получить один электрон. Таким образом, каждый элемент в этом столбце должен был бы получить один электрон, чтобы стать похожим на благородный газ рядом с ним. Получив этот один электрон, они получили бы заряд минус один. Потому что, помните, получение электронов дает нам отрицательный заряд. Кислород, кислород, когда он нейтрален, имеет восемь электронов, чтобы иметь 10 электронов, как неон. Сколько электронов нужно было бы получить, если бы вы сказали, что вы правы. То же самое с программным обеспечением имеет 16 и должно получить два электрона, чтобы стать такими же, как ушли.
Итак, благородные газы, поскольку они совершенны, их заряды. Ноль, поэтому у них нет заряда. Им не нужно приобретать или терять электроны. Давайте посмотрим на группы 78 все элементы групп. Семь. Флорин. Давайте посмотрим, что F Flooring имеет девять электронов, когда он нейтрален. Если он хочет иметь 10 электронов, как у неона, он должен получить один. Электронный хлор имеет 17 электронов с нейтралью, чтобы иметь 18, как будто они снова ушли и должны получить один электрон. Таким образом, каждый элемент в этом столбце должен был бы получить один электрон, чтобы стать похожим на благородный газ рядом с ним. Получив этот один электрон, они получили бы заряд минус один. Потому что, помните, получение электронов дает нам отрицательный заряд. Кислород, кислород, когда он нейтрален, имеет восемь электронов, чтобы иметь 10 электронов, как неон. Сколько электронов нужно было бы получить, если бы вы сказали, что вы правы. То же самое с программным обеспечением имеет 16 и должно получить два электрона, чтобы стать такими же, как ушли. Итак, эта шестая группа говорит, что ее заряды обычно тоже отрицательные. У азота семь. Таким образом, чтобы получить 10,5 игрового три электрона. Итак, этот заряд, заряд этой группы обычно минус три. Теперь, конечно, некоторые из этих групп, которые становятся сложными, потому что в пятой группе мы видим, что у нас здесь есть неметаллы, поэтому они имеют отрицательный заряд три. Но затем у нас есть металлические Ллойды, а затем мы сталкиваемся с медалями, медали не хотят иметь отрицательный заряд, они должны иметь положительный заряд. Таким образом, эти отрицательные заряды, если говорить о них, в основном связаны с неметаллами синего цвета. Элементы находятся в группе синих прямоугольников, потому что они сложнее, поэтому четвертая группа – это равное расстояние. В любом случае, я имею в виду, что углерод может попытаться получить электроны, чтобы стать похожими на неон. Или вы можете попытаться потерять четыре электрона, чтобы он полюбил гелий, так что это своего рода особая ситуация, поэтому в результате мы просто говорим, что не применимы к четвертой группе, исходя из их местоположения.
Итак, эта шестая группа говорит, что ее заряды обычно тоже отрицательные. У азота семь. Таким образом, чтобы получить 10,5 игрового три электрона. Итак, этот заряд, заряд этой группы обычно минус три. Теперь, конечно, некоторые из этих групп, которые становятся сложными, потому что в пятой группе мы видим, что у нас здесь есть неметаллы, поэтому они имеют отрицательный заряд три. Но затем у нас есть металлические Ллойды, а затем мы сталкиваемся с медалями, медали не хотят иметь отрицательный заряд, они должны иметь положительный заряд. Таким образом, эти отрицательные заряды, если говорить о них, в основном связаны с неметаллами синего цвета. Элементы находятся в группе синих прямоугольников, потому что они сложнее, поэтому четвертая группа – это равное расстояние. В любом случае, я имею в виду, что углерод может попытаться получить электроны, чтобы стать похожими на неон. Или вы можете попытаться потерять четыре электрона, чтобы он полюбил гелий, так что это своего рода особая ситуация, поэтому в результате мы просто говорим, что не применимы к четвертой группе, исходя из их местоположения.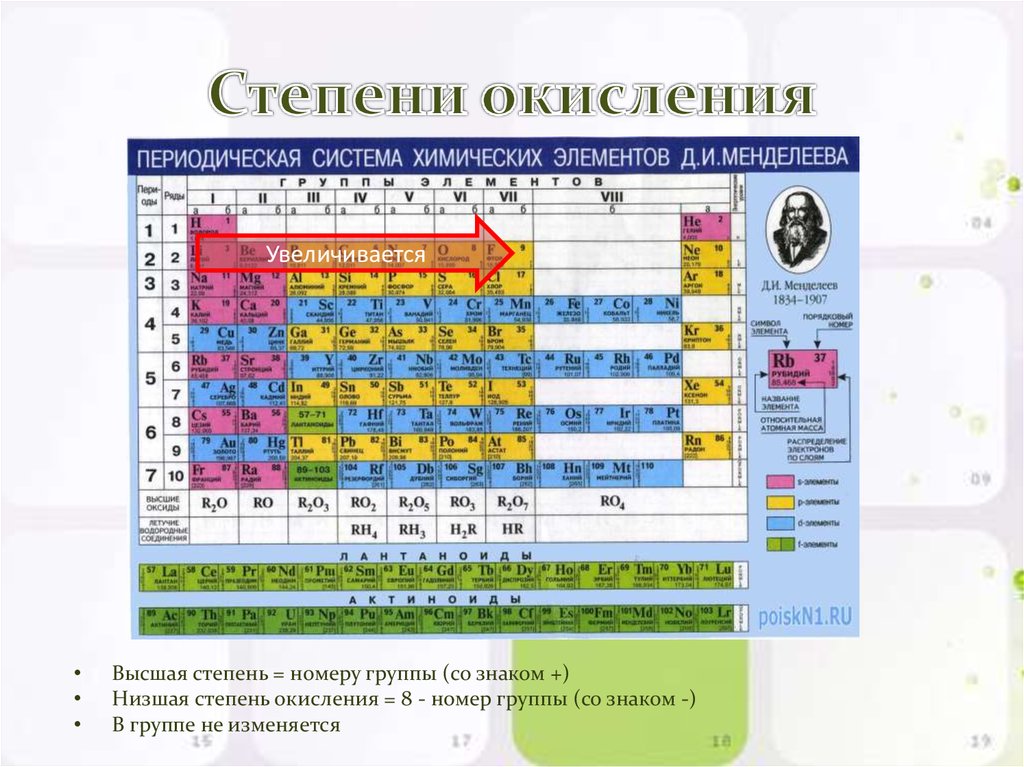 Периодическая таблица. Теперь, однако, у нас есть исключение, которое относится к исключению один, и оно относится к свинцу и олову. Свинец и олово обозначаются здесь S N и P B из-за того, где они расположены, как далеко они залегают. По своим характеристикам они схожи с переходными металлами. Они могут быть либо плюс два, либо плюс четыре за свои сборы. Так что просто помните, когда дело доходит до олова и свинца, это может быть плюс два или плюс из-за их, ммм, интересной ситуации, когда дело доходит до периодической таблицы в зарядах. Теперь давайте посмотрим на бор и другие элементы, входящие в эту группу. Бор представляет собой металл Ллойда, металл Ллойда. Они обладают характеристиками как металлов, так и неметаллов, так что с ними немного сложнее, так что про дебилов говорить не будем. Но мы можем говорить об элементах ниже бора алюминия вплоть до NH. Все они металлы, поэтому все они хотят потерять электроны, чтобы стать похожими на благородный газ. Теперь алюминий, его атомные номера 13.
Периодическая таблица. Теперь, однако, у нас есть исключение, которое относится к исключению один, и оно относится к свинцу и олову. Свинец и олово обозначаются здесь S N и P B из-за того, где они расположены, как далеко они залегают. По своим характеристикам они схожи с переходными металлами. Они могут быть либо плюс два, либо плюс четыре за свои сборы. Так что просто помните, когда дело доходит до олова и свинца, это может быть плюс два или плюс из-за их, ммм, интересной ситуации, когда дело доходит до периодической таблицы в зарядах. Теперь давайте посмотрим на бор и другие элементы, входящие в эту группу. Бор представляет собой металл Ллойда, металл Ллойда. Они обладают характеристиками как металлов, так и неметаллов, так что с ними немного сложнее, так что про дебилов говорить не будем. Но мы можем говорить об элементах ниже бора алюминия вплоть до NH. Все они металлы, поэтому все они хотят потерять электроны, чтобы стать похожими на благородный газ. Теперь алюминий, его атомные номера 13. Итак, когда он нейтрален, у него 13 электронов. У него есть два варианта. Он мог либо попытаться получить семь электронов, чтобы получить его. Я имею в виду, не семь. Вы можете попытаться получить пять электронов, чтобы получить 18 электронов, как у Арги. Или я мог бы сделать что-то проще, чем это. Вместо того, чтобы пытаться получить пять электронов, он может просто попытаться потерять три электрона, чтобы у него были электроны, как у неона. А когда дело доходит до камер для недельной химии, мы всегда уходим в прошлое. Это проще и быстрее всего. Итак, алюминию легче потерять три электрона, чем один палец. Посмотрите, чтобы получить пять электронов. Хорошо, потому что вам нужно прыгнуть, чтобы стать благородным газом таким образом. Легче просто отпустить свои три электрона. Таким образом, из-за этого эта группа обычно имеет плюс три к своему заряду. Бериллий. Давайте посмотрим на бериллий. Бериллий имеет атомный номер четыре, поэтому у него есть два варианта. Он мог либо попытаться получить шесть электронов.
Итак, когда он нейтрален, у него 13 электронов. У него есть два варианта. Он мог либо попытаться получить семь электронов, чтобы получить его. Я имею в виду, не семь. Вы можете попытаться получить пять электронов, чтобы получить 18 электронов, как у Арги. Или я мог бы сделать что-то проще, чем это. Вместо того, чтобы пытаться получить пять электронов, он может просто попытаться потерять три электрона, чтобы у него были электроны, как у неона. А когда дело доходит до камер для недельной химии, мы всегда уходим в прошлое. Это проще и быстрее всего. Итак, алюминию легче потерять три электрона, чем один палец. Посмотрите, чтобы получить пять электронов. Хорошо, потому что вам нужно прыгнуть, чтобы стать благородным газом таким образом. Легче просто отпустить свои три электрона. Таким образом, из-за этого эта группа обычно имеет плюс три к своему заряду. Бериллий. Давайте посмотрим на бериллий. Бериллий имеет атомный номер четыре, поэтому у него есть два варианта. Он мог либо попытаться получить шесть электронов. 123456 Стать как неон или сделать что-нибудь попроще. Просто потеряйте два электрона, чтобы у него было два электрона, как у гелия. Таким образом, более легкий и короткий путь — это потерять электроны. Так что это эта группа, как правило, плюс два. Наконец, опять же, мы говорим о медалях. Это те, кто хочет потерять электроны, чтобы превратиться в положительное тепло. Водород не металл, поэтому мы не говорим о водороде в этом отношении. Но мы бы сказали, что литий может попытаться получить семь электронов, чтобы добраться до 10, как гелий, а это большое расстояние. Или проще было бы просто потерять один электрон и стать похожим на гелий. Таким образом, эта группа имеет тенденцию быть плюс один. Так что это заряд, который вам нужно держать в памяти, когда дело доходит до этих разных групп. Группа один А плюс один группа к плюс два, потом плюс три. Четвертая группа не применима. Группа пять дней минус три минус в минус один Благородные газы прекрасно улавливают воздух, поэтому не хотят набирать заряд.
123456 Стать как неон или сделать что-нибудь попроще. Просто потеряйте два электрона, чтобы у него было два электрона, как у гелия. Таким образом, более легкий и короткий путь — это потерять электроны. Так что это эта группа, как правило, плюс два. Наконец, опять же, мы говорим о медалях. Это те, кто хочет потерять электроны, чтобы превратиться в положительное тепло. Водород не металл, поэтому мы не говорим о водороде в этом отношении. Но мы бы сказали, что литий может попытаться получить семь электронов, чтобы добраться до 10, как гелий, а это большое расстояние. Или проще было бы просто потерять один электрон и стать похожим на гелий. Таким образом, эта группа имеет тенденцию быть плюс один. Так что это заряд, который вам нужно держать в памяти, когда дело доходит до этих разных групп. Группа один А плюс один группа к плюс два, потом плюс три. Четвертая группа не применима. Группа пять дней минус три минус в минус один Благородные газы прекрасно улавливают воздух, поэтому не хотят набирать заряд.

 название
название Даже если бы таблица инопланетной цивилизации не была построена в форме замка с башнями, которую мы, люди, любим, их спиральная, пирамидальная или любая другая периодическая таблица естественно остановилась бы после 118 элементов. – Сэм Кин
Даже если бы таблица инопланетной цивилизации не была построена в форме замка с башнями, которую мы, люди, любим, их спиральная, пирамидальная или любая другая периодическая таблица естественно остановилась бы после 118 элементов. – Сэм Кин

