Обозначение цинка в таблице менделеева
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d 10 4s 2 . В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d 10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.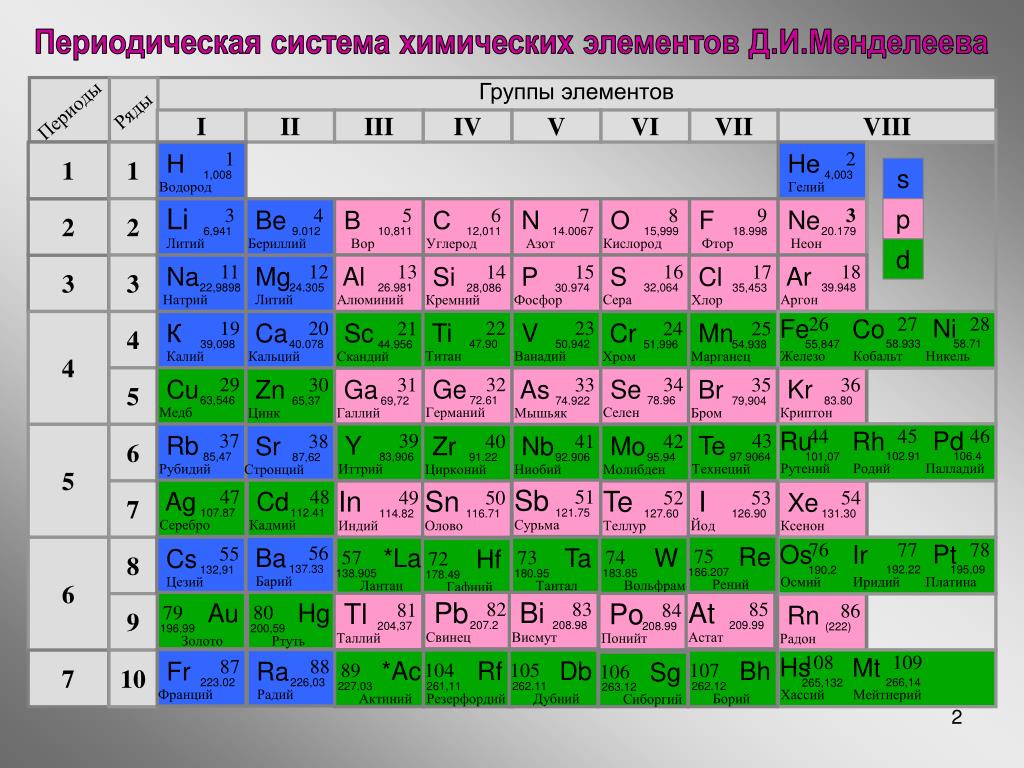
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см 3 , температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см 3 , при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Укажите, местоположение химического элемента цинк в таблице менделеева. Запишите электронную конфигурацию в основном состоянии. Укажите число валентных электронов. Охарактеризуйте метод хронопотенциометрического титрования.
Цинк в таблице менделеева расположен в четвертом периоде IIBгруппе. Это металл. Порядковый номер – 30. Заряд ядра +30, 30 электронов и 30 протонов. Массовое число – 65. Число нейтронов – 35. Электронная конфигурация имеет вид:
Относится к d-элементам. Все электроны спарены, на внешнем уровне – 2 электрона. Валентность цинка равнаII, степень окисления +2.
Хронопотенцнометрическое титрование — вариант потенциометрического титрования. Ход реакции изучают с помощью большого концентрационно поляризованного ртутного электрода в паре с подходящим электродом сравнения, опущенных в неперемешиваемый анализируемый раствор. Через электроды пропускают постоянный ток и наблюдают за временем, необходимым для перехода потенциала индикаторного электрода из первоначального значения в некоторое более высокое значение. Строят график зависимости квадратного корня времени перехода от объема прибавленною титранта. Конечную точку находят экстраполяцией участков кривой титрования в области изменения ее наклона. Метод применяют для анализа окрашенных или мутных водных и неводных растворов.
Метод применяют для анализа окрашенных или мутных водных и неводных растворов.
Цинк – цветной металл голубовато-серебристого цвета; на воздухе теряет блеск. Атомный номер цинка по таблице Менделеева – 30; обозначение – Zn (лат. Zincum).
В самородном виде цинк в природе не встречается. Существует 66 цинкосодержащих минералов, основные из которых – цинкит и сфалерит («цинковая обманка»).
Цинк в чистом виде представляет собой хрупкий пластичный металл, который хрустит при сгибании. Устойчив к коррозии, благодаря чему используется для оцинковки стальных поверхностей.
Цинк служит также материалом для отрицательного электрода в батарейках и аккумуляторах. Особенно важна функция цинка в цинк-воздушных аккумуляторах, которые гораздо более энергоемки.
В полиграфии для печати иллюстраций используются цинковые пластины (клише, на котором кислотой вытравливается рисунок).
С древних времен известно применение окиси цинка в составе антисептиков (цинковая мазь) и краски (цинковые белила).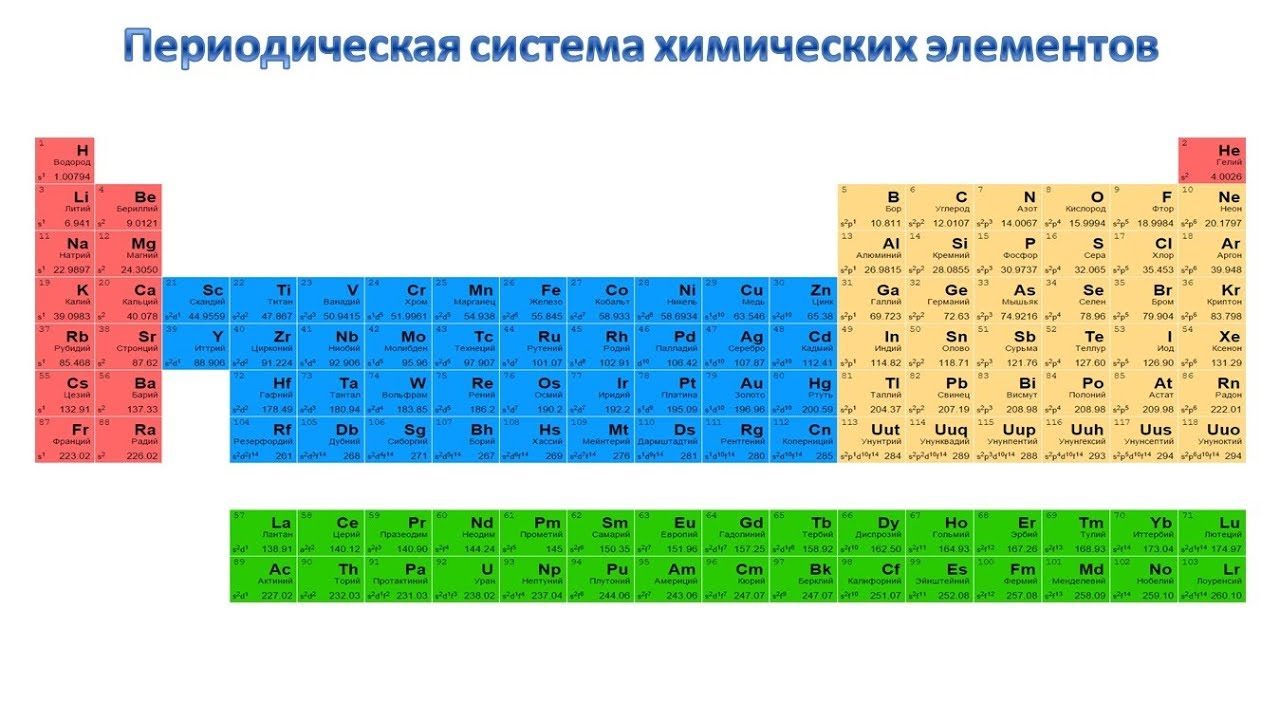 Тогда же люди начали использовать и сплав цинка с медью (латунь).
Тогда же люди начали использовать и сплав цинка с медью (латунь).
Существует и другой сплав – цинка с алюминием и магнием (ЦАМ, ZAMAK), который весьма устойчив к механическому воздействию и очень хорош в литейном деле, поэтому его активно используют в машиностроении для изготовления деталей «точного литья».
Из сплавов цинка также отливают разного рода фурнитуру, требующую точного литья и достаточной прочности. Это могут быть автомобильные ручки, корпусы карбюраторов и другие металлические изделия.
Цинк
| Цинк | |
|---|---|
| Атомный номер | 30 |
| Внешний вид простого вещества |
хрупкий металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
65,39 а.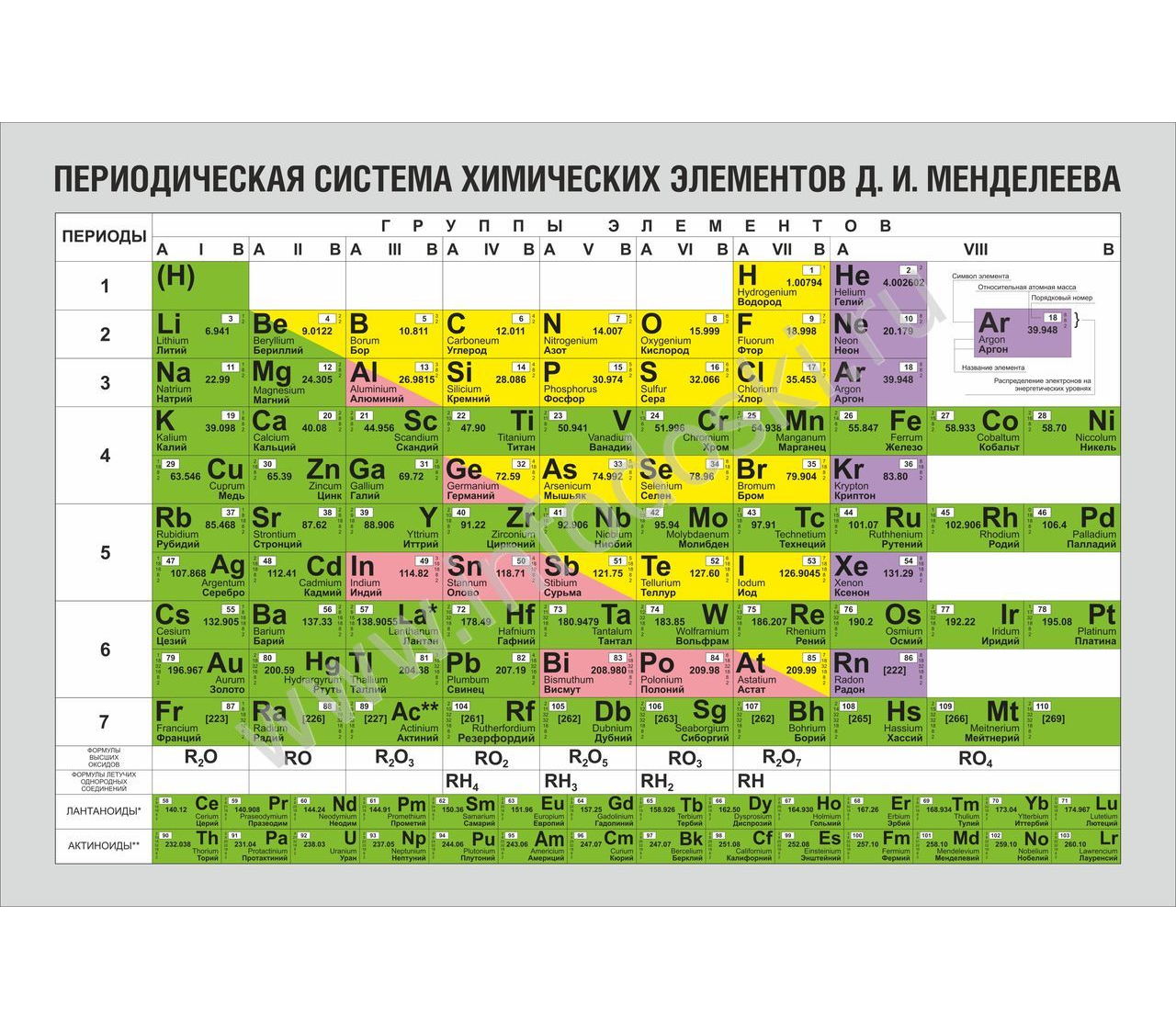 е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | 138 пм |
|
Энергия ионизации (первый электрон) |
905,8(9,39) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 |
| Химические свойства | |
| Ковалентный радиус | 125 пм |
| Радиус иона | (+2e) 74 пм |
|
Электроотрицательность (по Полингу) |
1,65 |
| Электродный потенциал | -0,763 |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,133 г/см³ |
| Молярная теплоёмкость | 25,4[1]Дж/(K·моль) |
| Теплопроводность | 116 Вт/(м·K) |
| Температура плавления | 692,73 K |
| Теплота плавления | 7,28 кДж/моль |
| Температура кипения | 1180 K |
| Теплота испарения | 114,8 кДж/моль |
| Молярный объём | 9,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,665 c=4,947 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
| Zn | 30 |
| 65,39 | |
| [Ar]3d104s2 | |
| Цинк | |
Цинк —элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д.
История
Сплав цинка с медью — латунь — был известен еще в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Получение
Цинк в природе как самородный метал не проявляется. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi.
От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2↑,
Zn + H ) = ZnSO4 + H2↑
) = ZnSO4 + H2↑
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
- Цинкование — 45-60%
- В медицине (оксид цинка как антисептик) — 10%
- Производство сплавов — 10%
- Производство резиновых шин — 10%
- Масляные краски — 10%
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Также используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи, ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др). Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.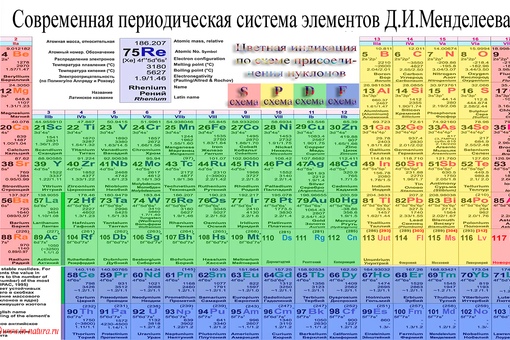
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»):
| Список стран по производству цинка | ||
|---|---|---|
| Место | Страна | Производительность (тонн) |
| — | Весь мир | 10,000,000 |
| 1 | Китай | 2,600,000 |
| 2 | Австралия | 1,380,000 |
| 3 | Перу | 1,201,794 |
| 4 | США | 727,000 |
| 5 | Канада | 710,000 |
| 6 | Мексика | 480,000 |
| 7 | Ирландия | 425,700 |
| 8 | Индия | 420,800 |
| 9 | Казахстан | 400,000 |
| 10 | Швеция | 192,400 |
| 11 | Россия | 190,000 |
| 12 | Бразилия | 176,000 |
| 13 | Боливия | 175,000 |
| 14 | Польша | 135,600 |
| 15 | Иран | 130,000 |
| 16 | Марокко | 73,000 |
| 17 | Намибия | 68,000 |
| 18 | Северная Корея | 67,000 |
| 19 | Турция | 50,000 |
| 20 | Вьетнам | 48,000 |
| 21 | Таиланд | 45,000 |
| 22 | Гондурас | 37,646 |
| 23 | Финляндия | 35,700 |
| 24 | ЮАР | 34,444 |
| 25 | Чили | 31,725 |
| 26 | Аргентина | 30,300 |
| 27 | Болгария | 17,300 |
| 28 | Румыния | 9,600 |
| 29 | Япония | 7,169 |
| 30 | Алжир | 5,000 |
| 31 | Саудовская Аравия | 1,500 |
| 32 | Грузия | 400 |
| 33 | Босния и Герцеговина | 300 |
| 34 | Мьянма | 100 |
Биологическая роль
Цинк:
-
необходим для продукции спермы и мужских гормонов.

- необходим для метаболизма витамина E, который является предшественником половых гормонов и включается в продукцию тестостерона.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 грамм устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек.
Содержание цинка:
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зеленые овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
-
~2—8 мг/кг — малина, черная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свекла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.

- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зеленый чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зерна пшеницы, тыквенные семечки, семечки подсолнечника.
Токсичность
Ионы Zn2+ токсичны.
Дополнительная информация
Категория:Соединения цинка
Микроэлементы, таблица и подробная информация о микроэлементах
Элементы
Из 92 встречающихся в природе химических элементов 81 обнаружен в организме человека. 12 элементов называют структурными, т.к. они составляют 99 % элементного состава человеческого организма: (углерод С, Кислород О, Водород Н, Азот N, Кальций Ca, Магний Mg, Натрий Na, Калий K, Сера S, Фосфор P, Фтор F, Хлор Cl).
Микроэлементами (МЭ) называют элементы, присутствующие в организме человека в очень малых следовых количествах (англ. – “trace elements”). Это в первую очередь 15 эссенциальных (жизненно необходимых, от англ. “essential”) – Fe, I, Cu, Zn, Co, Cr, Mo, Ni, V, Se, Mn, As, F, Si, Li, а также условно-эссенциальные B, Br. Элементы Cd, Pb, Al, Rb являются серьезными кандидатами на эссенциальность. В учение о МЭ особенно отчетливо видна справедливость слов Парацельса о том, что “нет токсичных веществ, а есть токсичные дозы”.
МЭ являются важнейшими катализаторами различных биохимических процессов, обмена веществ, играют значительную роль в адаптации организма в норме и патологии. Ряд элементов широко представленных в природе, редко встречается у человека, и наоборот. В этом проявляются особенности накопления элементов – активное и избирательное использование элементов внешней среды для поддержания гомеостаза и построения организма вне зависимости от меняющихся параметров внешних условий.
Хорошо известно, что микроэлементы обладают широким спектром синергических и антагонистических взаимоотношений. Так, показано, что между 15 известными жизненно необходимыми элементами существует 105 двусторонних и 455 трехсторонних взаимодействий. Это положение является естественной основой для изучения проявлений и оценки развития дисбаланса микроэлементного гомеостаза, столь характерного при дефиците даже одного эссенциального элемента.
Микроэлементный гомеостаз может нарушаться при недостаточном поступлении эссенциальных МЭ и/или избыточном поступлении в организм токсических микроэлементов. Причем, с учетом сложных антагонистических и синергических взаимовлияний и отношений между элементами, картина интоксикации или возникновения патологического состояния и заболеваний может быть очень сложной и трудной для интерпретации. В этом случае очень важна адекватная диагностика микроэлементозов, связанная, в первую очередь, с точным количественным определением элементов в индикаторных биосубстратах человека.
Накопленные к настоящему времени научные и медицинские данные о роли минеральных элементов в функционировании отдельных органов, систем и организма человека в целом, данные о последствиях, для здоровья человека, дефицита биогенных, жизненно необходимых элементов и избытка токсичных могут быть обобщены и используются в диагностической и лечебной практике Центром Биотической Медицины под руководством д.м.н. проф. А.В.Скального.
Подробно о каждом элементе:
Смотрите научные статьи в нашем журнале Микроэлементы в медицине
Исследование крови на микроэлементы Анализ волос на микроэлементы Определение содержание микроэлементов в моче Оценка шерсти животных на микроэлементный состав Анализ эякулята на микроэлементный статус Анализ слюны на микроэлементный состав Анализ волос на эссенциальные микроэлементы Анализ взаимодействия микроэлементов в реальной среде Источники микроэлементов Сопоставительный анализ крови и волос у пациентов с челюстно лицевой патологией можно увидеть здесь Большинство измерений элементного состава волос, крови, эякулята и других субстратах выполняется в лаборатории ЦБМ на самом современном оборудовании с использованием методик, разработанных с участием наших специалистов и аттестованных органами метрологического надзора за качеством измерений РФ: Аттестованная методика измерений элементов в волосах, крови и других биосубстратах человека
Цинк и его соединения | ChemToday – химический портал
Цинк (Zn) — 30-й элемент таблицы Менделеева, по внешнему виду представляющий из себя металл серебристого цвета со слегка синеватым отливом. Он довольно пластичен, на воздухе покрывается оксидной плёнкой, предохраняющей его от дальнейшего окисления. Довольно невысокая температура плавления (420°С) позволяет использовать его в качестве материала для металлических изделий.
Он довольно пластичен, на воздухе покрывается оксидной плёнкой, предохраняющей его от дальнейшего окисления. Довольно невысокая температура плавления (420°С) позволяет использовать его в качестве материала для металлических изделий.
Распространённость в природе и получение
Цинк — очень распространённый элемент. Природные соединения цинка включают в себя сульфид ZnS (две полиморфные модификации: вюрцит и сфалерит), он же цинковая обманка; карбонат ZnCO3 — цинковый шпат.
Сфалерит, цинковая обманкаДля получения чистого цинка руды сначала обжигают, а затем восстанавливают полученный оксид углём:
$$\ce{2ZnS + 3O_2 -> 2ZnO + 2SO_2}$$ $$\ce{ZnCO_3 -> ZnO + CO_2}$$ $$\ce{ZnO + C -> Zn + CO}$$Химические свойства
Цинк относится к довольно реакционноспособным металлам, поэтому и химических реакций с ним довольно много.
При повышении температуры цинк реагирует с неметаллами: кислородом, галогенами, серой, фосфором:
$$\ce{2Zn + O_2 -> 2ZnO}$$ $$\ce{Zn + Cl_2 -> ZnCl_2}$$ $$\ce{3Zn + 2P ->Zn_3P_2}$$ $$\ce{Zn + S ->ZnS}$$Реакция цинка с серой — одна из очень красивых, но относительно безопасных пиротехнических реакций, которую можно посмотреть в видео ниже:
youtube.com/embed/tbIFIQD-HIM?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>
Видео с YouTube-канала ChemTodayС кислотами-неокислителями цинк реагирует довольно быстро, выделяя водород:
$$\ce{Zn + 2HCl ->ZnCl_2 + H_2\uparrow}$$А при повышенной температуре (в раскалённом состоянии) цинк окисляется водой до оксида:
$$\ce{Zn_{раскал.} + H_2O ->[\ce{temp}]ZnO + H_2\uparrow}$$С кислотами-окислителями, то есть концентрированной серной, разбавленной и концентрированной азотной, цинк реагирует очень быстро, и в зависимости от концентрации кислоты получаются разные продукты восстановления элемента-окислителя в кислоте:
$$ \ce{3Zn + 8HNO_{3 (конц.)} ->3Zn(NO_3)_2 + 2NO\uparrow + 4H_2O}$$ $$\ce{4Zn + 10HNO_{3 (разб.)} -> 4Zn(NO_3)_2 + N_2O\uparrow + 5H_2O}$$ $$\ce{5Zn + 12HNO_{3 (оч. разб.)} -> 5Zn(NO_3)_2 + N_2\uparrow + 6H_2O}$$ $$\ce{4Zn + 10HNO_{3 (оч. разб.)} -> 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O}$$
$$\ce{Zn + 2H_2SO_{4 (конц.)} -> ZnSO_4 + SO_2 + 2H_2O}$$
$$\ce{3Zn + 4H_2SO_{4 (мен. конц.)} -> 3ZnSO_4 + S + 4H_2O}$$
$$\ce{4Zn + 5H_2SO_{4 (сред. конц.)} -> 4ZnSO_4 + H_2S + 4H_2O}$$
$$\ce{Zn + H_2SO_{4 (разб.)} -> ZnSO_4 + H_2}$$
разб.)} -> 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O}$$
$$\ce{Zn + 2H_2SO_{4 (конц.)} -> ZnSO_4 + SO_2 + 2H_2O}$$
$$\ce{3Zn + 4H_2SO_{4 (мен. конц.)} -> 3ZnSO_4 + S + 4H_2O}$$
$$\ce{4Zn + 5H_2SO_{4 (сред. конц.)} -> 4ZnSO_4 + H_2S + 4H_2O}$$
$$\ce{Zn + H_2SO_{4 (разб.)} -> ZnSO_4 + H_2}$$Металл имеет амфотерные свойства, поэтому помимо кислот растворяется также в растворах щелочей с образованием комплексных соединений — тетрагидроксоцинкатов, а при сплавлении — метацинкатов:
$$\ce{Zn + 2NaOH + 2H_2O ->[\ce{h3O}] Na_2[Zn(OH)_4] + H_2}$$ $$\ce{Zn + 2NaOH ->[\ce{temp.}] Na_2ZnO_2 + H_2}$$Вторая реакция идёт в присутствии следов воды или оксида цинка, который может попутно образовываться при высокой температуре сплавления.
За счёт комплексообразования цинк медленно растворяется даже в растворе аммиака, восстанавливая воду. При этом выделяется водород:
$$\ce{Zn + 4NH_3 * H_2O -> [Zn(NH_3)_4](OH)_2 + H_2\uparrow + 2H_2O}$$Соединения цинка
Оксид цинка ZnO — белое кристаллическое вещество, образующееся при окислении металла кислородом (обжиге) или при разложении его соединений:
Оксид цинка ZnO $$\ce{2Zn + O_2 -> 2ZnO}$$ $$\ce{Zn(OH)_2 -> ZnO + H_2O\uparrow}$$ $$\ce{ZnCO_3 -> ZnO + CO_2\uparrow}$$Оксид цинка проявляет амфотерные свойства, и легко реагирует как с кислотами, так и с основными оксидами и щелочами:
$$\ce{ZnO + 2HCl -> ZnCl_2 + H_2O}$$ $$\ce{ZnO + Na_2O -> Na_2ZnO_2}$$ $$\ce{ZnO + 2NaOH + H_2O ->[\ce{h3O}] Na_2[Zn(OH)_4]}$$ $$\ce{ZnO + 2NaOH ->[\ce{temp. }] Na_2ZnO_2 + H_2O\uparrow}$$
}] Na_2ZnO_2 + H_2O\uparrow}$$Оксид цинка легко превратить в металлический цинк реакцией с разными восстановителями, например, водородом и углём при повышенной температуре:
$$\ce{ZnO + C -> Zn + CO\uparrow}$$ $$\ce{ZnO + H_2 ->Zn + H_2O\uparrow}$$Гидроксид цинка Zn(OH)2 — твёрдое белое вещество, которое получают действием щёлочи на растворимые соли цинка. При реакции он образуется в виде белого аморфного осадка:
$$\ce{ZnCl_2 + 2NaOH -> Zn(OH)_2\downarrow + 2NaCl}$$Аналогично оксиду он проявляет амфотерные свойства. То есть очень легко растворяется в кислотах и щелочах, разлагается до оксида при нагревании:
$$\ce{Zn(OH)_2 + 2HNO_3 -> Zn(NO_3)_2 + 2H_2O}$$ $$\ce{Zn(OH)_2 + 2NaOH ->[\ce{h3O}] Na_2[Zn(OH)_4]}$$ $$\ce{Zn(OH)_2 + 2NaOH ->[\ce{temp.}] Na_2ZnO_2 + 2H_2O\uparrow}$$ $$\ce{Zn(OH)_2 ->ZnO + H_2O\uparrow}$$В отличие от алюминия цинк образует комплекс с аммиаком, и при помощи этой реакции их можно разделить или различить:
$$\ce{Zn(OH)_2 + 4NH_3 -> [Zn(NH_3)_4](OH)_2}$$ $$\ce{Al(OH)_3 + NH_3 ≠}$$А также в реакции с растворимыми карбонатами осаждается в виде карбоната, а не гидроксида:
$$\ce{ZnCl_2 + Na_2CO_3 -> ZnCO_3\downarrow + 2NaCl}$$ $$\ce{2AlCl_3 + 3Na_2CO_3 + 3H_2O -> 2Al(OH)_3\downarrow + 3CO_2\uparrow + 6NaCl}$$Любите химию!
химический символ для цинка
РАЗНИЦА МЕЖДУ ЦИНКОМ И ОКСИДОМ
Цинкэто химический элемент имеющий атомный номер 30 и химический символ Zn тогда как оксид цинка представляет собой химическое соединение имеющее химическую формулу ZnO.
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
Сорбционные методы концентрирования
· Химический символ элемента Cо произносится так же как и название самого элемента. Сырьё для получения цинка способы его получения. Основные минералы цинка
Коды обозначений типа покрытий согласно
В данной статье представлено буквенные обозначения (код) вида типа и толщины гальванических покрытий по ГОСТ 9.306-85 на деталях. Представлены примеры записи на чертежах. Показано
Сорбционные методы концентрирования
· Химический символ элемента Cо произносится так же как и название самого элемента. Сырьё для получения цинка способы его получения. Основные минералы цинка
МЕТАЛЛЫ ПОДГРУППЫ ЦИНКА Общая
· Цинк применяют для защиты железа от коррозии (цинкование) сплавы цинка прежде всего латуни (сплавы медь-цинк) используют в машиностроении и электротехнике кроме того цинк идет на изготовление гальванических
Картинки таблица химических эелементов
Символ для цинка химического элемента Никель из периодической таблицы Элемент ниобия 41. Щелочные земные металлы. Элемент М
РАЗНИЦА МЕЖДУ ЦИНКОМ И
Пиколинат цинкаэто пищевая добавка которую мы используем для лечения или предотвращения дефицита цинка. Ниже в инфографике в табличной форме представлены важные различия между цинком и пиколинатом цинка.
Как написать электронную конфигурацию
· Запишите блоки-колонки начиная от номера колонки за которым следует символ блока таким образом 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
Цинк свойства цинка Формулы и расчеты
· Символ Zn Латинское название Zinc Тип вещества простой химический элемент Год открытия 1500 Основные параметры цинка по таблице Менделеева Атомный номер Z 30 Атомная масса 65.409 Группа 12 Период 4
Цинк свойства цинка Формулы и расчеты
· Символ Zn Латинское название Zinc Тип вещества простой химический элемент Год открытия 1500 Основные параметры цинка по таблице Менделеева Атомный номер Z 30 Атомная масса 65.409 Группа 12 Период 4
Периодическая таблица элементовЦинк
· СимволZn. Атомный вес65.39. Плотность7.133. Температура плавления419 58°C. Температура кипения906 2°C. Известен с древних времен. Получение металлического цинка было известно еще до нашей эры
Цинк история открытия элемента
Состав соединений цинка оставался неизученным вплоть до XVIII в. хотя некоторые из них например белый купорос (сульфат цинка) использовали для получения латуни добавляя к расплаву меди вместе с порошком угля.
Для чего нужен цинк организму где
· Для каждого человека польза цинка огромна поскольку этот химический элемент является жизненно важным. Цинк по содержанию занимает второе место после железа по участию в важных биохимических функциях.
Zinco
Челябинский химический завод «Оксид» О компании История Вакансии Контакты Производство Мы создаем оксид цинка для всех направлений его применения История предприятия История
Цинк свойства цинка Формулы и расчеты
· Символ Zn Латинское название Zinc Тип вещества простой химический элемент Год открытия 1500 Основные параметры цинка по таблице Менделеева Атомный номер Z 30 Атомная масса 65.409 Группа 12 Период 4
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
Что изучает наука химия а) это наука о
· Масса цинка расходуемого для получения 6 моль водорода при взаимодействии с соляной кислотой Zn 2HCl=ZnCl2 h3 —-а) 65 в) 130 с) 390 d) 260 23.
Символы химических элементов — Википедия
· Символы химических элементов — условное обозначение химических элементов.Вместе с химическими формулами схемами и уравнениями химических реакций образуют формальный язык химии — систему условных обозначений и
Составь формулу соединения цинка с
· Если индекс равен 1 то ячейку для него оставь пустой. Составь формулу соединения цинка с кислородом. В формуле на первом месте запиши химический знак цинка а на втором — химический знак кислорода.
ЦИНКНовый словарь иностранных слов
· ЦИНК ( нем. zink) хим. элемент символ Zn ( лат. zincum) металл синевато-белого цвета примен. для защиты стали от коррозии (цинкование) и для изготовления многих сплавов напр с медью (латунь) окись цинкакраска (цинковые
Коды обозначений типа покрытий согласно
В данной статье представлено буквенные обозначения (код) вида типа и толщины гальванических покрытий по ГОСТ 9.306-85 на деталях. Представлены примеры записи на чертежах. Показано
Как написать электронную конфигурацию
· Запишите блоки-колонки начиная от номера колонки за которым следует символ блока таким образом 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
Цинк свойства соединения применение и
· ЦИНК Zn (Zincum а. zink н. Zink ф. zinc и. cine zinc) — химический элемент II группы периодической системы Менделеева атомный номер 30 атомная масса 65 39.В природе существует 5 стабильных изотопов 64 Zn (48 6 ) 6б Zn (27 9 ) 67
ЦИНКСловарь воровского жаргонаСленг
· Химический элемент ковкий металл синевато-белого цвета применяемый для защиты стали от кор-розии для изготовления сплавов.
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
Цинк свойства характеристики и
· Цинк производство и применение. Цинкэто металл стоящий в таблице Менделеева под номером 30 и имеет обозначение Zn. Плавится при температуре 419 °С градусов если же температура кипения 913
Периодическая таблица элементовЦинк
· СимволZn. Атомный вес65.39. Плотность7.133. Температура плавления419 58°C. Температура кипения906 2°C. Известен с древних времен. Получение металлического цинка было известно еще до нашей эры
Нужно характеризовать химический элемент
1.Химический символ(номер атомная масса) 2.Класс вещества(металл неметалл переходный элемент Напишите уравнения реакций гидроксида цинка и
Цинк свойства характеристики и
· Цинк производство и применение. Цинкэто металл стоящий в таблице Менделеева под номером 30 и имеет обозначение Zn. Плавится при температуре 419 °С градусов если же температура кипения 913
Цинк свойства соединения применение и
· ЦИНК Zn (Zincum а. zink н. Zink ф. zinc и. cine zinc) — химический элемент II группы периодической системы Менделеева атомный номер 30 атомная масса 65 39.В природе существует 5 стабильных изотопов 64 Zn (48 6 ) 6б Zn (27 9 ) 67
Таблица валентностей химических элементов
Характерные диапазоны времени расстояний и энергии для физики и химии. “Химический алфавит (словарь)”названия сокращения приставки обозначения веществ и соединений.
Цинк свойства соединения применение и
· Цинк. ЦИНК Zn (Zincum а. zink н. Zink ф. zinc и. cine zinc) — химический элемент II группы периодической системы Менделеева атомный номер 30 атомная масса 65 39.
ЦИНКСловарь воровского жаргонаСленг
· Химический элемент ковкий металл синевато-белого цвета применяемый для защиты стали от кор-розии для изготовления сплавов.
Цинк свойства цинка Формулы и расчеты
· Символ Zn Латинское название Zinc Тип вещества простой химический элемент Год открытия 1500 Основные параметры цинка по таблице Менделеева Атомный номер Z 30 Атомная масса 65.409 Группа 12 Период 4
Разница между Цинком и Пиколинатом
Цинкэто химический элемент имеющий символ Zn и атомный номер 30. ацетат цинка и таблетки глюконата цинка) применяется для лечения а также для
химический элемент Цинк Zincum — “Химическая продукция”
Что такое
Цинк, zincum, характеристики, свойстваЦинк — это химический элемент Zn химический элемент побочной подгруппы второй группы, четвёртого периода периодической системы, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк класс химических элементов
Элемент Zn — относится к группе, классу хим элементов (химический элемент побочной подгруппы второй группы, четвёртого периода периодической системы, с атомным номером 30)
Элемент Zn свойство химического элемента Цинк Zincum
Основные характеристики и свойства элемента Zn…, его параметры.
Название, символ, номер Цинк / Zincum (Zn), 30 Атомная масса (молярная масса) 65,38(2) а. е. м. (г/моль) Электронная конфигурация [Ar] 3d10 4s2 Радиус атома 138 пм
формула химического элемента Цинк Zincum
Химическая формула Цинка:
Атомы Цинк Zincum химических элементов
Атомы Zincum хим. элемента
Zincum Цинк ядро строение
Строение ядра химического элемента Zincum — Zn,
История открытия Цинк Zincum
Открытие элемента Zincum — Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка.
В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом:
В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
- 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C
- 1 января 1905 — первый в России цинк был получен на заводе «Алагир»
- 1915 году в Канаде и США — первые заводы, где цинк получали электролитическим способом
Цинк Zincum происхождение названия
Откуда произошло название Zincum … Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium I. Слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)
Распространённость Цинк Zincum
Как любой хим. элемент имеет свою распространенность в природе, Zn …
Цинк в природе как самородный металл не встречается.
Получение Цинк Zincum
Zincum — получение элемента Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами.
Пирометаллургический способ (дистилляционный способ) / Pyrometallurgical method (distillation method)
По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём.
Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %.
Цинковый купорос, Pb, Cu, Cd, Au, Ag; In, Ga, Ge, Tl получают из отходов производства цинка
Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства Цинк Zincum
Основные свойства Zincum — в чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Собственная концентрация носителей заряда в цинке — 13,1⋅1028 м−3.
Изотопы Zincum Цинк
Наличие и определение изотопов Zincum
Zn свойства изотопов Цинк Zincum
…
Химические свойства Цинк Zincum
Определение химических свойств Zincum
Меры предосторожности Цинк Zincum
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Zincum
Стоимость Цинк Zincum
Рыночная стоимость Zn, цена Цинк Zincum
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Zn
Сплавы алюминия
Алюминий – самый распространенный металл в земной коре и 13-й элемент в таблице Менделеева. Получают его путем электролиза оксида Al2O3.
Алюминий мягкий и легкий, устойчив к коррозии, плавится при 660 °С, имеет высокую тепло- и электропроводность, серебристо-белый цвет, малую плотность и хорошие прочностные характеристики. Алюминий и сплавы на его основе хорошо поддаются обработке, холодной и горячей деформации.
Какие бывают сплавы алюминия
По принципу использования сплавы алюминия делятся на 2 группы:
- Деформируемые – при нагреве они приобретают высокую пластичность, хорошо поддаются обработке давлением. Получают их путем добавления в алюминий растворимых в нем легирующих компонентов. Основные из них – Cu, Mn, Mg, Zn, в небольших количествах вводятся Si, Fe, Ni и другие элементы.
- Литейные – отличаются жидкотекучестью, применяются для фасонного литья заготовок. Для усиления литейных характеристик легируются кремнием.
В зависимости от использования термообработки различают термически упрочняемые и не упрочняемые сплавы. Кроме технически чистого алюминия, для получения сплавов на его основе используются силумины – двойные сплавы с кремнием (10–13% Si) и дополнительными примесями Fe, Ca, Ti, Mn (общее содержание 0,5–1,7%).
В зависимости от используемых легирующих элементов различают:
| Сплавы | Свойства |
|---|---|
| Al-магниевые | Пластичность, хорошая свариваемость, устойчивость к коррозии, высокая усталостная прочность. Содержат до 6% Mg – чем больше, тем прочнее материал. |
| Al-марганцевые | Прочность, пластичность, стойкость к коррозии, хорошая свариваемость. Легируются Ti, Fe, Si. |
| Алькусины – Al-Cu-Si | Твердость, отличные технические характеристики. Используются для производства блоков цилиндров и втулочных подшипников. |
| Al-медные | В термоупрочненном состоянии имеют превосходные механические свойства, но склонны к коррозии, нуждаются в защитных покрытиях. Легируются Si для придания способности к искусственному старению, Fe и Ni для усиления жаропрочности, Mn и Mg для повышения прочности и предела текучести. |
| Силумины – Al-кремниевые | Легируются Na или Li. Имеют выраженные литейные свойства. Востребованы при декоративном литье, производстве частей бытовых приборов и корпусов механизмов. |
| Al-Zn-Mg | Прочность, податливость обработке, подверженность коррозии при механическом напряжении – устраняется добавлением в состав меди. |
| Авиаль – Al-Mg-Si с добавлением Mn, Cu, Cr. | Пластичность, устойчивость к коррозии (повышается при снижении содержания меди до 0,1%). Авиаль подвергается искусственному состариванию и термоупрочнению путем выделения Mg2Si. Используется для изготовления корпусов смартфонов, штампованных и кованых изделий сложной геометрии. |
Марки алюминия и его сплавов
Первичный алюминий, используемый для переплавки с целью получения сплавов, бывает:
- Высокой чистоты (˃99,95% Al) – используется для получения спецсплавов авиационного и космического назначения. Включает марки А95, А97, А98, А99, А995. Числовое обозначение в маркировке обозначает сотые доли в процентном содержании алюминия.
- Технической чистоты (99–99,85% Al) – применяется для производства сплавов общего назначения. Включает марки А0, А35, А5, А5Е, А6, А7Э, А7Е, А7, А8, А85.
Альтернативный вариант маркировки первичного алюминия – в виде обозначения Pxxxx, где указано предельное содержание кремния и железа в сотых долях процента. Например, Р0506 – первичный Al с содержанием до 0,05% Si и 0,06% Fe.
Сплавы на основе алюминия маркируются по ГОСТ 4784-97 при помощи условных обозначений:
- А – технический Al;
- АВ – авиаль;
- Д – дюраль;
- АК – ковкий;
- В – высокой прочности;
- АЛ – литейный;
- АМг – с магнием;
- АМц – с марганцем;
- САП и САС – спеченные порошки и сплавы.
Далее в маркировке указывается номер марки и литера, отражающая состояние сплава:
- М – мягкий, отожженный;
- Т – подверженный закалке и естественному состариванию;
- Т1 – подверженный закалке и искусственному состариванию при 135–180 °С;
- П – полунагартованный;
- Н – нагартованный;
- А – плакированный, с нанесением чистого слоя Al;
- ПЧ, Ч – содержащий примеси.
Применение
Алюминиевые сплавы востребованы в автомобилестроении, самолетостроении, машиностроении, судостроении, электротехнике, пищевой промышленности, энергетической и строительной отрасли. Они используются для изготовления зеркал, фольги, проводников, бижутерии, столовых приборов, посуды. Из алюминия производят пистолеты, автоматы и другое стрелковое оружие, а в ракетной технике он используется в составе топлива.
Литейные и деформируемые сплавы Al
| Литейные | Деформируемые | |
|---|---|---|
| Марки | Силумины Al-Si: АЛ2, АЛ4, АЛ9, АЛ34. Хорошо поддаются литью, сварке, анодированию, резке. Дюрали Al-Cu. Сплавы АМг. |
Технический. Дюраль с Cu и Mg – Д1, Д2, Д19, Д21. Сплавы АМц. Высокопрочные сплавы с Mg, Zn, Cu – В92, В95. Авиаль АД 31, АД35, АД38. ВАД23. АМг6 и другие магниевые сплавы. Жаропрочные серии АК. |
| Технология производства | Расплавленный металл подается в литейную форму, соответствующую параметрам создаваемого изделия. | Изначально производятся в виде слитков, а в дальнейшем – приобретают необходимую форму при помощи обработки давлением. Для получения листов и фольги выполняется прокатка. Для получения труб, прутков, профилей – прессование. Сложные детали создают формовкой, а для улучшения механических характеристик – ковкой. |
Компания «Металлист» выполняет комплекс услуг по обработке алюминия и его сплавов:
фактов о цинке | Живая наука
Голубовато-серебряный цинк – это элемент рабочей лошадки, жизненно важный для жизни и важный во многих промышленных процессах, которые часто остаются незамеченными.
Этот металл находится в Периодической таблице элементов с атомным номером 30 и использовался греками и римлянами в древние времена, согласно Королевскому химическому обществу. Но цинк не был так популярен, как медь или железо, согласно статье 2006 года в журнале с открытым доступом Ancient Asia; он выкипает при более низкой температуре, чем требуется для извлечения его из руды, поэтому древние методы плавки не справлялись с задачей выделения цинка.
Тем не менее археологи нашли несколько цинковых артефактов, в том числе лист цинка из Афин, датируемый 300 годом до нашей эры. Сегодня металл используется в основном в качестве покрытия для стали и железа для предотвращения ржавчины. Этот процесс называется гальванизацией. Невероятно, но гальванизация восходит к столетиям – Королевская оружейная палата Великобритании включает коллекцию доспехов из Индии, изготовленных в 1680-х годах, которые были оцинкованы путем погружения в расплавленный цинк.
Только факты
По данным лаборатории линейных ускорителей Джефферсона, свойства цинка следующие:
- Атомный номер (количество протонов в ядре): 30
- Атомный символ (в Периодической таблице элементов): Zn
- Атомный вес (средняя масса атома): 65.38
- Плотность: 7,134 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердое вещество
- Точка плавления: 787,15 градусов по Фаренгейту (419,53 градусов по Цельсию)
- Точка кипения: 1665 F (907 C)
- Количество изотопов (атомов тот же элемент с другим числом нейтронов): 25; 5 стабильных
- Наиболее распространенные изотопы: Zn-64 (48,6% встречающихся в природе), Zn-66 (27,9% встречающихся в природе), Zn-67 (4,1% встречающихся в природе), Zn-68 (18.8 процентов природного происхождения) и Zn-70 (0,6 процента встречающегося в природе)
Полезный элемент
Цинк был открыт до того, как он был официально открыт. В 1746 году немецкий химик Андреас Маргграф (также изобретатель процесса извлечения сахара из свеклы) выяснил, как выделить цинк путем нагревания углерода и каламина (вещества в лосьоне с каламином). Маргграф очень подробно сообщил об открытии, что принесло ему признание за открытие, хотя несколько европейских исследователей уже совершили такой же подвиг.Английский металлург Уильям Чэмпион даже запатентовал этот процесс несколькими годами ранее.
Однако даже Чемпион использовал техники, восходящие к средневековью. Цинк был впервые использован в Китае по крайней мере в 1637 году нашей эры, а в Индии его добывали и выплавляли еще раньше – по крайней мере, в IX веке до нашей эры, согласно исследованию 2006 года, опубликованному в журнале Ancient Asia. Сначала древние люди использовали цинковые руды в основном для изготовления латуни (сплава меди с цинком). Однако, по данным Международной цинковой ассоциации (IZA), к 1374 году в Индии цинк был признан отдельным металлом.
Так чем же полезен цинк? По данным IZA, около половины из 12 миллионов тонн, производимых в год, идет на цинкование. Семнадцать процентов годового производства цинка идет на латунь и бронзу, и еще 17 процентов используется в литье под давлением, производстве металлических деталей с использованием форм. Остальное идет на другие производственные цели, такие как создание кровельных материалов или в химические соединения, такие как оксид цинка. Этот белый порошок присутствует во всем: от солнцезащитных кремов до солнечных батарей и ядерных реакторов, где он помогает предотвратить коррозию.
Цинк также играет важную роль в здоровье. Это важный минерал, который поддерживает работу ферментов организма. По данным Национального института здоровья, дефицит цинка может замедлить рост и ослабить иммунную систему. Некоторые из самых странных побочных эффектов дефицита цинка связаны с нарушениями запаха и вкуса, потому что металл имеет решающее значение для этих процессов.
Электронная конфигурация и элементные свойства цинка. (Изображение предоставлено Грегом Робсоном / Creative Commons, Андреем Маринкасом Shutterstock)Кто знал?
- Цинк может быть единственным известным лекарством от простуды.По данным NIH, медицинские исследования показали, что если цинковые леденцы или спрей используются в течение 24 часов с момента появления симптомов, продолжительность простуды сокращается. Однако эти безрецептурные препараты следует использовать с осторожностью, поскольку оптимальная дозировка не установлена, а слишком много цинка из назальных гелей или спреев связано с необратимой потерей обоняния. Может, стоит подержать холод еще день или два.
- Цинк составляет в среднем 70 миллиграммов на каждый килограмм земной коры, согласно данным IZA.
- Соединение цинка, глюконат цинка, может вылечить укус смертоносного яда коробчатой медузы, остановив утечку калия из клеток крови, согласно исследованию 2012 года.
- В вашем кармане цинк: пенни на 97,5% состоят из цинка и всего на 2,5% из меди.
- Большинство людей получают много цинка с пищей. Но добавки цинка могут быть полезны женщинам, которые борются с депрессией и раздражительностью перед менструацией. Исследование 2013 года показало, что прием как минимум 15 миллиграммов цинка в день был связан с более низким риском предменструального синдрома или ПМС.
Текущие исследования
Роль цинка в жизни трудно переоценить. Фактически, этот элемент, по-видимому, является важным компонентом встречи между сперматозоидами и яйцеклеткой.
Видео в декабре 2014 года, опубликованное вместе с исследованием в журнале Nature Chemistry, показывает фейерверк оплодотворения, когда яйцеклетка выпускает «искры» цинка после обволакивания сперматозоидов. Исследователи все еще изучают этот феномен, но они обнаружили, что без цинковых высыпаний яйцеклетка не может развиваться.
Цинк «может даже работать как главный выключатель, сообщающий клетке, когда делиться», – сказал Live Science соавтор исследования Томас О’Халлоран, химик из Северо-Западного университета в Чикаго.
Клетки обычно концентрируют цинк до тех пор, пока в клетке не будет примерно столько же атомов цинка, сколько пар оснований в геноме организмов, сказал О’Халлоран. Но некоторые клетки концентрируют больше, чем это.
В последние часы перед полным созреванием яйцеклетка начинает поглощать цинк, как выяснили О’Халлоран и его коллеги, с примерно 40 миллиардов атомов цинка до примерно 60 миллиардов.Около 15 процентов общего цинка оказывается в пузырьках, маленьких пакетиках, прячущихся прямо под поверхностью клетки.
Когда сперма и яйцеклетка встречаются, эти пакеты выбрасываются. Возможно, высвобождение цинка создает барьер для проникновения более чем одного сперматозоида, что может быть фатальным для развивающегося эмбриона. Но это еще предстоит доказать, сказала соавтор исследования Тереза Вудрафф, профессор акушерства, гинекологии и сохранения фертильности в Северо-Западном университете.
Цинковый фейерверк может иметь практическое применение для женщин, страдающих бесплодием, сказал Вудрафф Live Science.
«При ЭКО [экстракорпоральное оплодотворение] необходимо иметь возможность выбрать, какая яйцеклетка с наибольшей вероятностью даст начало здоровому потомству», – сказала она. Цинковые «искры» потенциально могут намекать на жизнеспособность яйцеклетки, что позволяет врачам выбирать лучшие оплодотворенные яйца для имплантации в матку.
Клетки мозга, особенно область памяти, известная как гиппокамп, также накапливают цинк, как и высвобождающие инсулин клетки поджелудочной железы, добавил О’Халлоран.
«Мы думаем, что мы действительно открыли кое-что, что будет широко полезно для понимания того, как работают клетки», – сказал он.Более того, исследование подчеркивает, как жизнь использует сырье Периодической таблицы для своего процветания.
«Мы склонны думать о неорганических вещах как о неживых», – сказал О’Халлоран. «Но когда выясняется, что они играют центральную роль в том, как устроена жизнь, это действительно интригует и отчасти противоречит здравому смыслу. Жизнь с самого начала приспосабливалась и использовала минералы и неорганические компоненты природы и несла это в себе. даже на высших этапах эволюции “.
Дополнительные ресурсы
Следите за Live Science @livescience , Facebook и Google+ .
Цинк – Science Learning Hub
Цинк – это химический элемент. Его официальный символ – Zn, а его атомный номер – 30, что означает, что каждый атом цинка имеет 30 протонов в своем ядре. Цинк не встречается в элементарной форме. Вместо этого он содержится в минералах с другими химическими элементами. Например, сфалерит – это минерал, состоящий из цинка, железа и серы. Сфалеритовая руда добывается в Австралии и многих других странах. Обжиг (нагрев) сфалерит отделяет цинк от других компонентов.
Мы используем много цинка – это четвертый по распространенности металл после железа, алюминия и меди. В 2017 году мировое потребление составило более 14 миллионов метрических тонн.
Элементарная история
На протяжении 2500 лет люди смешивали цинк с медью, чтобы сделать латунь, сплав. Древние римляне и другие жители Ближнего Востока использовали латунь для изготовления монет и украшений. Цинк, который они использовали, был нечистым (смешанным с другими веществами). Только 800 лет назад специалисты в Индии открыли, как плавить минералы и руды для получения металлического цинка.
Хотя Индия признала цинк металлом в 1374 году, а английский металлург запатентовал процесс дистилляции цинка в 1738 году, он был «официально открыт» в 1746 году немецким химиком Андреасом Маргграфом. Маргграф получил признание за открытие, потому что он опубликовал процесс дистилляции во всех подробностях.
Промышленное использование цинка
Цинк по-прежнему используется в производстве латуни и бронзы, как и тысячи лет назад. Более современное применение – электрические батареи.Внутри щелочных батарей находится цинковый порошок.
Более половины цинка, используемого сегодня, используется для гальванизации (покрытия) других металлов, таких как железо и сталь. Защитное цинковое покрытие замедляет ржавление и коррозию металлов. Если внимательно присмотреться к металлическим опорам, используемым в ограждении из рабицы или уличных перилах, можно увидеть защитное покрытие.
Соединения цинка
Соединения цинка имеют множество применений. Хлорид цинка часто добавляют в древесину в качестве химического антипирена.Сульфид цинка используется в люминесцентных лампах – он преобразует ультрафиолетовый свет в видимый свет.
Оксид цинка используется в качестве белого пигмента в краске. (Если у вас есть набор масляных красок, проверьте, есть ли в названии тюбика с белой краской слово «цинк».)
Оксид цинка используется в солнцезащитном креме. Он образует барьер на коже и отражает или рассеивает УФ-волны. Люди, которые проводят много времени на солнце – например, игроки в крикет – могут использовать густой крем с белым цинком на носу или губах.
Большинство солнцезащитных кремов сначала выглядят белыми, но становятся прозрачными при трении о кожу, потому что оксид цинка состоит из крошечных наночастиц. Были опасения, что эти наночастицы могут быть опасными, но исследование 2018 года показало, что крошечные частицы не проникают через кожу и не повреждают клетки кожи.
На ферме для профилактики или лечения экземы на лице у овец и крупного рогатого скота используют жидкости из оксида цинка. Это заболевание, поражающее печень животного. Животные также могут получать цинк в виде таблеток или с питьевой водой.
Природа науки
Не вся наука выполняется в лаборатории. В 1940-х годах Глэдис Рид – фермер, стоматологическая медсестра и гражданский ученый, живущая в Те-Ароха, – обнаружила, что заливание солей цинка в поилки с водой является лучшей профилактикой лицевой экземы у домашнего скота. Глэдис осознала важность доказательств и использовала контрольные группы для проверки своих идей. Средство Глэдис все еще используется!
Цинк и здоровье
Цинк является важным микроэлементом для большинства форм жизни.Взрослые люди в среднем имеют в организме 2–4 грамма цинка. Большинство людей получают достаточно цинка из продуктов, которые они едят: мясо, моллюски, яйца, бобовые, тыква и семена кунжута, орехи кешью, картофель и молочные продукты являются хорошими источниками цинка. Наш организм не накапливает цинк, поэтому важно каждый день есть разнообразную пищу, чтобы восполнить его.
Цинк играет важную роль в нашей иммунной системе и помогает заживлять раны. Существуют доказательства того, что цинк может помочь при простуде, если его использовать в течение 24 часов после появления симптомов.Эксперты говорят, что для определения дозы необходимы дополнительные исследования.
Недостаток цинка в организме может замедлить рост, нарушить нашу способность к воспроизводству, снизить иммунитет и нарушить обоняние.
It’s Elemental – Элемент цинк
Что в названии? От немецкого слова zink .
Сказать что? Цинк произносится как ZINK .
Хотя соединения цинка использовались для производства латуни не менее 2500 лет, цинк не был признан отдельным элементом до гораздо позже.Металлический цинк был впервые произведен в Индии где-то в 1400-х годах путем нагревания минерального каламина (ZnCO 3 ) с шерстью. Цинк был заново открыт Андреасом Сигизмундом Маргграфом в 1746 году путем нагревания каламина с древесным углем. Сегодня большая часть цинка производится электролизом водного сульфата цинка (ZnSO 4 ).
Примерно треть всего производимого сегодня металлического цинка используется в процессе, известном как гальванизация. Во время гальванизации на объект, подверженный коррозии, например железный гвоздь, наносится защитное покрытие из цинка.Цинк можно нанести на объект, окунув его в ванну с расплавленным цинком, но чаще всего его наносят путем гальваники. Аноды из жертвенного цинка используются в системах катодной защиты для защиты незащищенного железа от коррозии. Металлический цинк также используется для изготовления сухих аккумуляторных батарей, кровельных покрытий и литья под давлением.
Цинк используется для изготовления многих полезных сплавов. Латунь, сплав цинка, который содержит от 55% до 95% меди, вероятно, является самым известным цинковым сплавом. Впервые латунь была использована около 2500 лет назад и широко использовалась древними римлянами, которые использовали ее для изготовления таких вещей, как монеты, чайники и декоративные предметы.Латунь все еще используется сегодня, особенно в музыкальных инструментах, винтах и другом оборудовании, которое должно противостоять коррозии. Цинк сплавлен со свинцом и оловом для получения припоя – металла с относительно низкой температурой плавления, используемого для соединения электрических компонентов, труб и других металлических предметов. Prestal ® , сплав, содержащий 78% цинка и 22% алюминия, представляет собой странный материал, который почти такой же прочный, как сталь, но формуется так же легко, как пластик. Нейзильбер, металл пишущей машинки, пружинная латунь и немецкое серебро – другие распространенные сплавы цинка.
Оксид цинка (ZnO), обычное соединение цинка, образуется, когда металлический цинк подвергается воздействию воздуха, и образует защитное покрытие, которое защищает остальной металл. Оксид цинка используется, среди прочего, в красках, некоторых резиновых изделиях, косметике, фармацевтике, пластмассах, типографских красках, мыле и батареях. Сульфид цинка (ZnS), еще одно соединение цинка, светится при воздействии ультрафиолетового света, рентгеновских лучей или электронов и используется для изготовления светящихся циферблатов часов, телевизионных экранов и люминесцентных ламп.Хлорид цинка (ZnCl 2 ) – еще одно соединение цинка, которое используется для защиты древесины от гниения и насекомых.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
EniG. Периодическая таблица элементов
ПЕРЕХОДНЫЙ ЭЛЕМЕНТ: ZINC GROUP
| Атомный номер: | 30 | ||||||||
| Номера групп: | 12 | ||||||||
| Период: | 4 | ||||||||
| Электронная конфигурация: | [Ar] 3d 10 | Формальная степень окисления: | +2 | Электроотрицательность: | 1.65 | Атомный радиус / мкм: | 133,5 | Относительная атомная масса: | 65,38 (2) | |
Цинк известен с древних времен. Название происходит от немецкого слова zink . Это голубовато-серебристый пластичный металл, который вступает в реакцию со щелочами и кислотами. Цинк тускнеет на воздухе. Цинк содержится в минералах цинковой обманки (сфалерит) (ZnS), каламине, франклините, смитсоните (ZnCO3), виллемите и цинките (ZnO).Он используется для покрытия других металлов (гальваника), чтобы защитить их от ржавчины, 90% цинка используется для гальванизации стали. Металлический цинк используется в обычных сухих батареях и для изготовления сплавов, таких как латунь, бронза. Соединения цинка используются в производстве красок, косметики, пластмасс, электронных устройств и многих других продуктов. Цена гранул цинка с чистотой 99,99% составляет 39,60 евро за 500 г.
| Плотность / г дм -3 : | 7133 | (293 K) | ||
| 6577 | (м.p.) | |||
| Молярный объем / см 3 моль -1 : | 9,17 | (293 K) | ||
| 9,94 | (т. | 5,964 | (20 ° C) |
| Теплопроводность / Вт · м -1 K -1 : | 116 |
| Температура плавления / ° C: | 419.53 |
| Точка кипения / ° C: | 907 |
| Теплота плавления / кДж моль -1 : | 6,67 |
| Теплота испарения / кДж моль -1 10: | |
| Теплота распыления / кДж моль -1 : | 130,181 |
| Энергия первой ионизации / кДж моль -1 : | 906,41 |
| Энергия второй ионизации / кДж моль -1 : | 1733.31 |
| Третья энергия ионизации / кДж моль -1 : | 3832,71 |
| в атмосфере / ppm: | – |
| в земной коре / ppm: | 80 |
| в океанах / ppm: | 0,01 |
| Кристаллическая структура: | гексагональная |
| Размеры элементарной ячейки / мкм: | a = 266.47, c = 494,69 |
| Пространственная группа: | P6 3 / mmc |
| Изотоп | Относительная атомная масса | Массовый процент (%) | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 64 Zn | 63,929147 (2) | 48,6 (3) | ||||||||||||||||||||||||||||
| Zn | (3) | |||||||||||||||||||||||||||||
662| 27,9 (2) | | |||||||||||||||||||||||||||||
| 67 Zn | 66,927131 (2) | 4.1 (1) | ||||||||||||||||||||||||||||
| 68 Zn | 67.924848 (2) | 18,8 (4) | ||||||||||||||||||||||||||||
| 70 Zn | 69,925325 (4) | 0,6 902 | 0,6 902 902
Периодическая таблица и почему батареи не работают так, как вы думаетеХимические элементы – разновидности атомов, существующих в природе, и даже некоторые из них, созданные руками человека – являются бесконечным источником восхищения .Но что-то в них остается загадкой для большинства людей, возможно, даже для многих химиков. У меня была возможность напомнить себе об этой загадке, пока я читал две потрясающие книги на эту тему – Исчезающая ложка Сэма Кина и Periodic Tales Хью Олдерси-Уильямса – я проводил исследование написать текст для интерактивной периодической таблицы на сайте ScientificAmerican.com . В периодической таблице элементы аккуратно расположены в столбцы.Предполагается, что те элементы, которые находятся в одном столбце, обладают (примерно) схожими химическими свойствами. Большинство людей, которые хорошо знают таблицу и используют ее каждый день, включая практически всех химиков, биохимиков, материаловедов и множество инженеров, вряд ли задумываются об этом, но предсказания таблицы являются одними из самых странных фактов в природе. Законы, которые управляют большинством явлений на наших глазах – все, от клеточного метаболизма до батарей ноутбука – продиктованы химическим составом элементов, но мы редко осознаем, насколько странными и прекрасными являются лежащие в их основе силы. Значение столбцов таблицы наиболее четко проявляется в элементах в крайнем левом столбце, называемых щелочными металлами (которые включают литий, натрий и калий), и в элементах во втором столбце справа, называемых галогенами (фтор, хлор и их друзья). Эти два семейства содержат наиболее реактивные из всех элементов. Атомы галогенов, таких как фтор, имеют крайнюю тенденцию отрывать электрон от других атомов, в то время как атомы щелочных металлов имеют столь же сильную тенденцию отдавать электрон.Таким образом, смешайте галоген и щелочной металл, и вы получите идеальное соответствие один к одному – соль, такую как хлорид калия или хлорид натрия, также известную как поваренная соль. В более общем смысле, это тенденция к постепенному переходу от донорства электронов к их принятию по мере того, как вы двигаетесь слева направо по периодической таблице. Этот градиент количественно измеряется свойством, называемым электроотрицательностью, которая (по большому счету) увеличивается слева направо. Как только вы дойдете до последнего столбца справа, вы сбросите циферблат.Элементами этого семейства являются благородные газы, которые практически не вступают в реакцию. Каждый ученый скажет вам, что причина, по которой семейства химических веществ, составляющих каждый столбец, имеют более или менее предсказуемое поведение – другими словами, причина, по которой вообще существует периодическая таблица, – заключается в том, что все элементы тайно «хотят быть благородными газами ». В атоме благородного газа, такого как неон (элемент 10), орбиты электронов вокруг ядра аккуратно и симметрично расположены, как лепестки цветка.С другой стороны, галогеновый фтор (9), у которого на один электрон меньше, чем у неона, имеет скошенное орбитальное расположение. Он отчаянно «хочет» этого дополнительного электрона, чтобы сделать структуру симметричной и счастливой. Между тем, для щелочного металла натрия (11) проще всего стать похожим на неон – это сбросить один электрон. Само собой разумеется, что этот рассказ о неудовлетворенных электронных желаниях атомов не является действительным научным объяснением. Типичному пользователю периодической таблицы не нужно углубляться: истинные причины выяснены давно, и теперь ответ скрыт в каком-то сложном учебнике по квантовой физике.Но если мы остановимся и задумаемся на минуту, мы поймем, насколько это поразительно странное явление. Возьмите кислород. Корродирующий – ржавый, потускневший, ну, окисляющий – химикат par excellence , кислород вступает в реакцию, потому что он «хочет» завершить свой букет внешних электронных орбиталей до полного набора из восьми, имитируя безмятежную икебану неона. Вряд ли имеет значение, если некоторые из этих орбиталей также должны летать вокруг других атомов: например, разделяя часть своих электронов с двумя атомами водорода, кислород может образовать молекулу воды.Пока внешние орбитали образуют полный октет вокруг его ядра, химическая нирвана находится в пределах досягаемости. Но вот почему это так странно. Если вы возьмете атом кислорода изолированно и скормите ему электрон, он захватит его и станет ионом кислорода O-. А теперь представьте, что пролетает лишний электрон. Два объекта, электрон и ион кислорода, заряжены отрицательно, поэтому они должны отталкиваться друг от друга. И все же кислород настолько жаждет этого второго электрона, что он схватывает его и становится дважды ионизированным ионом O-.Реакционная способность кислорода настолько велика, что он побеждает электростатическое (или кулоновское) отталкивание, силу пресловутой интенсивности. (Я признаю, что описываемая мной обстановка довольно абстрактна, поскольку электроны и кислород на самом деле не имеют возможности взаимодействовать в вакууме, и, вероятно, полученный ион не будет стабильным, но, пожалуйста, потерпите меня.) Мы часто слышим, что все, что происходит в природе, за исключением, возможно, темной энергии, происхождение которой остается полной загадкой, является результатом действия одной из четырех фундаментальных сил: гравитации, слабых и сильных ядерных взаимодействий и электромагнетизма.Химические реакции и образование состояний материи, таких как квазикристаллы или люди, полностью регулируются электромагнитной силой. Но электромагнитные взаимодействия разнообразны и сложны, и электростатическая сила – лишь один из их частных случаев. Химические реакции являются электромагнитными, но в большинстве случаев они происходят против электростатических сил, а не вслед за ними. Механизмы, которые приводят в действие батарею, например, имеют прямое отношение к электромагнитным взаимодействиям, которые мы называем химией; но вопреки тому, что мы часто думаем, электроны не перемещаются от отрицательного полюса к положительному из-за электростатики.Дело не в том, что отрицательный полюс имеет избыток электронов – отрицательный заряд, а положительный полюс – их недостаток. Оба электрода в батарее электрически нейтральны . Что действительно питает батарею, так это разница в электроотрицательности материалов, из которых сделаны ее электроды. Возьмем, к примеру, гальваническую батарею, первую в истории батарею, изобретенную около 1800 года Алессандро Вольта. Отрицательный электрод сваи изготовлен из цинка (30), а положительный электрод – из меди (29).Медь немного более электроотрицательна, чем цинк *. Таким образом, если вы поместите два металла рядом друг с другом (или соедините их проволокой), часть электронов переместится от цинка к меди. Мы говорим, что медь – это положительный полюс, а цинк – отрицательный, но на самом деле переход электронов произойдет против электростатических сил, а не вслед за ними: положительный электрод, медь, станет отрицательно заряженным из-за дополнительных электроны, за счет отрицательного электрода, цинка, который будет заряжаться положительно! При таком положении дел простое соединение двух материалов, состоящих из атомов с разной электроотрицательностью (в случае материалов, соответствующий термин – электрохимический потенциал), не даст много энергии.Отрицательные заряды, накапливающиеся на положительном полюсе, быстро станут слишком сильными и будут отталкивать дальнейшие электроны; отрицательный электрод, тем временем, быстро станет положительно заряженным из-за потери электронов и, таким образом, будет сильнее цепляться за свои оставшиеся электроны за счет электростатического притяжения. Перенос электронов быстро прекратится. Вот почему батарея состоит не только из двух электродов, но и с электролитом. Электролит позволяет переносить ионы от отрицательного полюса к положительному полюсу батареи.Поскольку положительный полюс имеет тенденцию накапливать отрицательные заряды электронов, он также имеет тенденцию притягивать положительные ионы. Таким образом, ионы сохраняют нейтральные заряды с обеих сторон и позволяют переносу электронов продолжаться, по крайней мере, на некоторое время. Когда переносится слишком много ионов, производительность батареи начинает снижаться. В конце концов, все ионы, которые могли двигаться, переместились, и батарея разрядилась. Если ваша батарея является перезаряжаемой, вы можете приложить потенциал к ее электродам, чтобы переместить электроны обратно к отрицательному полюсу, и ионы последуют этому примеру. Так что же представляет собой загадочная квантовая физика, которая управляет цветочным расположением электронных орбиталей? Боюсь, что это станет темой другого поста. (*) Примечание: внимательный читатель заметит, что медь находится в таблице слева от цинка. Однако из двух металлов медь является более электроотрицательной. Правило, согласно которому электроотрицательность увеличивается при движении слева направо, имеет несколько исключений. При подготовке этого эссе мне помогли беседы с Петром Зеленаем. Факты о цинкеЭто разные образцы чистого цинка. В свежем виде металл блестящий серебристо-серый металлик. (Alchemist-hp) Цинк – это металл с атомным номером 30 и символом элемента Zn.Цинк – это серебристо-серый металл с символом элемента Zn и атомным номером 30. Этот элемент необходим для жизни человека и широко используется в коммерческих целях. Эти факты о цинке включают основные факты, химические и физические свойства, а также интересные мелочи об элементе. Основные факты о цинке Имя : Цинк Атомный номер : 30 Символ элемента : Zn Атомная масса : 65.38 (2) Группа : группа 12 Период : период 4 Блок : d-блок Семейство элементов : пост-переходный или переходный металл Электронная конфигурация : [ Ar] 3d 10 4s 2 Открытие : Цинк был открыт индийскими металлургами примерно до 1000 г. до н. Э. Индийский алхимик Расаратна Самучкая в 800 году признал его новым металлом.Немецкий химик Андреас Сигизмунд Маргграф впервые выделил чистый элемент в 1746 году. Алхимики ссылались на цинк, используя его алхимический символ.Происхождение имени : Название «цинк» было задокументировано Парацельсом, который назвал этот металл «цинком» или «цинкен» в своей книге Liber Mineralium II в 16 веке. Предположительно, оно происходит от немецкого слова zinke , что означает «зубчатый» или «зазубренный». Это относится к игольчатому виду кристаллов цинка.У цинка было множество алхимических символов. Изотопы : Природный цинк состоит из смеси пяти изотопов. Самый распространенный изотоп – 64 Zn. Хотя технически это радиоизотоп, его период полураспада настолько велик (4,3 × 10 18 года), что он считается стабильным. Синтезировано несколько десятков радиоизотопов цинка. Использует : Цинк является 4-м наиболее часто используемым промышленным металлом после железа, алюминия и меди. Примерно половина из 12 миллионов тонн цинка, производимых ежегодно, идет на цинкование.Около 17% продукции приходится на латунь и бронзу. Также важны соединения цинка. Оксид цинка содержится в красках и солнцезащитных кремах. Биологическая активность : Цинк является важным питательным веществом. Организм человека использует его для ферментативных реакций, оплодотворения яйцеклеток, образования лейкоцитов и деления клеток. Дефицит цинка – одна из причин возрастного ухудшения зрения. Однако слишком много цинка вызывает проблемы. Избыток цинка подавляет всасывание железа и может привести к необратимой потере обоняния и вкуса.FDA выпустило предупреждения о цинковых тампонах и спреях, чтобы повысить осведомленность о рисках. Источники : Около 95% добываемого цинка получают из сульфидной цинковой руды. Цинк легко перерабатывается. Около 30% используемого сегодня цинка – это вторичный металл. Физические данные Плотность (комнатная температура) : 7,14 г / см 3 Точка плавления : 692,68 K (419,53 ° C, 787,15 ° F) Точка кипения : 1180 K (907 ° C, 1665 ° F) Состояние при 20 ºC : Твердый Тепло плавления : 7.32 кДж / моль Теплота испарения : 115 кДж / моль Молярная теплоемкость : 25,470 Дж / (моль · К) Магнитное упорядочение : диамагнитный Кристаллическая структура : гексагональная близкая- в упаковке (hcp) Твердость по Моосу : 2,5 Атомные данные Электроотрицательность : 1,65 (Полинг) Атомный радиус : 134 пм (эмпирический) Ковалентный радиус 16:00 Радиус Ван-дер-Ваальса : 139 pm Энергия первой ионизации : 906.4 кДж / моль 2-я энергия ионизации : 1733,3 кДж / моль 3-я энергия ионизации : 3833 кДж / моль Степени окисления : наиболее распространенная степень окисления +2. Другие степени окисления включают -2, 0 и +1. 10 Фактов о цинке
|


